Method Article
저산소성 인간 태반의 작은 세포외 소포에 의한 생쥐 혈액-뇌 장벽의 파괴
* 이 저자들은 동등하게 기여했습니다
요약
저산소 조건(자간전증의 한 측면 모델링)에서 배양된 태반 외식에서 분리된 소형 EV(sEV)가 임신하지 않은 성인 암컷 마우스의 혈액-뇌 장벽을 파괴하는지 여부를 평가하기 위한 프로토콜이 제시됩니다.
초록
뇌부종, 허혈성 뇌졸중 및 출혈성 뇌졸중을 포함한 뇌혈관 합병증은 자간전증과 관련된 모성 사망의 주요 원인입니다. 이러한 뇌혈관 합병증의 근본적인 메커니즘은 아직 명확하지 않습니다. 그러나 태반 기능 장애 및 혈액-뇌 장벽(BBB) 파괴와 관련이 있습니다. 그럼에도 불구하고, 멀리 떨어져 있는 이 두 기관 사이의 연관성은 여전히 밝혀지지 않고 있다. 태반이 세포외 소포를 포함한 신호 분자를 산모의 순환계로 방출한다는 증거가 늘어나고 있습니다. 세포외 소포체는 크기에 따라 분류되며, 작은 세포외 소포체(직경 200nm보다 작은 sEV)는 생리학적 및 병리학적 조건 모두에서 중요한 신호 전달 입자로 간주됩니다. 자간전증에서는 산모의 순환 sEV가 증가하는데, 이들의 신호 전달 기능은 잘 알려져 있지 않습니다. 자간전증 또는 저산소증에 노출된 정상 임신 태반에서 방출되는 태반 sEV는 뇌 내피 기능 장애와 BBB 파괴를 유발합니다. 이 프로토콜에서는 저산소 조건에서 배양된 태반 외식에서 분리된 sEV가 생체 내에서 BBB를 방해하는지 여부를 평가합니다.
서문
자간전증, 태반 과정 장애, 산모 전신 내피 기능 장애, 심한 경우 다발성 장기 부전을 특징으로 하는 고혈압성 임신 증후군으로 인한 산모 사망의 약 70%는 급성 뇌혈관 합병증과 관련이 있다 3,4. 대부분의 모성 사망은 저소득 및 중간소득 국가에서 발생한다5. 그러나 자간전증과 관련된 뇌혈관 합병증의 임상적, 역학적 관련성에도 불구하고 근본적인 메커니즘은 여전히 불분명하다.
반면에, 세포외 소포체(EV)(직경 ~30-400nm)는 산모-태반 상호작용을 포함하여 조직과 기관 간의 세포 간 통신에 필수적인 매개체이다6. 외부 표면의 단백질과 지질 외에도 EV는 내부에 화물(단백질, RNA 및 지질)을 운반합니다. EV는 (1) 엑소좀(직경 ~50-150nm, 소형 EV(sEV)이라고도 함), (2) 중형/대형 EV, (3) 세포사멸체로 분류할 수 있으며 크기, 생물 발생, 함량 및 잠재적 신호 전달 기능에 따라 다릅니다. EV의 구성은 EV가 유래한 세포와 질병 유형7에 의해 결정된다. 세포융합 영양 아세포 유래 EV는 임신 중 태반 유래 순환 소형 EV(PDsEV)를 검출하는 태반 알칼리성 인산가수분해효소(PLAP)8,9를 발현합니다. 또한 PLAP는 PDsEV 화물의 변화와 자간전증 대 정상 혈압 임신에서의 영향을 식별하는 데 도움이 됩니다 10,11,12,13,14,15.
태반은 자간전증(preeclampsia)16 또는 이 질병과 관련된 뇌 합병증(17,18,19)의 병태생리학에 필요한 요소로 인식되어 왔다. 그러나 이 멀리 떨어진 기관이 어떻게 뇌 순환의 변화를 유도할 수 있는지는 알려져 있지 않습니다. sEV는 생체 활성 성분을 기증자에서 수용 세포로 전달하는 능력으로 인해 세포 간 통신에서 중추적인 역할을 하기 때문에 6,20,21, 점점 더 많은 연구에서 태반 sEV를 뇌 내피 세포를 포함한 모계 내피 기능 장애21,22,23,24 생성과 연관시켰습니다25,26자간전증이 있는 여성. 따라서 뇌 내피 기능의 손상은 자간전증과 관련된 뇌혈관 합병증의 중요한 구성 요소인 혈액-뇌 장벽(BBB)의 파괴로 이어질 수 있습니다 3,27.
그럼에도 불구하고, 자간전증28 여성의 혈청에 노출된 쥐의 뇌혈관 또는 자간전증29 여성의 혈장에 노출된 인간 뇌 내피세포를 이용한 전임상 결과에서는 순환인자(순환인자)가 BBB의 파괴를 유도하는 것으로 보고되었다. 자간전증 동안 산모의 순환계에 존재하는 BBB에 해를 끼칠 가능성이 있는 여러 후보 물질에도 불구하고, 예를 들어 전염증성 사이토카인(즉, 종양괴사인자)18,28 또는 혈관 조절인자(즉, 혈관내피 성장인자(VEGF))29,30,31 또는 산화 지단백질(oxo-LDL)32,33과 같은 산화분자 등이 있다, 그들 중 어느 것도 태반과 BBB 사이에 직접적인 연결을 설정하지 않습니다. 최근에, 저산소성 태반으로부터 분리된 sEV는 임신하지 않은 암컷 마우스에서 BBB를 교란할 수 있는 능력을 보여주었다25. 태반 sEV는 BBB를 파괴할 수 있는 능력을 가진 나열된 순환 인자의 대부분을 운반할 수 있기 때문에 sEV는 손상된 태반을 연결하고 유해한 순환 인자의 운반자가 되며 자간전증에서 BBB를 파괴하는 데 적합한 후보로 간주됩니다.
이 프로토콜을 통해 저산소 조건에서 배양된 태반 외식에서 분리된 sEV가 자간전증 중 뇌 합병증의 병태생리를 이해하기 위한 대리물로서 임신하지 않은 암컷 마우스의 BBB를 방해할 수 있는지 여부를 조사할 수 있습니다.
프로토콜
이 연구는 헬싱키 선언에 명시된 원칙에 따라 각 윤리 검토 위원회의 승인하에 수행되었습니다. 모든 인간 참가자는 이전에 보고된 바와 같이 샘플 수집 전에 정보에 입각한 동의를 제공했습니다25. 또한 Bío-Bío University의 생명 윤리 및 생물 안전위원회는이 프로젝트를 승인했습니다 (Fondecyt 보조금 1200250). 동물 연구는 실험에서 동물을 사용하는 데 있어 3R의 기본 원칙에 따라(35) 미국 국립보건원(National Institute of Health)에서 발행한 실험동물의 관리 및 사용 지침(Guidelines for Care and Use of Laboratory Animals)의 권고에 따라 수행되었다. 동물들은 비오비오 대학교(University of Bío-Bío)의 비바리움(Vivarium)에서 적절한 환경에서 사육되었습니다. 만삭(임신 38주 내지 41주)에 정상적인 임신을 한 산모(28-31세)로부터 선택적 제왕절개 후 1시간 이내에 신선한 태반을 얻었다. 제왕절개 수술은 칠레 칠란에 있는 헤르민다 마틴 임상병원에서 시행되었으며, 앞서보고된 바와 같이 25. in vivo 모델을 적용하기 위해, 4-6개월 된 암컷 비임신 마우스(균주 C57BLACK/6)를 사용하였다. 그들은 세 가지 실험 그룹으로 나뉘었습니다: (1) 대조군(치료 없음), (2) 정상산소증의 sEV로 처리(sEVs-Nor), (3) 저산소 배양 태반(sEVs-Hyp)의 sEV로 처리했으며, 이는 생체 내BBB의 파괴를 평가하는 데 사용되었습니다 25. 주입된 모든 용액은 멸균 상태였습니다. 또한 sEV의 준비는 오염을 피하기 위해 무균 조건과 클래스 II 생물 안전 후드 아래에서 수행되었습니다.
1. 태반 배양 이식
- 정상 임신 태반의 이식을 추출하려면 Miller et al. 200536에 의해 발표된 방법을 확인하십시오.
- 멸균된 집게를 사용하여 인간 태반의 기저판에서 혈전을 조심스럽게 제거합니다. 10g의 최종 조직 추출을 얻기 위해 작은 외엽을 추출합니다.
- 태반 외피가 태반의 모계 부분의 4개 사분면에서 제거되었는지 확인합니다. 활력이 없어진 조직과 석회화된 부위는 제외되어야 합니다.
- 태반 조직을 조작하려면 얼음 위, 멸균 조건 및 생물 안전 캐비닛 내에서 조작하십시오.
- 가능한 한 많은 혈액을 제거하기 위해 차가운 (4 °C) 인산염 완충 용액 (PBS 1x, pH 7.4)의 다량 (5 부피)으로 외식을 세척하십시오 (최소 3 회). 세척 사이에 실온에서 원심분리기(252 x g , 10분).
- 세척한 외식물 10g을 2% 소 태아 혈청, 100IU/mL 페니실린 및 스트렙토마이신 100μg/mL가 보충된 배양 배지 20mL에 재현탁시킵니다( 재료 표 참조).
- 서스펜션을 100mm 배양 접시에 넣습니다. 21 % 산소와 5 % CO2 가 있는 37°C의 인큐베이터에서 2시간 동안 외식을 그대로 둡니다.
- 그런 다음 37°C에서 1x PBS로 외식을 다시 세척합니다(3회). 세척 사이에 실온에서 원심분리기(252 x g , 10분).
- 또한, 이전에 나노 입자가 고갈된 배양 배지 20mL에 조직을 재현탁시킵니다.
알림: 나노 입자 고갈의 경우 초원심분리(실온에서 120,000시간 동안 18xg ) 및 미세여과(0.22μm 필터)를 수행합니다. - 재현탁 외식을 두 개의 배양 접시(100mm)로 나눕니다. 각 배양 접시에는 10mL의 재현탁 외설물이 포함되어야 합니다.
- 그 후, 태반 외식물이 들어있는 접시 중 하나를 표준 배양 조건 (37 % 산소 및 8 % CO2 의 5 ° C)에 놓고 다른 하나는 1 % O2의 저산소 챔버에 넣습니다.
참고: (선택적) 조직 생존율의 분석은 다른 곳에 기술된 바와 같이 동일한 조직 추출 및 3-(4,5-디메틸티아졸-2-일)-2,5-디페닐테트라졸륨 브로마이드 분석(MTT 분석)을 사용하여 수행할 수 있다37,38. 외식물 균질액에서 측정된 총 단백질 농도를 사용하여 MTT 값을 정규화합니다. - 배양한 후 식생의 조절된 배지를 새로운 15mL 튜브로 수확합니다.
알림: 이 단계에서 컨디셔닝된 매체는 장기간(몇 주) 동안 동결(-80°C)할 수 있습니다.
2. 태반 유래 sEV 분리
- 이전에 발표된 보고서25,39에 따라 차등 원심분리 및 미세여과 프로토콜을 사용하여 조절된 배지에서 sEV를 분리합니다.
- 수확된 컨디셔닝된 배지에 대해 순차적 원심분리를 수행합니다. 원심분리의 순차적 단계는 (1) 10분 동안 300 x g , (2) 10분 동안 2000 x g , (3) 30분 동안 10,000 x g , (4) 2시간 동안 120,000 x g 입니다. 실온에서 원심분리를 수행합니다.
- 이러한 모든 원심 분리에서 20-100 μL 피펫을 사용하여 상층액을 조심스럽게 수집하고 펠릿을 버립니다.
- 완료되면 마지막으로 수집된 상층액을 0.22μm 필터를 통과시킵니다( 재료 표 참조). 그런 다음 실온에서 120,000 x g 에서 18시간 동안 한 번 더 원심분리를 수행합니다.
- 그런 다음 500μL의 PBS(pH 7.4)에 펠릿(태반 sEV 포함)을 재현탁하면서 상층액을 버리고 다시 0.22μm 필터를 통과시킵니다. 마지막으로 실온에서 120,000 x g 에서 3시간 동안 마지막 원심분리를 수행합니다.
- 다음으로, 펠릿(태반 sEV 포함)을 500μL의 PBS(pH 7.4, 이전에 sEV가 고갈됨)에 재현탁시키고 0.22μm 필터를 통과시킵니다.
- 샘플에 sEVs-Normoxia(sEVs-Nor) 또는 sEVs-Hypoxia(sEVs-Hyp)의 재고로 라벨을 붙입니다.
참고: 추가 실험을 위해 분리된 sEV의 50-100μL 부분 표본을 준비합니다. 소형 EV는 -80°C에서 장기간(개월) 보관할 수 있습니다. - 이전에 보고된 바와 같이 크기, 개수 및 sEV 단백질 마커로 태반 sEV를 특성화합니다25. sEV의 이상적인 평균 입자 직경은 50-150nm입니다.
참고: sEV 특성 분석에는 CD63, Tsg101, Alix 및 HSP70의 양성 검출이 포함됩니다(즉, 엑소좀이 풍부한 sEV 집단의 특성 분석). 또한, PLAP를 태반 기원의 표지자로 사용한다25. - 제조업체의 지침에 따라 BCA 단백질 분석 키트를 사용하여 sEV 용액의 총 단백질 양을 측정합니다( 재료 표 참조).
참고: 그림 1 은 태반 외피 배양 및 세포외 소포체 분리에 대한 개요를 보여줍니다.
3. 마우스 주사
- 5% 이소플루란 분포가 있는 마취 유도 챔버에서 동물을 마취합니다( 재료 표 참조). 발가락 꼬집을 통해 마취 수준을 확인합니다.
- ~40초 후 안면 마스크를 사용하여 마우스를 마취 시스템에 넣고 2% 이소플루란의 마취 수준을 유지합니다.
- 다음으로, 28°C의 실온에서 가열 플랫폼( 재료 표 참조)에 동물을 놓습니다. 인공 눈물로 눈을 윤활하십시오.
- 주입하기 전에 태반 sEV(총 단백질 200μg)를 인산염 완충액(pH, 7.4)으로 희석하여 최종 부피가 70μL가 될 때까지 합니다.
- 70% 에탄올과 면봉을 사용하여 주사 부위를 소독합니다. 30G 바늘이 있는 인슐린 주사기를 사용하여 sEV 용액을 주입해야 합니다.
알림: 주사기는 생리적 온도를 얻기 위해 5분 동안 가열 플랫폼에 놓을 수 있습니다. - 그런 다음 용액을 외부 경정맥에 주입합니다. 이 단계에는 특별한 교육이 필요합니다.
알림: 시술은 바늘을 천천히 집어넣고 혈액 역류의 증거가 될 때까지 부드럽게 흡입하면서 조심스럽게 수행해야 합니다. - 주입 후 마른 면봉으로 주입 부위에 ~15초 동안 가벼운 압력을 가합니다. 그런 다음 동물을 각각의 우리로 되돌립니다.
- 15분 동안 의식과 행동을 평가해야 합니다. 의식 성취의 지표는 전체 운동 활동의 동물적 회복이다.
알림: 동물의 케이지는 따뜻한 온도를 유지하십시오.
4. 빠른 쥐 혼수 및 행동 척도(RMCBS)
- RMCBS를 사용하여 동물(40)의 신경학적 및 웰빙 매개변수를 평가한다.
알림: RMCBS는 작업자 개입으로 인한 최소한의 동물 스트레스로 빠른 평가(~ 3분)를 허용합니다. RMCBS에는 10개의 매개변수가 있습니다(각 점수는 0-2). - 0시간(sEV 주입 전) 및 주입 후 3시간, 6시간, 12시간 및 24시간에 RMCBS 척도를 사용하여 마우스 웰빙을 평가합니다.
참고: claudin-5(sEV 주입 후 6시간) 및 Evan의 청색 유출(sEV 주입 후 24시간)을 분석하여 BBB의 파괴를 평가합니다(그림 2).
5. 에반의 푸른 색채에 대한 분석
- 태반 sEV 주입(24시간) 후 3.1단계에 설명된 대로 마우스를 마취합니다.
- Evan's Blue 용액(2%, 인산염 완충 용액에 희석, 1x)을 준비합니다( 재료 표 참조).
- retro-orbital access25를 사용하여 Evan's Blue 용액을 2mL/kg으로 주입합니다.
- Evan의 파란색 용액을 마취 상태에서 20분 동안 순환시킵니다.
- 다음으로, 식염수(~3mL, 0.9%, w/v)로 앞서 설명한 프로토콜41 에 따라 심장 내 관류를 수행하여 순환에서 Evan의 청색 염료를 제거합니다. 이 단계는 필수입니다.
알림: 이 절차의 경우 마취를 5%로 늘리고 깊은 마취면(즉, 호흡수의 급격한 감소)을 확인합니다. - 내측 개흉술을 통해 심장을 노출시킨다41 (그림 3).
- 그 후, 파라 포름 알데히드 용액 (PBS에서 4 %, v / v)의 심장 내 주입으로 전체 동물을 고정하십시오.
알림: 적절한 고정을 모니터링하기 위해 꼬리의 강성을 확인하십시오. - 또한 고정이 완료되면 조심스럽게 뇌를 추출하고 무게를 측정한 후 사진을 찍습니다41. 뇌 전체를 자에 가깝게 사진을 찍는다42.
- 다음으로, 뇌를 뇌 마우스 슬라이서에 넣습니다( 재료 표 참조).
- 뇌를 소뇌를 포함하여 두루미-꼬리의 9개 섹션(각 섹션 100μm)으로 해부합니다.
- 해부 후 스테레오 줌 현미경으로 뇌 절편의 이미지를 시각화하고 캡처합니다( 재료 표 참조).
- 캡처된 이미지를 사용하여 ImageJ 소프트웨어를 사용하여 Evan의 청색 유출을 정량화합니다( 재료 표 참조).
알림: Evan의 파란색 염료의 존재를 분석하려면 뇌 섹션의 양성 대조군(염료를 주입했지만 심내 관류가 없는 동물 대조군 동물)을 사용하여 Evan의 파란색 값을 설정합니다. 양성 대조군에서 도달한 Evan의 청색 값은 일반적으로 청색 채널의 강도 히스토그램에서 75와 110 사이입니다(그림 4). - 관찰자 편향을 피하기 위해 각 실험 그룹이 뇌 이미지를 맹목적으로 분석하도록 합니다. 또는 뇌 균질화에 의한 Evan의 청색 유출을 정량화한 후 분광법43을 정량화합니다.
참고: 별도의 실험에서 sEV를 주입한 마우스(6시간)에서 갓 분리한 뇌를 사용하여 BBB44의 기밀성과 관련된 중요한 밀착 접합부인 클라우딘 5(CLND-5)의 단백질 수준을 분석합니다(재료 표 참조).
결과
이 프로토콜은 저산소증에서 배양된 태반에서 유래한 sEV가 임신하지 않은 마우스의 BBB를 방해하는 능력을 평가합니다. 이 방법을 사용하면 정상 및 병리학적 조건에서 태반과 뇌 사이의 잠재적인 연결을 더 잘 이해할 수 있습니다. 특히, 이 방법은 자간전증에서 뇌 합병증의 발병에 대한 태반 sEV의 참여를 분석하기 위한 대리물을 구성할 수 있다.
sEVs-Nor를 주입한 마우스와 달리, sEVs-Hyp를 주입한 마우스는 24시간까지 신경학적 점수가 점진적으로 감소했으며(표 1), 이는 뇌 기능을 손상시키는 sEVs-Hyp 용량을 시사합니다.
또한, sEVs-Hyp 주입군의 생쥐 뇌는 sEVs-Nor 또는 대조군 생쥐를 주입한 생쥐로부터 분리한 생쥐보다 신선도가 더 높으며(각각 0.51 ± 0.008; 0.46 ± 0.008; 0.47 ± 0.01g), 이는 뇌부종의 총 지표가 될 수 있다45.
이 발견과 호환되는, 이 프로토콜은 BBB의 붕괴를 나타내는 지표로서 Evan의 청색 유출을 식별할 수 있게 해준다. 이와 관련하여, sEVs-Hyp을 주입한 쥐의 뇌는 sEVs-Nor 그룹의 뇌보다 Evan의 청색 유출이 더 높습니다(그림 5A).
sEVs-Hyp에 의해 유도된 BBB의 근본적인 파괴 메커니즘은 이 프로토콜로 분석되지 않았지만, 결과는 또한 sEVs-Hyp를 주입한 마우스가 BBB가 가장 영향을 받은 영역(즉, 후방 영역)에서 CLND-5의 단백질 양이 감소했음을 나타냅니다(그림 5B). 따라서 sEVs-hyp이 이 중요한 내피 밀착 접합 단백질의 기능 발현을 손상시키는 것이 가능합니다.
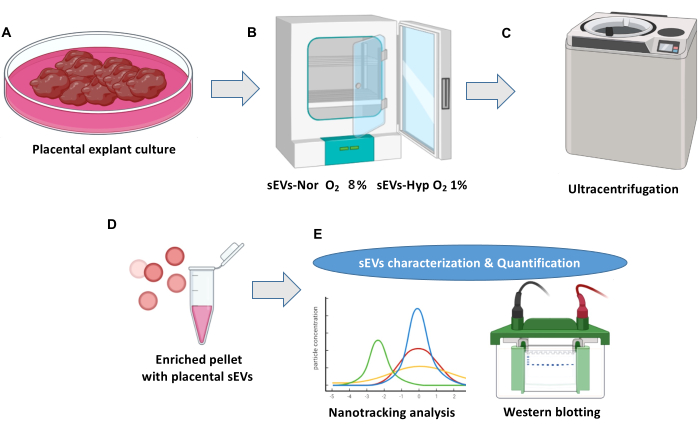
그림 1: 태반 외측 배양 및 세포외 소포체 분리 프로토콜. (A) 정상적인 태반 이식 배양. (B) 외식은 태반 소세포외 소포체(sEV)의 생물학적 발생을 위해 두 가지 조건으로 분포됩니다. 18시간 동안 Normoxia(sEVs-Nor, 8%O2) 또는 저산소증(sEVs-Hyp, 1%O2) (C) 조절된 배지를 채취, 여과 및 원심분리하여 세포 파편을 제거합니다. (D) sEV는 초원심분리에 의해 분리됩니다. (E) sEV는 나노 추적 분석 및 웨스턴 블롯을 사용하여 특성화됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 혈액-뇌장벽 파괴 프로토콜의 생체 내 평가. 임신하지 않은 C57BL6/J 마우스, 4-6개월 된 마우스가 사용됩니다. (A) 외부 경정맥을 통해, 동물은 노르목식(sEVs-Nor, 8%O2) 또는 저산소성(sEVs-Hyp, 1%O2) 태반 배양으로부터 분리된 sEV(총 단백질 200μg)를 투여받았다. RMCBS는 주입 후 0-24시간에 모니터링됩니다. (B) sEV 주입 후 6시간 후, 뇌를 추출하고 단백질 추출을 위해 9개의 세그먼트로 분할합니다. Claudin 5 (CLDN5)는 이 9개 섹션의 균질액에서 분석됩니다. (C) Evan의 청색 외래 분석(sEV 주입 후 24시간)은 9개 세그먼트 각각에서 역궤도 천공 주입 후 분석되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
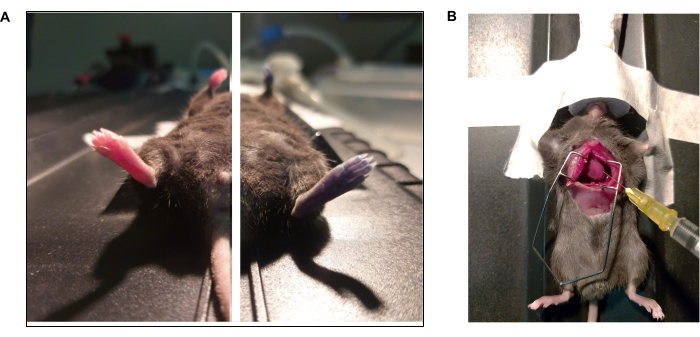
그림 3: Evan의 파란색 염료 및 심장 내 관류 프로토콜에 대한 사진 다큐멘터리. (A) 마우스는 역궤도 주사를 통해 Evan의 파란색을 받았습니다. (왼쪽) Evan의 파란색을 주입하기 전과 (오른쪽) (15 초) 후의 동물. (B) 인산염 완충 용액(1x PBS)과 파라포름알데히드(4% PFA)의 심내 관류를 수행하기 위한 흉강절개술. 좌심실은 바늘 끝이 뾰족합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: sEV 주입 후 Evan의 청색 유출 분석. (A) Evan의 청색 유출을 보여주는 전체 뇌의 대표 이미지. 점선은 뇌 전체에서 얻은 9개의 섹션을 나타냅니다. (B) 뇌 쥐 슬라이서를 사용하여 뇌를 해부했습니다. (C) sEV 주입 후 24시간 시점의 뇌 절편의 대표 이미지. 대조군(CTL), 정상산소(sEVs-Nor) 또는 저산소 상태(sEVs-Hyp)의 태반. 눈금 막대 = 0.4cm. (D) ImageJ를 사용한 뇌 절편의 디지털 윤곽선. (E) 파란색 채널의 히스토그램. 75-110 사이의 값은 Evan의 파란색 유출과 관련이 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 태반 외식에서 분리된 sEV를 주입한 마우스에서 Evan의 청색 유출 및 클라우딘-5 수준. (A) 전체 뇌 절편을 고려한 Evan의 청색(EB) 외출 비율. 대조군(CTL, 파란색), 정상산소(sEVs-Nor, 빨간색) 또는 저산소 조건(sEVs-Hyp, 녹색)의 태반. (B) 9개의 뇌 절편에서 클라우딘 5(CLDN5)의 상대적 수준은 3개의 실험 그룹으로부터 얻어졌다. β-액틴은 로딩 컨트롤로 사용됩니다. 값은 평균 ± 사분위수 범위입니다. 각 점은 개별 실험 대상을 나타냅니다. *p < 0.05, **p < 0.005. p < 0.0001입니다. p < 0.001; ANOVA 검정 후 Bonferroni 사후 검정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 시간(h) | 제어 | sEVs-노목시아 | sEVs-저산소증 | 분산 분석(ANOVA) |
| 0 | 18.75 ± 0.250 | 18.5 ± 0.288 | 18.75 ± 0.250 | NS |
| 3 | 18.5 ± 0.866 | 17 ± 0.707 | 13.25 ± 1.750*α | 0.006 |
| 6 | 19.25 ± 0.750 | 17 ± 0.577 | 11.75 ± 1.250*α | 0.002 |
| 12 | 18.5 ± 0.645 | 1.109± 16.75 | 13 ± 0.816*α | 0.001 |
| 24 | 19.5 ± 0.288 | 17.75 ± 0.250 | 10.25 ± 0.853*α | <0.0001 |
| *p < 대조군 대비 0.01. αp < 0.01 대 sEVs-Normoxia | ||||
표 1: sEV 주입 후 24시간 후의 빠른 쥐 혼수 및 행동 척도(RMCBS). 점수는 SEM± 평균으로 표현됩니다. 20에 가까운 동물의 점수는 표준이며, 점수가 낮을수록 중추신경계의 기능 장애가 높습니다.
토론
이 연구는 설치류의 혈액-뇌 장벽 파괴에 대한 저산소 조건에서 배양된 태반 외식에서 분리된 sEV로 인한 잠재적 피해에 대한 새로운 통찰력을 제공합니다. 병리학적 기전은 후방 뇌 영역(25)에서 CLND-5의 감소를 수반한다.
선행 조사에 의하면 자간전증이 있는 개인의 혈장-sEV는 시험관 내 모델46,47을 사용하여 다양한 장기에서 내피 기능 장애를 유도하는 것으로 밝혀졌다. 이 연구는 특히 혈액-뇌 장벽을 면밀히 조사하여 이 중요한 장벽을 파괴하는 저산소증 배양 태반에서 분리된 sEV에 대한 새로운 관점을 제공했습니다. 이러한 발견은 자간전증과 같은 정상 및 병리학적 시나리오 모두에서 sEV가 태반과 뇌 사이의 통신 채널 역할을 할 수 있는 새로운 연구 영역을 소개합니다.
제시된 프로토콜은 간단하지만 몇 가지 중요한 단계를 언급해야 합니다. 이 프로토콜은 분만 후 1시간 이내에 신선한 태반을 필요로 합니다. 또한 조직 분해를 방지하기 위해 배양 기간을 24시간 이상으로 연장하지 않는 것이 좋습니다. 이 프로토콜은 마우스 태반에 의해 생성된 sEV의 잠재적 오염을 완화합니다. Evan의 파란색 유출에 대한 디지털 분석은 시간이 많이 걸립니다. 더욱이, Evan의 파란색 염색은 뇌 절개 후 덜 눈에 띕니다. 따라서 포지티브 컨트롤을 사용하여 파란색 범위를 식별하기 위한 초기 설정이 권장됩니다. Evan의 파란색 주사를 받지 않은 쥐의 뇌와 같은 음성 대조군도 사용할 수 있습니다. 실험 그룹에 대한 맹검 분석은 잠재적인 관찰자 편향을 피하는 데 필수적입니다.
이 프로토콜 중에 몇 가지 문제가 발생할 수 있습니다. 중요한 한계는 인간 태반과 주입된 마우스 모두에서 발생하는 생물학적 다양성에 있습니다. Evan의 청색 유출 실험의 재현성을 보장하기 위해 인간 태반에서 분리된 sEV 용량을 설정하는 것이 좋습니다. 우리는 총 단백질 200μg을 선택했습니다. 그러나 이 양은 소포 순도, 경정맥 주입의 효능, Evan의 청색 투여, 순환계로부터의 제거, 그리고 무엇보다도 내용물을 고려한 sEV의 생물학적 영향에 따라 변동될 수 있습니다.
인간 태반의 sEV가 혈액-뇌 장벽을 파괴할 수 있는 세포 메커니즘은 추가 실험이 필요합니다. 그럼에도 불구하고 이 방법은 태반과 뇌 사이의 잠재적인 의사 소통을 암시하는 관련성을 가지고 있어 추가 연구가 필요합니다. 따라서 향후 연구는 sEV와 혈액-뇌 장벽과의 상호 작용, 화물이 신경 조직에 미치는 영향에 중점을 두도록 권장됩니다. 혈액뇌장벽 손상이 모체의 뇌에 지속적인 영향을 미치는지 여부는 추가 검사가 필요하다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
저자들은 귀중한 의견을 제시해 주신 GRIVAS Health 소속 연구원들에게 감사의 뜻을 전합니다. 또한 산부인과 서비스의 조산사와 임상 직원은 칠레 칠란 병원에 속해 있습니다. Fondecyt Regular 1200250에 의해 설립되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Adult mice brain slecer matrice 3D printed | Open access file | Adult mice | Adult mice brain slicer. Printed in PLA filament. |
| Anti β-Actin primary antibody | Sigma-Aldrich | Clon AC-74 | Antibody for loading control (Western blot) |
| Anti-Claudin5 primary antibody | Santa cruz Biotechnology | sc-374221 | Primary antibody for tight junction protein CLDN5 of mice BBB (Western blot) |
| BCA protein kit | Thermo Scientific | 23225 | Kit for measuring protein concentration |
| Culture media #200 500 mL | Thermo Fisher Scientific | m200500 | Culture media for placental explants |
| D180 CO2 incubator | RWD Life science | D180 | Standard incubator to estabilize explants and culture sEVs-Nor |
| Evans blue dye > 75% 10 g | Sigma-Aldrich | E2129.10G | Dye to analize blood brain barrier disruption IN VIVO |
| Fetal bovine serum 500 mL | Thermo Fisher Scientific | 16000044 | Additive growth factor for culture media 200 |
| Himac Ultracentrifuge CP100NX | Himac eppendorf group | 5720410101 | Ultracentrifuge for condicioned media > 1,20,000 x g |
| ImageJ software | NIH | https://imagej.nih.gov/ij/download.html | |
| Isoflurane x 100 mL | USP Baxter | 212-094 | Volatile inhalated anaesthesia agent for mice |
| Kit CellTiter 96 Non-radioactive | Promega | 0000105232 | In vitro assay for placental explants viability |
| Mouse IgG Secondary antibody | Thermo Fisher Scientific | MO 63103 | Secondary antibody for CLDN5 (western blot) |
| NanoSight NS300 | Malvern Panalytical | 90278090 | Nanotracking analysis of particles from placental explants condicioned media |
| Paraformaldehide E 97% solution 500 mL | Thermo Fisher Scientific | A11313.22 | Fixative solution for brain tissue slices and intracardial perfusion (once diluted) |
| PBS 1 X pH 7.4 500 mL | Thermo Fisher Scientific | 10010023 | Wash solution for placenta explants |
| Peniciline-streptomicine 100x 20 mL | Thermo Fisher Scientific | 10378016 | Antiobiotics for placental explants culture media |
| ProOX C21 Cytocentric O2 and CO2 Subchamber Controller | BioSpherix | SCR_021131 | CO2 regulator to induce Hypoxia in sealed chamber for sEVs-Hyp |
| Sodium Thiopental 1 g | Chemie | 7061 | humanitarian euthanasia agent |
| Somnosuite low flow anesthesia system | Kent Scientifics | SS-01 | Isoflurane vaporizer for small rodents |
| Surgical Warming platform | Kent Scientifics | A41166 | Warming platform for mainteinance anesthesia in mice |
| Syringe Filters, Polytetrafluoroethylene (PTFE), Hydrophobic, 0.22 µm, Sterile, 25 mm | Southern labware | 10026 | Filtration of condicioned media harvested from placental explants |
| Tabletop High-Speed Micro Centrifuges HITACHI himac CT15E/CT15RE | Hitachi medical systems | 6020 | Serial centrifugations of condicioned media < 1,20, 000 x g |
| Trinocular stereomicroscope transmided and reflective light 10x-160x | Center Medical | 2597 | Stereomicroscope to register brain slices |
참고문헌
- Lisonkova, S., Joseph, K. S. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 209 (544), 544.e1-544.e12 (2013).
- Sibai, B., Dekker, G., Kupferminc, M. Preeclampsia. Lancet. 365 (9461), 785-799 (2005).
- Hammer, E. S., Cipolla, M. J. Cerebrovascular dysfunction in preeclamptic pregnancies. Curr Hypertens Rep. 17 (8), 64(2015).
- Okanloma, K. A., Moodley, J. Neurological complications associated with the preeclampsia/eclampsia syndrome. Int J Gynaecol Obstet. 71, 223-225 (2000).
- Frias, A. E., Belfort, M. A. Post magpie: how should we be managing severe preeclampsia. Curr Opin Gynecol Obstet. 15 (6), 489-495 (2003).
- Familari, M., Cronqvist, T., Masoumi, Z., Hansson, S. R. Placenta-derived extracellular vesicles: Their cargo and possible functions. Reprod Fertil Dev. 29 (3), 433-447 (2017).
- Montoro-Garcia, S., Shantsila, E., Marin, F., Blann, A., Lip, G. Y. Circulating microparticles: new insights into the biochemical basis of microparticle release and activity. Basic Res Cardiol. 106, 911-923 (2011).
- Germain, S. J., Sacks, G. P., Sooranna, S. R., Sargent, I. L., Redman, C. W. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol. 178 (9), 5949-5956 (2007).
- Tannetta, D., Masliukaite, I., Vatish, M., Redman, C., Sargent, I. Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J Reprod Immunol. 119, 98-106 (2017).
- Collett, G. P., Redman, C. W., Sargent, I. L., Vatish, M. Endoplasmic reticulum stress stimulates the release of extracellular vesicles carrying danger-associated molecular pattern (DAMP) molecules. Oncotarget. 9 (6), 6707-6717 (2018).
- Cooke, W. R., et al. Maternal circulating syncytiotrophoblast-derived extracellular vesicles contain biologically active 5'-tRNA halves. Biochem Biophys Res Commun. 518 (1), 107-113 (2019).
- Gill, M., et al. Placental syncytiotrophoblast-derived extracellular vesicles carry active nep (neprilysin) and are increased in preeclampsia. Hypertension. 73 (5), 1112-1119 (2019).
- Kandzija, N., et al. Placental extracellular vesicles express active dipeptidyl peptidase IV; levels are increased in gestational diabetes mellitus. J Extracell Vesicles. 8 (1), 1617000(2019).
- Motta-Mejia, C., et al. Placental vesicles carry active endothelial nitric oxide synthase and their activity is reduced in preeclampsia. Hypertension. 70 (2), 372-381 (2017).
- Sammar, M., et al. Reduced placental protein 13 (PP13) in placental derived syncytiotrophoblast extracellular vesicles in preeclampsia - A novel tool to study the impaired cargo transmission of the placenta to the maternal organs. Placenta. 66, 17-25 (2018).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Warrington, J. P., et al. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiological Reports. 2 (8), e12134-e12134 (2014).
- Warrington, J. P., Drummond, H. A., Granger, J. P., Ryan, M. J. Placental Ischemia-induced increases in brain water content and cerebrovascular permeability: Role of TNFα. Am J Physiol Regul Integr Comp Physiol. 309 (11), R1425-R1431 (2015).
- Johnson, A. C., et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS ONE. 9 (11), e113670(2014).
- Escudero, C. A., et al. Role of extracellular vesicles and microRNAs on dysfunctional angiogenesis during preeclamptic pregnancies. Front Physiol. 7, 1-17 (2016).
- Salomon, C., et al. Placental exosomes as early biomarker of preeclampsia: Potential role of exosomalmicrornas across gestation. J Clin Endocrinol Metab. 102 (9), 3182-3194 (2017).
- Knight, M., Redman, C. W., Linton, E. A., Sargent, I. L. Shedding of syncytiotrophoblast microvilli into the maternal circulation in pre-eclamptic pregnancies. Br J Obstet Gynaecol. 105 (6), 632-640 (1998).
- Gilani, S. I., Weissgerber, T. L., Garovic, V. D., Jayachandran, M. Preeclampsia and extracellular vesicles. Curr Hypertens Rep. 18 (9), 68(2016).
- Dutta, S., et al. Hypoxia-induced small extracellular vesicle proteins regulate proinflammatory cytokines and systemic blood pressure in pregnant rats. Clin Sci (Lond). 134 (6), 593-607 (2020).
- Leon, J., et al. Disruption of the blood-brain barrier by extracellular vesicles from preeclampsia plasma and hypoxic placentae: attenuation by magnesium sulfate. Hypertension. 78 (5), 1423-1433 (2021).
- Han, C., et al. Placenta-derived extracellular vesicles induce preeclampsia in mouse models. Haematologica. 105 (6), 1686-1694 (2020).
- Amburgey, O. A., Chapman, A. C., May, V., Bernstein, I. M., Cipolla, M. J. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 56 (5), 1003-1008 (2010).
- Cipolla, M. J., et al. Pregnant serum induces neuroinflammation and seizure activity via TNFalpha. Exp Neurol. 234 (2), 398-404 (2012).
- Bergman, L., et al. Preeclampsia and increased permeability over the blood brain barrier - a role of vascular endothelial growth receptor 2. Am J Hypertens. 34 (1), 73-81 (2021).
- Torres-Vergara, P., et al. Dysregulation of vascular endothelial growth factor receptor 2 phosphorylation is associated with disruption of the blood-brain barrier and brain endothelial cell apoptosis induced by plasma from women with preeclampsia. Biochim Biophys Acta Mol Basis Dis. 1868 (9), 166451(2022).
- Schreurs, M. P., Houston, E. M., May, V., Cipolla, M. J. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placental growth factor during pregnancy. FASEB J. 26 (1), 355-362 (2012).
- Schreurs, M. P., Cipolla, M. J. Cerebrovascular dysfunction and blood-brain barrier permeability induced by oxidized LDL are prevented by apocynin and magnesium sulfate in female rats. J Cardiovasc Pharmacol. 63 (1), 33-39 (2014).
- Schreurs, M. P. H., et al. Increased oxidized low-density lipoprotein causes blood-brain barrier disruption in early-onset preeclampsia through LOX-1. FASEB J. 27 (3), 1254-1263 (2013).
- Escudero, C., et al. Brain vascular dysfunction in mothers and their children exposed to preeclampsia. Hypertension. 80 (2), 242-256 (2023).
- Russell, W. M. S., Burch, R. L. The principles of humane experimental technique. Universities Federation of Animal Welfare. , https://awionline.org/lab-animal-search/russell-w-m-s-burch-r-l-1959-principles-humane-experimental-technique-methuen-co (1959).
- Miller, R. K., et al. Human placental explants in culture: approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Troncoso, F. A. J., Herlitz, K., Ruiz, F., Bertoglia, P., Escudero, C. Elevated pro-angiogenic phenotype in feto-placental tissue from gestational diabetes mellitus. Placenta. 36 (4), 2(2015).
- Zhang, H. C., et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev. 21 (18), 3289-3297 (2012).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3), 22(2006).
- Carroll, R. W., et al. A rapid murine coma and behavior scale for quantitative assessment of murine cerebral malaria. PLoS One. 5 (10), e13124(2010).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988(2021).
- Walchli, T., et al. Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain. Nat Protoc. 10 (1), 53-74 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Sci Rep. 4, 6588(2014).
- Morita, K., Sasaki, H., Furuse, M., Tsukita, S. Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol. 147 (1), 185-194 (1999).
- Lara, E., et al. Abnormal cerebral microvascular perfusion and reactivity in female offspring of reduced uterine perfusion pressure (RUPP) mice model. J Cereb Blood Flow Metab. 42 (12), 2318-2332 (2022).
- Chang, X., et al. Exosomes from women with preeclampsia induced vascular dysfunction by delivering sflt (soluble fms-like tyrosine kinase)-1 and seng (soluble endoglin) to endothelial cells. Hypertension. 72, 1381-1390 (2018).
- Smarason, A. K., Sargent, I. L., Starkey, P. M., Redman, C. W. The effect of placental syncytiotrophoblast microvillous membranes from normal and pre-eclamptic women on the growth of endothelial cells in vitro. BJOG. 100 (10), 943-949 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유