Method Article
Нарушение гематоэнцефалического барьера мышей мелкими внеклеточными везикулами гипоксической плаценты человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
Представлен протокол для оценки того, нарушают ли малые ВВ (sEV), выделенные из плацентарных эксплантов, культивируемых в гипоксических условиях (моделируя один из аспектов преэклампсии), гематоэнцефалический барьер у небеременных взрослых самок мышей.
Аннотация
Цереброваскулярные осложнения, включая отек головного мозга и ишемический и геморрагический инсульт, являются основной причиной материнской смертности, связанной с преэклампсией. Механизмы, лежащие в основе этих цереброваскулярных осложнений, остаются неясными. Однако они связаны с плацентарной дисфункцией и нарушением гематоэнцефалического барьера (ГЭБ). Тем не менее, связь между этими двумя отдаленными органами до сих пор выясняется. Все больше данных свидетельствуют о том, что плацента высвобождает сигнальные молекулы, в том числе внеклеточные везикулы, в материнский кровоток. Внеклеточные везикулы классифицируются в соответствии с их размером, при этом небольшие внеклеточные везикулы (sEV менее 200 нм в диаметре) считаются критическими сигнальными частицами как при физиологических, так и при патологических состояниях. При преэклампсии наблюдается повышенное количество циркулирующих sEV в материнском кровотоке, сигнальная функция которых недостаточно изучена. Плацентарные sEV, высвобождаемые при преэклампсии или из нормальной плаценты беременности, подверженной гипоксии, индуцируют эндотелиальную дисфункцию головного мозга и нарушение ГЭБ. В этом протоколе мы оцениваем, нарушают ли sEV, выделенные из эксплантов плаценты, культивируемых в гипоксических условиях (моделируя один из аспектов преэклампсии), ГЭБ in vivo.
Введение
Примерно 70% случаев материнской смертности вследствие преэклампсии, синдрома гипертонической беременности, характеризующегося нарушением процессов плацентации, системной эндотелиальной дисфункцией матери и, в тяжелых случаях, полиорганной недостаточностью 1,2, связаны с острыми цереброваскулярными осложнениями 3,4. Большинство случаев материнской смертности происходит в странах с низким и средним уровнем дохода5. Однако основные механизмы до сих пор неясны, несмотря на клинико-эпидемиологическую значимость цереброваскулярных осложнений, ассоциированных с преэклампсией.
С другой стороны, внеклеточные везикулы (ВВ) (диаметр ~30-400 нм) являются важными медиаторами межклеточной коммуникации между тканями и органами, включая взаимодействие матери и плаценты6. Помимо белков и липидов на внешней поверхности, ВВ несут внутри себя груз (белки, РНК и липиды). ВВ можно разделить на (1) экзосомы (диаметр ~50-150 нм, также называемые малыми ВВ (sEV)), (2) средние/большие ВВ и (3) апоптотические тела, которые различаются по размеру, биогенезу, содержанию и потенциальной сигнальной функции. Состав ВВ определяется клетками, из которых они происходят, и типом заболевания7. ВВ, полученные из синцитиотрофобласта, экспрессируют плацентарную щелочную фосфатазу (PLAP)8,9, которая выявляет циркулирующие малые ВВ плацентарного происхождения (ПДСВ) во время беременности. Кроме того, PLAP помогает различить изменения в грузе ПДСЭВ и их влияние при преэклампсии по сравнению с нормотензивной беременностью 10,11,12,13,14,15.
Плацента признана необходимым компонентом в патофизиологии преэклампсии16 или церебральных осложнений, связанных с этим заболеванием 17,18,19. Однако неизвестно, как этот удаленный орган может вызывать изменения в мозговом кровообращении. Поскольку sEV играют ключевую роль в межклеточной коммуникации из-за их способности переносить биологически активные компоненты от донорских клеток к клеткам-реципиентам 6,20,21, все большее число исследований связывают плацентарные sEV с генерацией материнской эндотелиальной дисфункции 21,22,23,24, включая эндотелиальные клетки головного мозга25,26у женщин с преэклампсией. Таким образом, нарушение функции эндотелия головного мозга может привести к нарушению гематоэнцефалического барьера (ГЭБ), критического компонента цереброваскулярных осложнений, ассоциированных с преэклампсией 3,27.
Тем не менее, доклинические данные с использованием сосудов головного мозга крыс, подвергшихся воздействию сыворотки крови женщин с преэклампсией28, или эндотелиальных клеток головного мозга человека, подвергшихся воздействию плазмы женщин с преэклампсией29, показали, что циркулирующий фактор (факторы) индуцируют разрушение ГЭБ. Несмотря на наличие нескольких кандидатов, потенциально способных нанести вред ГЭБ, присутствующим в кровотоке матери во время преэклампсии, таких как повышенный уровень провоспалительных цитокинов (т.е. фактора некроза опухоли)18,28 или сосудистых регуляторов (например, фактора роста эндотелия сосудов (VEGF))29,30,31, или окислительных молекул, таких как окисленные липопротеины (оксо-ЛПНП)32,33 и др.34, ни один из них не устанавливает прямой связи между плацентой и ГЭБ. Недавно sEV, выделенные из гипоксической плаценты, показали способность разрушать ГЭБ у небеременных самок мышей25. Поскольку плацентарные sEV могут переносить большинство перечисленных циркулирующих факторов, способных разрушать ГЭБ, sEV считаются подходящими кандидатами для соединения поврежденной плаценты, быть переносчиком вредных циркулирующих факторов и нарушать ГЭБ при преэклампсии.
Этот протокол позволяет исследовать, могут ли sEV, выделенные из плацентарных эксплантов, культивируемых в условиях гипоксии, нарушать ГЭБ у небеременных самок мышей в качестве прокси для понимания патофизиологии церебральных осложнений при преэклампсии.
протокол
Исследование проводилось в соответствии с принципами, изложенными в Хельсинкской декларации, и с разрешения соответствующих этических наблюдательных советов. Все участники дали свое информированное согласие перед сбором образцов, о чем сообщалосьранее25. Кроме того, Комитет по биоэтике и биобезопасности Университета Био-Био одобрил этот проект (грант Fondecyt 1200250). Работа на животных проводилась в соответствии с основными принципами трех «Р» в использовании животных в экспериментах35 и в соответствии с рекомендациями руководства по уходу и использованию лабораторных животных, опубликованного Национальным институтом здравоохранения США. Животные содержались в соответствующих условиях в виварии Университета Био-Био. Свежие плаценты (n = 4) получали в течение 1 ч после планового кесарева сечения у матерей (в возрасте 28-31 года) с нормальной беременностью в срок (38-41 неделя гестации). Кесарево сечение было выполнено в клинической больнице Херминда Мартин, Чильян, Чили,как сообщалось ранее. Для применения модели in vivo использовали 4-6-месячных самок небеременных мышей (штамм C57BLACK/6). Они были разделены на три экспериментальные группы: (1) контрольная (без лечения), (2) получавшая sEV из нормоксии (sEVs-Nor) и (3) получавшая sEV из гипоксически культивируемой плаценты (sEVs-Hyp), которые использовались для оценки разрушения ГЭБ in vivo25. Все вводимые растворы были стерильными. Кроме того, приготовление электромобилей проводилось в асептических условиях и под колпаком биобезопасности II класса, чтобы избежать загрязнения.
1. Экспланты плацентарной культуры
- Чтобы извлечь экспланты нормальной плаценты беременности, обратитесь к методу, опубликованному Miller et al. 200536.
- Осторожно удалите сгустки из базальной пластинки плаценты человека с помощью стерилизованных щипцов. Извлекают небольшие экспланты для получения окончательной экстракции тканей 10 г.
- Убедитесь, что плацентарные экспланты удалены из четырех квадрантов материнской части плаценты. Убедитесь, что девитализированные ткани и кальцинированные участки исключены.
- Чтобы манипулировать плацентарной тканью, делайте это на льду, в стерильных условиях и в шкафу биобезопасности.
- Промойте экспланты (не менее трех раз) обильным количеством (пять объемов эксплантатов) холодного (4 °C) фосфатного буферного раствора (PBS 1x, pH 7,4), чтобы удалить как можно больше крови. Центрифуга (252 x g в течение 10 мин) при комнатной температуре между стирками.
- Ресуспендировать 10 г промытых эксплантов в 20 мл питательной среды с добавлением 2% фетальной бычьей сыворотки, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина (см. таблицу материалов).
- Поместите суспензию в культуральную чашку диаметром 100 мм. Экспланты оставляют на 2 ч в инкубаторе при температуре 37 °C с 21% кислорода и 5%СО2.
- После этого повторно промойте экспланты 1x PBS при 37 °C (три раза). Центрифуга (252 x g в течение 10 мин) при комнатной температуре между стирками.
- Далее ресуспендируют ткань в 20 мл питательной среды, предварительно обедненной наночастицами.
ПРИМЕЧАНИЕ: Для истощения наночастиц выполните ультрацентрифугирование (120 000 x g в течение 18 ч при комнатной температуре) и микрофильтрацию (фильтр 0,22 мкм). - Суспендированные экспланты разделить на две чашки для культур (100 мм). Каждая культуральная чашка должна содержать 10 мл ресуспендированных эксплантов.
- После этого одну из посуд, содержащих плацентарные экспланты, помещают в стандартные условия культивирования (37 °С с 8% кислорода и 5%СО2), а другую помещают в гипоксическую камеру с 1%О2.
ПРИМЕЧАНИЕ: (НЕОБЯЗАТЕЛЬНО) Анализ жизнеспособности тканей может быть выполнен с использованием тех же тканевых экстракций и анализа 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ-анализ), как описано в другом месте37,38. Используйте концентрацию общего белка, измеренную в гомогенатах эксплантов, для нормализации значений МТТ. - Через 18 ч в культуре соберите кондиционированную среду эксплантов в новую пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: На этом этапе кондиционированные среды можно замораживать (-80 °C) в течение длительного периода (недель).
2. Выделение сВВ плацентарного происхождения
- Изолируют sEV от кондиционируемой среды с помощью протокола дифференциального центрифугирования и микрофильтрации в соответствии с ранее опубликованными отчетами25,39.
- Выполните последовательное центрифугирование собранной кондиционированной среды. Последовательные этапы центрифугирования: (1) 300 x g в течение 10 мин, (2) 2000 x g в течение 10 мин, (3) 10 000 x g в течение 30 мин и (4) 120 000 x g в течение 2 ч. Выполняйте центрифугирование при комнатной температуре.
- Во всех этих центрифугациях с помощью пипетки объемом 20-100 мкл осторожно собирают надосадочную жидкость и выбрасывают гранулы.
- После этого пропустите последнюю собранную надосадочную жидкость через фильтр 0,22 мкм (см. Таблицу материалов). Затем проводят одно дополнительное центрифугирование при 120 000 x g в течение 18 ч при комнатной температуре.
- После этого выбросьте надосадочную жидкость при ресуспендировании гранулы (содержащей плацентарные sEV) в 500 мкл PBS (pH 7,4) и снова пропустите через фильтр 0,22 мкм. Наконец, выполните последнее центрифугирование при 120 000 x g в течение 3 ч при комнатной температуре.
- Затем повторно суспендируйте гранулу (содержащую плацентарные sEV) в 500 мкл PBS (pH 7,4, ранее обедненные sEV) и пропустите через фильтр 0,22 мкм.
- Маркируйте образцы как запасные sEVs-Normoxia (sEVs-Nor) или sEVs-Hypoxia (sEVs-Hyp).
ПРИМЕЧАНИЕ: Подготовьте 50-100 мкл аликвот изолированных sEV для дальнейших экспериментов. Небольшие электромобили можно хранить при температуре -80 °C в течение длительного периода времени (месяцев). - Охарактеризуйте плацентарные sEV по размеру, количеству и белковому маркеру sEVs, как сообщалось ранее25. Идеальный средний диаметр частиц sEV составляет 50-150 нм.
ПРИМЕЧАНИЕ: Характеристика sEV включает в себя положительное обнаружение CD63, Tsg101, Alix и HSP70 (т.е. для характеристики популяции sEV, обогащенной экзосомами). Кроме того, используют PLAP в качестве маркера плацентарного происхождения25. - Измерьте общее количество белка в растворе sEVs с помощью набора для анализа белка BCA, следуя инструкциям производителя (см. Таблицу материалов).
ПРИМЕЧАНИЕ: На рисунке 1 показан обзор культуры экспланта плаценты и выделения внеклеточных везикул.
3. Инъекции мышам
- Обезболивайте животное в наркозной индукционной камере с 5%-ным распределением изофлурана (см. таблицу материалов). Проверьте уровень анестезии с помощью зажима пальца ноги.
- Через ~40 с поместите мышь в наркозную систему, используя лицевую маску, и поддерживайте уровень анестезии 2% изофлурана.
- Затем поместите животное на нагревательную платформу (см. Таблицу материалов) при комнатной температуре 28 °C. Следите за тем, чтобы глаза были смазаны искусственными слезами.
- Перед инъекцией разбавляют плацентарные sEV (200 мкг общего белка) фосфатным буфером (pH, 7,4) до достижения окончательного объема 70 мкл.
- Продезинфицируйте место инъекции с помощью 70% этилового спирта и ватных тампонов. Обязательно используйте инсулиновый шприц с иглой 30 G для введения раствора sEVs.
ПРИМЕЧАНИЕ: Шприц можно расположить на нагревательной платформе в течение 5 минут, чтобы набрать физиологическую температуру. - Затем вводят раствор в наружную яремную вену. Этот шаг требует специальной подготовки.
ПРИМЕЧАНИЕ: Процедуру следует проводить осторожно, медленно втягивая иглу и осторожно аспирируя до признаков рефлюкса крови. - После инъекции слегка надавите на область инъекции в течение ~15 с сухим ватным тампоном. После этого верните животных в соответствующие клетки.
- Обязательно оценивайте сознание и поведение в течение 15 минут. Показателем достижения сознания является восстановление общей двигательной активности животного.
ПРИМЕЧАНИЕ: Следите за тем, чтобы в клетках для животных поддерживалась теплая температура.
4. Шкала быстрой комы и поведения мышей (RMCBS)
- Используйте RMCBS для оценки неврологических параметров и параметров самочувствия животных40.
ПРИМЕЧАНИЕ: RMCBS обеспечивает быструю оценку (~ 3 мин) с минимальным стрессом животного из-за вмешательства оператора. RMCBS имеет десять параметров (каждый балл 0-2). - Оценивайте самочувствие мышей по шкале RMCBS через 0 ч (до введения sEV) и через 3 ч, 6 ч, 12 ч и 24 ч после инъекции.
ПРИМЕЧАНИЕ: Проведите анализ клаудина-5 (через 6 ч после инъекции sEVs) и экстравазации синего цвета Эвана (через 24 ч после инъекции sEVs) для оценки разрушения ГЭБ (рис. 2).
5. Анализ экстравазации синего цвета Эвана
- После плацентарной инъекции sEVs (через 24 ч) обезболивайте мышей, как описано в шаге 3.1.
- Приготовьте раствор Evan's Blue (2%, разбавленный в фосфатном буферном растворе, 1x) (см. таблицу материалов).
- Используя ретроорбитальный доступ25, вводят раствор Evan's Blue в дозе 2 мл/кг.
- Дайте синему раствору Эвана циркулировать в течение 20 минут под наблюдением анестезии.
- Затем проводят внутрисердечную перфузию в соответствии с ранее описанным протоколом41 с физиологическим раствором (~3 мл, 0,9%, w/v) для удаления синего красителя Эвана из кровообращения. Этот шаг является обязательным.
ПРИМЕЧАНИЕ: Для этой процедуры увеличьте анестезию до 5% и проверьте глубокую плоскость анестезии (т.е. резкое снижение частоты дыхания). - Обнажают сердце с помощью медиальной торакотомии41 (рис. 3).
- После этого фиксируют все животное внутрикардиальной инфузией раствора параформальдегида (4% в ПБС, в/об).
ПРИМЕЧАНИЕ: Проверьте жесткость хвоста для контроля соответствующей фиксации. - Далее, как только фиксация будет завершена, осторожно извлеките мозг, взвесьте его и сфотографируйте. Фотографируйте весь мозг близко к линейке42.
- Затем поместите мозг в мышиный слайсер (см. Таблицу материалов).
- Рассекают мозг на девять отделов, журавлино-хвостовых, включая мозжечок (по 100 мкм каждый).
- После вскрытия визуализируйте и сделайте снимки срезов мозга в стерео-зум-микроскопе (см. таблицу материалов).
- Используйте полученные изображения для количественной оценки экстравазации синего цвета Эвана с помощью программного обеспечения ImageJ (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Чтобы проанализировать наличие синего красителя Эвана, установите значения синего цвета Эвана, используя положительный контроль участка мозга (от животного, которому вводили краситель, но без внутрикардиальной перфузии). Синие значения Эвана, полученные при положительном контроле, обычно находятся в диапазоне от 75 до 110 на гистограмме интенсивности синего канала (рис. 4). - Убедитесь, что изображения мозга анализируются вслепую соответствующей экспериментальной группой, чтобы избежать предвзятости наблюдателя. В качестве альтернативы можно количественно оценить экстравазацию синего цвета Эвана путем гомогенизации мозга с последующей спектроскопией43.
ПРИМЕЧАНИЕ: В отдельных экспериментах, используя свежеизолированный мозг мышей, которым вводили sEV (6 ч), анализировали уровни белка клаудина 5 (CLND-5) (см. таблицу материалов), критического плотного соединения, участвующего в герметичности ГЭБ44 (рис. 5).
Результаты
Этот протокол оценивает способность sEV, полученных из плаценты, культивируемой в условиях гипоксии, разрушать ГЭБ у небеременных мышей. Этот метод позволяет лучше понять потенциальную связь между плацентой и головным мозгом при нормальных и патологических состояниях. В частности, этот метод может служить прокси для анализа участия плацентарных СВ в возникновении церебральных осложнений при преэклампсии.
В отличие от мышей, которым вводили sEVs-Nor, у мышей, которым вводили sEVs-Hyp, наблюдалось прогрессирующее снижение неврологического показателя до 24 ч (Таблица 1), что свидетельствует о способности sEVs-Hyp нарушать функцию мозга.
Кроме того, мозг мышей из группы инъекций sEVs-Hyp имеет более высокую свежую массу, чем у мышей, которым вводили sEVs-Nor или контрольных мышей (0,51 ± 0,008; 0,46 ± 0,008; 0,47 ± 0,01 г соответственно), что может являться грубым показателем отека мозга45.
Совместимый с этим открытием, этот протокол позволяет идентифицировать экстравазацию синего цвета Эвана как индикатор нарушения ГЭБ. В связи с этим мозг мышей, которым вводили sEVs-Hyp, имеет более высокую экстравазацию синего цвета Эвана, чем мозг из группы sEVs-Nor (рис. 5A).
Несмотря на то, что основной механизм разрушения ГЭБ, индуцированного sEVs-Hyp, не был проанализирован с помощью этого протокола, результаты также указывают на то, что у мышей, которым вводили sEVs-Hyp, наблюдалось снижение количества белка CLND-5 в областях, в которых ГЭБ был наиболее поражен (т.е. в задних областях) (Рисунок 5B). Таким образом, вполне возможно, что sEVs-hyp нарушает экспрессию функции этого важнейшего эндотелиального белка плотного соединения.
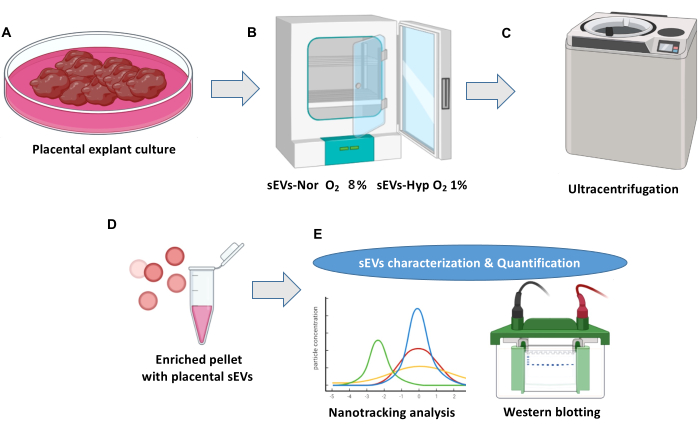
Рисунок 1: Культура экспланта плаценты и протокол выделения внеклеточных везикул . (A) Нормальные культуры эксплантата плаценты. (Б) Экспланты распределяются по двум условиям биогенеза плацентарных мелких внеклеточных везикул (sEV). Нормоксия (sEVs-Nor, 8% O2) или гипоксия (sEVs-Hyp, 1% O2) в течение 18 ч. (C) Кондиционированную среду собирают, фильтруют и центрифугируют для удаления клеточного мусора. (D) sEV выделяют с помощью ультрацентрифугирования. (E) sEV характеризуются с помощью анализа нанотрекинга и вестерн-блоттинга. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Оценка in vivo протокола нарушения гематоэнцефалического барьера. Используются небеременные мыши C57BL6/J в возрасте 4-6 месяцев. (А) Через наружную яремную вену животные получали sEV (200 мкг общего белка), выделенные из нормоксических (sEVs-Nor, 8% O2) или гипоксических (sEVs-Hyp, 1% O2) плацентарных культур. RMCBS контролируется через 0-24 ч после инъекции. (B) Через 6 ч после инъекции sEVs мозг извлекают и разделяют на девять сегментов для экстракции белка. Claudin 5 (CLDN5) анализируется в гомогенатах этих девяти секций. (C) Анализ синей экстравазации по Эвану (через 24 ч после инъекции sEVs) был проанализирован после инъекции ретроорбитальной пункции в каждый из девяти сегментов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
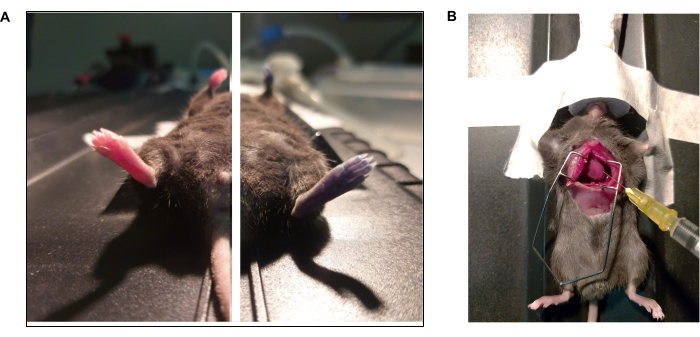
Рисунок 3: Документальные фотозаписи синего красителя Эвана и протокола внутрикардиальной перфузии. (А) Мышь получила синий цвет Эвана с помощью ретроорбитальной инъекции. (Слева) Животное до и (справа) после инъекции (15 с) голубого Эвана. (B) Торакотомия для выполнения внутрикардиальной перфузии фосфатного буферного раствора (1x PBS) и параформальдегида (4% PFA). Левый желудочек заострен кончиком иглы. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Анализ экстравазации синего цвета Эвана после инъекции sEVs. (A) Репрезентативное изображение всего мозга, показывающее синюю экстравазацию Эвана. Пунктирной линией обозначены девять участков, полученных из всего мозга. (B) Вскрытие мозга с помощью слайсера для мозговых мышей. (C) Репрезентативные изображения срезов головного мозга через 24 ч после инъекции sEVs. Контроль (CTL), плацента в нормоксических (sEVs-Nor) или гипоксических состояниях (sEVs-Hyp). Масштабная линейка = 0,4 см. (D) Цифровое очертание среза мозга с помощью ImageJ. (E) Гистограмма в синем канале. Значения от 75 до 110 связаны с экстравазацией синего цвета Эвана. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Экстравазация синего цвета Эвана и уровни клаудина-5 у мышей, которым вводили sEV, выделенные из плацентарных эксплантов. (A) Процент экстравазации синего (БЭ) Эвана с учетом целых отделов мозга. Контроль (CTL, синий), плацента в нормоксических (sEVs-Nor, красный) или гипоксических состояниях (sEVs-Hyp, зеленый). (B) Относительные уровни клаудина 5 (CLDN5) в девяти отделах мозга были получены из трех экспериментальных групп. β-актин используется в качестве регулятора нагрузки. Значения являются средними ± межквартильном диапазоне. Каждая точка представляет собой отдельного испытуемого. *p < 0,05, **p < 0,005. p < 0,0001. р < 0,001; Тест ANOVA с последующим тестом Бонферрони. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Время (ч) | Контроль | sEVs-Нормоксия | sEVs-Гипоксия | АНОВА |
| 0 | 18,75 ± 0,250 | 18,5 ± 0,288 | 18,75 ± 0,250 | НС |
| 3 | 18,5 ± 0,866 | 17 ± 0,707 | 13.25 ± 1.750*α | 0.006 |
| 6 | 19,25 ± 0,750 | 17 ± 0,577 | 11.75 ± 1.250*α | 0.002 |
| 12 | 18,5 ± 0,645 | 16.75 ± 1.109 | 13 ± 0.816*α | 0.001 |
| 24 | 19,5 ± 0,288 | 17,75 ± 0,250 | 10.25 ± 0.853*α | <0,0001 |
| *p < 0,01 по сравнению с контролем. αp < 0,01 в сравнении с sEVs-Normoxia | ||||
Таблица 1: Шкала быстрой мышиной комы и поведения (RMCBS) через 24 ч после инъекции sEVs. Оценка выражается как среднее значение ± SEM. У животных, близких к 20, баллы являются стандартными, в то время как чем ниже балл, тем выше дисфункция ЦНС.
Обсуждение
Это исследование раскрывает новые идеи о потенциальном вреде, наносимом sEV, выделенными из плацентарных эксплантов, культивируемых в гипоксических условиях, на нарушение гематоэнцефалического барьера грызунов. Патологический механизм включает снижение CLND-5 в заднем отделеголовного мозга 25.
Предыдущие исследования показали, что плазменные sEV от лиц с преэклампсией индуцируют эндотелиальную дисфункцию в различных органах с использованием моделей in vitro 46,47. В этом исследовании был особенно тщательно изучен гематоэнцефалический барьер, что позволило по-новому взглянуть на sEV, выделенные из плаценты, культивируемой гипоксией, которая нарушает этот жизненно важный барьер. Эти открытия открывают новую область исследований, в которой sEV могут служить каналом связи между плацентой и мозгом как при нормальных, так и при патологических сценариях, таких как преэклампсия.
Представленный протокол прост, но стоит упомянуть несколько важных шагов. Этот протокол требует свежей плаценты в течение 1 часа после родов. Мы также не рекомендуем увеличивать период культивирования более 24 часов, чтобы предотвратить деградацию тканей. Этот протокол снижает потенциальное загрязнение от sEV, продуцируемых плацентой мышей. Цифровой анализ синей экстравазации Эвана занимает много времени. Кроме того, синее окрашивание Эвана менее заметно после среза мозга. Поэтому рекомендуется первоначальная настройка для определения синего диапазона с помощью положительного контроля. Отрицательный контроль, например, мозг мыши, не подвергшейся синей инъекции Эвана, также может быть использован. Слепой анализ экспериментальных групп необходим для предотвращения потенциальной предвзятости наблюдателя.
В ходе этого протокола может возникнуть несколько проблем. Существенным ограничением является биологическая изменчивость, происходящая как от человеческой плаценты, так и от мышей, которым делали инъекции. Для обеспечения воспроизводимости экспериментов Эвана по экстравазации синего цвета предложено установить дозы sEV, выделенные из плаценты человека. Мы выбрали дозу 200 мкг общего белка; однако это количество может колебаться в зависимости от чистоты везикул, эффективности яремной инъекции, введения синего препарата Эвана, его выведения из кровеносной системы и, не в последнюю очередь, биологического воздействия sEV с учетом их содержимого.
Клеточные механизмы, с помощью которых sEV из плаценты человека могут нарушить гематоэнцефалический барьер, требуют дополнительных экспериментов. Тем не менее, этот метод имеет значение, намекая на потенциальную связь между плацентой и мозгом, что требует дальнейшего изучения. Поэтому мы поощряем будущие исследования, концентрируясь на sEV и их взаимодействии с гематоэнцефалическим барьером, а также на влиянии их груза на нейрональные ткани. Вопрос о том, приводит ли нарушение гематоэнцефалического барьера к долгосрочным последствиям для материнского мозга, требует дальнейшего изучения.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявлять.
Благодарности
Авторы благодарят исследователей GRIVAS Health за их ценный вклад. Кроме того, акушерки и клинический персонал Службы акушерства и гинекологии входят в состав больницы Чильян, Чили. Основана компанией Fondecyt Regular 1200250.
Материалы
| Name | Company | Catalog Number | Comments |
| Adult mice brain slecer matrice 3D printed | Open access file | Adult mice | Adult mice brain slicer. Printed in PLA filament. |
| Anti β-Actin primary antibody | Sigma-Aldrich | Clon AC-74 | Antibody for loading control (Western blot) |
| Anti-Claudin5 primary antibody | Santa cruz Biotechnology | sc-374221 | Primary antibody for tight junction protein CLDN5 of mice BBB (Western blot) |
| BCA protein kit | Thermo Scientific | 23225 | Kit for measuring protein concentration |
| Culture media #200 500 mL | Thermo Fisher Scientific | m200500 | Culture media for placental explants |
| D180 CO2 incubator | RWD Life science | D180 | Standard incubator to estabilize explants and culture sEVs-Nor |
| Evans blue dye > 75% 10 g | Sigma-Aldrich | E2129.10G | Dye to analize blood brain barrier disruption IN VIVO |
| Fetal bovine serum 500 mL | Thermo Fisher Scientific | 16000044 | Additive growth factor for culture media 200 |
| Himac Ultracentrifuge CP100NX | Himac eppendorf group | 5720410101 | Ultracentrifuge for condicioned media > 1,20,000 x g |
| ImageJ software | NIH | https://imagej.nih.gov/ij/download.html | |
| Isoflurane x 100 mL | USP Baxter | 212-094 | Volatile inhalated anaesthesia agent for mice |
| Kit CellTiter 96 Non-radioactive | Promega | 0000105232 | In vitro assay for placental explants viability |
| Mouse IgG Secondary antibody | Thermo Fisher Scientific | MO 63103 | Secondary antibody for CLDN5 (western blot) |
| NanoSight NS300 | Malvern Panalytical | 90278090 | Nanotracking analysis of particles from placental explants condicioned media |
| Paraformaldehide E 97% solution 500 mL | Thermo Fisher Scientific | A11313.22 | Fixative solution for brain tissue slices and intracardial perfusion (once diluted) |
| PBS 1 X pH 7.4 500 mL | Thermo Fisher Scientific | 10010023 | Wash solution for placenta explants |
| Peniciline-streptomicine 100x 20 mL | Thermo Fisher Scientific | 10378016 | Antiobiotics for placental explants culture media |
| ProOX C21 Cytocentric O2 and CO2 Subchamber Controller | BioSpherix | SCR_021131 | CO2 regulator to induce Hypoxia in sealed chamber for sEVs-Hyp |
| Sodium Thiopental 1 g | Chemie | 7061 | humanitarian euthanasia agent |
| Somnosuite low flow anesthesia system | Kent Scientifics | SS-01 | Isoflurane vaporizer for small rodents |
| Surgical Warming platform | Kent Scientifics | A41166 | Warming platform for mainteinance anesthesia in mice |
| Syringe Filters, Polytetrafluoroethylene (PTFE), Hydrophobic, 0.22 µm, Sterile, 25 mm | Southern labware | 10026 | Filtration of condicioned media harvested from placental explants |
| Tabletop High-Speed Micro Centrifuges HITACHI himac CT15E/CT15RE | Hitachi medical systems | 6020 | Serial centrifugations of condicioned media < 1,20, 000 x g |
| Trinocular stereomicroscope transmided and reflective light 10x-160x | Center Medical | 2597 | Stereomicroscope to register brain slices |
Ссылки
- Lisonkova, S., Joseph, K. S. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 209 (544), 544.e1-544.e12 (2013).
- Sibai, B., Dekker, G., Kupferminc, M. Preeclampsia. Lancet. 365 (9461), 785-799 (2005).
- Hammer, E. S., Cipolla, M. J. Cerebrovascular dysfunction in preeclamptic pregnancies. Curr Hypertens Rep. 17 (8), 64 (2015).
- Okanloma, K. A., Moodley, J. Neurological complications associated with the preeclampsia/eclampsia syndrome. Int J Gynaecol Obstet. 71, 223-225 (2000).
- Frias, A. E., Belfort, M. A. Post magpie: how should we be managing severe preeclampsia. Curr Opin Gynecol Obstet. 15 (6), 489-495 (2003).
- Familari, M., Cronqvist, T., Masoumi, Z., Hansson, S. R. Placenta-derived extracellular vesicles: Their cargo and possible functions. Reprod Fertil Dev. 29 (3), 433-447 (2017).
- Montoro-Garcia, S., Shantsila, E., Marin, F., Blann, A., Lip, G. Y. Circulating microparticles: new insights into the biochemical basis of microparticle release and activity. Basic Res Cardiol. 106, 911-923 (2011).
- Germain, S. J., Sacks, G. P., Sooranna, S. R., Sargent, I. L., Redman, C. W. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol. 178 (9), 5949-5956 (2007).
- Tannetta, D., Masliukaite, I., Vatish, M., Redman, C., Sargent, I. Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J Reprod Immunol. 119, 98-106 (2017).
- Collett, G. P., Redman, C. W., Sargent, I. L., Vatish, M. Endoplasmic reticulum stress stimulates the release of extracellular vesicles carrying danger-associated molecular pattern (DAMP) molecules. Oncotarget. 9 (6), 6707-6717 (2018).
- Cooke, W. R., et al. Maternal circulating syncytiotrophoblast-derived extracellular vesicles contain biologically active 5'-tRNA halves. Biochem Biophys Res Commun. 518 (1), 107-113 (2019).
- Gill, M., et al. Placental syncytiotrophoblast-derived extracellular vesicles carry active nep (neprilysin) and are increased in preeclampsia. Hypertension. 73 (5), 1112-1119 (2019).
- Kandzija, N., et al. Placental extracellular vesicles express active dipeptidyl peptidase IV; levels are increased in gestational diabetes mellitus. J Extracell Vesicles. 8 (1), 1617000 (2019).
- Motta-Mejia, C., et al. Placental vesicles carry active endothelial nitric oxide synthase and their activity is reduced in preeclampsia. Hypertension. 70 (2), 372-381 (2017).
- Sammar, M., et al. Reduced placental protein 13 (PP13) in placental derived syncytiotrophoblast extracellular vesicles in preeclampsia - A novel tool to study the impaired cargo transmission of the placenta to the maternal organs. Placenta. 66, 17-25 (2018).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Warrington, J. P., et al. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiological Reports. 2 (8), e12134-e12134 (2014).
- Warrington, J. P., Drummond, H. A., Granger, J. P., Ryan, M. J. Placental Ischemia-induced increases in brain water content and cerebrovascular permeability: Role of TNFα. Am J Physiol Regul Integr Comp Physiol. 309 (11), R1425-R1431 (2015).
- Johnson, A. C., et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS ONE. 9 (11), e113670 (2014).
- Escudero, C. A., et al. Role of extracellular vesicles and microRNAs on dysfunctional angiogenesis during preeclamptic pregnancies. Front Physiol. 7, 1-17 (2016).
- Salomon, C., et al. Placental exosomes as early biomarker of preeclampsia: Potential role of exosomalmicrornas across gestation. J Clin Endocrinol Metab. 102 (9), 3182-3194 (2017).
- Knight, M., Redman, C. W., Linton, E. A., Sargent, I. L. Shedding of syncytiotrophoblast microvilli into the maternal circulation in pre-eclamptic pregnancies. Br J Obstet Gynaecol. 105 (6), 632-640 (1998).
- Gilani, S. I., Weissgerber, T. L., Garovic, V. D., Jayachandran, M. Preeclampsia and extracellular vesicles. Curr Hypertens Rep. 18 (9), 68 (2016).
- Dutta, S., et al. Hypoxia-induced small extracellular vesicle proteins regulate proinflammatory cytokines and systemic blood pressure in pregnant rats. Clin Sci (Lond). 134 (6), 593-607 (2020).
- Leon, J., et al. Disruption of the blood-brain barrier by extracellular vesicles from preeclampsia plasma and hypoxic placentae: attenuation by magnesium sulfate. Hypertension. 78 (5), 1423-1433 (2021).
- Han, C., et al. Placenta-derived extracellular vesicles induce preeclampsia in mouse models. Haematologica. 105 (6), 1686-1694 (2020).
- Amburgey, O. A., Chapman, A. C., May, V., Bernstein, I. M., Cipolla, M. J. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 56 (5), 1003-1008 (2010).
- Cipolla, M. J., et al. Pregnant serum induces neuroinflammation and seizure activity via TNFalpha. Exp Neurol. 234 (2), 398-404 (2012).
- Bergman, L., et al. Preeclampsia and increased permeability over the blood brain barrier - a role of vascular endothelial growth receptor 2. Am J Hypertens. 34 (1), 73-81 (2021).
- Torres-Vergara, P., et al. Dysregulation of vascular endothelial growth factor receptor 2 phosphorylation is associated with disruption of the blood-brain barrier and brain endothelial cell apoptosis induced by plasma from women with preeclampsia. Biochim Biophys Acta Mol Basis Dis. 1868 (9), 166451 (2022).
- Schreurs, M. P., Houston, E. M., May, V., Cipolla, M. J. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placental growth factor during pregnancy. FASEB J. 26 (1), 355-362 (2012).
- Schreurs, M. P., Cipolla, M. J. Cerebrovascular dysfunction and blood-brain barrier permeability induced by oxidized LDL are prevented by apocynin and magnesium sulfate in female rats. J Cardiovasc Pharmacol. 63 (1), 33-39 (2014).
- Schreurs, M. P. H., et al. Increased oxidized low-density lipoprotein causes blood-brain barrier disruption in early-onset preeclampsia through LOX-1. FASEB J. 27 (3), 1254-1263 (2013).
- Escudero, C., et al. Brain vascular dysfunction in mothers and their children exposed to preeclampsia. Hypertension. 80 (2), 242-256 (2023).
- Russell, W. M. S., Burch, R. L. The principles of humane experimental technique. Universities Federation of Animal Welfare. , (1959).
- Miller, R. K., et al. Human placental explants in culture: approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Troncoso, F. A. J., Herlitz, K., Ruiz, F., Bertoglia, P., Escudero, C. Elevated pro-angiogenic phenotype in feto-placental tissue from gestational diabetes mellitus. Placenta. 36 (4), 2 (2015).
- Zhang, H. C., et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev. 21 (18), 3289-3297 (2012).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3), 22 (2006).
- Carroll, R. W., et al. A rapid murine coma and behavior scale for quantitative assessment of murine cerebral malaria. PLoS One. 5 (10), e13124 (2010).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988 (2021).
- Walchli, T., et al. Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain. Nat Protoc. 10 (1), 53-74 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Sci Rep. 4, 6588 (2014).
- Morita, K., Sasaki, H., Furuse, M., Tsukita, S. Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol. 147 (1), 185-194 (1999).
- Lara, E., et al. Abnormal cerebral microvascular perfusion and reactivity in female offspring of reduced uterine perfusion pressure (RUPP) mice model. J Cereb Blood Flow Metab. 42 (12), 2318-2332 (2022).
- Chang, X., et al. Exosomes from women with preeclampsia induced vascular dysfunction by delivering sflt (soluble fms-like tyrosine kinase)-1 and seng (soluble endoglin) to endothelial cells. Hypertension. 72, 1381-1390 (2018).
- Smarason, A. K., Sargent, I. L., Starkey, P. M., Redman, C. W. The effect of placental syncytiotrophoblast microvillous membranes from normal and pre-eclamptic women on the growth of endothelial cells in vitro. BJOG. 100 (10), 943-949 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены