Method Article
Störung der Blut-Hirn-Schranke der Maus durch kleine extrazelluläre Vesikel aus hypoxischen menschlichen Plazenta
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Es wird ein Protokoll vorgestellt, um zu evaluieren, ob kleine EVs (sEVs), die aus Plazenta-Explantaten isoliert wurden, die unter hypoxischen Bedingungen kultiviert wurden (ein Aspekt der Präeklampsie modellierend), die Blut-Hirn-Schranke bei nicht schwangeren erwachsenen weiblichen Mäusen stören.
Zusammenfassung
Zerebrovaskuläre Komplikationen, einschließlich Hirnödeme sowie ischämischer und hämorrhagischer Schlaganfall, sind die Hauptursache für die mütterliche Sterblichkeit im Zusammenhang mit Präeklampsie. Die zugrundeliegenden Mechanismen dieser zerebrovaskulären Komplikationen sind noch unklar. Sie werden jedoch mit Plazentafunktionsstörungen und einer Störung der Blut-Hirn-Schranke (BHS) in Verbindung gebracht. Dennoch wird die Verbindung zwischen diesen beiden entfernten Organen noch ermittelt. Immer mehr Hinweise deuten darauf hin, dass die Plazenta Signalmoleküle, einschließlich extrazellulärer Vesikel, in den mütterlichen Kreislauf abgibt. Extrazelluläre Vesikel werden nach ihrer Größe kategorisiert, wobei kleine extrazelluläre Vesikel (sEVs mit einem Durchmesser von weniger als 200 nm) sowohl unter physiologischen als auch unter pathologischen Bedingungen als kritische Signalpartikel gelten. Bei der Präeklampsie kommt es zu einer erhöhten Anzahl zirkulierender sEVs im mütterlichen Kreislauf, deren Signalfunktion nicht gut verstanden ist. Plazenta-sEVs, die bei Präeklampsie oder aus einer normalen Schwangerschaftsplazenta freigesetzt werden, die einer Hypoxie ausgesetzt sind, induzieren eine endotheliale Dysfunktion des Gehirns und eine Störung der BHS. In diesem Protokoll untersuchen wir, ob sEVs, die aus plazentaren Explantaten isoliert wurden, die unter hypoxischen Bedingungen kultiviert wurden (die einen Aspekt der Präeklampsie modellieren), die BHS in vivo stören.
Einleitung
Etwa 70 % der mütterlichen Todesfälle aufgrund von Präeklampsie, einem hypertensiven Schwangerschaftssyndrom, das durch gestörte Plazentationsprozesse, mütterliche systemische endotheliale Dysfunktion und in schweren Fällen durch Multiorganversagen 1,2 gekennzeichnet ist, sind mit akuten zerebrovaskulären Komplikationen assoziiert 3,4. Die meisten Todesfälle von Müttern treten in Ländern mit niedrigem und mittlerem Einkommen auf5. Die zugrundeliegenden Mechanismen sind jedoch trotz der klinischen und epidemiologischen Relevanz zerebrovaskulärer Komplikationen im Zusammenhang mit Präeklampsie noch unklar.
Auf der anderen Seite sind extrazelluläre Vesikel (EVs) (Durchmesser ~30-400 nm) essentielle Mediatoren der interzellulären Kommunikation zwischen Geweben und Organen, einschließlich der mütterlich-plazentaren Interaktion6. Zusätzlich zu Proteinen und Lipiden auf der äußeren Oberfläche transportieren EVs Fracht (Proteine, RNA und Lipide). EVs können in (1) Exosomen (Durchmesser ~50-150 nm, auch kleine EVs (sEVs) genannt), (2) mittlere/große EVs und (3) apoptotische Körper eingeteilt werden, die sich durch Größe, Biogenese, Inhalt und potenzielle Signalfunktion unterscheiden. Die Zusammensetzung von EVs wird durch die Zellen, aus denen sie stammen, und den Krankheitstyp7 bestimmt. Syncytiotrophoblasten-abgeleitete EVs exprimieren plazentare alkalische Phosphatase (PLAP)8,9, die Plazenta-abgeleitete zirkulierende kleine EVs (PDsEVs) in der Schwangerschaft nachweist. Außerdem hilft PLAP dabei, Veränderungen in der PDsEV-Fracht und deren Auswirkungen bei Präeklampsie im Vergleich zu normotensiven Schwangerschaften zu erkennen 10,11,12,13,14,15.
Die Plazenta wurde als notwendige Komponente in der Pathophysiologie der Präeklampsie16 oder der zerebralen Komplikationen im Zusammenhang mit dieser Erkrankung anerkannt 17,18,19. Es ist jedoch nicht bekannt, wie dieses entfernte Organ Veränderungen in der Gehirnzirkulation hervorrufen könnte. Da sEVs aufgrund ihrer Fähigkeit, bioaktive Komponenten von Spender- auf Empfängerzellen zu übertragen, eine zentrale Rolle in der Zell-zu-Zell-Kommunikation spielen 6,20,21, haben eine wachsende Anzahl von Studien plazentare sEVs mit der Entstehung von mütterlicher endothelialer Dysfunktion in Verbindung gebracht 21,22,23,24, einschließlich Gehirnendothelzellen 25,26bei Frauen mit Präeklampsie. Daher kann die Beeinträchtigung der Endothelfunktion des Gehirns zu einer Störung der Blut-Hirn-Schranke (BHS) führen, einer kritischen Komponente bei zerebrovaskulären Komplikationen im Zusammenhang mit Präeklampsie 3,27.
Nichtsdestotrotz berichteten präklinische Befunde mit Hirngefäßen von Ratten, die dem Serum von Frauen mit Präeklampsie28 ausgesetzt waren, oder menschlichen Gehirnendothelzellen, die dem Plasma von Frauen mit Präeklampsie29 ausgesetzt waren, dass zirkulierende Faktoren eine Störung der BHS induzieren. Trotz mehrerer Kandidaten, die das Potenzial haben, die BHS zu schädigen, die während der Präeklampsie im mütterlichen Kreislauf vorhanden sind, wie z. B. erhöhte Spiegel von proinflammatorischen Zytokinen (d. h. Tumornekrosefaktor)18,28 oder vaskulären Regulatoren (d. h. vaskulärer endothelialer Wachstumsfaktor (VEGF))29,30,31 oder oxidativen Molekülen wie oxidierten Lipoproteinen (Oxo-LDL)32,33, unter anderem34stellt keine von ihnen eine direkte Verbindung zwischen der Plazenta und der BHS her. Kürzlich haben sEVs, die aus hypoxischen Plazenten isoliert wurden, gezeigt, dass sie die BHS bei nicht schwangeren weiblichen Mäusen störenkönnen 25. Da plazentare sEVs die meisten der aufgeführten zirkulierenden Faktoren mit der Fähigkeit tragen können, die BHS zu stören, gelten sEVs als geeignete Kandidaten, um die verletzte Plazenta zu verbinden, Träger schädlicher zirkulierender Faktoren zu sein und die BHS bei Präeklampsie zu stören.
Dieses Protokoll ermöglicht es uns, zu untersuchen, ob sEVs, die aus Plazenta-Explantaten isoliert wurden, die unter hypoxischen Bedingungen kultiviert wurden, die BHS in nicht schwangeren weiblichen Mäusen stören können, um die Pathophysiologie von zerebralen Komplikationen während der Präeklampsie zu verstehen.
Protokoll
Die Forschung wurde nach den in der Deklaration von Helsinki formulierten Prinzipien und mit Genehmigung der jeweiligen Ethik-Prüfungsausschüsse durchgeführt. Alle menschlichen Teilnehmer gaben vor der Probenentnahme ihre Einverständniserklärung, wie bereits berichtet25. Darüber hinaus hat die Kommission für Bioethik und Biosicherheit der Universität Bío-Bío dieses Projekt genehmigt (Fondecyt-Stipendium 1200250). Die Tierarbeit wurde in Übereinstimmung mit den Grundprinzipien der drei R's bei der Verwendung von Tieren in Versuchen35 und gemäß den Empfehlungen der Richtlinien für die Pflege und Verwendung von Labortieren durchgeführt, die vom US-amerikanischen National Institute of Health veröffentlicht wurden. Die Tiere wurden in einer geeigneten Umgebung im Vivarium der Universität Bío-Bío gehalten. Frische Plazenten (n = 4) wurden innerhalb von 1 h nach elektivem Kaiserschnitt von Müttern (im Alter von 28-31 Jahren) mit normaler Schwangerschaft (38 bis 41 Schwangerschaftswoche) gewonnen. Kaiserschnitte wurden im Herminda Martin Clinical Hospital, Chillan, Chile, durchgeführt, wie bereits berichtet25. Für die Anwendung des in vivo Modells wurden 4-6 Monate alte weibliche, nicht trächtige Mäuse (Stamm C57BLACK/6) verwendet. Sie wurden in drei experimentelle Gruppen eingeteilt: (1) Kontrolle (ohne Behandlung), (2) Behandlung mit sEVs aus Normoxie (sEVs-Nor) und (3) Behandlung mit sEVs aus hypoxisch kultivierter Plazenta (sEVs-Hyp), die zur Bewertung der Störung der BHS in vivoverwendet wurden 25. Alle injizierten Lösungen waren steril. Außerdem wurde die Herstellung von sEVs unter aseptischen Bedingungen und unter einer Biosicherheitshaube der Klasse II durchgeführt, um eine Kontamination zu vermeiden.
1. Explantate der Plazentakultur
- Um Explantaten von normalen Schwangerschaftsplazenten zu extrahieren, überprüfen Sie die von Miller et al. 2005veröffentlichte Methode 36.
- Entfernen Sie die Gerinnsel vorsichtig mit einer sterilisierten Pinzette von der Basalplatte der menschlichen Plazenta. Extrahieren Sie kleine Explantate, um eine endgültige Gewebeextraktion von 10 g zu erhalten.
- Stellen Sie sicher, dass Plazenta-Explantaten aus den vier Quadranten des mütterlichen Teils der Plazenta entfernt werden. Stellen Sie sicher, dass devitalisiertes Gewebe und verkalkte Bereiche ausgeschlossen werden.
- Um Plazentagewebe zu manipulieren, tun Sie dies auf Eis, unter sterilen Bedingungen und in einer Biosicherheitswerkbank.
- Waschen Sie die Explantate (mindestens dreimal) mit reichlich (fünf Volumina der Explantate) kalter (4 °C) Phosphatpufferlösung (PBS 1x, pH 7,4), um so viel Blut wie möglich zu entfernen. Zentrifugieren (252 x g für 10 min) bei Raumtemperatur zwischen den Wäschen.
- Resuspendieren Sie 10 g gewaschene Explantate in 20 ml Kulturmedium, ergänzt mit 2 % fötalem Kälberserum, 100 IE/ml Penicillin und 100 μg/ml Streptomycin (siehe Materialtabelle).
- Geben Sie die Suspension in eine 100-mm-Kulturschale. Lassen Sie die Explantate 2 h in einem Inkubator bei 37 °C mit 21 % Sauerstoff und 5 %CO2 stehen.
- Danach werden die Explantate mit 1x PBS bei 37 °C (dreimal) nachgewaschen. Zentrifugieren (252 x g für 10 min) bei Raumtemperatur zwischen den Wäschen.
- Ferner wird das Gewebe in 20 ml Kulturmedium, das zuvor von Nanopartikeln abgereichert war, resuspendiert.
HINWEIS: Für die Abreicherung von Nanopartikeln führen Sie eine Ultrazentrifugation (120.000 x g für 18 Stunden bei Raumtemperatur) und eine Mikrofiltration (0,22-μm-Filter) durch. - Die resuspendierten Explantaten werden in zwei Kulturschalen (100 mm) aufgeteilt. Jede Kulturschale muss 10 ml resuspendierte Explantaten enthalten.
- Danach wird eine der Schalen, die Plazentaexplantaten enthalten, unter Standardkulturbedingungen (37 °C mit 8 % Sauerstoff und 5 %CO2) gestellt, während die andere in eine hypoxische Kammer mit 1 %O2 gestellt wird.
ANMERKUNG: (OPTIONAL) Die Analyse der Gewebeviabilität kann mit den gleichen Gewebeextraktionen und dem 3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromid-Assay (MTT-Assay) durchgeführt werden, wie an anderer Stelle37,38 beschrieben. Verwenden Sie die Gesamtproteinkonzentration, die in den Explantat-Homogenaten gemessen wird, um die MTT-Werte zu normalisieren. - Nach 18 Stunden in Kultur wird das konditionierte Medium der Explantaten in ein neues 15-ml-Röhrchen geerntet.
HINWEIS: In diesem Schritt können konditionierte Medien für einen längeren Zeitraum (Wochen) eingefroren werden (-80 °C).
2. Isolierung von Plazenta-abgeleiteten sEVs
- Isolierung von sEVs aus dem konditionierten Medium unter Verwendung des Differenzzentrifugations- und Mikrofiltrationsprotokolls gemäß den zuvor veröffentlichten Berichten25,39.
- Führen Sie eine sequentielle Zentrifugation für das geerntete konditionierte Medium durch. Aufeinanderfolgende Schritte von Zentrifugationen sind (1) 300 x g für 10 min, (2) 2000 x g für 10 min, (3) 10.000 x g für 30 min und (4) 120.000 x g für 2 h. Führen Sie die Zentrifugationen bei Raumtemperatur durch.
- Bei all diesen Zentrifugationen wird mit einer 20-100-μl-Pipette der Überstand vorsichtig aufgefangen und das Pellet entsorgt.
- Anschließend wird der zuletzt gesammelte Überstand durch einen 0,22-μm-Filter geleitet (siehe Materialtabelle). Anschließend wird eine weitere Zentrifugation bei 120.000 x g für 18 h bei Raumtemperatur durchgeführt.
- Danach wird der Überstand verworfen, während das Pellet (das plazentare sEVs enthält) in 500 μl PBS (pH 7,4) resuspendiert und erneut durch einen 0,22-μm-Filter geleitet. Zum Schluss wird eine letzte Zentrifugation bei 120.000 x g für 3 h bei Raumtemperatur durchgeführt.
- Als nächstes wird das Pellet (das plazentare sEVs enthält) in 500 μl PBS (pH 7,4, zuvor ohne sEVs) resuspendiert und durch einen 0,22-μm-Filter geleitet.
- Kennzeichnen Sie die Proben als Bestand an sEVs-Normoxie (sEVs-Nor) oder sEVs-Hypoxie (sEVs-Hyp).
HINWEIS: Bereiten Sie 50-100 μl Aliquots der isolierten sEVs für weitere Experimente vor. Kleine Elektrofahrzeuge können über einen längeren Zeitraum (Monate) bei -80 °C gelagert werden. - Charakterisierung der plazentaren sEVs nach Größe, Anzahl und Proteinmarker der sEVs, wie bereits berichtet25. Der ideale mittlere Partikeldurchmesser von sEVs beträgt 50-150 nm.
HINWEIS: Die Charakterisierung von sEVs umfasst den positiven Nachweis von CD63, Tsg101, Alix und HSP70 (d. h. zur Charakterisierung von sEVs, die mit Exosomen angereichert sind). Verwenden Sie PLAP auch als Marker für den plazentaren Ursprung25. - Messen Sie die Gesamtmenge an Protein in der sEVs-Lösung mit dem BCA-Protein-Assay-Kit gemäß den Anweisungen des Herstellers (siehe Materialtabelle).
HINWEIS: Abbildung 1 zeigt einen Überblick über die plazentare Explantatkultur und die Isolierung extrazellulärer Vesikel.
3. Mäuse-Injektion
- Betäuben Sie das Tier in einer Anästhesie-Induktionskammer mit 5% Isofluran-Verteilung (siehe Materialtabelle). Überprüfen Sie den Grad der Anästhesie durch eine Zehenkneife.
- Nach ~40 s wird die Maus mit einer Gesichtsmaske in das Anästhesiesystem eingeführt und ein Anästhesieniveau von 2% Isofluran aufrechterhalten.
- Anschließend wird das Tier bei einer Raumtemperatur von 28 °C auf eine Heizplattform (siehe Materialtabelle) gestellt. Halten Sie die Augen mit künstlichen Tränen befeuchtet.
- Vor der Injektion werden plazentarare sEVs (200 μg Gesamtprotein) mit Phosphatpuffer (pH, 7,4) verdünnt, bis ein Endvolumen von 70 μl erreicht ist.
- Desinfizieren Sie den Injektionsbereich mit 70% Ethanol und Wattestäbchen. Stellen Sie sicher, dass Sie eine Insulinspritze mit einer 30-G-Nadel verwenden, um die sEVs-Lösung zu injizieren.
HINWEIS: Die Spritze kann 5 Minuten lang auf der Heizplattform positioniert werden, um eine physiologische Temperatur zu erreichen. - Injizieren Sie dann die Lösung in die Vena jugularis externa. Dieser Schritt erfordert ein spezielles Training.
HINWEIS: Das Verfahren muss vorsichtig durchgeführt werden, indem die Nadel langsam zurückgezogen und vorsichtig abgesaugt wird, um Anzeichen von Blutreflux zu erkennen. - Üben Sie nach der Injektion ~15 s lang mit einem trockenen Wattestäbchen leichten Druck auf die injizierte Stelle aus. Danach bringen Sie die Tiere in ihre jeweiligen Käfige zurück.
- Stellen Sie sicher, dass Sie Bewusstsein und Verhalten 15 Minuten lang bewerten. Ein Indikator für das Erreichen des Bewusstseins ist die Wiederherstellung der gesamten motorischen Aktivität des Tieres.
HINWEIS: Stellen Sie sicher, dass die Temperatur in den Käfigen der Tiere warm gehalten wird.
4. Schnelles murines Koma und Verhaltensskala (RMCBS)
- Verwenden Sie das RMCBS, um die neurologischen Parameter und die Parameter des Wohlbefindens der Tierezu bewerten 40.
HINWEIS: RMCBS ermöglicht eine schnelle Auswertung (~ 3 min) mit minimalem Tierstress durch Bedienereingriffe. RMCBS hat zehn Parameter (jeder Wert ist 0-2). - Bewerten Sie das Wohlbefinden der Maus mit der RMCBS-Skala bei 0 h (vor der Injektion von sEVs) und 3 h, 6 h, 12 h und 24 h nach der Injektion.
HINWEIS: Führen Sie eine Analyse von Claudin-5 (6 Stunden nach der Injektion von sEVs) und der blauen Extravasation von Evan (24 Stunden nach der Injektion von sEVs) durch, um die Störung der BHS zu bewerten (Abbildung 2).
5. Analyse von Evans blauer Extravasation
- Nach der Injektion von plazentaren sEVs (24 h) werden die Mäuse wie in Schritt 3.1 beschrieben anästhesiert.
- Bereiten Sie Evan's Blue-Lösung (2 %, 1x in Phosphatpufferlösung verdünnt) vor (siehe Materialtabelle).
- Injizieren Sie mit retroorbitalem Zugang25 Evans blaue Lösung in einer Konzentration von 2 ml/kg.
- Lassen Sie Evans blaue Lösung 20 Minuten lang unter Narkose zirkulieren.
- Als nächstes führen Sie eine intrakardiale Perfusion gemäß dem zuvor beschriebenen Protokoll41 mit Kochsalzlösung (~3 ml, 0,9 %, w/v) durch, um Evans blauen Farbstoff aus dem Kreislauf zu entfernen. Dieser Schritt ist obligatorisch.
HINWEIS: Erhöhen Sie für dieses Verfahren die Anästhesie auf 5 % und überprüfen Sie eine tiefe Anästhesieebene (d. h. eine drastische Verringerung der Atemfrequenz). - Freilegen des Herzens mittels medialer Thorakotomie41 (Abbildung 3).
- Danach wird das ganze Tier mit einer intrakardialen Infusion von Paraformaldehydlösung (4% in PBS, v/v) fixiert.
HINWEIS: Überprüfen Sie die Steifigkeit des Schwanzes, um die richtige Fixierung zu überwachen. - Sobald die Fixierung abgeschlossen ist, wird das Gehirn vorsichtig entnommen, gewogen und fotografiert41. Machen Sie Fotos mit dem gesamten Gehirn in der Nähe eines Lineals42.
- Als nächstes legst du das Gehirn in einen Gehirn-Maus-Slicer (siehe Materialtabelle).
- Das Gehirn wird in neun Abschnitte unterteilt, kranich-kaudal, einschließlich des Kleinhirns (100 μm pro Abschnitt).
- Nach der Präparation werden die Hirnschnitte in einem Stereo-Zoom-Mikroskop visualisiert und aufgenommen (siehe Materialtabelle).
- Verwenden Sie die aufgenommenen Bilder, um Evans blaue Extravasation mit der ImageJ-Software zu quantifizieren (siehe Materialtabelle).
HINWEIS: Um das Vorhandensein von Evans blauem Farbstoff zu analysieren, stellen Sie Evans blaue Werte mit einer Positivkontrolle des Gehirnschnitts ein (von einem tierischen Kontrolltier, dem Farbstoff injiziert wurde, aber ohne intrakardiale Perfusion). Evans Blauwerte, die aus der Positivkontrolle erreicht werden, liegen im Intensitätshistogramm des blauen Kanals im Allgemeinen zwischen 75 und 110 (Abbildung 4). - Stellen Sie sicher, dass Gehirnbilder von der jeweiligen Versuchsgruppe blind analysiert werden, um eine Verzerrung des Beobachters zu vermeiden. Alternativ können Sie Evans blaue Extravasation durch Homogenisierung des Gehirns mit anschließender Spektroskopiequantifizieren 43.
HINWEIS: In separaten Experimenten mit frisch isolierten Gehirnen von sEVs-injizierten Mäusen (6 h) werden die Proteinspiegel von Claudin 5 (CLND-5) analysiert (siehe Materialtabelle), einer kritischen Tight Junction, die an der Dichtheit der BHS44 beteiligt ist (Abbildung 5).
Ergebnisse
Dieses Protokoll bewertet die Fähigkeit von sEVs, die aus Plazenten gewonnen werden, die in Hypoxie kultiviert wurden, die BHS bei nicht schwangeren Mäusen zu stören. Diese Methode ermöglicht es, die mögliche Verbindung zwischen der Plazenta und dem Gehirn unter normalen und pathologischen Bedingungen besser zu verstehen. Insbesondere kann diese Methode einen Proxy für die Analyse der Beteiligung von plazentaren sEVs am Auftreten von zerebralen Komplikationen bei Präeklampsie darstellen.
Im Gegensatz zu Mäusen, denen sEVs-Nor injiziert wurde, zeigen Mäuse, denen sEVs-Hyp injiziert wurde, eine fortschreitende Abnahme des neurologischen Scores bis 24 Stunden (Tabelle 1), was auf die Fähigkeit von sEVs-Hyp hindeutet, die Gehirnfunktion zu beeinträchtigen.
Außerdem haben Mäusegehirne der sEVs-Hyp-injizierten Gruppe ein höheres Frischgewicht als diejenigen, die von Mäusen isoliert wurden, denen sEVs-Nor injiziert wurde, oder Kontrollmäusen (0,51 ± 0,008; 0,46 ± 0,008; 0,47 ± 0,01 g), was einen groben Indikator für ein Hirnödem darstellen kann45.
Dieses Protokoll ist mit diesem Befund kompatibel und ermöglicht es, Evans blaue Extravasation als Indikator für eine Störung der BHS zu identifizieren. In dieser Hinsicht weisen Gehirne von Mäusen, denen sEVs-Hyp injiziert wurde, eine höhere Evan-Blau-Extravasation auf als Gehirne aus der sEVs-Nor-Gruppe (Abbildung 5A).
Obwohl der zugrundeliegende Mechanismus der Störung der durch sEVs-Hyp induzierten BHS mit diesem Protokoll nicht analysiert wurde, deuten die Ergebnisse auch darauf hin, dass mit sEVs-Hyp injizierte Mäuse reduzierte Proteinmengen von CLND-5 in den Bereichen aufwiesen, in denen die BHS am stärksten betroffen war (d. h. in den hinteren Bereichen) (Abbildung 5B). Daher ist es möglich, dass sEVs-hyp die Expression der Funktion dieses kritischen endothelialen Tight-Junction-Proteins beeinträchtigt.
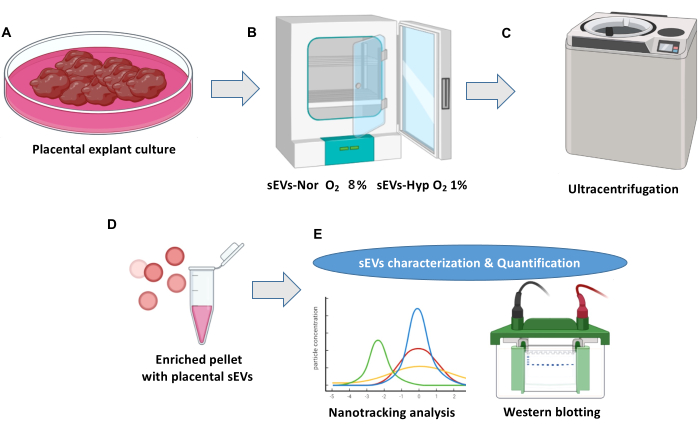
Abbildung 1: Plazenta-Explantatkultur und extrazelluläres Vesikel-Isolierungsprotokoll. (A) Normale Plazenta-Explantatkulturen. (B) Explantate sind in zwei Bedingungen für die Biogenese von plazentaren kleinen extrazellulären Vesikeln (sEVs) verteilt. Normoxie (sEVs-Nor, 8% O2) oder Hypoxie (sEVs-Hyp, 1% O2) für 18 Stunden. (C) Konditionierte Medien werden geerntet, gefiltert und zentrifugiert, um Zelltrümmer zu eliminieren. (D) sEVs werden durch Ultrazentrifugationen isoliert. (E) sEVs werden mittels Nano-Tracking-Analyse und Western Blot charakterisiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: In-vivo-Bewertung des Protokolls zur Störung der Blut-Hirn-Schranke. Es werden nicht trächtige C57BL6/J-Mäuse im Alter von 4-6 Monaten verwendet. (A) Über die Vena jugularis externa erhielten die Tiere sEVs (200 μg Gesamtprotein), die aus normoxischen (sEVs-Nor, 8% O2) oder hypoxischen (sEVs-Hyp, 1% O2) Plazentakulturen isoliert wurden. RMCBS wird 0-24 h nach der Injektion überwacht. (B) 6 Stunden nach der Injektion von sEVs werden die Gehirne extrahiert und für die Proteinextraktion in neun Segmente geschnitten. Claudin 5 (CLDN5) wird in Homogenaten dieser neun Abschnitte analysiert. (C) Evans blaue Extravasationsanalyse (24 Stunden nach der Injektion von sEVs) wurde nach retroorbitaler Punktionsinjektion in jedem der neun Segmente analysiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
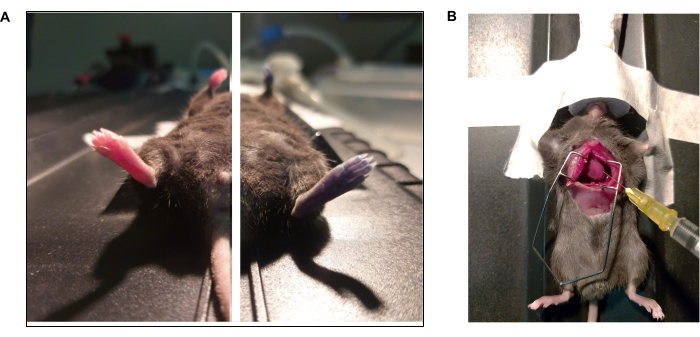
Abbildung 3: Fotodokumentationen von Evans blauem Farbstoff und intrakardialem Perfusionsprotokoll. (A) Die Maus erhielt Evans Blau durch retroorbitale Injektion. (Links) Tier vor und (rechts) nach der Injektion (15 s) von Evans Blau. (B) Thorakotomie zur Durchführung einer intrakardialen Perfusion von Phosphatpufferlösung (1x PBS) und Paraformaldehyd (4% PFA). Die linke Herzkammer wird mit der Nadelspitze spitz zugespitzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Analyse von Evans blauer Extravasation nach Injektion von sEVs. (A) Repräsentatives Bild des gesamten Gehirns, das Evans blaue Extravasation zeigt. Die gestrichelte Linie stellt neun Abschnitte dar, die aus dem gesamten Gehirn entnommen wurden. (B) Das Gehirn wurde mit einem Gehirn-Mäuse-Slicer seziert. (C) Repräsentative Bilder von Hirnschnitten 24 Stunden nach der Injektion von sEVs. Kontrolle (CTL), Plazenta unter normoxischen (sEVs-Nor) oder hypoxischen Bedingungen (sEVs-Hyp). Maßstabsbalken = 0,4 cm. (D) Digitale Gliederung des Gehirnschnitts mit ImageJ. (E) Histogramm im blauen Kanal. Werte zwischen 75 und 110 sind mit Evans blauer Extravasation assoziiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Evans blaue Extravasation und Claudin-5-Spiegel bei Mäusen, denen sEVs injiziert wurden, die aus Plazenta-Explantaten isoliert wurden. (A) Prozentualer Anteil der Evan'schen blauen (EB) Extravasation unter Berücksichtigung der gesamten Hirnabschnitte. Kontrolle (CTL, blau), Plazenta unter normoxischen (sEVs-Nor, rot) oder hypoxischen Bedingungen (sEVs-Hyp, grün). (B) Die relativen Konzentrationen von Claudin 5 (CLDN5) in den neun Hirnschnitten wurden aus den drei Versuchsgruppen ermittelt. β-Aktin wird als Beladungskontrolle verwendet. Die Werte sind Mittelwerte ± Interquartilsabstand. Jeder Punkt steht für ein individuelles Versuchsobjekt. *p < 0,05, **p < 0,005. p < 0,0001. p < 0,001; ANOVA-Test, gefolgt von Bonferroni-Posttest. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Zeit (h) | Steuerung | sEVs-Normoxie | sEVs-Hypoxie | ANOVA |
| 0 | 18,75 ± 0,250 | 18,5 ± 0,288 | 18,75 ± 0,250 | Ns |
| 3 | 18,5 ± 0,866 | 17 ± 0,707 | 13.25 ± 1.750*α | 0.006 |
| 6 | 19,25 ± 0,750 | 17 ± 0,577 | 11.75 ± 1.250*α | 0.002 |
| 12 | 18,5 ± 0,645 | 16,75 ± 1,109 | 13 ± 0.816*α | 0.001 |
| 24 | 19,5 ± 0,288 | 17,75 ± 0,250 | 10.25 ± 0.853*α | <0,0001 |
| *p < 0,01 im Vergleich zur Kontrolle. αp < 0,01 versus sEVs-Normoxie | ||||
Tabelle 1: Schnelles murines Koma und Verhaltensskala (RMCBS) nach 24 Stunden nach Injektion von sEVs. Der Score wird als Mittelwert ± SEM ausgedrückt. Die Werte der Tiere, die 20 am nächsten kommen, sind Standardwerte, während die Dysfunktion des ZNS umso höher ist, je niedriger der Wert ist.
Diskussion
Diese Studie enthüllt neue Erkenntnisse über mögliche Schäden, die sich aus Plazenta-Explantaten isolieren, die unter hypoxischen Bedingungen kultiviert wurden, auf die Störung der Blut-Hirn-Schranke von Nagetieren ergeben. Der pathologische Mechanismus beinhaltet eine Reduktion von CLND-5 in der hinteren Hirnregion25.
Frühere Untersuchungen haben gezeigt, dass Plasma-sEVs von Personen mit Präeklampsie eine endotheliale Dysfunktion in verschiedenen Organen unter Verwendung von In-vitro-Modellen induzieren46,47. Diese Untersuchung untersuchte insbesondere die Blut-Hirn-Schranke und bot eine neue Perspektive auf sEVs, die aus hypoxiekultivierter Plazenta isoliert wurden und diese lebenswichtige Barriere durchbrechen. Diese Entdeckungen eröffnen einen neuen Forschungsbereich, in dem sEVs sowohl in normalen als auch in pathologischen Szenarien, wie z. B. Präeklampsie, als Kommunikationskanal zwischen der Plazenta und dem Gehirn dienen können.
Das vorgestellte Protokoll ist einfach, aber mehrere kritische Schritte verdienen Erwähnung. Dieses Protokoll erfordert eine frische Plazenta innerhalb von 1 Stunde nach der Entbindung. Wir raten auch davon ab, die Kulturzeit über 24 Stunden hinaus zu verlängern, um einen Gewebeabbau zu verhindern. Dieses Protokoll mindert die potenzielle Kontamination durch sEVs, die von der Plazenta der Maus produziert werden. Die digitale Analyse von Evans blauer Extravasation ist zeitintensiv. Außerdem ist Evans Blaufärbung nach dem Hirnschnitt weniger auffällig. Daher wird eine anfängliche Einrichtung zur Identifizierung des blauen Bereichs mit Hilfe einer Positivkontrolle empfohlen. Eine Negativkontrolle, z. B. ein Gehirn einer Maus, die nicht Evans blaue Injektion erhalten hatte, kann ebenfalls verwendet werden. Die blinde Analyse von Versuchsgruppen ist zwingend erforderlich, um eine mögliche Verzerrung des Beobachters zu vermeiden.
Während dieses Protokolls können mehrere Herausforderungen auftreten. Eine wesentliche Einschränkung liegt in der biologischen Variabilität, die sowohl von menschlichen Plazenten als auch von injizierten Mäusen ausgeht. Um die Reproduzierbarkeit von Evans blauen Extravasationsexperimenten zu gewährleisten, wird vorgeschlagen, sEV-Dosen zu bestimmen, die aus menschlichen Plazenten isoliert wurden. Wir haben uns für eine Dosis von 200 μg Gesamtprotein entschieden; Diese Menge kann jedoch aufgrund der Reinheit der Vesikel, der Wirksamkeit der Jugularinjektion, der Verabreichung von Evans Blau, ihrer Entfernung aus dem Kreislaufsystem und nicht zuletzt der biologischen Auswirkungen von sEVs unter Berücksichtigung ihres Inhalts schwanken.
Die zellulären Mechanismen, durch die sEVs aus der menschlichen Plazenta die Blut-Hirn-Schranke stören können, erfordern zusätzliche Experimente. Nichtsdestotrotz ist diese Methode relevant, da sie auf eine mögliche Kommunikation zwischen der Plazenta und dem Gehirn hinweist, die weitere Untersuchungen rechtfertigt. Daher werden zukünftige Untersuchungen gefördert, die sich auf sEVs und ihre Wechselwirkungen mit der Blut-Hirn-Schranke sowie die Auswirkungen ihrer Fracht auf neuronale Gewebe konzentrieren. Ob eine Beeinträchtigung der Blut-Hirn-Schranke zu dauerhaften Folgen für das mütterliche Gehirn führt, muss weiter untersucht werden.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt zu erklären.
Danksagungen
Die Autoren danken den Forscherinnen und Forschern von GRIVAS Health für ihren wertvollen Input. Auch Hebammen und klinisches Personal des Geburtshilfe- und Gynäkologiedienstes gehören zum Hospital de Chillan, Chile. Gegründet von Fondecyt Regular 1200250.
Materialien
| Name | Company | Catalog Number | Comments |
| Adult mice brain slecer matrice 3D printed | Open access file | Adult mice | Adult mice brain slicer. Printed in PLA filament. |
| Anti β-Actin primary antibody | Sigma-Aldrich | Clon AC-74 | Antibody for loading control (Western blot) |
| Anti-Claudin5 primary antibody | Santa cruz Biotechnology | sc-374221 | Primary antibody for tight junction protein CLDN5 of mice BBB (Western blot) |
| BCA protein kit | Thermo Scientific | 23225 | Kit for measuring protein concentration |
| Culture media #200 500 mL | Thermo Fisher Scientific | m200500 | Culture media for placental explants |
| D180 CO2 incubator | RWD Life science | D180 | Standard incubator to estabilize explants and culture sEVs-Nor |
| Evans blue dye > 75% 10 g | Sigma-Aldrich | E2129.10G | Dye to analize blood brain barrier disruption IN VIVO |
| Fetal bovine serum 500 mL | Thermo Fisher Scientific | 16000044 | Additive growth factor for culture media 200 |
| Himac Ultracentrifuge CP100NX | Himac eppendorf group | 5720410101 | Ultracentrifuge for condicioned media > 1,20,000 x g |
| ImageJ software | NIH | https://imagej.nih.gov/ij/download.html | |
| Isoflurane x 100 mL | USP Baxter | 212-094 | Volatile inhalated anaesthesia agent for mice |
| Kit CellTiter 96 Non-radioactive | Promega | 0000105232 | In vitro assay for placental explants viability |
| Mouse IgG Secondary antibody | Thermo Fisher Scientific | MO 63103 | Secondary antibody for CLDN5 (western blot) |
| NanoSight NS300 | Malvern Panalytical | 90278090 | Nanotracking analysis of particles from placental explants condicioned media |
| Paraformaldehide E 97% solution 500 mL | Thermo Fisher Scientific | A11313.22 | Fixative solution for brain tissue slices and intracardial perfusion (once diluted) |
| PBS 1 X pH 7.4 500 mL | Thermo Fisher Scientific | 10010023 | Wash solution for placenta explants |
| Peniciline-streptomicine 100x 20 mL | Thermo Fisher Scientific | 10378016 | Antiobiotics for placental explants culture media |
| ProOX C21 Cytocentric O2 and CO2 Subchamber Controller | BioSpherix | SCR_021131 | CO2 regulator to induce Hypoxia in sealed chamber for sEVs-Hyp |
| Sodium Thiopental 1 g | Chemie | 7061 | humanitarian euthanasia agent |
| Somnosuite low flow anesthesia system | Kent Scientifics | SS-01 | Isoflurane vaporizer for small rodents |
| Surgical Warming platform | Kent Scientifics | A41166 | Warming platform for mainteinance anesthesia in mice |
| Syringe Filters, Polytetrafluoroethylene (PTFE), Hydrophobic, 0.22 µm, Sterile, 25 mm | Southern labware | 10026 | Filtration of condicioned media harvested from placental explants |
| Tabletop High-Speed Micro Centrifuges HITACHI himac CT15E/CT15RE | Hitachi medical systems | 6020 | Serial centrifugations of condicioned media < 1,20, 000 x g |
| Trinocular stereomicroscope transmided and reflective light 10x-160x | Center Medical | 2597 | Stereomicroscope to register brain slices |
Referenzen
- Lisonkova, S., Joseph, K. S. Incidence of preeclampsia: risk factors and outcomes associated with early- versus late-onset disease. Am J Obstet Gynecol. 209 (544), 544.e1-544.e12 (2013).
- Sibai, B., Dekker, G., Kupferminc, M. Preeclampsia. Lancet. 365 (9461), 785-799 (2005).
- Hammer, E. S., Cipolla, M. J. Cerebrovascular dysfunction in preeclamptic pregnancies. Curr Hypertens Rep. 17 (8), 64 (2015).
- Okanloma, K. A., Moodley, J. Neurological complications associated with the preeclampsia/eclampsia syndrome. Int J Gynaecol Obstet. 71, 223-225 (2000).
- Frias, A. E., Belfort, M. A. Post magpie: how should we be managing severe preeclampsia. Curr Opin Gynecol Obstet. 15 (6), 489-495 (2003).
- Familari, M., Cronqvist, T., Masoumi, Z., Hansson, S. R. Placenta-derived extracellular vesicles: Their cargo and possible functions. Reprod Fertil Dev. 29 (3), 433-447 (2017).
- Montoro-Garcia, S., Shantsila, E., Marin, F., Blann, A., Lip, G. Y. Circulating microparticles: new insights into the biochemical basis of microparticle release and activity. Basic Res Cardiol. 106, 911-923 (2011).
- Germain, S. J., Sacks, G. P., Sooranna, S. R., Sargent, I. L., Redman, C. W. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles. J Immunol. 178 (9), 5949-5956 (2007).
- Tannetta, D., Masliukaite, I., Vatish, M., Redman, C., Sargent, I. Update of syncytiotrophoblast derived extracellular vesicles in normal pregnancy and preeclampsia. J Reprod Immunol. 119, 98-106 (2017).
- Collett, G. P., Redman, C. W., Sargent, I. L., Vatish, M. Endoplasmic reticulum stress stimulates the release of extracellular vesicles carrying danger-associated molecular pattern (DAMP) molecules. Oncotarget. 9 (6), 6707-6717 (2018).
- Cooke, W. R., et al. Maternal circulating syncytiotrophoblast-derived extracellular vesicles contain biologically active 5'-tRNA halves. Biochem Biophys Res Commun. 518 (1), 107-113 (2019).
- Gill, M., et al. Placental syncytiotrophoblast-derived extracellular vesicles carry active nep (neprilysin) and are increased in preeclampsia. Hypertension. 73 (5), 1112-1119 (2019).
- Kandzija, N., et al. Placental extracellular vesicles express active dipeptidyl peptidase IV; levels are increased in gestational diabetes mellitus. J Extracell Vesicles. 8 (1), 1617000 (2019).
- Motta-Mejia, C., et al. Placental vesicles carry active endothelial nitric oxide synthase and their activity is reduced in preeclampsia. Hypertension. 70 (2), 372-381 (2017).
- Sammar, M., et al. Reduced placental protein 13 (PP13) in placental derived syncytiotrophoblast extracellular vesicles in preeclampsia - A novel tool to study the impaired cargo transmission of the placenta to the maternal organs. Placenta. 66, 17-25 (2018).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Warrington, J. P., et al. Placental ischemia in pregnant rats impairs cerebral blood flow autoregulation and increases blood-brain barrier permeability. Physiological Reports. 2 (8), e12134-e12134 (2014).
- Warrington, J. P., Drummond, H. A., Granger, J. P., Ryan, M. J. Placental Ischemia-induced increases in brain water content and cerebrovascular permeability: Role of TNFα. Am J Physiol Regul Integr Comp Physiol. 309 (11), R1425-R1431 (2015).
- Johnson, A. C., et al. Magnesium sulfate treatment reverses seizure susceptibility and decreases neuroinflammation in a rat model of severe preeclampsia. PLoS ONE. 9 (11), e113670 (2014).
- Escudero, C. A., et al. Role of extracellular vesicles and microRNAs on dysfunctional angiogenesis during preeclamptic pregnancies. Front Physiol. 7, 1-17 (2016).
- Salomon, C., et al. Placental exosomes as early biomarker of preeclampsia: Potential role of exosomalmicrornas across gestation. J Clin Endocrinol Metab. 102 (9), 3182-3194 (2017).
- Knight, M., Redman, C. W., Linton, E. A., Sargent, I. L. Shedding of syncytiotrophoblast microvilli into the maternal circulation in pre-eclamptic pregnancies. Br J Obstet Gynaecol. 105 (6), 632-640 (1998).
- Gilani, S. I., Weissgerber, T. L., Garovic, V. D., Jayachandran, M. Preeclampsia and extracellular vesicles. Curr Hypertens Rep. 18 (9), 68 (2016).
- Dutta, S., et al. Hypoxia-induced small extracellular vesicle proteins regulate proinflammatory cytokines and systemic blood pressure in pregnant rats. Clin Sci (Lond). 134 (6), 593-607 (2020).
- Leon, J., et al. Disruption of the blood-brain barrier by extracellular vesicles from preeclampsia plasma and hypoxic placentae: attenuation by magnesium sulfate. Hypertension. 78 (5), 1423-1433 (2021).
- Han, C., et al. Placenta-derived extracellular vesicles induce preeclampsia in mouse models. Haematologica. 105 (6), 1686-1694 (2020).
- Amburgey, O. A., Chapman, A. C., May, V., Bernstein, I. M., Cipolla, M. J. Plasma from preeclamptic women increases blood-brain barrier permeability: role of vascular endothelial growth factor signaling. Hypertension. 56 (5), 1003-1008 (2010).
- Cipolla, M. J., et al. Pregnant serum induces neuroinflammation and seizure activity via TNFalpha. Exp Neurol. 234 (2), 398-404 (2012).
- Bergman, L., et al. Preeclampsia and increased permeability over the blood brain barrier - a role of vascular endothelial growth receptor 2. Am J Hypertens. 34 (1), 73-81 (2021).
- Torres-Vergara, P., et al. Dysregulation of vascular endothelial growth factor receptor 2 phosphorylation is associated with disruption of the blood-brain barrier and brain endothelial cell apoptosis induced by plasma from women with preeclampsia. Biochim Biophys Acta Mol Basis Dis. 1868 (9), 166451 (2022).
- Schreurs, M. P., Houston, E. M., May, V., Cipolla, M. J. The adaptation of the blood-brain barrier to vascular endothelial growth factor and placental growth factor during pregnancy. FASEB J. 26 (1), 355-362 (2012).
- Schreurs, M. P., Cipolla, M. J. Cerebrovascular dysfunction and blood-brain barrier permeability induced by oxidized LDL are prevented by apocynin and magnesium sulfate in female rats. J Cardiovasc Pharmacol. 63 (1), 33-39 (2014).
- Schreurs, M. P. H., et al. Increased oxidized low-density lipoprotein causes blood-brain barrier disruption in early-onset preeclampsia through LOX-1. FASEB J. 27 (3), 1254-1263 (2013).
- Escudero, C., et al. Brain vascular dysfunction in mothers and their children exposed to preeclampsia. Hypertension. 80 (2), 242-256 (2023).
- Russell, W. M. S., Burch, R. L. The principles of humane experimental technique. Universities Federation of Animal Welfare. , (1959).
- Miller, R. K., et al. Human placental explants in culture: approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Troncoso, F. A. J., Herlitz, K., Ruiz, F., Bertoglia, P., Escudero, C. Elevated pro-angiogenic phenotype in feto-placental tissue from gestational diabetes mellitus. Placenta. 36 (4), 2 (2015).
- Zhang, H. C., et al. Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo. Stem Cells Dev. 21 (18), 3289-3297 (2012).
- Thery, C., Amigorena, S., Raposo, G., Clayton, A. Isolation and characterization of exosomes from cell culture supernatants and biological fluids. Curr Protoc Cell Biol. Chapter 3 (Unit 3), 22 (2006).
- Carroll, R. W., et al. A rapid murine coma and behavior scale for quantitative assessment of murine cerebral malaria. PLoS One. 5 (10), e13124 (2010).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio Protoc. 11 (5), e3988 (2021).
- Walchli, T., et al. Quantitative assessment of angiogenesis, perfused blood vessels and endothelial tip cells in the postnatal mouse brain. Nat Protoc. 10 (1), 53-74 (2015).
- Wang, H. L., Lai, T. W. Optimization of Evans blue quantitation in limited rat tissue samples. Sci Rep. 4, 6588 (2014).
- Morita, K., Sasaki, H., Furuse, M., Tsukita, S. Endothelial claudin: claudin-5/TMVCF constitutes tight junction strands in endothelial cells. J Cell Biol. 147 (1), 185-194 (1999).
- Lara, E., et al. Abnormal cerebral microvascular perfusion and reactivity in female offspring of reduced uterine perfusion pressure (RUPP) mice model. J Cereb Blood Flow Metab. 42 (12), 2318-2332 (2022).
- Chang, X., et al. Exosomes from women with preeclampsia induced vascular dysfunction by delivering sflt (soluble fms-like tyrosine kinase)-1 and seng (soluble endoglin) to endothelial cells. Hypertension. 72, 1381-1390 (2018).
- Smarason, A. K., Sargent, I. L., Starkey, P. M., Redman, C. W. The effect of placental syncytiotrophoblast microvillous membranes from normal and pre-eclamptic women on the growth of endothelial cells in vitro. BJOG. 100 (10), 943-949 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten