Method Article
Kimeraları Hedefleyen Proteoliz Tarafından İndüklenen Üçlü Kompleks Oluşumunun Değerlendirilmesi için Biyofiziksel Testlerin Geliştirilmesi ve Uygulanması (PROTACS)
Bu Makalede
Özet
Burada, ubikitin ligazları Von Hippel-Lindau E3 ligaz (VHL) ve Cereblon (CRBN) içeren kimeraları (PROTACS) hedefleyen proteoliz tarafından indüklenen üçlü kompleks oluşumunun biyofiziksel karakterizasyonu için protokolleri açıklıyoruz. Burada gösterilen biyofiziksel yöntemler arasında yüzey plazmon rezonansı (SPR), biyokatman interferometrisi (BLI) ve izotermal titrasyon kalorimetrisi (ITC) bulunur.
Özet
Bozunma için hedeflenen E3 ligazları ve proteinleri, çok aşamalı bir işlemde heterobifonksiyonel moleküller tarafından kompleksler oluşturmak üzere indüklenebilir. İlgili etkileşimlerin kinetiği ve termodinamiği, ubikitinasyonun verimliliğine ve bunun sonucunda proteinin bozulmasına katkıda bulunur. Yüzey plazmon rezonansı (SPR), biyokatman interferometrisi (BLI) ve izotermal titrasyon kalorimetrisi (ITC) gibi biyofiziksel teknikler, bu etkileşimlerin optimizasyonunda kullanılabilecek değerli bilgiler sağlar. İki model sistemi kullanılarak, üçlü kompleks oluşumunun işbirliğine dayalılığını ve 'kanca etkisinin' bağlanma kinetiği üzerindeki etkisini anlamak için bir biyofiziksel tahlil araç kiti oluşturulmuştur. Bir vakada, Brd4BD2 ve VHL arasında üçlü kompleks oluşumunu indükleyen kimera (PROTAC) molekülünü hedefleyen bir proteoliz değerlendirildi. Heterobifonksiyonel molekül olan MZ1, hem Brd4BD2 proteini (SPR K D = 1 nM, ITC K D = 4 nM) hem de VHL kompleksi (SPR K D = 29 nM, ITC K D = 66 nM) için nM afinitelerine sahiptir. Bu sistem için, üçlü kompleks oluşumunun işbirliğine elverişliliğini gösteren yayınlanmış sonuçları yeniden üreten sağlam SPR, BLI ve ITC tahlilleri geliştirilmiştir. Diğer durumda, 46.0 kDa'lık bir protein, PPM1D ve sereblon [CRBN (319-442)] arasında üçlü kompleksleri indükleyen bir molekül incelenmiştir. Heterobifonksiyonel molekül, BRD-5110, PPM1D için bir SPRKD = 1 nM'ye sahiptir, ancak kesilmiş CRBN (319-442) kompleksine (SPR KD = ~ 3 μM) karşı çok daha zayıf bağlanmaya sahiptir. Bu durumda, SPR'de CRBN için bağlanma doygun değildi ve bu da bir "kanca etkisi" ile sonuçlandı. SPR, BLI ve ITC için verim ve reaktif gereksinimleri değerlendirildi ve bunların PROTAC projelerine uygulanması için genel öneriler sağlandı.
Giriş
Hücredeki proteinlerin poliubikitinasyonu, Ubiquitin Ligas ailesi 1,2'deki enzimleri içeren sıkı bir şekilde düzenlenmiş bir süreçtir. Yoldaki terminal enzimler, ubikuitin moleküllerini protein bağlayıcı ortaklarınakovalent olarak bağlayan E3 ubikuitin ligazlarıdır 3. Bu protein bağlayıcı ortakların poliubikitinasyonu, onları proteazom4 tarafından proteolitik bozunma için hedefler. Bu sistem, hastalık5'te yer alan proteinlerin bozulmasını indüklemek için terapötik olarak kullanılan protein homeostazı sürecinin bir parçasıdır. Von Hippel-Lindau E3 ligaz (VHL) veya sereblon (CRBN) gibi E3 ubikitin ligazları arasındaki etkileşimi indükleyen küçük moleküller, tipik olarak, bozunma için hedeflenen proteine bağlanan bir savaş başlığına esnek bir bağlayıcı ile bağlanan bir E3 ligaz bağlayıcı savaş başlığından oluşur. Bu heterobifonksiyonel moleküller genellikle kimeraları veya PROTACS6'yı hedefleyen proteoliz olarak adlandırılır.
PROTACS'ın geliştirilmesi, moleküllerin hücrelerdeki proteinlerin bozulmasını indükleme yeteneğinin değerlendirilmesini içerir. Hücrelerin bir PROTAC molekülü ile muamelesi üzerine hedef protein ile VHL veya CRBN gibi E3 ligaz bileşenleri arasındaki indüklenmiş etkileşimi izleyen birçok hücresel tahlil sistemi geliştirilmiştir. Böyle bir hücresel tahlil olan nanoluc-Halotag sistemi7, Halotag alıcısına kaynaşmış bir E3 ligaz ve bir nanoluc donörü ile etiketlenmiş bir hedef protein içerir. Üçlü kompleks oluşumu, nanoluc donörü ve Halotag alıcısını yakınlaştırır ve donörden alıcıya enerji transferine izin vererek ışığın yayılmasına neden olur. Bu sistemin varyasyonları, PROTACS moleküllerinin8 hücresel geçirgenliğini veya hedef protein ubikitinasyonunun9 nispi seviyesindeki değişiklikleri değerlendirmek için kullanılabilir. Bu hücresel sistemler PROTACS'ın optimizasyonunu sağlamak için gerekli olsa da, E3 ligazları ve bozunması hedeflenen proteinler arasında komplekslerin oluşumu çok aşamalı bir süreçtir10,11. İlgili ikili ve üçlü etkileşimlerin kinetiği ve termodinamiği, verimliliğin her yerde bulunmasına ve bunun sonucunda proteininparçalanmasına katkıda bulunur 12,13,14.
Burada, yüzey plazmon rezonansı (SPR), biyotabaka interferometrisi (BLI) ve izotermal titrasyon kalorimetrisi (ITC) kullanılarak PROTACS tarafından indüklenen üçlü kompleks oluşumunun biyofiziksel karakterizasyonu için uyarlanabilen protokoller açıklanmaktadır. Literatür raporlarından türetilen Brd4BD2 ve VHL arasında üçlü kompleks oluşumunu indükleyen MZ1 PROTAC molekülü için SPR ve ITC protokolleri13,15 ve burada açıklanan, rapor edilen prosedürlerin bazı modifikasyonları ile rapor edilen sonuçları özetleyebilmiştir. MZI, Brd4BD2 ve VHL arasındaki üçlü kompleks oluşumunu değerlendirmek için kullanılan bir BLI testinin açıklaması bu rapora dahil edilmiştir. BLI'dan alınan afinite ölçümleri, SPR ve ITC'de gözlemlenenlerle tutarlıydı. Ekspresyonu p53'e bağımlı bir şekilde indüklenen bir Ser/Thr protein fosfatazolan PPM1D ile CRBN arasında PROTAC kaynaklı üçlü kompleks oluşumunu değerlendirmek için bir SPR testinin geliştirildiği daha önce yayınlanmış bir protokol de açıklanmaktadır. Bu durumda, PROTAC molekülü PPM1D için nanomolar bir afiniteye sahiptir, ancak CRBN için sadece bir mikromolar afiniteye sahiptir. Bu durumda, PROTAC molekülünün CRBN'ye bağlanması doygun değildir, bu da yaygın olarak gözlenen "kanca etkisi" ile sonuçlanır. Kanca etkisi, her ikisi de bir köprüleme molekülüne bağlandığında heterotrimerik bir kompleks oluşturabilen iki türün bulunduğu üç vücut sisteminin bir özelliğidir (Şekil 1)17. Kanca etkisi, köprüleme türleri diğer iki türe göre aşırı konsantrasyonda olduğunda gözlenir. Ortaya çıkan durum, ikili etkileşimlerin üçlü etkileşimleri geride bıraktığı bir durumdur. Kanca etkisinin gözlemlendiği sistemler, bu raporda tartışılan belirli deneysel tasarım hususlarını gerektirir. PROTAC kaynaklı üçlü kompleks oluşumunun değerlendirilmesi için biyofiziksel testlerin kullanımını değerlendirmek için genel kavramlar ve reaktif gereksinimleri sağlanmıştır.
Protokol
Tüm proteinler, literatür protokolleri18'e uygun olarak iyi verim ve saflıkta (% >80) E.coli'de aşırı eksprese edildi. Biyotinilasyon, BirA katalizli bir reaksiyon18 kullanılarak gerçekleştirildi. Tüm küçük moleküller %100 DMSO'da 1 mM stok çözeltilerde hazırlandı. Burada açıklanan prosedürler, özel laboratuvar güvenlik ekipmanı veya önlemleri gerektirmez. Standart laboratuvar kişisel koruyucu ekipmanı (KKD) kullanılmalıdır (örn. laboratuvar önlüğü, koruyucu gözlük ve eldiven).
Bu çalışmada uygulanan proteinler aşağıda listelenmiştir:
VHL: ElonginB'nin C-terminalinde Avi-etiketli biyotinillenmiş VHL (53-213) / ElonginB (1-104) / ElonginC (17-112) kompleksi.
Brd4BD2: Etiketsiz Brd4BD2(333-460)
CRBN: N terminalinde Avi etiketli biyotinillenmiş CRBN (319-442)
PPM1D: N terminalinde etiketsiz veya çift His8 etiketli PPM1D(1-420)
Bu çalışmada uygulanan küçük moleküller aşağıda listelenmiştir:
MZ1 (MW = 1002.6 Da): VHL ve Brd4BD2'ye bağlanan PROTAC
BRD-2512 (MW = 841.4 Da): CRBNKD ~ 3 μM, PPM1D'ye bağlanmaz
BRD-5110 (MW = 872.0 Da): CRBN KD ~3 μM, PPM1DKD = 1-2 nM
BRD-4761 (MW = 476.6 Da): CRBN, PPM1DKD = 1-2 nM'ye bağlanmaz
1. Yöntem 1: ITC (izotermal titrasyon kalorimetrisi)
NOT: Titrasyonlar, otomatik enjeksiyonlu bir mikro kalorimetre kullanılarak gerçekleştirilir.
- Tampon hazırlama: 20 mM HEPES, 150 mM NaCl, 1 mM TCEP, pH 7.5 içeren 3 L tampon hazırlayın.
- Diyaliz: VHL ve Brd4BD2'yi (her biri 150 μM'de ~ 500 μL) adım 1.1'de hazırlanan tamponun 1 L'sine karşı, 4 ° C'de 3 kez, sırasıyla 4 saat, 2 saat ve yaklaşık 16 saat boyunca diyaliz edin. Son diyalizden sonra tamponu sonraki adımlarda kullanmak üzere saklayın.
- Numuneleri plastik kapaklı 96 oyuklu bir plaka üzerinde hazırlayın.
- Her titrasyon için hücre için 400 μL çözelti, şırınga için 125 μL ve temizlik için 400 μL tampon hazırlayın. Numuneleri plakadaki ardışık üç oyuğa ekleyin. Bileşik stok% 100 DMSO'da 1 mM'de hazırlandığından, hücre ve şırıngada eşleşen tamponu sağlamak için protein çözeltilerine aynı oranda DMSO ekleyin. Nihai çözümlere %2 DMSO ekleyin.
- VHL'nin MZ1'e titrasyonu için örnek: 1 mM'de (10 μM nihai konsantrasyon) 392 μL tampon, 4 μL MZ1 ve 4 μL %100 DMSO içeren hücre çözeltisi hazırlayın. 85.7 μM'de 122.5 μL VHL, 2.5 μL% 100 DMSO (84 μM nihai konsantrasyon) içeren bir şırınga çözeltisi hazırlayın.
- VHL'nin tampona titrasyonu için numuneler (veriler, numune 1.3.1.1'den oluşturulan verilerin arka planda çıkarılması için kullanılacaktır): 392 μL tampon, 8 μL %100 DMSO içeren hücre çözeltisi hazırlayın. 85.7 μM'de (84 μM nihai konsantrasyon) 122.5 μL VHL içeren bir şırınga çözeltisi hazırlayın ve 2.5 μL% 100 DMSO ekleyin.
- VHL'nin MZ1 ve Brd4 BD2'ye titrasyonu için numuneler: 1 mM'de (8.4 μM nihai konsantrasyon) 392 μL 17.1 μM Brd4BD2 (16.8 μM nihai konsantrasyon), 3.36 μL MZ1 ve 4.64 μL %100 DMSO içeren hücre çözeltisi hazırlayın. 85.7 μM'de (84 μM nihai konsantrasyon) 122.5 μL VHL ve 2.5 μL% 100 DMSO içeren bir şırınga çözeltisi hazırlayın.
- VHL'nin Brd4 BD2'ye titrasyonu için numuneler (1.3.1.3'ün arka planı): 392 μL 17.1 μM Brd4BD2 (16.8 μM nihai konsantrasyon) ve 8 μL %100 DMSO içeren hücre çözeltisi hazırlayın. 85.7 μM'de (84 μM nihai konsantrasyon) 122.5 μL VHL ve 2.5 μL% 100 DMSO içeren bir şırınga çözeltisi hazırlayın.
- Her titrasyon için hücre için 400 μL çözelti, şırınga için 125 μL ve temizlik için 400 μL tampon hazırlayın. Numuneleri plakadaki ardışık üç oyuğa ekleyin. Bileşik stok% 100 DMSO'da 1 mM'de hazırlandığından, hücre ve şırıngada eşleşen tamponu sağlamak için protein çözeltilerine aynı oranda DMSO ekleyin. Nihai çözümlere %2 DMSO ekleyin.
- Mikro kalorimetrede dört titrasyonun tümünü çalıştırın. Her biri, 120 s zaman aralıklarında 2 μL/s hızında 19 μL 2 μL şırınga çözeltisi enjeksiyonundan oluşur. İlk protein enjeksiyonunu (0.4 μL) yapın ve veri analizi sırasında atın. Tüm deneyleri 25 °C'de, 600 rpm'de karıştırarak gerçekleştirin.
- Veri analizi: Üretici tarafından sağlanan analiz yazılımını kullanarak stokiyometriyi (n), ayrışma sabitini(KD) ve bağlanma entalpisini (ΔH) elde etmek için verileri tek bağlama bölgesi modeline sığdırın (Şekil 2).
2. Yöntem 2: BLI (biyotabaka interferometrisi)
- Streptavidin (SA) kaplı sensörleri kullanarak oda sıcaklığında (RT) 5 Hz alım hızıyla BLI deneyleri gerçekleştirin. Otomatik BLI deneyi sırasında, sensörlerin tek bir kolon içinde sabit olduğundan emin olun ve maksimum kuyu hacmi 392 μL olan 96 kuyulu, düz tabanlı, siyah bir plakanın farklı sütunları arasında hareket edin. Deneyde kullanılan plakanın her bir kuyucuğunu 200 μL çözelti ile doldurun.
NOT: BLI sadece protein-protein etkileşimlerini (yani üçlü kompleks oluşumunu) tespit etmek için yararlıdır. Proteinler ve küçük moleküller arasındaki etkileşimleri tespit edecek kadar hassas değildir.- Tampon hazırlama: 20 mM HEPES, 150 mM NaCl, 1 mM TCEP, %0.05 P20, pH 7.5 içeren 100 mL tampon hazırlayın.
- İmmobilizasyon adımı için optimizasyon: Test sensörünü üretici tarafından önerildiği gibi 1-3 nm'ye yükleyin. Burada açıklanan prosedürler için ~1.0 nm'lik bir yükleme kullanılır. Bunu başarmak için, sensörü 80 saniye boyunca 1,5 μg/mL'de VHL içeren bir çözeltiye daldırın.
- Aşağıdaki sırayı kullanarak yedi SA sensörü uygulayarak BLI kinetik ölçümleri gerçekleştirin:
- İlk temel aşama için, 60 saniye boyunca tampona daldırın.
- İmmobilizasyon aşaması için, 80 saniye boyunca 1.5 μg/mL'de bir VHL çözeltisine daldırın.
- İkinci temel aşama için, 60 s boyunca tampona daldırın.
- Birleşme aşaması için, 2 μM'de sabit bir Brd4BD2 konsantrasyonu, %2'de sabit DMSO konsantrasyonu ve 100 nM, 50 nM, 25 nM, 12.5 nM, 6.3 nM, 3.1 nM ve 0 nM'de değişen MZ1 konsantrasyonları (referans sensörü) 300 s için.
- Ayrışma aşaması için 600 s tampona daldırın.
- Üreticinin yazılımını kullanarak veri analizi gerçekleştirin. k açık, kkapalı ve KDveri uydurma için rapor edilir (Şekil 3).
3. Yöntem 3: SPR (yüzey plazmon rezonansı)
NOT: Tüm SPR deneyleri, RT'de streptavidin (SA) kaplı sensör çipleri kullanılarak gerçekleştirilmiştir. NTA çipi, protein ve küçük moleküller arasındaki tespit için kullanılsa da, muhtemelen yüklü çip yüzeyi ile analitteki protein arasındaki elektrostatik etkileşimler nedeniyle, SA çipinden çok daha yüksek bir arka plan gözlendiğinden, üçlü komplekse uygulandığında dikkatli kullanılmalıdır.
- VHL-MZ1 etkileşimi için SPR
- Tampon hazırlama.
- 20 mM HEPES, 150 mM NaCl, 1 mM TCEP, %0.005 P20, pH 7.5 içeren 1 L'lik bir tampon hazırlayın ve 0.2 μm'lik bir filtre ünitesinden geçirin.
- İleride kullanmak üzere 20 mL tamponu çıkarın (DMSO içermeyen tampon) ve 20 mL DMSO (son çalışan tamponda %2 DMSO) ile yeniden doldurun. Aşağıda açıklanan tüm örneklerde DMSO'yu %2'de tutun (adım 3.1 ve 3.2)
- Üreticinin protokolünü izleyerek SA çipini etkinleştirin ve VHL'yi ~2000 RU'ya sabitleyin (5 μL/dk'da 5 μg/mL protein çözeltisi enjekte edin).
- MZ1'i, maksimum 130 μL hacme sahip 384 oyuklu, konik tabanlı, yarı saydam, polipropilen bir plaka üzerinde üst konsantrasyonu 10 μM'de olacak şekilde 3 katlı, 8 noktalı seri seyreltmede hazırlayın. Plakayı polipropilen mikroplakalarla uyumlu kendinden yapışkanlı, şeffaf plastik folyolarla kaplayın.
- Son konsantrasyonda %2 DMSO'yu sağlamak için üst konsantrasyonu DMSO içermeyen tamponla hazırlayın. 147 μL DMSO içermeyen tampona, 1 mM'de 1,5 μL MZ1 stoğu ve 1,5 μL %100 DMSO ekleyin.
- %2 DMSO içeren çalışan tampon ile 3 katlı seri seyreltmeyi hazırlayın. 100 μL'lik çalışan tampona, adım 3.1.3.1'de hazırlanan en yüksek konsantrasyonda 50 μL çözelti ekleyin ve 2. en yüksek konsantrasyonu hazırlamak için iyice karıştırın.
- Daha sonra adım 3.1.3.2'de hazırlanan çözeltinin 50 μL'sini sonraki 100 μL'lik çalışan tampona aktarın, 3. en yüksek konsantrasyonu hazırlamak için iyice karıştırın vb.
- Çok döngülü kurulumu kullanarak SPR'yi çalıştırın: Mod: Yüksek performans; temas süresi: 120 sn; ayrışma süresi: 300 s; akış hızı: 50 μL/dak.
- Cihaz üreticisi tarafından sağlanan değerlendirme yazılımını kullanarak veri analizi gerçekleştirin. Kararlı durum analizi, KD = 26 (± 3) nM ve Rmax'ın ~%91 (± %5) bağlanma sağlandığını gösterdi (Şekil 4A)
- Tampon hazırlama.
- VHL için SPR: MZ1: Brd4BD2 üçlü kompleksi
- Arabelleği adım 3.1.1'de açıklandığı gibi hazırlayın.
- Üreticinin protokolünü izleyerek SA yongasını etkinleştirin ve VHL'yi ~100 RU'ya sabitleyin. ~100 RU yüzey yoğunluğuna ulaşılana kadar 5 μL/dak akış hızında ve 1-5 dakika arasında temas süresinde 0,5 μg/mL VHL'lik bir protein çözeltisi enjekte edin.
- Maksimum 323 μL hacme sahip 96 kuyulu, şeffaf, polistiren, yuvarlak tabanlı bir plakada iki adet 5 katlı, 5 noktalı tek döngülü enjeksiyon için numuneler hazırlayın ve 3.2.3.1-3.2.3.2 adımlarında açıklandığı gibi polistiren mikroplakalarla uyumlu kendinden yapışkanlı, şeffaf, plastik folyolarla kaplayın.
- Negatif kontrol: analit sadece Brd4BD2 içerir.
- 200 μL hacimli çalışma tamponunda 25 μM'de en yüksek konsantrasyonu hazırlayın (#A5)
- Soldaki sonraki 4 kuyucuğa çalışan tamponda 2 μM'de her biri 160 μL Brd4BD2 ekleyin (#A1-A4)
- 40 μL A5'i A4'e aktarın. İyice karıştırın.
- 40 μL A4'ü A3'e aktarın. İyice karıştırın. A1'e kadar bunu yapmaya devam edin.
- Üçlü kompleks oluşumu: analit MZ1 ve Brd4BD2 içerir.
- DMSO içermeyen tamponda (#B5) 25.5 μM Brd4BD2 içeren 196 μL'ye% 100-DMSO çözeltisinde 20 μM'de 4 μL MZ1 ekleyerek üst konsantrasyonu hazırlayın. Nihai konsantrasyonlar 25 μM Brd4BD2, 100 nM MZ1 ve% 2 DMSO'dur.
- Soldaki sonraki 4 kuyucuğa (#B1-B4) çalışan tamponda 2 μM'de her biri 160 μL Brd4BD2 ekleyin
- 40 μL B5'i B4'e aktarın. İyice karıştırın.
- 40 μL B4'ü B3'e aktarın. İyice karıştırın. B1'e kadar bunu yapmaya devam edin.
- Negatif kontrol: analit sadece Brd4BD2 içerir.
- Tek döngülü kurulumu kullanarak SPR'yi çalıştırın: Temas süresi: 100 sn; ayrışma süresi: 720 s; akış hızı: 50 μL/dak. Sabit bir arka plan sağlamak için her numuneden önce üç tampon enjeksiyonu uygulayın.
- Veri analizi: Çıkarma için arka plan olarak arabelleğin üçüncü enjeksiyonunu uygulayın. Negatif kontrol olarak, MZ1 mevcut olmadığında, VHL ve Brd4BD2 arasındaki SPR yanıtı ihmal edilebilir. MZ1 mevcut olduğunda, kinetik uydurma, VHL ve MZ1-Brd4BD2 kompleksi arasındaki etkileşimi gösterir k açık = 7.9 (± 1.5) *107 /M/s, kkapalı = 0.014 s-1 ve KD = 1 nM'dir. (Şekil 4B)
- CRBN ve küçük molekül etkileşimleri için SPR
- Tampon hazırlama.
- 50 mM Tris, 100 mM NaCl, 1 mM MgCl 2, 0.5 mM TCEP, %0.005 P20, pH 7.5 içeren 1 L'lik bir tampon hazırlayın ve0.2 μm'lik bir filtre ünitesinden geçirin.
- 20 mL tamponu çıkarın ve 20 mL %100 DMSO'yu (son çalışan tamponda %2 DMSO) yeniden doldurun. Aşağıda açıklanan tüm örneklerde DMSO'yu %2'de tutmak önemlidir (adım 3.3, 3.4 ve 3.5).
- Üreticinin protokolünü izleyerek SA yongasını etkinleştirin ve CRBN'yi ~800 RU'ya hareketsiz hale getirin.
- Bileşikleri, 3.1.3'te açıklandığı gibi 30 μM'lik bir üst konsantrasyona sahip 384 oyuklu bir plaka üzerinde 3 katlı, 6 pt seri seyreltmede hazırlayın.
- Çok döngülü kurulumu kullanarak SPR'yi çalıştırın: Mod: Yüksek performans, temas süresi: 60 sn, ayrışma süresi: 90 sn; akış hızı: 50 μL/dak. Bu sistem için, kararlı bir arka plan elde etmek için üç tampon enjeksiyonu yeterlidir. Diğer tahlil sistemleri için ek tampon enjeksiyonları yapmak gerekebilir.
- Üreticinin yazılımını kullanarak veri analizi gerçekleştirin.
NOT: Kararlı durum analizi, BRD-2512 ve BRD-5110'unKD'sinin her ikisinin de 3 μM civarında olduğunu gösterir. Bununla birlikte, bağlanma en yüksek konsantrasyonda yalnızca ~% 70 Rmaksimum bağlanmaya ulaştı. Hem zayıf afinite hem de sensorgramın şekli, yüksek konsantrasyonlarda bileşik çözünmezliğin meydana gelme olasılığının yüksek olduğunu gösterir. Bu nedenle,gerçek KD 3 μM'den daha yüksek olabilir. CRBN'ye bağlanmayan BRD-4761, negatif kontrol olarak dahil edildi.
- Tampon hazırlama.
- PPM1D ve küçük molekül etkileşimleri için SPR
- Arabelleği adım 3.3.1'de açıklandığı gibi hazırlayın. Bir nitriloasetik asit (NTA) sensör çipi kullanın.
- PPM1D savaş başlığının yavaş bir kaçık ve kkapalı olması nedeniyle tek döngü uygulayın. Üreticinin varsayılan kurulumunu kullanarak NTA çipini yeniden oluşturun ve her bileşik enjeksiyondan sonra PPM1D'yi ~ 1000 RU'ya hareketsiz hale getirin (5 μL/dk'da 5 μg/mL protein çözeltisi enjekte edin).
- Bileşikleri, 3.1.3'te açıklandığı gibi en yüksek konsantrasyon 400 nM'de olacak şekilde 3 katlı, 5 noktalı seri seyreltmede hazırlayın.
- Tek döngülü kurulumu kullanarak SPR'yi çalıştırın: Mod: yüksek performans; temas süresi: 90 sn; ayrışma süresi: 600 s; akış hızı: 50 μL/dak. Stabil bir arka plan sağlamak için her bileşikten önce üç tampon enjeksiyonu uygulayın.
- Veri analizi. Tamponun üçüncü enjeksiyonunu çıkarma için arka plan olarak uygulayın. Negatif kontrol olarak BRD-2512, PPM1D'ye bağlanma göstermez. BRD-4761 ve BRD-5110 için kinetik bağlantı, her ikisi için de KD'nin 1-2 nm olduğunu gösterdi.
- CRBN için SPR:PROTAC: PPM1D üçlü kompleks
- Arabelleği adım 3.3.1'de açıklandığı gibi hazırlayın.
- Üreticinin protokolünü izleyerek SA çipini etkinleştirin ve CRBN'yi ~35 RU'ya hareketsiz hale getirin (5 μL/dk'da 0,5 μg/mL'lik bir protein çözeltisi enjekte edin).
- Adım 3.2.3'te açıklanan yöntemi kullanarak, boşluklar dahil tüm numunelerde [PPM1D]'yi 1 μM'de tutarken, 30 μM üst konsantrasyona sahip 3 katlı, 6 noktalı seri seyreltmede üç bileşik hazırlayın.
- Çok döngülü kurulumu kullanarak SPR'yi çalıştırın: Mod: Yüksek performans; temas süresi: 60 sn; ayrışma süresi: 90 sn; akış hızı: 50 μL/dak.
- Üreticinin yazılımını kullanarak veri analizi gerçekleştirin.
NOT: BRD-2512 ve BRD-4761 hiçbir / ihmal edilebilir yanıt göstermezken, BRD-5110 hızlı açma/kapama kinetiği ile kararlı durumda "kanca etkisini" açıkça gösterir (Şekil 5A-C). BRD-5110'dan (Şekil 5C) gelen deneysel bağlanma yanıtı, KD'nin (CRBN, cpd) 3 veya 10 μM(Şekil 5E) olduğu varsayıldığında simülasyondan tahmin edilen yanıt arasındadır, bu da üçlüKD ve ikili KD'nin çok benzer olduğunu düşündürür. PPM1D: BRD-5110: CRBN kompleks oluşumunun belirgin bir işbirliği yoktur.
Sonuçlar
VHL: MZ1 ikili kompleksi ve VHL: MZ1: Brd4BD2 üçlü kompleksinin karakterizasyonu, çok benzer bir tampon kullanılarak Şekil 2 (ITC), Şekil 3 (BLI) ve Şekil 4'te (SPR) bulunabilir. Ortogonal tahlillerdenekstrakte edilen KD tutarlıdır. Kooperatifçilik, oldukça pozitif olan (ITC'den 15 veya SPR'den 26)KD (ikili) / KD (üçlü) ile hesaplanabilir.
CRBN:PROTAC: PPM1D sisteminin karakterizasyonu SPR ile gerçekleştirilmiştir (Şekil 5A-D). CRBN, üçlü kompleks oluşumunun gözlemlenmesini kolaylaştırmak için ~ 35 RU'ya immobilize edildi. PROTAC'ın tek başına bağlanması, gürültünün altında olan <2 RU'luk bir sinyalle sonuçlandı. Analitteki PPM1D, SA çip yüzeyinde yüksek bir arka plan sinyali verir ve uygulanabilecek en yüksek konsantrasyon 1 μM civarındadır. Bu değer, CRBN ile savaş başlığı ≥3 μM) arasındakiKD'den daha düşüktür, bu nedenle "kanca etkisi" beklenir. SPR, simülasyonla iyi bir uyum içinde olan bunu algılayacak kadar hassastır (Şekil 5E). Simülasyon, klasik SPR hesaplaması [Yanıtmaks = (Yanıt Ligandı × Kütleİmmobilizasyonu)/KütleLigandı] ile birlikte literatür19'daki işbirlikçi olmayan denge kullanılarak yapılmıştır. Bileşiğin yüksek konsantrasyonda çözünmezliği nedeniyle CRBN ve bileşik arasındaki KD doğru bir şekilde belirlenmediğinden, simülasyon dört varsayımsal KD kullanılarak yapıldı: 1 μM, 3 μM, 10 μM veya 30 μM. Deneysel sonuçlar, simüle edilmiş 3 μM ve 10 μM eğrileri arasında yer aldı, bu da ikilisistemdeki KD ile neredeyse aynıydı ve bu da işbirliği olmadığını düşündürdü.

Şekil 1: Üç bağlama senaryosunun gösterimi ve farklı KD'lerin tanımı. (A) Klasik iki bileşenli sistemler. (B) PROTAC'ın bir ucunun doyurulabildiği üç bileşenli sistem, böylece iki bileşenli bir sistem olarak değerlendirilebilir. (C) "Kanca etkisinin" gözlemlendiği üç bileşenli sistem. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: ITC sonuçları. VHL'nin MZ1 (solda) veya MZ1:Brd4BD2 kompleksine (sağda) titre edilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: BLI sonuçları. MZ1, VHL: MZ1: Brd4BD2 üçlü kompleksinin oluşumuna aracılık eder. (A) Ham veriler. (B) [MZ1] = 0 olduğunda arka plan sinyallerinin çıkarılması. (C) K'yiaçık, k'yi çıkarmak için B'nin kinetik uydurması, k kapalı ve KD. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: SPR sonuçları . (A) MZ1'in VHL'ye bağlanması. (B) MZ1:Brd4BD2 VHL'ye ikili karmaşık bağlanma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
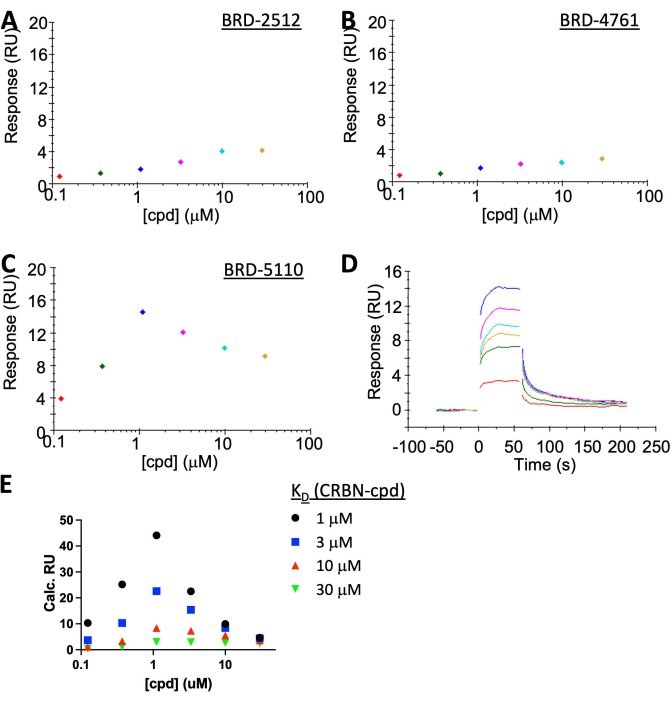
Şekil 5: Temsili bir PPM1D-PROTAC'ın "kanca etkisini" gösteren SPR sonuçları. CRBN, SA çip yüzeyinde immobilize edilirken, [PPM1D] tüm vakalar için analitte 1 μM'de tutuldu. (A) Yalnızca CRBN'ye bağlanan bir bileşik olan BRD-2512, neredeyse hiç yanıt vermez. (B) Yalnızca PPM1D'ye bağlanan bir bileşik olan BRD-4761 de yanıt vermez. (C,D) BRD-5110'de CRBN'nin savaş başlığına ve BRD-2512'de PPM1D'nin savaş başlığına sahip bir PROTAC olan BRD-4761, üçlü kompleksin oluşumunu indükledi. (E) CRBN ile bileşik arasındakiKD'nin 1 μM (siyah), 3 μM (mavi), 10 μM (kırmızı) veya 30 μM (yeşil) olduğunu varsayarak SPR sonuçlarının bir simülasyonu. BRD-2512 eğrisi 3 μM ile 10 μM arasındadır, bu da ölçülen ikiliKD'ye çok yakındır, bu da işbirliği olmadığını düşündürür (işbirliği = 1). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
PROTAC molekülleri ve bunların protein bağlayıcı ortakları arasındaki ikili ve üçlü etkileşimlerin biyofiziksel karakterizasyonu, yaygın olarak kullanılan hücresel sistemlere göre benzersiz ve tamamlayıcı bilgiler sağlayabilir. Bir PROTAC molekülünün her bir savaş başlığı ile protein bağlayıcı ortakları arasındaki afiniteyi anlamak, bu etkileşimlerin optimizasyonuna yönelik tıbbi kimya çabalarını yönlendirmeye yardımcı olabilir. Üçlü PROTAC komplekslerinin daha önce yayınlanmış kristal yapıları, bağlayıcı bölgedeki atomların, protein bağlayıcı ortaklardan biri veya her ikisi ile etkileşimler oluşturabileceğini ortaya koymuştur16,20. Üçlü kompleks oluşumunun işbirliğinin deneysel olarak belirlenmesi, bağlayıcı optimizasyonunu destekleyebilir.
Bu raporda, PROTAC molekülleri ve protein bağlayıcı ortakları arasındaki bağlanma afiniteleri hakkında bilgi sağlayabilen üç farklı biyofiziksel tekniğin kullanılması anlatılmaktadır. Yöntem 1, PROTAC molekülü, MZ1, VHL E3 ligaz kompleksi ve Brd4BD2 bromodomain için izotermal titrasyon kalorimetrisi (ITC) deney düzeneğini detaylandırır. ITC sonuçları, MZ1 ve VHL arasındaki ikili etkileşim için 59 nM'lik KD'leri ve VHL ile önceden karıştırılmış MZ1 ve Brd4BD2 arasındaki üçlü etkileşim için 4 nM'likKD'leri gösterdi. Afiniteler, SPR (MZ1 K D = 26 nM'ye immobilize VHL bağlanması, önceden karıştırılmış MZ1 ve Brd4BD2 K D = 1 nM'ye immobilize VHL bağlanması) ve BLI'da (K D = 2.8 nM) gözlenenlerle tutarlıydı. VHl'nin MZ1'e bağlanması için ITCKD sonuçları bildirilen değerler16 ile tutarlı olsa da, elde edilen stokiyometri farklıdır. Bu sonucun olası bir açıklaması, burada açıklanan protokolde kullanılan HEPES bazlı tamponda MZ1'in zayıf çözünürlüğüdür, literatürden elde edilen sonuçlar ise Bis-tris bazlı bir tampon kullanılarak oluşturulmuştur. Yazarlar SPR, ITC ve BLI'da aynı tampon bileşenlerini kullanmayı tercih ettiler.
Yöntem 2, hareketsizleştirilmiş VHL, sabit bir Brd4BD2 konsantrasyonu ve değişen MZ1 konsantrasyonlarının etkileşiminin BLI analizi için deney düzeneğini açıklar. Tekniğin duyarlılık sınırlamaları nedeniyle, üçlü kompleks oluşumuiçin KD, kaçık ve kkapalı değerleri üretilebilir, ancak MZ1 ve proteinler arasındaki ikili etkileşim için üretilemez.
Yöntem 3, birden çok SPR tahlilini açıklar. SPR, BLI'dan daha hassastır ve hem protein-küçük molekül (ikili) hem de protein-protein (üçlü) etkileşimlerini gözlemlemek için uygulanabilir. İkinci durumda, analitteki protein yüksek ve kararsız sinyaller verebileceğinden arka plan sinyalleri dikkatle izlenmelidir. SPR, DMSO, gliserol ve deterjanlar dahil olmak üzere yüksek kırılma indisine sahip reaktiflere karşı çok hassastır. Protein, gliserol veya deterjan içeren tamponda depolanıyorsa, çalışan tampon bu bileşenlerin eşleşen konsantrasyonlarını içermelidir. Alternatif olarak, boyut dışlama kromatografisinin uygulanması, herhangi bir SPR deneyinden önce bunları tamamen ortadan kaldırır. Tampon ve analit numuneleri arasındaki DMSO konsantrasyonlarının yakından eşleşmesine özen gösterilmelidir. DMSO solvent düzeltmeleri, üreticinin talimatlarına göre gerçekleştirilir.
Adım 3.1'deki yöntem, ikili VHL-MZ1 etkileşimi için SPR tahlilini açıklar. Yöntem 3.2, VHL için SPR tahlilini açıklar: VHL'nin hareketsiz hale getirildiği MZ1: Brd4 BD2 üçlü kompleksi ve analit ya tek başına Brd4 BD2 ya da MZ1: Brd4BD2 kompleksidir. Bu sistemde, Brd4BD2 ve VHL arasındaki etkileşim ihmal edilebilir düzeydedir. Üçlü kompleks oluşumu oldukça işbirlikçidir (ɑ = 26). Üçlü kompleks oluşumu için off-rate, tek döngülü kinetiğin kullanılmasını gerektiren 0.014 s-1'dir. ITC'den elde edilen sonuçlar ayrıca oldukça işbirlikçi bir üçlü kompleks oluşumu göstermektedir (ɑ=15). Adım 3.3, 3.4 ve 3.5'teki SPR yöntemleri, bir PROTAC molekülü olan BRD-5110'un varlığıyla indüklenen CRBN ve PPM1D arasında bir kompleks oluşumunu değerlendirmek için yapılan testleri açıklar. PROTAC molekülü, CRBN için zayıf bir afiniteye (KD ~ 3 μM) ve PPM1D için güçlü bir afiniteye(KD = 1-2 nM) sahiptir. Sonuç olarak, CRBN'ye zayıf bağlanma doygun değildir ve gözlemlenen bir "kanca etkisi" ile sonuçlanır. Deneyde kullanılan DMSO konsantrasyonunu artırarak ligand çözünürlüğünü artırmak mümkün olsa da, bu durumlarda yüksek DMSO konsantrasyonlarından olumsuz etkilenebilecek protein stabilitesini dikkatlice izlemek önemlidir. Ek olarak, DMSO, ligandların proteine bağlanma ısısını gizleyebilen yüksek bir çözünme ısısına sahiptir. Şırıngadaki çözeltinin DMSO konsantrasyonlarının ve hücredeki çözeltinin eşleşmesine dikkat edilmelidir. Yazarlar, aynı tampon preparatına karşı iki çözeltinin diyalizini önermektedir.
Burada gerçekleştirilen ve raporlanan deneylere dayalı olarak genel öneriler ve yönergeler sağlanmaktadır. PROTAC molekülleri ve protein bağlayıcı ortakları arasındaki ikili etkileşimlerin afiniteleri güçlü olduğunda(KD < 1 μM), SPR, üçlü kompleks oluşumunun işbirliği hakkında değerli bilgilerle birlikte güvenilir ve tekrarlanabilir afiniteler sağlar. Protein bağlayıcı ortaklardan biri ile PROTAC molekülü arasındaki ikili etkileşimin afiniteleri zayıf olduğunda(KD > 1 μM), tahlil kurulumunun değiştirilmesi gerekecektir. Bu durumlarda, bağlanma sabitlerinin sabit olduğu ve ligand ve analit konsantrasyonlarının değiştiği moleküler simülasyonların kullanılması, tahlil tasarımına rehberlik etmede ve deneysel sonuçları yorumlamada değerli olabilir. ITC tahlilleri, bağlanmanın stokiyometrisi hakkında önemli bilgiler sağlar, ancak SPR ve BLI'ya göre önemli ölçüde daha fazla protein ve bileşik reaktifi gerektirir. Ek olarak, PROTAC molekülünün çözünürlüğü ITC deneyleri için sınırlayıcı olabilir. BLI, ITC'den daha yüksek verime sahiptir ve daha az protein ve bileşik reaktifi gerektirir. Bununla birlikte, hassasiyet sınırlamaları nedeniyle, BLI, PROTAC molekülleri ve protein bağlayıcı ortakları arasındaki ikili etkileşimleri değil, yalnızca üçlü kompleks oluşumunu değerlendirmek için kullanılabilir. SPR'nin hem ikili hem de üçlü PROTAC bağlanma testlerinin ve SPR'den elde edilen sonuçların ortogonal validasyonu için kullanılan BLI ve ITC testlerinin rutin testleri için kullanılması önerilir.
Açıklamalar
Yazarların birbiriyle çelişen finansal çıkarları veya diğer çıkar çatışmaları yoktur.
Teşekkürler
Bu çalışma, MIT ve Harvard Broad Enstitüsü'ndeki Terapötik Geliştirme Merkezi'nden bir İnovasyon ve Teknoloji Geliştirme ödülü ile desteklenmiştir. Yazarlar, bu çalışmaya verdikleri destek için üst düzey liderlik ekibi üyelerine ve inceleme komitesine teşekkür etmek istemektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-plate | Greiner | 655076 | flat-bottom, black plates used In BLI experiments |
| 96-well plate | Nunc | 73520-120 | Plate use for ITC sample preparation |
| 96-well plate | Greiner | 650101 | Plate used to prepare samples for SPR experiments |
| Auto iTC200 micro-calorimeter | Malvern Panalytical | Instrument used to perform ITC experiments. Product discontinued. | |
| Biacore S200 | Cytiva | 29136649 | Instrument used to perform SPR experiments |
| MZ1 | ProbeChem | PC-60099 | PROTAC that binds to VHL and Brd4BD2 |
| NTA sensor chip | Cytiva | BR100532 | SPR chip used to perform SPR experiments involving PPM1D |
| Octet Red-384 | Sartorius | Instrument used to perform BLI experiments. Product discontinued. | |
| Plate cover | Malvern | PQA0001 | Cover for Nunc 96-well plate (73520-120) |
| Plate cover | Cytiva | 28975816 | Plate cover for Greiner plate (650101) |
| Series S SA sensor chip | Cytiva | BR100531 | SPR chip used to perform SPR experiments involving MZ1:VHL:BRD4 |
| Streptavidin (SA) Dip and Read Biosensors | Sartorius | 18-509 | Coated sensors used in BLI experiments |
Referanslar
- Balaji, V., Hoppe, T. Regulation of E3 ubiquitin ligases by homotypic and heterotypic assembly. F1000Research. 9, (2020).
- Song, L., Luo, Z. -. Q. Post-translational regulation of ubiquitin signaling. Journal of Cell Biology. 218 (6), 1776-1786 (2019).
- Yang, Q., Zhao, J., Chen, D., Wang, Y. E3 ubiquitin ligases: styles, structures and functions. Molecular Biomedicine. 2 (1), 23 (2021).
- Grice, G. L., Nathan, J. A. The recognition of ubiquitinated proteins by the proteasome. Cellular and Molecular Life Sciences: CMLS. 73 (18), 3497-3506 (2016).
- Chirnomas, D., Hornberger, K. R., Crews, C. M. Protein degraders enter the clinic - a new approach to cancer therapy. Nature Reviews Clinical Oncology. 20 (4), 265-278 (2023).
- Toure, M., Crews, C. M. Small-molecule PROTACS: New approaches to protein degradation. Angewandte Chemie (International ed. In English). 55 (6), 1966-1973 (2016).
- Ottis, P., Toure, M., Cromm, P. M., Ko, E., Gustafson, J. L., Crews, C. M. Assessing different E3 ligases for small molecule induced protein ubiquitination and degradation. ACS Chemical Biology. 12 (10), 2570-2578 (2017).
- Riching, K. M., et al. Quantitative live-cell kinetic degradation and mechanistic profiling of PROTAC mode of action. ACS Chemical Biology. 13 (9), 2758-2770 (2018).
- Nabet, B., et al. The dTAG system for immediate and target-specific protein degradation. Nature Chemical Biology. 14 (5), 431-441 (2018).
- Paiva, S. -. L., Crews, C. M. Targeted protein degradation: elements of PROTAC design. Current Opinion in Chemical Biology. 50, 111-119 (2019).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annual Review of Biochemistry. 67, 425-479 (1998).
- Chan, K. -. H., Zengerle, M., Testa, A., Ciulli, A. Impact of target warhead and linkage vector on inducing protein degradation: Comparison of bromodomain and extra-terminal (BET) degraders derived from triazolodiazepine (JQ1) and tetrahydroquinoline (I-BET726) BET inhibitor scaffolds. Journal of Medicinal Chemistry. 61 (2), 504-513 (2018).
- Roy, M. J., et al. SPR-measured dissociation kinetics of PROTAC ternary complexes influence target degradation rate. ACS Chemical Biology. 14 (3), 361-368 (2019).
- Pierce, N. W., Kleiger, G., Shan, S., Deshaies, R. J. Detection of sequential polyubiquitylation on a millisecond timescale. Nature. 462 (7273), 615-619 (2009).
- Gadd, M. S., et al. Structural basis of PROTAC cooperative recognition for selective protein degradation. Nature Chemical Biology. 13 (5), 514-521 (2017).
- Nahta, R., Castellino, R. C. Phosphatase magnesium-dependent 1 δ (PPM1D), serine/threonine protein phosphatase and novel pharmacological target in cancer. Biochemical Pharmacology. 184, 114362 (2021).
- Douglass, E. F., Miller, C. J., Sparer, G., Shapiro, H., Spiegel, D. A. A comprehensive mathematical model for three-body binding equilibria. Journal of the American Chemical Society. 135 (16), 6092-6099 (2013).
- Zorba, A., et al. Delineating the role of cooperativity in the design of potent PROTACs for BTK. Proceedings of the National Academy of Sciences. 115 (31), E7285-E7292 (2018).
- Fairhead, M., Howarth, M. Site-specific biotinylation of purified proteins using BirA. Methods in Molecular Biology. 1266, 171-184 (2015).
- Nowak, R. P., et al. Plasticity in binding confers selectivity in ligand-induced protein degradation. Nature Chemical Biology. 14 (7), 706-714 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır