Method Article
Entwicklung und Anwendung biophysikalischer Assays zur Evaluierung der Bildung ternärer Komplexe, die durch Proteolyse-Targeting-Chimären (PROTACS) induziert werden
In diesem Artikel
Zusammenfassung
In dieser Arbeit beschreiben wir Protokolle zur biophysikalischen Charakterisierung der ternären Komplexbildung, die durch Proteolyse-Targeting-Chimären (PROTACS) induziert wird, an denen die Ubiquitin-Ligasen Von-Hippel-Lindau E3-Ligase (VHL) und Cereblon (CRBN) beteiligt sind. Zu den hier dargestellten biophysikalischen Methoden gehören die Oberflächenplasmonenresonanz (SPR), die Bioschichtinterferometrie (BLI) und die isotherme Titrationskalorimetrie (ITC).
Zusammenfassung
E3-Ligasen und Proteine, die auf den Abbau abzielen, können durch heterobifunktionelle Moleküle in einem mehrstufigen Prozess dazu gebracht werden, Komplexe zu bilden. Die Kinetik und Thermodynamik der beteiligten Wechselwirkungen tragen zur Effizienz der Ubiquitinierung und des daraus resultierenden Abbaus des Proteins bei. Biophysikalische Techniken wie die Oberflächenplasmonenresonanz (SPR), die Bioschichtinterferometrie (BLI) und die isotherme Titrationskalorimetrie (ITC) liefern wertvolle Informationen, die bei der Optimierung dieser Wechselwirkungen verwendet werden können. Unter Verwendung von zwei Modellsystemen wurde ein biophysikalischer Assay-Toolkit zum Verständnis der Kooperativität der ternären Komplexbildung und des Einflusses des "Hook-Effekts" auf die Bindungskinetik entwickelt. In einem Fall wurde ein Proteolyse-Targeting-Chimären-Molekül (PROTAC) untersucht, das die ternäre Komplexbildung zwischen Brd4BD2 und VHL induziert. Das heterobifunktionelle Molekül MZ1 hat nM-Affinitäten sowohl für das Brd4-BD2-Protein (SPR K D = 1 nM, ITC K D = 4 nM) als auch für den VHL-Komplex (SPR K D = 29 nM, ITC K D = 66 nM). Für dieses System wurden robuste SPR-, BLI- und ITC-Assays entwickelt, die veröffentlichte Ergebnisse reproduzierten, die die Kooperativität der ternären Komplexbildung demonstrieren. Im anderen Fall wurde ein Molekül untersucht, das ternäre Komplexe zwischen einem 46,0 kDa-Protein, PPM1D, und Cereblon [CRBN (319-442)] induziert. Das heterobifunktionelle Molekül BRD-5110 hat eine SPR K D = 1 nM für PPM1D, aber eine viel schwächere Bindung gegen den verkürzten CRBN (319-442)-Komplex (SPR KD = ~ 3 μM). In diesem Fall war die Bindung für CRBN in SPR nicht sättigbar, was zu einem "Hook-Effekt" führte. Der Durchsatz- und Reagenzienbedarf für SPR, BLI und ITC wurde evaluiert und allgemeine Empfehlungen für deren Anwendung auf PROTAC-Projekte gegeben.
Einleitung
Die Polyubiquitinierung von Proteinen in der Zelle ist ein streng regulierter Prozess, an dem Enzyme der Ubiquitin-Ligase-Familie beteiligt sind 1,2. Die terminalen Enzyme im Signalweg sind die E3-Ubiquitin-Ligasen, die Ubiquitin-Moleküle kovalent an ihre Proteinbindungspartner binden3. Die Polyubiquitinierung dieser Proteinbindungspartner zielt auf den proteolytischen Abbau durch das Proteasom4 ab. Dieses System ist Teil des Proteinhomöostase-Prozesses, der therapeutisch genutzt wurde, um den Abbau von Proteinen zu induzieren, die an der Krankheit beteiligt sind5. Kleine Moleküle, die die Wechselwirkung zwischen E3-Ubiquitin-Ligasen induzieren, wie z. B. die Von-Hippel-Lindau-E3-Ligase (VHL) oder Cereblon (CRBN), bestehen typischerweise aus einem E3-Ligase-bindenden Gefechtskopf, der durch einen flexiblen Linker mit einem Gefechtskopf verbunden ist, der an das Protein bindet, das für den Abbau anvisiert wird. Diese heterobifunktionellen Moleküle werden allgemein als Proteolyse bezeichnet, die auf Chimären abzielt, oder PROTACS6.
Bei der Entwicklung von PROTACS wird die Fähigkeit von Molekülen untersucht, den Abbau von Proteinen in Zellen zu induzieren. Es wurden viele zelluläre Assay-Systeme entwickelt, die die induzierte Interaktion zwischen dem Zielprotein und E3-Ligase-Komponenten, wie VHL oder CRBN, bei der Behandlung der Zellen mit einem PROTAC-Molekül überwachen. Ein solcher zellulärer Assay, das nanoluc-Halotag-System7, beinhaltet eine E3-Ligase, die mit dem Halotag-Akzeptor fusioniert ist, und ein Zielprotein, das mit einem nanoluc-Donor markiert ist. Die ternäre Komplexbildung bringt den Nanoluc-Donor und den Halotag-Akzeptor in die Nähe und ermöglicht die Energieübertragung vom Donor zum Akzeptor, was zur Emission von Licht führt. Variationen dieses Systems können verwendet werden, um die zelluläre Permeabilität von PROTACS-Molekülen8 oder Änderungen des relativen Niveaus der Ubiquitinierung des Zielproteins9 zu bewerten. Während diese zellulären Systeme für die Optimierung von PROTACs unerlässlich sind, ist die Bildung von Komplexen zwischen E3-Ligasen und Proteinen, die für den Abbau bestimmt sind, ein mehrstufiger Prozess10,11. Die Kinetik und Thermodynamik der beteiligten binären und ternären Wechselwirkungen tragen zur effizienten Ubiquitinierung und dem daraus resultierenden Abbau des Proteins12,13,14 bei.
Darin werden Protokolle beschrieben, die für die biophysikalische Charakterisierung der durch PROTACS induzierten ternären Komplexbildung unter Verwendung von Oberflächenplasmonenresonanz (SPR), Bioschichtinterferometrie (BLI) und isothermer Titrationskalorimetrie (ITC) angepasst werden können. SPR- und ITC-Protokolle für das MZ1 PROTAC-Molekül, das die Bildung ternärer Komplexe zwischen Brd4,BD2 und VHL induziert, die aus den Literaturberichten13,15 abgeleitet und hier beschrieben wurden, waren in der Lage, die berichteten Ergebnisse mit einigen Modifikationen der berichteten Verfahren zu rekapitulieren, die diskutiert werden. Dieser Bericht enthält eine Beschreibung eines BLI-Assays, der zur Bewertung der ternären Komplexbildung zwischen MZI, Brd4BD2 und VHL verwendet wird. Die Affinitätsmessungen von BLI stimmten mit denen überein, die in SPR und ITC beobachtet wurden. Ein zuvor veröffentlichtes Protokoll, in dem ein SPR-Assay zur Bewertung der PROTAC-induzierten ternären Komplexbildung zwischen PPM1D, einer Ser/Thr-Proteinphosphatase, deren Expression p53-abhängig induziert wird,16, und CRBN entwickelt wurde, wird ebenfalls beschrieben. In diesem Fall hat das PROTAC-Molekül eine nanomolare Affinität zu PPM1D, aber nur eine mikromolare Affinität zu CRBN. In diesem Fall ist die Bindung des PROTAC-Moleküls an CRBN nicht sättigbar, was zu dem häufig beobachteten "Hook-Effekt" führt. Der Hook-Effekt ist eine Eigenschaft von drei Körpersystemen, in denen es zwei Spezies gibt, die einen heterotrimeren Komplex bilden können, wenn beide an ein Brückenmolekül gebunden sind (Abbildung 1)17. Der Hakeneffekt wird beobachtet, wenn die brückenbildende Spezies im Vergleich zu den beiden anderen Spezies eine Überkonzentration aufweist. Der resultierende Zustand ist einer, in dem die binären Wechselwirkungen die ternären Wechselwirkungen übertreffen. Die Systeme, bei denen der Hakeneffekt beobachtet wird, erfordern spezifische Überlegungen zur Versuchsplanung, die in diesem Bericht erörtert werden. Es werden allgemeine Konzepte und Reagenzienanforderungen für die Evaluierung des Einsatzes biophysikalischer Assays zur Bewertung der Bildung von PROTAC-induzierten ternären Komplexen bereitgestellt.
Protokoll
Alle Proteine wurden in E. coli mit guter Ausbeute und Reinheit (>80%) gemäß den Literaturprotokollen überexprimiert18. Die Biotinylierung wurde mit Hilfe einer BirA-katalysierten Reaktion18 durchgeführt. Alle kleinen Moleküle wurden in 1 mM Stammlösungen in 100% DMSO hergestellt. Die hier beschriebenen Verfahren erfordern keine spezielle Laborsicherheitsausrüstung oder Vorsichtsmaßnahmen. Es sollte Standard-Labor-Schutzausrüstung (PSA) verwendet werden (d. h. Laborkittel, Schutzbrille und Handschuhe).
Die in dieser Studie verwendeten Proteine sind unten aufgeführt:
VHL: biotinylierter VHL(53-213)/ElonginB (1-104)/ElonginC(17-112)-Komplex mit Avi-Tag am C-Terminus von ElonginB.
Brd4BD2: Nicht markiert Brd4BD2(333-460)
CRBN: biotinyliertes CRBN(319-442) mit Avi-Tag am N-Terminus
PPM1D: nicht markiertes oder doppeltes His8-markiertes PPM1D(1-420) am N-Terminus
Kleine Moleküle, die in dieser Studie verwendet werden, sind unten aufgeführt:
MZ1 (MW = 1002,6 Da): PROTAC, das an VHL und Brd4BD2 bindet
BRD-2512 (MW = 841,4 Da): CRBN K D ~3 μM, bindet nicht an PPM1D
BRD-5110 (MW = 872,0 Da): CRBN K D ~3 μM, PPM1D KD = 1-2 nM
BRD-4761 (MW = 476,6 Da): bindet nicht an CRBN, PPM1D KD = 1-2 nM
1. Methode 1: ITC (isotherme Titrationskalorimetrie)
HINWEIS: Die Titrationen werden mit einem Mikrokalorimeter mit automatischer Injektion durchgeführt.
- Puffervorbereitung: Bereiten Sie 3 l Puffer mit 20 mM HEPES, 150 mM NaCl, 1 mM TCEP, pH 7,5 vor.
- Dialyse: Dialysieren Sie VHL und Brd4BD2 (~ 500 μl bei jeweils 150 μM) gegen 1 l des in Schritt 1.1 hergestellten Puffers, 3 mal bei 4 °C, für 4 h, 2 h bzw. ca. 16 h. Bewahren Sie den Puffer nach der letzten Dialyse auf, um ihn in den folgenden Schritten zu verwenden.
- Bereiten Sie die Proben auf einer 96-Well-Platte mit Kunststoffabdeckung vor.
- Für jede Titration werden 400 μl Lösung für die Zelle, 125 μl für die Spritze und 400 μl Puffer für die Reinigung vorbereitet. Geben Sie Proben in drei aufeinanderfolgende Vertiefungen auf der Platte. Da das zusammengesetzte Material bei 1 mM in 100 % DMSO hergestellt wird, fügen Sie den Proteinlösungen den gleichen Prozentsatz DMSO hinzu, um den passenden Puffer in der Zelle und der Spritze zu gewährleisten. Fügen Sie 2% DMSO zu den endgültigen Lösungen hinzu.
- Probe für die Titration von VHL in MZ1: Bereiten Sie eine Zelllösung vor, die 392 μl Puffer, 4 μl MZ1 bei 1 mM (10 μM Endkonzentration) und 4 μl 100% DMSO enthält. Bereiten Sie eine Spritzenlösung mit 122,5 μl VHL bei 85,7 μM, 2,5 μl 100% DMSO (84 μM Endkonzentration) vor.
- Proben für die Titration von VHL in den Puffer (die Daten werden für die Hintergrundsubtraktion der aus der Probe 1.3.1.1 generierten Daten verwendet): Bereiten Sie eine Zelllösung mit 392 μl Puffer und 8 μl 100 % DMSO vor. Bereiten Sie eine Spritzenlösung mit 122,5 μl VHL bei 85,7 μM (84 μM Endkonzentration) vor und fügen Sie 2,5 μl 100%iges DMSO hinzu.
- Proben für die Titration von VHL in MZ1 und Brd4 BD2: Bereiten Sie eine Zelllösung vor, die 392 μl 17,1 μM Brd4BD2 (16,8 μM Endkonzentration), 3,36 μl MZ1 bei 1 mM (8,4 μM Endkonzentration) und 4,64 μl 100% DMSO enthält. Bereiten Sie eine Spritzenlösung mit 122,5 μl VHL bei 85,7 μM (84 μM Endkonzentration) und 2,5 μl 100% DMSO vor.
- Proben für die Titration von VHL zu Brd4 BD2 (Hintergrund von 1.3.1.3): Bereiten Sie eine Zelllösung vor, die 392 μl 17,1 μM Brd4BD2 (16,8 μM Endkonzentration) und 8 μl 100% DMSO enthält. Bereiten Sie eine Spritzenlösung mit 122,5 μl VHL bei 85,7 μM (84 μM Endkonzentration) und 2,5 μl 100% DMSO vor.
- Für jede Titration werden 400 μl Lösung für die Zelle, 125 μl für die Spritze und 400 μl Puffer für die Reinigung vorbereitet. Geben Sie Proben in drei aufeinanderfolgende Vertiefungen auf der Platte. Da das zusammengesetzte Material bei 1 mM in 100 % DMSO hergestellt wird, fügen Sie den Proteinlösungen den gleichen Prozentsatz DMSO hinzu, um den passenden Puffer in der Zelle und der Spritze zu gewährleisten. Fügen Sie 2% DMSO zu den endgültigen Lösungen hinzu.
- Führen Sie alle vier Titrationen auf dem Mikrokalorimeter durch. Jede besteht aus 19 Injektionen von 2 μl Spritzenlösung mit einer Rate von 2 μl/s in Zeitintervallen von 120 s. Nehmen Sie eine erste Injektion von Protein (0,4 μl) vor und verwerfen Sie es während der Datenanalyse. Alle Experimente werden bei 25 °C unter Rühren mit 600 U/min durchgeführt.
- Datenanalyse: Passen Sie die Daten an ein Modell mit einer einzigen Bindungsstelle an, um die Stöchiometrie (n), die Dissoziationskonstante (KD) und die Bindungsenthalpie (ΔH) mit der vom Hersteller bereitgestellten Analysesoftware zu erhalten (Abbildung 2).
2. Methode 2: BLI (Biolayer-Interferometrie)
- Durchführung von BLI-Experimenten mit Streptavidin (SA)-beschichteten Sensoren bei Raumtemperatur (RT) mit einer Erfassungsrate von 5 Hz. Stellen Sie während des automatisierten BLI-Experiments sicher, dass die Sensoren innerhalb einer einzelnen Säule stationär sind und sich zwischen verschiedenen Säulen einer schwarzen 96-Well-Platte mit flachem Boden und einem maximalen Well-Volumen von 392 μl bewegen. Füllen Sie jede Vertiefung der im Experiment verwendeten Platte mit 200 μl Lösung.
HINWEIS: BLI ist nur nützlich, um Protein-Protein-Wechselwirkungen (d. h. ternäre Komplexbildung) zu erkennen. Es ist nicht empfindlich genug, um Wechselwirkungen zwischen Proteinen und kleinen Molekülen zu erkennen.- Puffervorbereitung: Bereiten Sie 100 ml Puffer mit 20 mM HEPES, 150 mM NaCl, 1 mM TCEP, 0,05 % P20, pH 7,5 vor.
- Optimierung für den Immobilisierungsschritt: Belastung des Testsensors auf 1-3 nm, wie vom Hersteller empfohlen. Für die hier beschriebenen Verfahren wird eine Belastung von ~1,0 nm verwendet. Um dies zu erreichen, wird der Sensor 80 s lang in eine VHL-haltige Lösung mit 1,5 μg/ml getaucht.
- Führen Sie kinetische BLI-Messungen durch, indem Sie sieben SA-Sensoren in der folgenden Reihenfolge einsetzen:
- Für die erste Baseline-Phase 60 s lang in den Puffer eintauchen.
- Für die Immobilisierungsphase wird 80 s lang in eine VHL-Lösung mit 1,5 μg/ml getaucht.
- Für die zweite Basisphase 60 s lang in den Puffer eintauchen.
- Für die Assoziationsphase wird eine feste Konzentration von Brd4BD2 bei 2 μM, eine feste Konzentration von DMSO von 2 % und unterschiedliche Konzentrationen von MZ1 bei 100 nM, 50 nM, 25 nM, 12,5 nM, 6,3 nM, 3,1 nM und 0 nM (Referenzsensor) für 300 s in Lösung getaucht.
- Für die Dissoziationsphase 600 s lang in den Puffer eintauchen.
- Führen Sie eine Datenanalyse mit der Software des Herstellers durch. k on, koff und KD werden für die Datenanpassung gemeldet (Abbildung 3).
3. Methode 3: SPR (Oberflächenplasmonenresonanz)
HINWEIS: Alle SPR-Experimente werden mit Streptavidin (SA) beschichteten Sensorchips bei RT durchgeführt. Obwohl der NTA-Chip für die Detektion zwischen Protein und kleinen Molekülen verwendet wird, ist er mit Vorsicht zu verwenden, wenn er auf den ternären Komplex angewendet wird, da ein viel höherer Hintergrund als der SA-Chip beobachtet wird, möglicherweise aufgrund elektrostatischer Wechselwirkungen zwischen der geladenen Chipoberfläche und dem Protein im Analyten.
- SPR für VHL-MZ1-Wechselwirkung
- Vorbereitung der Puffer.
- Bereiten Sie einen 1-Liter-Puffer mit 20 mM HEPES, 150 mM NaCl, 1 mM TCEP, 0,005 % P20, pH 7,5 vor und leiten Sie ihn durch eine 0,2-μm-Filtereinheit.
- Entfernen Sie 20 ml Puffer für die zukünftige Verwendung (DMSO-freier Puffer) und füllen Sie 20 ml DMSO (2 % DMSO im endgültigen Laufpuffer) nach. Halten Sie DMSO in allen unten beschriebenen Proben bei 2 % (Schritte 3.1 und 3.2)
- Aktivieren Sie den SA-Chip gemäß dem Protokoll des Herstellers und immobilisieren Sie VHL auf ~2000 RU (injizieren Sie eine Proteinlösung von 5 μg/ml bei 5 μl/min).
- Bereiten Sie MZ1 in einer 3-fachen, seriellen 8-Punkt-Verdünnung mit der oberen Konzentration bei 10 μM auf einer transluzenten 384-Well-Bodenplatte aus transluzentem Polypropylen mit einem maximalen Volumen von 130 μl vor. Decken Sie die Platte mit selbstklebenden, transparenten Kunststofffolien ab, die mit Polypropylen-Mikrotiterplatten kompatibel sind.
- Bereiten Sie die oberste Konzentration mit dem DMSO-freien Puffer vor, um sicherzustellen, dass die 2%ige DMSO die Endkonzentration erreicht. Zu 147 μl DMSO-freiem Puffer 1,5 μl MZ1-Stamm mit 1 mM und 1,5 μl 100%igem DMSO hinzufügen.
- Bereiten Sie die 3-fache serielle Verdünnung mit dem laufenden Puffer vor, der 2 % DMSO enthält. Zu 100 μl des laufenden Puffers werden 50 μl Lösung in der in Schritt 3.1.3.1 hergestellten Spitzenkonzentration zugegeben und gut vermischt, um diezweithöchste Konzentration herzustellen.
- Dann werden 50 μl der in Schritt 3.1.3.2 hergestellten Lösung in die nächsten 100 μl des laufenden Puffers überführt, gut gemischt, um diedritthöchste Konzentration herzustellen, und so weiter.
- Führen Sie SPR mit dem Multi-Cycle-Setup aus: Modus: High-Performance; Kontaktzeit: 120 s; Dissoziationszeit: 300 s; Durchflussrate: 50 μL/min.
- Führen Sie die Datenanalyse mit der vom Gerätehersteller bereitgestellten Auswertungssoftware durch. Die stationäre Analyse ergab, dass KD = 26 (± 3) nM und Rmax von ~91% (± 5%) Bindung erreicht wurden (Abbildung 4A)
- Vorbereitung der Puffer.
- SPR für VHL: MZ1: Brd4BD2 ternärer Komplex
- Bereiten Sie den Puffer wie in Schritt 3.1.1 beschrieben vor.
- Aktivieren Sie den SA-Chip gemäß dem Protokoll des Herstellers und immobilisieren Sie VHL auf ~100 RU. Injizieren Sie eine Proteinlösung von 0,5 μg/ml VHL mit einer Flussrate von 5 μl/min und einer Kontaktzeit zwischen 1-5 Minuten, bis eine Oberflächendichte von ~100 RU erreicht ist.
- Bereiten Sie die Proben für zwei 5-fache, 5-Punkt-Einzelzyklusinjektionen in einer 96-Well-, durchsichtigen, runden Bodenplatte aus Polystyrol mit einem maximalen Volumen von 323 μl vor und decken Sie sie mit selbstklebenden, transparenten Kunststofffolien ab, die mit Polystyrol-Mikrotiterplatten kompatibel sind, wie in den Schritten 3.2.3.1-3.2.3.2 beschrieben.
- Negativkontrolle: Der Analyt enthält nur Brd4BD2 .
- Höchste Konzentration bei 25 μM in laufendem Puffer mit einem Volumen von 200 μl (#A5) vorbereiten
- Geben Sie je 160 μl Brd4BD2 bei 2 μM in den laufenden Puffer in die nächsten 4 Vertiefungen auf der linken Seite (#A1-A4)
- 40 μl A5 auf A4 übertragen. Gut mischen.
- 40 μl A4 auf A3 übertragen. Gut mischen. Wiederholen Sie dies bis A1.
- Ternäre Komplexbildung: Der Analyt enthält MZ1 und Brd4BD2.
- Die höchste Konzentration wird durch Zugabe von 4 μl MZ1 bei 20 μM in 100%iger DMSO-Lösung zu 196 μl mit 25,5 μM Brd4BD2 in DMSO-freiem Puffer (#B5) hergestellt. Die Endkonzentrationen betragen 25 μM Brd4BD2, 100 nM MZ1 und 2 % DMSO.
- Geben Sie je 160 μl Brd4BD2 bei 2 μM in den laufenden Puffer in die nächsten 4 Vertiefungen auf der linken Seite (#B1-B4)
- 40 μl B5 auf B4 übertragen. Gut mischen.
- 40 μl B4 auf B3 übertragen. Gut mischen. Wiederholen Sie dies bis B1.
- Negativkontrolle: Der Analyt enthält nur Brd4BD2 .
- Führen Sie SPR mit dem Single-Cycle-Setup durch: Kontaktzeit: 100 s; Dissoziationszeit: 720 s; Durchflussrate: 50 μL/min. Tragen Sie vor jeder Probe drei Injektionen Puffer auf, um einen stabilen Hintergrund zu gewährleisten.
- Datenanalyse: Wenden Sie die dritte Injektion des Puffers als Hintergrund für die Subtraktion an. Als Negativkontrolle ist die SPR-Antwort zwischen VHL und Brd4BD2 vernachlässigbar, wenn MZ1 nicht vorhanden ist. Wenn MZ1 vorhanden ist, zeigt die kinetische Anpassung an, dass die Wechselwirkung zwischen VHL und MZ1-Brd4BD2-Komplex k on = 7,9 (± 1,5) *107 /M/s, koff = 0,014 s-1 und KD = 1 nM hat. (Abbildung 4B)
- SPR für CRBN- und niedermolekulare Wechselwirkungen
- Vorbereitung der Puffer.
- Bereiten Sie einen 1-Liter-Puffer mit 50 mM Tris, 100 mM NaCl, 1 mM MgCl 2, 0,5 mM TCEP, 0,005 % P20, pH 7,5 vor und leiten Sie ihn durch eine 0,2-μm-Filtereinheit.
- Entfernen Sie 20 ml Puffer und füllen Sie 20 ml 100 % DMSO (2 % DMSO im letzten Laufpuffer) nach. Es ist wichtig, DMSO in allen unten beschriebenen Proben bei 2 % zu halten (Schritte 3.3, 3.4 und 3.5).
- Aktivieren Sie den SA-Chip gemäß dem Protokoll des Herstellers und immobilisieren Sie CRBN auf ~800 RU.
- Verbindungen werden in 3-facher serieller Verdünnung von 6 pt auf einer 384-Well-Platte mit einer Höchstkonzentration von 30 μM hergestellt, wie in Abschnitt 3.1.3 beschrieben.
- SPR mit dem Multi-Cycle-Setup ausführen: Modus: Hochleistungs, Kontaktzeit: 60 s, Dissoziationszeit: 90 s; Durchflussrate: 50 μL/min. Für dieses System reichen drei Pufferinjektionen aus, um einen stabilen Hintergrund zu erhalten. Bei anderen Assay-Systemen kann es erforderlich sein, zusätzliche Pufferinjektionen durchzuführen.
- Führen Sie eine Datenanalyse mit der Software des Herstellers durch.
ANMERKUNG: Die stationäre Analyse zeigt, dass KD von BRD-2512 und BRD-5110 beide bei etwa 3 μM liegt. Die Bindung erreichte jedoch nur ~ 70% Rmax Bindung bei der höchsten Konzentration. Sowohl die schwache Affinität als auch die Form des Sensorgramms deuten darauf hin, dass es bei hohen Konzentrationen wahrscheinlich zu einer Unlöslichkeit der Verbindung kommt. Somit könnte das tatsächliche KD höher als 3 μM sein. BRD-4761, das nicht an CRBN bindet, wurde als Negativkontrolle eingeschlossen.
- Vorbereitung der Puffer.
- SPR für PPM1D- und niedermolekulare Wechselwirkungen
- Bereiten Sie den Puffer wie in Schritt 3.3.1 beschrieben vor. Verwenden Sie einen Sensorchip für Nitriloessigsäure (NTA).
- Wenden Sie den Einzelzyklus an, da der PPM1D-Gefechtskopf ein langsames kan und k aus hat. Regenerieren Sie den NTA-Chip mit dem Standard-Setup des Herstellers und immobilisieren Sie PPM1D nach jeder Verbindungsinjektion auf ~ 1000 RU (Proteinlösung von 5 μg/ml bei 5 μl/min injizieren).
- Verbindungen werden in 3-facher 5-Punkt-Serienverdünnung mit der höchsten Konzentration bei 400 nM hergestellt, wie in Abschnitt 3.1.3 beschrieben.
- Führen Sie SPR mit dem Single-Cycle-Setup aus: Modus: Hochleistungsmodus; Einwirkzeit: 90 s; Dissoziationszeit: 600 s; Durchflussrate: 50 μL/min. Tragen Sie vor jeder Verbindung drei Injektionen Puffer auf, um einen stabilen Hintergrund zu gewährleisten.
- Datenanalyse. Wenden Sie die dritte Injektion des Puffers als Hintergrund für die Subtraktion an. Als Negativkontrolle zeigt BRD-2512 keine Bindung an PPM1D. Für BRD-4761 und BRD-5110 zeigte die kinetische Anpassung an, dass die KD für beide 1-2 nM beträgt.
- SPR für CRBN:PROTAC: Ternärer PPM1D-Komplex
- Bereiten Sie den Puffer wie in Schritt 3.3.1 beschrieben vor.
- Aktivieren Sie den SA-Chip gemäß dem Protokoll des Herstellers und immobilisieren Sie CRBN auf ~35 RU (injizieren Sie eine Proteinlösung von 0,5 μg/ml bei 5 μl/min).
- Drei Verbindungen werden in 3-facher 6-Punkt-Serienverdünnung mit einer Höchstkonzentration von 30 μM hergestellt, während [PPM1D] in allen Proben, einschließlich Leerproben, unter Verwendung der in Schritt 3.2.3 beschriebenen Methode bei 1 μM gehalten wird.
- Führen Sie SPR mit dem Multi-Cycle-Setup aus: Modus: High-Performance; Kontaktzeit: 60 s; Dissoziationszeit: 90 s; Durchflussrate: 50 μL/min.
- Führen Sie eine Datenanalyse mit der Software des Herstellers durch.
HINWEIS: Während BRD-2512 und BRD-4761 keine/vernachlässigbare Reaktion zeigen, zeigt BRD-5110 deutlich den "Hook-Effekt" im stationären Zustand mit schneller Ein-/Aus-Kinetik (Abbildung 5A-C). Die experimentelle Bindungsantwort von BRD-5110 (Abbildung 5C) liegt zwischen der vorhergesagten Antwort aus der Simulation, wenn angenommen wird, dass K D (CRBN, cpd) 3 oder 10 μM beträgt (Abbildung 5E), was darauf hindeutet, dass das ternäre KD und das binäre K D sehr ähnlich sind. Es gibt keine offensichtliche Kooperativität von PPM1D: BRD-5110: CRBN-Komplexbildung.
Ergebnisse
Die Charakterisierung des binären VHL:MZ1-Komplexes und des ternären VHL:MZ1:Brd4-BD2-Komplexes ist in Abbildung 2 (ITC), Abbildung 3 (BLI) und Abbildung 4 (SPR) unter Verwendung eines sehr ähnlichen Puffers zu finden. Die aus orthogonalen Assays extrahiertenK-D-Werte sind konsistent. Die Kooperativität kann durch K D (binär) / KD (ternär) berechnet werden, was sehr positiv ist (15 von ITC oder 26 von SPR).
Die Charakterisierung des CRBN:PROTAC:PPM1D-Systems wurde mittels SPR durchgeführt (Abbildung 5A-D). CRBN wurde auf ~35 RU's immobilisiert, um die Beobachtung der ternären Komplexbildung zu erleichtern. Allein die Bindung von PROTAC führte zu einem Signal von <2 RUs, das unter dem Rauschen liegt. PPM1D im Analyten liefert ein hohes Hintergrundsignal auf der SA-Chipoberfläche, und die höchste Konzentration, die angewendet werden kann, liegt bei etwa 1 μM. Dieser Wert ist niedriger als der K D zwischen CRBN und seinem Gefechtskopf ≥3 μM), so dassein "Hakeneffekt" zu erwarten ist. SPR ist empfindlich genug, um es zu detektieren, was eine gute Übereinstimmung mit der Simulation aufweist (Abbildung 5E). Die Simulation wurde unter Verwendung der nicht-kooperativen Gleichgewichte in Literatur19 in Kombination mit der klassischen SPR-Berechnung [Response max = (ResponseLigand × MassImmobilization)/MassLigand] durchgeführt. Da das K D zwischen CRBN und Verbindung aufgrund der Unlöslichkeit der Verbindung bei hoher Konzentration nicht genau bestimmt wird, wurde dieSimulation mit vier angenommenen KDs durchgeführt: 1 μM, 3 μM, 10 μM oder 30 μM. Die experimentellen Ergebnisse lagen zwischen den simulierten 3 μM- und 10 μM-Kurven, was fast identisch mit derK-D-Kurve im Doppelsternsystem ist, was darauf hindeutet, dass es keine Kooperativität gibt.

Abbildung 1: Darstellung von drei Bindungsszenarien und Definition verschiedener KD's. (A) Klassische Zweikomponentensysteme. (B) Drei-Komponenten-System, in dem ein Ende von PROTAC gesättigt werden kann, so dass es als Zwei-Komponenten-System bewertet werden kann. (C) Drei-Komponenten-System, bei dem der "Hakeneffekt" beobachtet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: ITC-Ergebnisse. Titration von VHL in MZ1 (links) oder MZ1:Brd4BD2-Komplex (rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: BLI-Ergebnisse. MZ1 vermittelt die Bildung des ternären VHL-Komplexes MZ1: Brd4BD2. (A) Rohdaten. (B) Subtraktion von Hintergrundsignalen, wobei [MZ1] = 0 ist. (C) Kinetische Anpassung von B an die Extraktion von k on, koff und KD. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: SPR-Ergebnisse. (A) MZ1-Bindung an VHL. (B) MZ1:Brd4BD2 binärer Komplex, der an VHL biniert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
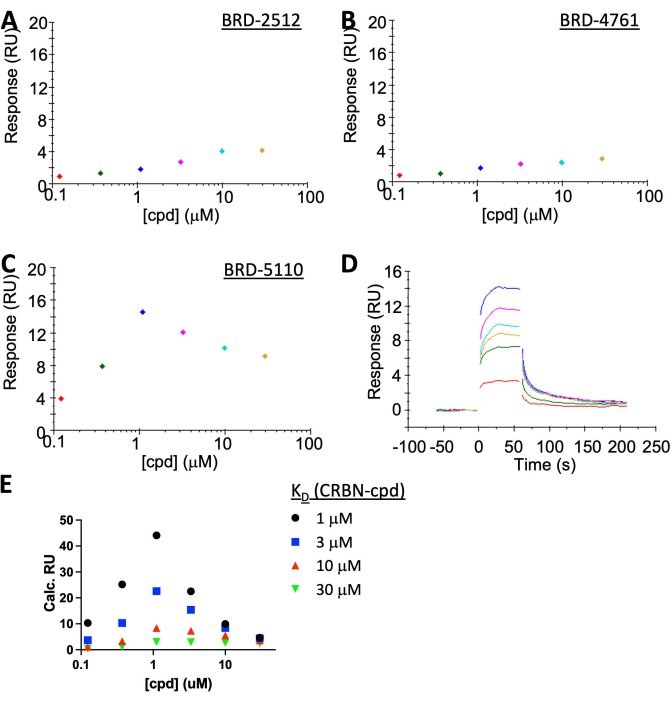
Abbildung 5: SPR-Ergebnisse, die den "Hook-Effekt" eines repräsentativen PPM1D-PROTAC zeigen. CRBN wurde auf der SA-Chip-Oberfläche immobilisiert, während [PPM1D] in allen Fällen bei 1 μM im Analyten gehalten wurde. (A) BRD-2512, eine Verbindung, die nur an CRBN bindet, reagiert fast nicht. (B) BRD-4761, eine Verbindung, die nur an PPM1D bindet, reagiert ebenfalls nicht. (C,D) BRD-5110, ein PROTAC mit dem Sprengkopf von CRBN in BRD-2512 und dem Gefechtskopf von PPM1D in BRD-4761, induzierte die Bildung des ternären Komplexes. (E) Eine Simulation der SPR-Ergebnisse unter der Annahme, dass der KD zwischen CRBN und Verbindung 1 μM (schwarz), 3 μM (blau), 10 μM (rot) oder 30 μM (grün) beträgt. Die BRD-2512-Kurve liegt zwischen 3 μM und 10 μM, was sehr nahe am gemessenen binären KD liegt, was auf keine Kooperativität hindeutet (Kooperativität = 1). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die biophysikalische Charakterisierung der binären und ternären Wechselwirkungen zwischen PROTAC-Molekülen und ihren Proteinbindungspartnern kann einzigartige und komplementäre Einblicke in weit verbreitete zelluläre Systeme liefern. Das Verständnis der Affinität zwischen den einzelnen Sprengköpfen eines PROTAC-Moleküls und seinen Proteinbindungspartnern kann dazu beitragen, die Bemühungen der medizinischen Chemie zur Optimierung dieser Wechselwirkungen zu lenken. Zuvor veröffentlichte Kristallstrukturen ternärer PROTAC-Komplexe haben gezeigt, dass Atome in der Linkerregion Wechselwirkungen mit einem oder beiden Proteinbindungspartnern eingehen können16,20. Die experimentelle Bestimmung der Kooperativität der ternären Komplexbildung kann die Linkeroptimierung unterstützen.
In diesem Bericht wird der Einsatz von drei verschiedenen biophysikalischen Techniken beschrieben, die Informationen über die Bindungsaffinitäten zwischen PROTAC-Molekülen und ihren Proteinbindungspartnern liefern können. Methode 1 beschreibt den Versuchsaufbau der isothermen Titrationskalorimetrie (ITC) für das PROTAC-Molekül MZ1, den VHL-E3-Ligasekomplex und die Brd4-BD2-Bromodomäne. Die ITC-Ergebnisse zeigten KD's von 59 nM für die binäre Wechselwirkung zwischen MZ1 und VHL und 4 nM für die ternäre Wechselwirkung zwischen VHL und vorgemischtem MZ1 und Brd4BD2. Die Affinitäten stimmten mit denen überein, die in SPR (immobilisierte VHL-Bindung an MZ1 KD = 26 nM, immobilisierte VHL-Bindung an vorgemischte MZ1 und Brd4BD2 K D=1 nM) und BLI (KD= 2,8 nM) beobachtet wurden. Während die ITC KD-Ergebnisse für die VHL-Bindung an MZ1 mit den berichteten Werten16 übereinstimmen, ist die erhaltene Stöchiometrie anders. Eine mögliche Erklärung für dieses Ergebnis ist die schlechte Löslichkeit von MZ1 in dem HEPES-basierten Puffer, der in dem hier beschriebenen Protokoll verwendet wird, während die Ergebnisse aus der Literatur mit einem Bis-tris-basierten Puffer generiert wurden. Die Autoren zogen es vor, die gleichen Pufferkomponenten für SPR, ITC und BLI zu verwenden.
Methode 2 beschreibt den Versuchsaufbau für die BLI-Analyse der Wechselwirkung von immobilisiertem VHL, einer festen Konzentration von Brd4BD2 und variierenden Konzentrationen von MZ1. Aufgrund der Empfindlichkeitsbeschränkungen der Technik konnten KD-, kon- und koff-Werte für die ternäre Komplexbildung generiert werden, jedoch nicht für die binäre Wechselwirkung zwischen MZ1 und den Proteinen.
Methode 3 beschreibt mehrere SPR-Assays. SPR ist empfindlicher als BLI und kann angewendet werden, um sowohl die Protein-Kleinmolekül-Wechselwirkungen (binär) als auch Protein-Protein-Wechselwirkungen (ternär) zu beobachten. Im letzteren Fall sollten Hintergrundsignale sorgfältig überwacht werden, da das Protein im Analyten hohe und instabile Signale geben kann. SPR reagiert sehr empfindlich auf Reagenzien mit hohem Brechungsindex, einschließlich DMSO, Glycerin und Detergenzien. Wenn das Protein in dem Puffer gelagert wird, der Glycerin oder Detergens enthält, muss der laufende Puffer übereinstimmende Konzentrationen dieser Komponenten enthalten. Alternativ werden sie durch die Anwendung der Größenausschlusschromatographie vor jedem SPR-Experiment vollständig entfernt. Es sollte darauf geachtet werden, dass die DMSO-Konzentrationen zwischen Puffer- und Analytproben genau übereinstimmen. Die DMSO-Lösemittelkorrekturen werden nach den Anweisungen des Herstellers durchgeführt.
Die Methode in Schritt 3.1 beschreibt den SPR-Assay für die binäre VHL-MZ1-Wechselwirkung. Methode 3.2 beschreibt den SPR-Assay für den ternären VHL: MZ1: Brd4 BD2-Komplex, bei dem VHL immobilisiert ist und der Analyt entweder Brd4 BD2 allein oder der MZ1:Brd4BD2-Komplex ist. In diesem System ist die Wechselwirkung zwischen Brd4BD2 und VHL vernachlässigbar. Die ternäre Komplexbildung ist hochgradig kooperativ (ɑ = 26). Die Off-Rate für die ternäre Komplexbildung beträgt 0,014 s-1, was die Verwendung von Single-Cycle-Kinetik erfordert. Die Ergebnisse der ITC zeigen auch eine hochgradig kooperative ternäre Komplexbildung (ɑ=15). SPR-Methoden in den Schritten 3.3, 3.4 und 3.5 beschreiben Assays zur Bewertung der Bildung eines Komplexes zwischen CRBN und PPM1D, der durch die Anwesenheit eines PROTAC-Moleküls, BRD-5110, induziert wird. Das PROTAC-Molekül hat eine schwache Affinität zu CRBN (K D ~3 μM) und eine starke Affinität zu PPM1D (KD = 1-2 nM). Infolgedessen ist die schwache Bindung an CRBN nicht gesättigt und führt zu einem beobachteten "Hook-Effekt". Während es möglich ist, die Ligandenlöslichkeit durch Erhöhung der DMSO-Konzentration zu erhöhen, die im Experiment verwendet wird, ist es in diesen Fällen wichtig, die Proteinstabilität, die durch hohe DMSO-Konzentrationen negativ beeinflusst werden kann, sorgfältig zu überwachen. Darüber hinaus hat DMSO eine hohe Auflösungswärme, die die Bindungswärme von Liganden an Protein verschleiern kann. Es sollte darauf geachtet werden, dass die DMSO-Konzentrationen der Lösung in der Spritze und der Lösung in der Zelle übereinstimmen. Die Autoren empfehlen die Dialyse der beiden Lösungen gegen das gleiche Pufferpräparat.
Basierend auf den hier durchgeführten und berichteten Experimenten werden allgemeine Empfehlungen und Richtlinien gegeben. Wenn die Affinitäten binärer Wechselwirkungen zwischen PROTAC-Molekülen und ihren Proteinbindungspartnern stark sind (KD <1 μM), liefert SPR zuverlässige und reproduzierbare Affinitäten sowie wertvolle Informationen über die Kooperativität der ternären Komplexbildung. Wenn die Affinitäten der binären Wechselwirkung zwischen einem der Proteinbindungspartner und dem PROTAC-Molekül schwach sind (KD >1 μM), muss der Assay-Aufbau modifiziert werden. In diesen Fällen kann der Einsatz molekularer Simulationen, bei denen die Bindungskonstanten festgelegt und die Konzentrationen von Liganden und Analyten variiert werden, für das Assay-Design und die Interpretation experimenteller Ergebnisse wertvoll sein. ITC-Assays liefern wichtige Informationen über die Stöchiometrie der Bindung, benötigen aber im Vergleich zu SPR und BLI deutlich mehr Protein- und Verbindungsreagenzien. Darüber hinaus kann die Löslichkeit des PROTAC-Moleküls für ITC-Experimente einschränkend sein. BLI hat einen höheren Durchsatz als ITC und benötigt weniger Protein- und Verbindungsreagenzien. Aufgrund von Empfindlichkeitsbeschränkungen kann BLI jedoch nur zur Beurteilung der ternären Komplexbildung und nicht zur Beurteilung binärer Wechselwirkungen zwischen PROTAC-Molekülen und ihren Proteinbindungspartnern verwendet werden. Es wird empfohlen, SPR für Routinetests von binären und ternären PROTAC-Bindungsassays sowie BLI- und ITC-Assays für die orthogonale Validierung von SPR-Ergebnissen zu verwenden.
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte.
Danksagungen
Diese Arbeit wurde durch einen Innovations- und Technologieentwicklungspreis des Center for the Development of Therapeutics am Broad Institute of MIT und Harvard unterstützt. Die Autoren danken den Mitgliedern des Senior Leadership Teams und des Review-Komitees für ihre Unterstützung dieser Arbeit.
Materialien
| Name | Company | Catalog Number | Comments |
| 96-plate | Greiner | 655076 | flat-bottom, black plates used In BLI experiments |
| 96-well plate | Nunc | 73520-120 | Plate use for ITC sample preparation |
| 96-well plate | Greiner | 650101 | Plate used to prepare samples for SPR experiments |
| Auto iTC200 micro-calorimeter | Malvern Panalytical | Instrument used to perform ITC experiments. Product discontinued. | |
| Biacore S200 | Cytiva | 29136649 | Instrument used to perform SPR experiments |
| MZ1 | ProbeChem | PC-60099 | PROTAC that binds to VHL and Brd4BD2 |
| NTA sensor chip | Cytiva | BR100532 | SPR chip used to perform SPR experiments involving PPM1D |
| Octet Red-384 | Sartorius | Instrument used to perform BLI experiments. Product discontinued. | |
| Plate cover | Malvern | PQA0001 | Cover for Nunc 96-well plate (73520-120) |
| Plate cover | Cytiva | 28975816 | Plate cover for Greiner plate (650101) |
| Series S SA sensor chip | Cytiva | BR100531 | SPR chip used to perform SPR experiments involving MZ1:VHL:BRD4 |
| Streptavidin (SA) Dip and Read Biosensors | Sartorius | 18-509 | Coated sensors used in BLI experiments |
Referenzen
- Balaji, V., Hoppe, T. Regulation of E3 ubiquitin ligases by homotypic and heterotypic assembly. F1000Research. 9, (2020).
- Song, L., Luo, Z. -. Q. Post-translational regulation of ubiquitin signaling. Journal of Cell Biology. 218 (6), 1776-1786 (2019).
- Yang, Q., Zhao, J., Chen, D., Wang, Y. E3 ubiquitin ligases: styles, structures and functions. Molecular Biomedicine. 2 (1), 23 (2021).
- Grice, G. L., Nathan, J. A. The recognition of ubiquitinated proteins by the proteasome. Cellular and Molecular Life Sciences: CMLS. 73 (18), 3497-3506 (2016).
- Chirnomas, D., Hornberger, K. R., Crews, C. M. Protein degraders enter the clinic - a new approach to cancer therapy. Nature Reviews Clinical Oncology. 20 (4), 265-278 (2023).
- Toure, M., Crews, C. M. Small-molecule PROTACS: New approaches to protein degradation. Angewandte Chemie (International ed. In English). 55 (6), 1966-1973 (2016).
- Ottis, P., Toure, M., Cromm, P. M., Ko, E., Gustafson, J. L., Crews, C. M. Assessing different E3 ligases for small molecule induced protein ubiquitination and degradation. ACS Chemical Biology. 12 (10), 2570-2578 (2017).
- Riching, K. M., et al. Quantitative live-cell kinetic degradation and mechanistic profiling of PROTAC mode of action. ACS Chemical Biology. 13 (9), 2758-2770 (2018).
- Nabet, B., et al. The dTAG system for immediate and target-specific protein degradation. Nature Chemical Biology. 14 (5), 431-441 (2018).
- Paiva, S. -. L., Crews, C. M. Targeted protein degradation: elements of PROTAC design. Current Opinion in Chemical Biology. 50, 111-119 (2019).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annual Review of Biochemistry. 67, 425-479 (1998).
- Chan, K. -. H., Zengerle, M., Testa, A., Ciulli, A. Impact of target warhead and linkage vector on inducing protein degradation: Comparison of bromodomain and extra-terminal (BET) degraders derived from triazolodiazepine (JQ1) and tetrahydroquinoline (I-BET726) BET inhibitor scaffolds. Journal of Medicinal Chemistry. 61 (2), 504-513 (2018).
- Roy, M. J., et al. SPR-measured dissociation kinetics of PROTAC ternary complexes influence target degradation rate. ACS Chemical Biology. 14 (3), 361-368 (2019).
- Pierce, N. W., Kleiger, G., Shan, S., Deshaies, R. J. Detection of sequential polyubiquitylation on a millisecond timescale. Nature. 462 (7273), 615-619 (2009).
- Gadd, M. S., et al. Structural basis of PROTAC cooperative recognition for selective protein degradation. Nature Chemical Biology. 13 (5), 514-521 (2017).
- Nahta, R., Castellino, R. C. Phosphatase magnesium-dependent 1 δ (PPM1D), serine/threonine protein phosphatase and novel pharmacological target in cancer. Biochemical Pharmacology. 184, 114362 (2021).
- Douglass, E. F., Miller, C. J., Sparer, G., Shapiro, H., Spiegel, D. A. A comprehensive mathematical model for three-body binding equilibria. Journal of the American Chemical Society. 135 (16), 6092-6099 (2013).
- Zorba, A., et al. Delineating the role of cooperativity in the design of potent PROTACs for BTK. Proceedings of the National Academy of Sciences. 115 (31), E7285-E7292 (2018).
- Fairhead, M., Howarth, M. Site-specific biotinylation of purified proteins using BirA. Methods in Molecular Biology. 1266, 171-184 (2015).
- Nowak, R. P., et al. Plasticity in binding confers selectivity in ligand-induced protein degradation. Nature Chemical Biology. 14 (7), 706-714 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten