Method Article
تطوير وتطبيق المقايسات الفيزيائية الحيوية لتقييم تكوين المركب الثلاثي الناجم عن التحلل البروتيني الذي يستهدف الوهم (PROTACS)
In This Article
Summary
هنا نصف بروتوكولات التوصيف الفيزيائي الحيوي للتكوين المركب الثلاثي الناجم عن التحلل البروتيني الذي يستهدف الوهم (PROTACS) الذي يتضمن أربطة يوبيكويتين فون هيبل-لينداو E3 ligase (VHL) و Cereblon (CRBN). تشمل الطرق الفيزيائية الحيوية الموضحة هنا رنين البلازمون السطحي (SPR) ، وقياس تداخل الطبقة الحيوية (BLI) ، وقياس كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة (ITC).
Abstract
يمكن حث الأربطة والبروتينات E3 المستهدفة للتحلل على تكوين معقدات بواسطة جزيئات غير متجانسة وظيفية في عملية متعددة الخطوات. تساهم الحركية والديناميكا الحرارية للتفاعلات المعنية في كفاءة الوجود في كل مكان وما ينتج عنه من تدهور البروتين. توفر التقنيات الفيزيائية الحيوية مثل رنين البلازمون السطحي (SPR) وقياس التداخل الحيوي (BLI) وقياس كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة (ITC) معلومات قيمة يمكن استخدامها في تحسين تلك التفاعلات. باستخدام نظامين نموذجيين ، تم إنشاء مجموعة أدوات الفحص البيوفيزيائي لفهم تعاونية تكوين المعقد الثلاثي وتأثير "تأثير الخطاف" على حركية الربط. في إحدى الحالات ، تم تقييم التحلل البروتيني الذي يستهدف جزيء الوهم (PROTAC) الذي تسبب في تكوين معقد ثلاثي بين Brd4BD2 و VHL. يحتوي الجزيء غير المتجانس ، MZ1 ، على صلات نانومتر لكل من بروتين Brd4BD2 (SPR K D = 1 نانومتر ، ITC K D = 4 نانومتر) ومجمع VHL (SPR K D = 29 نانومتر ، ITC K D = 66 نانومتر). بالنسبة لهذا النظام ، تم تطوير فحوصات SPR و BLI و ITC القوية التي أعادت إنتاج النتائج المنشورة التي توضح تعاونية التكوين المعقد الثلاثي. في الحالة الأخرى ، تمت دراسة جزيء تسبب في مجمعات ثلاثية بين بروتين 46.0 كيلو دالتون ، PPM1D ، والمخ [CRBN (319-442)]. يحتوي الجزيء غير المتجانس الوظيفي ، BRD-5110 ، على SPR K D = 1 نانومتر ل PPM1D ولكنه أضعف بكثير ضد مركب CRBN (319-442) المقطوع (SPR KD = ~ 3 μM). في هذه الحالة ، لم يكن ربط CRBN في SPR مشبعا ، مما أدى إلى "تأثير الخطاف". وجرى تقييم متطلبات الإنتاجية والكواشف لاحتياطي البترول الاستراتيجي ومعهد بلي والمركز الدولي للاتصالات، وقدمت توصيات عامة لتطبيقها على مشاريع البرنامج الاستشاري لتكنولوجيا المعلومات والاتصالات.
Introduction
إن polyubiquitination للبروتينات في الخلية هي عملية منظمة بإحكام تتضمن إنزيمات في عائلة Ubiquitin Ligase 1,2. الإنزيمات الطرفية في المسار هي أربطة يوبيكويتين E3 التي تربط تساهميا جزيئات يوبيكويتين بشركائها المرتبطين بالبروتين3. إن تعدد الوجود في كل مكان لشركاء ربط البروتين هؤلاء يستهدفهم للتحلل البروتيني بواسطة البروتيازوم4. هذا النظام هو جزء من عملية توازن البروتين التي تم الاستفادة منها علاجيا للحث على تدهور البروتينات المشاركة في المرض5. تتكون الجزيئات الصغيرة التي تحفز التفاعل بين أربطة يوبيكويتين E3 ، مثل Von Hippel-Lindau E3 ligase (VHL) أو cereblon (CRBN) ، عادة من رأس حربي ملزم ب E3 ligase متصل بواسطة رابط مرن برأس حربي يرتبط بالبروتين المستهدف للتحلل. يشار إلى هذه الجزيئات غير المتجانسة الوظيفية عادة باسم التحلل البروتيني الذي يستهدف الوهم أو PROTACS6.
يتضمن تطوير PROTACS تقييم قدرة الجزيئات على تحفيز تدهور البروتينات في الخلايا. تم تطوير العديد من أنظمة الفحص الخلوي التي تراقب التفاعل المستحث بين البروتين المستهدف ومكونات E3 ligase ، مثل VHL أو CRBN ، عند معالجة الخلايا بجزيء PROTAC. أحد هذه المقايسات الخلوية ، نظام nanoluc-Halotag7 ، يتضمن إنزيم ربط E3 مدمج في مستقبل Halotag وبروتين مستهدف موسوم بمانح نانولوك. يؤدي التكوين المركب الثلاثي إلى تقريب مانح nanoluc ومستقبل Halotag مما يسمح بنقل الطاقة من المتبرع إلى المستقبل مما يؤدي إلى انبعاث الضوء. يمكن استخدام الاختلافات في هذا النظام لتقييم النفاذية الخلوية لجزيئات PROTACS8 أو التغيرات في المستوى النسبي لانتشار البروتين المستهدففي كل مكان 9. في حين أن هذه الأنظمة الخلوية ضرورية لدفع تحسين PROTACS ، فإن تكوين المجمعات بين أربطة E3 والبروتينات المستهدفة للتحلل هو عملية متعددة الخطوات10,11. تساهم الحركية والديناميكا الحرارية للتفاعلات الثنائية والثلاثية المعنية في انتشار الكفاءة في كل مكان وما ينتج عنه من تدهور البروتين12،13،14.
فيما يلي وصف للبروتوكولات التي يمكن تكييفها للتوصيف الفيزيائي الحيوي للتكوين المركب الثلاثي الناجم عن PROTACS باستخدام رنين البلازمون السطحي (SPR) وقياس تداخل الطبقة الحيوية (BLI) وقياس كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة (ITC). تمكنت بروتوكولات SPR و ITC لجزيء MZ1 PROTAC الذي يحفز تكوين معقد ثلاثي بين Brd4BD2 و VHL المستمدة من تقارير الأدبيات13,15 والموضحة هنا من تلخيص النتائج المبلغ عنها مع بعض التعديلات على الإجراءات المبلغ عنها ، والتي سيتم مناقشتها. يتم تضمين وصف لمقايسة BLI المستخدمة لتقييم تكوين المعقد الثلاثي بين MZI و Brd4BD2 و VHL في هذا التقرير. كانت قياسات التقارب من BLI متسقة مع تلك التي لوحظت في SPR و ITC. بروتوكول منشور سابقا تم فيه تطوير اختبار SPR لتقييم تكوين المعقد الثلاثي الناجم عن PROTAC بين PPM1D ، وهو بروتين الفوسفاتيز Ser / Thr الذي يتم تحفيز تعبيره بطريقة تعتمد على p5316 ، و CRBN موصوف أيضا. في هذه الحالة ، يحتوي جزيء PROTAC على تقارب نانوي ل PPM1D ولكن فقط تقارب ميكرومولار ل CRBN. في هذه الحالة ، يكون ارتباط جزيء PROTAC ب CRBN غير مشبع ، مما يؤدي إلى "تأثير الخطاف" الشائع الملاحظ. تأثير الخطاف هو خاصية لثلاثة أنظمة جسم يوجد فيها نوعان يمكن أن يشكلان معقدا غير متجانس عندما يكون كلاهما مرتبطا بجزيء جسر (الشكل 1)17. لوحظ تأثير الخطاف عندما يكون نوع الجسور في تركيز زائد بالنسبة للنوعين الآخرين. الحالة الناتجة هي الحالة التي تتفوق فيها التفاعلات الثنائية على التفاعلات الثلاثية. تتطلب الأنظمة التي لوحظ فيها تأثير الخطاف اعتبارات تصميم تجريبية محددة تمت مناقشتها في هذا التقرير. يتم توفير المفاهيم العامة ومتطلبات الكواشف لتقييم استخدام المقايسات الفيزيائية الحيوية لتقييم تكوين المعقد الثلاثي الناجم عن PROTAC.
Protocol
تم التعبير عن جميع البروتينات بشكل مفرط في E.coli مع إنتاجية جيدة ونقاء (>80٪) باتباع بروتوكولات الأدبيات18. تم إجراء البيوتينيل باستخدام تفاعل محفز BirA18. تم تحضير جميع الجزيئات الصغيرة في محاليل مخزون 1 مللي متر في DMSO بنسبة 100٪. لا تتطلب الإجراءات الموضحة هنا معدات أو احتياطات متخصصة لسلامة المختبرات. يجب استخدام معدات الحماية الشخصية القياسية للمختبرات (PPE) (مثل معطف المختبر ونظارات السلامة والقفازات).
البروتينات المطبقة في هذه الدراسة مذكورة أدناه:
VHL: مركب VHL (53-213) / ElonginB (1-104) / ElonginC (17-112) مع علامة Avi في المحطة C ل ElonginB.
Brd4BD2: غير موسومة Brd4BD2 (333-460)
CRBN: البيوتينيل CRBN (319-442) مع علامة Avi في المحطة N
PPM1D: PPM1D غير موسومة أو مزدوجة His8 (1-420) في المحطة N
الجزيئات الصغيرة المطبقة في هذه الدراسة مذكورة أدناه:
MZ1 (MW = 1002.6 Da): PROTAC الذي يرتبط ب VHL و Brd4BD2
BRD-2512 (MW = 841.4 Da): CRBN KD ~ 3 μM ، لا يرتبط ب PPM1D
BRD-5110 (MW = 872.0 Da): CRBN K D ~ 3 μM ، PPM1D KD = 1-2 نانومتر
BRD-4761 (MW = 476.6 Da): لا يرتبط ب CRBN ، PPM1D KD = 1-2 نانومتر
1. الطريقة الأولى: ITC (كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة)
ملاحظة: يتم إجراء المعايرات باستخدام مسعر دقيق مع حقن تلقائي.
- تحضير المخزن المؤقت: تحضير 3 لتر من المخزن المؤقت الذي يحتوي على 20 مللي متر HEPES ، 150 مللي متر كلوريد الصوديوم ، 1 مللي متر TCEP ، درجة الحموضة 7.5.
- غسيل الكلى: غسيل الكلى VHL و Brd4BD2 (~ 500 ميكرولتر عند 150 ميكرومتر لكل منهما) مقابل 1 لتر من المخزن المؤقت المحضر في الخطوة 1.1 ، 3 مرات عند 4 درجات مئوية ، لمدة 4 ساعات ، 2 ساعة ، وحوالي 16 ساعة ، على التوالي. احفظ المخزن المؤقت بعد آخر غسيل كلوي لاستخدامه في الخطوات اللاحقة.
- تحضير العينات على لوحة 96 بئر مع غطاء بلاستيكي.
- لكل معايرة ، قم بإعداد 400 ميكرولتر من المحلول للخلية ، و 125 ميكرولتر للمحقنة ، و 400 ميكرولتر من المخزن المؤقت للتنظيف. أضف عينات إلى ثلاثة آبار متتالية على اللوحة. نظرا لأن المخزون المركب يتم تحضيره عند 1 mM في DMSO بنسبة 100٪ ، أضف نفس النسبة المئوية من DMSO إلى محاليل البروتين لضمان مطابقة المخزن المؤقت في الخلية والمحقنة. أضف 2٪ DMSO إلى الحلول النهائية.
- عينة لمعايرة VHL إلى MZ1: تحضير محلول خلوي يحتوي على 392 ميكرولتر من المخزن المؤقت ، و 4 ميكرولتر من MZ1 عند 1 mM (تركيز نهائي 10 ميكرومتر) ، و 4 ميكرولتر من DMSO بنسبة 100٪. تحضير محلول حقنة يحتوي على 122.5 ميكرولتر من VHL عند 85.7 ميكرومتر ، 2.5 ميكرولتر من 100٪ DMSO (تركيز نهائي 84 ميكرومتر).
- عينات لمعايرة VHL في المخزن المؤقت (سيتم استخدام البيانات لطرح الخلفية للبيانات المولدة من العينة 1.3.1.1): تحضير محلول خلوي يحتوي على 392 ميكرولتر عازلة ، 8 ميكرولتر 100٪ DMSO. تحضير محلول حقنة يحتوي على 122.5 ميكرولتر من VHL عند 85.7 ميكرومتر ، (تركيز نهائي 84 ميكرومتر) وإضافة 2.5 ميكرولتر من 100٪ DMSO.
- عينات لمعايرة VHL إلى MZ1 و Brd4 BD2: تحضير محلول خلوي يحتوي على 392 ميكرولتر من 17.1 ميكرومتر Brd4BD2 (تركيز نهائي 16.8 ميكرومتر) ، 3.36 ميكرولتر من MZ1 عند 1 mM (تركيز نهائي 8.4 ميكرومتر) ، و 4.64 ميكرولتر من DMSO بنسبة 100٪. تحضير محلول حقنة يحتوي على 122.5 ميكرولتر من VHL عند 85.7 ميكرومتر (تركيز نهائي 84 ميكرومتر) و 2.5 ميكرولتر من 100٪ DMSO.
- عينات لمعايرة VHL إلى Brd4 BD2 (خلفية 1.3.1.3): تحضير محلول خلوي يحتوي على 392 ميكرولتر من 17.1 ميكرومتر Brd4BD2 (تركيز نهائي 16.8 ميكرومتر) و 8 ميكرولتر من DMSO بنسبة 100٪. تحضير محلول حقنة يحتوي على 122.5 ميكرولتر من VHL عند 85.7 ميكرومتر (تركيز نهائي 84 ميكرومتر) و 2.5 ميكرولتر من 100٪ DMSO.
- لكل معايرة ، قم بإعداد 400 ميكرولتر من المحلول للخلية ، و 125 ميكرولتر للمحقنة ، و 400 ميكرولتر من المخزن المؤقت للتنظيف. أضف عينات إلى ثلاثة آبار متتالية على اللوحة. نظرا لأن المخزون المركب يتم تحضيره عند 1 mM في DMSO بنسبة 100٪ ، أضف نفس النسبة المئوية من DMSO إلى محاليل البروتين لضمان مطابقة المخزن المؤقت في الخلية والمحقنة. أضف 2٪ DMSO إلى الحلول النهائية.
- قم بتشغيل جميع المعايرات الأربعة على المسعر الحراري الصغير. يتكون كل منها من 19 حقنة من محلول حقنة 2 ميكرولتر بمعدل 2 ميكرولتر / ثانية على فترات زمنية 120 ثانية. قم بإجراء حقنة أولية من البروتين (0.4 ميكرولتر) وتخلص منه أثناء تحليل البيانات. قم بإجراء جميع التجارب عند 25 درجة مئوية ، مع التحريك عند 600 دورة في الدقيقة.
- تحليل البيانات: قم بملاءمة البيانات مع نموذج موقع ربط واحد للحصول على القياس المتكافئ (n) ، وثابت التفكك (KD) ، والمحتوى الحراري للربط (ΔH) باستخدام برنامج التحليل الذي توفره الشركة المصنعة (الشكل 2).
2. الطريقة الثانية: BLI (قياس تداخل الطبقة الحيوية)
- قم بإجراء تجارب BLI باستخدام مستشعرات مغلفة بالستربتافيدين (SA) في درجة حرارة الغرفة (RT) بمعدل اكتساب 5 هرتز. أثناء تجربة BLI الآلية ، تأكد من أن المستشعرات ثابتة داخل عمود واحد وتتحرك بين أعمدة مختلفة من 96 بئرا ، قاع مسطح ، لوحة سوداء بحد أقصى لحجم البئر يبلغ 392 ميكرولتر. املأ كل بئر من اللوحة المستخدمة في التجربة ب 200 ميكرولتر من المحلول.
ملاحظة: BLI مفيد فقط للكشف عن تفاعلات البروتين والبروتين (أي تكوين مركب ثلاثي). إنه ليس حساسا بدرجة كافية لاكتشاف التفاعلات بين البروتينات والجزيئات الصغيرة.- تحضير المخزن المؤقت: تحضير 100 مل من المخزن المؤقت الذي يحتوي على 20 مللي مول HEPES ، 150 mM NaCl ، 1 mM TCEP ، 0.05٪ P20 ، درجة الحموضة 7.5.
- تحسين خطوة التثبيت: قم بتحميل مستشعر الاختبار إلى 1-3 نانومتر ، على النحو الموصى به من قبل الشركة المصنعة. يتم استخدام تحميل ~ 1.0 نانومتر للإجراءات الموضحة هنا. لتحقيق ذلك ، اغمس المستشعر في محلول يحتوي على VHL عند 1.5 ميكروغرام / مل لمدة 80 ثانية.
- قم بإجراء قياسات حركية BLI من خلال تطبيق سبعة مستشعرات SA باستخدام التسلسل التالي:
- بالنسبة لمرحلة خط الأساس الأولى ، اغمس في المخزن المؤقت لمدة 60 ثانية.
- بالنسبة لمرحلة التثبيت ، اغمس في محلول VHL عند 1.5 ميكروغرام / مل لمدة 80 ثانية.
- بالنسبة لمرحلة خط الأساس الثانية ، اغمس في المخزن المؤقت لمدة 60 ثانية.
- بالنسبة لمرحلة الارتباط ، اغمس في محلول تركيز ثابت من Brd4BD2 عند 2 ميكرومتر ، وتركيز ثابت من DMSO عند 2٪ ، وتركيزات متفاوتة من MZ1 عند 100 نانومتر ، 50 نانومتر ، 25 نانومتر ، 12.5 نانومتر ، 6.3 نانومتر ، 3.1 نانومتر ، و 0 نانومتر (مستشعر مرجعي) لمدة 300 ثانية.
- لمرحلة التفكك ، تراجع في المخزن المؤقت لمدة 600 ثانية.
- إجراء تحليل البيانات باستخدام برنامج الشركة المصنعة. تم الإبلاغ عن k on و k off و kd لتركيب البيانات (الشكل 3).
3. الطريقة الثالثة: SPR (رنين البلازمون السطحي)
ملاحظة: يتم إجراء جميع تجارب SPR باستخدام رقائق المستشعر المطلية بالستربتافيدين (SA) في RT. على الرغم من أن شريحة NTA تستخدم للكشف بين البروتين والجزيئات الصغيرة ، إلا أنه يجب استخدامها بحذر عند تطبيقها على المركب الثلاثي ، حيث يتم ملاحظة خلفية أعلى بكثير من شريحة SA ، ربما بسبب التفاعلات الكهروستاتيكية بين سطح الرقاقة المشحونة والبروتين في المادة المراد تحليلها.
- SPR للتفاعل VHL-MZ1
- إعداد العازلة.
- قم بإعداد مخزن مؤقت سعة 1 لتر يحتوي على 20 مللي متر HEPES ، 150 mM NaCl ، 1 mM TCEP ، 0.005٪ P20 ، pH7.5 ، وقم بتمريره عبر وحدة مرشح 0.2 ميكرومتر.
- قم بإزالة 20 مل من المخزن المؤقت للاستخدام المستقبلي (المخزن المؤقت الخالي من DMSO) وأعد تعبئته ب 20 مل من DMSO (2٪ DMSO في المخزن المؤقت النهائي قيد التشغيل). احتفظ ب DMSO عند 2٪ في جميع العينات الموضحة أدناه (الخطوتان 3.1 و 3.2)
- قم بتنشيط شريحة SA باتباع بروتوكول الشركة المصنعة وشل حركة VHL إلى ~ 2000 RU (حقن محلول بروتين 5 ميكروغرام / مل عند 5 ميكرولتر / دقيقة).
- قم بإعداد MZ1 في تخفيف تسلسلي من 3 أضعاف و 8 نقاط مع التركيز العلوي عند 10 ميكرومتر على 384 بئرا ، قاع مخروطي ، شفاف ، لوحة بولي بروبيلين بحد أقصى 130 ميكرولتر. قم بتغطية اللوحة برقائق بلاستيكية شفافة ذاتية اللصق متوافقة مع ألواح البولي بروبلين الدقيقة.
- قم بإعداد التركيز العلوي باستخدام المخزن المؤقت الخالي من DMSO لضمان 2٪ DMSO عند التركيز النهائي. إلى 147 ميكرولتر من المخزن المؤقت الخالي من DMSO ، أضف 1.5 ميكرولتر من مخزون MZ1 عند 1 mM و 1.5 μL من DMSO بنسبة 100٪.
- قم بإعداد التخفيف التسلسلي المكون من 3 أضعاف باستخدام المخزن المؤقت قيد التشغيل الذي يحتوي على 2٪ DMSO. إلى 100 ميكرولتر من المخزن المؤقت الجاري ، أضف 50 ميكرولتر من المحلول عند التركيز العلوي المحضر في الخطوة 3.1.3.1 ، واخلطه جيدا لتحضيرأعلى تركيز ثان.
- ثم انقل 50 ميكرولتر من المحلول المحضر في الخطوة 3.1.3.2 إلى 100 ميكرولتر التالية من المخزن المؤقت للتشغيل ، واخلطها جيدا لتحضيرأعلى تركيز ثالث ، وهكذا.
- قم بتشغيل SPR باستخدام الإعداد متعدد الدورات: الوضع: عالي الأداء ؛ وقت الاتصال: 120 ثانية ؛ وقت التفكك: 300 ثانية ؛ معدل التدفق: 50 ميكرولتر / دقيقة.
- قم بإجراء تحليل البيانات باستخدام برنامج التقييم الذي توفره الشركة المصنعة للأداة. أشار تحليل الحالة المستقرة إلى أن KD = 26 (± 3) nM و Rmax من ~ 91٪ (± 5٪) تم تحقيق الارتباط (الشكل 4A)
- إعداد العازلة.
- SPR ل VHL: MZ1: مجمع ثلاثي Brd4BD2
- قم بإعداد المخزن المؤقت كما هو موضح في الخطوة 3.1.1.
- قم بتنشيط شريحة SA باتباع بروتوكول الشركة المصنعة وشل حركة VHL إلى ~ 100 RU. حقن محلول بروتين 0.5 ميكروغرام / مل VHL بمعدل تدفق 5 ميكرولتر / دقيقة ووقت التلامس بين 1-5 دقائق حتى يتم الوصول إلى كثافة سطح ~ 100 RU.
- قم بإعداد عينات لحقنتين أحاديتي الدورة من 5 أضعاف و 5 نقاط في صفيحة سفلية مستديرة من البوليسترين الشفاف سعة 96 بئرا بحد أقصى 323 ميكرولتر وقم بتغطيتها برقائق بلاستيكية شفافة ذاتية اللصق متوافقة مع ألواح البوليسترين الدقيقة كما هو موضح في الخطوات 3-2-3-1-3-3-3-2-2.
- التحكم السلبي: يحتوي التحليل على Brd4BD2 فقط.
- تحضير التركيز العلوي عند 25 ميكرومتر في المخزن المؤقت للتشغيل بحجم 200 ميكرولتر (#A5)
- أضف 160 ميكرولتر لكل من Brd4BD2 عند 2 ميكرومتر في المخزن المؤقت الجاري إلى الآبار الأربعة التالية على اليسار (#A1-A4)
- نقل 40 ميكرولتر من A5 إلى A4. تخلط جيدا.
- نقل 40 ميكرولتر من A4 إلى A3. تخلط جيدا. استمر في القيام بذلك حتى A1.
- تكوين مركب ثلاثي: يحتوي التحليل على MZ1 و Brd4BD2.
- قم بإعداد التركيز العلوي بإضافة 4 ميكرولتر من MZ1 عند 20 ميكرومتر في محلول 100٪ -DMSO إلى 196 ميكرولتر يحتوي على 25.5 ميكرومتر Brd4BD2 في مخزن مؤقت خال من DMSO (#B5). التركيزات النهائية هي 25 ميكرومتر Brd4BD2 و 100 نانومتر MZ1 و 2٪ DMSO.
- أضف 160 ميكرولتر لكل من Brd4BD2 عند 2 ميكرومتر في المخزن المؤقت الجاري إلى الآبار الأربعة التالية على اليسار (#B1-B4)
- نقل 40 ميكرولتر من B5 إلى B4. تخلط جيدا.
- نقل 40 ميكرولتر من B4 إلى B3. تخلط جيدا. استمر في القيام بذلك حتى B1.
- التحكم السلبي: يحتوي التحليل على Brd4BD2 فقط.
- قم بتشغيل SPR باستخدام إعداد الدورة الواحدة: وقت الاتصال: 100 ثانية ؛ وقت التفكك: 720 ثانية ؛ معدل التدفق: 50 ميكرولتر / دقيقة. ضع ثلاث حقن من المخزن المؤقت قبل كل عينة لضمان خلفية مستقرة.
- تحليل البيانات: قم بتطبيق الحقن الثالث من المخزن المؤقت كخلفية للطرح. كعنصر تحكم سلبي ، عندما لا يكون MZ1 موجودا ، تكون استجابة SPR بين VHL و Brd4BD2 ضئيلة. عند وجود MZ1 ، يشير التركيب الحركي إلى أن التفاعل بين VHL و MZ1-Brd4يحتوي مركب BD2 على k = 7.9 (± 1.5) * 107 / M / s ، koff = 0.014 s-1 ، و KD = 1 نانومتر. (الشكل 4 ب)
- SPR ل CRBN وتفاعلات الجزيئات الصغيرة
- إعداد العازلة.
- قم بإعداد مخزن مؤقت سعة 1 لتر يحتوي على 50 مللي متر تريس ، 100 مللي مول كلوريد الصوديوم ، 1 مللي مول MgCl 2 ، 0.5 مللي متر TCEP ، 0.005٪ P20 ، درجة الحموضة 7.5 ، وقم بتمريره عبر وحدة مرشح0.2 ميكرومتر.
- قم بإزالة 20 مل من المخزن المؤقت وأعد تعبئة 20 مل من DMSO بنسبة 100٪ (2٪ DMSO في المخزن المؤقت النهائي قيد التشغيل). من المهم الحفاظ على DMSO عند 2٪ في جميع العينات الموضحة أدناه (الخطوات 3.3 و 3.4 و 3.5).
- قم بتنشيط شريحة SA باتباع بروتوكول الشركة المصنعة وشل حركة CRBN إلى ~ 800 RU.
- تحضير المركبات في تخفيف تسلسلي 3 أضعاف ، 6 نقاط على صفيحة 384 بئر بتركيز علوي 30 ميكرومتر كما هو موضح في 3.1.3.
- قم بتشغيل SPR باستخدام الإعداد متعدد الدورات: الوضع: عالي الأداء ، وقت الاتصال: 60 ثانية ، وقت التفكك: 90 ثانية ؛ معدل التدفق: 50 ميكرولتر / دقيقة. بالنسبة لهذا النظام ، تكفي ثلاث حقن عازلة للحصول على خلفية مستقرة. بالنسبة لأنظمة الفحص الأخرى ، قد يكون من الضروري إجراء حقن عازلة إضافية.
- إجراء تحليل البيانات باستخدام برنامج الشركة المصنعة.
ملاحظة: يشير تحليل الحالة المستقرة إلى أن KD من BRD-2512 و BRD-5110 كلاهما حوالي 3 ميكرومتر. ومع ذلك ، وصل الربط فقط ~ 70٪R كحد أقصى للربط عند التركيز العلوي. يشير كل من التقارب الضعيف وشكل مخطط الاستشعار إلى أنه من المحتمل حدوث عدم قابلية للذوبان المركب بتركيزات عالية. وبالتالي ، قد يكون KD الفعلي أعلى من 3 ميكرومتر. تم تضمين BRD-4761 ، الذي لا يرتبط ب CRBN ، كعنصر تحكم سلبي.
- إعداد العازلة.
- SPR ل PPM1D وتفاعلات الجزيئات الصغيرة
- قم بإعداد المخزن المؤقت كما هو موضح في الخطوة 3.3.1. استخدم شريحة مستشعر حمض النيتريلوسيتيك (NTA).
- قم بتطبيق دورة واحدة لأن الرأس الحربي PPM1D به تشغيل وإيقاف تشغيل بطيء k. قم بتجديد شريحة NTA باستخدام الإعداد الافتراضي للشركة المصنعة وشل حركة PPM1D إلى ~ 1000 RU بعد كل حقن مركب (حقن محلول بروتين 5 ميكروغرام / مل عند 5 ميكرولتر / دقيقة).
- تحضير المركبات في تخفيف تسلسلي 3 أضعاف ، 5 نقاط مع التركيز العلوي عند 400 نانومتر كما هو موضح في 3.1.3.
- قم بتشغيل SPR باستخدام إعداد الدورة الواحدة: الوضع: عالي الأداء ؛ وقت الاتصال: 90 ثانية ؛ وقت التفكك: 600 ثانية ؛ معدل التدفق: 50 ميكرولتر / دقيقة. ضع ثلاث حقن من المخزن المؤقت قبل كل مركب لضمان خلفية مستقرة.
- تحليل البيانات. قم بتطبيق الحقن الثالث للمخزن المؤقت كخلفية للطرح. كعنصر تحكم سلبي ، لا يظهر BRD-2512 الارتباط ب PPM1D. بالنسبة ل BRD-4761 و BRD-5110 ، أشار التركيب الحركي إلى أن KD لكليهما هو 1-2 نانومتر.
- SPR ل CRBN: PROTAC: مركب ثلاثي PPM1D
- قم بإعداد المخزن المؤقت كما هو موضح في الخطوة 3.3.1.
- قم بتنشيط شريحة SA باتباع بروتوكول الشركة المصنعة وشل حركة CRBN إلى ~ 35 RU (حقن محلول بروتين 0.5 ميكروغرام / مل عند 5 ميكرولتر / دقيقة).
- قم بإعداد ثلاثة مركبات في تخفيف تسلسلي مكون من 3 أضعاف و 6 نقاط بتركيز أعلى يبلغ 30 ميكرومتر مع الحفاظ على [PPM1D] عند 1 ميكرومتر في جميع العينات ، بما في ذلك الفراغات ، باستخدام الطريقة الموضحة في الخطوة 3.2.3.
- قم بتشغيل SPR باستخدام الإعداد متعدد الدورات: الوضع: عالي الأداء ؛ وقت الاتصال: 60 ثانية ؛ وقت التفكك: 90 ثانية ؛ معدل التدفق: 50 ميكرولتر / دقيقة.
- إجراء تحليل البيانات باستخدام برنامج الشركة المصنعة.
ملاحظة: بينما لا يظهر BRD-2512 و BRD-4761 استجابة / لا تذكر ، يظهر BRD-5110 بوضوح "تأثير الخطاف" في الحالة المستقرة مع حركية تشغيل / إيقاف سريعة (الشكل 5A-C). تقع استجابة الربط التجريبية من BRD-5110 (الشكل 5C) بين الاستجابة المتوقعة من المحاكاة عند افتراض أن K D (CRBN ، cpd) هي 3 أو 10 ميكرومتر (الشكل 5E) ، مما يشير إلى أن K D الثلاثي وثنائي K D متشابهان جدا. لا يوجد تعاون واضح ل PPM1D: BRD-5110: تشكيل مجمع CRBN.
النتائج
يمكن العثور على توصيف المركب الثنائي VHL: MZ1 و VHL: MZ1: Brd4BD2 المركب الثلاثي في الشكل 2 (ITC) والشكل 3 (BLI) والشكل 4 (SPR) باستخدام مخزن مؤقت مشابه جدا. KD المستخرج من المقايسات المتعامدة متسقة. يمكن حساب التعاون بواسطة K D (ثنائي) / KD (ثلاثي) ، وهو إيجابي للغاية (15 من ITC أو 26 من SPR).
تم تنفيذ توصيف نظام CRBN: PROTAC: PPM1D بواسطة SPR (الشكل 5A-D). تم تجميد CRBN إلى ~ 35 RU لتسهيل مراقبة تكوين معقد ثلاثي. أدى ربط PROTAC وحده إلى إشارة <2 RU وهي أقل من الضوضاء. يعطي PPM1D في المادة المراد تحليلها إشارة خلفية عالية على سطح رقاقة SA ، وأعلى تركيز يمكن تطبيقه هو حوالي 1 ميكرومتر. هذه القيمة أقل من KD بين CRBN ورأسها الحربي ≥3 ميكرومتر) وبالتالي من المتوقع "تأثير الخطاف". SPR حساس بما يكفي لاكتشافه ، والذي لديه اتفاق جيد مع المحاكاة (الشكل 5E). تم إجراء المحاكاة باستخدام التوازن غير التعاوني في الأدبيات19 جنبا إلى جنب مع حساب SPR الكلاسيكي [الاستجابةالقصوى = (استجابة ليجند ×تجميد الكتلة) /ليجند الكتلة]. نظرا لأن KD بين CRBN والمركب لم يتم تحديده بدقة بسبب عدم قابلية الذوبان للمركب عند التركيز العالي ، فقد تم إجراء المحاكاة باستخدام أربعة KD افتراضية: 1 ميكرومتر ، 3 ميكرومتر ، 10 ميكرومتر ، أو 30 ميكرومتر. وقعت النتائج التجريبية بين منحنيات محاكاة 3 ميكرومتر و 10 ميكرومتر ، وهو مطابق تقريبا ل KD في النظام الثنائي ، مما يشير إلى عدم وجود تعاونية.

الشكل 1: توضيح لثلاثة سيناريوهات ملزمة وتعريف KD مختلفة . (أ) الأنظمة الكلاسيكية المكونة من عنصرين. (ب) نظام ثلاثي المكونات يمكن فيه تشبع أحد طرفي PROTAC وبالتالي ، يمكن تقييمه كنظام مكون من عنصرين. (ج) نظام ثلاثي المكونات يتم فيه ملاحظة "تأثير الخطاف". يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: نتائج مركز التجارة الدولية. معايرة VHL إلى MZ1 (يسار) أو مركب MZ1: Brd4BD2 (يمين). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: نتائج BLI. يتوسط MZ1 في تكوين VHL: MZ1: مجمع ثلاثي Brd4BD2. (أ) البيانات الخام. (ب) طرح إشارات الخلفية حيث [MZ1] = 0. (ج) التركيب الحركي ل B لاستخراج k on و koff و KD. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: نتائج SPR . (أ) ارتباط MZ1 ب VHL. (ب) MZ1: Brd4BD2 ربط معقد ثنائي إلى VHL. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
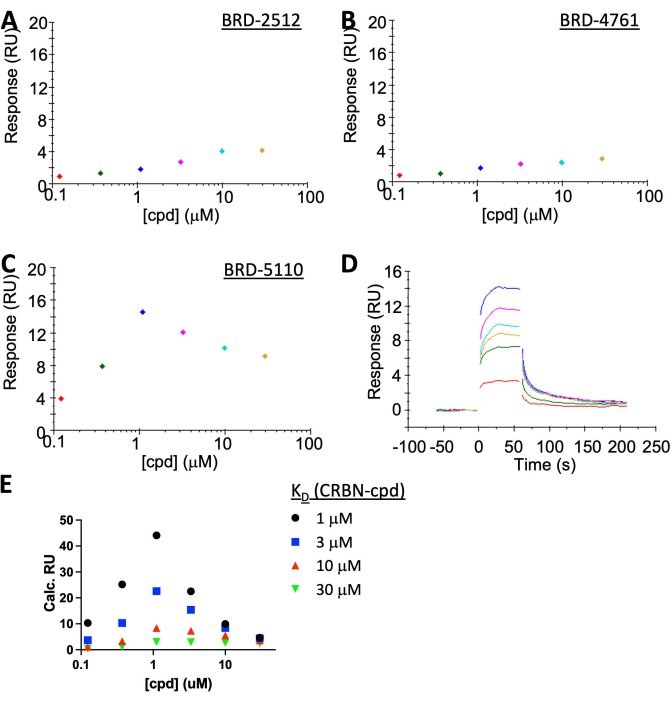
الشكل 5: نتائج SPR تظهر "تأثير الخطاف" لممثل PPM1D-PROTAC. تم تجميد CRBN على سطح رقاقة SA بينما تم الاحتفاظ ب [PPM1D] عند 1 ميكرومتر في المادة المراد تحليلها لجميع الحالات. (أ) BRD-2512 ، وهو مركب يرتبط فقط ب CRBN ، لا يعطي أي استجابة تقريبا. (ب) BRD-4761 ، وهو مركب يرتبط فقط ب PPM1D ، لا يعطي أي إجابة أيضا. (ج، د) BRD-5110 ، وهو PROTAC مع الرأس الحربي ل CRBN في BRD-2512 والرأس الحربي ل PPM1D في BRD-4761 ، تسبب في تشكيل المجمع الثلاثي. (ه) محاكاة لنتائج SPR بافتراض أن KD بين CRBN والمركب هو 1 ميكرومتر (أسود) أو 3 ميكرومتر (أزرق) أو 10 ميكرومتر (أحمر) أو 30 ميكرومتر (أخضر). يتراوح منحنى BRD-2512 بين 3 ميكرومتر و 10 ميكرومتر ، وهو قريب جدا من الثنائي KD المقاس ، مما يشير إلى عدم وجود تعاون (التعاونية = 1). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يمكن أن يوفر التوصيف الفيزيائي الحيوي للتفاعلات الثنائية والثلاثية بين جزيئات PROTAC وشركائها في ربط البروتين رؤى فريدة وتكميلية مقارنة بالأنظمة الخلوية المستخدمة على نطاق واسع. يمكن أن يساعد فهم التقارب بين كل رأس حربي لجزيء PROTAC وشركائه في ربط البروتين في توجيه جهود الكيمياء الطبية نحو تحسين تلك التفاعلات. كشفت الهياكل البلورية المنشورة سابقا لمجمعات PROTAC الثلاثية أن الذرات في منطقة الرابط يمكن أن تشكل تفاعلات مع أحد أو كلا شريكي ربط البروتين16,20. يمكن أن يدعم التحديد التجريبي لتعاون التكوين المعقد الثلاثي تحسين الرابط.
الموصوف في هذا التقرير هو استخدام ثلاث تقنيات فيزيائية حيوية مختلفة يمكن أن توفر معلومات حول تقارب الارتباط بين جزيئات PROTAC وشركائها في ربط البروتين. تفصل الطريقة 1 الإعداد التجريبي لقياس كالوريمتر المعايرة بالتحليل الحجمي متساوي الحرارة (ITC) لجزيء PROTAC ، MZ1 ، ومركب الربط VHL E3 ، وبرومودومين Brd4BD2. أظهرت نتائج ITC KD من 59 نانومتر للتفاعل الثنائي بين MZ1 و VHL و 4 نانومتر للتفاعل الثلاثي بين VHL و MZ1 و Brd4BD2 المخلوطة مسبقا. كانت الصلات متسقة مع تلك التي لوحظت في SPR (ارتباط VHL المجمد ب MZ1 K D = 26 نانومتر ، ارتباط VHL المتجمد ب MZ1 و Brd4BD2 K D = 1 نانومتر) و BLI (KD = 2.8 نانومتر). في حين أن نتائج ITC KD لربط VHL ب MZ1 تتوافق مع القيم المبلغ عنها16 ، فإن القياس الكيميائي الذي تم الحصول عليه مختلف. أحد التفسيرات المحتملة لهذه النتيجة هو ضعف قابلية ذوبان MZ1 في المخزن المؤقت القائم على HEPES المستخدم في البروتوكول الموصوف هنا ، بينما تم إنشاء النتائج من الأدبيات باستخدام مخزن مؤقت قائم على Bis-tris. فضل المؤلفون استخدام نفس مكونات المخزن المؤقت عبر SPR و ITC و BLI.
تصف الطريقة 2 الإعداد التجريبي لتحليل BLI لتفاعل VHL المتجمد ، وتركيز ثابت من Brd4BD2 ، وتركيزات متفاوتة من MZ1. بسبب قيود الحساسية لهذه التقنية ، يمكنإنشاء قيم K D و kon و k off لتشكيل معقد ثلاثي ، ولكن ليس للتفاعل الثنائي بين MZ1 والبروتينات.
تصف الطريقة 3 مقايسات SPR متعددة. SPR أكثر حساسية من BLI ويمكن تطبيقه لمراقبة كل من تفاعلات جزيء البروتين الصغير (ثنائي) والبروتين والبروتين (الثلاثي). في الحالة الأخيرة، يجب مراقبة إشارات الخلفية بعناية؛ لأن البروتين الموجود في المادة المراد تحليلها يمكن أن يعطي إشارات عالية وغير مستقرة. SPR حساس للغاية للكواشف ذات معامل الانكسار العالي ، بما في ذلك DMSO والجلسرين والمنظفات. إذا تم تخزين البروتين في المخزن المؤقت الذي يحتوي على الجلسرين أو المنظفات ، فيجب أن يحتوي المخزن المؤقت الجاري على تركيزات مطابقة من هذه المكونات. بدلا من ذلك ، يؤدي تطبيق كروماتوغرافيا استبعاد الحجم إلى إزالتها تماما قبل أي تجربة SPR. يجب توخي الحذر لمطابقة تركيزات DMSO بين العينات العازلة والعينات المراد تحليلها عن كثب. يتم إجراء تصحيحات مذيب DMSO وفقا لتعليمات الشركة الصانعة.
تصف الطريقة في الخطوة 3.1 مقايسة SPR لتفاعل VHL-MZ1 الثنائي. تصف الطريقة 3.2 مقايسة SPR للمجمع الثلاثي VHL: MZ1: Brd4 BD2 حيث يتم تجميد VHL ، ويكون التحليل إما Brd4 BD2 وحده أو مركب MZ1: Brd4BD2. في هذا النظام ، يكون التفاعل بين Brd4BD2 و VHL ضئيلا. التكوين المركب الثلاثي متعاون للغاية (ɑ = 26). معدل الخروج لتشكيل معقد ثلاثي هو 0.014 s-1 ، الأمر الذي يتطلب استخدام حركية دورة واحدة. تظهر النتائج من مركز التجارة الدولية أيضا تكوينا معقدا ثلاثيا متعاونا للغاية (ɑ = 15). تصف طرق SPR في الخطوات 3.3 و 3.4 و 3.5 المقايسات لتقييم تكوين مركب بين CRBN و PPM1D الناجم عن وجود جزيء PROTAC ، BRD-5110. يحتوي جزيء PROTAC على تقارب ضعيف ل CRBN (K D ~ 3 μM) وتقارب قوي ل PPM1D (KD = 1-2 نانومتر). نتيجة لذلك ، فإن الارتباط الضعيف ب CRBN غير مشبع وينتج عنه "تأثير خطاف" ملحوظ. في حين أنه من الممكن زيادة قابلية ذوبان الربيطة عن طريق زيادة تركيز DMSO المستخدم في التجربة ، فمن المهم في تلك الحالات مراقبة استقرار البروتين بعناية والذي يمكن أن يتأثر سلبا بتركيزات عالية من DMSO. بالإضافة إلى ذلك ، يحتوي DMSO على حرارة عالية من الذوبان والتي يمكن أن تحجب حرارة ارتباط الروابط بالبروتين. يجب توخي الحذر لمطابقة تركيزات DMSO للمحلول في المحقنة والمحلول في الخلية. يوصي المؤلفون بغسيل الكلى من المحلولين مقابل نفس التحضير العازل.
يتم توفير التوصيات والإرشادات العامة بناء على التجارب التي تم إجراؤها والإبلاغ عنها هنا. عندما تكون تقارب التفاعلات الثنائية بين جزيئات PROTAC وشركائها في ربط البروتين قوية (KD <1 μM) ، يوفر SPR صلات موثوقة وقابلة للتكرار جنبا إلى جنب مع معلومات قيمة عن تعاون تكوين معقد ثلاثي. عندما تكون صلات التفاعل الثنائي بين أحد شركاء ربط البروتين وجزيء PROTAC ضعيفة (KD >1 μM) ، يجب تعديل إعداد الفحص. في تلك الحالات ، يمكن أن يكون استخدام المحاكاة الجزيئية حيث يتم تثبيت ثوابت الربط ، وتتنوع تركيزات الرباط والتحليل مفيدا في توجيه تصميم الفحص وتفسير النتائج التجريبية. توفر مقايسات ITC معلومات مهمة عن القياس الكيميائي للربط ولكنها تتطلب المزيد من البروتين والكواشف المركبة مقارنة ب SPR و BLI. بالإضافة إلى ذلك ، يمكن أن تكون قابلية ذوبان جزيء PROTAC محدودة لتجارب ITC. BLI لديها إنتاجية أعلى من ITC وتتطلب كمية أقل من البروتين والكواشف المركبة. ومع ذلك ، نظرا لقيود الحساسية ، لا يمكن استخدام BLI إلا لتقييم تكوين المركب الثلاثي وليس التفاعلات الثنائية بين جزيئات PROTAC وشركائها في ربط البروتين. يوصى باستخدام SPR للاختبار الروتيني لكل من مقايسات ربط PROTAC الثنائية والثلاثية ومقايسات BLI و ITC المستخدمة للتحقق المتعامد من النتائج من SPR.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
تم دعم هذا العمل بجائزة الابتكار وتطوير التكنولوجيا من مركز تطوير العلاجات في معهد برود لمعهد ماساتشوستس للتكنولوجيا وهارفارد. ويود المؤلفون أن يشكروا أعضاء فريق القيادة العليا ولجنة المراجعة على دعمهم لهذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| 96-plate | Greiner | 655076 | flat-bottom, black plates used In BLI experiments |
| 96-well plate | Nunc | 73520-120 | Plate use for ITC sample preparation |
| 96-well plate | Greiner | 650101 | Plate used to prepare samples for SPR experiments |
| Auto iTC200 micro-calorimeter | Malvern Panalytical | Instrument used to perform ITC experiments. Product discontinued. | |
| Biacore S200 | Cytiva | 29136649 | Instrument used to perform SPR experiments |
| MZ1 | ProbeChem | PC-60099 | PROTAC that binds to VHL and Brd4BD2 |
| NTA sensor chip | Cytiva | BR100532 | SPR chip used to perform SPR experiments involving PPM1D |
| Octet Red-384 | Sartorius | Instrument used to perform BLI experiments. Product discontinued. | |
| Plate cover | Malvern | PQA0001 | Cover for Nunc 96-well plate (73520-120) |
| Plate cover | Cytiva | 28975816 | Plate cover for Greiner plate (650101) |
| Series S SA sensor chip | Cytiva | BR100531 | SPR chip used to perform SPR experiments involving MZ1:VHL:BRD4 |
| Streptavidin (SA) Dip and Read Biosensors | Sartorius | 18-509 | Coated sensors used in BLI experiments |
References
- Balaji, V., Hoppe, T. Regulation of E3 ubiquitin ligases by homotypic and heterotypic assembly. F1000Research. 9, (2020).
- Song, L., Luo, Z. -. Q. Post-translational regulation of ubiquitin signaling. Journal of Cell Biology. 218 (6), 1776-1786 (2019).
- Yang, Q., Zhao, J., Chen, D., Wang, Y. E3 ubiquitin ligases: styles, structures and functions. Molecular Biomedicine. 2 (1), 23 (2021).
- Grice, G. L., Nathan, J. A. The recognition of ubiquitinated proteins by the proteasome. Cellular and Molecular Life Sciences: CMLS. 73 (18), 3497-3506 (2016).
- Chirnomas, D., Hornberger, K. R., Crews, C. M. Protein degraders enter the clinic - a new approach to cancer therapy. Nature Reviews Clinical Oncology. 20 (4), 265-278 (2023).
- Toure, M., Crews, C. M. Small-molecule PROTACS: New approaches to protein degradation. Angewandte Chemie (International ed. In English). 55 (6), 1966-1973 (2016).
- Ottis, P., Toure, M., Cromm, P. M., Ko, E., Gustafson, J. L., Crews, C. M. Assessing different E3 ligases for small molecule induced protein ubiquitination and degradation. ACS Chemical Biology. 12 (10), 2570-2578 (2017).
- Riching, K. M., et al. Quantitative live-cell kinetic degradation and mechanistic profiling of PROTAC mode of action. ACS Chemical Biology. 13 (9), 2758-2770 (2018).
- Nabet, B., et al. The dTAG system for immediate and target-specific protein degradation. Nature Chemical Biology. 14 (5), 431-441 (2018).
- Paiva, S. -. L., Crews, C. M. Targeted protein degradation: elements of PROTAC design. Current Opinion in Chemical Biology. 50, 111-119 (2019).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annual Review of Biochemistry. 67, 425-479 (1998).
- Chan, K. -. H., Zengerle, M., Testa, A., Ciulli, A. Impact of target warhead and linkage vector on inducing protein degradation: Comparison of bromodomain and extra-terminal (BET) degraders derived from triazolodiazepine (JQ1) and tetrahydroquinoline (I-BET726) BET inhibitor scaffolds. Journal of Medicinal Chemistry. 61 (2), 504-513 (2018).
- Roy, M. J., et al. SPR-measured dissociation kinetics of PROTAC ternary complexes influence target degradation rate. ACS Chemical Biology. 14 (3), 361-368 (2019).
- Pierce, N. W., Kleiger, G., Shan, S., Deshaies, R. J. Detection of sequential polyubiquitylation on a millisecond timescale. Nature. 462 (7273), 615-619 (2009).
- Gadd, M. S., et al. Structural basis of PROTAC cooperative recognition for selective protein degradation. Nature Chemical Biology. 13 (5), 514-521 (2017).
- Nahta, R., Castellino, R. C. Phosphatase magnesium-dependent 1 δ (PPM1D), serine/threonine protein phosphatase and novel pharmacological target in cancer. Biochemical Pharmacology. 184, 114362 (2021).
- Douglass, E. F., Miller, C. J., Sparer, G., Shapiro, H., Spiegel, D. A. A comprehensive mathematical model for three-body binding equilibria. Journal of the American Chemical Society. 135 (16), 6092-6099 (2013).
- Zorba, A., et al. Delineating the role of cooperativity in the design of potent PROTACs for BTK. Proceedings of the National Academy of Sciences. 115 (31), E7285-E7292 (2018).
- Fairhead, M., Howarth, M. Site-specific biotinylation of purified proteins using BirA. Methods in Molecular Biology. 1266, 171-184 (2015).
- Nowak, R. P., et al. Plasticity in binding confers selectivity in ligand-induced protein degradation. Nature Chemical Biology. 14 (7), 706-714 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved