Method Article
用于评估蛋白水解靶向嵌合体(PROTACS)诱导的三元复合物形成的生物物理测定方法的发展和应用
摘要
在这里,我们描述了由蛋白水解靶向嵌合体 (PROTACS) 诱导的三元复合物形成的生物物理表征方案,这些嵌合体涉及泛素连接酶 Von Hippel-Lindau E3 连接酶 (VHL) 和 Cereblon (CRBN)。 本文说明的生物物理方法包括表面等离子体共振(SPR)、生物层干涉测量法(BLI)和等温滴定量热法(ITC)。
摘要
靶向降解的 E3 连接酶和蛋白质可以在多步骤过程中通过异双功能分子诱导形成复合物。所涉及的相互作用的动力学和热力学有助于泛素化的效率和由此产生的蛋白质降解。表面等离子体共振 (SPR)、生物层干涉测量法 (BLI) 和等温滴定量热法 (ITC) 等生物物理技术提供了可用于优化这些相互作用的宝贵信息。使用两个模型系统,建立了一个生物物理测定工具包,用于了解三元复合物形成的协同作用以及“钩效应”对结合动力学的影响。在一个案例中,评估了蛋白水解靶向嵌合体 (PROTAC) 分子,该分子诱导 Brd4BD2 和 VHL 之间形成三元复合物。异双功能分子 MZ1 对 Brd4BD2 蛋白 (SPR K D = 1 nM, ITC K D = 4 nM) 和 VHL 复合物 (SPR KD = 29 nM, ITC K D = 66 nM) 具有 nM 亲和力。对于该系统,开发了强大的 SPR、BLI 和 ITC 检测方法,这些检测方法重现了已发表的结果,证明了三元复合物形成的协同作用。在另一种情况下,研究了一种在46.0 kDa蛋白PPM1D和cereblon[CRBN(319-442)]之间诱导三元复合物的分子。异双功能分子 BRD-5110 对 PPM1D 的 SPR KD = 1 nM,但对截短的 CRBN (319-442) 复合物 (SPR KD= ~ 3 μM) 的结合要弱得多。在这种情况下,SPR中CRBN的结合是不可饱和的,导致了“钩效应”。评估了 SPR、BLI 和 ITC 的通量和试剂要求,并提供了将其应用于 PROTAC 项目的一般建议。
引言
细胞中蛋白质的多泛素化是一个严格调节的过程,涉及泛素连接酶家族中的酶 1,2。该途径中的末端酶是 E3 泛素连接酶,它们将泛素分子共价连接到其蛋白质结合伙伴3。这些蛋白质结合伴侣的多泛素化靶向它们,以蛋白酶体4 进行蛋白水解降解。该系统是蛋白质稳态过程的一部分,该过程已被用于治疗性地诱导与疾病5 相关的蛋白质降解。诱导 E3 泛素连接酶之间相互作用的小分子,例如 Von Hippel-Lindau E3 连接酶 (VHL) 或 cereblon (CRBN),通常由 E3 连接酶结合弹头组成,该弹头通过柔性连接子连接到弹头,弹头与靶向降解的蛋白质结合。这些异双功能分子通常被称为靶向嵌合体的蛋白水解或PROTACS6。
PROTACS的开发涉及评估分子诱导细胞中蛋白质降解的能力。已经开发了许多细胞检测系统,用于监测用 PROTAC 分子处理细胞后靶蛋白和 E3 连接酶组分(如 VHL 或 CRBN)之间的诱导相互作用。nanoluc-Halotag 系统7 是一种这样的细胞测定,涉及与 Halotag 受体融合的 E3 连接酶和用 nanoluc 供体标记的靶蛋白。三元络合物的形成使nanoluc供体和Halotag受体靠近,允许能量从供体转移到受体,从而产生光的发射。该系统的变化可用于评估 PROTACS 分子8 的细胞通透性或靶蛋白泛素化相对水平的变化9。虽然这些细胞系统对于推动 PROTACS 的优化至关重要,但在 E3 连接酶和靶向降解的蛋白质之间形成复合物是一个多步骤过程10,11。所涉及的二元和三元相互作用的动力学和热力学有助于蛋白质的效率泛素化和由此产生的降解12,13,14。
本文所描述的方案可用于使用表面等离子体共振(SPR),生物层干涉测量法(BLI)和等温滴定量热法(ITC)对PROTACS诱导的三元复合物形成进行生物物理表征。MZ1 PROTAC 分子的 SPR 和 ITC 协议诱导 Brd4BD2 和 VHL 之间形成三元复合物,源自文献报告13,15,此处描述,能够通过对报告程序进行一些修改来概括报告的结果,这将进行讨论。本报告描述了用于评估 MZI、Brd4BD2 和 VHL 之间三元复合物形成的 BLI 测定。BLI 的亲和力测量值与 SPR 和 ITC 中观察到的亲和力测量值一致。还描述了先前发表的方案,其中开发了用于评估 PROTAC 诱导的 PPM1D(一种以 p53 依赖性方式诱导表达的 Ser/Thr 蛋白磷酸酶16)和 CRBN 之间形成的 SPR 测定法。在这种情况下,PROTAC 分子对 PPM1D 具有纳摩尔亲和力,但对 CRBN 只有微摩尔亲和力。在这种情况下,PROTAC分子与CRBN的结合是不饱和的,导致通常观察到的“钩效应”。钩效应是三个体系统的特性,其中当两个物种都与桥接分子结合时,可以形成异源三聚体复合物(图1)17。当桥接物种相对于其他两种物种浓度过高时,观察到钩效应。由此产生的状态是二元相互作用胜过三元相互作用的状态。观察到钩效应的系统需要本报告中讨论的特定实验设计考虑因素。提供了评估生物物理测定法用于评估PROTAC诱导的三元复合物形成的一般概念和试剂要求。
研究方案
所有蛋白质均在大 肠杆菌 中过表达,产量和纯度均>80%),遵循文献方案18。使用BirA催化的反应18进行生物素化。所有小分子均在1 mM储备溶液中在100%DMSO中制备。此处描述的程序不需要专门的实验室安全设备或预防措施。应使用标准的实验室个人防护装备 (PPE)(即实验室外套、护目镜和手套)。
本研究中应用的蛋白质如下:
VHL:生物素化的VHL(53-213)/ElonginB(1-104)/ElonginC(17-112)复合物,在ElonginB的C末端带有Avi标签。
Brd4 BD2:无标签 Brd4BD2(333-460)
CRBN:生物素化 CRBN(319-442),在 N 末端带有 Avi-tag
PPM1D:N端未标记或双His8标记的PPM1D(1-420)
本研究中应用的小分子如下:
MZ1 (MW = 1002.6 Da):与 VHL 和 Brd4BD2 结合的 PROTAC
BRD-2512 (MW = 841.4 Da):CRBN KD ~3 μM,不与 PPM1D 结合
BRD-5110 (MW = 872.0 Da):CRBN KD ~3 μM,PPM1D KD = 1-2 nM
BRD-4761 (MW = 476.6 Da):不与 CRBN 结合,PPM1D KD = 1-2 nM
1.方法一:ITC(等温滴定量热法)
注意:使用自动进样的微量热仪进行滴定。
- 缓冲液制备:制备 3 L 含有 20 mM HEPES、150 mM NaCl、1 mM TCEP、pH 7.5 的缓冲液。
- 透析:对步骤1.1中制备的1L缓冲液透析VHL和Brd4BD2 (~500μL,每个150μM),在4°C下3次,分别4小时,2小时和约16小时。在最后一次透析后保存缓冲液,以便在后续步骤中使用。
- 在带有塑料盖的 96 孔板上制备样品。
- 对于每次滴定,为细胞准备 400 μL 溶液,为注射器准备 125 μL 溶液,为 400 μL 缓冲液准备清洁液。将样品添加到板上的三个连续孔中。由于化合物原液是在 100% DMSO 中以 1 mM 制备的,因此向蛋白质溶液中加入相同百分比的 DMSO,以确保细胞和注射器中的缓冲液匹配。在最终溶液中加入2%DMSO。
- 用于将 VHL 滴定到 MZ1 中的样品:制备含有 392 μL 缓冲液、4 μL 1 mM(10 μM 终浓度)和 4 μL 100% DMSO 的细胞溶液。制备含有 122.5 μL VHL 的注射器溶液,浓度为 85.7 μM,2.5 μL 100% DMSO(终浓度为 84 μM)。
- 用于将VHL滴定到缓冲液中的样品(数据将用于从样品1.3.1.1生成的数据的背景减去):制备含有392μL缓冲液,8μL 100%DMSO的细胞溶液。制备含有 122.5 μL VHL 的注射器溶液,浓度为 85.7 μM(终浓度为 84 μM),并加入 2.5 μL 100% DMSO。
- 用于将 VHL 滴定到 MZ1 和 Brd4 BD2 中的样品:制备含有 392 μL 17.1 μM Brd4BD2(16.8 μM 终浓度)、3.36 μL 1 mM(8.4 μM 终浓度)和 4.64 μL 100% DMSO 的细胞溶液。制备含有 122.5 μL 85.7 μM(84 μM 终浓度)和 2.5 μL 100% DMSO 的注射器溶液。
- 用于将VHL滴定到Brd4BD2 中的样品(1.3.1.3的背景):制备含有392μL的17.1μM Brd4BD2 (16.8μM终浓度)和8μL的100%DMSO的细胞溶液。制备含有 122.5 μL 85.7 μM(84 μM 终浓度)和 2.5 μL 100% DMSO 的注射器溶液。
- 对于每次滴定,为细胞准备 400 μL 溶液,为注射器准备 125 μL 溶液,为 400 μL 缓冲液准备清洁液。将样品添加到板上的三个连续孔中。由于化合物原液是在 100% DMSO 中以 1 mM 制备的,因此向蛋白质溶液中加入相同百分比的 DMSO,以确保细胞和注射器中的缓冲液匹配。在最终溶液中加入2%DMSO。
- 在微量热仪上运行所有四次滴定。每次包括 19 次以 2 μL/s 的速率以 120 秒的时间间隔进样 2 μL 注射器溶液。初始进样蛋白质(0.4μL),并在数据分析期间丢弃。在25°C下进行所有实验,同时以600rpm搅拌。
- 数据分析:使用制造商提供的分析软件将数据拟合到单结合位点模型中,以获得化学计量 (n)、解离常数 (KD) 和结合焓 (ΔH)(图 2)。
2. 方法二:BLI(生物层干涉测量法)
- 在室温 (RT) 下使用链霉亲和素 (SA) 涂层传感器以 5 Hz 的采集速率进行 BLI 实验。在自动化BLI实验期间,确保传感器在单个色谱柱内静止,并在最大孔容积为392 μL的96孔平底黑色板的不同色谱柱之间移动。 用200μL溶液填充实验中使用的板的每个孔。
注意:BLI 仅用于检测蛋白质-蛋白质相互作用(即三元复合物形成)。它不够灵敏,无法检测蛋白质和小分子之间的相互作用。- 缓冲液制备:制备 100 mL 缓冲液,其中含有 20 mM HEPES、150 mM NaCl、1 mM TCEP、0.05% P20、pH 7.5。
- 固定化步骤的优化:按照制造商的建议,将测试传感器加载到 1-3 nm。此处描述的程序使用 ~1.0 nm 的载荷。为此,将传感器浸入含有 1.5 μg/mL 的 VHL 溶液中 80 秒。
- 使用以下顺序应用七个 SA 传感器进行 BLI 动力学测量:
- 对于第一个基线阶段,浸入缓冲液中 60 秒。
- 对于固定阶段,将 1.5 μg/mL 的 VHL 溶液浸入 80 秒。
- 对于第二个基线阶段,浸入缓冲液中 60 秒。
- 对于缔合期,浸入固定浓度为2μM的Brd4BD2 溶液,固定浓度为2%的DMSO溶液和100nM,50nM,25nM,12.5nM,6.3nM,3.1nM和0nM(参考传感器)的不同浓度的MZ1溶液中浸入300秒。
- 对于解离阶段,浸入缓冲液中 600 秒。
- 使用制造商的软件进行数据分析。报告了 k on、koff 和 KD 的数据拟合(图 3)。
3. 方法3:SPR(表面等离子体共振)
注:所有 SPR 实验均在室温下使用链霉亲和素 (SA) 涂层传感器芯片进行。虽然NTA芯片用于检测蛋白质和小分子之间的检测,但在应用于三元配合物时应谨慎使用,因为观察到的背景比SA芯片高得多,这可能是由于带电芯片表面与分析物中蛋白质之间的静电相互作用。
- 用于 VHL-MZ1 交互的 SPR
- 缓冲液制备。
- 制备含有 20 mM HEPES、150 mM NaCl、1 mM TCEP、0.005% P20、pH7.5 的 1 L 缓冲液,并将其通过 0.2 μm 过滤单元。
- 取出 20 mL 缓冲液以备将来使用(不含 DMSO 的缓冲液),并重新填充 20 mL DMSO(最终运行缓冲液中的 2% DMSO)。在下面描述的所有样品中将DMSO保持在2%(步骤3.1和3.2)
- 按照制造商的方案激活SA芯片,并将VHL固定至~2000RU(以5μL / min的速度注入5μg/ mL的蛋白质溶液)。
- 在最大体积为 130 μL 的 384 孔、锥形底部、半透明聚丙烯板上,以 3 倍、8 点连续稀释液(最高浓度为 10 μM)制备 MZ1。 用与聚丙烯微孔板兼容的自粘透明塑料箔覆盖板。
- 用不含DMSO的缓冲液制备最高浓度,以确保最终浓度为2%DMSO。向 147 μL 不含 DMSO 的缓冲液中加入 1.5 μL 1 mM 的 MZ1 原液和 1.5 μL 100% DMSO。
- 用含有 2% DMSO 的电泳缓冲液制备 3 倍连续稀释液。向 100 μL 运行缓冲液中加入 50 μL 在步骤 3.1.3.1 中制备的最高浓度的溶液,并充分混合以制备第 2 个最高浓度。
- 然后将步骤3.1.3.2中制备的50 μL溶液转移到接下来的100 μL电泳缓冲液中,充分混合以制备第 3个最高浓度,依此类推。
- 使用多周期设置运行 SPR:模式:高性能;接触时间:120秒;解离时间:300 s;流速:50 μL/min。
- 使用仪器制造商提供的评估软件进行数据分析。稳态分析表明,KD = 26 (± 3) nM,Rmax 达到 ~91% (± 5%) 的结合(图 4A)
- 缓冲液制备。
- VHL 的 SPR:MZ1:Brd4BD2 三元复合物
- 按照步骤 3.1.1 中的说明准备缓冲液。
- 按照制造商的协议激活 SA 芯片并将 VHL 固定到 ~100 RU。以 5 μL/min 的流速和 1-5 分钟的接触时间注入 0.5 μg/mL VHL 的蛋白质溶液,直到达到 ~100 RU 的表面密度。
- 在最大体积为 323 μL 的 96 孔透明聚苯乙烯圆形底板中制备用于两次 5 倍、5 点单周期进样的样品,并用与聚苯乙烯微孔板兼容的自粘透明塑料箔覆盖,如步骤 3.2.3.1-3.2.3.2 所述。
- 阴性对照:分析物仅含有Brd4BD2 。
- 在体积为 200 μL (#A5) 的电泳缓冲液中制备 25 μM 的最高浓度
- 在运行缓冲液中以 2 μM 的 160 μL Brd4BD2 分别加入左侧 (#A1-A4) 的下一个 4 个孔中
- 将 40 μL 的 A5 转移到 A4 中。搅拌均匀。
- 将 40 μL 的 A4 转移到 A3 中。搅拌均匀。继续这样做,直到 A1。
- 三元络合物形成:分析物含有MZ1和Brd4BD2。
- 通过在100%-DMSO溶液中以20μM的4μLMZ1加入含有25.5μM Brd 4BD2 的无DMSO缓冲液(#B5)中的196μL来制备最高浓度。最终浓度为 25 μM Brd4BD2、100 nM MZ1 和 2% DMSO。
- 在运行缓冲液中以 2 μM 的 160 μL Brd4BD2 分别加入左侧 (#B1-B4) 的下一个 4 个孔中
- 将 40 μL 的 B5 转移到 B4 中。搅拌均匀。
- 将 40 μL 的 B4 转移到 B3 中。搅拌均匀。继续这样做,直到 B1。
- 阴性对照:分析物仅含有Brd4BD2 。
- 使用单周期设置运行 SPR:接触时间:100 秒;解离时间:720 s;流速:50 μL/min。在每个样品之前应用三次缓冲液进样,以确保背景稳定。
- 数据分析:应用缓冲液的第三次注入作为减法的背景。作为阴性对照,当 MZ1 不存在时,VHL 和 Brd4BD2 之间的 SPR 反应可以忽略不计。当 MZ1 存在时,动力学拟合表明 VHL 和 MZ1-Brd4BD2 复合物之间的相互作用具有 k on = 7.9 (± 1.5) *107 /M/s,koff = 0.014 s-1,K D = 1 nM。(图4B)
- 用于CRBN和小分子相互作用的SPR
- 缓冲液制备。
- 制备含有 50 mM Tris、100 mM NaCl、1 mM MgCl 2、0.5 mM TCEP、0.005% P20、pH 7.5 的 1 L 缓冲液,并将其通过0.2 μm 过滤单元。
- 取出 20 mL 缓冲液并重新填充 20 mL 100% DMSO(最终运行缓冲液中的 2% DMSO)。在下面描述的所有样品中,将DMSO保持在2%是很重要的(步骤3.3、3.4和3.5)。
- 按照制造商的协议激活 SA 芯片并将 CRBN 固定到 ~800 RU。
- 如3.1.3所述,在384孔板上以3倍,6点连续稀释制备化合物,最高浓度为30μM。
- 使用多循环设置运行 SPR:模式:高性能,接触时间:60 秒,解离时间:90 秒;流速:50 μL/min。对于该系统,三次缓冲液进样就足以获得稳定的背景。对于其他检测系统,可能需要进行额外的缓冲液进样。
- 使用制造商的软件进行数据分析。
注:稳态分析表明 BRD-2512 和 BRD-5110 的 KD 均在 3 μM 左右。然而,在最高浓度下,结合仅达到~70%R最大 结合。弱亲和力和感应图的形状都表明,在高浓度下可能会发生化合物不溶性。因此,实际的KD 可能高于3μM。 BRD-4761不与CRBN结合,作为阴性对照。
- 缓冲液制备。
- 用于 PPM1D 和小分子相互作用的 SPR
- 按照步骤 3.3.1 中的说明准备缓冲液。使用次氮乙酸 (NTA) 传感器芯片。
- 应用单周期,因为 PPM1D 弹头的 k 打开和 k关闭速度较慢。使用制造商的默认设置再生NTA芯片,并在每次化合物进样后将PPM1D固定至~1000 RU(以5μL / min的速度进样5μg/ mL的蛋白质溶液)。
- 如3.1.3所述,以3倍,5点连续稀释制备化合物,最高浓度为400nM。
- 使用单周期设置运行 SPR:模式:高性能;接触时间:90秒;解离时间:600 s;流速:50 μL/min。在每种化合物之前应用三次缓冲液进样,以确保背景稳定。
- 数据分析。应用缓冲液的第三次注入作为减法的背景。作为阴性对照,BRD-2512 不显示与 PPM1D 的结合。对于 BRD-4761 和 BRD-5110,动力学拟合表明两者的 KD 均为 1-2 nM。
- CRBN:PROTAC 的 SPR:PPM1D 三元复合物
- 按照步骤 3.3.1 中的说明准备缓冲液。
- 按照制造商的方案激活SA芯片,并将CRBN固定至~35RU(以5μL / min的速度注入0.5μg/ mL的蛋白质溶液)。
- 使用步骤3.2.3中描述的方法,以3倍,6点连续稀释制备三种化合物,最高浓度为30μM,同时将所有样品(包括空白)中的[PPM1D]保持在1μM。
- 使用多周期设置运行 SPR:模式:高性能;接触时间:60秒;解离时间:90 s;流速:50 μL/min。
- 使用制造商的软件进行数据分析。
注意:虽然 BRD-2512 和 BRD-4761 显示无响应/可忽略不计,但 BRD-5110 清楚地显示了稳定状态下的“钩效应”,具有快速开/关动力学(图 5A-C)。当假设KD(CRBN,cpd)为3或10μM(图5E)时,BRD-5110的实验结合反应(图5C)介于模拟的预测响应之间,表明三元K D和二元KD非常相似。PPM1D:BRD-5110:CRBN复合物的形成没有明显的合作性。
结果
VHL:MZ1二元复合物和VHL:MZ1:Brd4BD2三元复合物的表征可以在图2(ITC)、图3(BLI)和图4(SPR)中找到,使用非常相似的缓冲液。从正交测定中提取的KD是一致的。合作性可以通过K D(二元)/KD(三元)来计算,这是非常正的(ITC为15,SPR为26)。
CRBN:PROTAC:PPM1D系统的表征由SPR执行(图5A-D)。将CRBN固定在~35 RU上,以方便观察三元复合物的形成。仅 PROTAC 的结合就产生了低于噪声的 <2 RU 信号。分析物中的PPM1D在SA芯片表面产生高背景信号,可施加的最高浓度约为1μM。该值低于CRBN与其弹头之间的KD≥3μM),因此可以预期“钩效应”。SPR足够灵敏,可以检测到它,这与模拟非常吻合(图5E)。模拟是使用文献19 中的非合作平衡结合经典的 SPR 计算 [响应最大值 = (响应配体×质量固定)/质量配体]完成的。由于化合物在高浓度下不溶,CRBN和化合物之间的KD无法准确测定,因此使用四种假设KD进行模拟:1μM、3μM、10μM或30μM。实验结果介于模拟的3 μM和10 μM曲线之间,与二元系统中的KD几乎相同,表明没有协同作用。

图 1:三种结合方案的图示和不同 KD 的定义。 (A) 经典的双组分系统。(B) PROTAC一端饱和的三组分系统,因此可以将其评估为双组分系统。(C)观察到“钩效应”的三组分系统。请点击这里查看此图的较大版本.

图2:ITC结果。 将 VHL 滴定到 MZ1(左)或 MZ1:Brd4BD2 复合物(右)中。 请点击这里查看此图的较大版本.

图 3:BLI 结果。 MZ1 介导 VHL:MZ1:Brd4BD2 三元复合物的形成。(A) 原始数据。(B) 减去背景信号,其中 [MZ1] = 0。(C) B 的动力学拟合以提取 k on、k off 和 KD。请点击这里查看此图的较大版本.

图 4:SPR 结果 。 (A) MZ1 与 VHL 的结合。(B) MZ1:Brd4BD2 二元复合物与VHL的结合。 请点击这里查看此图的较大版本.
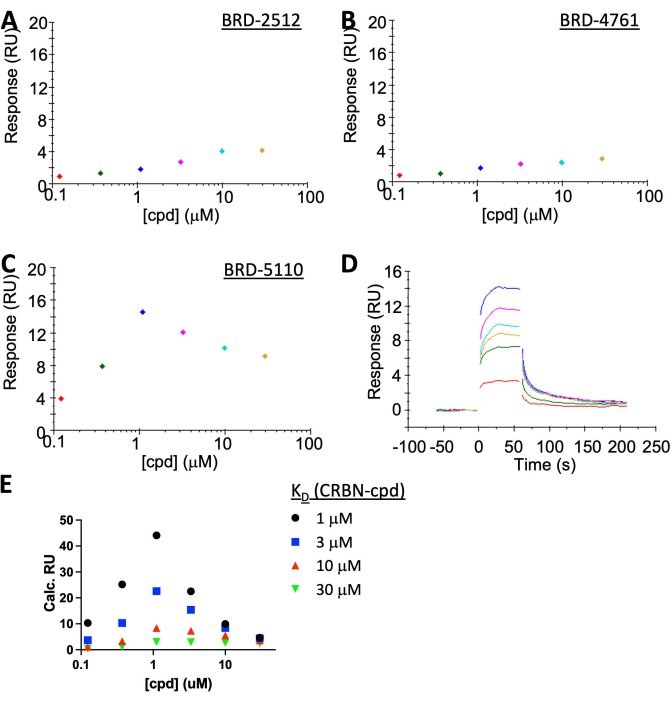
图 5:SPR 结果显示了具有代表性的 PPM1D-PROTAC 的“钩效应”。 将CRBN固定在SA芯片表面上,而[PPM1D]在所有情况下都保持在分析物中的1μM。(A) BRD-2512,一种仅与CRBN结合的化合物,几乎没有反应。(B) BRD-4761,一种仅与PPM1D结合的化合物,也没有反应。(三、四)BRD-5110 是一种 PROTAC,在 BRD-2512 中具有 CRBN 弹头,在 BRD-1 中具有 PPM4761D 弹头,诱导了三元复合物的形成。(E) 假设 CRBN 和化合物之间的 KD 为 1 μM(黑色)、3 μM(蓝色)、10 μM(红色)或 30 μM(绿色)的 SPR 结果模拟。BRD-2512 曲线介于 3 μM 和 10 μM 之间,非常接近测量的二元 KD,表明没有合作性(合作性 = 1)。 请点击这里查看此图的较大版本.
讨论
PROTAC分子与其蛋白质结合伙伴之间的二元和三元相互作用的生物物理表征可以提供与广泛使用的细胞系统相关的独特和互补的见解。了解PROTAC分子的每个弹头与其蛋白质结合伙伴之间的亲和力有助于指导药物化学工作优化这些相互作用。先前发表的三元PROTAC复合物的晶体结构表明,连接区域中的原子可以与一个或两个蛋白质结合伙伴形成相互作用16,20。通过实验确定三元复合物形成的协同作用可以支持连接子优化。
本报告中描述了三种不同生物物理技术的利用,这些技术可以提供有关 PROTAC 分子与其蛋白质结合伙伴之间结合亲和力的信息。方法 1 详细介绍了 PROTAC 分子、MZ1、VHL E3 连接酶复合物和 Brd4BD2 溴结构域的等温滴定量热法 (ITC) 实验设置。ITC 结果显示,MZ1 和 VHL 之间的二元相互作用的 KD 为 59 nM,VHL 与预混合 MZ1 和 Brd4BD2 之间的三元相互作用为 4 nM。亲和力与 SPR 中观察到的亲和力一致(固定化 VHL 与 MZ1 KD = 26 nM,固定化 VHL 与预混合 MZ1 和 Brd4BD2 K D=1 nM)和 BLI (KD= 2.8 nM) 中观察到的亲和力一致。虽然 VHL 与 MZ1 结合的 ITC KD 结果与报告的值16 一致,但获得的化学计量是不同的。该结果的一个可能解释是MZ1在本文所述方案中使用的基于HEPES的缓冲液中的溶解度较差,而文献中的结果是使用基于Bis-tris的缓冲液产生的。作者倾向于在 SPR、ITC 和 BLI 中使用相同的缓冲液组分。
方法 2 描述了用于 BLI 分析固定化 VHL、固定浓度的 Brd4BD2 和不同浓度的 MZ1 相互作用的实验设置。由于该技术的灵敏度限制,可以生成三元复合物形成的 KD、kon 和 koff 值,但不能生成 MZ1 和蛋白质之间的二元相互作用。
方法 3 描述了多种 SPR 检测。SPR 比 BLI 更灵敏,可用于观察蛋白质-小分子(二元)和蛋白质-蛋白质(三元)相互作用。在后一种情况下,应仔细监测背景信号,因为分析物中的蛋白质可能会发出高且不稳定的信号。SPR 对折射率高的试剂非常敏感,包括 DMSO、甘油和去污剂。如果蛋白质储存在含有甘油或去污剂的缓冲液中,则电泳缓冲液必须含有这些成分的匹配浓度。或者,在任何SPR实验之前应用尺寸排阻色谱法完全去除它们。应注意缓冲液和分析物样品之间的DMSO浓度紧密匹配。DMSO溶剂校正是根据制造商的说明进行的。
步骤 3.1 中的方法描述了二元 VHL-MZ1 相互作用的 SPR 测定。方法 3.2 描述了 VHL 的 SPR 测定:MZ1:Brd4 BD2 三元复合物,其中 VHL 被固定化,分析物是单独的 Brd4 BD2 或 MZ1:Brd4BD2 复合物。在这个系统中,Brd4BD2和VHL之间的相互作用可以忽略不计。三元复合物的形成是高度合作的(ɑ=26)。三元配合物形成的关闭率为0.014 s-1,需要采用单周期动力学。ITC的结果还显示出高度合作的三元复合物形成(ɑ=15)。步骤 3.3、3.4 和 3.5 中的 SPR 方法描述了用于评估由 PROTAC 分子 BRD-5110 的存在诱导的 CRBN 和 PPM1D 之间复合物形成的测定方法。PROTAC 分子对 CRBN 的亲和力较弱 (K D ~3 μM),对 PPM1D 的亲和力较强 (KD = 1-2 nM)。因此,与CRBN的弱结合不饱和,并导致观察到的“钩效应”。虽然可以通过增加实验中使用的DMSO浓度来增加配体溶解度,但在这些情况下,仔细监测蛋白质稳定性是很重要的,因为蛋白质稳定性可能会受到高浓度DMSO的负面影响。此外,DMSO具有很高的溶解热,可以掩盖配体与蛋白质结合的热。应注意使注射器中溶液的DMSO浓度与细胞中的溶液相匹配。作者建议对两种溶液进行透析,以对抗相同的缓冲液制备。
一般建议和指南是根据此处执行和报告的实验提供的。当 PROTAC 分子与其蛋白质结合伙伴之间的二元相互作用的亲和力很强 (KD <1 μM) 时,SPR 可提供可靠且可重复的亲和力以及有关三元复合物形成协同作用的宝贵信息。当其中一个蛋白质结合伴侣与PROTAC分子之间的二元相互作用的亲和力较弱(KD >1μM)时,需要修改测定设置。在这些情况下,使用分子模拟,其中结合常数是固定的,配体和分析物的浓度是不同的,对于指导检测设计和解释实验结果很有价值。ITC 检测提供了有关结合化学计量的重要信息,但与 SPR 和 BLI 相比,需要更多的蛋白质和化合物试剂。此外,PROTAC分子的溶解度对于ITC实验来说可能是有限的。BLI 的通量高于 ITC,并且需要更少的蛋白质和化合物试剂。然而,由于灵敏度的限制,BLI只能用于评估三元复合物的形成,而不能用于评估PROTAC分子与其蛋白质结合伙伴之间的二元相互作用。建议将 SPR 用于二元和三元 PROTAC 结合测定的常规测试,以及用于 SPR 结果正交验证的 BLI 和 ITC 测定。
披露声明
作者没有相互竞争的经济利益或其他利益冲突。
致谢
这项工作得到了麻省理工学院和哈佛大学布罗德研究所治疗学发展中心的创新和技术发展奖的支持。作者希望感谢高级领导小组成员和审查委员会对这项工作的支持。
材料
| Name | Company | Catalog Number | Comments |
| 96-plate | Greiner | 655076 | flat-bottom, black plates used In BLI experiments |
| 96-well plate | Nunc | 73520-120 | Plate use for ITC sample preparation |
| 96-well plate | Greiner | 650101 | Plate used to prepare samples for SPR experiments |
| Auto iTC200 micro-calorimeter | Malvern Panalytical | Instrument used to perform ITC experiments. Product discontinued. | |
| Biacore S200 | Cytiva | 29136649 | Instrument used to perform SPR experiments |
| MZ1 | ProbeChem | PC-60099 | PROTAC that binds to VHL and Brd4BD2 |
| NTA sensor chip | Cytiva | BR100532 | SPR chip used to perform SPR experiments involving PPM1D |
| Octet Red-384 | Sartorius | Instrument used to perform BLI experiments. Product discontinued. | |
| Plate cover | Malvern | PQA0001 | Cover for Nunc 96-well plate (73520-120) |
| Plate cover | Cytiva | 28975816 | Plate cover for Greiner plate (650101) |
| Series S SA sensor chip | Cytiva | BR100531 | SPR chip used to perform SPR experiments involving MZ1:VHL:BRD4 |
| Streptavidin (SA) Dip and Read Biosensors | Sartorius | 18-509 | Coated sensors used in BLI experiments |
参考文献
- Balaji, V., Hoppe, T. Regulation of E3 ubiquitin ligases by homotypic and heterotypic assembly. F1000Research. 9, (2020).
- Song, L., Luo, Z. -. Q. Post-translational regulation of ubiquitin signaling. Journal of Cell Biology. 218 (6), 1776-1786 (2019).
- Yang, Q., Zhao, J., Chen, D., Wang, Y. E3 ubiquitin ligases: styles, structures and functions. Molecular Biomedicine. 2 (1), 23 (2021).
- Grice, G. L., Nathan, J. A. The recognition of ubiquitinated proteins by the proteasome. Cellular and Molecular Life Sciences: CMLS. 73 (18), 3497-3506 (2016).
- Chirnomas, D., Hornberger, K. R., Crews, C. M. Protein degraders enter the clinic - a new approach to cancer therapy. Nature Reviews Clinical Oncology. 20 (4), 265-278 (2023).
- Toure, M., Crews, C. M. Small-molecule PROTACS: New approaches to protein degradation. Angewandte Chemie (International ed. In English). 55 (6), 1966-1973 (2016).
- Ottis, P., Toure, M., Cromm, P. M., Ko, E., Gustafson, J. L., Crews, C. M. Assessing different E3 ligases for small molecule induced protein ubiquitination and degradation. ACS Chemical Biology. 12 (10), 2570-2578 (2017).
- Riching, K. M., et al. Quantitative live-cell kinetic degradation and mechanistic profiling of PROTAC mode of action. ACS Chemical Biology. 13 (9), 2758-2770 (2018).
- Nabet, B., et al. The dTAG system for immediate and target-specific protein degradation. Nature Chemical Biology. 14 (5), 431-441 (2018).
- Paiva, S. -. L., Crews, C. M. Targeted protein degradation: elements of PROTAC design. Current Opinion in Chemical Biology. 50, 111-119 (2019).
- Hershko, A., Ciechanover, A. The ubiquitin system. Annual Review of Biochemistry. 67, 425-479 (1998).
- Chan, K. -. H., Zengerle, M., Testa, A., Ciulli, A. Impact of target warhead and linkage vector on inducing protein degradation: Comparison of bromodomain and extra-terminal (BET) degraders derived from triazolodiazepine (JQ1) and tetrahydroquinoline (I-BET726) BET inhibitor scaffolds. Journal of Medicinal Chemistry. 61 (2), 504-513 (2018).
- Roy, M. J., et al. SPR-measured dissociation kinetics of PROTAC ternary complexes influence target degradation rate. ACS Chemical Biology. 14 (3), 361-368 (2019).
- Pierce, N. W., Kleiger, G., Shan, S., Deshaies, R. J. Detection of sequential polyubiquitylation on a millisecond timescale. Nature. 462 (7273), 615-619 (2009).
- Gadd, M. S., et al. Structural basis of PROTAC cooperative recognition for selective protein degradation. Nature Chemical Biology. 13 (5), 514-521 (2017).
- Nahta, R., Castellino, R. C. Phosphatase magnesium-dependent 1 δ (PPM1D), serine/threonine protein phosphatase and novel pharmacological target in cancer. Biochemical Pharmacology. 184, 114362 (2021).
- Douglass, E. F., Miller, C. J., Sparer, G., Shapiro, H., Spiegel, D. A. A comprehensive mathematical model for three-body binding equilibria. Journal of the American Chemical Society. 135 (16), 6092-6099 (2013).
- Zorba, A., et al. Delineating the role of cooperativity in the design of potent PROTACs for BTK. Proceedings of the National Academy of Sciences. 115 (31), E7285-E7292 (2018).
- Fairhead, M., Howarth, M. Site-specific biotinylation of purified proteins using BirA. Methods in Molecular Biology. 1266, 171-184 (2015).
- Nowak, R. P., et al. Plasticity in binding confers selectivity in ligand-induced protein degradation. Nature Chemical Biology. 14 (7), 706-714 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。