Method Article
Caenorhabditis elegans'ta Uzun Ömürlülük ve Gen Transkripsiyonel Analizi için Lipid Takviyesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mevcut protokol, Caenorhabditis elegans için sıvı ve plaka üstü kültürlerde lipit takviyesi yöntemlerini, uzunlamasına çalışmalar ve toplu veya birkaç solucan ve solucan dokusundan gen transkripsiyonel analizi ile birlikte tanımlamaktadır.
Özet
Yaşlanma, hem çevresel hem de genetik katkılardan kaynaklanan ilerleyici fizyolojik değişikliklerle karakterize karmaşık bir süreçtir. Lipitler, hücre zarlarının yapısal bileşenlerini oluşturmada, enerji depolamada ve sinyal molekülleri olarak çok önemlidir. Lipid metabolizmasının ve sinyalizasyonun düzenlenmesi, farklı uzun ömürlü yolları aktive etmek için esastır. Yuvarlak kurt Caenorhabditis elegans , lipid metabolizmasının ve sinyalizasyonun uzun ömür regülasyonuna katkısını incelemek için mükemmel ve güçlü bir organizmadır. Çok sayıda araştırma çalışması, spesifik lipit moleküllerinin diyet takviyesinin C. elegans ömrünü nasıl uzatabileceğini açıklamıştır; Bununla birlikte, takviye koşullarındaki küçük farklılıklar, farklı laboratuvarlardaki bilim adamları arasında tekrarlanabilirlik sorunlarına neden olabilir. Burada, C. elegans için iki ayrıntılı takviye yönteminin, plakalara tohumlanmış bakterilerle veya sıvı kültürde bakteriyel süspansiyonla lipit takviyesi kullanıldığı bildirilmiştir. Burada ayrıca, ömür boyu lipit takviyesi ve bütün bir solucan lizatı veya birkaç solucandan türetilen disseke dokular kullanılarak qRT-PCR analizi ile ömür boyu tahliller yapmak için detaylar verilmiştir. Uzunlamasına çalışmaların ve lipit takviyesi üzerine transkripsiyonel araştırmaların bir kombinasyonunu kullanarak, beslenme analizleri, lipitlerin uzun ömürlülüğü ve sağlıklı yaşlanmayı nasıl etkilediğini incelemek için güvenilir yaklaşımlar sağlar. Bu metodoloji ayrıca, az sayıda disseke doku veya birkaç hayvan kullanarak transkriptlerin bir alt kümesindeki değişiklikleri değerlendirmek için çeşitli beslenme tarama yaklaşımları için uyarlanabilir.
Giriş
Lipit
Lipitler, organik çözücülerde çözünen, ancak suda çözünmeyen küçük hidrofobik veya amfipatik moleküllerdir 1,2. Farklı lipit molekülleri, zincirlerinde bulunan karbonların sayısına, konumlarına, çift bağların sayısına ve gliserol veya fosfatlar dahil olmak üzere bağlı yapılara bağlı olarak birbirlerinden ayrılırlar. Lipitler, membran çift katmanlarını oluşturmak, enerji depolaması sağlamak ve sinyal molekülleri olarak hareket etmek de dahil olmak üzere organizma fonksiyonlarını düzenlemek için farklı hücreler içinde ve arasında çok önemli roller oynar 3,4.
İlk olarak, lipitler, iç bölmeleri hücre dışı ortamdan ayıran plazma zarı ve hücre içi hücre altı membranlar dahil olmak üzere biyolojik membranların yapısal bileşenleridir. İkincisi, lipitler omurgalı ve omurgasız hayvanlarda enerji depolamanın ana şeklidir. Triasilgliseroller de dahil olmak üzere nötr lipitler, yağ dokusu da dahil olmak üzere çeşitli dokularda uzun süre depolanır. Nematodda Caenorhabditis elegans, bağırsak başlıca metabolik yağ depolama organıdır; işlevi sadece besinlerin sindirimi ve emiliminde değil, aynı zamanda memeli hepatositlerinin aktivitesine benzeyen detoksifikasyon sürecinde de rol oynar. Diğer yağ depolama dokuları, lipitlerin oosit gelişimi için gerekli olduğu germline ve cilt benzeri epidermal hücrelerden oluşan hipodermisi içerir 3,5. Üçüncüsü, son yıllarda, lipitlerin, G proteinine bağlı ve nükleer reseptörler de dahil olmak üzere çeşitli reseptörlere doğrudan etki ederek veya dolaylı olarak membran akışkanlık modülasyonu veya çeviri sonrası modifikasyonlar yoluyla hücre içi ve hücre dışı sinyalleşmede rol oynayan güçlü sinyal molekülleri olduğunu ileri sürmüştür 6,7,8,9 . Daha ileri çalışmalar, uzun ömürlülüğü ve sağlık süresini teşvik etmede lipid sinyallemesinin altında yatan moleküler mekanizmaları aydınlatmaya devam edecektir.
Model organizmalar, insanlarda çalışılamayacak kadar karmaşık olan belirli biyolojik soruları ele almak için önemlidir. Örneğin, yuvarlak kurt C. elegans, insan beslenmesi ve hastalığı ile ilgili biyolojik süreçleri incelemek için genetik analiz yapmak için mükemmel bir modeldir10. İnsan fizyolojisi, karmaşık dokular, davranış kalıpları ve bol miktarda genetik manipülasyon araçları ile ilgili yüksek oranda korunmuş moleküler yollar, C. elegans'ı dikkate değer bir model organizma11 yapar. Örneğin, C. elegans, fenotipe özgü genleri tanımlamak için genetik ekranların iletilmesinde ve RNA girişimi12 yoluyla genom çapında ters genetik ekranlarda mükemmeldir.
Laboratuvarlarda, nematodlar, Escherichia coli bakterilerinin bir çimi ile tohumlanmış agar Petri plakaları üzerinde yetiştirilir, proteinler, karbonhidratlar ve enerji ve yapı taşları olarak doymuş ve doymamış yağ asitleri gibi makro besinler ve ko-faktörler ve vitaminler gibi mikro besinler sağlar13. Memelilere benzer şekilde, nematodlar yağ asidi moleküllerini hem palmitik asitten hem de stearik asitten (sırasıyla doymuş 16-karbon ve 18-karbon molekülleri) sentezler, bunlar sırayla doymamış ve çeşitli tekli doymamış yağ asitleri (MUFA'lar) ve çoklu doymamış yağ asitleri (PUFA'lar) 14,15,16,17,18'e uzatılır. İlginçtir ki, C. elegans, yağ asidi biyosentezi, doygunluğun giderilmesi ve uzamasında rol oynayan gerekli tüm yağ asitlerinin ve çekirdek enzimlerin de novo sentezini yapabilir ve uzun zincirli PUFA'ların sentezini kolaylaştırır19. Diğer hayvan türlerinden farklı olarak, C. elegans 18-karbon ve 20-karbon ω-6 yağ asitlerini kendi ω-3 desaturaz enzimleri ile ω-3 yağ asitlerine dönüştürebilir. Ek olarak, solucanlar oleik asitten linoleik asit (LA) oluşumunu katalize eden bir Δ12 desaturaza sahiptir (OA, 18: 1) 20,21. Çoğu hayvan veya bitki hem Δ12 hem de ω-3 desaturazlardan yoksundur ve bu nedenle PUFA'larını elde etmek için ω-6 ve ω-3'ün diyet alımına güvenirken, C. elegans diyet yağ asitleri gerektirmez22. Fonksiyonel desaturaz enzimlerinden yoksun izole mutantlar, spesifik yağ asitlerinin üreme, büyüme, uzun ömürlülük ve nörotransmisyon dahil olmak üzere farklı biyolojik süreçlerdeki işlevlerini incelemek için kullanılmıştır. Bireysel yağ asitlerinin spesifik biyolojik yollar üzerindeki etkisi, hem genetik bir yaklaşım hem de diyet takviyesi kullanılarak ele alınabilir16,17,23. Bugüne kadar, lipit araştırmaları, nörolojik ve gelişimsel koşullarda lipit sentezi, bozulması, depolanması ve parçalanmasında rol oynayan genleri karakterize etmeye odaklanmıştır24. Bununla birlikte, lipitlerin uzun ömürlülük regülasyonundaki rolleri yeni ortaya çıkmaya başlamıştır.
Uzun ömürlülük regülasyonunda lipit sinyalizasyonu
Lipitler, farklı dokularda ve hücre tiplerinde hücresel sinyal kaskadlarını aktive ederek uzun ömürlülük regülasyonunda önemli roller oynamaktadır. Son zamanlarda yapılan çalışmalar, lipid bağlayıcı proteinler yoluyla transkripsiyon ve hücre-hücre iletişiminin modüle edilmesinde veya membran reseptörlerinin tanınmasında lipitlerin aktif rollerini vurgulamıştır25. Ek olarak, diyet lipit takviyesi, lipit metabolizmasının C. elegans'ta yaşam süresini nasıl etkilediğini incelemek için mükemmel bir araç sunar. Farklı MUFA'ların ve PUFA'ların, transkripsiyon faktörleri 26,27'yi aktive ederek uzun ömürlülüğü arttırdığı gösterilmiştir.
İnsülin / IGF-1 sinyallemesi ve germline öncü hücrelerinin ablasyonu da dahil olmak üzere uzun ömürlü modeller, MUFA biyosentez yolu ile ilişkilidir ve oleik asit, palmitoleik asit ve cis-vaccenic dahil olmak üzere MUFA takviyesi, C. elegans ömrünü uzatmak için yeterlidir26. MUFA uygulaması tarafından verilen uzun ömürlülük etkisi daha fazla araştırma gerektirse de, altta yatan mekanizmanın, oksidatif stres yanıtının ve uzun ömür düzenlemesinin kilit bir aktivatörü olan SKN-1 / Nrf2 transkripsiyon faktörü tarafından aracılık edilmesi muhtemeldir28,29. MUFA'lar arasında, N-asiletanolaminler (NAE'ler) adı verilen belirli bir yağlı açil etanolamidler sınıfı, iltihaplanma, alerjiler, öğrenme, hafıza ve enerji metabolizması gibi farklı mekanizmalarda çok önemli roller oynar30. Özellikle, oleoylethanolamid (OEA) olarak bilinen lipit molekülü, nükleer hormon reseptörleri NHR-49 ve NHR-807'yi aktive etmek için lipit bağlayıcı protein 8'in (LBP-8) çekirdeğe translokasyonunu teşvik ederek uzun ömürlülüğün pozitif bir düzenleyicisi olarak tanımlanmıştır. OEA analog KDS-5104'ün takviyesi ömrünü uzatmak için yeterlidir ve oksidatif stres yanıtları ve mitokondriyal β-oksidasyonda rol oynayan genlerin ekspresyonunu indükler 7,8.
Aynı zamanda, PUFA'ların rolü de uzun ömürlülük düzenlemesiyle ilişkilendirilmiştir. PUFA ω-3 yağ asidi α-linolenik asit (ALA) uygulaması, NHR-49 / PPARa, SKN-1 / NRF transkripsiyon faktörlerini aktive ederek ve mitokondriyal β-oksidasyonu indükleyerek uzun ömürlülüğü arttırır31. İlginç bir şekilde, oksilipinler olarak adlandırılan ALA'nın perokside ürünleri, SKN-1 / NRF'yi aktive eder, bu da hem PUFA'ların hem de oksidatif türevlerinin uzun ömürlülük yararları sağlayabileceğini düşündürmektedir23. ω-6 yağ asidi arakidonik asit (AA) ve dihomo-γ-linolenik asit (DGLA) takviyesi, otofaji aktivasyonu yoluyla ömrünü uzatır, protein kalite kontrolünü teşvik eder ve atık ve toksik protein agregalarının bozulmasına neden olur27,32. Daha yakın zamanlarda, lipid bağlayıcı protein 3 (LBP-3) ve DGLA'nın aracılık ettiği bir hücre-otonom olmayan sinyal düzenlemesinin, nöronlara periferik sinyaller göndererek uzun ömürlülüğü teşvik etmek için çok önemli olduğu gösterilmiştir, bu da lipid moleküllerinin sistemik seviyelerde dokular arası iletişimde uzun vadeli bir rol oynadığını düşündürmektedir33. Bu çalışma, plakalara ekilen bakterilerle lipit takviyesi veya sıvı kültürde bakteriyel süspansiyon ile lipit takviyesi yapmak için her adımı bildirmektedir. Bu metodolojiler, tüm vücut içeriğini veya birkaç solucandan türetilen disseke dokuları kullanarak yaşam süresini ve transkripsiyonel analizi değerlendirmek için kullanılır. Aşağıdaki teknikler çeşitli beslenme çalışmalarına uyarlanabilir ve lipit metabolizmasının uzun ömürlülüğü ve sağlıklı yaşlanmayı nasıl etkilediğini incelemek için geçerli bir araç sunar.
Protokol
Şekil 1 , farklı deneysel ortamlar kullanılarak lipit beslemenin bir şemasını göstermektedir.
1. Lipid şartlandırılmış bakterilerin hazırlanması
- Bakteriyel seyreltme diyet kısıtlaması (BDR) baz çözeltisini, 999mLdeiyonize suda 5.85 g NaCl, 1.0 g K 2 HPO4 ve 6.0 g KH2PO4 (bkz. 0,5 M KOH ile pH'ı 6,0'a ayarlayın ve ardından 0,22 μm'lik bir filtreden süzün.
NOT: BDR çözümü, uzun süreli depolama için oda sıcaklığında saklanabilir. - BDR ortamını, her 10 mL'lik BDR baz çözeltisine 10 μL 5 mg / mL kolesterol (200 geçirmez etanol içinde çözülmüş) ekleyerek hazırlayın.
- OP50 bakterilerini ( Malzeme Tablosuna bakınız) -80 °C stoktan LB-agar plakalarına kadar çizgilendirin ve gece boyunca 37 °C'de inkübe edin.
NOT: 37 °C'de gece boyunca inkübasyondan sonra, OP50 plakası sabit besleme sonuçları için 4 °C'de 1 haftaya kadar saklanabilir. - OP50 bakterilerini OP50 LB-agar plakasından LB ortamına aşılayın ve gece boyunca (16 saat) 37 ° C'lik bir çalkalayıcıda inkübe edin.
NOT: Gerekli LB orta hacmi, deneysel ayarlara bağlıdır. 6 cm'lik plakaların her birine tohumlanmış 200 μL 5x konsantre bakteri ve 10 cm'lik plakaların her biri için 1 mL 5x konsantre bakteri kullanılması ve sıvı besleme koşullarının her birinin çoğaltılması önerilir. Bu nedenle, her lipit besleme kültürü için sırasıyla 1 mL ve 5 mL başlangıç LB aşılaması hazırlanmalıdır. - Oda sıcaklığında 10 dakika boyunca 4.000 x g'de santrifüjleme yoluyla bakteri toplayın. Süper natantı atın.
- Bakteriyel peleti 20 mL BDR tabanında askıya alın ve 10 dakika boyunca 4.000 x g'de santrifüj yapın. Süper natantı atın.
NOT: Bu adım, bakteriyel peletteki LB kalıntılarını yıkamak için kritik öneme sahiptir. - 20x BDR bakteri stoğu oluşturmak için her bakteri peletini BDR ortamında askıya alın. Kullanmadan önce 20x BDR bakteri stoğunu BDR ortamı ile 5x arasında seyreltin.
NOT: Bakteriler için 20x konsantrasyona ulaşmak için orijinal LB hacminin 1/20 hacimlik BDR ortamını kullanın. 20x bakteri stoğu 4 ° C'de 1 haftaya kadar saklanabilir. - Yeni bir otoklavlanmış cam şişede çözücü olarak etanol veya dimetil sülfoksit (DMSO) kullanarak bir lipit stok çözeltisi hazırlayın ve oksidasyonu önlemek için cam şişeyi argon veya azotla doldurun.
NOT: Stok çözeltisi konsantrasyonu genellikle 250 mM ile 1 mM arasındadır. - Besleme koşullarında istenen nihai konsantrasyonu elde etmek için lipit stok çözeltisini istenen miktarda BDR bakteri çözeltisine aktarın. 20 sn boyunca vorteks yaparak iyice karıştırın.
NOT: Lipitlerin beslenmedeki son konsantrasyonu, lipit ve test koşullarına bağlı olarak genellikle 1 μM ila 1 mM'dir. Yeni lipitlerle çalışıyorsanız, 0,1 μM ila 1 mM arasında değişen farklı konsantrasyonları test etmek için önce bir pilot deney yapılması önerilir. Lipid stok çözeltisini, plakaya tohumlamadan veya sıvı solucan kültürlerine koymadan hemen önce BDR bakterileriyle karıştırın. Solucanlara beslenmeden önce lipit şartlandırılmış bakterileri en fazla 1 saat hazırlamak. - Araç kontrolü olarak hizmet etmek için aynı hacimlerde filtrelenmiş etanol veya DMSO'yu (lipit besleme grubu için hangisinin kullanıldığına bağlı olarak) BDR bakterileriyle karıştırın.
2. Lipid takviyesi için senkronize C. elegans'ın hazırlanması
- M9 tamponunu 22 mM KH 2 PO 4,22mM Na 2HPO 4, 85 mM NaCl ve2mM MgSO4'ü karıştırarak (belirtilen nihai konsantrasyonları kullanarak) hazırlayın (bkz. Sterilize etmek için tamponu otoklav edin.
- % 60 ev ağartıcısı (v / v, Malzeme Tablosuna bakınız) ve son konsantrasyonu 1.6 M NaOH olan taze bir ağartıcı çözeltisi hazırlayın.
- 10 mL M9 tampon kullanarak gravid yetişkinleri 15 mL'lik konik bir tüpte toplayın.
NOT: Senkronizasyon için gereken solucan ve plaka sayısı deneysel ayarlara bağlıdır (yani, koşulların ve çoğaltmaların sayısı ve besleme yöntemleri). İdeal olarak, yetişkin solucanların her tam 6 cm'lik plakası, senkronizasyondan sonra en az 600 L1 solucan verebilmelidir. - Solucanları 30 s için 1.450 x g'de döndürün. Süpernatantı çıkarın ve solucanları 10 mL M9 tamponu ile bir kez daha durulayın.
- Solucanları 30 s için 1.450 x g'de döndürün. Konik tüpte 4 mL'lik bir aliquot bırakarak süpernatanı aspire edin. 2 mL ağartıcı çözeltisi ekleyin ve 1 dakika boyunca kuvvetlice çalkalayın.
- Solucanları oda sıcaklığında 30 s için 1.450 x g'de döndürün.
- Süpernatantı çıkarın ve 4 mL M9 tampon ve 2 mL ağartıcı çözeltisi ekleyin. Solucan gövdeleri çözülene kadar tüpü çalkalayın.
- Yumurtaları oda sıcaklığında 30 s için 1.450 x g'da döndürün.
- Süpernatantı çıkarın ve yumurtaları 10 mL M9 tamponu ile yıkayın.
- 2.8 ve 2.9 3x numaralı adımları yineleyin.
- Embriyoları 6 mL M9 tamponu ile askıya alın. Embriyoları 20 ° C'de bir rotatörde 2 gün boyunca sallayın ve yumurtadan çıkmalarına ve senkronize olmalarına izin verin.
- L1 larvalarını OP50 tohumlu plakalara aktarın. Senkronize L4 solucanlarını toplamak için 48 saat boyunca 20 ° C'de, 1. gün yetişkinleri için 72 saatte ve 2. gün yetişkinleri için 96 saatte inkübe edin.
NOT: OP50 plakaları, her 10 cm'lik nematod büyüme ortamı (NGM) plakası34'e 1 mL 20x OP50 bakteri ilave edilerek hazırlanır. L4 aşamasında solucanları hasat etmeyi hedefliyorsa OP50 plakalarının her birine 30.000 L1 solucanı ekilebilir ve mevcut deney ortamlarında 1. gün-1 yetişkinlerini hasat etmeyi hedefliyorsa OP50 plakalarının her birine 20.000 L1 solucan ekilebilir. Farklı laboratuvar ortamları için farklı olabilir, bu nedenle solucanların hasat edilmeden önce yeterli yiyeceğe sahip olduklarından emin olmak için tohumlanabilecek solucan sayılarının test edilmesi önerilir. - L4, gün-1 yetişkin veya gün-2 yetişkin solucanları 10 mL M9 tamponu kullanarak 15 mL konik bir tüpte toplayın. Artık solucanları plakalardan durulamak için başka bir 5 mL M9 tamponu kullanın.
- Solucanları 30 s boyunca 1.450 x g'de döndürün ve süpernatanı atın. Solucan peletini 10 mL BDR ortamı ile yıkayın, 30 s için 1.450 x g'de santrifüj yapın ve süpernatanı atın.
- Sıvı besleme yöntemindeki solucanlar için, 3.000 solucan / mL'lik bir solucan konsantrasyonu elde etmek için BDR ortamını solucanlara aktarın. Plaka üstü besleme yöntemlerindeki solucanlar için, plakadaki kuruma süresini azaltmak için solucanlara eklenen BDR ortamının hacmini azaltın.
3. C. elegans için lipit takviyesi
- Aşağıdaki adımları izleyerek sıvı kültürde lipit takviyesi yapın.
NOT: Bu yöntem, lipitlerle desteklenmiş dökme solucanlar kullanarak transkripsiyonel değişiklikleri test etmek için uygundur.- İstenilen miktarda lipit veya araç kontrolünü 12 delikli bir plakadaki kuyucukların her birine aktarın. Biyolojik bir replikasyon olarak her besleme koşulu için üç ila dört kuyucuk hazırlayın.
- 2.15. adımdaki solucan süspansiyonunu 5x BDR bakterileriyle 1: 1 oranında karıştırarak 1.500 solucan / mL ve bakteriler için 2.5x'lik bir nihai konsantrasyon elde edin.
- BDR ortamındaki solucan-bakteri karışımının 2 mL'sini 12 delikli plakanın her bir kuyucuğuna aktarın.
- 12 delikli plakayı folyo ile sarın ve istenen inkübasyon uzunluğu için 100 rpm'de 20 ° C'lik bir inkübatörde çalkalayın.
NOT: Farklı besleme koşullarını test etmek için, lipitleri solucanlarla 6 saat, 12 saat ve 24 saat gibi farklı uzunluklarda inkübe edin. Ek olarak, L4 veya gün-1 yetişkin aşamasından lipit besleme de dahil olmak üzere optimal sonuçlar için farklı solucan aşamaları test edilebilir.
- Aşağıdaki adımları izleyerek 10 cm'lik NGM agar plakaları üzerinde lipit takviyesi yapın.
NOT: Bu yöntem, lipitlerle desteklenmiş dökme solucanlar kullanarak transkripsiyonel değişiklikleri test etmek için uygundur.- Lipid şartlandırılmış bakterilerin 1 mL'sini 1.9. adımdan 10 cm'lik plakaların her birinin merkezine tohumlayın. Çok sayıda plaka hazırlandığında, tohumlama arasında son çalışma çözeltisini birkaç kez vorteksleyin. Plakaları karanlıkta biyogüvenlik başlığı kullanarak kurulayın.
- Adım 2.15'ten 10 cm'lik plakaların her birine 3.000 solucan aktarın. Solucanlar yüzmek yerine lipit takviyeli plakalar üzerinde sürünene kadar plakaları bir biyogüvenlik başlığında kurutun.
- Solucanları lipit şartlandırılmış plakalar üzerinde 20 °C'lik bir inkübatörde istenen süre boyunca inkübe edin. Çoklu doymamış lipitler kullanıyorsanız ışıktan koruyun.
NOT: Farklı besleme koşullarını test etmek için, lipitleri solucanlarla 6 saat, 12 saat ve 24 saat gibi çeşitli uzunluklarda inkübe edin. Ek olarak, L4 veya gün-1 yetişkin aşamasında lipit besleme de dahil olmak üzere optimal sonuçlar için farklı solucan aşamaları test edilebilir.
- Transkripsiyonel analiz için 6 cm NGM agar plakaları üzerinde lipit takviyesi yapın.
NOT: Bu yöntem, lipitlerle desteklenmiş birkaç solucandaki transkripsiyonel değişiklikleri test etmek için uygundur.- 300 μL lipid şartlandırılmış bakterileri 1.9. adımdan 6 cm'lik plakaların her birinin merkezine tohumlayın. Çok sayıda plaka hazırlandığında, tohumlama arasında son çalışma çözeltisini birkaç kez vorteksleyin. Plakaları karanlıkta biyogüvenlik başlığı kullanarak kurulayın.
- Adım 2.15'ten 6 cm'lik plakaların her birine 300'e kadar solucan aktarın. Solucanlar yüzmek yerine lipit takviyeli plakalar üzerinde sürünene kadar plakaları bir biyogüvenlik başlığında kurutun.
- Solucanları lipit şartlandırılmış plakalar üzerinde 20 °C'lik bir inkübatörde istenen süre boyunca inkübe edin. Çoklu doymamış lipitler kullanıyorsanız ışıktan koruyun.
NOT: Farklı besleme koşullarını test etmek için, lipitleri solucanlarla 6 saat, 12 saat ve 24 saat gibi farklı zaman noktalarında inkübe edin. Ek olarak, L4 veya gün-1 yetişkin aşamasında lipit besleme de dahil olmak üzere optimal sonuçlar için farklı solucan aşamaları test edilebilir.
- Uzunlamasına ömür testi için 6 cm NGM agar plakaları üzerinde lipit takviyesi yapın.
- 6 cm'lik NGM plakalarının her birinin merkezine 200 μL lipid şartlandırılmış bakteri (1x lipid konsantrasyonu ve 5x konsantre bakteri ile) tohumlayın. Her besleme koşulu için üç tabak hazırlayın.
NOT: Plakalar kullanım gününde taze olarak hazırlanmalıdır (ideal olarak kullanımdan hemen önce). - Plakaları biyogüvenlik başlığında kurutun. Çoklu doymamış lipitler kullanıyorsanız, ışıkları kaputta ve odada kapalı tutun.
- Plakaların her birine 30-40 senkronize L4 solucanı seçin. Plakaları solucanlarla birlikte 20 ° C'lik bir inkübatörde tutun. Çoklu doymamış lipitlerle besleniyorsanız, plakaları 20 ° C inkübatörde ışık korumalı bir kutuda saklayın.
NOT: OP50'yi solucanları toplamak için normal bir 6 cm'lik geçiş plakasından (koşulsuz OP50) yapıştırıcı olarak kullanmak mümkündür, ancak şartsız OP50'nin büyük bir miktarını tahlil plakasında bırakmamak çok önemlidir. - Solucanları, istenen beslenme durumuna bağlı olarak her gün veya her gün yeni, taze yapılmış lipit şartlandırılmış plakalara aktarın. Hayatta kalma daha önce tarif edildiği gibi puanlanır4.
- 6 cm'lik NGM plakalarının her birinin merkezine 200 μL lipid şartlandırılmış bakteri (1x lipid konsantrasyonu ve 5x konsantre bakteri ile) tohumlayın. Her besleme koşulu için üç tabak hazırlayın.
4. Transkripsiyonel analiz için RNA ekstraksiyonu
- Çok sayıda solucandan RNA ekstraksiyonu gerçekleştirin.
- Sıvı kültürdeki solucanları adım 3.1 ila 1.5 mL mikrosantrifüj tüplerinden aktarın. M9 tamponunu kullanarak 10 cm'lik plakaları adım 3.2'den yıkayın ve solucanları M9 tamponunda 1,5 mL mikrosantrifüj tüplerine aktarın.
- Solucanları 10 sn boyunca masa üstü mini bir santrifüj ile kısaca santrifüj edin ( Malzeme Tablosuna bakınız) ve süpernatanı hızla aspire edin.
- Artık solucanları sıvı besleme kuyularından aktarın veya plaka beslemelerinden aynı tüpe yıkayın ve aşağı doğru döndürün. Süper natantı çıkarın.
- Solucan peletlerini 1 mL buz gibi soğuk M9 ile yıkayın, mini bir santrifüjle 10 sn kısaca döndürün ve süpernatanı aspire edin. Süpernatanın şeffaflığına bağlı olarak 1x veya 2x'i tekrarlayın.
- Mikrosantrifüj tüplerini 2 dakika boyunca buz üzerine yerleştirin ve 200 μL'lik bir pipetle mümkün olduğunca fazla süpernatant çıkarın ve 15 μL'den fazla olmayan paketlenmiş bir solucan peleti bırakın.
- Fenol ve guanidin izotiyosiyanat (Malzeme Tablosu) içeren 15 μL RNA ekstraksiyon çözeltisini mikrosantrifüj tüplerinin her birine aktarın ve solucanları, sağlam solucanlar görünmeyene kadar yaklaşık 30 s boyunca bir motorlu öğütücü ile öğütün.
DİKKAT: RNA ekstraksiyon çözeltisi toksik ve yanıcıdır ve bu reaktifle açık bir kabı içeren herhangi bir adım kimyasal bir başlıkta çalıştırılmalıdır. - RNA ekstraksiyon çözeltisinin 285 μL'sini mikrosantrifüj tüpüne aktarırken, motor öğütücü ucundaki herhangi bir solucan içeriğini mikrosantrifüj tüpüne durulayın. İyice karıştırmak için vorteks.
NOT: Bu bir duraklatma noktasıdır. Numuneler RNA ekstraksiyon çözeltisinde -80 ° C'de birkaç ay saklanabilir. -80 °C'den alındığında, numunelerin oda sıcaklığında çözülmesine izin verin. - Her numuneye 60 μL kloroform aktarın ve vorteksi kuvvetli bir şekilde geçirin. Numunelerin 10 dakika boyunca oda sıcaklığında yerleşmesine izin verin.
DİKKAT: Kloroform toksiktir ve kimyasal bir başlıkta kullanılmalıdır. - 4 °C'de 20 dakika boyunca 21.000 x g'de santrifüj. Üstteki sulu tabakanın 140 μL'sini, 200 μL'lik bir pipet kullanarak yeni ve RNaz içermeyen bir mikrosantrifüj tüpüne dikkatlice aktarın ve her seferinde 70 μL ile 2x aktarın.
NOT: Bu adımdan itibaren, numuneyle doğrudan teması olan tüm pipet uçlarının ve kapların RNase içermeyen olması gerekir. Tüm ekipmanı ve çalışma alanını silmek için RNase dekontaminasyon çözeltisinin kullanılması da önerilir. - Numune tüpüne 140 μL izopropanol aktarın. Vorteksi kuvvetlice uygulayın ve numunenin 10 dakika boyunca oda sıcaklığında yerleşmesine izin verin. 4 ° C'de 20 dakika boyunca 21.000 x g'de santrifüj yapın ve tüm süpernatanları dikkatlice çıkarın.
- RNA peleti ile numune tüpüne 0,5 mL buz gibi soğuk% 80 etanol (v / v) aktarın. RNA peleti tüpün dibinden ayrılana ve etanol çözeltisinde yüzene kadar vorteksi kuvvetlice yapın. 4 ° C'de 10 dakika boyunca 21.000 x g'de santrifüj yapın ve süpernatanı çıkarın.
- Tüp duvarına yapışan herhangi bir çözücüyü döndürmek için mini santrifüjdeki numune tüplerini 15 saniye boyunca kısaca santrifüj edin ve ardından mümkün olduğunca fazla etanol çözeltisini bir pipetle çıkarın.
- RNA peletini kurutmak için tüp kapağını açık bırakın. Pelet etanol çözeltisi ile iyice yıkanmışsa, kurutma adımı 10 dakikadan az sürmelidir.
NOT: Bu bir duraklatma noktasıdır. Kurutulmuş RNA peleti -80 °C'de 1 aya kadar saklanabilir. - Kuru RNA peletini 40 μL nükleaz içermeyen su ile çözün ve üretici talimatlarına göre DNA giderici bir kit ile işleyin (bkz.
NOT: Önce RNA'nın nükleaz içermeyen suda çözülmesi önerilir. RNA tüpüne aktarılmadan önce 40 μL su 10x DNaz tamponu ile karıştırılırsa, RNA peleti tamamen çözünmez. RNA peletini suda çözerken RNA örneklerinin buz üzerinde tutulması gerekir. Donma-çözülme döngüleri RNA kalitesini düşürür; bu nedenle, DNaz tedavisinin aynı gününde ters transkripsiyon adımına geçin.
- Az sayıda bütün solucandan RNA ekstraksiyonu.
- Bakterileri solucandan çıkarmak için bakteri çimlerinden taze tohumlanmamış bir NGM plakasına 15-20 solucan seçin.
- qRT-PCR 2 adımlı kitin üreticisine göre (bkz. Malzeme Tablosu), PCR tüplerinde 0.2 μL DNaz ile 19.8 μL lizis çözeltisini karıştırarak her numune için 20 μL nihai lizis çözeltisi hazırlayın. Lizis çözeltisini 5 kat yukarı ve aşağı pipetle indirerek karıştırın.
- Tohumlanmamış NGM plakasından 15-20 solucanı, minimum bakteri sayısı ile 20 μL nihai lizis çözeltisi içeren PCR tüpüne aktarın. Lizis reaksiyonunu oda sıcaklığında 5 dakika boyunca inkübe edin.
- Prob-sonicate (bkz. Malzeme Tablosu) aşağıdaki programı kullanarak% 30 genliğe sahip solucanlar: 5 s için sonikasyon, 5 s için duraklatma ve 4x'i toplam 20 s sonikasyon süresi ile tekrarlayın. Sonication sırasında örnekleri buz gibi soğuk bir su banyosunda tutun.
- Oda sıcaklığında 5 dakika inkübe edin.
NOT: RT negatif olmayan kontrol ilgili bir seviyede DNA kontaminasyonunu gösteriyorsa, inkübasyondan önce daha fazla DNaz ekleyin. - 2 μL durdurma çözeltisini lizis reaksiyonuna aktarın ve hafifçe dokunarak karıştırın. Oda sıcaklığında 2 dakika inkübe edin ve ardından buz üzerine koyun.
NOT: Numuneler, ters transkripsiyon adımına geçmeden önce 2 saate kadar buz üzerinde bırakılabilir.
- Aşağıdaki adımları izleyerek solucan dokularından RNA ekstraksiyonu gerçekleştirin.
- Bakteri çimlerinden yaklaşık 20 solucan toplayın ve bakterileri onlardan çıkarmak için taze tohumlanmamış bir NGM plakasına yerleştirin.
- 20 solucanı (mümkün olduğunca az bakteri içeren) 4 μM levamisol içeren 500 μL M9 çözeltisi içeren bir saat camına taşıyın (bkz. İmmobilizasyon saniyeler içinde gerçekleşecektir.
- Solucanlar hareketsiz hale getirildiğinde, 1 mL şırıngaya tutturulabilen 25 G'lik bir iğne kullanarak germline veya bağırsağı diseke edin.
- Diseksiyon kapsamında, bağırsak ve germline'ın doğal ekstrüzyonuna izin vermek için ikinci faringeal ampulün pozisyonunda bir kesim yapın. İki doku, morfolojilerine ve farklı kontrastlarına göre kolayca ayırt edilebilir. Dokuları nazikçe ayırmak için cımbız veya iğne kullanın, onlara zarar vermekten kaçının.
NOT: 5-10 dakika içinde diseksiyon yapılması önerilir. Kesim iyi bir doku ekstrüzyonu üretmezse, bir sonraki solucana geçmeniz ve 10 dakika içinde mümkün olduğunca çok diseksiyon yapmanız önerilir. Bu yordam, ortamdan gelen transkripsiyonel değişiklikleri önlemek için kısa bir zaman dilimi gerektirir.
- Diseksiyon kapsamında, bağırsak ve germline'ın doğal ekstrüzyonuna izin vermek için ikinci faringeal ampulün pozisyonunda bir kesim yapın. İki doku, morfolojilerine ve farklı kontrastlarına göre kolayca ayırt edilebilir. Dokuları nazikçe ayırmak için cımbız veya iğne kullanın, onlara zarar vermekten kaçının.
- qRT-PCR 2 adımlı kit üreticisine göre, PCR tüplerinde 0,2 μL DNaz I ile 19,8 μL lizis çözeltisi karıştırarak her numune için 20 μL nihai lizis çözeltisi hazırlayın. Lizis çözeltisini 5 kat yukarı ve aşağı pipetle indirerek karıştırın.
- Disseke edilmiş dokuları bir PCR tüpüne aktarmak için otoklavlanmış bir cam pipet kullanın. Altta malzeme birikmesine izin vermek için PCR tüplerini 2 dakika boyunca buz üzerine yerleştirin. Süpernatanı çıkarın, PCR tüpüne 20 μL nihai lizis çözeltisi ekleyin ve dokunarak karıştırın.
- Lizis reaksiyonunu oda sıcaklığında 5 dakika boyunca inkübe edin. Daha sonra, 2 μL durdurma çözeltisini lizis reaksiyonuna aktarın ve dokunarak karıştırın. Oda sıcaklığında 2 dakika kuluçkaya yatırın.
NOT: Numuneler, ters transkripsiyon adımına geçmeden önce 2 saate kadar buz üzerinde bırakılabilir.
5. Ters transkripsiyon ve qRT-PCR
- Toplu solucanlardan ters transkripsiyon ve qRT-PCR gerçekleştirin.
- RNA konsantrasyonunu ölçün ve ters transkripsiyon için 5 μg toplam RNA hazırlayın.
- Her numuneden eşit miktarda RNA karıştırarak ve nihai RNA konsantrasyonunu 0.556 g / L'ye (5 μg / 9 μL) ayarlayarak havuzlanmış bir RNA örneği hazırlayın. qRT-PCR standart eğrisi ve RT-negatif kontrolleri için havuzlanmış RNA örneğini kullanın.
- Üretici talimatlarına göre ters transkripsiyon gerçekleştirin (bkz. Aşağıdaki kalite kontrol ters transkripsiyon reaksiyonlarını bireysel RNA örnekleriyle birlikte çalıştırın.
- Şablon olarak havuzlanmış RNA örneği ile ters transkripsiyon gerçekleştirin (qRT-PCR standart eğrisi için).
- Ters transkriptaz olmadan şablon olarak havuzlanmış RNA örneği ile ters transkripsiyon gerçekleştirin (RT-negatif kontrol; potansiyel genom DNA kontaminasyonu için kalite kontrolü).
- Şablon olarak nükleaz içermeyen su ile ters transkripsiyon yapın (RT-negatif kontrol; reaktiflerde potansiyel RNA kontaminasyonu için kalite kontrolü).
NOT: Bu bir duraklatma noktasıdır. Numuneler termosikler içinde gece boyunca bırakılabilir veya birkaç ay boyunca -20 ° C'de saklanabilir.
- Havuzlanmış RNA örneklerinden üretilen cDNA'yı, qRT-PCR standart eğrileri için nükleaz içermeyen su ile dört kez, 20 kez, 100 kez ve 500 kez seyreltin.
- qRT-PCR reaksiyonları için şablon olarak kullanmak üzere her RNA örneğinden üretilen cDNA'yı 20-100 kez seyreltin.
NOT: Seyreltme oranı, ilgilenilen genin bolluğuna bağlıdır. Bu çalışmada kullanılan temizlik genleri veya egl-3 ve egl-21 gibi yüksek eksprese genler için, 100x seyreltme önerilir. lbp-8 gibi düşük eksprese edilen genler için 20x seyreltme önerilir. - Aşağıdaki üretici talimatlarına göre qRT-PCR reaktifleri ile qRT-PCR gerçekleştirin: 10 dakika boyunca 95 °C, 15 s için 95 °C ve 1 dakika boyunca 60 °C ile 40 kez tekrarlayın, ardından varsayılan erime eğrisi programı izleyin ve belirsiz bir süre için 8 °C'de tutun.
- Birkaç solucandan veya solucan dokusundan ters transkripsiyon ve qRT-PCR gerçekleştirin.
- qPCR 2 adımlı kitten 25 μL RT tamponu ve 2,5 μL 20x RT enzim karışımını (bkz. Malzeme Tablosu) adım 4.2.6 veya adım 4.3.6'dan solucan lizat içeren her tüpe aktarın.
NOT: RT-negatif kontrol, birkaç solucandan gelen qRT-PCR için kritik öneme sahiptir. Her deney, örneklerdeki DNA kontaminasyonunu incelemek için RT tamponlu ancak RT enzimi olmayan bir solucan lizat örneği (adım 4.2.6'dan itibaren) içermelidir. DNA kontaminasyonu bir sorunsa, solucanlar lize edildikten sonra lizis tamponuna daha fazla DNaz veya numuneye daha fazla DNaz eklemeyi düşünün. Alternatif olarak, lizatın yarısını normal bir RT reaksiyonunda ve diğer yarısını ters transkriptaz olmadan bir RT reaksiyonunda kullanarak her numune için RT-negatif kontrol gerçekleştirilebilir. - Hafifçe dokunarak karıştırın. 10 sn'lik mini bir santrifüj kullanarak aşağı doğru döndürün.
- Numuneleri üreticinin talimatlarını izleyerek termosikler makinesine yükleyin: 60 dakika boyunca 37 ° C, 5 dakika için 95 ° C ve belirsiz bir süre için 8 ° C.
NOT: Bu bir duraklatma noktasıdır. Numuneler termosikler içinde gece boyunca bırakılabilir veya birkaç ay boyunca -20 ° C'de saklanabilir. - Tüm reaktifleri ve numuneleri buz üzerinde tutun ve qRT-PCR reaktiflerini ışıktan koruyun.
- 96 delikli bir qPCR plakası hazırlayın ve her bir kuyucukta 6 μL nükleaz içermeyen su, 10 μL qRT-PCR reaktifi, 2 μL 5 μM astar karışımı (ileri ve geri) ve 2 μL cDNA karıştırın. 96 delikli qPCR plaka yüzeyini koruyucu bir optik filmle örtün ve sızdırmazlık sağlamak için aşağı doğru bastırın.
- qRT-PCR programını üreticinin talimatlarını izleyerek bir termal bisikletçi üzerinde aşağıdaki gibi çalıştırın: 2 dakika boyunca 50 °C, 2 dakika için 95 °C, 3 s için 95 °C ve 30 s için 60 °C ile 40 kez tekrarlayın, ardından belirsiz bir süre için 8 °C.
- qPCR 2 adımlı kitten 25 μL RT tamponu ve 2,5 μL 20x RT enzim karışımını (bkz. Malzeme Tablosu) adım 4.2.6 veya adım 4.3.6'dan solucan lizat içeren her tüpe aktarın.
Sonuçlar
Lipid takviyesi üzerine birkaç bütün solucan kullanılarak transkripsiyonel değişikliklerin doğrulanması
RNA'yı birkaç bütün solucandan cDNA'ya çıkarma ve retrotranskripsiyon protokolünün çoğaltılabilir olup olmadığını ve toplu solucanlardan elde edilen verilerle karşılaştırılabilir olup olmadığını araştırmak için, bağırsakta lizozomal asit lipaz lipl-4'ü aşırı eksprese eden uzun ömürlü bir solucan suşu 7,8,33,35 kullanılmıştır. Önceki çalışmalarda bildirilen nöropeptit işleme genleri egl-3 ve egl-21'in transkripsiyonel indüksiyonu 7,8,33 olarak doğrulandı (Şekil 2A,B). Bu indüksiyon, birkaç hayvandan RNA ekstraksiyon yönteminin, toplu solucan kültürlerinden standart cDNA sentez tekniklerine geçerli bir alternatif olduğunu göstermektedir.
Lipid takviyesi üzerine disseke edilmiş solucan dokuları kullanılarak transkripsiyonel değerlendirmelerin doğrulanması
C. elegans'ta, 20 karbonlu PUFA'ların sentezi, desaturaz FAT-316,17'nin aktivitesine bağlıdır. Önceki çalışmalar, yağ-3 mutantlarının DGLA16 dahil olmak üzere 20 karbonlu PUFA'lardan yoksun olduğunu bildirmiştir. Daha önce, lipl-4g solucanlarında Δ6-desaturaz FAT-3 kaybının, nöropeptit işleme genleri egl-3 ve egl-21 33'ün transkripsiyonel indüksiyonunu baskıladığı keşfedilmişti. Ek olarak, DGLA takviyesi bu indüksiyonu kurtarır33. egl-21'i kodlayan gen nöronlarda eksprese edilirken, egl-3 hem nöronlarda hem de bağırsaklarda36,37 olarak tespit edilir. DGLA takviyesinin bağırsakta veya nöronlarda egl-3 ve egl-21 indüksiyonunu geri yükleyip geri yüklemediğini daha fazla test etmek için, bağırsak diseke edildi ve transkripsiyonel seviyeleri, bu protokolün 4.3 ve 5.2 numaralı adımlarında açıklanan qRT-PCR analizi kullanılarak değerlendirildi. DGLA, 1. gün yetişkinliğinde 12 saat boyunca kaynak gıdada desteklendi. Bağırsakta egl-3 veya egl-21'in transkripsiyonel indüksiyonu bulunmadı (Şekil 2C), önceki bulgular36,38 ile tutarlıdır.
Lipid takviyesi üzerine ömür testinin doğrulanması
20 karbonlu PUFA'lar ile yağ-3'ü inaktive eden uzun ömür mekanizması arasındaki ilişki daha önce, özellikle lipl-4g solucanları33'ün bağırsağında araştırılmıştır. Yağ-3 nakavtının, lipl-433 tarafından verilen yaşam süresini tamamen bastırdığı bulunmuştur. DGLA'nın lipl-4'ün aracılık ettiği uzun ömürlülüğü geri getirip getirmediğini değerlendirmek için, DGLA yetişkinliğin 1. gününde kaynak gıdaya her gün taze olarak desteklenmiştir. Yağ-3 nakavtı üzerine, DGLA takviyesinin yaşam süresi uzatımını kurtardığı bulunmuştur (Şekil 2D)33, yaşam süresi testi ile birlikte başarılı bir lipit takviyesi prosedürüne işaret etmektedir.
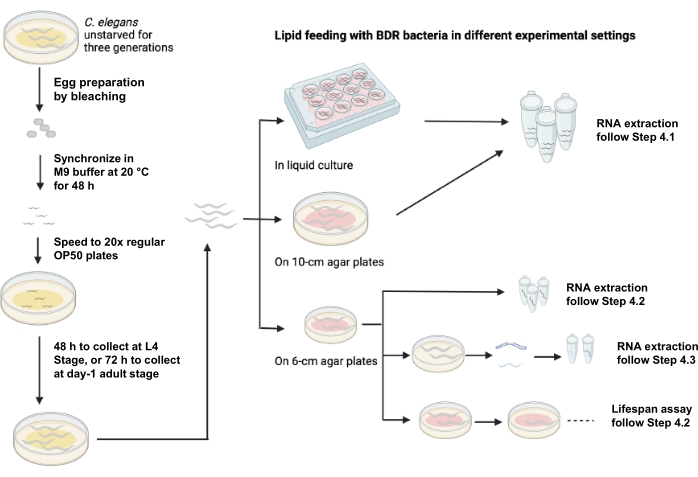
Şekil 1: Farklı deneysel ayarlar kullanılarak lipit besleme şeması. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Büyük bir solucan popülasyonu, birkaç solucan ve disseke dokular kullanılarak nöropeptit işleme genlerinin transkripsiyonel değerlendirmesinin doğrulanması. (A) Büyük bir solucan popülasyonundan ekstrakte edilen RNA,lipl-4 Tg hayvanlarında nöropeptit işleme genlerinin egl-3 ve egl-21 transkript seviyelerinin indüksiyonunu göstermektedir. Hata çubukları ±1 SEM'i temsil eder. **** p < 0.0001 iki kuyruklu Öğrenci t-testi ile. (B) Birkaç solucandan RNA ekstraksiyonu, lipl-4 Tg solucanlarında nöropeptit işleme genlerinin egl-3 ve egl-21 transkript seviyelerinin indüksiyonunu doğrular. Hata çubukları ±1 SEM'i temsil eder. **** p < 0.0001 iki kuyruklu Öğrenci t-testi ile. (C) Nöronal nöropeptit işleme genleri egl-3 ve egl-21, disseke bağırsaklarda indüklenmez. Hata çubukları ±1 SEM'i temsil eder. İki kuyruklu Öğrenci t-testi ile istatistiksel analiz. (D) 10 μm, 100 μm ve 1 mM dahil olmak üzere farklı konsantrasyonlarda DGLA takviyesi, yağ-3 RNAi üzerindeki lipl-4Tg uzun ömür etkisini kurtarır. p log-rank testi ile 0.001 <. Bu şekil Savini et al.33'ten uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Lipid takviyesi, bazı lipit türlerinin sağlıklı yaşlanma üzerindeki doğrudan etkisini aydınlatmak için yaşlanma araştırmalarında kullanılmıştır 6,7,23,26,27,31. Bununla birlikte, lipit takviyesi prosedürü zor olabilir ve deneyler arasındaki herhangi bir tutarsızlık tekrarlanamayan sonuçlara neden olabilir. Burada, ilk ayrıntılı adım adım protokol, teknik belirsizliğin neden olduğu potansiyel tuzaklardan kaçınmak için yeni bilim insanlarına rehberlik etmek için belgelenmiştir. Bu protokoldeki kritik adımlar aşağıdaki paragraflarda ayrıntılı olarak ele alınacaktır. Lipid araştırma araç kutusu, lipit takviyesinden sonra sadece birkaç solucandan ve spesifik solucan dokularından RNA izolasyonu getirilerek de genişletilmiştir. Transkript seviyelerini incelemek için metodoloji göz önüne alındığında, birkaç solucan veya disseke dokulu qRT-PCR, birkaç transkriptin analiz edilmesi veya belirli dokuya özgü transkripsiyonel değişikliklerin incelenmesi için olağanüstüdür. Dahası, bu metodolojileri kullanmak, yaklaşık 5-6 gün daha sürebilen solucan amplifikasyonu adımının üstesinden gelebilir. Aynı zamanda, toplu RNA ekstraksiyonu ile takip edilen lipit beslemesi daha uygun maliyetlidir ve daha büyük bir hedef gen kümesinin analiz edilmesi gerektiğinde geçerli bir alternatiftir.
Lipid besleme etkilerinin tekrarlanabilirliği için birkaç adım kritik olabilir. İlk husus bakteriyel koşullarla ilgilidir. Aşılama için 7 günden eski olmayan taze bakteri plakalarının kullanılması önerilmektedir. BDR ortamında hazırlanan bakterilerin 1 hafta içinde kullanılması önerilir. Lipitlerle karıştırılan bakteriler hemen kullanılmalıdır. Bakteriler lipitleri metabolize edeceğinden, bakteri 4 ° C'de bile depolanmamalıdır. BDR tabanındaki yıkama adımları ve BDR ortamındaki yeniden süspansiyon, bakteriler LB'de yetiştirildiği ve doğrudan solucanlara beslendiği için bakteri koşulları için kritik öneme sahiptir ve her zaman lipit takviyelerinin derin etkilerini ortadan kaldırır. İkinci faktör solucan koşulları ile ilişkilidir. C. elegans, sağlıklı ve stabil bir metabolik durumda olduklarından emin olmak için yumurta hazırlama adımından önce en az üç nesil boyunca aç bırakılmamalıdır. Lipid takviyesinden önce agar plakaları üzerinde C. elegans kültürü için de çok önemlidir; bu, eşitleme adımından önce ve sonra içerir.
Uzun süre sıvı kültürlere adapte olan solucanlar kısmen aç kalır; Açlık, uzun ömürlü genlerin taban çizgisini yükseltir ve bu da lipit takviyesinin zayıflamış bir etkisine yol açar. Metabolik sürüklenme ve tutuklanmış L1 larvalarını kullanan değişiklikler endişe vericiyse, geçerli bir alternatif yumurtaları doğrudan plakalamak olacaktır. Yaşam süresi veya gen ekspresyon analizi yapmak için sadece birkaç solucana ihtiyaç duyulduğunda, yumurtaları doğrudan lipit şartlandırılmış plakalara tabaklamak ve sonraki deneyler için L4 aşamasında elle toplayarak yeniden senkronize etmek mümkündür. Bununla birlikte, L4'ün elle toplanması mümkün olmadığında büyük miktarda solucana ihtiyaç duyulursa, yumurtaların doğrudan kaplanması ideal değildir. Gravid yetişkinlerden ağartıldıktan sonra yumurtadan çıkan yumurtalar farklı zaman noktalarında ortaya çıkabilir ve popülasyonun senkronize olmamasına neden olabilir, bu da transkripsiyonel analize müdahale eder. Üçüncü kritik kısım lipit depolama koşullarıyla bağlantılıdır; PUFA'ları takviye ederken, bu moleküller ışığa duyarlı ve havadaki oksidasyona eğilimli oldukları için ekstra dikkat gerekir.
Solucan evreleri, takviye uzunluğu ve konsantrasyonları dahil olmak üzere çoklu lipit besleme koşulları, yeni lipit moleküllerini test ederken daha fazla araştırma gerektirir. L4, gün-1 yetişkin ve gün-2 yetişkin solucanlar genellikle farklı solucan aşamalarında test için başlangıç noktasıdır. Özellikle, L4 solucanlarını beslerken, kuluçka süresi nematod erime fazı etrafında sona ererse, sonuçların önemini ve tekrarlanabilirliğini büyük ölçüde etkileyen büyük bir varyasyon beklenir. Gün-1 veya gün-2 yetişkin solucanlarını kullanmak için ek bir zorluk, gen ekspresyon analizini zorlaştırabilecek döllerle ilgilidir. Bu örnekte, birkaç bütün solucandan RNA ekstraksiyonu, toplu popülasyonlardan daha güvenilirdir. Farklı lipit molekülleri, fizyolojik etkiler üretmek için farklı konsantrasyon aralıklarına sahiptir; Bu nedenle, 1 μM'den 1 mM'ye kadar bir dizi konsantrasyonun test edilmesi önerilmektedir.
Besleme yöntemini seçerken göz önünde bulundurulması gereken birkaç sınırlama vardır. İlk olarak, lipitler solucanlar tarafından emilemediğinde veya yutulamadığında, biyolojik etkilerini C. elegans'ta test etmek için bir takviye yöntemi kullanmak zordur. Mevcut teknolojilerle, kütle spektrometresi veya SRS, 13C veya 2H etiketli lipit bileşiği39 ile birleştiğinde, solucan gövdesine lipit alımını test etmek için geçerli araçlardır. İkincisi, bu besleme yöntemleri yüksek verimli araştırma teknikleri için optimize edilmemiştir. Dökme solucanlarla lipit takviyesi için, sıvı besleme yönteminden numune hazırlama, plaka üstü beslemeden daha hızlıdır, çünkü sıvı kültürler besleme plakalarından yıkanmak yerine doğrudan mikrosantrifüj tüplerine aktarılabilir. Ekstrakte edilen RNA'nın hasat durumunda olduğundan emin olmak için, solucanların buz üzerine ayarlanması ile RNA ekstraksiyon çözeltisinde öğütülmesi noktası arasında 15-20 dakikadan fazla geçmesine izin verilmemesi önerilir. Çok sayıda numunenin işlenmesi gerektiğinde her 15 dakikada bir daha az koşulun işlenmesi önerilir. Birkaç hayvandan tüm solucan RNA ekstraksiyonu için, elle toplama adımı hız sınırlayıcı adımdır, dokuları diseke etmek için, fizyolojik olmayan bir ortama uzun süreli maruz kalmaktan kaçınmak için zaman verimli bir şekilde hareket etmek çok önemlidir. Toplu RNA ekstraksiyonuna benzer şekilde, solucanların toplanması veya doku örneklerinin 10 dakika içinde parçalanması tercih edilir.
Sınırlamalara rağmen, bu takviye yöntemleri, herhangi bir beslenme ve tıbbi etkinin tanımlanmasına yardımcı olmak için lipit araştırmalarının ötesinde kullanılabilir. Burada bildirilen prosedürler sadece yaşlanma araştırmaları ile sınırlı değildir, aynı zamanda organel uygunluğunu ve hücre metabolik homeostazını değerlendirmek için alternatif fenotiplerdir. Toplu popülasyon ile takviye yöntemi, transkriptom analizi için RNA-seq, metabolomik ve proteomik analiz için kütle spektrometrisi veya spesifik protein belirteçlerinin analizi için Western blot ile birleştirilebilirken, birkaç solucanla lipit takviyesi görüntüleme ve davranışsal analiz ile birleştirilebilir.
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Bakım desteği için P. Svay'a teşekkür ederiz. Bu çalışma NIH hibeleri R01AG045183 (MCW), R01AT009050 (MCW), R01AG062257 (MCW), DP1DK113644 (MCW), March of Dimes Foundation (MCW), Welch Foundation (MCW), HHMI araştırmacısı (M.C.W.) ve NIH T32 ES027801 doktora öncesi öğrenci arkadaşı (M.S.) tarafından desteklenmiştir. Bazı suşlar, NIH Araştırma Altyapı Programları Ofisi (P40 OD010440) tarafından finanse edilen CGC tarafından sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
Referanslar
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır