Method Article
Lipidsupplementierung für Langlebigkeit und Gentranskriptionsanalyse bei Caenorhabditis elegans
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt Lipidergänzungsmethoden in Flüssig- und On-Plate-Kulturen für Caenorhabditis elegans, gekoppelt mit Längsschnittstudien und Gentranskriptionsanalysen von Massen oder einigen wenigen Würmern und Wurmgeweben.
Zusammenfassung
Das Altern ist ein komplexer Prozess, der durch fortschreitende physiologische Veränderungen gekennzeichnet ist, die sowohl aus Umwelt- als auch aus genetischen Beiträgen resultieren. Lipide sind entscheidend für die Bildung struktureller Bestandteile von Zellmembranen, die Speicherung von Energie und als Signalmoleküle. Die Regulierung des Fettstoffwechsels und der Signalübertragung ist unerlässlich, um unterschiedliche Langlebigkeitswege zu aktivieren. Der Spulwurm Caenorhabditis elegans ist ein ausgezeichneter und leistungsfähiger Organismus, um den Beitrag des Fettstoffwechsels und der Signalübertragung zur Langlebigkeitsregulation zu analysieren. Mehrere Forschungsstudien haben beschrieben, wie die Nahrungsergänzung spezifischer Lipidmoleküle die Lebensdauer von C. elegans verlängern kann; Geringfügige Unterschiede in den Ergänzungsbedingungen können jedoch zu Reproduzierbarkeitsproblemen bei Wissenschaftlern in verschiedenen Labors führen. Hier werden zwei detaillierte Supplementierungsmethoden für C. elegans berichtet, die eine Lipidsupplementierung entweder mit Bakterien, die auf Platten ausgesät werden, oder mit Bakteriensuspension in flüssiger Kultur verwenden. Ebenfalls hierin enthalten sind die Details zur Durchführung von Lebensdauer-Assays mit lebenslanger Lipidsupplementierung und qRT-PCR-Analyse unter Verwendung eines ganzen Wurmlysats oder seziertem Gewebe, das von einigen Würmern stammt. Unter Verwendung einer Kombination aus Längsschnittstudien und transkriptionellen Untersuchungen zur Lipidsupplementierung liefern die Fütterungsassays zuverlässige Ansätze, um zu analysieren, wie Lipide die Langlebigkeit und das gesunde Altern beeinflussen. Diese Methodik kann auch für verschiedene Ernährungs-Screening-Ansätze angepasst werden, um Veränderungen in einer Teilmenge von Transkripten entweder mit einer kleinen Anzahl von sezierten Geweben oder einigen Tieren zu bewerten.
Einleitung
Lipide
Lipide sind kleine hydrophobe oder amphipathische Moleküle, die in organischen Lösungsmitteln löslich, aber in Wasser unlöslichsind 1,2. Unterschiedliche Lipidmoleküle unterscheiden sich voneinander basierend auf der Anzahl der in ihren Ketten enthaltenen Kohlenstoffe, der Lage, der Anzahl der Doppelbindungen und der gebundenen Strukturen, einschließlich Glycerin oder Phosphaten. Lipide spielen eine entscheidende Rolle innerhalb und zwischen verschiedenen Zellen, um organismische Funktionen zu regulieren, einschließlich der Bildung von Membrandoppelschichten, der Bereitstellung von Energiespeicherung und der Funktion als Signalmoleküle 3,4.
Erstens sind Lipide strukturelle Bestandteile biologischer Membranen, einschließlich der Plasmamembran und intrazellulärer subzellulärer Membranen, die die inneren Kompartimente von der extrazellulären Umgebung trennen. Zweitens sind Lipide die wichtigste Form der Energiespeicherung bei Wirbeltieren und wirbellosen Tieren. Neutrale Lipide, einschließlich Triacylglycerine, werden über einen längeren Zeitraum in verschiedenen Geweben, einschließlich im Fettgewebe, gespeichert. Beim Fadenwurm Caenorhabditis elegans ist der Darm das wichtigste metabolische Fettspeicherorgan; Seine Funktion ist nicht nur an der Verdauung und Aufnahme von Nährstoffen beteiligt, sondern auch am Entgiftungsprozess, der der Aktivität von Säugetierhepatozyten ähnelt. Andere Fettspeichergewebe umfassen die Keimbahn, in der Lipide für die Entwicklung von Eizellen unerlässlich sind, und die Hypodermis, die aus hautähnlichen epidermalen Zellen besteht 3,5. Drittens haben in den letzten Jahren mehr Beweise dafür gezeigt, dass Lipide starke Signalmoleküle sind, die an der intra- und extrazellulären Signalübertragung beteiligt sind, indem sie direkt auf eine Vielzahl von Rezeptoren wirken, einschließlich G-Protein-gekoppelter und nukleärer Rezeptoren, oder indirekt über Membranfluiditätsmodulation oder posttranslationale Modifikationen 6,7,8,9 . Weitere Studien werden weiterhin die zugrunde liegenden molekularen Mechanismen der Lipidsignalisierung zur Förderung von Langlebigkeit und Gesundheitsspanne aufklären.
Modellorganismen sind wichtig, um spezifische biologische Fragen zu beantworten, die zu komplex sind, um sie am Menschen zu untersuchen. Zum Beispiel ist der Spulwurm C. elegans ein hervorragendes Modell für die Durchführung genetischer Analysen zur Analyse biologischer Prozesse, die für die menschliche Ernährung und Krankheit relevant sind10. Die hochkonservierten molekularen Signalwege, die für die menschliche Physiologie relevant sind, komplexe Gewebe, Verhaltensmuster und reichlich genetische Manipulationswerkzeuge machen C. elegans zu einem bemerkenswerten Modellorganismus11. Zum Beispiel eignet sich C. elegans hervorragend für die Weiterleitung genetischer Screens zur Identifizierung phänotypspezifischer Gene sowie für genomweite umgekehrte genetische Screens über RNA-Interferenz12.
In Laboratorien werden die Nematoden auf Agar-Petriplatten gezüchtet, die mit einem Rasen aus Escherichia coli-Bakterien besät sind und Makronährstoffe wie Proteine, Kohlenhydrate sowie gesättigte und ungesättigte Fettsäuren als Energiequellen und Bausteine sowie Mikronährstoffe wie Co-Faktoren und Vitamine13 liefern. Ähnlich wie Säugetiere synthetisieren Nematoden Fettsäuremoleküle sowohl aus Palmitinsäure als auch aus Stearinsäure (gesättigte 16-Kohlenstoff- bzw. 18-Kohlenstoffmoleküle), die sequentiell entsättigt und zu einer Vielzahl von einfach ungesättigten Fettsäuren (MUFAs) und mehrfach ungesättigten Fettsäuren (PUFAs) verlängert werden14,15,16,17,18. Interessanterweise ist C. elegans in der Lage, alle erforderlichen Fettsäuren und Kernenzyme de novo zu synthetisieren, die an der Fettsäurebiosynthese, -entsättigung und -verlängerung beteiligt sind, was die Synthese langkettiger PUFAs erleichtert19. Im Gegensatz zu anderen Tierarten kann C. elegans 18-Kohlenstoff- und 20-Kohlenstoff-ω-6-Fettsäuren mit eigenen ω-3-Desaturase-Enzymen in ω-3-Fettsäuren umwandeln. Zusätzlich besitzen Würmer eine Δ12-Desaturase, die die Bildung von Linolsäure (LA) aus Ölsäure katalysiert (OA, 18:1)20,21. Den meisten Tieren oder Pflanzen fehlen sowohl Δ12- als auch ω-3-Desaturasen und sind daher auf die Nahrungsaufnahme von ω-6 und ω-3 angewiesen, um ihre PUFAs zu erhalten, während C. elegans keine Nahrungsfettsäuren benötigt22. Isolierte Mutanten ohne funktionelle Desaturase-Enzyme wurden verwendet, um die Funktionen spezifischer Fettsäuren in verschiedenen biologischen Prozessen zu untersuchen, einschließlich Fortpflanzung, Wachstum, Langlebigkeit und Neurotransmission. Die Wirkung einzelner Fettsäuren auf spezifische biologische Signalwege kann sowohl durch einen genetischen Ansatz als auch durch Nahrungsergänzung behandelt werden16,17,23. Bisher konzentrierte sich die Lipidforschung auf die Charakterisierung von Genen, die an der Synthese, dem Abbau, der Speicherung und dem Abbau von Lipiden bei neurologischen und Entwicklungsbedingungen beteiligt sind24. Die Rolle von Lipiden bei der Langlebigkeitsregulation beginnt jedoch gerade erst, aufgedeckt zu werden.
Lipidsignalisierung in der Langlebigkeitsregulation
Lipide spielen eine entscheidende Rolle bei der Langlebigkeitsregulation, indem sie zelluläre Signalkaskaden in verschiedenen Geweben und Zelltypen aktivieren. Neuere Studien haben die aktive Rolle von Lipiden bei der Modulation der Transkription und Zell-Zell-Kommunikation über lipidbindende Proteine oder die Erkennung von Membranrezeptoren hervorgehoben25. Darüber hinaus bietet die Nahrungsergänzung mit Lipiden ein hervorragendes Werkzeug, um zu analysieren, wie der Fettstoffwechsel die Lebensdauer von C. elegans beeinflusst. Es wurde gezeigt, dass unterschiedliche MUFAs und PUFAs die Langlebigkeit fördern, indem sie die Transkriptionsfaktoren26,27 aktivieren.
Langlebigkeitsmodelle, einschließlich der Insulin / IGF-1-Signalisierung und der Ablation von Keimbahnvorläuferzellen, sind mit dem MUFA-Biosyntheseweg assoziiert, und eine MUFA-Supplementierung, einschließlich Ölsäure, Palmitoleinsäure und cis-Vaccen, reicht aus, um die Lebensdauer von C. elegans zu verlängern26. Obwohl der durch die MUFA-Verabreichung verliehene Langlebigkeitseffekt weitere Untersuchungen erfordert, wird der zugrunde liegende Mechanismus wahrscheinlich durch den SKN-1/Nrf2-Transkriptionsfaktor vermittelt, der ein Schlüsselaktivator der oxidativen Stressreaktion und der Langlebigkeitsregulationist 28,29. Unter MUFAs spielt eine bestimmte Klasse von Fettacylethanolamiden, die N-Acylethanolamine (NAEs), eine entscheidende Rolle bei verschiedenen Mechanismen wie Entzündungen, Allergien, Lernen, Gedächtnis und Energiestoffwechsel30. Insbesondere wurde das als Oleoylethanolamid (OEA) bekannte Lipidmolekül als positiver Regulator der Langlebigkeit identifiziert, indem es die Translokation des lipidbindenden Proteins 8 (LBP-8) in den Zellkern fördert, um die nukleären Hormonrezeptoren NHR-49 und NHR-807 zu aktivieren. Die Supplementierung des OEA-Analogons KDS-5104 ist ausreichend, um die Lebensdauer zu verlängern, und induziert die Expression von Genen, die an oxidativen Stressreaktionen und mitochondrialer β-Oxidation beteiligt sind 7,8.
Gleichzeitig wurde die Rolle von PUFAs auch mit der Regulierung der Langlebigkeit in Verbindung gebracht. Die Verabreichung von PUFA ω-3-Fettsäuren α-Linolensäure (ALA) fördert die Langlebigkeit durch Aktivierung der NHR-49/PPARα, SKN-1/NRF-Transkriptionsfaktoren und induziert mitochondriale β-Oxidation31. Interessanterweise aktivieren peroxidierte Produkte von ALA, die als Oxylipine bezeichnet werden, SKN-1 / NRF, was darauf hindeutet, dass sowohl PUFAs als auch ihre oxidativen Derivate Langlebigkeitsvorteile verleihen können23. Die Supplementierung von ω-6-Fettsäure Arachidonsäure (AA) und Dihomo-γ-Linolensäure (DGLA) verlängert die Lebensdauer durch Autophagieaktivierung, fördert die Proteinqualitätskontrolle und führt zum Abbau von verschwendeten und toxischen Proteinaggregaten27,32. In jüngerer Zeit hat sich gezeigt, dass eine zellun-autonome Signalregulation, die durch das lipidbindende Protein 3 (LBP-3) und DGLA vermittelt wird, entscheidend für die Förderung der Langlebigkeit ist, indem periphere Signale an Neuronen gesendet werden, was auf eine weitreichende Rolle von Lipidmolekülen in der Kommunikation zwischen Geweben auf systemischer Ebene hindeutet33. Die vorliegende Studie berichtet über jeden Schritt, um eine Lipidsupplementierung mit Bakterien durchzuführen, die auf Platten oder Bakteriensuspension in flüssiger Kultur ausgesät werden. Diese Methoden werden verwendet, um die Lebensdauer und die Transkriptionsanalyse zu bewerten, wobei Ganzkörperinhalte oder seziertes Gewebe von einigen Würmern verwendet werden. Die folgenden Techniken können an eine Vielzahl von Ernährungsstudien angepasst werden und bieten ein gültiges Werkzeug, um zu analysieren, wie der Fettstoffwechsel die Langlebigkeit und das gesunde Altern beeinflusst.
Protokoll
Abbildung 1 zeigt eine schematische Darstellung der Lipidfütterung unter Verwendung verschiedener experimenteller Einstellungen.
1. Herstellung von lipidkonditionierten Bakterien
- Die BDR-Basislösung (Bacterial dilution dietary restriction aires) wird hergestellt, indem 5,85 g NaCl, 1,0 g K2HPO4 und 6,0 gKH2PO4(siehe Materialtabelle) in 999 ml entionisiertem Wasser gelöst werden. Stellen Sie den pH-Wert auf 6,0 mit 0,5 M KOH ein und filtern Sie dann durch einen 0,22-μm-Filter.
HINWEIS: Die BDR-Lösung kann zur Langzeitlagerung bei Raumtemperatur gelagert werden. - Bereiten Sie das BDR-Medium vor, indem Sie 10 μL 5 mg/ml Cholesterin (gelöst in 200-prozentigem Ethanol) zu jedem 10 ml BDR-Basislösung hinzufügen.
- Streifen Sie die OP50-Bakterien (siehe Materialtabelle) von -80 °C auf LB-Agarplatten und inkubieren Sie sie über Nacht bei 37 °C.
HINWEIS: Nach der nächtlichen Inkubation bei 37 °C kann die OP50-Platte bis zu 1 Woche bei 4 °C gelagert werden, um stabile Fütterungsergebnisse zu erzielen. - Die OP50-Bakterien von der OP50 LB-Agarplatte auf LB-Medium impfen und in einem 37 °C Shaker über Nacht (16 h) inkubieren.
HINWEIS: Das benötigte LB-Mediumvolumen hängt von den experimentellen Einstellungen ab. Es wird empfohlen, 200 μL 5x konzentrierte Bakterien auf jede der 6 cm Platten und 1 ml 5x konzentrierte Bakterien für jede der 10 cm Platten und jede Replikation der flüssigen Fütterungsbedingungen zu verwenden. Daher müssen für jede lipidfütternde Kultur 1 ml bzw. 5 ml der anfänglichen LB-Impfung vorbereitet werden. - Bakterien durch Zentrifugieren bei 4.000 x g für 10 min bei Raumtemperatur sammeln. Verwerfen Sie den Überstand.
- Suspendieren Sie das Bakterienpellet in 20 ml BDR-Base und zentrifugieren Sie es bei 4.000 x g für 10 min. Verwerfen Sie den Überstand.
HINWEIS: Dieser Schritt ist entscheidend, um die übrig gebliebenen LB-Rückstände im Bakterienpellet abzuwaschen. - Suspendieren Sie jedes Bakterienpellet im BDR-Medium, um einen 20-fachen BDR-Bakterienvorrat zu erhalten. Verdünnen Sie die 20x BDR-Bakterienbrühe mit BDR-Medium auf 5x vor Gebrauch.
HINWEIS: Verwenden Sie ein 1/20-Volumen BDR-Medium des ursprünglichen LB-Volumens, um eine 20-fache Konzentration für die Bakterien zu erreichen. Der 20x Bakterienvorrat kann bis zu 1 Woche bei 4 °C gelagert werden. - Bereiten Sie eine Lipid-Stammlösung unter Verwendung von Ethanol oder Dimethylsulfoxid (DMSO) als Lösungsmittel in einer neuen autoklavierten Glasdurchstechflasche vor und füllen Sie die Durchstechflasche mit Argon oder Stickstoff, um eine Oxidation zu verhindern.
HINWEIS: Die Stammlösungskonzentration liegt normalerweise zwischen 250 mM und 1 mM. - Übertragen Sie die Lipidstammlösung in die gewünschte Menge BDR-Bakterienlösung, um die gewünschte Endkonzentration unter Fütterungsbedingungen zu erreichen. Mischen Sie gründlich durch Wirbeln für 20 s.
HINWEIS: Die Endkonzentration der Lipide in der Fütterung beträgt normalerweise 1 μM bis 1 mM, abhängig von den Lipid- und Testbedingungen. Es wird empfohlen, zunächst ein Pilotexperiment durchzuführen, um verschiedene Konzentrationen von 0,1 μM bis 1 mM zu testen, wenn mit neuen Lipiden gearbeitet wird. Mischen Sie die Lipid-Stammlösung mit BDR-Bakterien, unmittelbar bevor Sie sie auf den Teller säen oder in flüssige Wurmkulturen geben. Bereiten Sie die lipidkonditionierten Bakterien nicht länger als 1 h vor der Fütterung an die Würmer vor. - Mischen Sie die gleichen Mengen an gefiltertem Ethanol oder DMSO (je nachdem, welches für die Lipidfütterungsgruppe verwendet wird) mit BDR-Bakterien, um als Vehikelkontrolle zu dienen.
2. Vorbereitung von synchronisierten C. elegans zur Lipidsupplementierung
- M9-Puffer wird durch Mischen (unter Verwendung der angegebenen Endkonzentrationen) 22 mM KH 2 PO 4, 22 mM Na 2 HPO4, 85 mM NaCl und2mMMgSO4 hergestellt (siehe Materialtabelle). Autoklavieren Sie den zu sterilisierenden Puffer.
- Bereiten Sie eine frische Bleichlösung mit 60% Hausbleichmittel (v/v, siehe Materialtabelle) und einer Endkonzentration von 1,6 M NaOH vor.
- Sammeln Sie schwere Erwachsene in einem 15-ml-konischen Röhrchen mit 10 ml M9-Puffer.
HINWEIS: Die Anzahl der Würmer und Platten, die für die Synchronisation benötigt werden, hängt von den experimentellen Einstellungen ab (d.h. Anzahl der Bedingungen und Replikate und Fütterungsmethoden). Idealerweise sollte jede volle 6-cm-Platte erwachsener Würmer nach der Synchronisation mindestens 600 L1-Würmer ergeben können. - Drehen Sie die Würmer mit 1.450 x g für 30 s herunter. Entfernen Sie den Überstand und spülen Sie die Würmer noch einmal mit 10 ml M9-Puffer.
- Drehen Sie die Würmer mit 1.450 x g für 30 s herunter. Saugen Sie den Überstand ab und lassen Sie ein Aliquot von 4 ml im konischen Röhrchen. 2 ml Bleichlösung zugeben und 1 min kräftig schütteln.
- Die Würmer bei 1.450 x g für 30 s bei Raumtemperatur herunterdrehen.
- Entfernen Sie den Überstand und fügen Sie 4 ml M9-Puffer und 2 ml Bleichlösung hinzu. Schütteln Sie das Röhrchen, bis sich die Wurmkörper aufgelöst haben.
- Die Eier bei 1.450 x g für 30 s bei Raumtemperatur herunterdrehen.
- Entfernen Sie den Überstand und waschen Sie die Eier mit 10 ml M9-Puffer.
- Wiederholen Sie die Schritte 2.8 und 2.9 3x.
- Suspendieren Sie die Embryonen mit 6 ml M9-Puffer. Schaukeln Sie die Embryonen 2 Tage lang auf einem Rotator bei 20 °C, damit sie schlüpfen und synchronisieren können.
- L1-Larven auf OP50-Samenplatten übertragen. Inkubieren Sie bei 20 ° C für 48 Stunden, um synchronisierte L4-Würmer zu sammeln, 72 Stunden für Tag-1-Erwachsene und 96 Stunden für Tag-2-Erwachsene.
HINWEIS: OP50-Platten werden durch Zugabe von 1 ml 20x OP50-Bakterien zu jeder 10 cm Nematoden-Wachstumsmedium (NGM)-Platte34 hergestellt. 30.000 L1-Würmer können auf jede der OP50-Platten ausgesät werden, wenn die Würmer im L4-Stadium geerntet werden sollen, und 20.000 L1-Würmer können auf jede der OP50-Platten ausgesät werden, wenn in den gegenwärtigen experimentellen Umgebungen Erwachsene am Tag 1 geerntet werden sollen. Es kann für verschiedene Laboreinstellungen unterschiedlich sein, daher wird empfohlen, die Wurmzahlen zu testen, die ausgesät werden können, um sicherzustellen, dass die Würmer vor der Ernte genügend Nahrung übrig haben. - Sammeln Sie L4-, Tag-1-Erwachsene oder Tag-2-adulte Würmer in einem 15-ml-konischen Röhrchen mit 10 ml M9-Puffer. Verwenden Sie weitere 5 ml M9-Puffer, um die übrig gebliebenen Würmer von den Platten abzuspülen.
- Drehen Sie die Würmer bei 1.450 x g für 30 s herunter und verwerfen Sie den Überstand. Das Schneckenpellet mit 10 mL BDR-Medium waschen, bei 1.450 x g 30 s zentrifugieren und den Überstand entsorgen.
- Bei Würmern in der flüssigen Fütterungsmethode das BDR-Medium auf die Würmer übertragen, um eine Wurmkonzentration von 3.000 Würmern / ml zu erreichen. Reduzieren Sie bei Würmern in On-Plate-Fütterungsmethoden das Volumen des BDR-Mediums, das den Würmern zugesetzt wird, um die Trocknungszeit auf dem Teller zu verkürzen.
3. Lipidergänzung für C. elegans
- Führen Sie eine Lipidergänzung in flüssiger Kultur durch, indem Sie die folgenden Schritte ausführen.
HINWEIS: Diese Methode eignet sich zum Testen von Transkriptionsveränderungen mit Massenwürmern, die mit Lipiden ergänzt wurden.- Übertragen Sie die gewünschte Menge an Lipid oder Vehikelkontrolle in jede der Vertiefungen in einer 12-Well-Platte. Bereiten Sie drei bis vier Brunnen für jede Fütterungsbedingung als biologische Replikation vor.
- Mischen Sie die Wurmsuspension aus Schritt 2.15 mit 5x BDR-Bakterien im Verhältnis 1:1, um eine Endkonzentration von 1.500 Würmern/ml und 2,5x für Bakterien zu erreichen.
- 2 mL des Wurm-Bakterien-Gemisches in BDR-Medium in jede Vertiefung der 12-Well-Platte überführen.
- Die 12-Well-Platte mit Folie umwickeln und in einem 20 °C Inkubator bei 100 U/min für die gewünschte Inkubationslänge schütteln.
HINWEIS: Um verschiedene Fütterungsbedingungen zu testen, inkubieren Sie die Lipide mit Würmern für unterschiedliche Zeiträume, z. B. für 6 h, 12 h und 24 h. Darüber hinaus können verschiedene Wurmstadien für optimale Ergebnisse getestet werden, einschließlich der Lipidfütterung aus dem L4- oder Tag-1-Erwachsenenstadium.
- Führen Sie eine Lipidergänzung auf den 10 cm NGM-Agarplatten durch, indem Sie die folgenden Schritte ausführen.
HINWEIS: Diese Methode eignet sich zum Testen von Transkriptionsveränderungen mit Massenwürmern, die mit Lipiden ergänzt wurden.- Samen Sie 1 ml der lipidkonditionierten Bakterien aus Schritt 1.9 auf die Mitte jeder der 10 cm Platten. Wenn eine große Anzahl von Platten vorbereitet wurde, wirbeln Sie die endgültige Arbeitslösung zwischen der Aussaat mehrmals ab. Trocknen Sie die Platten im Dunkeln mit einer Biosicherheitshaube.
- Übertragen Sie 3.000 Würmer aus Schritt 2.15 auf jede der 10 cm großen Platten. Trocknen Sie die Platten in einer Biosicherheitshaube, bis die Würmer auf den lipidergänzten Platten kriechen können, anstatt zu schwimmen.
- Inkubieren Sie die Würmer auf den lipidkonditionierten Platten in einem 20 °C Inkubator für die gewünschte Zeit. Vor Licht schützen, wenn Sie mehrfach ungesättigte Lipide verwenden.
HINWEIS: Um verschiedene Fütterungsbedingungen zu testen, inkubieren Sie die Lipide mit Würmern für verschiedene Zeiträume, z. B. 6 h, 12 h und 24 h. Darüber hinaus können verschiedene Wurmstadien auf optimale Ergebnisse getestet werden, einschließlich der Lipidfütterung im L4- oder Tag-1-Erwachsenenstadium.
- Führen Sie eine Lipidsupplementierung auf den 6 cm NGM-Agarplatten für die Transkriptionsanalyse durch.
HINWEIS: Diese Methode eignet sich zum Testen von Transkriptionsveränderungen bei einigen Würmern, die mit Lipiden ergänzt sind.- Samen Sie 300 μL lipidkonditionierte Bakterien aus Schritt 1.9 auf die Mitte jeder 6 cm großen Platte. Wenn eine große Anzahl von Platten vorbereitet wurde, wirbeln Sie die endgültige Arbeitslösung zwischen der Aussaat mehrmals ab. Trocknen Sie die Platten im Dunkeln mit einer Biosicherheitshaube.
- Übertragen Sie bis zu 300 Würmer aus Schritt 2.15 auf jede der 6 cm großen Platten. Trocknen Sie die Platten in einer Biosicherheitshaube, bis Würmer auf den lipidergänzten Platten kriechen können, anstatt zu schwimmen.
- Inkubieren Sie die Würmer auf den lipidkonditionierten Platten in einem 20 °C Inkubator für die gewünschte Zeit. Vor Licht schützen, wenn Sie mehrfach ungesättigte Lipide verwenden.
HINWEIS: Um verschiedene Fütterungsbedingungen zu testen, inkubieren Sie die Lipide zu verschiedenen Zeitpunkten mit Würmern, z. B. 6 h, 12 h und 24 h. Darüber hinaus können verschiedene Wurmstadien auf optimale Ergebnisse getestet werden, einschließlich der Lipidfütterung im L4- oder Tag-1-Erwachsenenstadium.
- Führen Sie eine Lipidsupplementierung an den 6 cm NGM-Agarplatten für die longitudinale Lebensdauer durch.
- Samen Sie 200 μL lipidkonditionierte Bakterien (mit 1x Lipidkonzentration und 5x konzentrierten Bakterien) auf die Mitte jeder der 6 cm NGM-Platten. Bereiten Sie drei Platten für jede Fütterungsbedingung vor.
HINWEIS: Die Teller müssen am Tag des Gebrauchs frisch zubereitet werden (idealerweise direkt vor Gebrauch). - Trocknen Sie die Platten in einer Biosicherheitshaube. Halten Sie Lichter in der Motorhaube und im Raum aus, wenn Sie mehrfach ungesättigte Lipide verwenden.
- Wählen Sie 30-40 synchronisierte L4-Würmer zu jeder der Platten. Bewahren Sie die Platten mit den Würmern in einem 20 °C Inkubator auf. Wenn Sie mit mehrfach ungesättigten Lipiden füttern, bewahren Sie die Teller in einer lichtgeschützten Box im 20 °C Inkubator auf.
HINWEIS: Es ist möglich, OP50 von einer normalen 6-cm-Durchgangsplatte (unkonditioniertes OP50) als Klebstoff zur Aufnahme von Würmern zu verwenden, aber es ist wichtig, keine große Menge des unkonditionierten OP50 in der Assay-Platte zu belassen. - Übertragen Sie die Würmer täglich oder jeden zweiten Tag auf neue, frisch zubereitete lipidkonditionierte Platten, abhängig von der gewünschten Fütterungsbedingung. Das Überleben wird auf die gleiche Weise bewertet wie zuvor beschrieben4.
- Samen Sie 200 μL lipidkonditionierte Bakterien (mit 1x Lipidkonzentration und 5x konzentrierten Bakterien) auf die Mitte jeder der 6 cm NGM-Platten. Bereiten Sie drei Platten für jede Fütterungsbedingung vor.
4. RNA-Extraktion für die Transkriptionsanalyse
- Führen Sie eine RNA-Extraktion aus einer großen Anzahl ganzer Würmer durch.
- Transferwürmer in der Flüssigkultur von Schritt 3,1 auf 1,5 ml Mikrozentrifugenröhrchen. Die Würmer aus Schritt 3.2 werden mit dem M9-Puffer von den 10-cm-Platten abgewaschen und die Schnecken im M9-Puffer in 1,5-ml-Mikrozentrifugenröhrchen überführt.
- Zentrifugieren Sie die Würmer kurz mit einer Tisch-Minizentrifuge (siehe Materialtabelle) für 10 s und saugen Sie den Überstand schnell ab.
- Übertragen Sie übrig gebliebene Würmer aus den flüssigen Futterbrunnen oder waschen Sie sie von den Plattenfütterungen in dasselbe Rohr und schleudern Sie sich herunter. Entfernen Sie den Überstand.
- Die Schneckenpellets mit 1 ml eiskaltem M9 waschen, mit einer Minizentrifuge 10 s kurz drehen und den Überstand absaugen. Wiederholen Sie 1x oder 2x, abhängig von der Transparenz des Überstands.
- Stellen Sie die Mikrozentrifugenröhrchen für 2 min auf Eis und entfernen Sie so viel Überstand wie möglich mit einer 200 μL Pipette, so dass ein verpacktes Schneckenpellet von nicht mehr als 15 μL Volumen übrig bleibt.
- 15 μL RNA-Extraktionslösung, die Phenol und Guanidinisothiocyanat (Table of Materials) enthält, in jedes der Mikrozentrifugenröhrchen überführen und die Würmer mit einem Motorschleifer ca. 30 s mahlen, bis keine intakten Würmer mehr sichtbar sind.
ACHTUNG: Die RNA-Extraktionslösung ist giftig und brennbar, und jeder Schritt, der einen offenen Behälter mit diesem Reagenz beinhaltet, muss in einer chemischen Haube betrieben werden. - 285 μL der RNA-Extraktionslösung in das Mikrozentrifugenröhrchen überführen, während der Inhalt der Schnecke von der Motorschleiferspitze in das Mikrozentrifugenröhrchen gespült wird. Vortex, um gründlich zu mischen.
HINWEIS: Dies ist ein Pausenpunkt. Die Proben können in der RNA-Extraktionslösung bei -80 °C für einige Monate gelagert werden. Bei Entnahme aus den -80 °C die Proben bei Raumtemperatur auftauen lassen. - Übertragen Sie 60 μL Chloroform in jede Probe und wirbeln Sie kräftig. Lassen Sie die Proben 10 min bei Raumtemperatur absetzen.
ACHTUNG: Chloroform ist giftig und muss in einer chemischen Haube gehandhabt werden. - Zentrifugieren bei 21.000 x g für 20 min bei 4 °C. Übertragen Sie vorsichtig 140 μL der wässrigen Schicht auf der Oberseite mit einer 200 μL Pipette in ein neues und RNase-freies Mikrozentrifugenröhrchen, wobei jedes Mal 2x mit 70 μL übertragen wird.
HINWEIS: Ab diesem Schritt müssen alle Pipettenspitzen und -behälter, die direkten Kontakt mit der Probe haben, RNase-frei sein. Es wird auch empfohlen, RNase-Dekontaminationslösung zu verwenden, um alle Geräte und den Arbeitsbereich abzuwischen. - 140 μL Isopropanol in das Probenröhrchen überführen. Wirbeln Sie kräftig vor und lassen Sie die Probe 10 min bei Raumtemperatur absetzen. Bei 21.000 x g 20 min bei 4 °C zentrifugieren und den gesamten Überstand vorsichtig entfernen.
- 0,5 mL eiskaltes 80% Ethanol (v/v) mit dem RNA-Pellet in das Probenröhrchen überführen. Wirbeln Sie kräftig, bis das RNA-Pellet den Boden des Röhrchens verlässt und in der Ethanollösung herumschwimmt. Bei 21.000 x g 10 min bei 4 °C zentrifugieren und den Überstand entfernen.
- Zentrifugieren Sie die Probenröhrchen in der Minizentrifuge kurz für 15 s, um das an der Röhrchenwand haftende Lösungsmittel herunterzuschleudern, und entfernen Sie dann die größtmögliche Ethanollösung mit einer Pipette.
- Lassen Sie die Schlauchkappe offen, um das RNA-Pellet zu trocknen. Wenn das Pellet gründlich mit der Ethanollösung gewaschen wurde, sollte der Trocknungsschritt weniger als 10 Minuten dauern.
HINWEIS: Dies ist ein Pausenpunkt. Das getrocknete RNA-Pellet kann bei -80 °C bis zu 1 Monat gelagert werden. - Das trockene RNA-Pellet wird mit 40 μL nukleasefreiem Wasser gelöst und mit einem DNA-Entfernungskit gemäß den Anweisungen des Herstellers verarbeitet (siehe Materialtabelle).
HINWEIS: Es wird empfohlen, RNA zuerst in nukleasefreiem Wasser aufzulösen. Wenn 40 μL Wasser mit dem 10x DNase-Puffer gemischt werden, bevor es in das RNA-Röhrchen überführt wird, löst sich das RNA-Pellet nicht vollständig auf. Die RNA-Proben müssen beim Auflösen des RNA-Pellets in Wasser auf Eis gehalten werden. Gefrier-Tau-Zyklen verringern die RNA-Qualität; Fahren Sie daher am selben Tag der DNase-Behandlung mit dem umgekehrten Transkriptionsschritt fort.
- RNA-Extraktion aus einer kleinen Anzahl ganzer Würmer.
- Pflücken Sie 15-20 Würmer von ihrem Bakterienrasen in eine frische, ungesäte NGM-Platte, um die Bakterien aus dem Wurm zu entfernen.
- Nach Angaben des Herstellers des qRT-PCR 2-Schritte-Kits (siehe Materialtabelle) werden 20 μL endgültige Lyselösung für jede Probe hergestellt, indem 0,2 μL DNase mit 19,8 μL Lyselösung in PCR-Röhrchen gemischt werden. Mischen Sie die Lyselösung, indem Sie 5x auf und ab pipettieren.
- 15-20 Würmer von der ungesäten NGM-Platte in das PCR-Röhrchen mit 20 μL der endgültigen Lyselösung mit der minimalen Anzahl von Bakterien überführen. Inkubieren Sie die Lysereaktion für 5 min bei Raumtemperatur.
- Sondierung (siehe Materialtabelle) der Würmer mit 30% Amplitude mit folgendem Programm: Ultraschall für 5 s, Pause für 5 s und 4x wiederholen mit einer Gesamtbeschallungszeit von 20 s. Bewahren Sie die Proben während der Beschallung in einem eiskalten Wasserbad auf.
- Bei Raumtemperatur 5 min inkubieren.
HINWEIS: Fügen Sie vor der Inkubation mehr DNase hinzu, wenn die NO-RT-Negativkontrolle eine DNA-Kontamination auf einem besorgniserregenden Niveau zeigt. - 2 μL Stopplösung in die Lysereaktion überführen und durch vorsichtiges Klopfen mischen. 2 min bei Raumtemperatur inkubieren und dann auf Eis legen.
HINWEIS: Die Proben können bis zu 2 Stunden auf Eis gelassen werden, bevor mit dem umgekehrten Transkriptionsschritt fortgefahren wird.
- Führen Sie eine RNA-Extraktion aus Wurmgeweben durch, indem Sie die folgenden Schritte ausführen.
- Pflücken Sie etwa 20 Würmer von ihrem Bakterienrasen und legen Sie sie auf eine frische, ungesäte NGM-Platte, um die Bakterien von ihnen zu entfernen.
- Bringen Sie die 20 Würmer (mit so wenig Bakterien wie möglich) in ein Uhrenglas, das 500 μL M9-Lösung mit 4 μM Levamisol enthält (siehe Materialtabelle). Die Immobilisierung erfolgt innerhalb von Sekunden.
- Wenn die Würmer immobilisiert sind, sezieren Sie die Keimbahn oder den Darm mit einer 25-G-Nadel, die an der 1-ml-Spritze befestigt werden kann.
- Führen Sie unter dem Sezierbereich einen Schnitt an der Position des zweiten Rachenkolbens durch, um eine natürliche Extrusion des Darms und der Keimbahn zu ermöglichen. Die beiden Gewebe können leicht anhand ihrer Morphologie und ihres unterschiedlichen Kontrasts unterschieden werden. Verwenden Sie eine Pinzette oder Nadeln, um das Gewebe vorsichtig zu trennen und sie nicht zu beschädigen.
HINWEIS: Es wird empfohlen, innerhalb von 5-10 Minuten zu sezieren. Wenn der Schnitt keine gute Gewebeextrusion ergibt, wird empfohlen, zum nächsten Wurm zu gehen und innerhalb von 10 Minuten so viele wie möglich zu sezieren. Dieses Verfahren erfordert einen kurzen Zeitrahmen, um transkriptionelle Veränderungen aus der Umgebung zu vermeiden.
- Führen Sie unter dem Sezierbereich einen Schnitt an der Position des zweiten Rachenkolbens durch, um eine natürliche Extrusion des Darms und der Keimbahn zu ermöglichen. Die beiden Gewebe können leicht anhand ihrer Morphologie und ihres unterschiedlichen Kontrasts unterschieden werden. Verwenden Sie eine Pinzette oder Nadeln, um das Gewebe vorsichtig zu trennen und sie nicht zu beschädigen.
- Nach Angaben des Herstellers des qRT-PCR 2-Schritte-Kits 20 μL endgültige Lyselösung für jede Probe vorbereiten, indem 0,2 μL DNase I bis 19,8 μL Lyselösung in den PCR-Röhrchen gemischt werden. Mischen Sie die Lyselösung, indem Sie 5x auf und ab pipettieren.
- Verwenden Sie eine autoklavierte Glaspipette, um das sezierte Gewebe in ein PCR-Röhrchen zu übertragen. Legen Sie die PCR-Röhrchen für 2 min auf Eis ab, um die Materialabscheidung am Boden zu ermöglichen. Entfernen Sie den Überstand, geben Sie 20 μL der endgültigen Lyselösung in das PCR-Röhrchen und mischen Sie durch Abklopfen.
- Inkubieren Sie die Lysereaktion für 5 min bei Raumtemperatur. Dann werden 2 μL Stopplösung in die Lysereaktion überführt und durch Klopfen gemischt. 2 min bei Raumtemperatur inkubieren.
HINWEIS: Die Proben können bis zu 2 Stunden auf Eis gelassen werden, bevor mit dem umgekehrten Transkriptionsschritt fortgefahren wird.
5. Reverse Transkription und qRT-PCR
- Führen Sie eine reverse Transkription und qRT-PCR von Massenwürmern durch.
- Messen Sie die RNA-Konzentration und bereiten Sie 5 μg Gesamt-RNA für die reverse Transkription vor.
- Bereiten Sie eine gepoolte RNA-Probe vor, indem Sie gleiche Mengen an RNA aus jeder Probe mischen und die endgültige RNA-Konzentration auf 0,556 g / L (5 μg / 9 μL) einstellen. Verwenden Sie die gepoolte RNA-Probe für die qRT-PCR-Standardkurve und RT-Negativkontrollen.
- Führen Sie die umgekehrte Transkription gemäß den Anweisungen des Herstellers durch (siehe Materialtabelle). Führen Sie die folgenden reversen Transkriptionsreaktionen der Qualitätskontrolle zusammen mit den einzelnen RNA-Proben durch.
- Führen Sie eine reverse Transkription mit der gepoolten RNA-Probe als Vorlage durch (für qRT-PCR-Standardkurve).
- Führen Sie eine umgekehrte Transkription mit der gepoolten RNA-Probe als Vorlage durch, ohne die umgekehrte Transkriptase (RT-Negativkontrolle; Qualitätskontrolle für potenzielle Genom-DNA-Kontamination).
- Durchführung der reversen Transkription mit dem nukleasefreien Wasser als Vorlage (RT-Negativkontrolle; Qualitätskontrolle bei möglicher RNA-Kontamination in Reagenzien).
HINWEIS: Dies ist ein Pausenpunkt. Die Proben können über Nacht im Thermocycler belassen oder einige Monate bei -20 °C gelagert werden.
- Verdünnen Sie die aus den gepoolten RNA-Proben erzeugte cDNA viermal, 20-mal, 100-mal und 500-mal mit nukleasefreiem Wasser für qRT-PCR-Standardkurven.
- Verdünnen Sie die aus jeder RNA-Probe erzeugte cDNA 20-100 Mal, um sie als Vorlage für die qRT-PCR-Reaktionen zu verwenden.
HINWEIS: Das Verdünnungsverhältnis hängt von der Häufigkeit des interessierenden Gens ab. Für hoch exprimierte Gene, wie Housekeeping-Gene oder egl-3 und egl-21 , die in dieser Studie verwendet werden, wird eine 100-fache Verdünnung empfohlen. Für niedrig exprimierte Gene wie lbp-8 wird eine 20-fache Verdünnung empfohlen. - Die qRT-PCR mit qRT-PCR-Reagenzien gemäß den Anweisungen des Herstellers wird wie folgt durchgeführt: 95 °C für 10 min, 40 mal wiederholen mit 95 °C für 15 s und 60 °C für 1 min, gefolgt vom Standard-Schmelzkurvenprogramm, und auf unbestimmte Zeit bei 8 °C halten.
- Führen Sie eine reverse Transkription und qRT-PCR von einigen Würmern oder Wurmgeweben durch.
- 25 μL RT-Puffer und 2,5 μL 20x RT-Enzymmischung aus dem qPCR-2-Schritte-Kit (siehe Materialtabelle) werden in jedes Röhrchen mit Wurmlysat aus Schritt 4.2.6 oder Schritt 4.3.6 überführt.
HINWEIS: Eine RT-Negativkontrolle ist entscheidend für qRT-PCR von einigen wenigen Würmern. Jedes Experiment muss eine Probe von Wurmlysat (aus Schritt 4.2.6) mit RT-Puffer, aber ohne RT-Enzym enthalten, um die DNA-Kontamination in den Proben zu untersuchen. Wenn eine DNA-Kontamination ein Problem darstellt, sollten Sie erwägen, dem Lysepuffer mehr DNase oder mehr DNase zur Probe hinzuzufügen, nachdem die Würmer lysiert wurden. Alternativ kann man eine RT-Negativkontrolle für jede Probe durchführen, indem man die Hälfte des Lysats in einer normalen RT-Reaktion und die andere Hälfte in einer RT-Reaktion ohne reverse Transkriptase verwendet. - Durch vorsichtiges Klopfen mischen. Mit einer Minizentrifuge für 10 s herunterdrehen.
- Laden Sie die Proben gemäß den Anweisungen des Herstellers in die Thermocycler-Maschine: 37 °C für 60 min, 95 °C für 5 min und 8 °C für unbestimmte Zeit.
HINWEIS: Dies ist ein Pausenpunkt. Die Proben können über Nacht im Thermocycler belassen oder einige Monate bei -20 °C gelagert werden. - Halten Sie alle Reagenzien und Proben auf Eis und schützen Sie die qRT-PCR-Reagenzien vor Licht.
- Bereiten Sie eine 96-Well-qPCR-Platte vor und mischen Sie in jeder Vertiefung 6 μL nukleasefreies Wasser, 10 μL qRT-PCR-Reagenz, 2 μL 5 μM Primer-Mischung (vorwärts und rückwärts) und 2 μL cDNA. Decken Sie die Oberfläche der 96-Well-qPCR-Platte mit einem optischen Schutzfilm ab und drücken Sie sie nach unten, um sie zu versiegeln.
- Führen Sie das qRT-PCR-Programm auf einem Thermocycler gemäß den Anweisungen des Herstellers wie folgt aus: 50 °C für 2 min, 95 °C für 2 min, 40 mal wiederholen mit 95 °C für 3 s und 60 °C für 30 s, gefolgt von 8 °C auf unbestimmte Zeit.
- 25 μL RT-Puffer und 2,5 μL 20x RT-Enzymmischung aus dem qPCR-2-Schritte-Kit (siehe Materialtabelle) werden in jedes Röhrchen mit Wurmlysat aus Schritt 4.2.6 oder Schritt 4.3.6 überführt.
Ergebnisse
Validierung von Transkriptionsveränderungen mit einigen ganzen Würmern nach Lipidsupplementierung
Um zu untersuchen, ob das Protokoll zur Extraktion und Retrotranskribierung von RNA in cDNA von einigen ganzen Würmern reproduzierbar und vergleichbar mit den Daten von Massenwürmern ist, wurde ein langlebiger Wurmstamm verwendet, der die lysosomale saure Lipase lipl-4 im Darm überexprimiert 7,8,33,35. Die in früheren Studien 7,8,33 berichtete transkriptionelle Induktion der Neuropeptid-verarbeitenden Gene egl-3 und egl-21 wurde validiert (Abbildung 2A,B). Diese Induktion deutet darauf hin, dass die RNA-Extraktionsmethode von wenigen Tieren eine gültige Alternative zu Standard-cDNA-Synthesetechniken aus Massenwurmkulturen darstellt.
Validierung von transkriptionellen Bewertungen mit seziertem Wurmgewebe nach Lipidsupplementierung
Bei C. elegans ist die Synthese von 20-Kohlenstoff-PUFAs von der Aktivität der Desaturase FAT-316,17 abhängig. Frühere Studien haben berichtet, dass Fett-3-Mutanten 20-Kohlenstoff-PUFAs fehlen, einschließlich DGLA16. Zuvor wurde entdeckt, dass der Verlust der Δ6-Desaturase FAT-3 in lipl-4g-Würmern die transkriptionelle Induktion der Neuropeptid-verarbeitenden Gene egl-3 und egl-2133 unterdrückt. Darüber hinaus rettet die DGLA-Supplementierung eine solche Induktion33. Das Gen, das für egl-21 kodiert, wird in Neuronen exprimiert, während egl-3 sowohl in Neuronen als auch im Darm nachgewiesen wird36,37. Um weiter zu testen, ob die DGLA-Supplementierung die Induktion von egl-3 und egl-21 im Darm oder in den Neuronen wiederherstellt, wurde der Darm seziert und ihre Transkriptionsspiegel wurden mittels qRT-PCR-Analyse bewertet, die in den Schritten 4.3 und 5.2 dieses Protokolls beschrieben ist. DGLA wurde in der Ausgangsnahrung für 12 Stunden im Erwachsenenalter von Tag 1 ergänzt. Es wurde keine transkriptionelle Induktion von egl-3 oder egl-21 im Darm gefunden (Abbildung 2C), was mit früheren Befunden übereinstimmt 36,38.
Validierung des Lebensdauerassays bei Lipidsupplementierung
Die Beziehung zwischen 20-Kohlenstoff-PUFAs und dem Langlebigkeitsmechanismus, der Fett-3 inaktiviert, wurde zuvor untersucht, insbesondere im Darm von Lipl-4g-Würmern 33. Es wurde festgestellt, dass der Fett-3-Knockdown die durch lipl-433 verliehene Lebensdauerverlängerung vollständig unterdrückt. Um zu beurteilen, ob DGLA die durch Lipl-4 vermittelte Langlebigkeit wiederherstellt, wurde DGLA jeden zweiten Tag frisch in die Ausgangsnahrung am Tag 1 des Erwachsenenalters ergänzt. Es wurde festgestellt, dass die DGLA-Supplementierung nach Fett-3-Knockdown die Lebensdauerverlängerung rettet (Abbildung 2D)33, was auf ein erfolgreiches Lipidsupplementierungsverfahren in Verbindung mit dem Lebensdauertest hinweist.
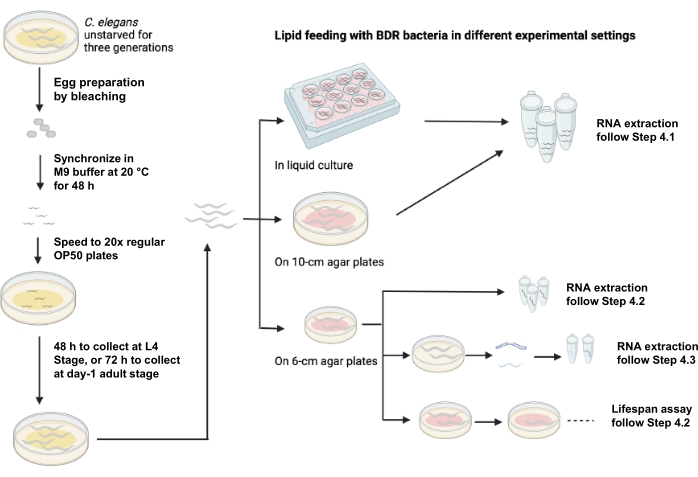
Abbildung 1: Schematische Darstellung der Lipidfütterung unter Verwendung verschiedener experimenteller Einstellungen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Validierung der Transkriptionsbewertung der Neuropeptid-verarbeitenden Gene anhand einer großen Population von Würmern, einigen Würmern und seziertem Gewebe. (A) RNA, die aus einer großen Population von Würmern extrahiert wurde, zeigt die Induktion der egl-3- und egl-21-Transkriptspiegel der Neuropeptid-verarbeitenden Gene in lipl-4 Tg-Tieren. Fehlerbalken repräsentieren ±1 SEM. **** p < 0,0001 durch zweiseitigen Student's t-Test. (B) RNA-Extraktion aus einigen wenigen Würmern bestätigt die Induktion der egl-3- und egl-21-Transkriptspiegel der Neuropeptid-verarbeitenden Gene in lipl-4 Tg-Ern. Fehlerbalken repräsentieren ±1 SEM. **** p < 0,0001 durch zweiseitigen Student's t-Test. (C) Neuronale Neuropeptide verarbeitende Gene egl-3 und egl-21 werden im sezierten Darm nicht induziert. Fehlerbalken repräsentieren ±1 SEM. Statistische Auswertung mit zweiseitigem Student's t-Test. (D) DGLA-Supplementierung bei verschiedenen Konzentrationen, einschließlich 10 μm, 100 μm und 1 mM, rettet den lipl-4Tg-Langlebigkeitseffekt auf Fett-3-RNAi. p < 0,001 durch Log-Rank-Test. Diese Abbildung stammt von Savini et al.33. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Lipidergänzung wurde in der Alterungsforschung eingesetzt, um die direkten Auswirkungen bestimmter Lipidspezies auf gesundes Altern aufzuklären 6,7,23,26,27,31. Das Lipidergänzungsverfahren kann jedoch eine Herausforderung darstellen, und jede Inkonsistenz zwischen Experimenten kann zu nicht reproduzierbaren Ergebnissen führen. Hier wird das erste detaillierte Schritt-für-Schritt-Protokoll dokumentiert, das neue Wissenschaftler anleitet, die potenziellen Fallstricke durch technische Ungenauigkeiten zu vermeiden. Die kritischen Schritte in diesem Protokoll werden in den folgenden Abschnitten ausführlich erörtert. Die Toolbox der Lipidforschung wird auch durch die Einführung einer RNA-Isolierung von nur wenigen Würmern und spezifischen Wurmgeweben nach der Lipidsupplementierung erweitert. Bei der Betrachtung der Methodik zur Untersuchung von Transkriptspiegeln eignet sich die qRT-PCR mit einigen wenigen Würmern oder sezierten Geweben hervorragend, um einige wenige Transkripte zu analysieren oder bestimmte gewebespezifische transkriptionelle Veränderungen zu untersuchen. Darüber hinaus könnte die Verwendung dieser Methoden den Schritt der Wurmamplifikation überwinden, der etwa 5-6 zusätzliche Tage dauern kann. Gleichzeitig ist die Lipidfütterung mit anschließender RNA-Extraktion kostengünstiger und eine gültige Alternative, wenn ein größerer Satz von Zielgenen analysiert werden muss.
Mehrere Schritte können für die Reproduzierbarkeit von Lipidfütterungseffekten entscheidend sein. Der erste Aspekt hängt mit den bakteriellen Bedingungen zusammen. Es wird empfohlen, frische Bakterienplatten zu verwenden, die nicht älter als 7 Tage für die Impfung sind. Es wird empfohlen, Bakterien zu verwenden, die innerhalb von 1 Woche in BDR-Medium hergestellt wurden. Bakterien, die mit Lipiden vermischt wurden, müssen sofort verwendet werden. Lipide mit Bakterien sollten auch bei 4 °C nicht gelagert werden, da die Bakterien die Lipide verstoffwechseln. Die Waschschritte in der BDR-Basis und die Resuspension im BDR-Medium sind entscheidend für Bakterienzustände, da Bakterien in LB gezüchtet wurden und direkt an Würmer verfüttert wurden, beseitigt immer die tiefgreifenden Auswirkungen von Lipidpräparaten. Der zweite Faktor ist mit Wurmbedingungen verbunden. C. elegans muss mindestens drei Generationen vor dem Bleichen für die Eizubereitung nicht verhungert sein, um sicherzustellen, dass sie sich in einem gesunden und stabilen Stoffwechselzustand befinden. Es ist auch wichtig, C. elegans vor der Lipidsupplementierung auf Agarplatten zu kultivieren; Dies gilt auch vor und nach dem Synchronisierungsschritt.
Würmer, die sich längere Zeit an flüssige Kulturen angepasst haben, sind teilweise verhungert; Hunger erhöht die Basislinie für Langlebigkeitsgene, was zu einer geschwächten Wirkung der Lipidergänzung führt. Wenn die metabolische Drift und Veränderungen mit blockierten L1-Larven Bedenken haben, wäre eine gültige Alternative, die Eier direkt zu platten. Wenn nur wenige Würmer benötigt werden, um eine Lebensdauer- oder Genexpressionsanalyse durchzuführen, ist es möglich, Eier direkt auf lipidkonditionierten Platten zu legen und sie durch Handpflücken im L4-Stadium für nachfolgende Experimente neu zu synchronisieren. Wenn jedoch große Mengen an Würmern benötigt werden, wenn L4 nicht von Hand gepflückt werden kann, ist das direkte Plattieren von Eiern nicht ideal. Eier, die nach dem Bleichen von graviden Erwachsenen schlüpfen, können zu unterschiedlichen Zeitpunkten auftreten und dazu führen, dass die Population nicht synchronisiert ist, was die Transkriptionsanalyse beeinträchtigen würde. Der dritte kritische Teil hängt mit den Lipidspeicherbedingungen zusammen; Bei der Ergänzung von PUFAs ist besondere Aufmerksamkeit erforderlich, da diese Moleküle lichtempfindlich und anfällig für Oxidation in der Luft sind.
Mehrere Lipidfütterungsbedingungen, einschließlich Wurmstadien, Ergänzungslänge und Konzentrationen, erfordern weitere Untersuchungen beim Testen neuer Lipidmoleküle. L4, Tag-1 Erwachsene und Tag-2 erwachsene Würmer sind in der Regel der Ausgangspunkt für Tests in verschiedenen Wurmstadien. Insbesondere bei der Fütterung von L4-Würmern, wenn die Inkubationszeit um die Nematodenhäutungsphase endet, wird eine große Variation erwartet, die die Signifikanz und Reproduzierbarkeit der Ergebnisse stark beeinflusst. Eine zusätzliche Herausforderung für die Verwendung von adulten Tag-1- oder Tag-2-Würmern hängt mit den Nachkommen zusammen, die die Genexpressionsanalyse erschweren können. In diesem Fall ist die RNA-Extraktion aus einigen ganzen Würmern zuverlässiger als Massenpopulationen. Verschiedene Lipidmoleküle haben unterschiedliche Konzentrationsbereiche, um physiologische Effekte zu erzeugen; daher wird eine Reihe von Konzentrationen von 1 μM bis 1 mM zur Prüfung vorgeschlagen.
Es gibt einige Einschränkungen, die bei der Wahl der Fütterungsmethode zu beachten sind. Erstens, wenn Lipide nicht von den Würmern absorbiert oder aufgenommen werden können, ist es schwierig, eine Ergänzungsmethode zu verwenden, um ihre biologische Wirkung in C. elegans zu testen. Mit aktuellen Technologien sind Massenspektrometrie oder SRS gekoppelt mit 13C- oder 2H-markierten Lipidverbindungen39 gültige Werkzeuge, um die Lipidaufnahme in den Wurmkörper zu testen. Zweitens sind diese Fütterungsmethoden nicht für Untersuchungstechniken mit hohem Durchsatz optimiert. Bei der Lipidsupplementierung mit Massenwürmern ist die Probenvorbereitung aus der Flüssigfütterungsmethode schneller als die Fütterung auf der Platte, da die flüssigen Kulturen direkt in Mikrozentrifugenröhrchen übertragen werden können, anstatt von den Futterplatten abzuwaschen. Um sicherzustellen, dass sich die extrahierte RNA im Erntezustand befindet, wird empfohlen, nicht mehr als 15-20 Minuten zwischen dem Einlegen der Würmer auf Eis und dem Mahlen in der RNA-Extraktionslösung verstreichen zu lassen. Es wird empfohlen, alle 15 Minuten weniger Bedingungen zu verarbeiten, wenn eine hohe Anzahl von Proben verarbeitet werden muss. Für die Extraktion ganzer Wurm-RNA von einigen wenigen Tieren ist der Schritt der Handpflückung der geschwindigkeitsbegrenzende Schritt, während es für das Sezieren von Geweben entscheidend ist, zeiteffizient zu handeln, um eine langfristige Exposition gegenüber einer unphysiologischen Umgebung zu vermeiden. Ähnlich wie bei der Massen-RNA-Extraktion ist das Sammeln von Würmern oder das Sezieren von Gewebeproben innerhalb von 10 Minuten vorzuziehen.
Trotz der Einschränkungen können diese Ergänzungsmethoden über die Lipidforschung hinaus verwendet werden, um die Identifizierung ernährungsphysiologischer und medizinischer Wirkungen zu unterstützen. Die hier beschriebenen Verfahren beschränken sich nicht nur auf die Alternsforschung, sondern auch auf alternative Phänotypen zur Beurteilung der Organellenfitness und der metabolischen Homöostase von Zellen. Die Supplementierungsmethode mit Massenpopulation kann mit RNA-seq für die Transkriptomanalyse, Massenspektrometrie für metabolomische und proteomische Analyse oder Western Blot für die Analyse spezifischer Proteinmarker gekoppelt werden, während die Lipidsupplementierung mit einigen wenigen Würmern mit Bildgebung und Verhaltensanalyse kombiniert werden kann.
Offenlegungen
Die Autoren haben keine Interessenkonflikte.
Danksagungen
Wir danken P. Svay für die Unterstützung bei der Wartung. Diese Arbeit wurde durch die NIH-Zuschüsse R01AG045183 (MCW), R01AT009050 (MCW), R01AG062257 (MCW), DP1DK113644 (MCW), March of Dimes Foundation (MCW), Welch Foundation (MCW), HHMI Investigator (M.C.W.) und NIH T32 ES027801 Pre-doctoral Student Fellow (M.S.) unterstützt. Einige Stämme wurden vom CGC bereitgestellt, das vom NIH Office of Research Infrastructure Programs (P40 OD010440) finanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
Referenzen
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten