Method Article
Suplementação lipídica para longevidade e análise transcricional gênica em Caenorhabditis elegans
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve métodos de suplementação lipídica em culturas líquidas e a placas para Caenorhabditis elegans, juntamente com estudos longitudinais e análise transcricional gênica a granel ou de alguns vermes e tecidos de vermes.
Resumo
O envelhecimento é um processo complexo caracterizado por mudanças fisiológicas progressivas resultantes de contribuições ambientais e genéticas. Os lipídios são cruciais na constituição de componentes estruturais das membranas celulares, no armazenamento de energia e como moléculas sinalizadoras. A regulação do metabolismo lipídico e da sinalização é essencial para ativar vias distintas de longevidade. A lombriga Caenorhabditis elegans é um organismo excelente e poderoso para dissecar a contribuição do metabolismo lipídico e da sinalização na regulação da longevidade. Vários estudos de pesquisa descreveram como a suplementação dietética de moléculas lipídicas específicas pode prolongar a vida útil de C. elegans ; no entanto, pequenas diferenças nas condições de suplementação podem causar problemas de reprodutibilidade entre os cientistas em diferentes laboratórios. Aqui, dois métodos detalhados de suplementação para C. elegans são relatados empregando suplementação lipídica com bactérias semeadas em placas ou suspensão bacteriana em cultura líquida. Também são fornecidos aqui os detalhes para realizar ensaios de vida útil com suplementação lipídica ao longo da vida e análise qRT-PCR usando um lisado de verme inteiro ou tecidos dissecados derivados de alguns vermes. Usando uma combinação de estudos longitudinais e investigações transcricionais sobre a suplementação lipídica, os ensaios de alimentação fornecem abordagens confiáveis para dissecar como os lipídios influenciam a longevidade e o envelhecimento saudável. Essa metodologia também pode ser adaptada para várias abordagens de triagem nutricional para avaliar mudanças em um subconjunto de transcritos usando um pequeno número de tecidos dissecados ou alguns animais.
Introdução
Lípidos
Os lipídios são pequenas moléculas hidrofóbicas ou anfipáticas solúveis em solventes orgânicos, mas insolúveis em água 1,2. Moléculas lipídicas distintas se diferenciam umas das outras com base no número de carbonos contidos em suas cadeias, localização, número de ligações duplas e estruturas ligadas, incluindo glicerol ou fosfatos. Os lipídios desempenham papéis cruciais dentro e através de células distintas para regular as funções do organismo, incluindo a constituição de bicamadas de membrana, fornecendo armazenamento de energia e atuando como moléculas sinalizadoras 3,4.
Primeiro, os lipídios são componentes estruturais das membranas biológicas, incluindo a membrana plasmática e as membranas subcelulares intracelulares que dividem os compartimentos internos do ambiente extracelular. Em segundo lugar, os lipídios são a principal forma de armazenamento de energia em animais vertebrados e invertebrados. Lipídios neutros, incluindo triacilgliceróis, são armazenados por um período prolongado em vários tecidos, inclusive no tecido adiposo. No nematoide Caenorhabditis elegans, o intestino é o principal órgão metabólico de armazenamento de gordura; sua função não está envolvida apenas na digestão e absorção de nutrientes, mas também no processo de desintoxicação, que se assemelha à atividade dos hepatócitos de mamíferos. Outros tecidos de armazenamento de gordura incluem a linha germinativa, na qual os lipídios são essenciais para o desenvolvimento de ovócitos, e a hipoderme, que é composta por células epidérmicas semelhantes à pele 3,5. Em terceiro lugar, nos últimos anos, mais evidências sugeriram que os lipídios são poderosas moléculas sinalizadoras envolvidas na sinalização intra e extracelular, agindo diretamente em uma variedade de receptores, incluindo receptores nucleares e acoplados à proteína G, ou indiretamente via modulação da fluidez da membrana ou modificações pós-translacionais 6,7,8,9 . Novos estudos continuarão a elucidar os mecanismos moleculares subjacentes da sinalização lipídica na promoção da longevidade e da saúde.
Organismos modelo são importantes para abordar questões biológicas específicas que são muito complexas para serem estudadas em humanos. Por exemplo, a lombriga C. elegans é um excelente modelo para a realização de análises genéticas para dissecar processos biológicos relevantes para a nutrição humana e doenças10. As vias moleculares altamente conservadas relevantes para a fisiologia humana, tecidos complexos, padrões comportamentais e abundantes ferramentas de manipulação genética fazem de C. elegans um organismo modelo notável11. Por exemplo, C. elegans é excelente no encaminhamento de telas genéticas para identificar genes específicos do fenótipo, bem como em telas genéticas reversas em todo o genoma via interferência de RNA12.
Em laboratórios, os nematoides são cultivados em placas de Petri de ágar semeadas com um gramado da bactéria Escherichia coli, fornecendo macronutrientes como proteínas, carboidratos e ácidos graxos saturados e insaturados como fontes de energia e blocos de construção, e micronutrientes como cofatores e vitaminas13. Semelhante aos mamíferos, os nematoides sintetizam moléculas de ácidos graxos a partir do ácido palmítico e do ácido esteárico (moléculas saturadas de 16 carbonos e 18 carbonos, respectivamente) que são sequencialmente dessaturadas e alongadas para uma variedade de ácidos graxos monoinsaturados (MUFAs) e ácidos graxos poli-insaturados (PUFAs)14,15,16,17,18. Curiosamente, C. elegans é capaz de síntese de novo de todos os ácidos graxos necessários e enzimas centrais envolvidas na biossíntese, dessaturação e alongamento de ácidos graxos, facilitando a síntese de PUFAs de cadeia longa19. Diferente de outras espécies animais, C. elegans pode converter ácidos graxos ω-6 de 18 carbonos e 20 carbonos em ácidos graxos ω-3 com suas próprias enzimas ω-3 dessaturase. Além disso, os vermes possuem uma dessaturase Δ12 que catalisa a formação de ácido linoleico (LA) a partir do ácido oleico (OA, 18:1)20,21. A maioria dos animais ou plantas carece de dessaturações Δ12 e ω-3 e, portanto, depende da ingestão dietética de ω-6 e ω-3 para obter seus PUFAs, enquanto C. elegans não requer ácidos graxos dietéticos22. Mutantes isolados sem enzimas dessaturase funcionais têm sido usados para estudar as funções de ácidos graxos específicos em processos biológicos distintos, incluindo reprodução, crescimento, longevidade e neurotransmissão. O efeito de ácidos graxos individuais em vias biológicas específicas pode ser abordado tanto por meio de uma abordagem genética quanto de suplementação dietética16,17,23. Até o momento, a pesquisa lipídica tem se concentrado em caracterizar genes envolvidos na síntese, degradação, armazenamento e quebra lipídica em condições neurológicas e de desenvolvimento24. No entanto, os papéis dos lipídios na regulação da longevidade estão apenas começando a ser revelados.
Sinalização lipídica na regulação da longevidade
Os lipídios desempenham papéis cruciais na regulação da longevidade, ativando cascatas de sinalização celular em tecidos e tipos de células distintos. Estudos recentes têm destacado os papéis ativos dos lipídios na modulação da transcrição e da comunicação célula-célula via proteínas ligadoras de lipídios ou no reconhecimento de receptores de membrana25. Além disso, a suplementação lipídica dietética oferece uma excelente ferramenta para dissecar como o metabolismo lipídico influencia a expectativa de vida em C. elegans. Distintos MUFAs e PUFAs demonstraram promover a longevidade ativando fatores de transcrição26,27.
Modelos de longevidade, incluindo a sinalização insulina/IGF-1 e a ablação de células precursoras da linha germinativa, estão associados à via de biossíntese MUFA, e a suplementação de MUFA, incluindo ácido oleico, ácido palmitoléico e cis-vaccênico, é suficiente para prolongar a vida útil de C. elegans 26. Embora o efeito de longevidade conferido pela administração de MUFA exija uma investigação mais aprofundada, o mecanismo subjacente provavelmente será mediado pelo fator de transcrição SKN-1/Nrf2, que é um ativador chave da resposta ao estresse oxidativo e da regulação da longevidade28,29. Entre os MUFAs, uma classe particular de etanolamidas-acila gordurosas chamadas N-aciletanolaminas (NAEs) desempenha papéis cruciais em mecanismos distintos, incluindo inflamação, alergias, aprendizado, memória e metabolismo energético30. Particularmente, a molécula lipídica conhecida como oleoiletanamida (OEA) foi identificada como um regulador positivo da longevidade, promovendo a translocação da proteína de ligação lipídica 8 (LBP-8) para o núcleo para ativar os receptores hormonais nucleares NHR-49 e NHR-807. A suplementação do análogo da OEA KDS-5104 é suficiente para prolongar a vida útil e induz a expressão de genes envolvidos nas respostas oxidativas ao estresse e na β-oxidação mitocondrial 7,8.
Ao mesmo tempo, o papel dos PUFAs também tem sido associado à regulação da longevidade. A administração de ácido graxo PUFA ω-3 α-linolênico (ALA) promove a longevidade ativando os fatores de transcrição NHR-49/PPARα, SKN-1/NRF e induzindo a β-oxidação mitocondrial31. Curiosamente, os produtos peroxidados de ALA, referidos como oxilipinas, ativam o SKN-1/NRF, sugerindo que tanto os PUFAs quanto seus derivados oxidativos podem conferir benefícios de longevidade23. A suplementação de ácido graxo ω-6 ácido araquidônico (AA) e ácido dihomo-γ-linolênico (DGLA) prolonga a vida útil por meio da ativação da autofagia, promovendo o controle de qualidade proteico e resultando na degradação de agregados proteicos desperdiçados e tóxicos27,32. Mais recentemente, uma regulação de sinalização celular não autônoma mediada pela proteína de ligação lipídica 3 (LBP-3) e DGLA tem se mostrado crucial para promover a longevidade, enviando sinais periféricos aos neurônios, sugerindo um papel de longo alcance das moléculas lipídicas na comunicação intertecidual em níveis sistêmicos33. O presente estudo relata cada etapa para a realização da suplementação lipídica com bactérias semeadas em placas ou suspensão bacteriana em cultura líquida. Essas metodologias são usadas para avaliar a expectativa de vida e a análise transcricional, empregando conteúdo de corpo inteiro ou tecidos dissecados derivados de alguns vermes. As técnicas a seguir podem ser adaptadas a uma variedade de estudos nutricionais e oferecem uma ferramenta válida para dissecar como o metabolismo lipídico influencia a longevidade e o envelhecimento saudável.
Protocolo
A Figura 1 mostra um esquema de alimentação lipídica utilizando diferentes cenários experimentais.
1. Preparação de bactérias condicionadas por lípidos
- Preparar a solução de base de restrição alimentar por diluição bacteriana (BDR) dissolvendo 5,85 g de NaCl, 1,0 g de K 2HPO 4 e 6,0 g de KH2PO4 (ver Tabela de Materiais) em 999 mL de água deionizada. Ajuste o pH para 6,0 com 0,5 M KOH e, em seguida, filtre através de um filtro de 0,22 μm.
NOTA: A solução BDR pode ser armazenada à temperatura ambiente para armazenamento a longo prazo. - Preparar o meio BDR adicionando 10 μL de 5 mg/mL de colesterol (dissolvido em etanol à prova de 200) a cada 10 mL de solução de base de BDR.
- Escorra as bactérias OP50 (ver Tabela de Materiais) do stock de -80 °C para as placas de ágar LB e incube a 37 °C durante a noite.
NOTA: Após a incubação durante a noite a 37 °C, a placa OP50 pode ser armazenada a 4 °C durante um período máximo de 1 semana para resultados de alimentação estáveis. - Inocular as bactérias OP50 da placa de ágar OP50 LB para o meio LB e incubar num agitador de 37 °C durante a noite (16 h).
NOTA: O volume médio LB necessário depende das configurações experimentais. Recomenda-se usar 200 μL de 5x de bactérias concentradas semeadas em cada uma das placas de 6 cm e 1 mL de 5x de bactérias concentradas para cada uma das placas de 10 cm e cada réplica das condições de alimentação líquida. Assim, 1 mL e 5 mL de inoculação inicial de LB devem ser preparados para cada cultura de alimentação lipídica, respectivamente. - Coletar bactérias por centrifugação a 4.000 x g por 10 min à temperatura ambiente. Descarte o sobrenadante.
- Suspender o pellet bacteriano em 20 mL de base BDR e centrifugar a 4.000 x g por 10 min. Descarte o sobrenadante.
NOTA: Esta etapa é fundamental para lavar os resíduos remanescentes de LB no pellet bacteriano. - Suspenda cada pellet bacteriano no meio BDR para fazer um estoque de bactérias BDR 20x. Dilua o estoque de bactérias BDR 20x com o meio BDR para 5x antes do uso.
NOTA: Use um volume de 1/20 de meio BDR do volume LB original para atingir uma concentração de 20x para as bactérias. O estoque de bactérias 20x pode ser armazenado a 4 °C por até 1 semana. - Prepare uma solução de estoque lipídico, usando etanol ou sulfóxido de dimetilo (DMSO) como solvente em um novo frasco de vidro autoclavado e encha o frasco de vidro com argônio ou nitrogênio para evitar a oxidação.
NOTA: A concentração da solução-mãe situa-se geralmente entre 250 mM e 1 mM. - Transfira a solução de estoque lipídico para a quantidade desejada de solução de bactérias BDR para atingir a concentração final desejada nas condições de alimentação. Misture bem por vórtice por 20 s.
NOTA: A concentração final dos lipídios na alimentação é geralmente de 1 μM a 1 mM, dependendo das condições lipídicas e de teste. Recomenda-se executar um experimento piloto primeiro para testar diferentes concentrações que variam de 0,1 μM a 1 mM se trabalhar com novos lipídios. Misture a solução de estoque lipídico com bactérias BDR imediatamente antes de semeá-la na placa ou colocá-la em culturas líquidas de vermes. Prepare as bactérias condicionadas por lipídios não mais de 1 h antes de alimentar os vermes. - Misture os mesmos volumes de etanol filtrado ou DMSO (dependendo de qual é usado para o grupo de alimentação lipídica) com bactérias BDR para servir como controle do veículo.
2. Preparação de C. elegans sincronizado para suplementação lipídica
- Preparar o tampão M9 misturando (utilizando concentrações finais especificadas) 22 mM KH 2 PO4, 22 mM Na 2 HPO 4, 85 mM NaCl e2mM MgSO 4 (ver Tabela de Materiais). Autoclave o tampão para esterilizar.
- Preparar uma solução de lixívia fresca com lixívia doméstica a 60% (v/v, ver Tabela de Materiais) e uma concentração final de 1,6 M de NaOH.
- Coletar adultos gravídicos em um tubo cônico de 15 mL usando 10 mL de tampão M9.
NOTA: O número de vermes e placas necessários para a sincronização depende das configurações experimentais (ou seja, número de condições e replicações e métodos de alimentação). Idealmente, cada placa completa de 6 cm de vermes adultos deve ser capaz de produzir pelo menos 600 vermes L1 após a sincronização. - Gire os vermes a 1.450 x g por 30 s. Retire o sobrenadante e enxágue os vermes mais uma vez com 10 mL de tampão M9.
- Gire os vermes a 1.450 x g por 30 s. Aspirar o sobrenadante, deixando uma alíquota de 4 mL no tubo cônico. Adicione 2 ml de solução de lixívia e agite vigorosamente durante 1 min.
- Gire os vermes a 1.450 x g por 30 s à temperatura ambiente.
- Retirar o sobrenadante e adicionar 4 ml de tampão M9 e 2 ml de solução de lixívia. Agite o tubo até que os corpos dos vermes estejam dissolvidos.
- Gire os ovos a 1.450 x g por 30 s à temperatura ambiente.
- Retire o sobrenadante e lave os ovos com 10 mL de tampão M9.
- Repita as etapas 2.8 e 2.9 3x.
- Suspender os embriões com 6 mL de tampão M9. Agite os embriões em um rotador a 20 °C por 2 dias para deixá-los eclodir e sincronizar.
- Transfira larvas L1 para placas semeadas OP50. Incubar a 20 °C durante 48 h para recolher vermes L4 sincronizados, 72 h para adultos do dia 1 e 96 h para adultos do dia 2.
NOTA: As placas OP50 são preparadas adicionando 1 mL de 20x bactérias OP50 a cada placa34 do meio de crescimento de nematoides (NGM) de 10 cm. 30.000 vermes L1 podem ser semeados em cada uma das placas OP50 com o objetivo de colher os vermes no estágio L4, e 20.000 vermes L1 podem ser semeados em cada uma das placas OP50 com o objetivo de colher adultos do dia 1 nos presentes ambientes experimentais. Pode ser diferente para diferentes configurações de laboratório, por isso recomenda-se testar os números de vermes que podem ser semeados para garantir que os vermes tenham comida suficiente antes de serem colhidos. - Colete vermes L4, adultos do dia 1 ou adultos do dia 2 em um tubo cônico de 15 mL usando 10 mL de tampão M9. Use mais 5 mL de tampão M9 para enxaguar os vermes que sobraram das placas.
- Gire os vermes a 1.450 x g por 30 s e descarte o sobrenadante. Lave o pellet de minhoca com 10 mL de meio BDR, centrifugar a 1.450 x g por 30 s e descarte o sobrenadante.
- Para vermes no método de alimentação líquida, transfira o meio BDR para os vermes para atingir uma concentração de vermes de 3.000 vermes/mL. Para vermes em métodos de alimentação a placa, reduza o volume de meio BDR adicionado aos vermes para reduzir o tempo de secagem na placa.
3. Suplementação lipídica para C. elegans
- Realizar suplementação lipídica em cultura líquida seguindo os passos abaixo.
NOTA: Este método é adequado para testar alterações transcricionais usando vermes a granel suplementados com lipídios.- Transfira a quantidade desejada de lipídios ou controle do veículo para cada um dos poços em uma placa de 12 poços. Prepare de três a quatro poços para cada condição de alimentação como uma replicação biológica.
- Misture a suspensão de minhoca da etapa 2.15 com 5x bactérias BDR em uma proporção de 1:1 para atingir uma concentração final de 1.500 vermes/mL e 2,5x para bactérias.
- Transfira 2 mL da mistura verme-bactéria em meio BDR para cada poço da placa de 12 poços.
- Envolver a placa de 12 poços com papel alumínio e agitar numa incubadora a 20 °C a 100 rpm para o comprimento de incubação desejado.
NOTA: Para testar diferentes condições de alimentação, incube os lipídios com vermes por diferentes períodos de tempo, como por 6 h, 12 h e 24 h. Além disso, diferentes estágios de vermes podem ser testados para obter resultados ótimos, incluindo a alimentação lipídica do estágio L4 ou adulto do dia 1.
- Realizar suplementação lipídica nas placas de ágar NGM de 10 cm seguindo os passos abaixo.
NOTA: Este método é adequado para testar alterações transcricionais usando vermes a granel suplementados com lipídios.- Semear 1 mL das bactérias condicionadas por lipídios do passo 1.9 para o centro de cada uma das placas de 10 cm. Quando um grande número de placas tiver sido preparado, vortex a solução de trabalho final várias vezes entre a semeadura. Seque as placas no escuro usando um exaustor de biossegurança.
- Transfira 3.000 vermes da etapa 2.15 para cada uma das placas de 10 cm. Seque as placas em um exaustor de biossegurança até que os vermes possam rastejar nas placas suplementadas com lipídios em vez de nadar.
- Incubar os vermes nas placas condicionadas por lípidos numa incubadora a 20 °C durante o período de tempo desejado. Proteja da luz se estiver usando lipídios poli-insaturados.
NOTA: Para testar diferentes condições de alimentação, incube os lipídios com vermes por vários períodos de tempo, como 6 h, 12 h e 24 h. Além disso, diferentes estágios de vermes podem ser testados para obter resultados ótimos, incluindo a alimentação lipídica no estágio L4 ou no dia 1 do adulto.
- Realizar suplementação lipídica nas placas de ágar NGM de 6 cm para análise transcricional.
NOTA: Este método é adequado para testar alterações transcricionais em alguns vermes suplementados com lipídios.- Semeia 300 μL de bactérias condicionadas por lipídios do passo 1.9 para o centro de cada uma das placas de 6 cm. Quando um grande número de placas tiver sido preparado, vortex a solução de trabalho final várias vezes entre a semeadura. Seque as placas no escuro usando um exaustor de biossegurança.
- Transfira até 300 minhocas da etapa 2.15 para cada uma das placas de 6 cm. Seque as placas em um exaustor de biossegurança até que os vermes possam rastejar nas placas suplementadas com lipídios em vez de nadar.
- Incubar os vermes nas placas condicionadas por lípidos numa incubadora a 20 °C durante o período de tempo desejado. Proteja da luz se estiver usando lipídios poli-insaturados.
NOTA: Para testar diferentes condições de alimentação, incubar os lipídios com vermes em diferentes pontos de tempo, como 6 h, 12 h e 24 h. Além disso, diferentes estágios de vermes podem ser testados para obter resultados ótimos, incluindo a alimentação lipídica no estágio L4 ou no dia 1 do adulto.
- Realizar suplementação lipídica nas placas de ágar NGM de 6 cm para ensaio longitudinal de vida útil.
- Semeia 200 μL de bactérias condicionadas por lipídios (com concentração lipídica 1x e bactérias concentradas 5x) no centro de cada uma das placas NGM de 6 cm. Prepare três pratos para cada condição de alimentação.
NOTA: Os pratos devem ser preparados na hora no dia de uso (idealmente logo antes do uso). - Seque as placas em um exaustor de biossegurança. Mantenha as luzes no capô e na sala apagadas se estiver usando lipídios poli-insaturados.
- Escolha 30-40 worms L4 sincronizados para cada uma das placas. Manter as placas com os vermes numa incubadora a 20 °C. Se alimentar com lípidos poli-insaturados, manter as placas numa caixa protegida contra a luz na incubadora a 20 °C.
NOTA: É possível usar OP50 de uma placa de passagem normal de 6 cm (OP50 não condicionada) como cola para pegar vermes, mas é crucial não deixar uma grande quantidade do OP50 incondicionado na placa de ensaio. - Transfira os vermes para pratos novos e recém-feitos com condicionados de lipídios diariamente ou a cada dois dias, dependendo da condição de alimentação desejada. A sobrevida é pontuada da mesma forma que a descrita anteriormente4.
- Semeia 200 μL de bactérias condicionadas por lipídios (com concentração lipídica 1x e bactérias concentradas 5x) no centro de cada uma das placas NGM de 6 cm. Prepare três pratos para cada condição de alimentação.
4. Extração de RNA para análise transcricional
- Realize a extração de RNA de um grande número de vermes inteiros.
- Transferir vermes na cultura líquida da etapa 3,1 para tubos microcentrífugos de 1,5 mL. Lave os vermes das placas de 10 cm da etapa 3.2 usando o tampão M9 e transfira os vermes no tampão M9 para tubos de microcentrífuga de 1,5 mL.
- Centrifugar brevemente os vermes com uma minicentrífuga de mesa (ver Tabela de Materiais) por 10 s e aspirar rapidamente o sobrenadante.
- Transfira as sobras de vermes dos poços de alimentação líquida ou lave das alimentações de placas para o mesmo tubo e gire para baixo. Remova o sobrenadante.
- Lave os pellets de vermes com 1 mL de M9 gelado, gire brevemente por 10 s com uma mini centrífuga e aspirar o sobrenadante. Repita 1x ou 2x dependendo da transparência do sobrenadante.
- Coloque os tubos de microcentrífuga no gelo por 2 min e remova o máximo de sobrenadante possível com uma pipeta de 200 μL, deixando um pellet de minhoca embalado de não mais de 15 μL de volume.
- Transferir 15 μL de solução de extração de RNA contendo fenol e isotiocianato de guanidina (Tabela de Materiais) para cada um dos tubos de microcentrífuga e moer os vermes com um moedor de motor por cerca de 30 s até que nenhum verme intacto seja visível.
CUIDADO: A solução de extração de RNA é tóxica e inflamável, e qualquer etapa que envolva um recipiente aberto com este reagente deve ser operada em um exaustor químico. - Transfira 285 μL da solução de extração de RNA para o tubo de microcentrífuga enquanto enxagua qualquer conteúdo de sem-fim da ponta do moedor do motor para o tubo de microcentrífuga. Vórtice para misturar completamente.
Observação : este é um ponto de pausa. As amostras podem ser armazenadas na solução de extração de RNA a -80 °C por alguns meses. Quando retirado do -80 °C, deixar as amostras descongelar à temperatura ambiente. - Transferir 60 μL de clorofórmio para cada amostra e vórtice vigorosamente. Deixe as amostras assentarem à temperatura ambiente durante 10 min.
CUIDADO: O clorofórmio é tóxico e deve ser manuseado em um exaustor químico. - Centrífuga a 21.000 x g durante 20 min a 4 °C. Transfira cuidadosamente 140 μL da camada aquosa na parte superior para um tubo de microcentrífuga novo e livre de RNase usando uma pipeta de 200 μL, transferindo 2x com 70 μL de cada vez.
NOTA: A partir deste passo em diante, todas as pontas e recipientes de pipeta que têm contato direto com a amostra precisam ser livres de RNase. Sugere-se também o uso da solução de descontaminação da RNase para limpar todos os equipamentos e o espaço de trabalho. - Transferir 140 μL de isopropanol para o tubo de amostragem. Vórtice vigorosamente e deixe a amostra assentar à temperatura ambiente por 10 min. Centrifugar a 21.000 x g durante 20 min a 4 °C e remover cuidadosamente todo o sobrenadante.
- Transfira 0,5 mL de etanol gelado a 80% (v/v) para o tubo de amostra com o pellet de RNA. Vórtice vigorosamente até que o pellet de RNA saia do fundo do tubo e flutue na solução de etanol. Centrifugar a 21.000 x g durante 10 min a 4 °C e remover o sobrenadante.
- Centrifugar brevemente os tubos de amostra na minicentrífuga por 15 s para girar para baixo qualquer solvente aderente à parede do tubo e, em seguida, remova a solução de etanol o máximo possível com uma pipeta.
- Deixe a tampa do tubo aberta para secar o pellet de RNA. Se o pellet foi lavado cuidadosamente com a solução de etanol, a etapa de secagem deve levar menos de 10 min.
Observação : este é um ponto de pausa. O pellet de RNA seco pode ser armazenado a -80 °C por até 1 mês. - Dissolva o pellet de ARN seco com 40 μL de água isenta de nuclease e processe com um kit de remoção de ADN de acordo com as instruções do fabricante (ver Tabela de Materiais).
NOTA: Recomenda-se dissolver o RNA em água livre de nuclease primeiro. Se 40 μL de água forem misturados com o tampão DNase 10x antes de serem transferidos para o tubo de RNA, o pellet de RNA não se dissolverá completamente. As amostras de RNA precisam ser mantidas no gelo ao dissolver o pellet de RNA em água. Os ciclos de congelamento-descongelamento diminuem a qualidade do RNA; portanto, prossiga para a etapa de transcrição reversa no mesmo dia do tratamento com DNase.
- Extração de RNA de um pequeno número de vermes inteiros.
- Escolha 15-20 vermes de seu gramado bacteriano em uma placa de NGM fresca sem sementes para remover as bactérias do verme.
- De acordo com o fabricante do kit qRT-PCR de 2 etapas (ver Tabela de Materiais), prepare 20 μL de solução de lise final para cada amostra misturando 0,2 μL de DNase com 19,8 μL de solução de lise em tubos de PCR. Misture a solução de lise pipetando para cima e para baixo 5x.
- Transferir 15-20 vermes da placa NGM não semeada para o tubo de PCR contendo 20 μL da solução de lise final com o número mínimo de bactérias. Incubar a reação de lise por 5 min à temperatura ambiente.
- Sonda-sonicate (ver Tabela de Materiais) os vermes com 30% de amplitude usando o seguinte programa: sonicação para 5 s, pausa para 5 s, e repetir 4x com um tempo total de sonicação de 20 s. Mantenha as amostras em um banho de água gelada durante a sonicação.
- Incubar à temperatura ambiente durante 5 min.
NOTA: Adicionar mais DNase antes da incubação se o controlo negativo sem RT revelar contaminação do ADN a um nível preocupante. - Transfira 2 μL de solução de parada para a reação de lise e misture batendo suavemente. Incubar durante 2 minutos à temperatura ambiente e, em seguida, colocar no gelo.
NOTA: As amostras podem ser deixadas no gelo por até 2 h antes de prosseguir para a etapa de transcrição reversa.
- Realize a extração de RNA dos tecidos do verme seguindo as etapas abaixo.
- Escolha cerca de 20 vermes de seu gramado bacteriano e coloque-os em uma placa de NGM fresca sem sementes para remover as bactérias deles.
- Deslocar os 20 vermes (com o menor número possível de bactérias) para um vidro de relógio contendo 500 μL de solução M9 contendo 4 μM de levamisol (ver Tabela de Materiais). A imobilização ocorrerá em segundos.
- Quando os vermes estiverem imobilizados, disseque a linha germinativa ou o intestino usando uma agulha de 25 G que possa ser anexada à seringa de 1 mL.
- Sob o escopo da dissecção, realize um corte na posição do segundo bulbo faríngeo para permitir a extrusão natural do intestino e da linha germinativa. Os dois tecidos podem ser facilmente distinguidos com base em sua morfologia e contraste diferente. Use pinças ou agulhas para separar suavemente os tecidos, evitando danificá-los.
NOTA: Recomenda-se dissecar dentro de 5-10 min. Se o corte não produzir uma boa extrusão de tecido, sugere-se passar para o próximo verme e dissecar o maior número possível dentro de 10 minutos. Esse procedimento requer um curto período de tempo para evitar alterações transcricionais do ambiente.
- Sob o escopo da dissecção, realize um corte na posição do segundo bulbo faríngeo para permitir a extrusão natural do intestino e da linha germinativa. Os dois tecidos podem ser facilmente distinguidos com base em sua morfologia e contraste diferente. Use pinças ou agulhas para separar suavemente os tecidos, evitando danificá-los.
- De acordo com o fabricante do kit qRT-PCR de 2 etapas, prepare 20 μL de solução de lise final para cada amostra misturando 0,2 μL de DNase I a 19,8 μL de solução de lise nos tubos de PCR. Misture a solução de lise pipetando para cima e para baixo 5x.
- Use uma pipeta de vidro autoclavada para transferir os tecidos dissecados para um tubo de PCR. Coloque os tubos de PCR no gelo por 2 minutos para permitir a deposição de material no fundo. Retire o sobrenadante, adicione 20 μL de solução de lise final ao tubo de PCR e misture batendo ao toque.
- Incubar a reação de lise por 5 min à temperatura ambiente. Em seguida, transfira 2 μL de solução de parada para a reação de lise e misture tocando. Incubar durante 2 min à temperatura ambiente.
NOTA: As amostras podem ser deixadas no gelo por até 2 h antes de prosseguir para a etapa de transcrição reversa.
5. Transcrição reversa e qRT-PCR
- Execute a transcrição reversa e qRT-PCR de worms em massa.
- Meça a concentração de RNA e prepare 5 μg de RNA total para transcrição reversa.
- Preparar uma amostra de RNA agrupada misturando quantidades iguais de RNA de cada amostra e ajustando a concentração final de RNA para 0,556 g/L (5 μg/9 μL). Use a amostra de RNA agrupada para a curva padrão qRT-PCR e controles RT-negativos.
- Realize a transcrição reversa de acordo com as instruções do fabricante (consulte Tabela de Materiais). Execute as seguintes reações de transcrição reversa de controle de qualidade ao lado das amostras individuais de RNA.
- Execute a transcrição reversa com a amostra de RNA agrupada como modelo (para a curva padrão qRT-PCR).
- Realizar a transcrição reversa com a amostra de RNA agrupada como modelo, sem a transcriptase reversa (controle RT-negativo; controle de qualidade para potencial contaminação do DNA do genoma).
- Realizar a transcrição reversa com a água livre de nuclease como molde (controle RT-negativo; controle de qualidade para potencial contaminação por RNA em reagentes).
Observação : este é um ponto de pausa. As amostras podem ser deixadas no termociclador durante a noite ou armazenadas a -20 °C durante alguns meses.
- Diluir o cDNA gerado a partir das amostras de RNA agrupadas quatro vezes, 20 vezes, 100 vezes e 500 vezes com água livre de nuclease para curvas padrão de qRT-PCR.
- Diluir o cDNA gerado a partir de cada amostra de RNA 20-100 vezes para usar como modelos para as reações qRT-PCR.
NOTA: A razão de diluição depende da abundância do gene de interesse. Para genes de alta expressão, como genes de limpeza ou egl-3 e egl-21 usados neste estudo, recomenda-se uma diluição de 100x. Para genes de baixa expressão, como lbp-8, recomenda-se uma diluição de 20x. - Executar qRT-PCR com reagentes qRT-PCR de acordo com as instruções do fabricante da seguinte forma: 95 °C por 10 min, repetir 40 vezes com 95 °C por 15 s e 60 °C por 1 min, seguido pelo programa de curva de fusão padrão, e manter a 8 °C por um tempo indefinido.
- Realize a transcrição reversa e qRT-PCR a partir de alguns vermes ou tecidos de vermes.
- Transfira 25 μL de tampão RT e 2,5 μL de mistura enzimática RT 20x do kit qPCR de 2 etapas (ver Tabela de Materiais) para cada tubo contendo lisado sem-fim a partir da etapa 4.2.6 ou da etapa 4.3.6.
Observação : um controle RT-negativo é crítico para qRT-PCR de alguns worms. Cada experimento precisa incluir uma amostra de lisado de verme (da etapa 4.2.6) com tampão RT, mas sem enzima RT para examinar a contaminação do DNA nas amostras. Se a contaminação do DNA for um problema, considere adicionar mais DNase ao tampão de lise ou mais DNase à amostra depois que os vermes forem lisados. Alternativamente, pode-se realizar o controle RT-negativo para cada amostra usando metade do lisado em uma reação RT normal e a outra metade em uma reação RT sem transcriptase reversa. - Misture batendo suavemente. Gire para baixo usando uma minicentrífuga por 10 s.
- Carregar as amostras na máquina termocicladora de acordo com as instruções do fabricante: 37 °C durante 60 min, 95 °C durante 5 min e 8 °C durante um tempo indeterminado.
Observação : este é um ponto de pausa. As amostras podem ser deixadas no termociclador durante a noite ou armazenadas a -20 °C durante alguns meses. - Mantenha todos os reagentes e amostras no gelo e proteja os reagentes qRT-PCR da luz.
- Prepare uma placa de qPCR de 96 poços e, em cada poço, misture 6 μL de água livre de nuclease, 10 μL de reagente de qRT-PCR, 2 μL de mistura de primer de 5 μM (para frente e para trás) e 2 μL de cDNA. Cubra a superfície da placa qPCR de 96 poços com uma película óptica protetora e pressione para baixo até selar.
- Execute o programa qRT-PCR em um termociclador seguindo as instruções do fabricante da seguinte forma: 50 °C por 2 min, 95 °C por 2 min, repita 40 vezes com 95 °C por 3 s e 60 °C por 30 s, seguido por 8 °C por um tempo indefinido.
- Transfira 25 μL de tampão RT e 2,5 μL de mistura enzimática RT 20x do kit qPCR de 2 etapas (ver Tabela de Materiais) para cada tubo contendo lisado sem-fim a partir da etapa 4.2.6 ou da etapa 4.3.6.
Resultados
Validação de alterações transcricionais usando alguns vermes inteiros após suplementação lipídica
Para investigar se o protocolo de extração e retrotranscrição de RNA em cDNA de alguns vermes inteiros é reprodutível e comparável com os dados de vermes a granel, uma cepa de verme de longa duração superexpressando a lipase láptica lisossômica lipl-4 no intestino foi empregada 7,8,33,35. A indução transcricional dos genes de processamento de neuropeptídeos egl-3 e egl-21 relatados em estudos anteriores 7,8,33 foi validada (Figura 2A,B). Essa indução indica que o método de extração de RNA de alguns animais é uma alternativa válida às técnicas padrão de síntese de cDNA a partir de culturas de vermes a granel.
Validação de avaliações transcricionais utilizando tecidos de vermes dissecados mediante suplementação lipídica
Em C. elegans, a síntese de AGPIs de 20 carbonos é dependente da atividade da dessaturase FAT-316,17. Estudos anteriores relataram que os mutantes de gordura-3 não possuem PUFAs de 20 carbonos, incluindo o DGLA16. Anteriormente, descobriu-se que a perda de Δ6-dessaturase FAT-3 em vermes lipl-4g suprime a indução transcricional dos genes de processamento de neuropeptídeos egl-3 e egl-2133. Além disso, a suplementação de DGLA resgata tal indução33. O gene que codifica egl-21 é expresso em neurônios, enquanto egl-3 é detectado em neurônios e intestinos36,37. Para testar ainda mais se a suplementação de DGLA restaura a indução de egl-3 e egl-21 no intestino ou nos neurônios, o intestino foi dissecado e seus níveis transcricionais foram avaliados usando a análise qRT-PCR descrita nas etapas 4.3 e 5.2 deste protocolo. DGLA foi suplementado na fonte de alimento por 12 h no dia-1 da idade adulta. Não foi encontrada indução transcricional de egl-3 ou egl-21 no intestino (Figura 2C), o que é consistente com achados prévios 36,38.
Validação do ensaio de tempo de vida após suplementação lipídica
A relação entre os AGPIs de 20 carbonos e o mecanismo de longevidade que inativa a gordura-3 foi explorada anteriormente, especificamente no intestino de vermes lipl-4g 33. Verificou-se que o knockdown de gordura-3 suprime totalmente a extensão de vida útil conferida pelo lipl-433. Para avaliar se o DGLA restaura a longevidade afetada mediada pelo lipl-4, o DGLA foi suplementado na hora a cada dois dias no alimento de origem no dia- 1 da idade adulta. Verificou-se que, após o knockdown de gordura-3, a suplementação de DGLA resgata a extensão da vida útil (Figura 2D)33, indicando um procedimento de suplementação lipídica bem-sucedido juntamente com o ensaio de tempo de vida.
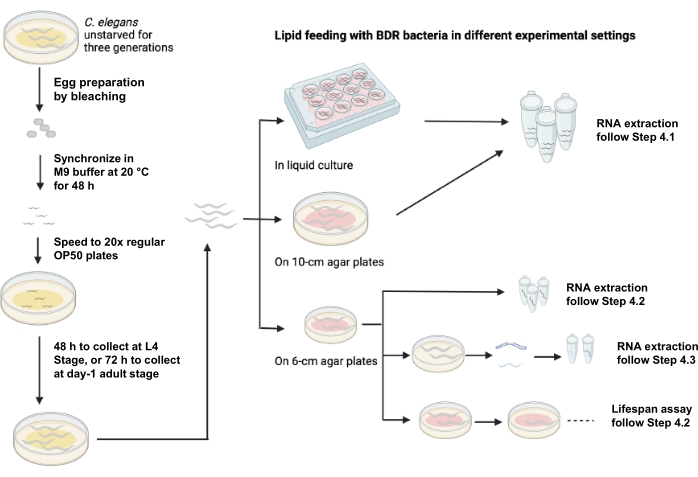
Figura 1: Esquema da alimentação lipídica usando diferentes configurações experimentais. Clique aqui para ver uma versão maior desta figura.

Figura 2: Validação da avaliação transcricional dos genes de processamento de neuropeptídeos usando uma grande população de vermes, alguns vermes e tecidos dissecados. (A) O RNA extraído de uma grande população de vermes mostra a indução dos níveis de transcrição egl-3 e egl-21 dos genes de processamento de neuropeptídeosem animais lipl-4 Tg. As barras de erro representam ±1 SEM. **** p < 0,0001 pelo teste t de Student bicaudal. (B) A extração de RNA de alguns vermes confirma a indução dos níveis de transcrito egl-3 e egl-21 dos genes de processamento de neuropeptídeos em vermes lipl-4 Tg. As barras de erro representam ±1 SEM. **** p < 0,0001 pelo teste t de Student bicaudal. (C) Os genes de processamento de neuropeptídeos neuronais egl-3 e egl-21 não são induzidos em intestinos dissecados. As barras de erro representam ±1 MEV. Análise estatística com teste t de Student bicaudal. (D) A suplementação de DGLA em diferentes concentrações, incluindo 10 μm, 100 μm e 1 mM, resgata o efeito da longevidade do lipl-4Tg sobre o RNAi de gordura-3. p < 0,001 pelo teste log-rank. Essa figura é adaptada de Savini et al.33. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
A suplementação lipídica tem sido empregada em pesquisas sobre envelhecimento para elucidar o impacto direto de determinadas espécies lipídicas no envelhecimento saudável 6,7,23,26,27,31. No entanto, o procedimento de suplementação lipídica pode ser desafiador, e qualquer inconsistência entre os experimentos pode causar resultados não reprodutíveis. Aqui, o primeiro protocolo passo-a-passo detalhado é documentado para orientar novos cientistas a evitar as possíveis armadilhas causadas pela imprecisão técnica. As etapas críticas deste protocolo serão discutidas em detalhes nos parágrafos a seguir. A caixa de ferramentas de pesquisa lipídica também é expandida pela introdução do isolamento de RNA de apenas alguns vermes e tecidos específicos de vermes após a suplementação lipídica. Ao considerar a metodologia para examinar os níveis de transcrição, a qRT-PCR com alguns vermes ou tecidos dissecados é excelente para analisar alguns transcritos ou examinar certas alterações transcricionais específicas do tecido. Além disso, o uso dessas metodologias poderia superar a etapa de amplificação de vermes que pode levar aproximadamente 5-6 dias extras. Ao mesmo tempo, a alimentação lipídica seguida de extração de RNA a granel é mais econômica e uma alternativa válida quando um conjunto maior de genes-alvo precisa ser analisado.
Várias etapas podem ser críticas para a reprodutibilidade dos efeitos da alimentação lipídica. O primeiro aspecto está relacionado às condições bacterianas. Sugere-se o uso de placas bacterianas frescas que não tenham mais de 7 dias para a inoculação. Recomenda-se o uso de bactérias preparadas em meio BDR dentro de 1 semana. As bactérias que foram misturadas com lipídios devem ser usadas imediatamente. Os lipídios com bactérias não devem ser armazenados mesmo a 4 °C, pois as bactérias metabolizarão os lipídios. As etapas de lavagem na base BDR e a ressuspensão no meio BDR são críticas para as condições bacterianas, pois as bactérias foram cultivadas em LB e alimentadas diretamente aos vermes sempre eliminam os efeitos profundos dos suplementos lipídicos. O segundo fator está associado a condições de vermes. C. elegans deve não passar fome por pelo menos três gerações antes da etapa de branqueamento para a preparação do ovo, a fim de garantir que eles estejam em um estado metabólico saudável e estável. Também é crucial cultivar C. elegans em placas de ágar antes da suplementação lipídica; isso inclui antes e depois da etapa de sincronização.
Vermes que se adaptaram a culturas líquidas por períodos prolongados estão parcialmente famintos; A fome eleva a linha de base para genes pró-longevidade, o que leva a um efeito enfraquecido da suplementação lipídica. Se a deriva metabólica e as mudanças usando larvas L1 presas são preocupações, uma alternativa válida seria chapear diretamente os ovos. Quando apenas alguns vermes são necessários para realizar a vida útil ou a análise da expressão gênica, é possível emplacar ovos diretamente em placas condicionadas por lipídios e ressincronizá-los escolhendo manualmente no estágio L4 para experimentos subsequentes. No entanto, se grandes quantidades de vermes forem necessárias quando a colheita manual de L4 não for aplicável, o revestimento direto dos ovos não é ideal. A eclosão dos ovos após o branqueamento de adultos gravídicos pode ocorrer em diferentes momentos e fazer com que a população não seja sincronizada, o que interferiria na análise transcricional. A terceira parte crítica está ligada às condições de armazenamento lipídico; Ao suplementar PUFAs, é necessária atenção extra, pois essas moléculas são sensíveis à luz e propensas à oxidação no ar.
Múltiplas condições de alimentação lipídica, incluindo estágios de vermes, duração da suplementação e concentrações, requerem uma investigação mais aprofundada ao testar novas moléculas lipídicas. Os vermes L4, adultos do dia 1 e adultos do dia 2 são geralmente o ponto de partida para o teste em diferentes estágios do verme. Notavelmente, ao alimentar vermes L4, se o tempo de incubação termina em torno da fase de muda do nematoide, uma grande variação é esperada, o que influencia muito a significância e a reprodutibilidade dos resultados. Um desafio adicional para o uso de vermes adultos do dia 1 ou dia 2 está relacionado às progênies que podem complicar a análise da expressão gênica. Neste caso, a extração de RNA de alguns vermes inteiros é mais confiável do que as populações em massa. Diferentes moléculas lipídicas têm diferentes faixas de concentração para produzir efeitos fisiológicos; assim, sugere-se que uma série de concentrações de 1 μM a 1 mM seja testada.
Existem algumas limitações a serem consideradas na escolha do método de alimentação. Primeiro, quando os lipídios não podem ser absorvidos ou ingeridos pelos vermes, é um desafio usar um método de suplementação para testar seu efeito biológico em C. elegans. Com as tecnologias atuais, a espectrometria de massa ou SRS, juntamente com compostos lipídicos marcados com 13C ou 2H 39, são ferramentas válidas para testar a absorção de lipídios no corpo do verme. Em segundo lugar, esses métodos de alimentação não são otimizados para técnicas de investigação de alto rendimento. Para a suplementação lipídica com vermes a granel, a preparação da amostra do método de alimentação líquida é mais rápida do que a alimentação a granel, porque as culturas líquidas podem ser transferidas diretamente para tubos de microcentrífuga em vez de lavadas das placas de alimentação. Para garantir que o RNA extraído esteja no estado de colheita, sugere-se não deixar passar mais de 15-20 min entre o ponto de colocar os vermes no gelo para moê-los na solução de extração de RNA. Recomenda-se processar menos condições a cada 15 minutos quando um grande número de amostras precisa ser processado. Para a extração de RNA de vermes inteiros de alguns animais, a etapa de colheita manual é a etapa limitadora da taxa, enquanto para dissecar tecidos, é crucial agir de maneira eficiente em termos de tempo para evitar a exposição a longo prazo a um ambiente não fisiológico. Semelhante à extração de RNA a granel, a colheita de vermes ou a dissecação de amostras de tecido dentro de 10 minutos é preferível.
Apesar das limitações, esses métodos de suplementação podem ser usados além da pesquisa lipídica para auxiliar na identificação de quaisquer efeitos nutricionais e medicinais. Os procedimentos relatados aqui não se limitam apenas à pesquisa do envelhecimento, mas a fenótipos alternativos para avaliar a aptidão das organelas e a homeostase metabólica celular. O método de suplementação com população a granel pode ser acoplado com RNA-seq para análise de transcriptoma, espectrometria de massa para análise metabolômica e proteômica ou Western blot para análise de marcadores proteicos específicos, enquanto a suplementação lipídica com alguns vermes pode ser combinada com imagens e análise comportamental.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Agradecemos a P. Svay pelo suporte de manutenção. Este trabalho foi apoiado pelos subsídios do NIH R01AG045183 (MCW), R01AT009050 (MCW), R01AG062257 (MCW), DP1DK113644 (MCW), March of Dimes Foundation (MCW), Welch Foundation (MCW), investigador do HHMI (M.C.W.) e NIH T32 ES027801 bolsista de pré-doutorado (MS). Algumas cepas foram fornecidas pelo CGC, que é financiado pelo Escritório de Programas de Infraestrutura de Pesquisa do NIH (P40 OD010440).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
Referências
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados