Method Article
مكملات الدهون لطول العمر وتحليل النسخ الجيني في Caenorhabditis elegans
* These authors contributed equally
In This Article
Summary
يصف البروتوكول الحالي طرق مكملات الدهون في المزارع السائلة وعلى الصفائح ل Caenorhabditis elegans ، إلى جانب الدراسات الطولية وتحليل النسخ الجيني من السائبة أو عدد قليل من الديدان وأنسجة الديدان.
Abstract
الشيخوخة هي عملية معقدة تتميز بالتغيرات الفسيولوجية التدريجية الناتجة عن المساهمات البيئية والجينية. الليبيدات ضرورية في تكوين المكونات التركيبية لأغشية الخلايا، وتخزين الطاقة، وكجزيئات إشارة. يعد تنظيم استقلاب الدهون والإشارات أمرا ضروريا لتنشيط مسارات طول العمر المتميزة. الدودة المستديرة Caenorhabditis elegans هي كائن حي ممتاز وقوي لتشريح مساهمة التمثيل الغذائي للدهون والإشارة في تنظيم طول العمر. وصفت دراسات بحثية متعددة كيف يمكن لمكملات النظام الغذائي لجزيئات دهنية معينة أن تطيل عمر C. elegans. ومع ذلك ، يمكن أن تسبب الاختلافات الطفيفة في ظروف المكملات مشكلات في التكاثر بين العلماء في المختبرات المختلفة. هنا ، تم الإبلاغ عن طريقتين مفصلتين لمكملات C. elegans باستخدام مكملات الدهون إما مع البكتيريا المصنفة على الألواح أو التعليق البكتيري في الثقافة السائلة. كما ترد هنا تفاصيل لإجراء فحوصات العمر مع مكملات الدهون مدى الحياة وتحليل qRT-PCR باستخدام محللة دودة كاملة أو أنسجة تشريح مشتقة من عدد قليل من الديدان. باستخدام مزيج من الدراسات الطولية والتحقيقات النسخية على مكملات الدهون ، توفر فحوصات التغذية طرقا يمكن الاعتماد عليها لتشريح كيفية تأثير الدهون على طول العمر والشيخوخة الصحية. يمكن أيضا تكييف هذه المنهجية مع مناهج الفحص الغذائي المختلفة لتقييم التغييرات في مجموعة فرعية من النصوص باستخدام إما عدد صغير من الأنسجة المشرحة أو عدد قليل من الحيوانات.
Introduction
الدهون
الليبيدات هي جزيئات صغيرة كارهة للماء أو برمائية قابلة للذوبان في المذيبات العضوية ولكنها غير قابلة للذوبان في الماء 1,2. تتمايز جزيئات الليبيدات المتميزة بعضها عن بعض بناء على عدد ذرات الكربون الموجودة في سلاسلها، وموقعها، وعدد الروابط المزدوجة، والتراكيب المرتبطة، بما في ذلك الجليسرول أو الفوسفات. تلعب الليبيدات أدوارا حاسمة داخل الخلايا المتميزة وعبرها لتنظيم وظائف الكائنات الحية ، بما في ذلك تكوين طبقات ثنائية الغشاء ، وتوفير تخزين الطاقة ، والعمل كجزيئات إشارة 3,4.
أولا، الليبيدات هي مكونات تركيبية للأغشية البيولوجية، بما في ذلك غشاء البلازما والأغشية تحت الخلوية داخل الخلايا التي تفصل الأجزاء الداخلية عن البيئة خارج الخلية. ثانيا، الليبيدات هي الشكل الرئيسي لتخزين الطاقة في الحيوانات الفقارية واللافقارية. يتم تخزين الدهون المحايدة ، بما في ذلك ثلاثي الجلسرين ، لفترة طويلة في الأنسجة المختلفة ، بما في ذلك الأنسجة الدهنية. في الديدان الخيطية Caenorhabditis elegans ، الأمعاء هي الجهاز الرئيسي لتخزين الدهون الأيضية. لا تشارك وظيفتها فقط في هضم وامتصاص العناصر الغذائية ، ولكن أيضا في عملية إزالة السموم ، والتي تشبه نشاط خلايا الكبد في الثدييات. تشمل أنسجة تخزين الدهون الأخرى الخط الجرثومي ، حيث تكون الدهون ضرورية لتطوير البويضات ، وتحت الجلد ، والتي تتكون من خلايا البشرةالشبيهة بالجلد 3,5. ثالثا ، في السنوات الأخيرة ، أشارت المزيد من الأدلة إلى أن الدهون هي جزيئات إشارات قوية تشارك في الإشارات داخل وخارج الخلية من خلال العمل مباشرة على مجموعة متنوعة من المستقبلات ، بما في ذلك مستقبلات G المقترنة بالبروتين والنووية ، أو بشكل غير مباشر عن طريق تعديل سيولة الغشاء أو تعديلات ما بعد الترجمة6،7،8،9 . ستستمر الدراسات الإضافية في توضيح الآليات الجزيئية الأساسية لإشارات الدهون في تعزيز طول العمر والصحة.
الكائنات النموذجية مهمة لمعالجة أسئلة بيولوجية محددة معقدة للغاية بحيث لا يمكن دراستها على البشر. على سبيل المثال ، تعد الدودة المستديرة C. elegans نموذجا ممتازا لإجراء التحليل الجيني لتشريح العمليات البيولوجية ذات الصلة بالتغذية البشرية والمرض10. إن المسارات الجزيئية المحفوظة للغاية ذات الصلة بعلم وظائف الأعضاء البشرية والأنسجة المعقدة والأنماط السلوكية وأدوات التلاعب الجيني الوفيرة تجعل C. elegans كائنا نموذجيا رائعا11. على سبيل المثال ، C. elegans ممتاز في إعادة توجيه الشاشات الجينية لتحديد الجينات الخاصة بالنمط الظاهري ، وكذلك في الشاشات الجينية العكسية على مستوى الجينوم عبر تداخل الحمض النووي الريبي12.
في المختبرات ، تزرع الديدان الخيطية على ألواح بتري أجار المزروعة بعشب من بكتيريا الإشريكية القولونية ، مما يوفر المغذيات الكبيرة مثل البروتينات والكربوهيدرات والأحماض الدهنية المشبعة وغير المشبعة كمصادر للطاقة ولبنات البناء ، والمغذيات الدقيقة مثل العوامل المساعدة والفيتامينات13. على غرار الثدييات ، تقوم الديدان الخيطية بتوليف جزيئات الأحماض الدهنية من كل من حمض النخيل وحامض دهني (جزيئات الكربون 16 و 18 الكربون المشبعة ، على التوالي) التي يتم إلغاء تشبعها بالتتابع وممدودة إلى مجموعة متنوعة من الأحماض الدهنية الأحادية غير المشبعة (MUFAs) والأحماض الدهنية المتعددة غير المشبعة (PUFAs)14،15،16،17،18. ومن المثير للاهتمام ، أن C. elegans قادر على تخليق جميع الأحماض الدهنية المطلوبة والإنزيمات الأساسية المشاركة في التخليق الحيوي للأحماض الدهنية ، وإزالة التشبع ، والاستطالة ، مما يسهل تخليق PUFAsطويلة السلسلة 19. تختلف عن الأنواع الحيوانية الأخرى ، يمكن ل C. elegans تحويل الأحماض الدهنية 18-كربون و 20-كربون ω-6 إلى أحماض دهنية ω-3 مع إنزيمات desaturase ω-3 الخاصة بها. بالإضافة إلى ذلك ، تمتلك الديدان Δ12 desaturase الذي يحفز تكوين حمض اللينوليك (LA) من حمض الأوليك (OA ، 18: 1) 20،21. تفتقر معظم الحيوانات أو النباتات إلى كل من Δ12 و ω-3 desaturases وبالتالي تعتمد على المدخول الغذائي من ω-6 و ω-3 للحصول على PUFAs ، في حين أن C. elegans لا تتطلب الأحماض الدهنية الغذائية22. تم استخدام الطفرات المعزولة التي تفتقر إلى إنزيمات ديساتوراز الوظيفية لدراسة وظائف الأحماض الدهنية المحددة في العمليات البيولوجية المتميزة ، بما في ذلك التكاثر والنمو وطول العمر والنقل العصبي. يمكن معالجة تأثير الأحماض الدهنية الفردية على مسارات بيولوجية محددة باستخدام كل من النهج الجيني ومكملات النظام الغذائي16،17،23. حتى الآن ، ركزت أبحاث الدهون على توصيف الجينات المشاركة في تخليق الدهون ، وتدهورها ، وتخزينها ، وتكسيرها في الحالات العصبية والتنموية24. ومع ذلك ، فإن أدوار الدهون في تنظيم طول العمر بدأت للتو في الكشف.
إشارات الدهون في تنظيم طول العمر
تلعب الدهون أدوارا حاسمة في تنظيم طول العمر عن طريق تنشيط شلالات الإشارات الخلوية في الأنسجة وأنواع الخلايا المتميزة. أبرزت الدراسات الحديثة الأدوار النشطة للدهون في تعديل النسخ والتواصل بين الخلايا الخلوية عبر البروتينات المرتبطة بالدهون أو التعرف على مستقبلات الغشاء25. بالإضافة إلى ذلك ، توفر مكملات الدهون الغذائية أداة ممتازة لتشريح كيفية تأثير استقلاب الدهون على العمر الافتراضي في C. elegans. لقد ثبت أن MUFAs و PUFAs المتميزة تعزز طول العمر من خلال تنشيط عوامل النسخ26,27.
ترتبط نماذج طول العمر ، بما في ذلك إشارات الأنسولين / IGF-1 واستئصال خلايا سلائف الخط الجرثومي ، بمسار التخليق الحيوي MUFA ، ومكملات MUFA ، بما في ذلك حمض الأوليك وحمض البالميتوليك و cis-vaccenic ، كافية لإطالة عمر C. elegans 26. على الرغم من أن تأثير طول العمر الذي تمنحه إدارة MUFA يتطلب مزيدا من التحقيق ، فمن المرجح أن يتم التوسط في الآلية الأساسية بواسطة عامل النسخ SKN-1 / Nrf2 ، وهو المنشط الرئيسي لاستجابة الإجهاد التأكسدي وتنظيم طول العمر28,29. من بين MUFAs ، تلعب فئة معينة من الأسيل إيثانولاميدات الدهنية تسمى N-acylethanolamines (NAEs) أدوارا حاسمة في آليات متميزة بما في ذلك الالتهاب والحساسية والتعلم والذاكرة واستقلاب الطاقة30. على وجه الخصوص ، تم تحديد جزيء الدهون المعروف باسم oleoylethanolamide (OEA) كمنظم إيجابي لطول العمر من خلال تعزيز نقل البروتين المرتبط بالدهون 8 (LBP-8) إلى النواة لتنشيط مستقبلات الهرمونات النووية NHR-49 و NHR-807. مكملات OEA التناظرية KDS-5104 كافية لإطالة العمر ، وتحفز التعبير عن الجينات المشاركة في استجابات الإجهاد التأكسدي وأكسدة β الميتوكوندريا 7,8.
في الوقت نفسه ، تم ربط دور PUFAs أيضا بتنظيم طول العمر. إدارة حمض PUFA ω-3 الدهني حمض α لينولينيك (ALA) يعزز طول العمر عن طريق تنشيط عوامل النسخ NHR-49 / PPARα و SKN-1 / NRF وتحفيز أكسدة β الميتوكوندريا31. ومن المثير للاهتمام ، أن المنتجات البيروكسيد من ALA ، المشار إليها باسم oxylipins ، تنشط SKN-1 / NRF ، مما يشير إلى أن كلا من PUFAs ومشتقاتها المؤكسدة يمكن أن تمنح فوائد طول العمر23. مكملات الأحماض الدهنية ω-6 حمض الأراكيدونيك (AA) وحمض ثنائي هومو-γ-لينولينيك (DGLA) يطيل العمر عن طريق تنشيط الالتهام الذاتي ، مما يعزز مراقبة جودة البروتين ويؤدي إلى تدهور مجاميع البروتين المهدرة والسامة27,32. في الآونة الأخيرة ، ثبت أن تنظيم الإشارات الخلوية غير المستقلة بوساطة البروتين المرتبط بالدهون 3 (LBP-3) و DGLA أمر حاسم لتعزيز طول العمر عن طريق إرسال إشارات محيطية إلى الخلايا العصبية ، مما يشير إلى دور طويل المدى لجزيئات الدهون في التواصل بين الأنسجة عند المستويات الجهازية33. تشير الدراسة الحالية إلى كل خطوة لأداء مكملات الدهون مع البكتيريا المصنفة على الألواح أو التعليق البكتيري في الثقافة السائلة. تستخدم هذه المنهجيات لتقييم العمر الافتراضي وتحليل النسخ ، باستخدام محتوى الجسم بالكامل أو الأنسجة المشرحة المشتقة من عدد قليل من الديدان. يمكن تكييف التقنيات التالية مع مجموعة متنوعة من الدراسات الغذائية وتقديم أداة صالحة لتشريح كيفية تأثير استقلاب الدهون على طول العمر والشيخوخة الصحية.
Protocol
يوضح الشكل 1 مخططا لتغذية الدهون باستخدام إعدادات تجريبية مختلفة.
1. إعداد البكتيريا المكيفة الدهون
- قم بإعداد محلول قاعدة التقييد الغذائي للتخفيف البكتيري (BDR) عن طريق إذابة 5.85 جم من كلوريد الصوديوم و 1.0 جم من K 2 HPO 4 و 6.0 جم من KH2PO4 (انظر جدول المواد) في 999 مل من الماء منزوع الأيونات. اضبط الرقم الهيدروجيني على 6.0 مع 0.5 M KOH ، ثم قم بالتصفية من خلال مرشح 0.22 ميكرومتر.
ملاحظة: يمكن تخزين محلول BDR في درجة حرارة الغرفة للتخزين طويل الأجل. - تحضير وسط BDR بإضافة 10 ميكرولتر من 5 ملغ / مل من الكوليسترول (المذاب في الإيثانول 200 برهان) إلى كل 10 مل من محلول قاعدة BDR.
- قم بتجميع بكتيريا OP50 (انظر جدول المواد) من مخزون -80 درجة مئوية إلى ألواح LB-agar واحتضانها عند 37 درجة مئوية طوال الليل.
ملاحظة: بعد الحضانة الليلية عند 37 درجة مئوية ، يمكن تخزين لوحة OP50 عند 4 درجات مئوية لمدة تصل إلى 1 أسبوع للحصول على نتائج تغذية ثابتة. - قم بتلقيح بكتيريا OP50 من صفيحة OP50 LB-agar إلى وسط LB واحتضانها في شاكر 37 درجة مئوية طوال الليل (16 ساعة).
ملاحظة: يعتمد الحجم المتوسط المطلوب LB على الإعدادات التجريبية. يوصى باستخدام 200 ميكرولتر من البكتيريا المركزة 5x المزروعة على كل من الألواح 6 سم و 1 مل من البكتيريا المركزة 5x لكل من الألواح 10 سم وكل تكرار لظروف التغذية السائلة. وبالتالي ، يجب تحضير 1 مل و 5 مل من التلقيح الأولي LB لكل مزرعة تغذية دهنية ، على التوالي. - اجمع البكتيريا عن طريق الطرد المركزي بمعدل 4000 × جم لمدة 10 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية.
- قم بتعليق الحبيبات البكتيرية في 20 مل من قاعدة BDR ، وأجهزة الطرد المركزي عند 4000 × جم لمدة 10 دقائق. تخلص من المادة الطافية.
ملاحظة: هذه الخطوة ضرورية لغسل بقايا بقايا LB في الحبيبات البكتيرية. - قم بتعليق كل حبيبات بكتيرية في وسط BDR لعمل مخزون بكتيريا BDR 20x. قم بتخفيف مخزون البكتيريا 20x BDR بمتوسط BDR إلى 5x قبل الاستخدام.
ملاحظة: استخدم حجم 1/20 من وسط BDR من حجم LB الأصلي للوصول إلى تركيز 20x للبكتيريا. يمكن تخزين مخزون البكتيريا 20x في 4 °C لمدة تصل إلى 1 أسبوع. - قم بإعداد محلول مخزون الدهون ، باستخدام الإيثانول أو ثنائي ميثيل سلفوكسيد (DMSO) كمذيب في قارورة زجاجية جديدة معقمة ، واملأ القارورة الزجاجية بالأرجون أو النيتروجين لمنع الأكسدة.
ملاحظة: يتراوح تركيز محلول المخزون عادة بين 250 مللي متر و 1 مليمتر. - انقل محلول مخزون الدهون إلى الكمية المطلوبة من محلول بكتيريا BDR لتحقيق التركيز النهائي المطلوب في ظروف التغذية. تخلط جيدا عن طريق دوامة لمدة 20 ثانية.
ملاحظة: عادة ما يكون التركيز النهائي للدهون في التغذية من 1 ميكرومتر إلى 1 مليمول، اعتمادا على الدهون وظروف الاختبار. يوصى بإجراء تجربة تجريبية أولا لاختبار تركيزات مختلفة تتراوح من 0.1 ميكرومتر إلى 1 مللي مول إذا كانت تعمل مع دهون جديدة. امزج محلول مخزون الدهون مع بكتيريا BDR مباشرة قبل بذره على الطبق أو وضعه في مزارع الديدان السائلة. تحضير البكتيريا المكيفة الدهون لا تزيد عن 1 ساعة قبل تغذية الديدان. - امزج نفس الأحجام من الإيثانول المصفى أو DMSO (اعتمادا على ما يستخدم لمجموعة تغذية الدهون) مع بكتيريا BDR لتكون بمثابة عنصر تحكم في السيارة.
2. إعداد C. elegans متزامنة لمكملات الدهون
- تحضير المخزن المؤقت M9 عن طريق الخلط (باستخدام تركيزات نهائية محددة) 22 mM KH 2 PO 4 ، 22 mM Na 2 HPO4 ، 85 mM NaCl ، و2mM MgSO 4 (انظر جدول المواد). الأوتوكلاف العازلة لتعقيم.
- قم بإعداد محلول مبيض طازج مع 60٪ مبيض منزلي (v / v ، انظر جدول المواد) وتركيز نهائي يبلغ 1.6 م هيدروكسيد الصوديوم.
- اجمع البالغين الجاذبين في أنبوب مخروطي سعة 15 مل باستخدام 10 مل من المخزن المؤقت M9.
ملاحظة: يعتمد عدد الديدان والألواح اللازمة للمزامنة على الإعدادات التجريبية (أي عدد الحالات والنسخ المتماثلة وطرق التغذية). من الناحية المثالية ، يجب أن تكون كل صفيحة كاملة 6 سم من الديدان البالغة قادرة على إنتاج 600 دودة L1 على الأقل بعد المزامنة. - قم بتدوير الديدان بسرعة 1450 × جم لمدة 30 ثانية. قم بإزالة المادة الطافية وشطف الديدان مرة أخرى باستخدام 10 مل من المخزن المؤقت M9.
- قم بتدوير الديدان بسرعة 1450 × جم لمدة 30 ثانية. استنشاق المادة الطافية ، وترك حصة 4 مل في الأنبوب المخروطي. أضف 2 مل من محلول التبييض ورجه بقوة لمدة 1 دقيقة.
- قم بتدوير الديدان بسرعة 1,450 × جم لمدة 30 ثانية في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية وأضف 4 مل من المخزن المؤقت M9 و 2 مل من محلول التبييض. هز الأنبوب حتى تذوب أجسام الدودة.
- قم بتدوير البيض على حرارة 1,450 × جم لمدة 30 ثانية في درجة حرارة الغرفة.
- قم بإزالة المادة الطافية واغسل البيض باستخدام 10 مل من المخزن المؤقت M9.
- كرر الخطوتين 2.8 و2.9 3x.
- تعليق الأجنة مع 6 مل من العازلة M9. صخر الأجنة على دوار عند 20 درجة مئوية لمدة يومين للسماح لها بالفقس والمزامنة.
- انقل يرقات L1 إلى ألواح OP50 المصنفة. احتضان عند 20 درجة مئوية لمدة 48 ساعة لجمع ديدان L4 المتزامنة ، و 72 ساعة للبالغين في اليوم 1 ، و 96 ساعة للبالغين في اليوم الثاني.
ملاحظة: يتم تحضير ألواح OP50 بإضافة 1 مل من بكتيريا OP50 20x إلى كل لوحة34 متوسطة نمو الديدان الخيطية (NGM) 10 سم. يمكن بذر 30000 دودة L1 لكل من لوحات OP50 إذا كانت تهدف إلى حصاد الديدان في المرحلة L4 ، ويمكن بذر 20000 دودة L1 لكل من لوحات OP50 إذا كانت تهدف إلى حصاد اليوم الأول للبالغين في البيئات التجريبية الحالية. قد يكون الأمر مختلفا باختلاف إعدادات المختبر ، لذلك يوصى باختبار أعداد الديدان التي يمكن بذرها للتأكد من أن الديدان لديها ما يكفي من الطعام المتبقي قبل حصادها. - اجمع الديدان البالغة L4 أو اليوم الأول أو اليوم الثاني من الديدان البالغة في أنبوب مخروطي سعة 15 مل باستخدام 10 مل من المخزن المؤقت M9. استخدم 5 مل أخرى من المخزن المؤقت M9 لشطف الديدان المتبقية من الألواح.
- قم بتدوير الديدان بسرعة 1450 × جم لمدة 30 ثانية وتخلص من المادة الطافية. اغسل حبيبات الدودة ب 10 مل من وسط BDR ، وأجهزة الطرد المركزي عند 1,450 × جم لمدة 30 ثانية ، وتخلص من المادة الطافية.
- بالنسبة للديدان في طريقة التغذية السائلة ، انقل وسط BDR إلى الديدان لتحقيق تركيز دودة يبلغ 3000 دودة / مل. بالنسبة للديدان في طرق التغذية على اللوحة ، قلل من حجم وسط BDR المضاف إلى الديدان لتقليل وقت التجفيف على اللوحة.
3. مكملات الدهون ل C. elegans
- قم بإجراء مكملات الدهون في المزرعة السائلة باتباع الخطوات أدناه.
ملاحظة: هذه الطريقة مناسبة لاختبار التغييرات النسخية باستخدام الديدان السائبة المكملة بالدهون.- انقل الكمية المطلوبة من الدهون أو التحكم في السيارة إلى كل بئر في لوحة مكونة من 12 بئرا. قم بإعداد ثلاثة إلى أربعة آبار لكل حالة تغذية كتكرار بيولوجي.
- امزج معلق الدودة من الخطوة 2.15 مع بكتيريا BDR 5x بنسبة 1: 1 لتحقيق تركيز نهائي يبلغ 1500 دودة / مل و 2.5x للبكتيريا.
- انقل 2 مل من خليط البكتيريا الدودية في وسط BDR إلى كل بئر من الصفيحة المكونة من 12 بئرا.
- لف الصفيحة المكونة من 12 بئرا بورق القصدير ورجها في حاضنة 20 درجة مئوية عند 100 دورة في الدقيقة للحصول على طول الحضانة المطلوب.
ملاحظة: لاختبار ظروف التغذية المختلفة ، احتضان الدهون بالديدان لفترات زمنية مختلفة ، مثل 6 ساعات و 12 ساعة و 24 ساعة. بالإضافة إلى ذلك ، يمكن اختبار مراحل دودة مختلفة للحصول على أفضل النتائج ، بما في ذلك تغذية الدهون من مرحلة البالغين L4 أو day-1.
- قم بإجراء مكملات الدهون على ألواح أجار NGM مقاس 10 سم باتباع الخطوات أدناه.
ملاحظة: هذه الطريقة مناسبة لاختبار التغييرات النسخية باستخدام الديدان السائبة المكملة بالدهون.- بذرة 1 مل من البكتيريا المكيفة، من الخطوة 1.9 إلى مركز كل لوح من الصفائح التي يبلغ طولها 10 سم. عندما يتم تحضير عدد كبير من الألواح ، دوامة حل العمل النهائي عدة مرات بين البذر. جفف الألواح في الظلام باستخدام غطاء السلامة البيولوجية.
- انقل 3000 دودة من الخطوة 2.15 إلى كل لوحة من الألواح التي يبلغ طولها 10 سم. جفف الألواح في غطاء السلامة البيولوجية حتى تتمكن الديدان من الزحف على الألواح المكملة بالدهون بدلا من السباحة.
- احتضان الديدان على الألواح المكيفة بالدهون في حاضنة 20 درجة مئوية للمدة الزمنية المطلوبة. يحفظ بعيدا عن الضوء في حالة استخدام الدهون المتعددة غير المشبعة.
ملاحظة: لاختبار ظروف التغذية المختلفة ، احتضان الدهون بالديدان لفترات زمنية مختلفة ، مثل 6 ساعات و 12 ساعة و 24 ساعة. بالإضافة إلى ذلك ، يمكن اختبار مراحل دودة مختلفة للحصول على أفضل النتائج ، بما في ذلك تغذية الدهون في مرحلة البالغين L4 أو day-1.
- قم بإجراء مكملات الدهون على ألواح أجار NGM مقاس 6 سم لتحليل النسخ.
ملاحظة: هذه الطريقة مناسبة لاختبار التغيرات النسخية في عدد قليل من الديدان المكملة بالدهون.- بذرة 300 ميكرولتر من البكتيريا المكيفة بالدهون من الخطوة 1.9 إلى مركز كل طبق 6 سم. عندما يتم تحضير عدد كبير من الألواح ، دوامة حل العمل النهائي عدة مرات بين البذر. جفف الألواح في الظلام باستخدام غطاء السلامة البيولوجية.
- انقل ما يصل إلى 300 دودة من الخطوة 2.15 إلى كل لوحة من الألواح التي يبلغ طولها 6 سم. جفف الألواح في غطاء السلامة البيولوجية حتى تتمكن الديدان من الزحف على الألواح المكملة بالدهون بدلا من السباحة.
- احتضان الديدان على الألواح المكيفة بالدهون في حاضنة 20 درجة مئوية للمدة الزمنية المطلوبة. يحفظ بعيدا عن الضوء في حالة استخدام الدهون المتعددة غير المشبعة.
ملاحظة: لاختبار ظروف التغذية المختلفة ، احتضان الدهون بالديدان في نقاط زمنية مختلفة ، مثل 6 ساعات و 12 ساعة و 24 ساعة. بالإضافة إلى ذلك ، يمكن اختبار مراحل دودة مختلفة للحصول على أفضل النتائج ، بما في ذلك تغذية الدهون في مرحلة البالغين L4 أو day-1.
- قم بإجراء مكملات الدهون على ألواح أجار NGM مقاس 6 سم لفحص العمر الطولي.
- قم بزرع 200 ميكرولتر من البكتيريا المكيفة للدهون (بتركيز 1x دهون و 5x بكتيريا مركزة) على مركز كل من ألواح NGM مقاس 6 سم. تحضير ثلاث لوحات لكل حالة تغذية.
ملاحظة: يجب تحضير الأطباق طازجة في يوم الاستخدام (من الناحية المثالية قبل الاستخدام مباشرة). - جفف الألواح في غطاء السلامة البيولوجية. احتفظ بالأضواء في غطاء المحرك والغرفة مطفأة في حالة استخدام الدهون المتعددة غير المشبعة.
- اختر 30-40 ديدان L4 متزامنة لكل لوحة. احتفظ بالأطباق مع الديدان في حاضنة 20 درجة مئوية. في حالة التغذية بالدهون المتعددة غير المشبعة ، احتفظ بالأطباق في صندوق محمي من الضوء في حاضنة 20 درجة مئوية.
ملاحظة: من الممكن استخدام OP50 من لوحة مرور عادية 6 سم (OP50 غير مشروطة) كغراء لالتقاط الديدان ، ولكن من الضروري عدم ترك كمية كبيرة من OP50 غير المشروط في لوحة الفحص. - انقل الديدان إلى أطباق جديدة طازجة مكيفة بالدهون يوميا أو كل يومين ، اعتمادا على حالة التغذية المطلوبة. يتم تسجيل البقاء على قيد الحياة بنفس الطريقة الموضحة سابقا4.
- قم بزرع 200 ميكرولتر من البكتيريا المكيفة للدهون (بتركيز 1x دهون و 5x بكتيريا مركزة) على مركز كل من ألواح NGM مقاس 6 سم. تحضير ثلاث لوحات لكل حالة تغذية.
4. استخراج الحمض النووي الريبي لتحليل النسخ
- إجراء استخراج الحمض النووي الريبي من عدد كبير من الديدان الكاملة.
- نقل الديدان في الثقافة السائلة من الخطوة 3.1 إلى 1.5 مل أنابيب الطرد المركزي الدقيقة. اغسل الديدان من ألواح 10 سم من الخطوة 3.2 باستخدام المخزن المؤقت M9 وانقل الديدان في المخزن المؤقت M9 إلى أنابيب الطرد المركزي الدقيقة سعة 1.5 مل.
- قم بطرد الديدان بالطرد المركزي لفترة وجيزة باستخدام جهاز طرد مركزي صغير منضدية (انظر جدول المواد) لمدة 10 ثوان واستنشاق المادة الطافية بسرعة.
- انقل بقايا الديدان من آبار التغذية السائلة أو اغسلها من تغذية الألواح إلى نفس الأنبوب وقم بتدويرها. إزالة طاف .
- اغسل كريات الدودة ب 1 مل من M9 المثلج ، وقم بتدويرها لفترة وجيزة لمدة 10 ثوان باستخدام جهاز طرد مركزي صغير ، واستنشاق المادة الطافية. كرر 1x أو 2x اعتمادا على شفافية المادة الطافية.
- ضع أنابيب الطرد المركزي الدقيقة على الجليد لمدة دقيقتين وقم بإزالة أكبر قدر ممكن من المواد الطافية باستخدام ماصة 200 ميكرولتر ، تاركا كرية دودة معبأة لا يزيد حجمها عن 15 ميكرولتر.
- انقل 15 ميكرولتر من محلول استخراج الحمض النووي الريبي المحتوي على الفينول وجوانيدين إيزوثيوسيانات (جدول المواد) إلى كل من أنابيب الطرد المركزي الدقيقة وطحن الديدان بمطحنة محرك لمدة 30 ثانية تقريبا حتى لا تظهر ديدان سليمة.
تنبيه: محلول استخراج الحمض النووي الريبي سام وقابل للاشتعال ، وأي خطوة تتضمن حاوية مفتوحة مع هذا الكاشف يجب تشغيلها في غطاء كيميائي. - انقل 285 ميكرولتر من محلول استخراج الحمض النووي الريبي إلى أنبوب الطرد المركزي الدقيق أثناء شطف أي محتوى دودي من طرف مطحنة المحرك إلى أنبوب الطرد المركزي الدقيق. دوامة لخلط جيدا.
ملاحظة: هذه نقطة توقف مؤقت. يمكن تخزين العينات في محلول استخراج الحمض النووي الريبي عند -80 درجة مئوية لبضعة أشهر. عند إخراجها من -80 درجة مئوية ، اترك العينات تذوب في درجة حرارة الغرفة. - نقل 60 ميكرولتر من الكلوروفورم إلى كل عينة ودوامة بقوة. دع العينات تستقر في درجة حرارة الغرفة لمدة 10 دقائق.
تنبيه: الكلوروفورم سام ويجب التعامل معه في غطاء كيميائي. - جهاز طرد مركزي عند 21000 × جم لمدة 20 دقيقة عند 4 درجات مئوية. انقل بعناية 140 ميكرولتر من الطبقة المائية الموجودة في الأعلى إلى أنبوب طرد مركزي دقيق جديد وخالي من RNase باستخدام ماصة 200 ميكرولتر ، ونقل 2x مع 70 ميكرولتر في كل مرة.
ملاحظة: من هذه الخطوة إلى الأمام ، يجب أن تكون جميع أطراف الماصة والحاويات التي لها اتصال مباشر بالعينة خالية من RNase. يقترح أيضا استخدام محلول إزالة التلوث RNase لمسح جميع المعدات ومساحة العمل. - نقل 140 ميكرولتر من الأيزوبروبانول إلى أنبوب العينة. دوامة بقوة واترك العينة تستقر في درجة حرارة الغرفة لمدة 10 دقائق. جهاز طرد مركزي عند 21000 × جم لمدة 20 دقيقة عند 4 درجات مئوية ، وقم بإزالة جميع المواد الطافية بعناية.
- انقل 0.5 مل من الإيثانول المثلج البارد بنسبة 80٪ (v / v) إلى أنبوب العينة باستخدام حبيبات الحمض النووي الريبي. دوامة بقوة حتى تترك حبيبات الحمض النووي الريبي قاع الأنبوب وتطفو في محلول الإيثانول. جهاز طرد مركزي عند 21000 × جم لمدة 10 دقائق عند 4 درجات مئوية وإزالة المادة الطافية.
- قم بطرد مركزي لفترة وجيزة من أنابيب العينة في جهاز الطرد المركزي المصغر لمدة 15 ثانية لتدوير أي مذيب يلتصق بجدار الأنبوب ، ثم قم بإزالة أكبر قدر ممكن من محلول الإيثانول باستخدام ماصة.
- اترك غطاء الأنبوب مفتوحا لتجفيف حبيبات الحمض النووي الريبي. إذا تم غسل الحبيبات جيدا بمحلول الإيثانول ، فيجب أن تستغرق خطوة التجفيف أقل من 10 دقائق.
ملاحظة: هذه نقطة توقف مؤقت. يمكن تخزين حبيبات الحمض النووي الريبي المجففة في -80 درجة مئوية لمدة تصل إلى 1 شهر. - قم بإذابة حبيبات الحمض النووي الريبي الجافة ب 40 ميكرولتر من الماء الخالي من النيوكلياز وقم بمعالجتها باستخدام مجموعة إزالة الحمض النووي وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
ملاحظة: يوصى بإذابة الحمض النووي الريبي في الماء الخالي من النيوكلياز أولا. إذا تم خلط 40 ميكرولتر من الماء مع مخزن DNase 10x قبل نقله إلى أنبوب الحمض النووي الريبي ، فلن تذوب حبيبات الحمض النووي الريبي تماما. يجب الاحتفاظ بعينات الحمض النووي الريبي على الجليد عند إذابة حبيبات الحمض النووي الريبي في الماء. دورات التجميد والذوبان تقلل من جودة الحمض النووي الريبي. لذلك ، انتقل إلى خطوة النسخ العكسي في نفس يوم علاج DNase.
- استخراج الحمض النووي الريبي من عدد صغير من الديدان الكاملة.
- اختر 15-20 دودة من حديقتها البكتيرية في صفيحة NGM جديدة غير مصنفة لإزالة البكتيريا من الدودة.
- وفقا للشركة المصنعة لمجموعة qRT-PCR المكونة من خطوتين (انظر جدول المواد) ، قم بإعداد 20 ميكرولتر من محلول التحلل النهائي لكل عينة عن طريق خلط 0.2 ميكرولتر من DNase مع 19.8 ميكرولتر من محلول التحلل في أنابيب PCR. امزج محلول التحلل عن طريق سحب 5x لأعلى ولأسفل.
- انقل 15-20 دودة من صفيحة NGM غير المصنفة إلى أنبوب تفاعل البوليميراز المتسلسل الذي يحتوي على 20 ميكرولتر من محلول التحلل النهائي مع الحد الأدنى لعدد البكتيريا. احتضان تفاعل التحلل لمدة 5 دقائق في درجة حرارة الغرفة.
- مسبار سونيكات (انظر جدول المواد) الديدان بسعة 30٪ باستخدام البرنامج التالي: صوتنة لمدة 5 ثوان ، توقف مؤقتا لمدة 5 ثوان ، وكرر 4x مع وقت صوتنة إجمالي يبلغ 20 ثانية. احتفظ بالعينات في حمام ماء مثلج أثناء الصوتنة.
- احتضان في درجة حرارة الغرفة لمدة 5 دقائق.
ملاحظة: أضف المزيد من DNase قبل الحضانة إذا أظهر التحكم السلبي no-RT تلوث الحمض النووي عند مستوى مقلق. - انقل 2 ميكرولتر من محلول التوقف إلى تفاعل التحلل واخلطه عن طريق النقر برفق. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة ، ثم وضعت على الجليد.
ملاحظة: يمكن ترك العينات على الثلج لمدة تصل إلى 2 ساعة قبل المتابعة إلى خطوة النسخ العكسي.
- قم بإجراء استخراج الحمض النووي الريبي من أنسجة الدودة باتباع الخطوات أدناه.
- اختر حوالي 20 دودة من حديقتها البكتيرية وضعها على طبق NGM طازج غير مصنف لإزالة البكتيريا منها.
- انقل 20 دودة (مع أقل عدد ممكن من البكتيريا) إلى زجاج ساعة يحتوي على 500 ميكرولتر من محلول M9 يحتوي على 4 ميكرومتر ليفاميزول (انظر جدول المواد). سيحدث الشلل في غضون ثوان.
- عندما يتم تجميد الديدان ، قم بتشريح الخط الجرثومي أو الأمعاء باستخدام إبرة 25 جم يمكن توصيلها بالمحقنة سعة 1 مل.
- تحت نطاق التشريح ، قم بإجراء قطع في موضع لمبة البلعوم الثانية للسماح بالبثق الطبيعي للأمعاء والخط الجرثومي. يمكن تمييز النسيجين بسهولة بناء على مورفولوجيتهما وتباينهما المختلف. استخدم الملقط أو الإبر لفصل الأنسجة برفق ، وتجنب إتلافها.
ملاحظة: يوصى بالتشريح في غضون 5-10 دقائق. إذا لم ينتج عن القطع قذف جيد للأنسجة ، يقترح الانتقال إلى الدودة التالية وتشريح أكبر عدد ممكن في غضون 10 دقائق. يتطلب هذا الإجراء إطارا زمنيا قصيرا لتجنب التغييرات النسخية من البيئة.
- تحت نطاق التشريح ، قم بإجراء قطع في موضع لمبة البلعوم الثانية للسماح بالبثق الطبيعي للأمعاء والخط الجرثومي. يمكن تمييز النسيجين بسهولة بناء على مورفولوجيتهما وتباينهما المختلف. استخدم الملقط أو الإبر لفصل الأنسجة برفق ، وتجنب إتلافها.
- وفقا للشركة المصنعة لمجموعة qRT-PCR المكونة من خطوتين ، قم بإعداد 20 ميكرولتر من محلول التحلل النهائي لكل عينة عن طريق خلط 0.2 ميكرولتر من DNase I إلى 19.8 ميكرولتر من محلول التحلل في أنابيب PCR. امزج محلول التحلل عن طريق سحب 5x لأعلى ولأسفل.
- استخدم ماصة زجاجية معقمة لنقل الأنسجة المشرحة إلى أنبوب PCR. تسوية أنابيب PCR على الجليد لمدة 2 دقيقة للسماح بترسب المواد في القاع. قم بإزالة المادة الطافية ، وأضف 20 ميكرولتر من محلول التحلل النهائي في أنبوب تفاعل البوليميراز المتسلسل ، واخلطه عن طريق النقر.
- احتضان تفاعل التحلل لمدة 5 دقائق في درجة حرارة الغرفة. بعد ذلك ، انقل 2 ميكرولتر من محلول التوقف إلى تفاعل التحلل واخلطه عن طريق النقر. احتضان لمدة 2 دقيقة في درجة حرارة الغرفة.
ملاحظة: يمكن ترك العينات على الثلج لمدة تصل إلى 2 ساعة قبل المتابعة إلى خطوة النسخ العكسي.
5. النسخ العكسي و qRT-PCR
- إجراء النسخ العكسي و qRT-PCR من الديدان السائبة.
- قياس تركيز الحمض النووي الريبي وإعداد 5 ميكروغرام من إجمالي الحمض النووي الريبي للنسخ العكسي.
- تحضير عينة RNA مجمعة عن طريق خلط كميات متساوية من الحمض النووي الريبي من كل عينة وضبط تركيز الحمض النووي الريبي النهائي إلى 0.556 جم / لتر (5 ميكروغرام / 9 ميكرولتر). استخدم عينة الحمض النووي الريبي المجمعة للمنحنى القياسي qRT-PCR وعناصر التحكم السلبية RT.
- قم بإجراء النسخ العكسي وفقا لتعليمات الشركة المصنعة (انظر جدول المواد). قم بتشغيل تفاعلات النسخ العكسي لمراقبة الجودة التالية جنبا إلى جنب مع عينات الحمض النووي الريبي الفردية.
- قم بإجراء النسخ العكسي باستخدام عينة الحمض النووي الريبي المجمعة كقالب (للمنحنى القياسي qRT-PCR).
- قم بإجراء النسخ العكسي باستخدام عينة الحمض النووي الريبي المجمعة كقالب ، بدون النسخ العكسي (التحكم السلبي RT ؛ مراقبة الجودة للتلوث المحتمل بالحمض النووي للجينوم).
- قم بإجراء النسخ العكسي باستخدام الماء الخالي من النيوكلياز كقالب (التحكم السلبي RT ؛ مراقبة الجودة لتلوث الحمض النووي الريبي المحتمل في الكواشف).
ملاحظة: هذه نقطة توقف مؤقت. يمكن ترك العينات في العجلة الحرارية طوال الليل أو تخزينها في -20 درجة مئوية لبضعة أشهر.
- قم بتخفيف cDNA المتولد من عينات الحمض النووي الريبي المجمعة أربع مرات و 20 مرة و 100 مرة و 500 مرة بالماء الخالي من النيوكلياز للحصول على منحنيات qRT-PCR القياسية.
- قم بتخفيف cDNA المتولد من كل عينة من الحمض النووي الريبي 20-100 مرة لاستخدامها كقوالب لتفاعلات qRT-PCR.
ملاحظة: تعتمد نسبة التخفيف على وفرة الجين محل الاهتمام. بالنسبة للجينات عالية التعبير ، مثل جينات التدبير المنزلي أو egl-3 و egl-21 المستخدمة في هذه الدراسة ، يوصى بتخفيف 100x. بالنسبة للجينات منخفضة التعبير ، مثل lbp-8 ، يوصى بتخفيف 20x. - قم بإجراء qRT-PCR باستخدام كواشف qRT-PCR وفقا لتعليمات الشركة المصنعة على النحو التالي: 95 درجة مئوية لمدة 10 دقائق ، كرر 40 مرة مع 95 درجة مئوية لمدة 15 ثانية و 60 درجة مئوية لمدة 1 دقيقة ، متبوعا ببرنامج منحنى الذوبان الافتراضي ، واستمر عند 8 درجات مئوية لفترة غير محددة.
- قم بإجراء النسخ العكسي و qRT-PCR من عدد قليل من الديدان أو أنسجة الديدان.
- نقل 25 ميكرولتر من المخزن المؤقت RT و 2.5 ميكرولتر من مزيج إنزيم RT 20x من مجموعة qPCR المكونة من خطوتين (انظر جدول المواد) إلى كل أنبوب يحتوي على محللة دودة من الخطوة 4.2.6 أو الخطوة 4.3.6.
ملاحظة: يعد التحكم السلبي RT أمرا بالغ الأهمية ل qRT-PCR من عدد قليل من الديدان. تحتاج كل تجربة إلى تضمين عينة من محللة الدودة (من الخطوة 4.2.6) مع مخزن RT ولكن بدون إنزيم RT لفحص تلوث الحمض النووي في العينات. إذا كان تلوث الحمض النووي يمثل مشكلة، ففكر في إضافة المزيد من إنزيم DNase إلى مخزن التحلل المؤقت أو المزيد من إنزيم DNase إلى العينة بعد تحلل الديدان. بدلا من ذلك ، يمكن للمرء إجراء تحكم سلبي RT لكل عينة باستخدام نصف المحللة في تفاعل RT العادي والنصف الآخر في تفاعل RT بدون نسخ عكسي. - تخلط عن طريق النقر برفق. قم بالدوران باستخدام جهاز طرد مركزي صغير لمدة 10 ثوان.
- قم بتحميل العينات في آلة التدوير الحراري باتباع تعليمات الشركة المصنعة: 37 درجة مئوية لمدة 60 دقيقة ، و 95 درجة مئوية لمدة 5 دقائق ، و 8 درجات مئوية لفترة غير محددة.
ملاحظة: هذه نقطة توقف مؤقت. يمكن ترك العينات في العجلة الحرارية طوال الليل أو تخزينها في -20 درجة مئوية لبضعة أشهر. - احتفظ بجميع الكواشف والعينات على الجليد واحم كواشف qRT-PCR من الضوء.
- قم بإعداد لوحة qPCR ذات 96 بئرا ، وفي كل بئر ، امزج 6 ميكرولتر من الماء الخالي من النيوكلياز ، و 10 ميكرولتر من كاشف qRT-PCR ، و 2 ميكرولتر من مزيج التمهيدي 5 ميكرومتر (للأمام والخلف) ، و 2 ميكرولتر من cDNA. قم بتغطية سطح لوحة qPCR الذي يبلغ طوله 96 بئرا بفيلم بصري واقي واضغط لأسفل لإغلاقه.
- قم بتشغيل برنامج qRT-PCR على جهاز تدوير حراري باتباع تعليمات الشركة المصنعة على النحو التالي: 50 درجة مئوية لمدة 2 دقيقة ، 95 درجة مئوية لمدة دقيقتين ، كرر 40 مرة مع 95 درجة مئوية لمدة 3 ثوان و 60 درجة مئوية لمدة 30 ثانية ، تليها 8 درجات مئوية لفترة غير محددة.
- نقل 25 ميكرولتر من المخزن المؤقت RT و 2.5 ميكرولتر من مزيج إنزيم RT 20x من مجموعة qPCR المكونة من خطوتين (انظر جدول المواد) إلى كل أنبوب يحتوي على محللة دودة من الخطوة 4.2.6 أو الخطوة 4.3.6.
النتائج
التحقق من صحة التغييرات النسخية باستخدام عدد قليل من الديدان الكاملة عند تناول مكملات الدهون
للتحقق مما إذا كان بروتوكول استخراج الحمض النووي الريبي ونسخه إلى cDNA من عدد قليل من الديدان الكاملة قابلا للتكرار وقابلا للمقارنة مع البيانات من الديدان السائبة ، تم استخدام سلالة دودة طويلة العمر تفرط في التعبير عن حمض الليزوزومات lipl-4 في الأمعاء7،8،33،35. تم التحقق من صحة الحث النسخي لجينات معالجة الببتيد العصبي egl-3 و egl-21 المبلغ عنها في الدراسات السابقة 7،8،33 (الشكل 2 أ ، ب). يشير هذا الحث إلى أن طريقة استخراج الحمض النووي الريبي من عدد قليل من الحيوانات هي بديل صالح لتقنيات تخليق cDNA القياسية من مزارع الديدان السائبة.
التحقق من صحة التقييمات النسخية باستخدام أنسجة دودة تشريح عند التكميل بالدهون
في C. elegans ، يعتمد تخليق 20-carbon PUFAs على نشاط desaturase FAT-316,17. أفادت الدراسات السابقة أن طفرات الدهون 3 تفتقر إلى 20 كربون PUFAs ، بما في ذلك DGLA16. في السابق ، تم اكتشاف أن فقدان Δ6-desaturase FAT-3 في ديدان lipl-4g يثبط الحث النسخي لجينات معالجة الببتيد العصبي egl-3 و egl-2133. بالإضافة إلى ذلك ، تنقذ مكملات DGLA مثل هذا الحث33. يتم التعبير عن الجين المشفر egl-21 في الخلايا العصبية ، بينما يتم الكشف عن egl-3 في كل من الخلايا العصبية والأمعاء36,37. لمزيد من الاختبار ما إذا كانت مكملات DGLA تعيد تحريض egl-3 و egl-21 في الأمعاء أو في الخلايا العصبية ، تم تشريح الأمعاء وتقييم مستويات النسخ باستخدام تحليل qRT-PCR الموصوف في الخطوتين 4.3 و 5.2 من هذا البروتوكول. تم استكمال DGLA في مصدر الغذاء لمدة 12 ساعة في اليوم 1 مرحلة البلوغ. لم يتم العثور على تحريض نسخي لأي من egl-3 أو egl-21 في الأمعاء (الشكل 2C) ، وهو ما يتوافق مع النتائج السابقة36,38.
التحقق من صحة فحص العمر عند مكملات الدهون
تم استكشاف العلاقة بين 20-carbon PUFAs وآلية طول العمر التي تعطل الدهون -3 سابقا ، وتحديدا في أمعاء ديدان lipl-4g 33. وقد وجد أن ضربة قاضية fat-3 تمنع تماما تمديد العمر الذي يمنحه lipl-433. لتقييم ما إذا كان DGLA يستعيد طول العمر الذي تم التوسط فيه بواسطة lipl-4 ، تم استكمال DGLA طازجا كل يوم في مصدر الغذاء في اليوم 1 من مرحلة البلوغ. وجد أنه عند ضربة قاضية fat-3 ، تنقذ مكملات DGLA تمديد العمر (الشكل 2D) 33 ، مما يشير إلى إجراء مكملات الدهون الناجح إلى جانب فحص العمر.
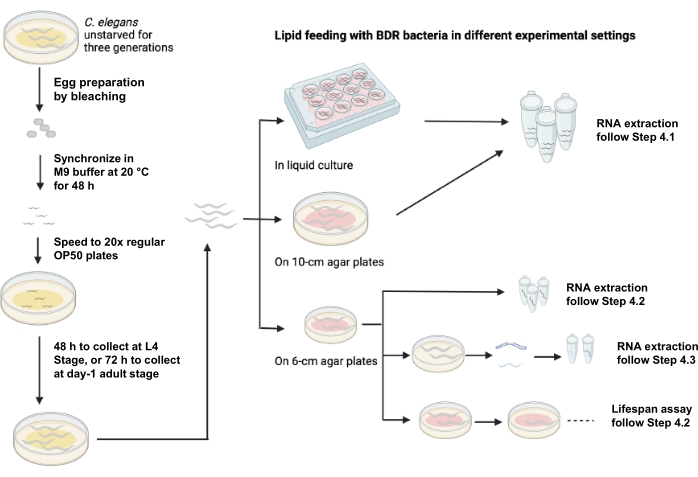
الشكل 1: رسم تخطيطي لتغذية الدهون باستخدام إعدادات تجريبية مختلفة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: التحقق من صحة التقييم النسخي لجينات معالجة الببتيد العصبي باستخدام عدد كبير من الديدان، وعدد قليل من الديدان، والأنسجة المشرحة. (أ) يوضح الحمض النووي الريبوزي المستخرج من مجموعة كبيرة من الديدان تحريض مستويات نسخ egl-3 و egl-21 لجينات معالجة الببتيد العصبيفي lipl-4 Tg. تمثل أشرطة الخطأ ±1 SEM. **** p < 0.0001 بواسطة اختبار t للطالب ثنائي الذيل. (ب) يؤكد استخراج الحمض النووي الريبي من عدد قليل من الديدان تحريض مستويات نسخ جينات معالجة الببتيد العصبي egl-3 و egl-21 في ديدان lipl-4 Tg. تمثل أشرطة الخطأ ±1 SEM. **** p < 0.0001 بواسطة اختبار t للطالب ثنائي الذيل. (ج) لا يتم تحفيز جينات معالجة الببتيد العصبي العصبي egl-3 و egl-21 في الأمعاء المشرحة. تمثل أشرطة الخطأ ±1 SEM. التحليل الإحصائي مع اختبار t للطالب ثنائي الذيل. (د) مكملات DGLA بتركيزات مختلفة ، بما في ذلك 10 ميكرومتر و 100 ميكرومتر و 1 مللي متر تنقذ تأثير طول العمر lipl-4Tg على الدهون -3 RNAi. p < 0.001 عن طريق اختبار رتبة السجل. هذا الرقم مقتبس من Savini et al.33. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
تم استخدام مكملات الدهون في أبحاث الشيخوخة لتوضيح التأثير المباشر لبعض أنواع الدهون على الشيخوخة الصحية6،7،23،26،27،31. ومع ذلك ، يمكن أن يكون إجراء مكملات الدهون صعبا ، وأي عدم اتساق بين التجارب يمكن أن يسبب نتائج غير قابلة للتكرار. هنا ، يتم توثيق أول بروتوكول مفصل خطوة بخطوة لتوجيه العلماء الجدد لتجنب المزالق المحتملة الناجمة عن عدم الدقة التقنية. ستتم مناقشة الخطوات الحاسمة في هذا البروتوكول بالتفصيل في الفقرات التالية. يتم أيضا توسيع مجموعة أدوات البحث عن الدهون عن طريق إدخال عزل الحمض النووي الريبي من عدد قليل من الديدان وأنسجة دودة معينة بعد مكملات الدهون. عند النظر في منهجية فحص مستويات النسخ ، فإن qRT-PCR مع عدد قليل من الديدان أو الأنسجة المشرحة يكون رائعا لتحليل بعض النصوص أو فحص بعض التغييرات النسخية الخاصة بالأنسجة. علاوة على ذلك ، فإن استخدام هذه المنهجيات يمكن أن يتغلب على خطوة تضخيم الديدان التي يمكن أن تستغرق حوالي 5-6 أيام إضافية. في الوقت نفسه ، فإن تغذية الدهون متبوعة باستخراج الحمض النووي الريبي السائب أكثر فعالية من حيث التكلفة وبديل صالح عندما تحتاج مجموعة أكبر من الجينات المستهدفة إلى التحليل.
يمكن أن تكون عدة خطوات حاسمة لاستنساخ تأثيرات تغذية الدهون. الجانب الأول يتعلق بالظروف البكتيرية. يقترح استخدام ألواح بكتيرية طازجة لا يزيد عمرها عن 7 أيام للتلقيح. فمن المستحسن استخدام البكتيريا أعدت في BDR المتوسطة في غضون 1 أسبوع. يجب استخدام البكتيريا التي تم خلطها مع الدهون على الفور. لا ينبغي تخزين الدهون مع البكتيريا حتى عند 4 درجات مئوية ، لأن البكتيريا سوف تستقلب الدهون. تعتبر خطوات الغسيل في قاعدة BDR وإعادة التعليق في وسط BDR أمرا بالغ الأهمية لظروف البكتيريا ، حيث كانت البكتيريا تزرع في LB ، وتغذى مباشرة على الديدان تقضي دائما على الآثار العميقة لمكملات الدهون. يرتبط العامل الثاني بظروف الدودة. يجب أن تكون C. elegans غير جائعة لمدة ثلاثة أجيال على الأقل قبل خطوة التبييض لإعداد البيض للتأكد من أنها في حالة استقلابية صحية ومستقرة. ومن الأهمية بمكان أيضا زراعة C. elegans على لوحات أجار قبل مكملات الدهون. يتضمن ذلك قبل وبعد خطوة المزامنة.
الديدان التي تكيفت مع الثقافات السائلة لفترات طويلة يتم تجويعها جزئيا ؛ يرفع الجوع خط الأساس للجينات المؤيدة لطول العمر ، مما يؤدي إلى ضعف تأثير مكملات الدهون. إذا كان الانجراف الأيضي والتغيرات باستخدام يرقات L1 الموقوفة من المخاوف ، فإن البديل الصحيح هو وضع البيض مباشرة. عندما تكون هناك حاجة إلى عدد قليل فقط من الديدان لإجراء تحليل العمر أو التعبير الجيني ، فمن الممكن وضع البيض مباشرة على ألواح مكيفة الدهون وإعادة مزامنتها عن طريق الانتقاء اليدوي في المرحلة L4 للتجارب اللاحقة. ومع ذلك ، إذا كانت هناك حاجة إلى كميات كبيرة من الديدان عندما لا يكون قطف L4 يدويا قابلا للتطبيق ، فإن طلاء البيض مباشرة ليس مثاليا. يمكن أن يحدث تفقيس البيض بعد التبييض من البالغين الجاذبين في نقاط زمنية مختلفة ويتسبب في عدم تزامن السكان ، مما قد يتداخل مع التحليل النسخي. يرتبط الجزء الحرج الثالث بظروف تخزين الدهون. عند استكمال PUFAs ، هناك حاجة إلى مزيد من الاهتمام لأن هذه الجزيئات حساسة للضوء وعرضة للأكسدة في الهواء.
تتطلب ظروف التغذية الدهنية المتعددة ، بما في ذلك مراحل الديدان وطول المكملات والتركيزات ، مزيدا من التحقيق عند اختبار جزيئات الدهون الجديدة. عادة ما تكون الديدان البالغة L4 و day-1 البالغة و day-2 نقطة البداية للاختبار في مراحل الديدان المختلفة. والجدير بالذكر أنه عند تغذية ديدان L4 ، إذا انتهى وقت الحضانة حول مرحلة طرح الديدان الخيطية ، فمن المتوقع حدوث تباين كبير ، مما يؤثر بشكل كبير على أهمية النتائج وإمكانية تكرارها. يرتبط التحدي الإضافي لاستخدام الديدان البالغة day-1 أو day-2 بالنسل الذي يمكن أن يعقد تحليل التعبير الجيني. في هذه الحالة ، يكون استخراج الحمض النووي الريبي من عدد قليل من الديدان الكاملة أكثر موثوقية من المجموعات السائبة. جزيئات الدهون المختلفة لها نطاقات تركيز مختلفة لإنتاج تأثيرات فسيولوجية. وبالتالي ، يقترح اختبار سلسلة من التركيزات من 1 ميكرومتر إلى 1 مليمتر.
هناك بعض القيود التي يجب مراعاتها عند اختيار طريقة التغذية. أولا ، عندما لا تستطيع الديدان امتصاص الدهون أو تناولها ، يكون من الصعب استخدام طريقة مكملات لاختبار تأثيرها البيولوجي في C. elegans. مع التقنيات الحالية ، يعد قياس الطيف الكتلي أو SRS إلى جانب 13مركبا دهنيا يحمل علامة C أو 2H39 أدوات صالحة لاختبار امتصاص الدهون في جسم الدودة. ثانيا ، لم يتم تحسين طرق التغذية هذه لتقنيات التحقيق عالية الإنتاجية. بالنسبة لمكملات الدهون مع الديدان السائبة ، يكون تحضير العينات من طريقة التغذية السائلة أسرع من التغذية على اللوحة ، لأنه يمكن نقل الثقافات السائلة مباشرة إلى أنابيب الطرد المركزي الدقيقة بدلا من غسلها من ألواح التغذية. للتأكد من أن الحمض النووي الريبي المستخرج في حالة الحصاد ، يقترح عدم ترك مرور أكثر من 15-20 دقيقة بين نقطة وضع الديدان على الجليد وطحنها في محلول استخراج الحمض النووي الريبي. يوصى بمعالجة ظروف أقل كل 15 دقيقة عند الحاجة إلى معالجة عدد كبير من العينات. بالنسبة لاستخراج الحمض النووي الريبي للدودة الكاملة من عدد قليل من الحيوانات ، فإن خطوة الانتقاء اليدوي هي خطوة تحديد المعدل ، بينما بالنسبة لتشريح الأنسجة ، من الضروري التصرف بطريقة فعالة من حيث الوقت لتجنب التعرض طويل الأمد لبيئة غير فسيولوجية. على غرار استخراج الحمض النووي الريبي السائب ، يفضل التقاط الديدان أو تشريح عينات الأنسجة في غضون 10 دقائق.
على الرغم من القيود ، يمكن استخدام طرق المكملات هذه خارج نطاق أبحاث الدهون للمساعدة في تحديد أي آثار غذائية وطبية. لا تقتصر الإجراءات المذكورة هنا على أبحاث الشيخوخة فحسب ، بل تقتصر أيضا على الأنماط الظاهرية البديلة لتقييم لياقة العضيات والتوازن الأيضي للخلايا. يمكن أن تقترن طريقة التكميل مع السكان السائبين مع RNA-seq لتحليل النسخ ، أو قياس الطيف الكتلي للتحليل الأيضي والبروتيني ، أو اللطخة الغربية لتحليل علامات بروتين محددة ، في حين يمكن دمج مكملات الدهون مع عدد قليل من الديدان مع التصوير والتحليل السلوكي.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح.
Acknowledgements
نشكر P. Svay على دعم الصيانة. وأيد هذا العمل من قبل المعاهد الوطنية للصحة المنح R01AG045183 (MCW) ، R01AT009050 (MCW) ، R01AG062257 (MCW) ، DP1DK113644 (MCW) ، مارس من مؤسسة الدايمز (MCW) ، مؤسسة ويلش (MCW) ، محقق HHMI (MCW) ، والمعاهد الوطنية للصحة T32 ES027801 زميل طالب ما قبل الدكتوراه (MS). تم توفير بعض السلالات من قبل CGC ، والتي يمولها مكتب المعاهد الوطنية للصحة لبرامج البنية التحتية البحثية (P40 OD010440).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
References
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved