Method Article
Supplémentation en lipides pour la longévité et analyse transcriptionnelle des gènes chez Caenorhabditis elegans
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit des méthodes de supplémentation en lipides dans des cultures liquides et sur plaque pour Caenorhabditis elegans, associées à des études longitudinales et à l’analyse transcriptionnelle des gènes à partir de vers et de tissus de vers en vrac ou de quelques vers.
Résumé
Le vieillissement est un processus complexe caractérisé par des changements physiologiques progressifs résultant à la fois de contributions environnementales et génétiques. Les lipides sont essentiels pour constituer les composants structurels des membranes cellulaires, stocker l’énergie et en tant que molécules de signalisation. La régulation du métabolisme et de la signalisation des lipides est essentielle pour activer des voies de longévité distinctes. Le ver rond Caenorhabditis elegans est un organisme excellent et puissant pour disséquer la contribution du métabolisme lipidique et de la signalisation dans la régulation de la longévité. De nombreuses études ont décrit comment la supplémentation alimentaire de molécules lipidiques spécifiques peut prolonger la durée de vie de C. elegans ; Cependant, des différences mineures dans les conditions de supplémentation peuvent causer des problèmes de reproductibilité entre les scientifiques de différents laboratoires. Ici, deux méthodes de supplémentation détaillées pour C. elegans sont signalées en utilisant la supplémentation lipidique soit avec des bactéries ensemencées sur des plaques, soit une suspension bactérienne en culture liquide. Vous trouverez également ici les détails permettant d’effectuer des tests de durée de vie avec supplémentation en lipides à vie et une analyse qRT-PCR à l’aide d’un lysat de ver entier ou de tissus disséqués dérivés de quelques vers. En utilisant une combinaison d’études longitudinales et d’enquêtes transcriptionnelles sur la supplémentation en lipides, les tests d’alimentation fournissent des approches fiables pour disséquer comment les lipides influencent la longévité et le vieillissement en bonne santé. Cette méthodologie peut également être adaptée à diverses approches de dépistage nutritionnel afin d’évaluer les changements dans un sous-ensemble de transcrits en utilisant soit un petit nombre de tissus disséqués, soit quelques animaux.
Introduction
Lipide
Les lipides sont de petites molécules hydrophobes ou amphipathiques solubles dans les solvants organiques mais insolubles dans l’eau 1,2. Les molécules lipidiques distinctes se différencient les unes des autres en fonction du nombre de carbones contenus dans leurs chaînes, de leur emplacement, du nombre de doubles liaisons et des structures liées, y compris le glycérol ou les phosphates. Les lipides jouent un rôle crucial à l’intérieur et entre les cellules distinctes pour réguler les fonctions de l’organisme, notamment en constituant des bicouches membranaires, en assurant le stockage de l’énergie et en agissant comme molécules de signalisation 3,4.
Premièrement, les lipides sont des composants structurels des membranes biologiques, y compris la membrane plasmique et les membranes subcellulaires intracellulaires qui séparent les compartiments internes de l’environnement extracellulaire. Deuxièmement, les lipides sont la principale forme de stockage d’énergie chez les animaux vertébrés et invertébrés. Les lipides neutres, y compris les triacylglycérols, sont stockés pendant une période prolongée dans divers tissus, y compris dans le tissu adipeux. Chez le nématode Caenorhabditis elegans, l’intestin est le principal organe métabolique de stockage des graisses; Sa fonction n’est pas seulement impliquée dans la digestion et l’absorption des nutriments, mais également dans le processus de désintoxication, qui ressemble à l’activité des hépatocytes de mammifères. D’autres tissus de stockage des graisses comprennent la lignée germinale, dans laquelle les lipides sont essentiels au développement des ovocytes, et l’hypoderme, qui est composé de cellules épidermiques semblables à la peau 3,5. Troisièmement, au cours des dernières années, de plus en plus de preuves ont suggéré que les lipides sont de puissantes molécules de signalisation impliquées dans la signalisation intra et extracellulaire en agissant directement sur une variété de récepteurs, y compris les récepteurs couplés aux protéines G et nucléaires, ou indirectement via la modulation de la fluidité membranaire ou les modifications post-traductionnelles 6,7,8,9 . D’autres études continueront d’élucider les mécanismes moléculaires sous-jacents de la signalisation lipidique dans la promotion de la longévité et de la durée de vie.
Les organismes modèles sont importants pour répondre à des questions biologiques spécifiques qui sont trop complexes pour être étudiées chez l’homme. Par exemple, le ver rond C. elegans est un excellent modèle pour effectuer des analyses génétiques afin de disséquer les processus biologiques pertinents pour la nutrition humaine et les maladies10. Les voies moléculaires hautement conservées pertinentes pour la physiologie humaine, les tissus complexes, les modèles comportementaux et les nombreux outils de manipulation génétique font de C. elegans un organisme modèle remarquable11. Par exemple, C. elegans est excellent dans la transmission de criblages génétiques pour identifier des gènes spécifiques au phénotype, ainsi que dans les criblages génétiques inverses à l’échelle du génome via l’interférence ARN12.
En laboratoire, les nématodes sont cultivés sur des plaques de Petri ensemencées d’une pelouse de bactéries Escherichia coli, fournissant des macronutriments tels que des protéines, des glucides et des acides gras saturés et insaturés comme sources d’énergie et éléments constitutifs, et des micronutriments tels que des cofacteurs et des vitamines13. Comme les mammifères, les nématodes synthétisent des molécules d’acides gras à partir de l’acide palmitique et de l’acide stéarique (molécules saturées de 16 carbones et de 18 carbones, respectivement) qui sont désaturées séquentiellement et allongées en une variété d’acides gras mono-insaturés (AGMI) et d’acides gras polyinsaturés (AGPI)14,15,16,17,18. Fait intéressant, C. elegans est capable de synthétiser de novo tous les acides gras et enzymes de base nécessaires impliqués dans la biosynthèse, la désaturation et l’allongement des acides gras, facilitant ainsi la synthèse d’AGPI à longue chaîne19. Contrairement aux autres espèces animales, C. elegans peut convertir les acides gras ω-6 à 18 et 20 carbones en acides gras ω-3 avec ses propres enzymes ω-3 désaturase. De plus, les vers possèdent une désaturase Δ12 qui catalyse la formation d’acide linoléique (LA) à partir de l’acide oléique (OA, 18:1)20,21. La plupart des animaux ou des plantes manquent à la fois de désaturases Δ12 et ω-3 et dépendent donc de l’apport alimentaire de ω-6 et ω-3 pour obtenir leurs AGPI, alors que C. elegans n’a pas besoin d’acides gras alimentaires22. Des mutants isolés dépourvus d’enzymes désaturases fonctionnelles ont été utilisés pour étudier les fonctions d’acides gras spécifiques dans des processus biologiques distincts, y compris la reproduction, la croissance, la longévité et la neurotransmission. L’effet des acides gras individuels sur des voies biologiques spécifiques peut être abordé à l’aide d’une approche génétique et d’une supplémentation alimentaire16,17,23. À ce jour, la recherche sur les lipides s’est concentrée sur la caractérisation des gènes impliqués dans la synthèse, la dégradation, le stockage et la dégradation des lipides dans les affections neurologiques et développementales24. Cependant, les rôles des lipides dans la régulation de la longévité commencent tout juste à être révélés.
Signalisation lipidique dans la régulation de la longévité
Les lipides jouent un rôle crucial dans la régulation de la longévité en activant des cascades de signalisation cellulaire dans des tissus et des types de cellules distincts. Des études récentes ont mis en évidence les rôles actifs des lipides dans la modulation de la transcription et de la communication cellule-cellule via des protéines liant les lipides ou la reconnaissance des récepteurs membranaires25. De plus, la supplémentation en lipides alimentaires offre un excellent outil pour disséquer comment le métabolisme des lipides influence la durée de vie chez C. elegans. Il a été démontré que des AGMI et des AGPI distincts favorisent la longévité en activant les facteurs de transcription26,27.
Les modèles de longévité, y compris la signalisation insuline/IGF-1 et l’ablation des cellules précurseurs de la lignée germinale, sont associés à la voie de biosynthèse des AGMI, et la supplémentation en AGMI, y compris l’acide oléique, l’acide palmitoléique et le cis-vaccenic, est suffisante pour prolonger la durée de vie de C. elegans 26. Bien que l’effet de longévité conféré par l’administration de MUFA nécessite une étude plus approfondie, le mécanisme sous-jacent est susceptible d’être médié par le facteur de transcription SKN-1 / Nrf2, qui est un activateur clé de la réponse au stress oxydatif et de la régulation de la longévité28,29. Parmi les AGMI, une classe particulière d’acyléthanolamides gras appelés N-acyléthanolamines (NAE) joue un rôle crucial dans des mécanismes distincts, notamment l’inflammation, les allergies, l’apprentissage, la mémoire et le métabolisme énergétique30. En particulier, la molécule lipidique connue sous le nom d’oléoyléthanolamide (OEA) a été identifiée comme un régulateur positif de la longévité en favorisant la translocation de la protéine de liaison aux lipides 8 (LBP-8) dans le noyau pour activer les récepteurs hormonaux nucléaires NHR-49 et NHR-807. La supplémentation de l’analogue de l’OEA KDS-5104 est suffisante pour prolonger la durée de vie, et induit l’expression de gènes impliqués dans les réponses au stress oxydatif et la β-oxydation mitochondriale 7,8.
Dans le même temps, le rôle des AGPI a également été lié à la réglementation de la longévité. L’administration d’acide gras α-linolénique (ALA) d’AGPI ω-3 favorise la longévité en activant les facteurs de transcription NHR-49/PPARα, SKN-1/NRF et en induisant la β-oxydation mitochondriale31. Fait intéressant, les produits peroxydés d’ALA, appelés oxylipines, activent SKN-1 / NRF, ce qui suggère que les AGPI et leurs dérivés oxydatifs peuvent conférer des avantages de longévité23. La supplémentation en acide arachidonique (AA) et en acide dihomo-γ-linolénique (DGLA) d’acide gras ω-6 prolonge la durée de vie par activation de l’autophagie, favorisant le contrôle de la qualité des protéines et entraînant la dégradation des agrégats de protéines gaspillés et toxiques27,32. Plus récemment, une régulation de signalisation cellulaire non autonome médiée par la protéine de liaison aux lipides 3 (LBP-3) et la DGLA s’est avérée cruciale pour promouvoir la longévité en envoyant des signaux périphériques aux neurones, suggérant un rôle à long terme des molécules lipidiques dans la communication intertissulaire aux niveaux systémiques33. La présente étude rapporte chaque étape pour effectuer une supplémentation en lipides avec des bactéries ensemencées sur des plaques ou une suspension bactérienne en culture liquide. Ces méthodologies sont utilisées pour évaluer la durée de vie et l’analyse transcriptionnelle, en utilisant le contenu du corps entier ou des tissus disséqués dérivés de quelques vers. Les techniques suivantes peuvent être adaptées à une variété d’études nutritionnelles et offrent un outil valide pour disséquer comment le métabolisme des lipides influence la longévité et le vieillissement en santé.
Protocole
La figure 1 illustre un schéma de l’alimentation lipidique en utilisant différents contextes expérimentaux.
1. Préparation de bactéries conditionnées par les lipides
- Préparer la solution de base de restriction alimentaire à dilution bactérienne (RDB) en dissolvant 5,85 g de NaCl, 1,0 g deK2HPO4 et 6,0 g de KH2PO4 (voir le tableau des matières) dans 999 mL d’eau désionisée. Réglez le pH à 6,0 avec 0,5 M KOH, puis filtrez à travers un filtre de 0,22 μm.
REMARQUE: La solution BDR peut être stockée à température ambiante pour un stockage à long terme. - Préparer le milieu BDR en ajoutant 10 μL de 5 mg/mL de cholestérol (dissous dans de l’éthanol 200-résistant) à chaque 10 mL de solution de base BDR.
- Étaler les bactéries OP50 (voir le tableau des matériaux) du stock de -80 °C aux plaques de gélose LB et incuber à 37 °C pendant la nuit.
REMARQUE: Après la nuit d’incubation à 37 °C, la plaque OP50 peut être conservée à 4 °C jusqu’à 1 semaine pour des résultats d’alimentation stables. - Inoculer les bactéries OP50 de la plaque OP50 LB-agar dans un milieu LB et incuber dans un agitateur à 37 °C pendant une nuit (16 h).
REMARQUE: Le volume moyen LB nécessaire dépend des paramètres expérimentaux. Il est recommandé d’utiliser 200 μL de 5x bactéries concentrées ensemencées sur chacune des plaques de 6 cm et 1 mL de 5x bactéries concentrées pour chacune des plaques de 10 cm et chaque répétition des conditions d’alimentation liquide. Ainsi, 1 mL et 5 mL d’inoculation LB initiale doivent être préparés pour chaque culture d’alimentation lipidique, respectivement. - Recueillir les bactéries par centrifugation à 4 000 x g pendant 10 min à température ambiante. Jetez le surnageant.
- Suspendre la pastille bactérienne dans 20 mL de base BDR et centrifuger à 4 000 x g pendant 10 min. Jetez le surnageant.
REMARQUE: Cette étape est essentielle pour éliminer les résidus restants de LB dans la pastille bactérienne. - Suspendre chaque pastille bactérienne dans le milieu BDR pour faire un stock de bactéries BDR 20x. Diluer le stock de bactéries BDR 20x avec le milieu BDR à 5x avant utilisation.
REMARQUE: Utilisez un volume 1/20 de milieu BDR du volume LB original pour atteindre une concentration de 20x pour les bactéries. Le stock de bactéries 20x peut être conservé à 4 °C jusqu’à 1 semaine. - Préparez une solution mère de lipides, en utilisant de l’éthanol ou du diméthylsulfoxyde (DMSO) comme solvant dans un nouveau flacon en verre autoclavé, et remplissez le flacon en verre avec de l’argon ou de l’azote pour éviter l’oxydation.
NOTE: La concentration de la solution mère est généralement comprise entre 250 mM et 1 mM. - Transférer la solution mère lipidique à la quantité désirée de solution bactérienne BDR pour atteindre la concentration finale souhaitée dans les conditions d’alimentation. Bien mélanger en tourbillonnant pendant 20 s.
REMARQUE: La concentration finale des lipides dans l’alimentation est généralement de 1 μM à 1 mM, selon les lipides et les conditions d’essai. Il est recommandé d’effectuer d’abord une expérience pilote pour tester différentes concentrations allant de 0,1 μM à 1 mM si vous travaillez avec de nouveaux lipides. Mélanger la solution mère lipidique avec des bactéries BDR immédiatement avant de l’ensemencer sur la plaque ou de la mettre dans des cultures de vers liquides. Préparez les bactéries conditionnées par les lipides pas plus de 1 h avant de nourrir les vers. - Mélanger les mêmes volumes d’éthanol filtré ou de DMSO (selon celui qui est utilisé pour le groupe d’alimentation lipidique) avec des bactéries BDR pour servir de contrôle du véhicule.
2. Préparation de C. elegans synchronisé pour la supplémentation en lipides
- Préparer le tampon M9 en mélangeant (en utilisant les concentrations finales spécifiées) 22 mM KH 2 PO 4, 22 mMNa2 HPO 4, 85 mM NaCl et2mM MgSO 4 (voir le tableau des matériaux). Autoclaver le tampon à stériliser.
- Préparer une solution d’eau de Javel fraîche avec 60 % d’eau de Javel domestique (v/v, voir le tableau des matières) et une concentration finale de 1,6 M de NaOH.
- Recueillir les adultes gravides dans un tube conique de 15 ml en utilisant 10 ml de tampon M9.
REMARQUE : Le nombre de vers et de plaques nécessaires à la synchronisation dépend des paramètres expérimentaux (c’est-à-dire le nombre de conditions, de répétitions et de méthodes d’alimentation). Idéalement, chaque plaque complète de 6 cm de vers adultes devrait pouvoir produire au moins 600 vers L1 après synchronisation. - Faire tourner les vers à 1 450 x g pendant 30 s. Retirer le surnageant et rincer les vers une fois de plus avec 10 ml de tampon M9.
- Faire tourner les vers à 1 450 x g pendant 30 s. Aspirer le surnageant, en laissant une partie aliquote de 4 mL dans le tube conique. Ajouter 2 mL de solution d’eau de Javel et agiter vigoureusement pendant 1 min.
- Faire tourner les vers à 1 450 x g pendant 30 s à température ambiante.
- Retirer le surnageant et ajouter 4 mL de tampon M9 et 2 mL de solution d’eau de Javel. Secouez le tube jusqu’à ce que les corps des vers soient dissous.
- Faire tourner les œufs à 1 450 x g pendant 30 s à température ambiante.
- Retirer le surnageant et laver les œufs avec 10 ml de tampon M9.
- Répétez les étapes 2.8 et 2.9 3x.
- Suspendre les embryons avec 6 mL de tampon M9. Balancer les embryons sur un rotateur à 20 °C pendant 2 jours pour les laisser éclore et se synchroniser.
- Transférer les larves L1 dans des plaques ensemencées OP50. Incuber à 20 °C pendant 48 h pour recueillir les vers L4 synchronisés, 72 h pour les adultes du jour 1 et 96 h pour les adultes du jour 2.
REMARQUE : Les plaques OP50 sont préparées en ajoutant 1 mL de 20x bactéries OP50 à chaque plaque de milieu de croissance de nématodes (NGM)34 de 10 cm. 30 000 vers L1 peuvent être ensemencés sur chacune des plaques OP50 si l’objectif est de récolter les vers au stade L4, et 20 000 vers L1 peuvent être ensemencés sur chacune des plaques OP50 si vous souhaitez récolter des adultes du jour 1 dans les contextes expérimentaux actuels. Il peut être différent pour différents environnements de laboratoire, il est donc recommandé de tester le nombre de vers qui peuvent être ensemencés pour s’assurer que les vers ont suffisamment de nourriture avant d’être récoltés. - Recueillir les vers adultes L4, 1er jour ou 2e jour dans un tube conique de 15 ml à l’aide de 10 ml de tampon M9. Utilisez un autre tampon de 5 ml de M9 pour rincer les vers restants des plaques.
- Faire tourner les vers à 1 450 x g pendant 30 s et jeter le surnageant. Laver la pastille de ver avec 10 ml de milieu BDR, centrifuger à 1 450 x g pendant 30 s et jeter le surnageant.
- Pour les vers dans la méthode d’alimentation liquide, transférer le milieu BDR sur les vers pour atteindre une concentration de vers de 3 000 vers/mL. Pour les vers dans les méthodes d’alimentation sur plaque, réduire le volume de milieu BDR ajouté aux vers pour réduire le temps de séchage dans la plaque.
3. Supplémentation en lipides pour C. elegans
- Effectuer la supplémentation lipidique en culture liquide en suivant les étapes ci-dessous.
REMARQUE: Cette méthode convient pour tester les changements transcriptionnels à l’aide de vers en vrac supplémentés en lipides.- Transférer la quantité désirée de lipides ou de contrôle du véhicule à chacun des puits dans une plaque de 12 puits. Préparer trois à quatre puits pour chaque condition d’alimentation en tant que réplication biologique.
- Mélanger la suspension de vers de l’étape 2.15 avec 5x bactéries BDR dans un rapport de 1:1 pour obtenir une concentration finale de 1 500 vers/ml et 2,5x pour les bactéries.
- Transférer 2 mL du mélange vers-bactéries dans un milieu BDR dans chaque puits de la plaque de 12 puits.
- Envelopper la plaque de 12 puits avec du papier d’aluminium et agiter dans un incubateur à 20 °C à 100 tr/min pour la durée d’incubation souhaitée.
REMARQUE: Pour tester différentes conditions d’alimentation, incuber les lipides avec des vers pendant différentes durées, par exemple pendant 6 h, 12 h et 24 h. En outre, différents stades de ver peuvent être testés pour des résultats optimaux, y compris l’alimentation lipidique à partir du stade adulte L4 ou jour-1.
- Effectuer la supplémentation lipidique sur les plaques de gélose NGM de 10 cm en suivant les étapes ci-dessous.
REMARQUE: Cette méthode convient pour tester les changements transcriptionnels à l’aide de vers en vrac supplémentés en lipides.- Ensemencez 1 mL de bactéries conditionnées par les lipides de l’étape 1,9 au centre de chacune des plaques de 10 cm. Lorsqu’un grand nombre de plaques ont été préparées, vortex la solution de travail finale plusieurs fois entre les semis. Sécher les assiettes dans l’obscurité à l’aide d’une hotte de biosécurité.
- Transférer 3 000 vers de l’étape 2.15 sur chacune des plaques de 10 cm. Sécher les plaques dans une cagoule de biosécurité jusqu’à ce que les vers puissent ramper sur les plaques supplémentées en lipides au lieu de nager.
- Incuber les vers sur les plaques conditionnées en lipides dans un incubateur à 20 °C pendant la durée souhaitée. Protéger de la lumière si vous utilisez des lipides poly-insaturés.
REMARQUE: Pour tester différentes conditions d’alimentation, incuber les lipides avec des vers pendant différentes durées, telles que 6 h, 12 h et 24 h. En outre, différents stades de ver peuvent être testés pour des résultats optimaux, y compris l’alimentation lipidique au stade adulte L4 ou jour-1.
- Effectuer une supplémentation lipidique sur les plaques de gélose NGM de 6 cm pour l’analyse transcriptionnelle.
REMARQUE: Cette méthode convient pour tester les changements transcriptionnels chez quelques vers supplémentés en lipides.- Ensemencez 300 μL de bactéries lipidiques de l’étape 1.9 au centre de chaque plaque de 6 cm. Lorsqu’un grand nombre de plaques ont été préparées, vortex la solution de travail finale plusieurs fois entre les semis. Sécher les assiettes dans l’obscurité à l’aide d’une hotte de biosécurité.
- Transférer jusqu’à 300 vers de l’étape 2.15 sur chacune des plaques de 6 cm. Sécher les plaques dans une hotte de biosécurité jusqu’à ce que les vers puissent ramper sur les plaques supplémentées en lipides au lieu de nager.
- Incuber les vers sur les plaques conditionnées en lipides dans un incubateur à 20 °C pendant la durée souhaitée. Protéger de la lumière si vous utilisez des lipides poly-insaturés.
REMARQUE: Pour tester différentes conditions d’alimentation, incuber les lipides avec des vers à différents moments, tels que 6 h, 12 h et 24 h. En outre, différents stades de ver peuvent être testés pour des résultats optimaux, y compris l’alimentation lipidique au stade adulte L4 ou jour-1.
- Effectuer une supplémentation lipidique sur les plaques de gélose NGM de 6 cm pour le dosage de la durée de vie longitudinale.
- Ensemencer 200 μL de bactéries conditionnées par les lipides (avec 1x concentration de lipides et 5x bactéries concentrées) sur le centre de chacune des plaques NGM de 6 cm. Préparez trois assiettes pour chaque condition d’alimentation.
NOTE: Les assiettes doivent être préparées fraîchement le jour de l’utilisation (idéalement juste avant utilisation). - Sécher les assiettes dans une hotte de biosécurité. Gardez les lumières dans la hotte et la pièce éteintes si vous utilisez des lipides poly-insaturés.
- Choisissez 30 à 40 vers L4 synchronisés sur chacune des plaques. Conservez les plaques avec les vers dans un incubateur à 20 °C. Si vous nourrissez avec des lipides polyinsaturés, conservez les assiettes dans une boîte protégée contre la lumière dans l’incubateur à 20 °C.
REMARQUE: Il est possible d’utiliser OP50 à partir d’une plaque de passage normale de 6 cm (OP50 non conditionnée) comme colle pour ramasser les vers, mais il est crucial de ne pas laisser une grande quantité d’OP50 non conditionné dans la plaque d’essai. - Transférer les vers dans de nouvelles assiettes conditionnées en lipides fraîchement préparées tous les jours ou tous les deux jours, selon les conditions d’alimentation souhaitées. La survie est notée de la même manière que celle décrite précédemment4.
- Ensemencer 200 μL de bactéries conditionnées par les lipides (avec 1x concentration de lipides et 5x bactéries concentrées) sur le centre de chacune des plaques NGM de 6 cm. Préparez trois assiettes pour chaque condition d’alimentation.
4. Extraction d’ARN pour l’analyse transcriptionnelle
- Effectuer l’extraction de l’ARN à partir d’un grand nombre de vers entiers.
- Transfèrent les vers dans la culture liquide de l’étape 3,1 aux tubes microcentrifugés de 1,5 mL. Laver les vers des plaques de 10 cm de l’étape 3.2 à l’aide d’un tampon M9 et transférer les vers dans un tampon M9 dans des tubes microcentrifugés de 1,5 mL.
- Centrifuger brièvement les vers avec une mini-centrifugeuse de table (voir le tableau des matériaux) pendant 10 s et aspirer rapidement le surnageant.
- Transférer les vers restants des puits d’alimentation liquide ou laver des trayons de la plaque dans le même tube et les faire tourner. Retirez le surnageant.
- Laver les pastilles de vers avec 1 ml de M9 glacé, tourner brièvement pendant 10 s avec une mini-centrifugeuse et aspirer le surnageant. Répétez 1x ou 2x selon la transparence du surnageant.
- Placer les tubes de microcentrifugation sur la glace pendant 2 minutes et enlever autant de surnageant que possible avec une pipette de 200 μL, en laissant une pastille de vis sans fin emballée d’un volume ne dépassant pas 15 μL.
- Transférer 15 μL de solution d’extraction d’ARN contenant du phénol et de l’isothiocyanate de guanidine (tableau des matériaux) dans chacun des tubes de microcentrifugation et broyer les vers avec un broyeur moteur pendant environ 30 s jusqu’à ce qu’aucun ver intact ne soit visible.
ATTENTION : La solution d’extraction d’ARN est toxique et inflammable, et toute étape impliquant un récipient ouvert avec ce réactif doit être opérée dans une hotte chimique. - Transférer 285 μL de la solution d’extraction d’ARN dans le tube de microcentrifugation tout en rinçant tout contenu de vis sans fin de la pointe du broyeur du moteur vers le tube de microcentrifugation. Vortex pour bien mélanger.
Remarque : Il s’agit d’un point de pause. Les échantillons peuvent être conservés dans la solution d’extraction d’ARN à -80 °C pendant quelques mois. Une fois prélevés à -80 °C, laisser les échantillons décongeler à température ambiante. - Transférer vigoureusement 60 μL de chloroforme dans chaque échantillon et vortex. Laisser les échantillons déposer à température ambiante pendant 10 min.
ATTENTION : Le chloroforme est toxique et doit être manipulé dans une hotte chimique. - Centrifuger à 21 000 x g pendant 20 min à 4 °C. Transférer soigneusement 140 μL de la couche aqueuse sur le dessus dans un nouveau tube microcentrifugeuse sans RNase à l’aide d’une pipette de 200 μL, en transférant 2x avec 70 μL à chaque fois.
REMARQUE: À partir de cette étape, tous les embouts de pipette et les récipients qui ont un contact direct avec l’échantillon doivent être exempts de RNase. Il est également suggéré d’utiliser une solution de décontamination RNase pour essuyer tout l’équipement et l’espace de travail. - Transférer 140 μL d’isopropanol dans le tube à échantillon. Vortex vigoureusement et laisser l’échantillon se déposer à température ambiante pendant 10 min. Centrifuger à 21 000 x g pendant 20 min à 4 °C et retirer délicatement tout surnageant.
- Transférer 0,5 mL d’éthanol à 80 % (v/v) glacé dans le tube à échantillon avec la pastille d’ARN. Vortex vigoureusement jusqu’à ce que la pastille d’ARN quitte le fond du tube et flotte dans la solution d’éthanol. Centrifuger à 21 000 x g pendant 10 min à 4 °C et retirer le surnageant.
- Centrifuger brièvement les tubes d’échantillon dans la mini-centrifugeuse pendant 15 s pour faire tourner tout solvant adhérant à la paroi du tube, puis retirer la solution d’éthanol autant que possible avec une pipette.
- Laissez le capuchon du tube ouvert pour sécher la pastille d’ARN. Si le granulé a été soigneusement lavé avec la solution d’éthanol, l’étape de séchage devrait prendre moins de 10 minutes.
Remarque : Il s’agit d’un point de pause. La pastille d’ARN séchée peut être conservée à -80 °C jusqu’à 1 mois. - Dissoudre la pastille d’ARN sec avec 40 μL d’eau exempte de nucléases et traiter avec une trousse d’élimination de l’ADN conformément aux instructions du fabricant (voir le tableau des matériaux).
REMARQUE: Il est recommandé de dissoudre d’abord l’ARN dans de l’eau exempte de nucléase. Si 40 μL d’eau sont mélangés avec le tampon DNase 10x avant d’être transférés dans le tube à ARN, la pastille d’ARN ne se dissoudra pas complètement. Les échantillons d’ARN doivent être conservés sur la glace lors de la dissolution de la pastille d’ARN dans l’eau. Les cycles de congélation-dégel diminuent la qualité de l’ARN; par conséquent, passez à l’étape de transcription inverse le jour même du traitement par DNase.
- Extraction d’ARN à partir d’un petit nombre de vers entiers.
- Choisissez 15 à 20 vers de leur pelouse bactérienne dans une plaque de NGM fraîche non ensemencée pour éliminer les bactéries du ver.
- Selon le fabricant du kit qRT-PCR en 2 étapes (voir le tableau des matériaux), préparer 20 μL de solution de lyse finale pour chaque échantillon en mélangeant 0,2 μL de DNase avec 19,8 μL de solution de lyse dans des tubes PCR. Mélanger la solution de lyse en tuytant de haut en bas 5x.
- Transférer 15 à 20 vers de la plaque NGM non ensemencée dans le tube de PCR contenant 20 μL de la solution de lyse finale avec le nombre minimum de bactéries. Incuber la réaction de lyse pendant 5 min à température ambiante.
- Sonder (voir le tableau des matériaux) les vers avec une amplitude de 30% en utilisant le programme suivant: sonication pendant 5 s, pause pendant 5 s et répétition 4x avec un temps de sonication total de 20 s. Conservez les échantillons dans un bain d’eau glacée pendant la sonication.
- Incuber à température ambiante pendant 5 min.
REMARQUE: Ajouter plus de DNase avant l’incubation si le contrôle négatif sans RT montre une contamination de l’ADN à un niveau préoccupant. - Transférer 2 μL de solution stop dans la réaction de lyse et mélanger en tapotant doucement. Incuber pendant 2 min à température ambiante, puis mettre sur de la glace.
REMARQUE : Les échantillons peuvent être laissés sur la glace jusqu’à 2 heures avant de passer à l’étape de transcription inverse.
- Effectuez l’extraction de l’ARN des tissus des vers en suivant les étapes ci-dessous.
- Choisissez environ 20 vers de leur pelouse bactérienne et placez-les sur une plaque NGM fraîche non ensemencée pour en éliminer les bactéries.
- Déplacer les 20 vers (avec le moins de bactéries possible) dans un verre de montre contenant 500 μL de solution M9 contenant 4 μM de lévamisole (voir le tableau des matériaux). L’immobilisation se produira en quelques secondes.
- Lorsque les vers sont immobilisés, disséquez la lignée germinale ou l’intestin à l’aide d’une aiguille de 25 g qui peut être fixée à la seringue de 1 mL.
- Sous le champ de dissection, effectuer une coupe à la position du deuxième bulbe pharyngé pour permettre l’extrusion naturelle de l’intestin et de la lignée germinale. Les deux tissus peuvent être facilement distingués en fonction de leur morphologie et de leur contraste différent. Utilisez une pince à épiler ou des aiguilles pour séparer doucement les tissus, en évitant de les endommager.
REMARQUE: Il est recommandé de disséquer dans les 5-10 min. Si la coupe ne produit pas une bonne extrusion tissulaire, il est suggéré de passer au ver suivant et d’en disséquer autant que possible dans les 10 minutes. Cette procédure nécessite un court laps de temps pour éviter les modifications transcriptionnelles de l’environnement.
- Sous le champ de dissection, effectuer une coupe à la position du deuxième bulbe pharyngé pour permettre l’extrusion naturelle de l’intestin et de la lignée germinale. Les deux tissus peuvent être facilement distingués en fonction de leur morphologie et de leur contraste différent. Utilisez une pince à épiler ou des aiguilles pour séparer doucement les tissus, en évitant de les endommager.
- Selon le fabricant du kit qRT-PCR en 2 étapes, préparer 20 μL de solution de lyse finale pour chaque échantillon en mélangeant 0,2 μL de DNase I à 19,8 μL de solution de lyse dans les tubes PCR. Mélanger la solution de lyse en tuytant de haut en bas 5x.
- Utilisez une pipette en verre autoclavée pour transférer les tissus disséqués dans un tube PCR. Déposer les tubes de PCR sur de la glace pendant 2 minutes pour permettre le dépôt de matière au fond. Retirer le surnageant, ajouter 20 μL de solution de lyse finale dans le tube de PCR et mélanger en tapotant.
- Incuber la réaction de lyse pendant 5 min à température ambiante. Ensuite, transférer 2 μL de solution stop dans la réaction de lyse et mélanger en tapotant. Incuber pendant 2 min à température ambiante.
REMARQUE : Les échantillons peuvent être laissés sur la glace jusqu’à 2 heures avant de passer à l’étape de transcription inverse.
5. Transcription inverse et qRT-PCR
- Effectuez une transcription inverse et une qRT-PCR à partir de vers en vrac.
- Mesurer la concentration d’ARN et préparer 5 μg d’ARN total pour la transcription inverse.
- Préparer un échantillon d’ARN groupé en mélangeant des quantités égales d’ARN de chaque échantillon et en ajustant la concentration finale d’ARN à 0,556 g/L (5 μg/9 μL). Utilisez l’échantillon d’ARN combiné pour la courbe standard qRT-PCR et les témoins RT-négatifs.
- Effectuer une transcription inverse conformément aux instructions du fabricant (voir le tableau des matériaux). Exécutez les réactions de transcription inverse de contrôle de qualité suivantes avec les échantillons d’ARN individuels.
- Effectuer une transcription inverse avec l’échantillon d’ARN groupé comme modèle (pour la courbe standard qRT-PCR).
- Effectuer une transcription inverse avec l’échantillon d’ARN combiné comme modèle, sans transcriptase inverse (contrôle RT-négatif; contrôle de la qualité pour la contamination potentielle de l’ADN du génome).
- Effectuer une transcription inverse avec l’eau exempte de nucléases comme matrice (contrôle RT-négatif; contrôle de la qualité de la contamination potentielle de l’ARN dans les réactifs).
Remarque : Il s’agit d’un point de pause. Les échantillons peuvent être laissés dans le thermocycleur pendant la nuit ou conservés à -20 °C pendant quelques mois.
- Diluer l’ADNc généré à partir des échantillons d’ARN combinés quatre fois, 20 fois, 100 fois et 500 fois avec de l’eau sans nucléase pour les courbes standard qRT-PCR.
- Diluer l’ADNc généré à partir de chaque échantillon d’ARN 20 à 100 fois pour l’utiliser comme modèle pour les réactions qRT-PCR.
NOTE: Le taux de dilution dépend de l’abondance du gène d’intérêt. Pour les gènes fortement exprimés, tels que les gènes d’entretien ménager ou egl-3 et egl-21 utilisés dans cette étude, une dilution de 100x est recommandée. Pour les gènes faiblement exprimés, tels que lbp-8, une dilution de 20x est recommandée. - Effectuer la qRT-PCR avec les réactifs qRT-PCR conformément aux instructions du fabricant comme suit : 95 °C pendant 10 min, répéter 40 fois avec 95 °C pendant 15 s et 60 °C pendant 1 min, suivi du programme de courbe de fusion par défaut, et maintenir à 8 °C pendant une durée indéterminée.
- Effectuez la transcription inverse et la qRT-PCR à partir de quelques vers ou tissus de vers.
- Transfèrent 25 μL de tampon RT et 2,5 μL de mélange enzymatique RT 20x du kit qPCR en 2 étapes (voir le tableau des matériaux) dans chaque tube contenant du lysat de vers de l’étape 4.2.6 ou 4.3.6.
REMARQUE: Un contrôle RT-négatif est essentiel pour la qRT-PCR de quelques vers. Chaque expérience doit inclure un échantillon de lysat de ver (de l’étape 4.2.6) avec tampon RT mais sans enzyme RT pour examiner la contamination de l’ADN dans les échantillons. Si la contamination de l’ADN est un problème, envisagez d’ajouter plus de DNase au tampon de lyse ou plus de DNase à l’échantillon après la lyse des vers. Alternativement, on peut effectuer un contrôle RT-négatif pour chaque échantillon en utilisant la moitié du lysat dans une réaction RT normale et l’autre moitié dans une réaction RT sans transcriptase inverse. - Mélanger en tapotant doucement. Filer vers le bas à l’aide d’une mini-centrifugeuse pendant 10 s.
- Chargez les échantillons dans le thermocycleur en suivant les instructions du fabricant : 37 °C pendant 60 min, 95 °C pendant 5 min et 8 °C pour une durée indéterminée.
Remarque : Il s’agit d’un point de pause. Les échantillons peuvent être laissés dans le thermocycleur pendant la nuit ou conservés à -20 °C pendant quelques mois. - Gardez tous les réactifs et échantillons sur la glace et protégez les réactifs qRT-PCR de la lumière.
- Préparer une plaque qPCR à 96 puits et, dans chaque puits, mélanger 6 μL d’eau exempte de nucléase, 10 μL de réactif qRT-PCR, 2 μL de mélange d’amorce 5 μM (avant et arrière) et 2 μL d’ADNc. Couvrir la surface de la plaque qPCR à 96 puits avec un film optique protecteur et appuyer pour sceller.
- Exécutez le programme qRT-PCR sur un thermocycleur en suivant les instructions du fabricant comme suit : 50 °C pendant 2 min, 95 °C pendant 2 min, répéter 40 fois avec 95 °C pendant 3 s et 60 °C pendant 30 s, suivi de 8 °C pendant une durée indéterminée.
- Transfèrent 25 μL de tampon RT et 2,5 μL de mélange enzymatique RT 20x du kit qPCR en 2 étapes (voir le tableau des matériaux) dans chaque tube contenant du lysat de vers de l’étape 4.2.6 ou 4.3.6.
Résultats
Validation des changements transcriptionnels à l’aide de quelques vers entiers lors de la supplémentation en lipides
Pour déterminer si le protocole d’extraction et de rétrotranscription de l’ARN en ADNc de quelques vers entiers est reproductible et comparable aux données des vers en vrac, une souche de ver à longue durée de vie surexprimant la lipase lysosomale lipase lipl-4 dans l’intestin a été utilisée 7,8,33,35. L’induction transcriptionnelle des gènes de traitement des neuropeptides egl-3 et egl-21 rapportée dans les études précédentes 7,8,33 a été validée (Figure 2A,B). Cette induction indique que la méthode d’extraction de l’ARN de quelques animaux est une alternative valable aux techniques standard de synthèse de l’ADNc à partir de cultures de vers en vrac.
Validation des évaluations transcriptionnelles utilisant des tissus de vers disséqués lors de la supplémentation en lipides
Chez C. elegans, la synthèse des AGPI à 20 carbones dépend de l’activité de la désaturase FAT-316,17. Des études antérieures ont rapporté que les mutants de graisse 3 manquent d’AGPI à 20 carbones, y compris DGLA16. Auparavant, il avait été découvert que la perte de Δ6-désaturase FAT-3 dans les vers lipl-4g supprimait l’induction transcriptionnelle des gènes de traitement des neuropeptides egl-3 et egl-2133. En outre, la supplémentation en DGLA sauve une telle induction33. Le gène codant pour egl-21 est exprimé dans les neurones, tandis que egl-3 est détecté dans les neurones et les intestins36,37. Pour tester davantage si la supplémentation en DGLA restaure l’induction de l’egl-3 et de l’egl-21 dans l’intestin ou dans les neurones, l’intestin a été disséqué et leurs niveaux transcriptionnels ont été évalués à l’aide de l’analyse qRT-PCR décrite aux étapes 4.3 et 5.2 de ce protocole. DGLA a été complété dans l’aliment source pendant 12 heures à l’âge adulte jour-1. Aucune induction transcriptionnelle de l’egl-3 ou de l’egl-21 n’a été observée dans l’intestin (Figure 2C), ce qui est cohérent avec les résultats précédents36,38.
Validation de l’essai de durée de vie lors de la supplémentation en lipides
La relation entre les AGPI à 20 carbones et le mécanisme de longévité inactivant la graisse 3 a déjà été explorée, en particulier dans l’intestin des vers lipl-4g 33. Il a été constaté que le fat-3 knockdown supprime complètement l’extension de la durée de vie conférée par lipl-433. Pour évaluer si DGLA restaure la longévité affectée par lipl-4, DGLA a été complété fraîchement tous les deux jours dans l’aliment source au jour 1 de l’âge adulte. Il a été constaté que lors de l’élimination de la graisse 3, la supplémentation DGLA sauve l’extension de la durée de vie (Figure 2D)33, indiquant une procédure de supplémentation lipidique réussie couplée au test de durée de vie.
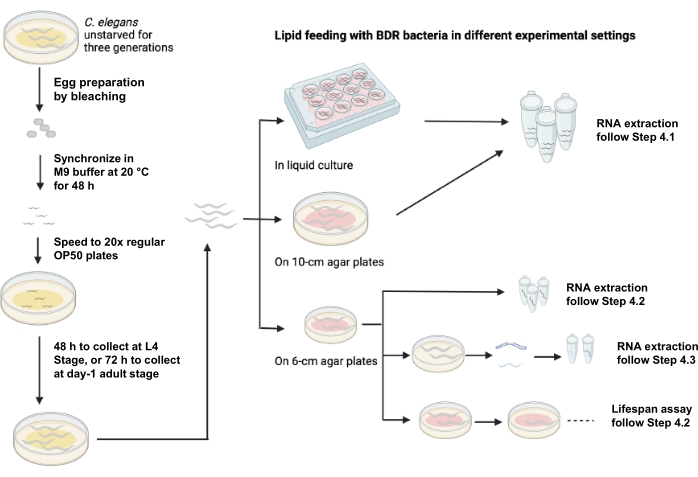
Figure 1 : Schéma de l’alimentation lipidique à l’aide de différents contextes expérimentaux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Validation de l’évaluation transcriptionnelle des gènes de traitement des neuropeptides à l’aide d’une grande population de vers, de quelques vers et de tissus disséqués. (A) L’ARN extrait d’une grande population de vers montre l’induction des niveaux de transcrits egl-3 et egl-21 des gènes de traitement des neuropeptides chez les animauxlipl-4 Tg. Les barres d’erreur représentent ±1 SEM. **** p < 0,0001 par le test t bilatéral de Student. (B) L’extraction d’ARN de quelques vers confirme l’induction des niveaux de transcrits egl-3 et egl-21 des gènes de traitement des neuropeptides chez les vers lipl-4 Ig. Les barres d’erreur représentent ±1 SEM. **** p < 0,0001 par le test t bilatéral de Student. (C) Les gènes de traitement neuropeptidique egl-3 et egl-21 ne sont pas induits dans les intestins disséqués. Les barres d’erreur représentent ±1 SEM. Analyse statistique avec test t de Student bilatéral. (D) La supplémentation en DGLA à différentes concentrations, y compris 10 μm, 100 μm et 1 mM sauve l’effet de longévité de la lipl-4Tg sur l’ARNi de la graisse 3. p < 0,001 par test log-rank. Cette figure est adaptée de Savini et al.33. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
La supplémentation en lipides a été utilisée dans la recherche sur le vieillissement pour élucider l’impact direct de certaines espèces lipidiques sur le vieillissement en bonne santé 6,7,23,26,27,31. Cependant, la procédure de supplémentation en lipides peut être difficile, et toute incohérence entre les expériences peut entraîner des résultats non reproductibles. Ici, le premier protocole détaillé étape par étape est documenté pour guider les nouveaux scientifiques afin d’éviter les pièges potentiels causés par l’imprécision technique. Les étapes critiques de ce protocole seront examinées en détail dans les paragraphes suivants. La boîte à outils de recherche sur les lipides est également élargie en introduisant l’isolement de l’ARN de quelques vers et de tissus de vers spécifiques après la supplémentation en lipides. Lorsque l’on considère la méthodologie pour examiner les niveaux de transcription, la qRT-PCR avec quelques vers ou tissus disséqués est exceptionnelle pour analyser quelques transcriptions ou examiner certains changements transcriptionnels spécifiques aux tissus. De plus, l’utilisation de ces méthodologies pourrait surmonter l’étape d’amplification du ver qui peut prendre environ 5 à 6 jours supplémentaires. Dans le même temps, l’alimentation lipidique suivie d’une extraction massive d’ARN est plus rentable et constitue une alternative valable lorsqu’un plus grand ensemble de gènes cibles doit être analysé.
Plusieurs étapes peuvent être critiques pour la reproductibilité des effets d’alimentation lipidique. Le premier aspect est lié aux conditions bactériennes. Il est suggéré d’utiliser des plaques bactériennes fraîches qui ne datent pas de plus de 7 jours pour l’inoculation. Il est recommandé d’utiliser des bactéries préparées dans un milieu BDR dans un délai de 1 semaine. Les bactéries qui ont été mélangées avec des lipides doivent être utilisées immédiatement. Les lipides contenant des bactéries ne doivent pas être stockés même à 4 ° C, car les bactéries métaboliseront les lipides. Les étapes de lavage dans la base BDR et de remise en suspension dans le milieu BDR sont essentielles pour les conditions bactériennes, car les bactéries ont été cultivées dans LB, et l’alimentation directe aux vers élimine toujours les effets profonds des suppléments lipidiques. Le deuxième facteur est associé aux conditions des vers. C. elegans doit être non affamé pendant au moins trois générations avant l’étape de blanchiment pour la préparation des œufs afin de s’assurer qu’ils sont dans un état métabolique sain et stable. Il est également crucial pour la culture de C. elegans sur des plaques de gélose avant la supplémentation en lipides; Cela inclut avant et après l’étape de synchronisation.
Les vers qui se sont adaptés aux cultures liquides pendant des périodes prolongées sont partiellement affamés; La famine élève la base de référence pour les gènes pro-longévité, ce qui conduit à un effet affaibli de la supplémentation en lipides. Si la dérive métabolique et les changements à l’aide de larves L1 arrêtées sont préoccupants, une alternative valable serait de plaquer directement les œufs. Lorsque seulement quelques vers sont nécessaires pour effectuer une analyse de la durée de vie ou de l’expression génique, il est possible de plaquer les œufs directement sur des plaques conditionnées par les lipides et de les resynchroniser en les cueillant à la main au stade L4 pour des expériences ultérieures. Cependant, si de grandes quantités de vers sont nécessaires lorsque la cueillette manuelle de L4 n’est pas applicable, le placage direct des œufs n’est pas idéal. L’éclosion des œufs après le blanchiment des adultes gravides peut se produire à différents moments et provoquer une non-synchronisation de la population, ce qui interférerait avec l’analyse transcriptionnelle. La troisième partie critique est liée aux conditions de stockage des lipides ; lors de la supplémentation en AGPI, une attention particulière est nécessaire car ces molécules sont sensibles à la lumière et sujettes à l’oxydation dans l’air.
De multiples conditions d’alimentation en lipides, y compris les stades de vers, la durée de la supplémentation et les concentrations, nécessitent une enquête plus approfondie lors de l’essai de nouvelles molécules lipidiques. Les vers adultes L4, jour 1 et jour 2 sont généralement le point de départ des tests à différents stades des vers. Notamment, lors de l’alimentation des vers L4, si le temps d’incubation se termine autour de la phase de mue des nématodes, une grande variation est attendue, ce qui influence grandement la signification et la reproductibilité des résultats. Un défi supplémentaire pour l’utilisation de vers adultes du jour 1 ou du jour 2 est lié aux descendants qui peuvent compliquer l’analyse de l’expression génique. Dans ce cas, l’extraction d’ARN de quelques vers entiers est plus fiable que les populations en vrac. Différentes molécules lipidiques ont des gammes de concentration différentes pour produire des effets physiologiques; il est donc suggéré d’essayer une série de concentrations de 1 μM à 1 mM.
Il y a quelques limites à prendre en compte lors du choix de la méthode d’alimentation. Premièrement, lorsque les lipides ne peuvent pas être absorbés ou ingérés par les vers, il est difficile d’utiliser une méthode de supplémentation pour tester leur effet biologique chez C. elegans. Avec les technologies actuelles, la spectrométrie de masse ou SRS couplée à 13composés lipidiques marqués C ou 2H39 sont des outils valides pour tester l’absorption des lipides dans le corps du ver. Deuxièmement, ces méthodes d’alimentation ne sont pas optimisées pour les techniques d’enquête à haut débit. Pour la supplémentation en lipides avec des vers en vrac, la préparation des échantillons à partir de la méthode d’alimentation liquide est plus rapide que l’alimentation sur plaque, car les cultures liquides peuvent être directement transférées dans des tubes microcentrifugés au lieu d’être lavées des plaques d’alimentation. Pour s’assurer que l’ARN extrait est à l’état de récolte, il est suggéré de ne pas laisser passer plus de 15-20 minutes entre le moment de la mise des vers sur la glace et leur broyage dans la solution d’extraction d’ARN. Il est recommandé de traiter moins de conditions toutes les 15 minutes lorsqu’un grand nombre d’échantillons doit être traité. Pour l’extraction de l’ARN de vers entiers de quelques animaux, l’étape de cueillette manuelle est l’étape limitant la vitesse, tandis que pour disséquer les tissus, il est crucial d’agir de manière efficace pour éviter une exposition à long terme à un environnement non physiologique. Comme pour l’extraction d’ARN en vrac, il est préférable de cueillir des vers ou de disséquer des échantillons de tissus dans les 10 minutes.
Malgré les limites, ces méthodes de supplémentation peuvent être utilisées au-delà de la recherche sur les lipides pour aider à identifier les effets nutritionnels et médicinaux. Les procédures rapportées ici ne se limitent pas seulement à la recherche sur le vieillissement, mais aussi à des phénotypes alternatifs pour évaluer la valeur adaptative des organites et l’homéostasie métabolique cellulaire. La méthode de supplémentation avec population globale peut être couplée avec un RNA-seq pour l’analyse du transcriptome, une spectrométrie de masse pour l’analyse métabolomique et protéomique, ou un transfert Western pour l’analyse de marqueurs protéiques spécifiques, tandis que la supplémentation lipidique avec quelques vers peut être combinée avec l’imagerie et l’analyse comportementale.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Nous remercions P. Svay pour son soutien à la maintenance. Ce travail a été soutenu par les subventions NIH R01AG045183 (MCW), R01AT009050 (MCW), R01AG062257 (MCW), DP1DK113644 (MCW), March of Dimes Foundation (MCW), Welch Foundation (MCW), HHMI investigator (M.C.W.) et NIH T32 ES027801 pré-doctorant étudiant boursier (MS). Certaines souches ont été fournies par la CCG, qui est financée par le NIH Office of Research Infrastructure Programs (P40 OD010440).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
Références
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon