Method Article
Suplementación lipídica para la longevidad y análisis transcripcional de genes en Caenorhabditis elegans
* Estos autores han contribuido por igual
En este artículo
Resumen
El presente protocolo describe métodos de suplementación lipídica en cultivos líquidos y en placa para Caenorhabditis elegans, junto con estudios longitudinales y análisis transcripcionales de genes a granel o unos pocos gusanos y tejidos de gusanos.
Resumen
El envejecimiento es un proceso complejo caracterizado por cambios fisiológicos progresivos resultantes de contribuciones ambientales y genéticas. Los lípidos son cruciales para constituir componentes estructurales de las membranas celulares, almacenar energía y como moléculas de señalización. La regulación del metabolismo lipídico y la señalización es esencial para activar distintas vías de longevidad. El gusano redondo Caenorhabditis elegans es un organismo excelente y poderoso para diseccionar la contribución del metabolismo lipídico y la señalización en la regulación de la longevidad. Múltiples estudios de investigación han descrito cómo la suplementación dietética de moléculas lipídicas específicas puede extender la vida útil de C. elegans ; Sin embargo, las diferencias menores en las condiciones de suplementación pueden causar problemas de reproducibilidad entre los científicos en diferentes laboratorios. Aquí, se informan dos métodos detallados de suplementación para C. elegans que emplean suplementos de lípidos con bacterias sembradas en placas o suspensión bacteriana en cultivo líquido. También se proporcionan aquí los detalles para realizar ensayos de vida útil con suplementos lipídicos de por vida y análisis qRT-PCR utilizando un lisado de gusanos enteros o tejidos disecados derivados de unos pocos gusanos. Utilizando una combinación de estudios longitudinales e investigaciones transcripcionales sobre la suplementación con lípidos, los ensayos de alimentación proporcionan enfoques confiables para diseccionar cómo los lípidos influyen en la longevidad y el envejecimiento saludable. Esta metodología también se puede adaptar para varios enfoques de detección nutricional para evaluar los cambios en un subconjunto de transcripciones utilizando un pequeño número de tejidos disecados o unos pocos animales.
Introducción
Lípidos
Los lípidos son pequeñas moléculas hidrofóbicas o anfipáticas solubles en disolventes orgánicos pero insolubles en agua 1,2. Las distintas moléculas lipídicas se diferencian entre sí en función del número de carbonos contenidos en sus cadenas, ubicación, número de dobles enlaces y estructuras unidas, incluidos el glicerol o los fosfatos. Los lípidos desempeñan un papel crucial dentro y a través de distintas células para regular las funciones del organismo, incluida la constitución de bicapas de membrana, el almacenamiento de energía y la actuación como moléculas de señalización 3,4.
En primer lugar, los lípidos son componentes estructurales de las membranas biológicas, incluyendo la membrana plasmática y las membranas subcelulares intracelulares que dividen los compartimentos internos del entorno extracelular. En segundo lugar, los lípidos son la principal forma de almacenamiento de energía en animales vertebrados e invertebrados. Los lípidos neutros, incluidos los triacilgliceroles, se almacenan durante un período prolongado en varios tejidos, incluido el tejido adiposo. En el nematodo Caenorhabditis elegans, el intestino es el principal órgano metabólico de almacenamiento de grasa; Su función no solo está involucrada en la digestión y absorción de nutrientes, sino también en el proceso de desintoxicación, que se asemeja a la actividad de los hepatocitos de mamíferos. Otros tejidos de almacenamiento de grasa incluyen la línea germinal, en la que los lípidos son esenciales para el desarrollo de ovocitos, y la hipodermis, que está compuesta por células epidérmicas similares a la piel 3,5. En tercer lugar, en los últimos años, más evidencia ha sugerido que los lípidos son poderosas moléculas de señalización involucradas en la señalización intra y extracelular al actuar directamente sobre una variedad de receptores, incluidos los receptores nucleares y acoplados a proteínas G, o indirectamente a través de la modulación de la fluidez de la membrana o modificaciones postraduccionales 6,7,8,9 . Otros estudios continuarán dilucidando los mecanismos moleculares subyacentes de la señalización lipídica en la promoción de la longevidad y la salud.
Los organismos modelo son importantes para abordar cuestiones biológicas específicas que son demasiado complejas para estudiarlas en humanos. Por ejemplo, el gusano redondo C. elegans es un excelente modelo para realizar análisis genéticos para diseccionar procesos biológicos relevantes para la nutrición humana y la enfermedad10. Las vías moleculares altamente conservadas relevantes para la fisiología humana, los tejidos complejos, los patrones de comportamiento y las abundantes herramientas de manipulación genética hacen de C. elegans un organismo modelo notable11. Por ejemplo, C. elegans es excelente en el envío de pantallas genéticas para identificar genes específicos del fenotipo, así como en pantallas genéticas inversas de todo el genoma a través de la interferencia de ARN12.
En los laboratorios, los nematodos se cultivan en placas de Petri de agar sembradas con un césped de bacterias Escherichia coli, proporcionando macronutrientes como proteínas, carbohidratos y ácidos grasos saturados e insaturados como fuentes de energía y bloques de construcción, y micronutrientes como cofactores y vitaminas13. Al igual que los mamíferos, los nematodos sintetizan moléculas de ácidos grasos tanto del ácido palmítico como del ácido esteárico (moléculas saturadas de 16 carbonos y 18 carbonos, respectivamente) que se desaturan secuencialmente y se alargan a una variedad de ácidos grasos monoinsaturados (MUFA) y ácidos grasos poliinsaturados (PUFA)14,15,16,17,18. Curiosamente, C. elegans es capaz de sintetizar de novo todos los ácidos grasos requeridos y enzimas centrales involucradas en la biosíntesis, desaturación y elongación de ácidos grasos, facilitando la síntesis de AGPI de cadena larga19. A diferencia de otras especies animales, C. elegans puede convertir ácidos grasos ω-6 de 18 carbonos y 20 carbonos en ácidos grasos ω-3 con sus propias enzimas desaturasas ω-3. Además, los gusanos poseen una Δ12 desaturasa que cataliza la formación de ácido linoleico (LA) a partir del ácido oleico (OA, 18:1)20,21. La mayoría de los animales o plantas carecen de desaturasas tanto Δ12 como ω-3 y, por lo tanto, dependen de la ingesta dietética de ω-6 y ω-3 para obtener sus AGPI, mientras que C. elegans no requiere ácidos grasos dietéticos22. Los mutantes aislados que carecen de enzimas desaturasas funcionales se han utilizado para estudiar las funciones de ácidos grasos específicos en distintos procesos biológicos, incluida la reproducción, el crecimiento, la longevidad y la neurotransmisión. El efecto de los ácidos grasos individuales sobre vías biológicas específicas puede ser abordado utilizando tanto un enfoque genético como la suplementación dietética16,17,23. Hasta la fecha, la investigación lipídica se ha centrado en la caracterización de genes implicados en la síntesis, degradación, almacenamiento y descomposición de lípidos en condiciones neurológicas y de desarrollo24. Sin embargo, los roles de los lípidos en la regulación de la longevidad apenas comienzan a revelarse.
Señalización lipídica en la regulación de la longevidad
Los lípidos juegan un papel crucial en la regulación de la longevidad mediante la activación de cascadas de señalización celular en distintos tejidos y tipos de células. Estudios recientes han destacado el papel activo de los lípidos en la modulación de la transcripción y la comunicación célula-célula a través de proteínas de unión a lípidos o el reconocimiento de receptores de membrana25. Además, la suplementación con lípidos en la dieta ofrece una excelente herramienta para diseccionar cómo el metabolismo de los lípidos influye en la vida útil de C. elegans. Se ha demostrado que distintos MUFA y PUFA promueven la longevidad mediante la activación de factores de transcripción26,27.
Los modelos de longevidad, incluida la señalización de insulina/IGF-1 y la ablación de células precursoras de la línea germinal, están asociados con la vía de biosíntesis de MUFA, y la suplementación con MUFA, que incluye ácido oleico, ácido palmitoleico y cis-vaccénico, es suficiente para extender la vida útil de C. elegans 26. Aunque el efecto de longevidad conferido por la administración de MUFA requiere más investigación, es probable que el mecanismo subyacente esté mediado por el factor de transcripción SKN-1/Nrf2, que es un activador clave de la respuesta al estrés oxidativo y la regulación de la longevidad28,29. Entre los MUFA, una clase particular de etanolamidas de acilo graso llamadas N-aciletanolaminas (NAE) desempeña un papel crucial en distintos mecanismos, incluyendo inflamación, alergias, aprendizaje, memoria y metabolismo energético30. En particular, la molécula lipídica conocida como oleoiletanolamida (OEA) ha sido identificada como un regulador positivo de la longevidad al promover la translocación de la proteína de unión a lípidos 8 (LBP-8) en el núcleo para activar los receptores de hormonas nucleares NHR-49 y NHR-807. La suplementación del análogo OEA KDS-5104 es suficiente para prolongar la vida útil e induce la expresión de genes implicados en las respuestas al estrés oxidativo y en la β-oxidación mitocondrial 7,8.
Al mismo tiempo, el papel de los PUFA también se ha relacionado con la regulación de la longevidad. La administración de AGPI ω-3 de ácidos grasos α-ácido linolénico (ALA) promueve la longevidad activando los factores de transcripción NHR-49/PPARα, SKN-1/NRF e induciendo la β-oxidación mitocondrial31. Curiosamente, los productos peroxidados de ALA, conocidos como oxilipinas, activan SKN-1/NRF, sugiriendo que tanto los AGPI como sus derivados oxidativos pueden conferir beneficios de longevidad23. La suplementación de ácido graso ω-6 ácido araquidónico (AA) y ácido dihomo-γ-linolénico (DGLA) extiende la vida útil a través de la activación de la autofagia, promoviendo el control de calidad de las proteínas y resultando en la degradación de agregados proteicos desperdiciados y tóxicos27,32. Más recientemente, una regulación de señalización celular no autónoma mediada por la proteína de unión a lípidos 3 (LBP-3) y DGLA ha demostrado ser crucial para promover la longevidad mediante el envío de señales periféricas a las neuronas, lo que sugiere un papel de largo alcance de las moléculas lipídicas en la comunicación intertisular a niveles sistémicos33. El presente estudio informa cada paso para realizar la suplementación lipídica con bacterias sembradas en placas o suspensión bacteriana en cultivo líquido. Estas metodologías se utilizan para evaluar la vida útil y el análisis transcripcional, empleando contenido corporal completo o tejidos disecados derivados de unos pocos gusanos. Las siguientes técnicas se pueden adaptar a una variedad de estudios nutricionales y ofrecen una herramienta válida para diseccionar cómo el metabolismo de los lípidos influye en la longevidad y el envejecimiento saludable.
Protocolo
La Figura 1 muestra un esquema de alimentación de lípidos utilizando diferentes entornos experimentales.
1. Preparación de bacterias condicionadas por lípidos
- Prepare la solución base de restricción dietética de dilución bacteriana (BDR) disolviendo 5.85 g de NaCl, 1.0 g de K 2HPO 4 y 6.0 g de KH2PO4 (ver Tabla de materiales) en 999 ml de agua desionizada. Ajuste el pH a 6.0 con 0.5 M KOH, y luego filtre a través de un filtro de 0.22 μm.
NOTA: La solución BDR se puede almacenar a temperatura ambiente para su almacenamiento a largo plazo. - Prepare el medio BDR agregando 10 μL de colesterol 5 mg/ml (disuelto en etanol a prueba de 200) a cada 10 ml de solución base BDR.
- Rayar la bacteria OP50 (ver Tabla de materiales) de -80 °C a placas de agar LB e incubar a 37 °C durante la noche.
NOTA: Después de la incubación nocturna a 37 °C, la placa OP50 se puede almacenar a 4 °C durante un máximo de 1 semana para obtener resultados de alimentación constantes. - Inocular la bacteria OP50 de la placa OP50 LB-agar al medio LB e incubar en una agitadora a 37 °C durante la noche (16 h).
NOTA: El volumen medio LB necesario depende de la configuración experimental. Se recomienda utilizar 200 μL de 5x bacterias concentradas sembradas en cada una de las placas de 6 cm y 1 mL de 5x bacterias concentradas para cada una de las placas de 10 cm y cada réplica de las condiciones de alimentación líquida. Por lo tanto, se deben preparar 1 ml y 5 ml de inoculación inicial de LB para cada cultivo de alimentación de lípidos, respectivamente. - Recoger las bacterias por centrifugación a 4.000 g durante 10 min a temperatura ambiente. Deseche el sobrenadante.
- Suspender el pellet bacteriano en 20 mL de base BDR, y centrifugar a 4.000 x g durante 10 min. Deseche el sobrenadante.
NOTA: Este paso es crítico para lavar los residuos sobrantes de LB en el pellet bacteriano. - Suspenda cada pellet bacteriano en el medio BDR para hacer un stock de bacterias BDR 20x. Diluya el stock de bacterias 20x BDR con medio BDR a 5x antes de usar.
NOTA: Utilice un volumen de 1/20 de medio BDR del volumen LB original para alcanzar una concentración de 20x para las bacterias. El stock de bacterias 20x se puede almacenar a 4 °C durante un máximo de 1 semana. - Prepare una solución de reserva de lípidos, utilizando etanol o dimetilsulfóxido (DMSO) como disolvente en un nuevo vial de vidrio esterilizado en autoclave, y llene el vial de vidrio con argón o nitrógeno para evitar la oxidación.
NOTA: La concentración de la solución madre suele estar entre 250 mM y 1 mM. - Transfiera la solución de reserva lipídica a la cantidad deseada de solución de bacterias BDR para lograr la concentración final deseada en condiciones de alimentación. Mezclar bien mediante vórtice durante 20 s.
NOTA: La concentración final de los lípidos en la alimentación suele ser de 1 μM a 1 mM, dependiendo de las condiciones lipídicas y de prueba. Se recomienda ejecutar primero un experimento piloto para probar diferentes concentraciones que van desde 0,1 μM a 1 mM si se trabaja con nuevos lípidos. Mezcle la solución madre de lípidos con bacterias BDR inmediatamente antes de sembrarla en la placa o ponerla en cultivos de lombrices líquidas. Prepare las bacterias condicionadas por lípidos no más de 1 h antes de alimentar a los gusanos. - Mezcle los mismos volúmenes de etanol filtrado o DMSO (dependiendo de cuál se use para el grupo de alimentación de lípidos) con bacterias BDR para que sirvan como control del vehículo.
2. Preparación de C. elegans sincronizados para la suplementación lipídica
- Preparar el tampón M9 mezclando (utilizando concentraciones finales especificadas) 22 mM KH 2 PO 4, 22 mM Na 2 HPO 4, 85mM NaCl y2mM MgSO 4 (ver Tabla de materiales). Autoclave el tampón a esterilizar.
- Prepare una solución de lejía fresca con lejía doméstica al 60% (v/v, ver Tabla de materiales) y una concentración final de NaOH de 1,6 M.
- Recolectar adultos grávidos en un tubo cónico de 15 ml usando 10 ml de tampón M9.
NOTA: El número de gusanos y placas necesarios para la sincronización depende de la configuración experimental (es decir, el número de condiciones y réplicas y métodos de alimentación). Idealmente, cada placa completa de 6 cm de gusanos adultos debería ser capaz de producir al menos 600 gusanos L1 después de la sincronización. - Girar los gusanos a 1.450 x g durante 30 s. Retire el sobrenadante y enjuague los gusanos una vez más con 10 ml de tampón M9.
- Girar los gusanos a 1.450 x g durante 30 s. Aspirar el sobrenadante, dejando una alícuota de 4 mL en el tubo cónico. Añadir 2 ml de solución de lejía y agitar vigorosamente durante 1 min.
- Girar los gusanos a 1.450 x g durante 30 s a temperatura ambiente.
- Retire el sobrenadante y agregue 4 ml de tampón M9 y 2 ml de solución de lejía. Agite el tubo hasta que los cuerpos del gusano se disuelvan.
- Girar los huevos a 1.450 x g durante 30 s a temperatura ambiente.
- Retire el sobrenadante y lave los huevos con 10 ml de tampón M9.
- Repita los pasos 2.8 y 2.9 3x.
- Suspender los embriones con 6 mL de tampón M9. Mece los embriones en un rotador a 20 °C durante 2 días para que eclosionen y se sincronicen.
- Transfiera las larvas L1 a las placas con semillas OP50. Incubar a 20 °C durante 48 h para recolectar gusanos L4 sincronizados, 72 h para adultos de día 1 y 96 h para adultos de día 2.
NOTA: Las placas OP50 se preparan agregando 1 ml de 20x bacterias OP50 a cada placa34 del medio de crecimiento de nematodos (NGM) de 10 cm. Se pueden sembrar 30,000 gusanos L1 en cada una de las placas OP50 si se pretende cosechar los gusanos en la etapa L4, y 20,000 gusanos L1 se pueden sembrar en cada una de las placas OP50 si se apunta a cosechar adultos del día 1 en los entornos experimentales actuales. Puede ser diferente para diferentes entornos de laboratorio, por lo que se recomienda probar el número de gusanos que se pueden sembrar para asegurarse de que los gusanos tengan suficiente comida antes de ser cosechados. - Recolecte los gusanos L4, día 1 adulto o día 2 adultos en un tubo cónico de 15 ml usando 10 ml de tampón M9. Use otros 5 ml de tampón M9 para enjuagar los gusanos sobrantes de las placas.
- Girar los gusanos a 1.450 x g durante 30 s y desechar el sobrenadante. Lave el pellet de lombriz con 10 ml de medio BDR, centrifugar a 1,450 x g durante 30 s y deseche el sobrenadante.
- Para los gusanos en el método de alimentación líquida, transfiera el medio BDR a los gusanos para lograr una concentración de gusanos de 3.000 gusanos / ml. Para los gusanos en los métodos de alimentación en placa, reduzca el volumen de medio BDR agregado a los gusanos para reducir el tiempo de secado en la placa.
3. Suplementación con lípidos para C. elegans
- Realice la suplementación de lípidos en cultivo líquido siguiendo los pasos a continuación.
NOTA: Este método es adecuado para probar cambios transcripcionales utilizando gusanos a granel suplementados con lípidos.- Transfiera la cantidad deseada de control de lípidos o vehículos a cada uno de los pocillos en una placa de 12 pocillos. Prepare de tres a cuatro pozos para cada condición de alimentación como una replicación biológica.
- Mezcle la suspensión de gusanos del paso 2.15 con 5x bacterias BDR en una proporción de 1:1 para lograr una concentración final de 1.500 gusanos / ml y 2,5x para bacterias.
- Transfiera 2 ml de la mezcla de gusanos y bacterias en medio BDR a cada pocillo de la placa de 12 pocillos.
- Envuelva la placa de 12 pocillos con papel de aluminio y agite en una incubadora a 20 °C a 100 rpm durante la duración de incubación deseada.
NOTA: Para probar diferentes condiciones de alimentación, incube los lípidos con gusanos durante diferentes períodos de tiempo, como durante 6 h, 12 h y 24 h. Además, se pueden probar diferentes etapas de gusanos para obtener resultados óptimos, incluida la alimentación de lípidos desde la etapa L4 o el día 1 adulto.
- Realice la suplementación lipídica en las placas de agar NGM de 10 cm siguiendo los pasos a continuación.
NOTA: Este método es adecuado para probar cambios transcripcionales utilizando gusanos a granel suplementados con lípidos.- Siembre 1 ml de las bacterias condicionadas por lípidos desde el paso 1.9 hasta el centro de cada una de las placas de 10 cm. Cuando se haya preparado un gran número de placas, voltee la solución de trabajo final varias veces entre la siembra. Seque las placas en la oscuridad con una campana de bioseguridad.
- Transfiera 3.000 gusanos del paso 2.15 a cada una de las placas de 10 cm. Seque las placas en una campana de bioseguridad hasta que los gusanos puedan arrastrarse sobre las placas suplementadas con lípidos en lugar de nadar.
- Incubar los gusanos en las placas acondicionadas con lípidos en una incubadora a 20 °C durante el tiempo deseado. Protéjase de la luz si usa lípidos poliinsaturados.
NOTA: Para probar diferentes condiciones de alimentación, incube los lípidos con gusanos durante varios períodos de tiempo, como 6 h, 12 h y 24 h. Además, se pueden probar diferentes etapas de gusanos para obtener resultados óptimos, incluida la alimentación con lípidos en la etapa L4 o en la etapa adulta del día 1.
- Realizar la suplementación lipídica en las placas de agar NGM de 6 cm para el análisis transcripcional.
NOTA: Este método es adecuado para probar cambios transcripcionales en algunos gusanos suplementados con lípidos.- Sembrar 300 μL de bacterias condicionadas por lípidos desde el paso 1.9 hasta el centro de cada placa de 6 cm. Cuando se haya preparado un gran número de placas, voltee la solución de trabajo final varias veces entre la siembra. Seque las placas en la oscuridad con una campana de bioseguridad.
- Transfiera hasta 300 gusanos del paso 2.15 a cada una de las placas de 6 cm. Seque las placas en una campana de bioseguridad hasta que los gusanos puedan arrastrarse sobre las placas suplementadas con lípidos en lugar de nadar.
- Incubar los gusanos en las placas acondicionadas con lípidos en una incubadora a 20 °C durante el tiempo deseado. Protéjase de la luz si usa lípidos poliinsaturados.
NOTA: Para probar diferentes condiciones de alimentación, incube los lípidos con gusanos en diferentes puntos de tiempo, como 6 h, 12 h y 24 h. Además, se pueden probar diferentes etapas de gusanos para obtener resultados óptimos, incluida la alimentación con lípidos en la etapa L4 o en la etapa adulta del día 1.
- Realice la suplementación de lípidos en las placas de agar NGM de 6 cm para el ensayo longitudinal de vida útil.
- Semilla 200 μL de bacterias condicionadas por lípidos (con 1x concentración de lípidos y 5x bacterias concentradas) en el centro de cada una de las placas NGM de 6 cm. Prepare tres platos para cada condición de alimentación.
NOTA: Los platos deben prepararse recién el día de su uso (idealmente justo antes de su uso). - Seque las placas en una campana de bioseguridad. Mantenga las luces en el capó y la habitación apagadas si usa lípidos poliinsaturados.
- Elija 30-40 gusanos L4 sincronizados en cada una de las placas. Conservar las placas con los gusanos en una incubadora a 20 °C. Si se alimenta con lípidos poliinsaturados, mantenga las placas en una caja protegida contra la luz en la incubadora a 20 °C.
NOTA: Es posible utilizar OP50 de una placa de paso normal de 6 cm (OP50 no condicionada) como pegamento para recoger gusanos, pero es crucial no dejar una cantidad masiva de OP50 sin condicionar en la placa de ensayo. - Transfiera los gusanos a placas nuevas, recién hechas y acondicionadas con lípidos diariamente o cada dos días, dependiendo de la condición de alimentación deseada. La supervivencia se puntúa de la misma manera que la descrita anteriormente4.
- Semilla 200 μL de bacterias condicionadas por lípidos (con 1x concentración de lípidos y 5x bacterias concentradas) en el centro de cada una de las placas NGM de 6 cm. Prepare tres platos para cada condición de alimentación.
4. Extracción de ARN para análisis transcripcional
- Realizar la extracción de ARN de un número masivo de gusanos enteros.
- Transfiera los gusanos en el cultivo líquido del paso 3.1 a 1,5 ml de tubos de microcentrífuga. Lave los gusanos de las placas de 10 cm del paso 3.2 utilizando un tampón M9 y transfiera los gusanos en el tampón M9 a tubos de microcentrífuga de 1,5 ml.
- Centrifugar brevemente los gusanos con una mini centrífuga de mesa (ver Tabla de materiales) durante 10 s y aspirar rápidamente el sobrenadante.
- Transfiera los gusanos sobrantes de los pozos de alimentación de líquido o lave desde las alimentaciones de placas al mismo tubo y gire hacia abajo. Retire el sobrenadante.
- Lave los gránulos de gusano con 1 ml de M9 helado, gire brevemente durante 10 s con una mini centrífuga y aspire el sobrenadante. Repita 1x o 2x dependiendo de la transparencia del sobrenadante.
- Coloque los tubos de microcentrífuga en hielo durante 2 min y retire la mayor cantidad posible de sobrenadante con una pipeta de 200 μL, dejando una bolita de gusano empaquetada de no más de 15 μL de volumen.
- Transfiera 15 μL de solución de extracción de ARN que contenga fenol e isotiocianato de guanidina (Tabla de materiales) a cada uno de los tubos de microcentrífuga y muele los gusanos con un molinillo motorizado durante aproximadamente 30 s hasta que no se vean gusanos intactos.
PRECAUCIÓN: La solución de extracción de ARN es tóxica e inflamable, y cualquier paso que involucre un recipiente abierto con este reactivo debe operarse en una campana química. - Transfiera 285 μL de la solución de extracción de ARN al tubo de microcentrífuga mientras enjuaga cualquier contenido de gusano de la punta del molinillo del motor al tubo de microcentrífuga. Vórtice para mezclar bien.
NOTA: Este es un punto de pausa. Las muestras pueden almacenarse en la solución de extracción de ARN a -80 °C durante un par de meses. Cuando se saque de los -80 °C, deje que las muestras se descongelen a temperatura ambiente. - Transfiera 60 μL de cloroformo a cada muestra y vórtice vigorosamente. Deje que las muestras se asienten a temperatura ambiente durante 10 min.
PRECAUCIÓN: El cloroformo es tóxico y debe manipularse en una campana química. - Centrifugadora a 21.000 x g durante 20 min a 4 °C. Transfiera cuidadosamente 140 μL de la capa acuosa en la parte superior a un tubo de microcentrífuga nuevo y libre de RNasa utilizando una pipeta de 200 μL, transfiriendo 2x con 70 μL cada vez.
NOTA: A partir de este paso adelante, todas las puntas y recipientes de pipeta que tienen contacto directo con la muestra deben estar libres de RNasa. También se sugiere utilizar la solución de descontaminación RNasa para limpiar todo el equipo y el espacio de trabajo. - Transfiera 140 μL de isopropanol al tubo de muestra. Vortex vigorosamente y deje que la muestra se asiente a temperatura ambiente durante 10 min. Centrifugar a 21.000 x g durante 20 min a 4 °C y retirar con cuidado todo el sobrenadante.
- Transfiera 0,5 ml de etanol (v/v) helado al tubo de muestra con el pellet de ARN. Vórtice vigorosamente hasta que el pellet de ARN salga del fondo del tubo y flote en la solución de etanol. Centrifugar a 21.000 x g durante 10 min a 4 °C y retirar el sobrenadante.
- Centrifugar brevemente los tubos de muestra en la mini centrífuga durante 15 s para hacer girar cualquier disolvente adherido a la pared del tubo, y luego retirar la mayor cantidad de solución de etanol posible con una pipeta.
- Deje la tapa del tubo abierta para secar el pellet de ARN. Si el pellet se lavó a fondo con la solución de etanol, el paso de secado debe tomar menos de 10 minutos.
NOTA: Este es un punto de pausa. El pellet de ARN seco se puede almacenar a -80 °C durante un máximo de 1 mes. - Disuelva el pellet de ARN seco con 40 μL de agua libre de nucleasa y procese con un kit de eliminación de ADN de acuerdo con las instrucciones del fabricante (consulte la Tabla de materiales).
NOTA: Se recomienda disolver primero el ARN en agua libre de nucleasas. Si se mezclan 40 μL de agua con el tampón DNasa 10x antes de transferirlo al tubo de ARN, el pellet de ARN no se disolverá completamente. Las muestras de ARN deben mantenerse en hielo al disolver el pellet de ARN en agua. Los ciclos de congelación-descongelación disminuyen la calidad del ARN; por lo tanto, proceda al paso de transcripción inversa el mismo día del tratamiento con DNasa.
- Extracción de ARN de un pequeño número de gusanos enteros.
- Elija 15-20 gusanos de su césped bacteriano en una placa NGM fresca sin semillas para eliminar las bacterias del gusano.
- Según el fabricante del kit de 2 pasos qRT-PCR (consulte la Tabla de materiales), prepare 20 μL de solución final de lisis para cada muestra mezclando 0,2 μL de DNasa con 19,8 μL de solución de lisis en tubos de PCR. Mezclar la solución de lisis pipeteando hacia arriba y hacia abajo 5x.
- Transfiera 15-20 gusanos de la placa NGM sin sembrar al tubo de PCR que contiene 20 μL de la solución final de lisis con el número mínimo de bacterias. Incubar la reacción de lisis durante 5 min a temperatura ambiente.
- Sondear-sonicar (ver Tabla de materiales) los gusanos con una amplitud del 30% utilizando el siguiente programa: sonicación durante 5 s, pausa durante 5 s y repetición 4x con un tiempo total de sonicación de 20 s. Mantenga las muestras en un baño de agua helada durante la sonicación.
- Incubar a temperatura ambiente durante 5 min.
NOTA: Agregue más DNasa antes de la incubación si el control negativo sin RT muestra contaminación del ADN a un nivel preocupante. - Transfiera 2 μL de solución de parada a la reacción de lisis y mezcle golpeando suavemente. Incubar durante 2 minutos a temperatura ambiente y luego colocar en hielo.
NOTA: Las muestras se pueden dejar en hielo hasta 2 h antes de proceder al paso de transcripción inversa.
- Realice la extracción de ARN de los tejidos de gusanos siguiendo los pasos a continuación.
- Recoja alrededor de 20 gusanos de su césped bacteriano y colóquelos en una placa NGM fresca sin semillas para eliminar las bacterias de ellos.
- Mueva los 20 gusanos (con la menor cantidad posible de bacterias) a un vidrio de reloj que contenga 500 μL de solución M9 que contenga 4 μM de levamisol (consulte la Tabla de materiales). La inmovilización ocurrirá en cuestión de segundos.
- Cuando los gusanos estén inmovilizados, diseccionar la línea germinal o el intestino con una aguja de 25 G que se puede conectar a la jeringa de 1 ml.
- Bajo el alcance de la disección, realice un corte en la posición del segundo bulbo faríngeo para permitir la extrusión natural del intestino y la línea germinal. Los dos tejidos se pueden distinguir fácilmente en función de su morfología y diferente contraste. Use pinzas o agujas para separar suavemente los tejidos, evitando dañarlos.
NOTA: Se recomienda diseccionar dentro de 5-10 min. Si el corte no produce una buena extrusión de tejido, se sugiere pasar al siguiente gusano y diseccionar tantos como sea posible dentro de los 10 minutos. Este procedimiento requiere un corto período de tiempo para evitar cambios transcripcionales del entorno.
- Bajo el alcance de la disección, realice un corte en la posición del segundo bulbo faríngeo para permitir la extrusión natural del intestino y la línea germinal. Los dos tejidos se pueden distinguir fácilmente en función de su morfología y diferente contraste. Use pinzas o agujas para separar suavemente los tejidos, evitando dañarlos.
- De acuerdo con el fabricante del kit de 2 pasos qRT-PCR, prepare 20 μL de solución de lisis final para cada muestra mezclando 0,2 μL de DNasa I a 19,8 μL de solución de lisis en los tubos de PCR. Mezclar la solución de lisis pipeteando hacia arriba y hacia abajo 5x.
- Utilice una pipeta de vidrio esterilizada en autoclave para transferir los tejidos disecados a un tubo de PCR. Coloque los tubos de PCR en hielo durante 2 minutos para permitir la deposición de material en la parte inferior. Retire el sobrenadante, agregue 20 μL de solución de lisis final en el tubo de PCR y mezcle golpeando.
- Incubar la reacción de lisis durante 5 min a temperatura ambiente. Luego, transfiera 2 μL de solución de parada a la reacción de lisis y mezcle golpeando. Incubar durante 2 min a temperatura ambiente.
NOTA: Las muestras se pueden dejar en hielo hasta 2 h antes de proceder al paso de transcripción inversa.
5. Transcripción inversa y qRT-PCR
- Realizar transcripción inversa y qRT-PCR de gusanos a granel.
- Mida la concentración de ARN y prepare 5 μg de ARN total para la transcripción inversa.
- Preparar una muestra de ARN agrupada mezclando cantidades iguales de ARN de cada muestra y ajustando la concentración final de ARN a 0,556 g/L (5 μg/9 μL). Utilice la muestra de ARN agrupada para la curva estándar qRT-PCR y los controles RT negativos.
- Realice la transcripción inversa de acuerdo con las instrucciones del fabricante (consulte la Tabla de materiales). Ejecute las siguientes reacciones de transcripción inversa de control de calidad junto con las muestras individuales de ARN.
- Realice la transcripción inversa con la muestra de ARN agrupada como plantilla (para la curva estándar qRT-PCR).
- Realizar la transcripción inversa con la muestra de ARN agrupada como plantilla, sin la transcriptasa inversa (control RT-negativo; control de calidad para la posible contaminación del ADN del genoma).
- Realizar la transcripción inversa con el agua libre de nucleasa como plantilla (control RT-negativo; control de calidad para la posible contaminación de ARN en reactivos).
NOTA: Este es un punto de pausa. Las muestras pueden dejarse en el termociclador durante la noche o almacenarse a -20 °C durante unos meses.
- Diluir el ADNc generado a partir de las muestras de ARN agrupadas cuatro veces, 20 veces, 100 veces y 500 veces con agua libre de nucleasas para curvas estándar qRT-PCR.
- Diluir el ADNc generado a partir de cada muestra de ARN 20-100 veces para usarlo como plantilla para las reacciones qRT-PCR.
NOTA: La relación de dilución depende de la abundancia del gen de interés. Para genes de alta expresión, como los genes de mantenimiento o egl-3 y egl-21 utilizados en este estudio, se recomienda una dilución de 100x. Para genes de baja expresión, como lbp-8, se recomienda una dilución de 20x. - Realice qRT-PCR con reactivos qRT-PCR de acuerdo con las instrucciones del fabricante de la siguiente manera: 95 °C durante 10 min, repita 40 veces con 95 °C durante 15 s y 60 °C durante 1 min, seguido del programa de curva de fusión predeterminado, y mantenga a 8 °C durante un tiempo indefinido.
- Realizar transcripción inversa y qRT-PCR de unos pocos gusanos o tejidos de gusanos.
- Transfiera 25 μL de tampón RT y 2,5 μL de mezcla enzimática RT 20x del kit de 2 pasos de qPCR (consulte la Tabla de materiales) a cada tubo que contenga lisado de lombriz del paso 4.2.6 o del paso 4.3.6.
NOTA: Un control RT-negativo es crítico para qRT-PCR de unos pocos gusanos. Cada experimento debe incluir una muestra de lisado de lombriz (del paso 4.2.6) con tampón RT pero sin enzima RT para examinar la contaminación del ADN en las muestras. Si la contaminación del ADN es un problema, considere agregar más DNasa al tampón de lisis o más DNasa a la muestra después de que los gusanos se lisen. Alternativamente, se puede realizar un control RT-negativo para cada muestra utilizando la mitad del lisado en una reacción RT normal y la otra mitad en una reacción RT sin transcriptasa inversa. - Mezclar golpeando suavemente. Girar hacia abajo con una mini centrífuga durante 10 s.
- Cargue las muestras en la máquina termocicladora siguiendo las instrucciones del fabricante: 37 °C durante 60 min, 95 °C durante 5 min y 8 °C durante un tiempo indefinido.
NOTA: Este es un punto de pausa. Las muestras pueden dejarse en el termociclador durante la noche o almacenarse a -20 °C durante unos meses. - Mantenga todos los reactivos y muestras en hielo y proteja los reactivos qRT-PCR de la luz.
- Prepare una placa de qPCR de 96 pocillos y en cada pocillo mezcle 6 μL de agua libre de nucleasa, 10 μL de reactivo qRT-PCR, 2 μL de mezcla de cebador de 5 μM (hacia adelante y hacia atrás) y 2 μL de ADNc. Cubra la superficie de la placa qPCR de 96 pocillos con una película óptica protectora y presione hacia abajo para sellar.
- Ejecute el programa qRT-PCR en un termociclador siguiendo las instrucciones del fabricante de la siguiente manera: 50 °C durante 2 min, 95 °C durante 2 min, repetir 40 veces con 95 °C durante 3 s y 60 °C durante 30 s, seguido de 8 °C durante un tiempo indefinido.
- Transfiera 25 μL de tampón RT y 2,5 μL de mezcla enzimática RT 20x del kit de 2 pasos de qPCR (consulte la Tabla de materiales) a cada tubo que contenga lisado de lombriz del paso 4.2.6 o del paso 4.3.6.
Resultados
Validación de cambios transcripcionales usando unos pocos gusanos enteros sobre la suplementación de lípidos
Para investigar si el protocolo para extraer y retrotranscribir ARN en ADNc de unos pocos gusanos enteros es reproducible y comparable con los datos de gusanos a granel, se empleó una cepa de gusano de larga vida que sobreexpresa la lipasa ácida lisosomal lipl-4 en el intestino 7,8,33,35. Se validó la inducción transcripcional de los genes de procesamiento de neuropéptidos egl-3 y egl-21 reportados en estudios previos 7,8,33 (Figura 2A,B). Esta inducción indica que el método de extracción de ARN de unos pocos animales es una alternativa válida a las técnicas estándar de síntesis de ADNc a partir de cultivos de gusanos a granel.
Validación de evaluaciones transcripcionales utilizando tejidos de gusanos disecados tras la suplementación lipídica
En C. elegans, la síntesis de AGPI de 20 carbonos depende de la actividad de la desaturasa FAT-316,17. Estudios anteriores han informado que los mutantes de grasa-3 carecen de AGPI de 20 carbonos, incluido DGLA16. Anteriormente, se descubrió que la pérdida de Δ6-desaturasa FAT-3 en gusanos lipl-4g suprime la inducción transcripcional de los genes de procesamiento de neuropéptidos egl-3 y egl-2133. Además, la suplementación con DGLA rescata dicha inducción33. El gen que codifica egl-21 se expresa en las neuronas, mientras que egl-3 se detecta tanto en las neuronas como en los intestinos36,37. Para probar aún más si la suplementación con DGLA restaura la inducción de egl-3 y egl-21 en el intestino o en las neuronas, se diseccionó el intestino y se evaluaron sus niveles transcripcionales mediante el análisis qRT-PCR descrito en los pasos 4.3 y 5.2 de este protocolo. DGLA se complementó en el alimento de origen durante 12 h en el día 1 de la edad adulta. No se encontró inducción transcripcional de egl-3 o egl-21 en el intestino (Figura 2C), lo que es consistente con hallazgos previos36,38.
Validación del ensayo de vida útil tras la suplementación con lípidos
La relación entre los AGPI de 20 carbonos y el mecanismo de longevidad que inactiva la grasa-3 fue explorada previamente, específicamente en el intestino de los gusanos lipl-4g 33. Se encontró que el knockdown de grasa-3 suprime completamente la extensión de la vida útil conferida por lipl-433. Para evaluar si DGLA restaura la longevidad efectuada mediada por lipl-4, DGLA se complementó recientemente cada dos días en el alimento de origen en el día 1 de la edad adulta. Se encontró que tras la eliminación de grasa-3, la suplementación con DGLA rescata la extensión de la vida útil (Figura 2D)33, lo que indica un procedimiento exitoso de suplementación con lípidos junto con el ensayo de vida útil.
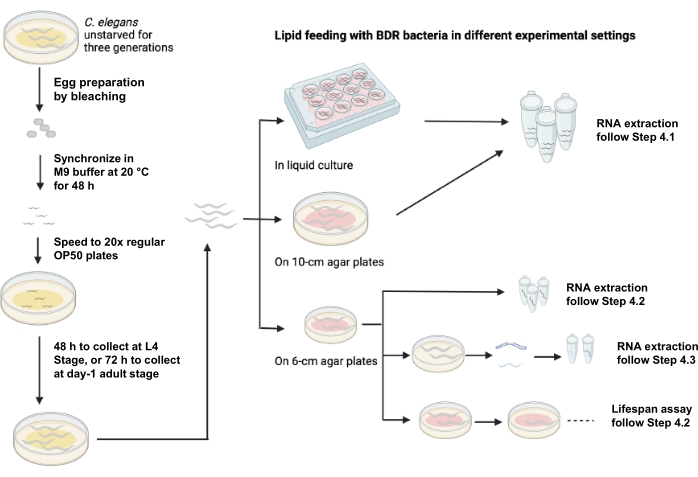
Figura 1: Esquema de alimentación lipídica utilizando diferentes entornos experimentales. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Validación de la evaluación transcripcional de los genes de procesamiento de neuropéptidos utilizando una gran población de gusanos, algunos gusanos y tejidos disecados. (A) El ARN extraído de una gran población de gusanos muestra la inducción de los niveles de transcripción egl-3 y egl-21 de los genes de procesamiento de neuropéptidos en animales Tg lipl-4. Las barras de error representan ±1 SEM. **** p < 0.0001 por la prueba t de Student de dos colas. (B) La extracción de ARN de unos pocos gusanos confirma la inducción de los niveles de transcripción egl-3 y egl-21 de los genes de procesamiento de neuropéptidos en gusanos Tg lipl-4. Las barras de error representan ±1 SEM. **** p < 0.0001 por la prueba t de Student de dos colas. (C) Los genes de procesamiento de neuropéptidos neuronales egl-3 y egl-21 no se inducen en intestinos disecados. Las barras de error representan ±1 SEM. Análisis estadístico con prueba t de Student de dos colas. (D) La suplementación con DGLA a diferentes concentraciones, incluyendo 10 μm, 100 μm y 1 mM rescata el efecto de longevidad de lipl-4Tg sobre el ARNi de grasa-3. p < 0,001 por la prueba de rango logarítmico. Esta figura está adaptada de Savini et al.33. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La suplementación con lípidos se ha empleado en la investigación del envejecimiento para dilucidar el impacto directo de ciertas especies lipídicas en el envejecimiento saludable 6,7,23,26,27,31. Sin embargo, el procedimiento de suplementación con lípidos puede ser un desafío, y cualquier inconsistencia entre los experimentos puede causar resultados no reproducibles. Aquí, se documenta el primer protocolo detallado paso a paso para guiar a los nuevos científicos a evitar las posibles trampas causadas por la imprecisión técnica. Los pasos críticos en este protocolo se discutirán en detalle en los párrafos siguientes. La caja de herramientas de investigación de lípidos también se amplía al introducir el aislamiento de ARN de solo unos pocos gusanos y tejidos específicos de gusanos después de la suplementación con lípidos. Al considerar la metodología para examinar los niveles de transcripción, la qRT-PCR con unos pocos gusanos o tejidos disecados es sobresaliente para analizar algunas transcripciones o examinar ciertos cambios transcripcionales específicos del tejido. Además, el uso de estas metodologías podría superar el paso de amplificación de gusanos que puede tomar aproximadamente 5-6 días adicionales. Al mismo tiempo, la alimentación con lípidos seguida de la extracción masiva de ARN es más rentable y una alternativa válida cuando es necesario analizar un conjunto más grande de genes diana.
Varios pasos pueden ser críticos para la reproducibilidad de los efectos de la alimentación de lípidos. El primer aspecto está relacionado con las condiciones bacterianas. Se sugiere usar placas bacterianas frescas que no tengan más de 7 días para la inoculación. Se recomienda utilizar bacterias preparadas en medio BDR dentro de 1 semana. Las bacterias que se han mezclado con lípidos deben usarse de inmediato. Los lípidos con bacterias no deben almacenarse ni siquiera a 4 °C, ya que las bacterias metabolizarán los lípidos. Los pasos de lavado en la base BDR y la resuspensión en el medio BDR son críticos para las condiciones bacterianas, ya que las bacterias se cultivaron en LB, y se alimentan directamente a los gusanos siempre elimina los efectos profundos de los suplementos lipídicos. El segundo factor está asociado con las condiciones del gusano. C. elegans no debe morir de hambre durante al menos tres generaciones antes de la etapa de blanqueamiento para la preparación del huevo para garantizar que estén en un estado metabólico saludable y estable. También es crucial cultivar C. elegans en placas de agar antes de la suplementación con lípidos; Esto incluye antes y después del paso de sincronización.
Los gusanos que se adaptaron a cultivos líquidos durante tiempos prolongados están parcialmente hambrientos; La inanición eleva la línea de base para los genes pro-longevidad, lo que conduce a un efecto debilitado de la suplementación con lípidos. Si la deriva metabólica y los cambios utilizando larvas L1 detenidas son preocupaciones, una alternativa válida sería colocar directamente los huevos en placas. Cuando solo se necesitan unos pocos gusanos para realizar análisis de vida útil o expresión génica, es posible colocar huevos directamente en placas acondicionadas con lípidos y volver a sincronizarlos seleccionándolos a mano en la etapa L4 para experimentos posteriores. Sin embargo, si se necesitan grandes cantidades de gusanos cuando la recolección manual de L4 no es aplicable, emplatar los huevos directamente no es ideal. Los huevos que eclosionan después del blanqueamiento de adultos grávidos pueden ocurrir en diferentes puntos de tiempo y hacer que la población no esté sincronizada, lo que interferiría con el análisis transcripcional. La tercera parte crítica está relacionada con las condiciones de almacenamiento de lípidos; cuando se complementan los PUFA, se necesita atención adicional ya que estas moléculas son sensibles a la luz y propensas a la oxidación en el aire.
Múltiples condiciones de alimentación de lípidos, incluidas las etapas del gusano, la longitud de la suplementación y las concentraciones, requieren más investigación al probar nuevas moléculas de lípidos. Los gusanos adultos L4, día 1 y día 2 adultos suelen ser el punto de partida para las pruebas en diferentes etapas del gusano. En particular, al alimentar a los gusanos L4, si el tiempo de incubación termina alrededor de la fase de muda del nematodo, se espera una gran variación, lo que influye en gran medida en la importancia y reproducibilidad de los resultados. Un desafío adicional para usar gusanos adultos de día 1 o día 2 está relacionado con las progenies que pueden complicar el análisis de la expresión génica. En este caso, la extracción de ARN de unos pocos gusanos enteros es más confiable que las poblaciones a granel. Diferentes moléculas lipídicas tienen diferentes rangos de concentración para producir efectos fisiológicos; por lo tanto, se sugiere probar una serie de concentraciones de 1 μM a 1 mM.
Hay algunas limitaciones a considerar al elegir el método de alimentación. Primero, cuando los lípidos no pueden ser absorbidos o ingeridos por los gusanos, es difícil usar un método de suplementación para probar su efecto biológico en C. elegans. Con las tecnologías actuales, la espectrometría de masas o SRS junto con 13compuestos lipídicos marcados con C o 2H39 son herramientas válidas para probar la absorción de lípidos en el cuerpo del gusano. En segundo lugar, estos métodos de alimentación no están optimizados para técnicas de investigación de alto rendimiento. Para la suplementación de lípidos con gusanos a granel, la preparación de la muestra del método de alimentación líquida es más rápida que la alimentación en placa, ya que los cultivos líquidos se pueden transferir directamente a los tubos de microcentrífuga en lugar de lavarse de las placas de alimentación. Para asegurarse de que el ARN extraído está en el estado de cosecha, se sugiere no dejar pasar más de 15-20 minutos entre el punto de colocación de los gusanos en hielo para molerlos en la solución de extracción de ARN. Se recomienda procesar menos condiciones cada 15 minutos cuando se necesita procesar un gran número de muestras. Para la extracción de ARN de gusano completo de unos pocos animales, el paso de selección manual es el paso limitante de la velocidad, mientras que para la disección de tejidos, es crucial actuar de manera eficiente en el tiempo para evitar la exposición a largo plazo a un entorno no fisiológico. Similar a la extracción masiva de ARN, es preferible recoger gusanos o diseccionar muestras de tejido dentro de los 10 minutos.
A pesar de las limitaciones, estos métodos de suplementación se pueden utilizar más allá de la investigación de lípidos para ayudar a la identificación de cualquier efecto nutricional y medicinal. Los procedimientos informados aquí no solo se limitan a la investigación del envejecimiento, sino también a fenotipos alternativos para evaluar la aptitud de los orgánulos y la homeostasis metabólica celular. El método de suplementación con población a granel se puede acoplar con RNA-seq para el análisis del transcriptoma, espectrometría de masas para el análisis metabolómico y proteómico, o Western blot para el análisis de marcadores proteicos específicos, mientras que la suplementación lipídica con unos pocos gusanos se puede combinar con imágenes y análisis de comportamiento.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Agradecemos a P. Svay por el apoyo de mantenimiento. Este trabajo fue apoyado por las subvenciones de los NIH R01AG045183 (MCW), R01AT009050 (MCW), R01AG062257 (MCW), DP1DK113644 (MCW), March of Dimes Foundation (MCW), Welch Foundation (MCW), HHMI investigator (M.C.W.) y NIH T32 ES027801 predoctoral student fellow (M.S.). Algunas cepas fueron proporcionadas por el CGC, que está financiado por la Oficina de Programas de Infraestructura de Investigación de los NIH (P40 OD010440).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
Referencias
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados