Method Article
秀丽隐杆线虫长寿的脂质补充和基因转录分析
* 这些作者具有相同的贡献
摘要
本协议描述了 秀丽隐杆线虫液体和平板培养物中的脂质补充方法,以及来自大量或少数蠕虫和蠕虫组织的纵向研究和基因转录分析。
摘要
衰老是一个复杂的过程,其特征是由环境和遗传贡献引起的渐进式生理变化。脂质在构成细胞膜的结构成分、储存能量和作为信号分子方面至关重要。脂质代谢和信号传导的调节对于激活不同的长寿途径至关重要。 秀丽隐杆线虫 是一种优秀而强大的生物体,可以剖析脂质代谢和信号传导对长寿调节的贡献。多项研究描述了特定脂质分子的饮食补充如何延长 秀丽隐杆线虫 的寿命;然而,补充条件的微小差异可能会导致不同实验室的科学家之间的可重复性问题。在这里,报道了秀 丽隐杆线虫 的两种详细补充方法,采用脂质补充,将细菌接种在平板上或在液体培养物中细菌悬浮液。本文还提供了使用全蠕虫裂解物或来自少数蠕虫的解剖组织进行终身脂质补充和qRT-PCR分析的寿命测定的详细信息。结合纵向研究和脂质补充转录研究,喂养测定提供了可靠的方法来剖析脂质如何影响长寿和健康老龄化。该方法还可以适用于各种营养筛查方法,以使用少量解剖组织或少数动物来评估转录本子集的变化。
引言
血脂
脂质是可溶于有机溶剂但不溶于水的小疏水性或两亲性分子1,2。不同的脂质分子根据其链中所含的碳数量、位置、双键数量和结合结构(包括甘油或磷酸盐)相互区分。脂质在不同细胞内和跨不同细胞发挥关键作用,以调节生物体功能,包括构成膜双层、提供能量储存和充当信号分子3,4。
首先,脂质是生物膜的结构成分,包括将内部隔室与细胞外环境分开的质膜和细胞内亚细胞膜。其次,脂质是脊椎动物和无脊椎动物能量储存的主要形式。中性脂质,包括三酰基甘油,在各种组织中长时间储存,包括脂肪组织。在线虫秀丽隐杆线虫中,肠道是主要的代谢脂肪储存器官;它的功能不仅参与营养物质的消化和吸收,还参与解毒过程,类似于哺乳动物肝细胞的活性。其他脂肪储存组织包括种系,其中脂质对卵母细胞发育至关重要,以及由皮肤样表皮细胞组成的皮下组织3,5。第三,近年来,越来越多的证据表明,脂质是参与细胞内和细胞外信号传导的强大信号分子,通过直接作用于多种受体,包括G蛋白偶联和核受体,或通过膜流动性调节或翻译后修饰间接作用6,7,8,9.进一步的研究将继续阐明脂质信号传导在促进长寿和健康方面的潜在分子机制。
模式生物对于解决在人类中研究的复杂特定生物学问题非常重要。例如,秀丽隐杆线虫是进行遗传分析以剖析与人类营养和疾病相关的生物过程的绝佳模型10。与人体生理学、复杂组织、行为模式和丰富的遗传操作工具相关的高度保守的分子途径使秀丽隐杆线虫成为非凡的模式生物11.例如,秀丽隐杆线虫在转发遗传筛选以识别表型特异性基因方面非常出色,以及通过RNA干扰12进行全基因组反向遗传筛选。
在实验室中,线虫生长在琼脂培养皿上,琼脂培养皿上接种了大肠杆菌草坪,提供蛋白质、碳水化合物、饱和和不饱和脂肪酸等常量营养素作为能量和构建块的来源,以及辅因子和维生素等微量营养素13。与哺乳动物类似,线虫从棕榈酸和硬脂酸(分别为饱和的16碳和18碳分子)合成脂肪酸分子,这些分子依次去饱和并拉长为多种单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)14,15,16,17,18。有趣的是,秀丽隐杆线虫能够从头合成所有必需的脂肪酸和参与脂肪酸生物合成、去饱和和伸长的核心酶,促进长链多不饱和脂肪酸的合成19。与其他动物物种不同,秀丽隐杆线虫可以用自己的ω-3去饱和酶将18碳和20碳ω-6脂肪酸转化为ω-3脂肪酸。此外,蠕虫具有Δ12去饱和酶,可催化油酸(OA,18:1)形成亚油酸(LA)20,21。大多数动物或植物同时缺乏Δ12和ω-3去饱和酶,因此依靠膳食摄入ω-6和ω-3来获得多不饱和脂肪酸,而秀丽隐杆线虫不需要膳食脂肪酸22。缺乏功能性去饱和酶的分离突变体已被用于研究特定脂肪酸在不同生物过程中的功能,包括繁殖、生长、寿命和神经传递。单个脂肪酸对特定生物学途径的影响可以使用遗传方法和饮食补充剂来解决16,17,23。迄今为止,脂质研究的重点是表征参与神经和发育条件下脂质合成、降解、储存和分解的基因24.然而,脂质在长寿调节中的作用才刚刚开始显现。
长寿调节中的脂质信号传导
脂质通过激活不同组织和细胞类型中的细胞信号级联,在长寿调节中起着至关重要的作用。最近的研究强调了脂质在通过脂质结合蛋白或识别膜受体 调节 转录和细胞间通讯中的积极作用25。此外,膳食脂质补充剂为剖析脂质代谢如何影响 秀丽隐杆线虫的寿命提供了极好的工具。不同的MUFAs和PUFAs已被证明通过激活转录因子来促进长寿26,27。
长寿模型,包括胰岛素/IGF-1信号传导和种系前体细胞的消融,与MUFA生物合成途径有关,MUFA补充剂,包括油酸,棕榈油酸和顺式牛痘,足以延长秀丽隐杆线虫的寿命26。尽管MUFA管理赋予的长寿效应需要进一步研究,但其潜在机制很可能由SKN-1 / Nrf2转录因子介导,SKN-1 / Nrf2转录因子是氧化应激反应和长寿调节的关键激活剂28,29。在MUFAs中,一类称为N-酰基乙醇胺(NAEs)的特定类别的脂肪酰基乙醇酰胺在不同的机制中起着至关重要的作用,包括炎症,过敏,学习,记忆和能量代谢30。特别是,称为油酰乙醇酰胺(OEA)的脂质分子已被确定为长寿的正调节因子,通过促进脂质结合蛋白8(LBP-8)易位到细胞核中以激活核激素受体NHR-49和NHR-807。补充OEA类似物KDS-5104足以延长寿命,并诱导参与氧化应激反应和线粒体β氧化的基因表达7,8。
同时,PUFA的作用也与长寿调节有关。给予PUFA ω-3脂肪酸α-亚麻酸(ALA)通过激活NHR-49 / PPARα,SKN-1 / NRF转录因子和诱导线粒体β氧化来促进长寿31。有趣的是,ALA的过氧化物产物,称为脂氧化物,激活SKN-1 / NRF,表明PUFAs及其氧化衍生物都可以带来长寿益处23。补充ω-6脂肪酸花生四烯酸(AA)和二同γ-亚麻酸(DGLA)通过自噬活化 延长 寿命,促进蛋白质质量控制,并导致浪费和有毒蛋白质聚集体的降解27,32。最近,由脂质结合蛋白3(LBP-3)和DGLA介导的细胞非自主信号传导调节已被证明通过向神经元发送外周信号来促进长寿至关重要,这表明脂质分子在系统水平的组织间通讯中具有长期作用33。本研究报告了用接种在平板上的细菌或液体培养中的细菌悬浮液进行脂质补充的每个步骤。这些方法用于评估寿命和转录分析,使用全身内容物或来自少数蠕虫的解剖组织。以下技术可以适用于各种营养研究,并提供有效的工具来剖析脂质代谢如何影响长寿和健康老龄化。
研究方案
图1 描述了使用不同实验设置的脂质喂养示意图。
1. 脂质条件细菌的制备
- 通过将 5.85 g NaCl、1.0 g K 2 HPO 4 和 6.0 g KH2PO4(参见材料表)溶解在 999 mL 去离子水中来制备细菌稀释饮食限制 (BDR)碱溶液。用0.5M KOH将pH调节至6.0,然后通过0.22μm过滤器过滤。
注意:BDR溶液可以在室温下储存,以便长期储存。 - 通过向每 10 mL BDR 碱溶液中加入 10 μL 5 mg/mL 胆固醇(溶解在 200 度乙醇中)来制备 BDR 培养基。
- 将OP50细菌(参见 材料表)从-80°C原液划线到LB-琼脂平板上,并在37°C孵育过夜。
注意:在37°C孵育过夜后,OP50板可以在4°C下储存长达1周,以获得稳定的进料结果。 - 将OP50细菌从OP50 LB-琼脂平板接种到LB培养基中,并在37°C振荡器中孵育过夜(16小时)。
注意:所需的LB培养基体积取决于实验设置。建议使用 200 μL 的 5 倍浓缩细菌接种到每个 6 cm 平板上,每个 10 cm 平板和每次重复液体喂养条件使用 1 mL 5x 浓缩细菌。因此,必须分别为每种脂质喂养培养物制备 1 mL 和 5 mL 的初始 LB 接种。 - 通过在室温下以4,000× g 离心10分钟来收集细菌。弃去上清液。
- 将细菌沉淀悬浮在 20 mL BDR 碱中,并以 4,000 x g 离心 10 分钟。弃去上清液。
注意:此步骤对于洗掉细菌沉淀中剩余的LB残留物至关重要。 - 将每个细菌沉淀悬浮在BDR培养基中,制成20倍BDR细菌原液。使用前用BDR培养基将20倍BDR细菌原液稀释至5倍。
注意:使用原始LB体积的1/20体积的BDR培养基以达到细菌的20倍浓度。20x细菌原液可在4°C下储存长达1周。 - 在新的高压灭菌玻璃小瓶中制备脂质储备溶液,使用乙醇或二甲基亚砜(DMSO)作为溶剂,并用氩气或氮气填充玻璃小瓶以防止氧化。
注意:储备溶液浓度通常在250 mM和1 mM之间。 - 将脂质储备溶液转移到所需量的BDR细菌溶液中,以在喂养条件下达到所需的最终浓度。涡旋20秒充分混合。
注意:喂养中脂质的最终浓度通常为1μM至1mM,具体取决于脂质和测试条件。如果使用新的脂质,建议先进行试点实验,以测试从0.1μM到1mM的不同浓度。在将其接种到平板上或将其放入液体蠕虫培养物之前,立即将脂质储备溶液与BDR细菌混合。在喂食蠕虫之前不超过1小时准备脂质条件细菌。 - 将相同体积的过滤乙醇或DMSO(取决于用于脂质喂养组)与BDR细菌混合以作为载体对照。
2.同步秀丽隐杆线虫 补脂的制备
- 通过混合(使用指定的最终浓度)22 mM KH 2 PO 4、22 mMNa 2 HPO 4、85 mM NaCl 和2mM MgSO 4 制备 M9 缓冲液(参见材料表)。高压灭菌缓冲液进行灭菌。
- 制备含有60%房屋漂白剂(v / v,见 材料表)和最终浓度为1.6M NaOH的新鲜漂白剂溶液。
- 使用 10 mL M9 缓冲液在 15 mL 锥形管中收集妊娠成人。
注意:同步所需的蠕虫和板的数量取决于实验设置(即条件和重复和喂食方法的数量)。理想情况下,每整块6厘米的成虫板在同步后应该能够产生至少600个L1蠕虫。 - 以 1,450 x g 的速度旋转蠕虫 30 秒。除去上清液,用10mL M9缓冲液再次冲洗蠕虫。
- 以 1,450 x g 的速度旋转蠕虫 30 秒。吸出上清液,在锥形管中留下 4 mL 等分试样。加入 2 mL 漂白剂溶液,剧烈摇晃 1 分钟。
- 在室温下以 1,450 x g 离心蠕虫 30 秒。
- 除去上清液,加入 4 mL M9 缓冲液和 2 mL 漂白剂溶液。摇动管子直到蠕虫体溶解。
- 在室温下以 1,450 x g 离心鸡蛋 30 秒。
- 除去上清液,用 10 mL M9 缓冲液洗涤鸡蛋。
- 重复步骤 2.8 和 2.9 3 次。
- 用 6 mL M9 缓冲液悬浮胚胎。将胚胎在20°C的旋转器上摇动2天,让它们孵化并同步。
- 将L1幼虫转移到OP50播种板上。在20°C孵育48小时以收集同步的L4蠕虫,第1天成虫72小时,第2天成虫96小时。
注意:OP50板是通过向每个10cm线虫生长培养基(NGM)板34中加入1mL的20x OP50细菌来制备的。如果目标是在L4阶段收获蠕虫,则可以将30,000个L1蠕虫播种到每个OP50板中,如果旨在收获第1天成虫,则可以将20,000个L1蠕虫播种到每个OP50板中。对于不同的实验室设置,这可能会有所不同,因此建议测试可以播种的蠕虫数量,以确保蠕虫在收获之前有足够的食物。 - 使用 10 mL M9 缓冲液在 15 mL 锥形管中收集 L4、第 1 天成虫或第 2 天成虫。使用另外 5 mL 的 M9 缓冲液冲洗板上剩余的蠕虫。
- 以1,450× g 旋转蠕虫30秒,并丢弃上清液。用10mL BDR培养基洗涤蠕虫沉淀,以1,450× g 离心30秒,弃去上清液。
- 对于液体进料方法中的蠕虫,将BDR培养基转移到蠕虫上,以达到3,000蠕虫/mL的蠕虫浓度。对于板上进料方法中的蠕虫,减少添加到蜗杆中的BDR培养基的体积,以减少板上的干燥时间。
3. 秀丽隐杆线虫的脂质补充
- 按照以下步骤在液体培养中进行脂质补充。
注意:此方法适用于使用补充脂质的散装蠕虫测试转录变化。- 将所需量的脂质或载体对照转移到12孔板中的每个孔中。为每个饲养条件准备三到四个孔作为生物复制。
- 将步骤 2.15 中的蠕虫悬浮液与 5x BDR 细菌以 1:1 的比例混合,以达到 1,500 个蠕虫/mL 和 2.5x 细菌的最终浓度。
- 将BDR培养基中的2mL蠕虫 - 细菌混合物转移到12孔板的每个孔中。
- 用箔纸包裹12孔板,并在20°C培养箱中以100rpm摇动所需的孵育长度。
注意:要测试不同的喂养条件,请将脂质与蠕虫孵育不同的时间长度,例如6小时,12小时和24小时。此外,可以测试不同的蠕虫阶段以获得最佳结果,包括从L4或第1天成虫阶段进行脂质喂养。
- 按照以下步骤在10cm NGM琼脂平板上进行脂质补充。
注意:此方法适用于使用补充脂质的散装蠕虫测试转录变化。- 将步骤1.9中的1mL脂质条件细菌接种到每个10cm板的中心。当制备了大量板时,在播种之间多次涡旋最终工作溶液。使用生物安全罩在黑暗中干燥板。
- 将步骤2.15中的3,000个蠕虫转移到10厘米板中的每个板上。在生物安全罩中干燥板,直到蠕虫可以在补充脂质的平板上爬行而不是游泳。
- 将蠕虫在20°C培养箱中的脂质调节板上孵育所需时间长度。如果使用多不饱和脂质,请避光。
注意:要测试不同的喂养条件,请将脂质与蠕虫孵育各种时间长度,例如6小时,12小时和24小时。此外,可以测试不同的蠕虫阶段以获得最佳结果,包括在L4或第1天成虫阶段进行脂质喂养。
- 在6cm NGM琼脂平板上进行脂质补充以进行转录分析。
注意:此方法适用于测试补充脂质的少数蠕虫的转录变化。- 将步骤1.9中的300μL脂质条件细菌接种到每个6cm板的中心。当制备了大量板时,在播种之间多次涡旋最终工作溶液。使用生物安全罩在黑暗中干燥板。
- 将多达300个蠕虫从步骤2.15转移到每个6厘米板。在生物安全罩中干燥板,直到蠕虫可以在补充脂质的平板上爬行而不是游泳。
- 将蠕虫在20°C培养箱中的脂质调节板上孵育所需时间长度。如果使用多不饱和脂质,请避光。
注意:要测试不同的喂养条件,请在不同的时间点(例如6小时,12小时和24小时)与蠕虫孵育脂质。此外,可以测试不同的蠕虫阶段以获得最佳结果,包括在L4或第1天成虫阶段进行脂质喂养。
- 在6cm NGM琼脂平板上进行脂质补充以进行纵向寿命测定。
- 将 200 μL 脂质条件细菌(具有 1 倍脂质浓度和 5 倍浓缩细菌)接种到每个 6 cm NGM 板的中心。为每个喂养条件准备三个盘子。
注意:盘子必须在使用当天新鲜准备(最好在使用前)。 - 在生物安全罩中干燥板。如果使用聚不饱和脂质,请保持引擎盖和房间内的灯光关闭。
- 将 30-40 个同步的 L4 蠕虫挑到每个板上。将带有蠕虫的板保持在20°C培养箱中。如果用多不饱和脂质喂养,请将板保存在20°C培养箱的避光盒中。
注意:可以使用普通6厘米通道板(无条件OP50)中的OP50作为胶水来拾取蠕虫,但至关重要的是不要在测定板中留下大量未经调节的OP50。 - 根据所需的喂养条件,每天或每隔一天将蠕虫转移到新的、新鲜制作的脂质调节盘中。生存评分方式与前面描述的相同4.
- 将 200 μL 脂质条件细菌(具有 1 倍脂质浓度和 5 倍浓缩细菌)接种到每个 6 cm NGM 板的中心。为每个喂养条件准备三个盘子。
4. 用于转录分析的RNA提取
- 从大量全蠕虫中提取RNA。
- 将液体培养物中的蠕虫从步骤3.1转移到1.5 mL微量离心管中。使用 M9 缓冲液从步骤 3.2 中的 10 cm 板上洗掉蠕虫,并将蠕虫转移到 M9 缓冲液中 1.5 mL 微量离心管中。
- 用台式微型离心机(见 材料表)短暂离心蠕虫10秒,并快速吸出上清液。
- 将液体进料孔中的剩余蠕虫或从板式进料中洗涤的蠕虫转移到同一管中并向下旋转。除去上清液。
- 用 1 mL 冰冷的 M9 洗涤蠕虫颗粒,用小型离心机短暂旋转 10 秒,然后吸出上清液。根据上清液的透明度重复1x或2x。
- 将微量离心管放在冰上2分钟,并用200μL移液器除去尽可能多的上清液,留下体积不超过15μL的填充蠕虫颗粒。
- 将 15 μL 含有苯酚和异硫氰酸胍的 RNA 提取溶液(材料表)转移到每个微量离心管中,并用电动研磨机研磨蠕虫约 30 秒,直到看不到完整的蠕虫。
注意:RNA提取溶液有毒且易燃,任何涉及装有该试剂的打开容器的步骤都必须在化学罩中操作。 - 将 285 μL RNA 提取溶液转移到微量离心管中,同时将电机研磨机尖端上的任何蠕虫内容物冲洗到微量离心管中。涡旋以充分混合。
注意:这是一个暂停点。样品可以在-80°C的RNA提取溶液中储存几个月。当取出-80°C时,让样品在室温下解冻。 - 将 60 μL 氯仿转移到每个样品中并剧烈涡旋。让样品在室温下沉降10分钟。
注意:氯仿有毒,必须在化学罩中处理。 - 在4°C下以21,000× g 离心20分钟。 使用 200 μL 移液器小心地将顶部的 140 μL 水层转移到新的无 RNase 微量离心管中,每次用 70 μL 转移 2 次。
注意:从这一步开始,所有与样品直接接触的移液器吸头和容器都需要不含RNase。还建议使用RNase去污溶液擦拭所有设备和工作空间。 - 将 140 μL 异丙醇转移到样品管中。剧烈涡旋,让样品在室温下沉降10分钟。在4°C下以21,000× g 离心20分钟,并小心地除去所有上清液。
- 将 0.5 mL 冰冷的 80% 乙醇 (v/v) 转移到带有 RNA 沉淀的样品管中。剧烈涡旋,直到RNA沉淀离开管底部并在乙醇溶液中漂浮。在4°C下以21,000× g 离心10分钟,并除去上清液。
- 在小型离心机中短暂离心样品管15秒,以旋转粘附在管壁上的任何溶剂,然后用移液管尽可能多地除去乙醇溶液。
- 打开管盖以干燥RNA沉淀。如果用乙醇溶液彻底洗涤沉淀,则干燥步骤应少于10分钟。
注意:这是一个暂停点。干燥的RNA沉淀可以在-80°C下储存长达1个月。 - 用 40 μL 无核酸酶水溶解干燥的 RNA 沉淀,并根据制造商的说明使用 DNA 去除试剂盒进行处理(参见 材料表)。
注意:建议先将RNA溶解在无核酸酶的水中。如果在转移到RNA管之前将40 μL水与10x DNase缓冲液混合,则RNA沉淀不会完全溶解。将RNA沉淀溶解在水中时,需要将RNA样品保存在冰上。冻融循环会降低RNA质量;因此,在DNase治疗的同一天进行逆转录步骤。
- 从少量全蠕虫中提取RNA。
- 从细菌草坪中挑选 15-20 条蠕虫到新鲜的未播种 NGM 板中,以去除蠕虫中的细菌。
- 根据qRT-PCR两步试剂盒的制造商(参见 材料表),通过在PCR管中将0.2 μLDNase与19.8 μL裂解液混合,为每个样品制备20 μL最终裂解液。通过上下移液5次混合裂解溶液。
- 将 15-20 个蠕虫从未接种的 NGM 板转移到含有 20 μL 细菌数量最少的最终裂解溶液的 PCR 管中。将裂解反应在室温下孵育5分钟。
- 使用以下程序以30%的振幅对蠕虫进行超声检测(见 材料表):超声处理5秒,暂停5秒,重复4次,总超声时间为20秒。超声处理期间将样品保存在冰冷的水浴中。
- 在室温下孵育5分钟。
注意:如果无RT阴性对照显示DNA污染达到相关水平,则在孵育前添加更多DNA酶。 - 将 2 μL 终止液转移到裂解反应中,轻轻敲击混合。在室温下孵育2分钟,然后放在冰上。
注意:在进行逆转录步骤之前,可以将样品在冰上放置长达2小时。
- 按照以下步骤从蠕虫组织中进行RNA提取。
- 从细菌草坪上挑选大约 20 条蠕虫,并将它们放在新鲜的未播种 NGM 板上以去除其中的细菌。
- 将20条蠕虫(细菌尽可能少)移至含有500μL含有4μM左旋咪唑的M9溶液的手表玻璃杯中(参见 材料表)。固定将在几秒钟内发生。
- 当蠕虫被固定时,使用可以连接到1mL注射器的25 G针头解剖种系或肠道。
- 在解剖范围内,在第二个咽球的位置进行切割,以允许肠道和种系的自然挤出。这两种组织可以根据它们的形态和不同的对比度轻松区分。使用镊子或针头轻轻分开组织,避免损坏它们。
注意:建议在5-10分钟内解剖。如果切口不能产生良好的组织挤出,建议移动到下一个蠕虫并在10分钟内尽可能多地解剖。此过程需要较短的时间范围,以避免环境中的转录更改。
- 在解剖范围内,在第二个咽球的位置进行切割,以允许肠道和种系的自然挤出。这两种组织可以根据它们的形态和不同的对比度轻松区分。使用镊子或针头轻轻分开组织,避免损坏它们。
- 根据 qRT-PCR 两步试剂盒制造商的说法,通过在 PCR 管中将 0.2 μL DNase I 与 19.8 μL 裂解液混合,为每个样品制备 20 μL 最终裂解液。通过上下移液5次混合裂解溶液。
- 使用高压灭菌的玻璃移液管将解剖的组织转移到PCR管中。将PCR管在冰上沉降2分钟,以使材料沉积在底部。除去上清液,将 20 μL 终裂解溶液加入 PCR 管中,并通过敲击混合。
- 将裂解反应在室温下孵育5分钟。然后,将 2 μL 终止液转移到裂解反应中,并通过敲击混合。在室温下孵育2分钟。
注意:在进行逆转录步骤之前,可以将样品在冰上放置长达2小时。
5. 逆转录和 qRT-PCR
- 对散装蠕虫进行逆转录和 qRT-PCR。
- 测量RNA浓度并制备5μg总RNA用于逆转录。
- 通过混合来自每个样品的等量的RNA并将最终RNA浓度调整为0.556 g / L(5 μg / 9 μL)来制备混合的RNA样品。将混合的RNA样品用于qRT-PCR标准曲线和RT阴性对照。
- 根据制造商说明进行逆转录(参见 材料表)。在单个RNA样品的同时运行以下质量控制逆转录反应。
- 以混合的RNA样品为模板进行逆转录(用于qRT-PCR标准曲线)。
- 使用混合的RNA样品作为模板进行逆转录,无需逆转录酶(RT阴性对照;潜在基因组DNA污染的质量控制)。
- 使用无核酸酶的水作为模板进行逆转录(RT阴性对照;试剂中潜在RNA污染的质量控制)。
注意:这是一个暂停点。样品可以在热循环仪中过夜或在-20°C下储存几个月。
- 用无核酸酶水稀释混合RNA样品产生的cDNA四倍、20倍、100倍和500倍,以获得qRT-PCR标准曲线。
- 将每个RNA样品产生的cDNA稀释20-100倍,用作qRT-PCR反应的模板。
注意:稀释比例取决于目的基因的丰度。对于高表达基因,例如本研究中使用的管家基因或egl-3和egl-21,建议使用100倍稀释。对于低表达基因,如lbp-8,建议使用20倍稀释。 - 根据制造商的说明使用qRT-PCR试剂进行qRT-PCR,如下所示:95°C10分钟,用95°C重复40次15秒和60°C重复1分钟,然后是默认熔解曲线程序,并在8°C下无限期保持。
- 对一些蠕虫或蠕虫组织进行逆转录和qRT-PCR。
- 将 25 μL RT 缓冲液和 2.5 μL 20x RT 酶混合物从 qPCR 2 步试剂盒(参见 材料表)转移到步骤 4.2.6 或步骤 4.3.6 中含有蠕虫裂解物的每个管中。
注意:RT阴性对照对于来自少数蠕虫的qRT-PCR至关重要。每个实验都需要包括一个带有RT缓冲液但没有RT酶的蠕虫裂解物样品(来自步骤4.2.6),以检查样品中的DNA污染。如果DNA污染是一个问题,请考虑在裂解蠕虫后向裂解缓冲液中添加更多的DNase,或在样品中添加更多的DNA酶。或者,可以通过在正常RT反应中使用一半的裂解物,在没有逆转录酶的RT反应中使用另一半来对每个样品进行RT阴性对照。 - 轻轻拍打混合。使用小型离心机旋转10秒。
- 按照制造商的说明将样品装入热循环仪机器:37°C60分钟,95°C5分钟,8°C无限期。
注意:这是一个暂停点。样品可以在热循环仪中过夜或在-20°C下储存几个月。 - 将所有试剂和样品放在冰上,并保护qRT-PCR试剂免受光照。
- 准备 96 孔 qPCR 板,并在每个孔中混合 6 μL 无核酸酶水、10 μL qRT-PCR 试剂、2 μL 5 μM 引物混合物(正向和反向)和 2 μL cDNA。用保护性光学膜覆盖 96 孔 qPCR 板表面并向下按压以密封。
- 按照制造商的说明在热循环仪上运行qRT-PCR程序,如下所示:50°C2分钟,95°C2分钟,用95°C重复40次3秒,60°C重复30秒,然后无限期8°C。
- 将 25 μL RT 缓冲液和 2.5 μL 20x RT 酶混合物从 qPCR 2 步试剂盒(参见 材料表)转移到步骤 4.2.6 或步骤 4.3.6 中含有蠕虫裂解物的每个管中。
结果
在补充脂质时使用一些全虫验证转录变化
为了研究从几个全蠕虫中提取和逆转录RNA到cDNA的方案是否可重现并与来自散装蠕虫的数据进行比较,采用了一种在肠道中过表达溶酶体酸性脂肪酶lipl-4的长寿命蠕虫菌株7,8,33,35。先前研究7,8,33中报道的神经肽加工基因egl-3和egl-21的转录诱导得到验证(图2A,B)。这种诱导表明,从少数动物中提取RNA方法是从批量蠕虫培养物中提取标准cDNA合成技术的有效替代方案。
在补充脂质时使用解剖的蠕虫组织验证转录评估
在秀丽隐杆线虫中,20-碳多不饱和脂肪酸的合成取决于去饱和酶FAT-316,17的活性。以前的研究报告称,脂肪-3突变体缺乏20碳多不饱和脂肪酸,包括DGLA16。先前,发现lipl-4g蠕虫中Δ6-去饱和酶FAT-3的缺失抑制了神经肽加工基因egl-3和egl-2133的转录诱导。 此外,DGLA补充拯救了这种诱导33。编码egl-21的基因在神经元中表达,而egl-3在神经元和肠道中均被检测到36,37。 为了进一步测试DGLA补充剂是否恢复肠道或神经元中egl-3和egl-21的诱导,解剖肠道并使用本协议步骤4.3和5.2中描述的qRT-PCR分析评估其转录水平。在成年第1天补充DGLA在源食物中12小时。在肠道中未发现egl-3或egl-21的转录诱导(图2C),这与先前的发现一致36,38。
脂质补充时寿命测定的验证
20碳多不饱和脂肪酸与使脂肪-3失活的长寿机制之间的关系先前已被探索过,特别是在lipl-4g蠕虫33的肠道中。结果发现,脂肪-3击倒完全抑制了lipl-433赋予的寿命延长。 为了评估DGLA是否恢复了lipl-4介导的寿命,DGLA每隔一天新鲜补充一次,在成年期的第1天补充到源食物中。结果发现,在脂肪-3敲低后,DGLA补充剂挽救了寿命延长(图2D)33,表明脂质补充程序与寿命测定相结合。
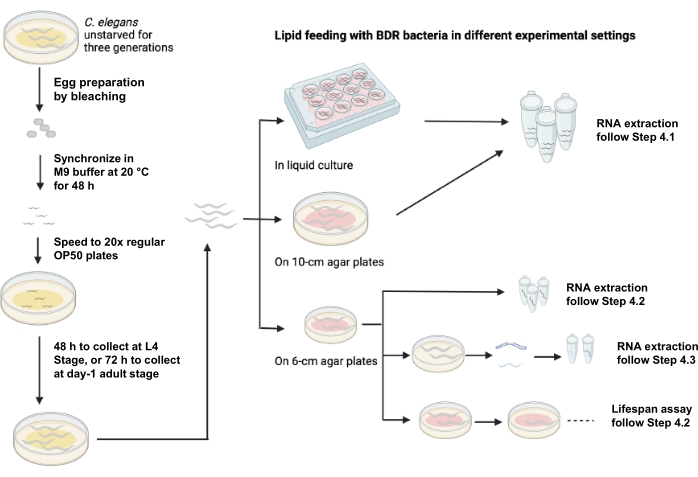
图1:使用不同实验设置的脂质喂养示意图。 请点击此处查看此图的大图。

图 2:使用大量蠕虫、少数蠕虫和解剖组织验证神经肽加工基因的转录评估。 (A)从大量蠕虫群中提取的RNA显示lipl-4 Tg动物中神经肽加工基因的egl-3和egl-21转录本水平的诱导 。误差线表示 ±1 SEM. **** p < 0.0001 通过双尾学生 t 检验。(B)从一些蠕虫中提取RNA证实了lipl-4 Tg蠕虫中神经肽加工基因的egl-3和egl-21转录本水平的诱导。 误差线表示 ±1 SEM. **** p < 0.0001 通过双尾学生 t 检验。(C)神经元神经肽加工基因egl-3和egl-21在解剖肠中不被诱导。 误差线表示 ±1 SEM。 使用双尾学生 t 检验进行统计分析。(D)不同浓度的DGLA补充剂,包括10μm,100μm和1mM,挽救了脂-4Tg对脂肪-3 RNAi的长寿效应。p < 0.001 通过对数秩检验。这个数字改编自萨维尼等人33。请点击此处查看此图的大图。
讨论
脂质补充剂已被用于衰老研究,以阐明某些脂质物种对健康衰老的直接影响6,7,23,26,27,31。然而,脂质补充过程可能具有挑战性,实验之间的任何不一致都可能导致不可重复的结果。在这里,记录了第一个详细的分步协议,以指导新科学家避免因技术不精确而导致的潜在陷阱。该协议中的关键步骤将在以下段落中详细讨论。脂质研究工具箱还通过在脂质补充后仅从少数蠕虫和特定蠕虫组织中引入RNA分离来扩展。在考虑检查转录本水平的方法时,具有少量蠕虫或解剖组织的qRT-PCR对于分析一些转录本或检查某些组织特异性转录变化非常出色。此外,使用这些方法可以克服蠕虫扩增的步骤,这可能需要大约5-6天的额外时间。同时,脂质喂养后进行批量RNA提取更具成本效益,并且在需要分析更多靶基因集时是一种有效的替代方案。
有几个步骤对于脂质喂养效应的重现性至关重要。第一个方面与细菌条件有关。建议使用不超过7天的新鲜细菌板进行接种。建议在1周内使用在BDR培养基中制备的细菌。与脂质混合的细菌必须立即使用。即使在4°C下也不应储存带有细菌的脂质,因为细菌会代谢脂质。BDR基底中的洗涤步骤和BDR培养基中的重悬对于细菌条件至关重要,因为细菌在LB中生长,并直接喂食蠕虫总是消除了脂质补充剂的深远影响。第二个因素与蠕虫状况有关。 秀丽隐杆线虫 在进行卵子准备的漂白步骤之前必须至少三代不饥饿,以确保它们处于健康稳定的代谢状态。在补充脂质之前,在琼脂平板上培养秀 丽隐杆线虫 也很重要;这包括同步步骤之前和之后。
长时间适应液体培养的蠕虫部分饥饿;饥饿提高了长寿基因的基线,导致脂质补充的效果减弱。如果担心使用停滞的L1幼虫的代谢漂移和变化,则有效的替代方案是直接将卵板。当只需要少数蠕虫进行寿命或基因表达分析时,可以直接将鸡蛋放在脂质条件的平板上,并通过在L4阶段手动采摘来重新同步它们以进行后续实验。但是,如果在手工采摘L4不适用时需要大量蠕虫,则直接电镀鸡蛋并不理想。妊娠成虫漂白后的卵孵化可能发生在不同的时间点,并导致种群不同步,这会干扰转录分析。第三个关键部分与脂质储存条件有关;补充多不饱和脂肪酸时,需要格外注意,因为这些分子对光敏感,容易在空气中氧化。
在测试新的脂质分子时,需要进一步研究多种脂质喂养条件,包括蠕虫阶段、补充长度和浓度。L4、第 1 天成虫和第 2 天成虫通常是不同蠕虫阶段检测的起点。值得注意的是,当饲喂L4蠕虫时,如果潜伏时间在线虫蜕皮期左右结束,则预计会有较大的变化,这极大地影响了结果的重要性和可重复性。使用第1天或第2天成虫的另一个挑战与后代有关,这可能会使基因表达分析复杂化。在这种情况下,从少数全虫中提取RNA比大量种群更可靠。不同的脂质分子具有不同的浓度范围,产生生理效应;因此,建议测试从1μM到1mM的一系列浓度。
选择喂食方法时需要考虑一些限制。首先,当脂质不能被蠕虫吸收或摄入时,使用补充方法来测试它们在 秀丽隐杆线虫中的生物学效应具有挑战性。使用当前的技术,质谱或SRS与 13种C或 2种H标记的脂质化合物39 相结合是测试脂质吸收到蠕虫体内的有效工具。其次,这些喂食方法没有针对高通量调查技术进行优化。对于散装蠕虫的脂质补充,液体进料方法的样品制备比板上进料更快,因为液体培养物可以直接转移到微量离心管中,而不是从进料板上洗掉。为确保提取的RNA处于收获状态,建议从将蠕虫放在冰上到在RNA提取溶液中研磨它们之间不要超过15-20分钟。当需要处理大量样品时,建议每 15 分钟处理较少的条件。对于从少数动物中提取全蠕虫RNA,手工采摘步骤是限速步骤,而对于解剖组织,以省时的方式采取行动以避免长期暴露于非生理环境至关重要。与批量RNA提取类似,最好在10分钟内挑选蠕虫或解剖组织样品。
尽管有局限性,但这些补充方法可用于脂质研究之外,以帮助确定任何营养和药用效果。这里报道的程序不仅限于衰老研究,还包括评估细胞器适应性和细胞代谢稳态的替代表型。大体积群体的补充方法可以与RNA-seq相结合进行转录组分析,质谱法用于代谢组学和蛋白质组学分析,或蛋白质印迹法用于分析特异性蛋白质标志物,而少量蠕虫的脂质补充可以与成像和行为分析相结合。
披露声明
作者没有利益冲突。
致谢
我们感谢 P. Svay 的维护支持。这项工作得到了NIH资助R01AG045183(MCW),R01AT009050(MCW),R01AG062257(MCW),DP1DK113644(MCW),March of Dimes基金会(MCW),韦尔奇基金会(MCW),HHMI研究员(MCW)和NIH T32 ES027801博士前学生研究员(MS)的支持。一些菌株由CGC提供,CGC由NIH研究基础设施计划办公室(P40 OD010440)资助。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL Pestle | Genesee Scientific | 93-165P15 | For worm grinding with Trizol |
| Agarose | Sigma | A9639-500G | |
| AmfiRivert cDNA Synthesis Platinum Master Mix | GenDEPOT | R5600 | For reverse transcription from bulk worm samples |
| Applied Biosystems QuanStudio 3 Real-Time PCR | ThermoFisher | A28567 | For qRT-PCR |
| Benchmark Scientific StripSpin 12 Microcentrifuge | Benchmark Scientific | C1248 | For spin down PCR tubes |
| Branson 450 Digital Sonifier, w/ 1/8" tip | Branson Ultrasonic Corporation | 100-132-888R | |
| Chloroform | Fisher Scientific | C298-500 | |
| Cholesterol | Sigma | C8503-25G | |
| Dimethyl sulfoxide (DMSO) | Sigma | D8418-100ML | |
| Eppendorf 5424 R centrifuge | Eppendorf | 22620444R | For RNA extraction |
| Eppendorf vapo protect mastercycler pro | Eppendorf | 950030010 | For reverse transcription |
| Ethanol, Absolute (200 Proof) | Fisher Scientific | BP2818-500 | |
| Greiner Bio-One CELLSTAR, 12 W Plate | Neta Scientific | 665180 | 12-well plates for licuid feeding |
| Greiner Bio-One Petri Dish, Ps, 100 x 20 mm | Neta Scientific | 664161 | For bacterial LB plates and worm 10-cm NGM plates |
| Greiner Bio-One Petri Dish, Ps, 60 x 15 mm | Neta Scientific | 628161 | For worm6-cm NGM plates |
| Invitrogen nuclease-free water | ThermoFisher | AM9937 | |
| Isoproanol | Sigma | PX1835-2 | |
| Levamisole hydrochloride | VWR | SPCML1054 | |
| lipl-4Tg | MCW Lab | N/A | Transgenic C. elegans |
| lipl-4Tg;fat-3(wa22) | MCW Lab | N/A | Transgenic C. elegans |
| Luria Broth Base | ThermoFisher | 12795-084 | |
| Magnesium sulfate (MgSO4) | Sigma | M2643-500G | |
| MicroAmp EnduraPlate Optical 96-Well Fast Clear Reaction Plate with Barcode | ThermoFisher | 4483354 | 96-well qPCR plate |
| MicroAmp Optical Adhesive Film | Applied BioSystem | 4311971 | For sealing the 96-well qPCR plate |
| Milli-Q Advantage A10 Water Purification System | Sigma | Z00Q0V0WW | Deionized water used to make all reagents, including buffer and cultural media, unless specified as nuclease-free water in the protocol |
| N2 | Caenorhabditis Genetics Center | N/A | C. elegans wild isolate |
| NanoDrop ND-1000 Spectrophotometer | ThermoFisher | N/A | For measuring RNA concentration |
| OP50 | Caenorhabditis Genetics Center | N/A | Bacteria used as C. elegans food |
| Potasium phosphate dibasic trihydrate (K2HPO4·3H2O) | Sigma | P5504-1KG | |
| Potasium phosphate monobasic (KH2PO4) | Sigma | P0662-2.5KG | |
| Power SYBR Green cells-to-Ct kit | ThermoFisher | 4402953 | For reverse transcription and qPCR from a few worms or worm tissue |
| Power SYBR Green Master Mix | ThermoFisher | 4367659 | For qPCR from bulk worm samples |
| Pure Bright germicidal ultra bleach | KIK International LLC. | 59647210143 | 6% house bleach For worm egg preparation |
| Pyrex spot plate with nine depressions | Sigma | CLS722085-18EA | Watch glass for dissecting the worms |
| RNaseZap RNase Decontamination Solution | ThermoFisher | AM9780 | |
| Sodium cloride (NaCl) | Sigma | S7653-1KG | |
| Sodium hydroxide (NaOH) | Sigma | SX0590-3 | |
| Sodium phosphate dibasic heptahydrate (Na2HPO4·7H2O) | Sigma | S9390-1KG | |
| Thermo Sorvall Legend Mach 1.6R Centrifuge | Thermo | 7500-4337 | For bacteria collection |
| Thermo Sorvall ST 8 centrifuge | Thermo | 7500-7200 | For worm egg preparation |
| TRIzol Reagent | TheroFisher | 15596018 | RNA extraction reagent |
| Turbo DNA-free kit | ThermoFisher | AM1907 | For removing DNA contamination in RNA extractions |
| Vortexer 59 | Denville Scientific INV | S7030 | |
| VWR Disposable Pellet Mixers and Cordless Motor | VWR | 47747-370 | For worm grinding with Trizol |
| VWR Kinetic Energy 26 Joules Mini Centrifuge C1413 V-115 | VWR | N/A | For worm collection. Discontinued model, a similar one available at VWR with Cat# 76269-064 |
| Worm picker | WormStuff | 59-AWP |
参考文献
- Fahy, E., et al. Update of the LIPID MAPS comprehensive classification system for lipids 1. Journal of Lipid Research. 50, 9-14 (2009).
- Liebisch, G., et al. Update on LIPID MAPS classification, nomenclature, and shorthand notation for MS-derived lipid structures. Journal of Lipid Research. 61 (12), 1539-1555 (2020).
- Mutlu, A. S., Duffy, J., Wang, M. C. Lipid metabolism and lipid signals in aging and longevity. Developmental Cell. 56 (10), 1394-1407 (2021).
- Kimura, T., Jennings, W., Epand, R. M. Roles of specific lipid species in the cell and their molecular mechanism. Progress in Lipid Research. 62, 75-92 (2016).
- Duffy, J., Mutlu, A. S., Wang, M. C. Lipid Metabolism, Lipid Signalling and Longevity. Ageing: Lessons from C. elegans. Healthy Ageing and Longevity. Olsen, A., Gill, M. , Springer. Cham. 307-329 (2017).
- Lesa, G. M., et al. Long chain poly-unsaturated fatty acids are required for efficient neurotransmission in C. elegans. Journal of Cell Science. 116 (24), 4965-4975 (2003).
- Folick, A., et al. Lysosomal signaling molecules regulate longevity in Caenorhabditis elegans. Science. 347 (6217), 83-86 (2015).
- Ramachandran, P. V., et al. Lysosomal signaling promotes longevity by adjusting mitochondrial activity. Developmental Cell. 48 (5), 685-696 (2019).
- Byrne, E. F. X., et al. Structural basis of Smoothened regulation by its extracellular domains. Nature. 535 (7613), 517-522 (2016).
- Corsi, A. K., Wightman, B., Chalfie, M. A. Transparent window into biology: a primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Nigon, V. M., Félix, M. -A. History of research on C. elegans and other free-living nematodes as model organisms. WormBook. , 1-84 (2017).
- Kutscher, L. M., Shaham, S. Forward and reverse mutagenesis in C. elegans. WormBook. , 1-26 (2014).
- Brooks, K. K., Liang, B., Watts, J. L. The influence of bacterial diet on fat storage in C. elegans. PloS ONE. 4 (10), 7545(2009).
- Brock, T. J., Browse, J., Watts, J. L. Fatty acid desaturation and the regulation of adiposity in Caenorhabditis elegans. Genetics. 176 (2), 865-875 (2007).
- Brock, T. J., Browse, J., Watts, J. L. Genetic regulation of unsaturated fatty acid composition in C. elegans. PloS Genetics. 2 (7), 108(2006).
- Watts, J. L., Phillips, E., Griffing, K. R., Browse, J. Deficiencies in C20 poly-unsaturated fatty acids cause behavioral and developmental defects in Caenorhabditis elegans fat-3 mutants. Genetics. 163 (2), 581-589 (2003).
- Watts, J. L., Browse, J. Genetic dissection of poly-unsaturated fatty acid synthesis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences. 99 (9), 5854-5859 (2002).
- Watts, J. L., Browse, J. A. Palmitoyl-CoA-specific Δ9 fatty acid desaturase from Caenorhabditis elegans. Biochemical and Biophysical Research Communications. 272 (1), 263-269 (2000).
- Watts, J. L. Fat synthesis and adiposity regulation in Caenorhabditis elegans. Trends in Endocrinology & Metabolism. 20 (2), 58-65 (2009).
- Peyou-Ndi, M. M., Watts, J. L., Browse, J. Identification and characterization of an animal Δ12 fatty acid desaturase gene by heterologous expression in Saccharomyces cerevisiae. Archives of Biochemistry and Biophysics. 376 (2), 399-408 (2000).
- Spychalla, J. P., Kinney, A. J., Browse, J. Identification of an animal ω-3 fatty acid desaturase by heterologous expression in Arabidopsis. Proceedings of the National Academy of Sciences. 94 (4), 1142-1147 (1997).
- Watts, J. L., Browse, J. Isolation and characterization of a Δ5-fatty acid desaturase from Caenorhabditis elegans. Archives of Biochemistry and Biophysics. 362 (1), 175-182 (1999).
- Deline, M. L., Vrablik, T. L., Watts, J. L. Dietary supplementation of polyunsaturated fatty acids in Caenorhabditis elegans. Journal of Visualized Experiments. (81), e50879(2013).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695(2021).
- Sunshine, H., Iruela-Arispe, M. L. Membrane lipids and cell signaling. Current Opinion in Lipidology. 28 (5), 408-413 (2017).
- Han, S., et al. Mono-unsaturated fatty acids link H3K4me3 modifiers to C. elegans lifespan. Nature. 544 (7649), 185-190 (2017).
- O'Rourke, E. J., Kuballa, P., Xavier, R., Ruvkun, G. ω-6 Poly-unsaturated fatty acids extend life span through the activation of autophagy. Genes & Development. 27 (4), 429-440 (2013).
- Steinbaugh, M. J., et al. Lipid-mediated regulation of SKN-1/Nrf in response to germ cell absence. eLife. 4, 07836(2015).
- Blackwell, T. K., Steinbaugh, M. J., Hourihan, J. M., Ewald, C. Y., Isik, M. SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radical Biology and Medicine. 88, 290-301 (2015).
- Ezzili, C., Otrubova, K., Boger, D. L. Fatty acid amide signaling molecules. Bioorganic & Medicinal Chemistry Letters. 20 (20), 5959-5968 (2010).
- Qi, W., et al. The ω-3 fatty acid α-linolenic acid extends Caenorhabditis elegans lifespan via NHR-49/PPARα and oxidation to oxylipins. Aging Cell. 16 (5), 1125-1135 (2017).
- Shemesh, N., Meshnik, L., Shpigel, N., Ben-Zvi, A. Dietary-induced signals that activate the gonadal longevity pathway during development regulate a proteostasis switch in Caenorhabditis elegans adulthood. Frontiers in Molecular Neuroscience. 10, 254(2017).
- Savini, M., et al. Lysosome lipid signalling from the periphery to neurons regulates longevity. Nature Cell Biology. 24 (6), 906-916 (2022).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , (2006).
- Wang, M. C., O'Rourke, E. J., Ruvkun, G. Fat metabolism links germline stem cells and longevity in C. elegans. Science. 322 (5903), 957-960 (2008).
- Jacob, T. C., Kaplan, J. M. The EGL-21 carboxypeptidase E facilitates acetylcholine release at Caenorhabditis elegans neuromuscular junctions. The Journal of Neuroscience. 23 (6), 2122-2130 (2003).
- Kass, J., Jacob, T. C., Kim, P., Kaplan, J. M. The EGL-3 proprotein convertase regulates mechanosensory responses of Caenorhabditis elegans. The Journal of Neuroscience. 21 (23), 9265-9272 (2001).
- Bael, S. V., et al. Mass spectrometric evidence for neuropeptide-amidating enzymes in Caenorhabditis elegans. Journal of Biological Chemistry. 293 (16), 6052-6063 (2018).
- Fu, D., et al. In vivo metabolic fingerprinting of neutral lipids with hyperspectral stimulated Raman scattering microscopy. Journal of the American Chemical Society. 136 (24), 8820-8828 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。