Method Article
Beyin Dilimlerinde Miyelinasyon Görüntüleme için Tutarlı Anti-Stokes Raman Spektroskopisi (CARS) Uygulaması
Bu Makalede
Özet
Miyelinasyonu görselleştirmek, sinir sistemini inceleyen birçok araştırmacı için önemli bir hedeftir. CARS, miyelin gibi özel yapıları aydınlatan beyin gibi doku içindeki lipitleri doğal olarak görüntüleyebilen immünofloresan ile uyumlu bir tekniktir.
Özet
Tutarlı anti-Stokes Raman spektroskopisi (CARS), kimyagerler ve fizikçiler tarafından moleküllerin imza titreşimlerinin tutarlı bir sinyalini üretmek için klasik olarak kullanılan bir tekniktir. Bununla birlikte, bu titreşimsel imzalar aynı zamanda beyin gibi anatomik doku içindeki moleküllerin karakteristiğidir ve bu da onu Sinirbilim uygulamaları için giderek daha kullanışlı ve uygulanabilir hale getirir. Örneğin, CARS, lipitleri, bu moleküller içindeki özellikle heyecan verici kimyasal bağlarla ölçebilir ve nörotransmisyonda yer alan miyelin gibi dokunun farklı yönlerinin nicelleştirilmesine izin verebilir. Ek olarak, tipik olarak miyelini ölçmek için kullanılan diğer tekniklerle karşılaştırıldığında, CARS ayrıca immünofloresan tekniklerle uyumlu olacak şekilde ayarlanabilir ve sodyum kanalları veya sinaptik iletimin diğer bileşenleri gibi diğer belirteçlerle birlikte etiketlemeye izin verir. Miyelinasyon değişiklikleri, multipl skleroz gibi demiyelinizan hastalıklarda veya Frajil X Sendromu veya otizm spektrum bozuklukları gibi diğer nörolojik durumlarda doğal olarak önemli bir mekanizmadır. Sonuç olarak, CARS, Nörobilimdeki acil soruları cevaplamak ve birçok farklı nörolojik durumla ilgili altta yatan mekanizmalar için kanıt sağlamak için yenilikçi yollarla kullanılabilir.
Giriş
Aksiyon potansiyelleri beyindeki temel bilgi birimidir ve aksonlar aracılığıyla aksiyon potansiyeli yayılımı bilgi işlemenin bir ayağını oluşturur 1,2,3. Nöronlar tipik olarak diğer birçok nörondan afferent girdiler alır ve bu girdileri belirli bir dar zaman aralığı 4,5 içinde bütünleştirir. Bu nedenle, aksonlardaki potansiyel yayılım mekanizmaları araştırmacılardan önemli miktarda ilgi görmüştür.
Bir akson boyunca yayılırken, güvenilir yayılmayı sağlamak için bir aksiyon potansiyeli akson boyunca tekrar tekrar yenilenir6. Çeneli omurgalıların (gnathostomlar) nöronlarının çoğunda, aksonlar, glial hücrelerin tipleri olan yakındaki oligodendrositler veya Schwann hücreleri tarafından üretilen lipit bakımından zengin bir madde olan bir miyelin kılıfı ile çevrilidir (7,8'de gözden geçirilmiştir). Bu miyelin kılıf, aksonu elektriksel olarak yalıtır, kapasitansını azaltır ve aksiyon potansiyelinin verimli, hızlı ve daha düşük enerji tüketimi ile yayılmasına izin verir. Miyelin, aksonu düzgün bir şekilde örtmez, ancak aksonu, Ranvier'in düğümleri olarak adlandırılan aralarında kısa boşluklar olan bölümler halinde kaplar (9,10'da gözden geçirilmiştir). Hem bir aksonun elektriksel yalıtım seviyesini kontrol eden miyelinasyon kalınlığı hem de bir akson boyunca aksiyon potansiyellerinin yenilenme sıklığını kontrol eden Ranvier düğümlerinin aralığı, aksiyon potansiyeli yayılım hızını etkiler (11'de gözden geçirilmiştir).
Miyelinasyon kalınlığının aksonlar12,13,14'teki aksiyon potansiyeli yayılım hızını etkilediğini öne süren geniş bir literatür vardır. Ayrıca, akson miyelinasyonundaki değişiklikler bir dizi CNS açığına neden olabilir 15,16,17,18,19,20,21. Bu nedenle, birçok araştırma çabasının odak noktasının akson miyelinasyonunun ölçümünü ve karakterizasyonunu içermesi şaşırtıcı değildir. Miyelin kalınlığının ölçümleri en yaygın olarak, önemli miktarda doku hazırlığı gerektiren ve immünohistokimya ile kombinasyon halinde kullanılması zor olan bir teknik olan elektron mikroskobu ile yapılmıştır. Bununla birlikte, Tutarlı Anti-Stokes Raman Spektroskopisine (CARS) dayanan akson miyelinasyonunu ölçmek için daha hızlı ve daha basit bir teknik de vardır. Bir CARS lazeri çeşitli frekanslara ayarlanabilir ve lipitleri uyarmak için uygun frekanslara ayarlandığında, miyelin herhangi bir ek etikete ihtiyaç duymadan görüntülenebilir22. Lipid görüntüleme, standart immünohistokimya ile birleştirilebilir, böylece lipitler birkaç floresan kanalı ile birlikte görüntülenebilir23. CARS ile miyelinasyonun görüntülenmesi, elektron mikroskobundan önemli ölçüde daha hızlıdır ve EM'den daha düşük olsa da, aynı tip aksonlardaki miyelinasyondaki küçük farklılıkları bile tespit etmek için yeterli bir çözünürlüğe sahiptir.
Protokol
Tüm deneyler yürürlükteki tüm yasalara, Ulusal Sağlık Enstitüleri yönergelerine uymuş ve Colorado Üniversitesi Anschutz Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır.
1. Hayvanlar
- Jackson Laboratuvarı'ndan elde edilen C57BL / 6J (stok #000664) farelerini (Mus musculus) veya aslen Charles Nehri'nden elde edilen Moğol gerbillerini (Meriones unguiculatus) kullanın.
2. Doku hazırlığı
- Transkardiyal perfüzyon için, pentobarbital (120 mg / kg vücut ağırlığı) ile ilgilenen aşırı doz kemirgen türleri ve transkardiyal olarak fosfat tamponlu salin (PBS; 137 mM NaCl, 2.7 mM KCl, 1.76 mM KH 2 PO 4, 10 mM Na2HPO4) ile%4 paraformaldehit (PFA) 24 ile perfüze edilir.
- Spesifik olarak, karın ve göğüs kafesini makas kullanarak açın ve kalbi açığa çıkarmak için göğüs kafesini Kelly hemostatik forseps ile yerinde tutun.
- Sol ventriküle bir perfüzyon pompasına bağlı 23 GA'lık bir iğne yerleştirin ve ince makas kullanarak sağ atriyumu hızla kesin.
- Beyni ve vücudu kandan temizlemek için PBS'yi perfüzyon pompası ve kalpteki iğne ile 10 dakika boyunca uygulayın.
- Perfüzyon pompasını 10 dakika boyunca% 4 PFA'ya değiştirin ve başarılı perfüzyonu onaylamak için uzuvların ve kuyruğun sertliğini kontrol edin.
- Perfüzyondan sonra, hayvanların kafasını kesin ve beyinlerini kafatasından çıkarın. PBS'ye geçmeden önce beyinleri gece boyunca% 4 PFA'da tutun. Beyin saplarını% 4 agaroza (PBS'de) gömün ve 200 μm kalınlığında bir vibratom kullanarak koronal olarak dilimleyin.
3. Boyama
- Nissl için, hücre cisimciklerini görselleştirmek için (1:100), antikor ortamında (AB ortamı: 0,1 M fosfat tamponu (PB: 50 mM KH 2 PO 4, 150 mM Na2HPO4), 150 mM NaCl, 3 mM Triton-X, %1 sığır serum albümini (BSA)) standart bir laboratuvar çalkalayıcı25 üzerinde oda sıcaklığında 30 dakika boyunca lekesiz yüzer kesitler.
- Alüminyum folyo ve/veya kapak kullanarak bölümleri ışıktan koruyun. 550 nm veya altındaki dalga boyları CARS görüntüleme ile uyumludur (Şekil 1).
NOT: Triton-X veya diğer reaktiflerin lipitlerin CARS görüntülemesi üzerinde bir etkisi olmasını beklemesek de, spesifik antikor ortamları ile ek kontroller garanti edilebilir.
- Alüminyum folyo ve/veya kapak kullanarak bölümleri ışıktan koruyun. 550 nm veya altındaki dalga boyları CARS görüntüleme ile uyumludur (Şekil 1).
- DURAKLATMA NOKTASI: Serbest kayan bölümleri (ışıktan korunurken) görüntülemeye kadar PBS'de saklayın. Bölümlendikten sonra, 2 hafta içinde beyin bölümlerini görüntüleyin.

Şekil 1: CARS görüntüleme immünofloresan görüntüleme ile birleştirilebilir. Grafikler, CARS görüntülemenin 660/640 nm kırmızı sinyal spektrumu26'da gerçekleştiğini göstermektedir. Bu dalga boyu yeşil, mavi veya UV aralığından yeterince uzaktır ve CARS sinyalinin bu aralıklarda immünofloresan ile kombinasyonuna izin verir. Özellikle, grafik ayrıca, bu yayın için temsili sonuçların toplanması sırasında CARS ile birleştirilen mavi florofor ile etiketlenmiş Nissl için uyarma ve emisyonu da göstermektedir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Görüntüleme
NOT: CARS lazer kurulumu, 80 MHz saat sağlayan bir fiber lazer ve CARS sinyalini toplamak için gerekli olan 1031 nm'de sabitlenmiş Stokes ışını ile 770-990 nm ayarlanabilir aralıkta bir OPO (Optik Parametrik Osilatör) lazer içerir. Her iki ışın için de bir diyafram açıklığı vardır.
- Örnekleri mikroskopa getirmeden önce, CARS lazerini en az 1 saat boyunca açın ve ısıtın, CARS lazerini ve Koehler'i kondenser optiklerini ve ileri CARS görüntüleme için mikroskobun diyaframını hizalayın.
NOT: Bu adım, CARS mikroskopisinin düzgün çalışması için kritik öneme sahiptir.- İki lazer ışınının (pompa ve stoklar) uzamsal hizalaması için, CARS lazer GUI'si aracılığıyla iki dahili PSD'ye (konuma duyarlı dedektörler) erişin.
- CARS lazer GUI'sindeki gecikme işlevini kullanarak zamansal hizalama elde edin, bu da farklı dalga boyları nedeniyle farklı dağılımlara sahip iki lazerin (pompa ve stoklar) darbelerinin üst üste binmesine yardımcı olabilir. Bu nedenle, pompa ve stokes kirişlerinin hem zamansal hem de mekansal örtüşmesi, GUI üzerinden kullanıcı girişi ile yapılır.
- Uzaysal olarak üst üste binen iki lazeri mikroskobun tarama kafası aynalarına ortalamak için harici periskopu (kurulumun son iki aynası) ayarlayın.
- En iyi ileri CARS taramasız algılama için, kondenserin Koehler-ed olduğundan emin olun (kondenserin ortalandığı ve düzgün aydınlatma elde etmek için diyaframa odaklandığı anlamına gelir)
- İmmünofloresan konfokal görüntüleme ve CARS görüntüleme için, floresan görüntüleme için görünür lazerlerle donatılmış bir konfokal mikroskop kullanarak, CARS lazerini hem ileri hem de epi CARS taranmamış dedektörlerle (NDD'ler) birlikte takın (Şekil 2).
- Bölümleri kapak kayması (ters mikroskopi için), dokunun kurumasını önlemek için PBS ve dokuyu örtü kaymasının yakınında tutmak için bir cam ağırlığı olan bir kültür kabına yerleştirin.
- CARS sinyalinin epi yönde toplanmasına ve yamuk cismin medial çekirdeği (MNTB) gibi beyin bölgelerini görüntülemek için ileri yönde 0,55 NA kondenserden toplanmasına hizmet eden 60X, 1,2 NA kızılötesi düzeltilmiş su hedefi ile z-yığınları veya tek görüntüler alın.
- CARS lazer GUI'sini kullanarak CARS görüntülerini yaklaşık 600 mW pompa/prob ve 300 mW Stokes'ta alın. Bu lazer güç değerleri sistem tarafından dahili olarak ölçülür. Her iki lazerin de numune konumundaki güçleri 25 mW'tan azdır ve doku numunesi için güvenlidir.
- Pompa ve Stokes kirişlerini mekansal ve geçici olarak üst üste bindirin. OPO'yu 797,2 nm olarak ayarlayın. Bu, 650 nm'lik bir CARS dalga boyu verir. Daha yüksek enerji seviyesi nedeniyle, zemin durumuna ortaya çıkan geri dönüş, uyarılmaya karşı anti-Stokes'tur (mavi kaydırılmış).
- CARS sinyalini, bandpass filtreleri (640-680 nm) kullanarak epi veya ileri taramasız dedektörlerde yakalayın, ardından immünofloresan etiketinin (bu örnekte floresan olarak etiketlenmiş Nissl) sıralı olarak algılanmasını sağlayın.
NOT: Nissl nöronal soma işaretleyicisi, CARS 640-680 nm bandpass filtresinde yakalanmamıştır ve aşağıda sunulan görüntülerde floresan ve CARS görüntüleme kombinasyonuna izin vermektedir. - CARS ve floresan PMT'leri paylaşmaz. Bu ayarları, beyin bölgesindeki miyelinasyonu seçici olarak görüntülemek için optimal lipit sinyali için kullanın.
DİKKAT: Kullanıcıyı lazer ışınından koruyun
- Görüntüleri, daha fazla niceleme için bir görüntü analiz programına aktarılabilen .oib dosyaları olarak kaydedin (Şekil 3).
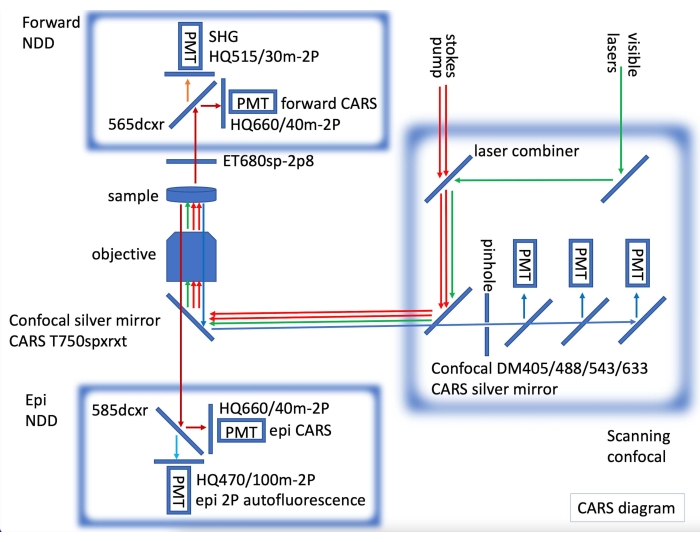
Şekil 2: Bir lazer tarama konfokaline dahil edilen CARS lazerlerini (kırmızı oklar) ve taranmamış (NDD) epi ve ileri algılamayı gösteren CARS cihaz diyagramı. İleri NDD'de, 515 nm'de (turuncu ok) C-H bağları (koyu kırmızı oklar) ve SHG (ikinci harmonik genratioin) için CARS satın aldık. Epi NDD'de, C-H bağları (koyu kırmızı oklar) ve 2PE (iki foton emisyonu) otofloresan (açık mavi ok) için CARS satın aldık. Sırasıyla, floresan konfokal görüntüler elde edilebilir (görünür lazer için yeşil oklar, konfokal algılama için mavi oklar). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
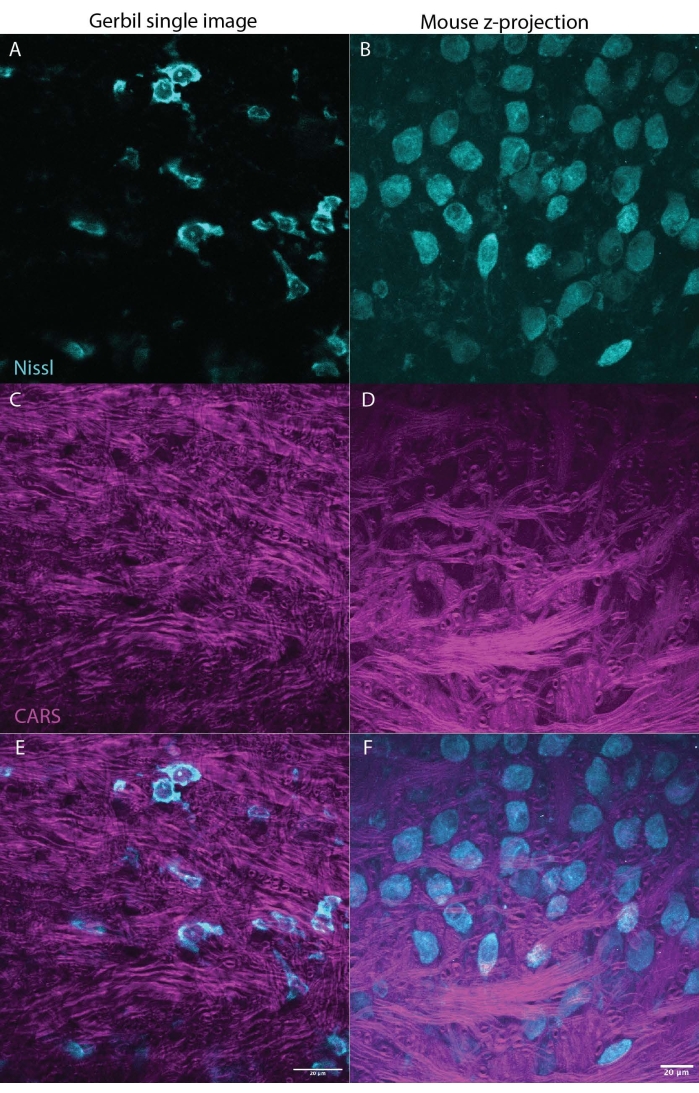
Şekil 3: CARS, beyin dokusundaki (beyin sapı) miyelini (macenta) aydınlatırken, aynı zamanda Nissl (camgöbeği) veya floresan belirteçleri de görüntüleyebilir. İki panel, Moğol gerbili (tek görüntü M. unguiculatus, Şekil 3A, C, E) ve fare (z-stack max projeksiyonu M. musculus, Şekil 2B, D, F) beyninden temsili sonuçlar göstererek, bu tekniğin türler arasında kullanılabileceğini göstermektedir. Şekil 3A,B, camgöbeğinde Nissl'i gösterir, C,D macentadaki CARS sinyalini gösterir, E,F sırasıyla gerbil veya fare için her panelle Nissl ve CARS sinyallerini birleştirir. Her iki görüntü seti de beyin sapındaki yamuk cismin (MNTB) medial çekirdeğinin bir bölümünü göstermektedir. MNTB'deki nöronlar, bir tür dev sinaps27 olan tutulan kalikste sonlanan ağır miyelinli aksonlardan girdiler alırlar. Ölçek çubuğu 20 μm'dir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
CARS mikroskopisinin diğer tekniklere göre en büyük avantajlarından biri, floresan görüntüleme23 ile uyumluluğudur. Şekil 1 , spektrumlarda çok az / hiç örtüşme göstermeyen/hiç örtüşme göstermeyen immünofloresan işaretleyici ile etiketlenmiş Nissl ile karşılaştırıldığında CARS spektrumlarını göstermektedir. Şekil 2 , konfokal mikroskopi ile birlikte CARS için kurulan lazeri göstermektedir. Şekil 3 , biri tek bir yığın ve bir z-yığını maksimum projeksiyonu olarak gerbil ve fareden hem hücre gövdelerini (camgöbeği) hem de miyelin sinyalini (macenta) gösteren CARS görüntüleme kullanılarak elde edilebilecek iki temsili görüntüyü göstermektedir.
Tartışmalar
Giderek artan bir literatür, miyelinin beyin fonksiyonlarındaki rolünü vurgulamaktadır 13,16,21,28. Ayrıca, miyelinasyon kalınlığının ve miyelinasyon paterninin multipl skleroz (29'da gözden geçirildi), yaşlanma (30'da gözden geçirildi), otizm 20,31 ve diğerleri gibi çeşitli nörolojik durumlarda değişebileceğini biliyoruz. Bu nedenle, giderek daha fazla araştırmacının beyin dokuları ve hayvan modelleri arasında, çeşitli tıbbi durumlarda ve giderek artan sayıda deneysel durumda miyelinasyonu değerlendirmesi şaşırtıcı değildir. Beyin dokusunda miyelinasyonu görüntülemek için geleneksel yöntemler arasında antikor etiketlemesi, ardından ışık mikroskobu ve elektron mikroskobu (EM) bulunur. Her iki teknik de zaman alıcıdır ve olası hatalar ve doku kompozisyonundaki değişikliklerle ilişkili çok adımlı doku hazırlama protokolleri gerektirir. Miyelini çok daha hızlı görüntüleme yeteneği nedeniyle benzer sonuçları çok daha hızlı verebilen ve ek floresan ışık mikroskobu ile birleştirilebilen alternatif bir yöntem gösterdik. Önemli olarak, bu teknik, ek belirteçlere veya etiketlere ihtiyaç duymadan beyin dokusundaki lipitleri görüntülemek için kullanılabilir. Bu teknik sadece miyelinin sağlam aksonlar boyunca görüntülenmesine izin vermekle kalmaz, aynı zamanda örneğin multipl skleroz33'te meydana geldiği gösterilen plaklar veya sıvı damlacıklar32 gibi miyelin parçalanma ürünlerinin görüntülenmesine de izin verir.
CARS lazerinin ayarlanma sıklığı, görüntüyü lipitler lehine ağır bir şekilde önyargılı hale getirmek için uygundu, bu da miyelinasyonun genel olarak yüksek kaliteli görüntüleriyle sonuçlandı, çünkü miyelin beyindeki en yaygın lipit bakımından zengin maddedir. Bu tekniğin prensibi, çeşitli frekanslara ayarlanabilen bir CARS lazerinin, CH 2 bağlarını uyarmak için uygun bir frekans olan792.2 nm'ye ayarlanmasıdır. Bunlar, sonunda bir terminal karboksilik asit grubu ile karbon-karbon bağları ile bağlanmış CH2 gruplarının uzun zincirlerini içeren lipitlerde bol miktarda bulunur. Bu frekansa sahip heyecan verici lipitler, daha sonra standart konfokal mikroskop algılama teknolojisi ile görüntülenebilecek bir sinyalle sonuçlandı. Elde edilen görüntülerin kalitesi, bir insan gözlemcisi veya otomatik algoritmalar tarafından yapılabilecek nicel analizleri destekler34. Bununla birlikte, CH2 bağları miyeline özgü olmadığından bu yöntem sadece miyelini etiketlemez ve bu nedenle CARS bir antikorun olacağından daha az spesifiktir. Sonuç olarak, görüntüler miyelin ile ilişkili olmayan bazı etiketler göstermektedir. Daha da önemlisi, bu arka plan etiketi, ölçümlerin kalitesinden veya nicel analizlerin yeteneğinden ödün vermez.
CARS görüntülemenin çözünürlüğü kırınım sınırlıdır ve iki foton mikroskobuna (~ 250 nm) benzer ve bu nedenle EM'ninkinden daha düşüktür. Bu nedenle, örneğin belirli tıbbi durumlarda meydana gelen miyelinasyon kalınlığındaki çok küçük farklılıkları değerlendirmeyi amaçlayan araştırmacıların bu sınırlamanın farkında olmaları gerekir. Küçük bir örneklemdeki ek EM kontrolleri, çözünürlüğün araştırma amaçları için yeterli olduğunu doğrulayabilir.
CARS'ın miyelin görüntülemede en büyük avantajlarından biri, hız ve kolaylığın yanı sıra, etiketsiz lipit görüntülemeyi floresan konfokal mikroskopi ile birleştirme yeteneğidir. CARS için kullanılan mikroskopa bağlı olarak, miyelin görüntülemenin antikor etiketleme, Nissl boyası, floresan proteinleri ifade eden transgenik fare çizgileri veya benzeri ile birleştirilebileceği şekilde iki veya hatta üç ek kanal görüntülenebilir. Daha uzun dalga boylu florofor kullanan potansiyel sınırlamalar çoğunlukla CARS sinyalinin yeşil ve / veya kırmızı floroforların emisyonunu yakalayabilen 640-680 nm bandpass filtreleri aracılığıyla gözlemlenmesidir. Bununla birlikte, CARS uyarımı için kullanılan pikosaniye lazeri, ~ 100 daha az floresana çevrilmiş iki foton uyarımı için kullanılan standart femtosaniye lazerden ~ 10 kat daha az bir tepe darbe enerjisine sahiptir. Dahası, CARS uyarımı için kullanılan 797.2 nm darbeli pikosaniye lazer, görünür floroforların iki foton kesitli absorpsiyonunun zirvesinden spektral olarak uzaktır. Bu nedenle, CARS pikosaniye lazeri, görünür floroforların iki fotonlu uyarımı için çok verimsizdir ve floresan sinyalini CARS algılamasına geçmek için ihmal edilebilir hale getirir. Bununla birlikte, bu, floresan belirteçlere sahip bir numuneye kıyasla herhangi bir floresan etiketine sahip olmayan negatif bir kontrol numunesi görüntülenerek test edilmelidir.
Sonuç olarak, CARS görüntüleme beyin dokusundaki miyelini görüntülemek için uygun bir tekniktir. Çözünürlük standart ışık mikroskobu ile karşılaştırılabilir ve bu nedenle EM'den daha düşük olsa da, hız ve kullanım kolaylığı bu tekniği mevcut yöntemlere çekici bir alternatif haline getirir.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
NIH R01 DC 17924, R01 DC 18401 (Klug) ve NIH 1R15HD105231-01, T32DC012280 ve FRAXA (McCullagh) tarafından desteklenir. CARS görüntüleme, kısmen NIH P30 NS048154 ve NIH P30 DK116073 tarafından desteklenen Colorado Üniversitesi Anschutz Tıp Kampüsü'ndeki Nöroteknoloji Merkezi'nin Gelişmiş Işık Mikroskobu Çekirdeği bölümünde gerçekleştirildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| 1 mL disposable syringe with needle 27 GA x 0.5" | Exel int | 260040 | |
| Fatal + | Vortech | ||
| Surgery: | |||
| Spring Scissors - 8mm Cutting Edge | Fine Science Tools | 15024-10 | |
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Perfusion: | |||
| 4% Paraformaldehyde | Fisher Chemical | SF994 (CS) | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Kelly hemostats | Fine Science Tools | 13019-14 | |
| Millipore H2O | |||
| Needle tip, 23 GA x 1" | BD precision glide | 305193 | |
| Phosphate buffered saline (PBS): | |||
| Potassium chloride | Sigma | P9333 | |
| Potassium phosphate monobase | Sigma | P5655 | |
| pump with variable flow or equivalent | |||
| Sodium chloride | Fisher Chemical | s271-1 | |
| Sodiumphosphate dibasic | Sigma | S7907 | |
| Dissection: | |||
| 50 mL vial with 4% PFA | |||
| Bochem Chemical Spoon 180mm | Bochem | 230331000 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Noyes Spring Scissors | Fine Science Tools | 15011-12 | |
| Pair of fine (Graefe) tweezers | Fine Science Tools | 11050-10 | |
| Shallow glass or plastic tray, approximately 10" x 10" | |||
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Surgical Scissors - Blunt | Fine Science Tools | 14000-20 | |
| Slicing: | |||
| Agar, plant | RPI | 9002-18-0 | |
| Vibratome | Leica | VT1000s | |
| well plate | Alkali Sci. | TPN1048-NT | |
| Staining: | |||
| AB Media: | 1n 1,000 mL of Millipore H2O | ||
| Phosphate buffered (PB): | |||
| Potassium Phosphate Monobase | Sigma | P5655 | |
| Sodium Phosohate Dibasic | Sigma | S7907 | |
| BSA (Bovine serum albumin) | Sigma life science | A2153-100g | |
| Sodium Chloride | Fisher Chemical | s271-1 | |
| Triton X-100 | Sigma - Aldrich | x100-500ml | |
| Nissl 435/455 | Invitrogen | N21479 | |
| CARS: | |||
| APE picoemerald laser | Angewandte Physik & Elektronik GmbH | ||
| bandpass filter (420-520 nm) | Chroma Technology | HQ470/100m-2P | |
| bandpass filter (500-530 nm) | Chroma Technology | HQ515/30m-2P | |
| bandpass filters (640-680 nm) | Chroma Technology | HQ660/40m-2P | |
| Confocal microscope | Olympus | FV1000 | |
| Cut Transfer pipet | Fisher | 13-711-7M | |
| dichroic longpass 565 nm | Chroma Technology | 565dcxr | |
| dichroic longpass 585 nm | Chroma Technology | 585dcxr | |
| dichroic shortpass 750 nm | Chroma Technology | T750spxrxt | |
| glass bottom culture dish | MatTek | P35G-0-10-C | |
| glass weight (10 mm x 10 mm boro rod) | Allen Scientific Glass Inc | ||
| multiphoton shortpass emission filter 680 nm | Chroma Technology | ET680sp-2p8 | |
| PBS |
Referanslar
- Cole, K., Curtis, H. Electric impedance of the squid giant axon during activity. The Journal of General Physiology. 22 (5), 649-670 (1939).
- Cole, K. S., Curtis, H. J. Membrane potential of the squid giant axon during current flow. Journal of General Physiology. 24 (4), 551-563 (1941).
- Alcami, P., El Hady, A. Axonal computations. Frontiers in Cellular Neuroscience. 13, 413(2019).
- Neumann, E., Nachmansohn, D. Nerve excitability-Toward an integrating concept. Aharon Katzir Memorial Volume. , 99-166 (1975).
- Waxman, S. G. Integrative properties and design principles of axons. International Review of Neurobiology. 18, 1-40 (1975).
- Fitzhugh, R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophysical Journal. 2 (1), 11-21 (1962).
- Zalc, B. The acquisition of myelin: a success story. Novartis Foundation Symposium. 276, 275-281 (2006).
- Salzer, J. L., Zalc, B. Myelination. Current Biology. 26 (20), 971-975 (2016).
- Boullerne, A. I. The history of myelin. Experimental Neurology. 283, 431-445 (2016).
- Kuhn, S., Gritti, L., Crooks, D., Dombrowski, Y. Oligodendrocytes in development, myelin generation and beyond. Cells. 8 (11), 1424(2019).
- Saab, A. S., Nave, K. -A. Myelin dynamics: protecting and shaping neuronal functions. Current Opinion in Neurobiology. 47, 104-112 (2017).
- Chomiak, T., Hu, B. What is the optimal value of the g-Ratio for myelinated fibers in the rat CNS? A theoretical approach. PLOS ONE. 4 (11), 7754(2009).
- Ford, M. C., et al. Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications. 6, 8073(2015).
- Stange-Marten, A., et al. Input timing for spatial processing is precisely tuned via constant synaptic delays and myelination patterns in the auditory brainstem. Proceedings of the National Academy of Sciences of the United States of America. 114 (24), 4851-4858 (2017).
- Bu, J., Banki, A., Wu, Q., Nishiyama, A. Increased NG2+ glial cell proliferation and oligodendrocyte generation in the hypomyelinating mutant shiverer. Glia. 48 (1), 51-63 (2004).
- Pacey, L. K. K., et al. Delayed myelination in a mouse model of fragile X syndrome. Human Molecular Genetics. 22 (19), 3920-3930 (2013).
- Green, A. J., et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet. 390 (10111), London, England. 2481-2489 (2017).
- Jeon, S. J., Ryu, J. H., Bahn, G. H. Altered translational control of fragile X mental retardation protein on myelin proteins in neuropsychiatric disorders. Biomolecules & Therapeutics. 25 (3), 231-238 (2017).
- Barak, B., et al. Neuronal deletion of Gtf2i, associated with Williams syndrome, causes behavioral and myelin alterations rescuable by a remyelinating drug. Nature Neuroscience. 22 (5), 700-708 (2019).
- Phan, B. N., et al. A myelin-related transcriptomic profile is shared by Pitt-Hopkins syndrome models and human autism spectrum disorder. Nature Neuroscience. 23 (3), 375-385 (2020).
- Lucas, A., Poleg, S., Klug, A., McCullagh, E. A. Myelination deficits in the auditory brainstem of a mouse model of fragile X syndrome. Frontiers in Neuroscience. 15, 1536(2021).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. -X. Coherent anti-stokes raman scattering imaging of axonal myelin in live spinal ttissues. Biophysical Journal. 89 (1), 581-591 (2005).
- Kim, S. -H., et al. Multiplex coherent anti-stokes raman spectroscopy images intact atheromatous lesions and concomitantly identifies distinct chemical profiles of atherosclerotic lipids. Circulation Research. 106 (8), 1332-1341 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Tu, L., et al. Free-floating Immunostaining of Mouse Brains. Journal of Visualized Experiments. (176), e62876(2021).
- Fluorescence SpectraViewer. , Available from: https://www.thermofisher.com/order/fluorescence-spectraviewer (2022).
- Held, H. Die centrale gehörleitung. Arch Anat Physiol Anat Abt. 17, 201-248 (1893).
- Sherman, D. L., Brophy, P. J. Mechanisms of axon ensheathment and myelin growth. Nature Reviews Neuroscience. 6 (9), 683-690 (2005).
- Gruchot, J., et al. The molecular basis for remyelination failure in multiple sclerosis. Cells. 8 (8), 825(2019).
- Rivera, A. D., et al. Epidermal growth factor pathway in the age-related decline of oligodendrocyte regeneration. Frontiers in Cellular Neuroscience. 16, 838007(2022).
- Kútna, V., O'Leary, V. B., Hoschl, C., Ovsepian, S. V. Cerebellar demyelination and neurodegeneration associated with mTORC1 hyperactivity may contribute to the developmental onset of autism-like neurobehavioral phenotype in a rat model. Autism Research: Official Journal of the International Society for Autism Research. 15 (5), 791-805 (2022).
- Ozsvár, A., et al. Quantitative analysis of lipid debris accumulation caused by cuprizone induced myelin degradation in different CNS areas. Brain Research Bulletin. 137, 277-284 (2018).
- Prineas, J. W., Graham, J. S. Multiple sclerosis: capping of surface immunoglobulin G on macrophages engaged in myelin breakdown. Annals of Neurology. 10 (2), 149-158 (1981).
- Bégin, S., et al. Automated method for the segmentation and morphometry of nerve fibers in large-scale CARS images of spinal cord tissue. Biomedical Optics Express. 5 (12), 4145-4161 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır