Method Article
Application cohérente de spectroscopie Raman anti-Stokes (CARS) pour l’imagerie de la myélinisation dans les tranches de cerveau
Dans cet article
Résumé
La visualisation de la myélinisation est un objectif important pour de nombreux chercheurs qui étudient le système nerveux. CARS est une technique compatible avec l’immunofluorescence qui permet d’imager nativement les lipides dans les tissus tels que le cerveau éclairant des structures spécialisées telles que la myéline.
Résumé
La spectroscopie Raman anti-Stokes cohérente (CARS) est une technique classiquement employée par les chimistes et les physiciens pour produire un signal cohérent des vibrations de signature des molécules. Cependant, ces signatures vibratoires sont également caractéristiques des molécules dans le tissu anatomique tels que le cerveau, ce qui les rend de plus en plus utiles et applicables pour les applications en neurosciences. Par exemple, CARS peut mesurer les lipides en activant spécifiquement des liaisons chimiques au sein de ces molécules, ce qui permet de quantifier différents aspects des tissus, tels que la myéline impliquée dans la neurotransmission. En outre, par rapport à d’autres techniques généralement utilisées pour quantifier la myéline, CARS peut également être configuré pour être compatible avec les techniques d’immunofluorescence, permettant le comarquage avec d’autres marqueurs tels que les canaux sodiques ou d’autres composants de la transmission synaptique. Les changements de myélinisation sont un mécanisme intrinsèquement important dans la démyélinisation de maladies telles que la sclérose en plaques ou d’autres affections neurologiques telles que le syndrome de l’X fragile ou les troubles du spectre autistique est un domaine de recherche émergent. En conclusion, CARS peut être utilisé de manière innovante pour répondre à des questions urgentes en neurosciences et fournir des preuves de mécanismes sous-jacents liés à de nombreuses affections neurologiques différentes.
Introduction
Les potentiels d’action sont l’unité de base de l’information dans le cerveau, et la propagation du potentiel d’action à travers les axones constitue un pilier du traitement de l’information 1,2,3. Les neurones reçoivent généralement des entrées afférentes de plusieurs autres neurones et intègrent ces entrées dans une fenêtre temporelle étroitedonnée 4,5. Par conséquent, les mécanismes d’action de propagation potentielle dans les axones ont reçu une attention importante de la part des chercheurs.
Lors de la propagation à travers un axone, un potentiel d’action est régénéré à plusieurs reprises le long de l’axone pour assurer une propagation fiable6. Dans la plupart des neurones des vertébrés à mâchoires (gnathostomes), les axones sont entourés d’une gaine de myéline, qui est une substance riche en lipides produite par les oligodendrocytes voisins ou les cellules de Schwann, qui sont des types de cellules gliales (revue dans 7,8). Cette gaine de myéline isole électriquement l’axone, réduisant sa capacité et permettant une propagation du potentiel d’action efficacement, rapidement et avec une consommation d’énergie réduite. La myéline ne couvre pas l’axone uniformément, mais elle gaine l’axone dans des segments qui ont de courts espaces entre eux, appelés les nœuds de Ranvier (examiné dans 9,10). L’épaisseur de myélinisation, qui contrôle le niveau d’isolation électrique d’un axone, et l’espacement des nœuds de Ranvier, qui contrôlent la fréquence à laquelle les potentiels d’action sont régénérés le long d’un axone, influencent la vitesse de propagation du potentiel d’action (revue en11).
Il existe un grand nombre de littérature suggérant que l’épaisseur de myélinisation affecte la vitesse de propagation du potentiel d’action dans les axones12,13,14. De plus, les altérations de la myélinisation axonale peuvent entraîner un certain nombre de déficits du SNC 15,16,17,18,19,20,21. Il n’est donc pas surprenant que de nombreux efforts de recherche portent sur la mesure et la caractérisation de la myélinisation axonale. Les mesures de l’épaisseur de la myéline ont le plus souvent été effectuées par microscopie électronique, une technique qui nécessite une quantité importante de préparation tissulaire et qui est difficile à utiliser en combinaison avec l’immunohistochimie. Cependant, il existe également une technique plus rapide et plus simple pour mesurer la myélinisation axonale qui est basée sur la spectroscopie Raman anti-Stokes cohérente (CARS). Un laser CARS peut être réglé sur différentes fréquences et lorsqu’il est accordé à des fréquences adaptées à l’excitation des lipides, la myéline peut être imagée sans avoir besoin d’étiquettes supplémentaires22. L’imagerie lipidique peut être combinée avec l’immunohistochimie standard de sorte que les lipides peuvent être imagés avec plusieurs canaux fluorescents23. L’imagerie de la myélinisation avec CARS est significativement plus rapide que la microscopie électronique et a une résolution qui, bien que inférieure à EM, est suffisante pour détecter même de petites différences de myélinisation dans le même type d’axones.
Protocole
Toutes les expériences étaient conformes à toutes les lois applicables, aux directives des National Institutes of Health et ont été approuvées par le comité institutionnel de soin et d’utilisation des animaux Anschutz de l’Université du Colorado.
1. Animaux
- Utilisez des souris C57BL / 6J (stock #000664) (Mus musculus) obtenues du Jackson Laboratory ou des gerbilles de Mongolie (Meriones unguiculatus) obtenues à l’origine de Charles River.
2. Préparation des tissus
- Pour la perfusion transcardique, surdoser les espèces de rongeurs d’intérêt avec le pentobarbital (120 mg/kg de poids corporel) et les perfuser par voie transcardique avec une solution saline tamponnée au phosphate (PBS; 137 mM NaCl, 2,7 mM KCl, 1,76 mM KH2PO 4, 10 mMNa2HPO 4) suivi de4% de paraformaldéhyde (PFA)24.
- Plus précisément, ouvrez l’abdomen et la cage thoracique à l’aide de ciseaux et maintenez la cage thoracique en place avec des pinces hémostatiques Kelly pour exposer le cœur.
- Insérez une aiguille de 23 GA reliée à une pompe de perfusion dans le ventricule gauche et coupez rapidement l’oreillette droite à l’aide de fins ciseaux.
- Administrer PBS à travers la pompe de perfusion et l’aiguille dans le cœur pendant 10 minutes pour nettoyer le cerveau et le corps du sang.
- Basculez la pompe de perfusion à 4% PFA pendant 10 minutes et vérifiez la rigidité des membres et de la queue pour confirmer la réussite de la perfusion.
- Après la perfusion, décapitez les animaux et retirez leur cerveau du crâne. Gardez le cerveau pendant la nuit dans 4% PFA avant de transférer vers PBS. Incorporer les troncs cérébraux dans de l’agarose à 4 % (dans PBS) et trancher coronalement à l’aide d’un vibratome de 200 μm d’épaisseur.
3. Coloration
- Colorer des sections flottantes pour Nissl, pour visualiser les corps cellulaires (1:100), dans des milieux anticorps (milieu AB : tampon phosphate 0,1 M (PB : 50 mM KH2PO 4, 150 mMNa2HPO4), 150 mM NaCl, 3 mM Triton-X, 1% albumine sérique bovine (BSA)) pendant 30 min à température ambiante sur un agitateur de laboratoire standard25.
- Protéger les sections de la lumière à l’aide d’une feuille d’aluminium et/ou d’un couvercle. Les longueurs d’onde de 550 nm ou moins sont compatibles avec l’imagerie CARS (Figure 1).
REMARQUE : Bien que nous ne nous attendions pas à ce que Triton-X ou d’autres réactifs aient un impact sur l’imagerie CARS des lipides, des contrôles supplémentaires avec des milieux d’anticorps spécifiques peuvent être justifiés.
- Protéger les sections de la lumière à l’aide d’une feuille d’aluminium et/ou d’un couvercle. Les longueurs d’onde de 550 nm ou moins sont compatibles avec l’imagerie CARS (Figure 1).
- POINT DE PAUSE: Stockez les sections flottantes (à l’abri de la lumière) dans PBS jusqu’à l’imagerie. Une fois sectionnée, imagez les sections du cerveau dans les 2 semaines.

Figure 1 : L’imagerie CARS peut être combinée à l’imagerie immunofluorescente. Les graphiques montrent que l’imagerie CARS se produit à 660/640 nm de spectre de signal rouge26. Cette longueur d’onde est suffisamment éloignée de la gamme verte, bleue ou UV, ce qui permet de combiner le signal CARS avec l’immunofluorescence dans ces gammes. Plus précisément, le graphique indique également l’excitation et l’émission de Nissl marqué avec du fluorophore bleu, qui a été combiné avec CARS lors de la collecte de résultats représentatifs pour cette publication. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Imagerie
REMARQUE: La configuration laser CARS contient un laser à fibre qui fournit l’horloge 80 MHz et un laser OPO (Optical Parametric Oscillator) avec une plage accordable de 770-990 nm avec le faisceau Stokes fixé à 1031 nm, qui sont nécessaires pour collecter le signal CARS. Il y a une ouverture pour les deux faisceaux.
- Avant d’apporter des échantillons au microscope, allumez et réchauffez le laser CARS pendant au moins 1 heure, alignez le laser CARS et Koehler l’optique du condensateur et le diaphragme du microscope pour l’imagerie CARS vers l’avant.
REMARQUE: Cette étape est essentielle au bon fonctionnement de la microscopie CARS.- Pour l’alignement spatial des deux faisceaux laser (pompe et stokes), accédez aux deux PSD internes (détecteurs sensibles à la position) via l’interface graphique laser CARS.
- Obtenez un alignement temporel en utilisant la fonction de retard de l’interface graphique laser CARS, qui peut aider à chevaucher les impulsions des deux lasers (pompe et stokes) qui ont des dispersions différentes en raison de leurs longueurs d’onde différentes. Par conséquent, le chevauchement temporel et spatial des faisceaux de la pompe et des attisés se fait avec l’entrée de l’utilisateur via l’interface graphique.
- Ajustez le périscope externe (les deux derniers miroirs de la configuration) pour centrer les deux lasers superposés spatialement sur les miroirs de tête de balayage du microscope.
- Pour une meilleure détection non numérisée CARS vers l’avant, assurez-vous que le condenseur est Koehler-ed (ce qui signifie que le condenseur est centré et focalisé sur le diaphragme pour obtenir un éclairage uniforme)
- Pour l’imagerie confocale par immunofluorescence et l’imagerie CARS, équiper le laser CARS de détecteurs non décantés (NDD) CARS directs et épi, en incorporant un microscope confocal équipé de lasers visibles pour l’imagerie par fluorescence (Figure 2).
- Placez les sections dans une boîte de culture avec une lamelle de couverture (pour la microscopie inversée), du PBS pour éviter le dessèchement des tissus et un poids en verre pour garder le tissu près de la lamelle de couverture.
- Prenez des piles z ou des images uniques avec un objectif d’eau corrigé infrarouge 60X, 1,2 NA, qui sert à recueillir le signal CARS dans la direction épi et à travers un condensateur 0,55 NA dans la direction avant pour l’imagerie des zones cérébrales telles que le noyau médian du corps trapézoïdal (MNTB).
- Prenez les images CARS à environ 600 mW de pompe/sonde et 300 mW de Stokes, en utilisant l’interface graphique laser CARS. Ces valeurs de puissance laser sont mesurées en interne par le système. Les puissances des deux lasers à l’emplacement de l’échantillon sont inférieures à 25 mW et sans danger pour l’échantillon de tissu.
- Chevauchez la pompe et les faisceaux de Stokes dans l’espace et dans le temps. Réglez l’OPO sur 797,2 nm. Cela donne une longueur d’onde CARS de 650 nm. En raison du niveau d’énergie plus élevé, le retour résultant à l’état fondamental est anti-Stokes (décalé vers le bleu) à l’excitation.
- Capturer le signal CARS dans des détecteurs épi ou avant non numérisés à l’aide de filtres passe-bande (640-680 nm) suivis d’une détection séquentielle de l’étiquette d’immunofluorescence (dans ce cas, marquée par fluorescence Nissl).
REMARQUE: Le marqueur neuronal soma de Nissl n’est pas capturé dans le filtre passe-bande CARS 640-680 nm, ce qui permet la combinaison de la fluorescence et de l’imagerie CARS dans les images présentées ci-dessous. - Le CARS et la fluorescence ne partagent pas les PMT. Utilisez ces paramètres pour un signal lipidique optimal afin d’imager sélectivement la myélinisation dans la région du cerveau.
ATTENTION : Protéger l’utilisateur du faisceau laser
- Enregistrez les images en tant que fichiers .oib, qui peuvent être importés dans un programme d’analyse d’images pour une quantification plus poussée (Figure 3).
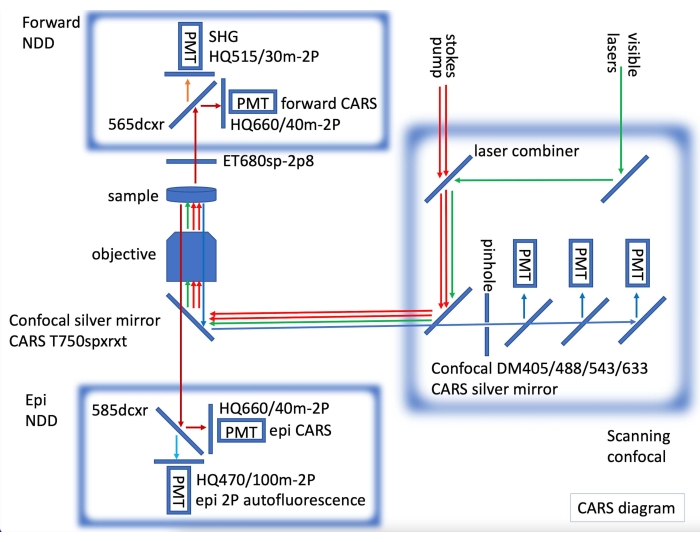
Figure 2 : Diagramme de l’instrument CARS montrant les lasers CARS (flèches rouges) et l’épi non numérisé (NDD) et la détection directe incorporés sur un confocal à balayage laser. Dans NDD avant, nous acquérons CARS pour les liaisons C-H (flèches rouge foncé) et SHG (deuxième génératioine harmonique) à 515 nm (flèche orange). Dans epi NDD, nous acquérons CARS pour les liaisons C-H (flèches rouge foncé) et l’autofluorescence 2PE (émission de deux photons) (flèche bleu clair). Séquentiellement, des images confocales de fluorescence peuvent être acquises (flèches vertes pour le laser visible, flèches bleues pour la détection confocale). Veuillez cliquer ici pour voir une version agrandie de cette figure.
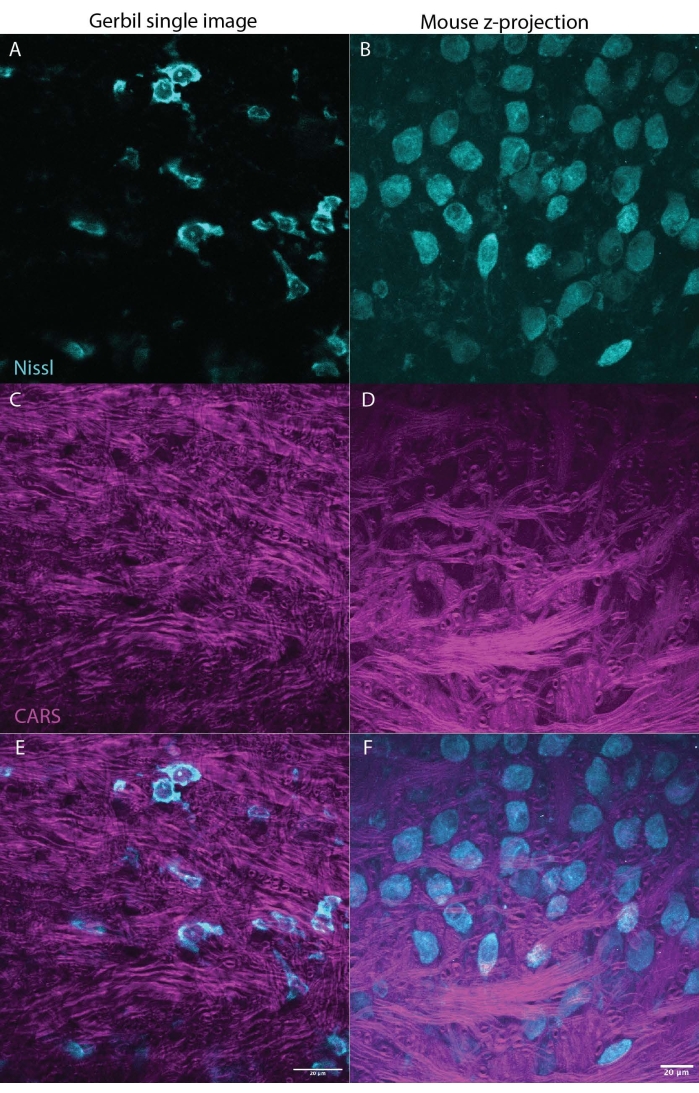
Figure 3 : CARS peut illuminer la myéline (magenta) dans les tissus cérébraux (tronc cérébral) tout en imageant des marqueurs Nissl (cyan) ou fluorescents. Les deux panneaux montrent des résultats représentatifs d’un cerveau de gerbille mongole (image unique M. unguiculatus, Figure 3A, C, E) et de souris (projection maximale z-stack M. musculus, Figure 2B, D, F), indiquant que cette technique peut être utilisée à travers les espèces. La figure 3A, B montrant Nissl en cyan, C, D montrant le signal CARS en magenta, E, F combinent les signaux Nissl et CARS avec chaque panneau pour gerbille ou souris, respectivement. Les deux séries d’images montrent une section du noyau médian du corps trapézoïdal (MNTB) dans le tronc cérébral. Les neurones du MNTB reçoivent des entrées d’axones fortement myélinisés, qui se terminent dans le calice de held, un type de synapse géante27. La barre d’échelle est de 20 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
L’un des plus grands avantages de la microscopie CARS par rapport aux autres techniques est la compatibilité avec l’imagerie fluorescente23. La figure 1 montre les spectres CARS par rapport à Nissl marqués avec un marqueur immunofluorescent montrant peu ou pas de chevauchement dans les spectres. La figure 2 illustre la configuration laser de CARS en combinaison avec la microscopie confocale. La figure 3 montre deux images représentatives, l’une sous forme de pile unique et l’autre sous forme de projection z-stack max de gerbille et de souris qui pourrait être obtenue à l’aide de l’imagerie CARS montrant à la fois le corps cellulaire (cyan) et le signal de myéline (magenta).
Discussion
Un nombre croissant de littérature souligne le rôle de la myéline dans le fonctionnement du cerveau 13,16,21,28. De plus, nous savons que l’épaisseur et le modèle de myélinisation peuvent changer dans plusieurs affections neurologiques telles que la sclérose en plaques (examinée dans29), le vieillissement (revue dans 30), l’autisme20, 31 et bien d’autres. Il n’est donc pas surprenant que de plus en plus de chercheurs aient besoin d’évaluer la myélinisation à travers les tissus cérébraux et les modèles animaux, dans plusieurs conditions médicales et dans un nombre croissant de situations expérimentales. Les méthodes traditionnelles de myélinisation par imagerie dans les tissus cérébraux comprennent le marquage des anticorps suivi de la microscopie optique et de la microscopie électronique (EM). Les deux techniques prennent beaucoup de temps et nécessitent des protocoles de préparation tissulaire en plusieurs étapes, qui sont associés à des erreurs et des changements possibles dans la composition des tissus. Nous avons démontré une méthode alternative qui peut donner des résultats similaires beaucoup plus rapidement en raison de la capacité d’imager la myéline beaucoup plus rapidement, et qui peut être combinée avec une microscopie optique à fluorescence supplémentaire. Il est important de noter que cette technique peut être utilisée pour imager les lipides dans les tissus cérébraux sans avoir besoin de marqueurs ou d’étiquettes supplémentaires. Cette technique permet non seulement l’imagerie de la myéline le long des axones intacts, mais elle permet également l’imagerie des produits de dégradation de la myéline tels que les plaques ou les gouttelettes liquides32, dont il a été démontré, par exemple, qu’ils se produisaient dans la sclérose en plaques33.
La fréquence à laquelle le laser CARS a été réglé était appropriée pour biaiser fortement l’image en faveur des lipides, ce qui a donné des images globales de haute qualité de la myélinisation, puisque la myéline est de loin la substance riche en lipides la plus courante dans le cerveau. Le principe de cette technique est qu’un laser CARS, qui peut être accordé à différentes fréquences, est accordé à 792,2 nm, ce qui est une fréquence adaptée pour exciter les liaisonsCH2 . Ceux-ci sont abondants en lipides, qui contiennent de longues chaînes de groupesCH2 liées par des liaisons carbone-carbone avec un groupe acide carboxylique terminal à la fin. Des lipides excitants avec cette fréquence ont abouti à un signal qui a ensuite pu être imagé avec la technologie standard de détection au microscope confocal. La qualité des images résultantes permet des analyses quantitatives qui peuvent être effectuées par un observateur humain ou des algorithmes automatisés34. Cependant, cette méthode ne marque pas exclusivement la myéline puisque les liaisons CH2 ne sont pas exclusives à la myéline, et donc CARS est moins spécifique qu’un anticorps le serait. En conséquence, les images montrent une étiquette, qui n’est pas associée à la myéline. Il est important de noter que cette étiquette de fond ne compromet pas la qualité des mesures ou la capacité des analyses quantitatives.
La résolution de l’imagerie CARS est limitée par diffraction et similaire à la microscopie à deux photons (~250 nm) et donc inférieure à celle de l’EM. Par conséquent, les chercheurs qui visent à évaluer de très petites différences dans l’épaisseur de la myélinisation lorsqu’elle se produit, par exemple, dans certaines conditions médicales, doivent être conscients de cette limitation. Des contrôles EM supplémentaires dans un petit échantillon peuvent confirmer que la résolution est suffisante pour leur objectif de recherche.
Un avantage majeur de CARS pour l’imagerie de la myéline, outre la rapidité et la facilité, est la possibilité de combiner l’imagerie lipidique sans marquage avec la microscopie confocale à fluorescence. Selon le microscope utilisé pour CARS, deux ou même trois canaux supplémentaires peuvent être imagés de sorte que l’imagerie de la myéline peut être combinée avec le marquage des anticorps, la coloration Nissl, les lignées de souris transgéniques exprimant des protéines fluorescentes, ou similaire. Les limitations potentielles de l’utilisation de fluorophores de plus grande longueur d’onde sont principalement dues au fait que le signal CARS est observé à travers des filtres passe-bande de 640 à 680 nm qui peuvent capter l’émission de fluorophores verts et / ou rouges. Cependant, le laser picoseconde utilisé pour l’excitation CARS a une énergie d’impulsion maximale de ~10 fois inférieure au laser femtoseconde standard utilisé pour l’excitation à deux photons, traduite en ~100 fluorescence en moins. De plus, le laser picoseconde à impulsions de 797,2 nm utilisé pour l’excitation CARS est spectralement loin du pic d’absorption de la section efficace à deux photons des fluorophores visibles. Par conséquent, le laser picoseconde CARS est très inefficace pour l’excitation à deux photons des fluorophores visibles, ce qui rend le signal fluorescent négligeable pour le passage dans la détection CARS. Cependant, cela devrait être testé en imageant un échantillon témoin négatif qui n’a pas d’étiquettes fluorescentes par rapport à un échantillon avec des marqueurs fluorescents.
En conclusion, l’imagerie CARS est une technique appropriée pour imager la myéline dans les tissus cérébraux. Bien que la résolution soit comparable à la microscopie optique standard et donc inférieure à l’EM, la vitesse et la facilité d’utilisation font de cette technique une alternative attrayante aux méthodes existantes.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Pris en charge par NIH R01 DC 17924, R01 DC 18401 (Klug) et NIH 1R15HD105231-01, T32DC012280 et FRAXA (McCullagh). L’imagerie CARS a été réalisée dans la partie centrale de microscopie optique avancée du Centre de neurotechnologie du campus médical Anschutz de l’Université du Colorado, soutenue en partie par NIH P30 NS048154 et NIH P30 DK116073.
matériels
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| 1 mL disposable syringe with needle 27 GA x 0.5" | Exel int | 260040 | |
| Fatal + | Vortech | ||
| Surgery: | |||
| Spring Scissors - 8mm Cutting Edge | Fine Science Tools | 15024-10 | |
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Perfusion: | |||
| 4% Paraformaldehyde | Fisher Chemical | SF994 (CS) | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Kelly hemostats | Fine Science Tools | 13019-14 | |
| Millipore H2O | |||
| Needle tip, 23 GA x 1" | BD precision glide | 305193 | |
| Phosphate buffered saline (PBS): | |||
| Potassium chloride | Sigma | P9333 | |
| Potassium phosphate monobase | Sigma | P5655 | |
| pump with variable flow or equivalent | |||
| Sodium chloride | Fisher Chemical | s271-1 | |
| Sodiumphosphate dibasic | Sigma | S7907 | |
| Dissection: | |||
| 50 mL vial with 4% PFA | |||
| Bochem Chemical Spoon 180mm | Bochem | 230331000 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Noyes Spring Scissors | Fine Science Tools | 15011-12 | |
| Pair of fine (Graefe) tweezers | Fine Science Tools | 11050-10 | |
| Shallow glass or plastic tray, approximately 10" x 10" | |||
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Surgical Scissors - Blunt | Fine Science Tools | 14000-20 | |
| Slicing: | |||
| Agar, plant | RPI | 9002-18-0 | |
| Vibratome | Leica | VT1000s | |
| well plate | Alkali Sci. | TPN1048-NT | |
| Staining: | |||
| AB Media: | 1n 1,000 mL of Millipore H2O | ||
| Phosphate buffered (PB): | |||
| Potassium Phosphate Monobase | Sigma | P5655 | |
| Sodium Phosohate Dibasic | Sigma | S7907 | |
| BSA (Bovine serum albumin) | Sigma life science | A2153-100g | |
| Sodium Chloride | Fisher Chemical | s271-1 | |
| Triton X-100 | Sigma - Aldrich | x100-500ml | |
| Nissl 435/455 | Invitrogen | N21479 | |
| CARS: | |||
| APE picoemerald laser | Angewandte Physik & Elektronik GmbH | ||
| bandpass filter (420-520 nm) | Chroma Technology | HQ470/100m-2P | |
| bandpass filter (500-530 nm) | Chroma Technology | HQ515/30m-2P | |
| bandpass filters (640-680 nm) | Chroma Technology | HQ660/40m-2P | |
| Confocal microscope | Olympus | FV1000 | |
| Cut Transfer pipet | Fisher | 13-711-7M | |
| dichroic longpass 565 nm | Chroma Technology | 565dcxr | |
| dichroic longpass 585 nm | Chroma Technology | 585dcxr | |
| dichroic shortpass 750 nm | Chroma Technology | T750spxrxt | |
| glass bottom culture dish | MatTek | P35G-0-10-C | |
| glass weight (10 mm x 10 mm boro rod) | Allen Scientific Glass Inc | ||
| multiphoton shortpass emission filter 680 nm | Chroma Technology | ET680sp-2p8 | |
| PBS |
Références
- Cole, K., Curtis, H. Electric impedance of the squid giant axon during activity. The Journal of General Physiology. 22 (5), 649-670 (1939).
- Cole, K. S., Curtis, H. J. Membrane potential of the squid giant axon during current flow. Journal of General Physiology. 24 (4), 551-563 (1941).
- Alcami, P., El Hady, A. Axonal computations. Frontiers in Cellular Neuroscience. 13, 413(2019).
- Neumann, E., Nachmansohn, D. Nerve excitability-Toward an integrating concept. Aharon Katzir Memorial Volume. , 99-166 (1975).
- Waxman, S. G. Integrative properties and design principles of axons. International Review of Neurobiology. 18, 1-40 (1975).
- Fitzhugh, R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophysical Journal. 2 (1), 11-21 (1962).
- Zalc, B. The acquisition of myelin: a success story. Novartis Foundation Symposium. 276, 275-281 (2006).
- Salzer, J. L., Zalc, B. Myelination. Current Biology. 26 (20), 971-975 (2016).
- Boullerne, A. I. The history of myelin. Experimental Neurology. 283, 431-445 (2016).
- Kuhn, S., Gritti, L., Crooks, D., Dombrowski, Y. Oligodendrocytes in development, myelin generation and beyond. Cells. 8 (11), 1424(2019).
- Saab, A. S., Nave, K. -A. Myelin dynamics: protecting and shaping neuronal functions. Current Opinion in Neurobiology. 47, 104-112 (2017).
- Chomiak, T., Hu, B. What is the optimal value of the g-Ratio for myelinated fibers in the rat CNS? A theoretical approach. PLOS ONE. 4 (11), 7754(2009).
- Ford, M. C., et al. Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications. 6, 8073(2015).
- Stange-Marten, A., et al. Input timing for spatial processing is precisely tuned via constant synaptic delays and myelination patterns in the auditory brainstem. Proceedings of the National Academy of Sciences of the United States of America. 114 (24), 4851-4858 (2017).
- Bu, J., Banki, A., Wu, Q., Nishiyama, A. Increased NG2+ glial cell proliferation and oligodendrocyte generation in the hypomyelinating mutant shiverer. Glia. 48 (1), 51-63 (2004).
- Pacey, L. K. K., et al. Delayed myelination in a mouse model of fragile X syndrome. Human Molecular Genetics. 22 (19), 3920-3930 (2013).
- Green, A. J., et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet. 390 (10111), London, England. 2481-2489 (2017).
- Jeon, S. J., Ryu, J. H., Bahn, G. H. Altered translational control of fragile X mental retardation protein on myelin proteins in neuropsychiatric disorders. Biomolecules & Therapeutics. 25 (3), 231-238 (2017).
- Barak, B., et al. Neuronal deletion of Gtf2i, associated with Williams syndrome, causes behavioral and myelin alterations rescuable by a remyelinating drug. Nature Neuroscience. 22 (5), 700-708 (2019).
- Phan, B. N., et al. A myelin-related transcriptomic profile is shared by Pitt-Hopkins syndrome models and human autism spectrum disorder. Nature Neuroscience. 23 (3), 375-385 (2020).
- Lucas, A., Poleg, S., Klug, A., McCullagh, E. A. Myelination deficits in the auditory brainstem of a mouse model of fragile X syndrome. Frontiers in Neuroscience. 15, 1536(2021).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. -X. Coherent anti-stokes raman scattering imaging of axonal myelin in live spinal ttissues. Biophysical Journal. 89 (1), 581-591 (2005).
- Kim, S. -H., et al. Multiplex coherent anti-stokes raman spectroscopy images intact atheromatous lesions and concomitantly identifies distinct chemical profiles of atherosclerotic lipids. Circulation Research. 106 (8), 1332-1341 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Tu, L., et al. Free-floating Immunostaining of Mouse Brains. Journal of Visualized Experiments. (176), e62876(2021).
- Fluorescence SpectraViewer. , Available from: https://www.thermofisher.com/order/fluorescence-spectraviewer (2022).
- Held, H. Die centrale gehörleitung. Arch Anat Physiol Anat Abt. 17, 201-248 (1893).
- Sherman, D. L., Brophy, P. J. Mechanisms of axon ensheathment and myelin growth. Nature Reviews Neuroscience. 6 (9), 683-690 (2005).
- Gruchot, J., et al. The molecular basis for remyelination failure in multiple sclerosis. Cells. 8 (8), 825(2019).
- Rivera, A. D., et al. Epidermal growth factor pathway in the age-related decline of oligodendrocyte regeneration. Frontiers in Cellular Neuroscience. 16, 838007(2022).
- Kútna, V., O'Leary, V. B., Hoschl, C., Ovsepian, S. V. Cerebellar demyelination and neurodegeneration associated with mTORC1 hyperactivity may contribute to the developmental onset of autism-like neurobehavioral phenotype in a rat model. Autism Research: Official Journal of the International Society for Autism Research. 15 (5), 791-805 (2022).
- Ozsvár, A., et al. Quantitative analysis of lipid debris accumulation caused by cuprizone induced myelin degradation in different CNS areas. Brain Research Bulletin. 137, 277-284 (2018).
- Prineas, J. W., Graham, J. S. Multiple sclerosis: capping of surface immunoglobulin G on macrophages engaged in myelin breakdown. Annals of Neurology. 10 (2), 149-158 (1981).
- Bégin, S., et al. Automated method for the segmentation and morphometry of nerve fibers in large-scale CARS images of spinal cord tissue. Biomedical Optics Express. 5 (12), 4145-4161 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon