Method Article
Applicazione coerente della spettroscopia Raman anti-Stokes (CARS) per l'imaging della mielinizzazione nelle fette di cervello
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Visualizzare la mielinizzazione è un obiettivo importante per molti ricercatori che studiano il sistema nervoso. CARS è una tecnica compatibile con l'immunofluorescenza in grado di visualizzare nativamente i lipidi all'interno di tessuti come il cervello illuminando strutture specializzate come la mielina.
Abstract
La spettroscopia coerente anti-Stokes Raman (CARS) è una tecnica classicamente impiegata da chimici e fisici per produrre un segnale coerente delle vibrazioni delle molecole. Tuttavia, queste firme vibrazionali sono anche caratteristiche delle molecole all'interno del tessuto anatomico come il cervello, rendendolo sempre più utile e applicabile per le applicazioni delle neuroscienze. Ad esempio, CARS può misurare i lipidi eccitando specificamente i legami chimici all'interno di queste molecole, consentendo la quantificazione di diversi aspetti del tessuto, come la mielina coinvolta nella neurotrasmissione. Inoltre, rispetto ad altre tecniche tipicamente utilizzate per quantificare la mielina, CARS può anche essere impostato per essere compatibile con le tecniche immunofluorescenti, consentendo la co-etichettatura con altri marcatori come i canali del sodio o altri componenti della trasmissione sinaptica. I cambiamenti della mielinizzazione sono un meccanismo intrinsecamente importante nelle malattie demielinizzanti come la sclerosi multipla o altre condizioni neurologiche come la sindrome dell'X fragile o i disturbi dello spettro autistico è un'area emergente di ricerca. In conclusione, CARS può essere utilizzato in modi innovativi per rispondere a domande urgenti nelle neuroscienze e fornire prove dei meccanismi sottostanti legati a molte diverse condizioni neurologiche.
Introduzione
I potenziali d'azione sono l'unità di base dell'informazione nel cervello e la propagazione del potenziale d'azione attraverso gli assoni costituisce un pilastro dell'elaborazione delle informazioni 1,2,3. I neuroni ricevono tipicamente input afferenti da più altri neuroni e integrano questi input all'interno di una data finestra temporale ristretta 4,5. Pertanto, i meccanismi di propagazione del potenziale d'azione negli assoni hanno ricevuto una notevole attenzione da parte degli investigatori.
Quando si propaga attraverso un assone, un potenziale d'azione viene rigenerato ripetutamente lungo l'assone per garantire una propagazione affidabile6. Nella maggior parte dei neuroni dei vertebrati mascellari (gnatostomi) gli assoni sono circondati da una guaina di mielina, che è una sostanza ricca di lipidi prodotta dagli oligodendrociti vicini o dalle cellule di Schwann, che sono tipi di cellule gliali (rivisto in 7,8). Questa guaina mielinica isola elettricamente l'assone, riducendone la capacità e consentendo la propagazione del potenziale d'azione in modo efficiente, rapido e con un minor consumo di energia. La mielina non copre l'assone in modo uniforme, ma riveste l'assone in segmenti che hanno brevi spazi tra di loro, chiamati nodi di Ranvier (recensito in 9,10). Sia lo spessore della mielinizzazione, che controlla il livello di isolamento elettrico di un assone, sia la spaziatura dei nodi di Ranvier, che controllano la frequenza con cui i potenziali d'azione vengono rigenerati lungo un assone, influenzano la velocità di propagazione del potenziale d'azione (rivisto in11).
C'è un ampio corpo di letteratura che suggerisce che lo spessore della mielinizzazione influenza la velocità di propagazione del potenziale d'azione negli assoni12,13,14. Inoltre, alterazioni nella mielinizzazione degli assoni possono provocare un numero di deficit del SNC 15,16,17,18,19,20,21. Non sorprende quindi che il focus di molti sforzi di ricerca riguardi la misurazione e la caratterizzazione della mielinizzazione assonica. Le misurazioni dello spessore della mielina sono state comunemente eseguite con la microscopia elettronica, una tecnica che richiede una quantità significativa di preparazione dei tessuti ed è difficile da usare in combinazione con l'immunoistochimica. Tuttavia, esiste anche una tecnica più rapida e semplice per misurare la mielinizzazione degli assoni basata sulla spettroscopia Raman coerente anti-Stokes (CARS). Un laser CARS può essere sintonizzato su varie frequenze e quando sintonizzato su frequenze adatte ad eccitare i lipidi, la mielina può essere ripresa senza la necessità di etichette aggiuntive22. L'imaging lipidico può essere combinato con l'immunoistochimica standard in modo tale che i lipidi possano essere visualizzati insieme a diversi canali fluorescenti23. La mielinizzazione per immagini con CARS è significativamente più veloce della microscopia elettronica e ha una risoluzione che, sebbene inferiore a EM, è sufficiente per rilevare anche piccole differenze nella mielinizzazione nello stesso tipo di assoni.
Protocollo
Tutti gli esperimenti sono conformi a tutte le leggi applicabili, alle linee guida del National Institutes of Health e sono stati approvati dal Comitato istituzionale per la cura e l'uso degli animali dell'Università del Colorado Anschutz.
1. Animali
- Utilizzare topi C57BL/6J (stock #000664) (Mus musculus ) ottenuti dal Jackson Laboratory o gerbilli mongoli (Meriones unguiculatus) originariamente ottenuti da Charles River.
2. Preparazione dei tessuti
- Per la perfusione transcardica, sovradosare le specie di roditori di interesse con pentobarbital (120 mg/kg di peso corporeo) e perfonderli transcardialmente con soluzione salina tamponata fosfato (PBS; 137 mM NaCl, 2,7 mM KCl, 1,76 mM KH 2 PO 4, 10 mM Na2HPO 4) seguitida paraformaldeide (PFA) al4% (PFA)24.
- In particolare, aprire l'addome e la gabbia toracica usando le forbici e tenere la gabbia toracica in posizione con una pinza emostatica Kelly per esporre il cuore.
- Inserire un ago da 23 GA collegato a una pompa di perfusione nel ventricolo sinistro e tagliare rapidamente l'atrio destro usando le forbici sottili.
- Somministrare PBS attraverso la pompa di perfusione e l'ago nel cuore per 10 minuti per liberare il cervello e il corpo dal sangue.
- Passare la pompa di perfusione al 4% di PFA per 10 minuti e verificare la rigidità degli arti e della coda per confermare la corretta perfusione.
- Dopo la perfusione, decapitare gli animali e rimuovere il loro cervello dal cranio. Mantenere il cervello durante la notte in 4% PFA prima di trasferire a PBS. Incorporare i tronchi cerebrali in agarosio al 4% (in PBS) e affettare coronalmente usando una vibratoma a 200 μm di spessore.
3. Colorazione
- Sezioni fluttuanti senza macchie per Nissl, per visualizzare corpi cellulari (1:100), in mezzi anticorpali (media AB: tampone fosfato 0,1 M (PB: 50 mM KH 2 PO 4,150 mM Na2HPO4), 150 mM NaCl, 3 mM Triton-X, 1% albumina sierica bovina (BSA)) per 30 minuti a temperatura ambiente su uno shaker standard da laboratorio25.
- Proteggere le sezioni dalla luce utilizzando un foglio di alluminio e/o una copertura. Le lunghezze d'onda di 550 nm o inferiori sono compatibili con l'imaging CARS (Figura 1).
NOTA: Anche se non ci aspettiamo che Triton-X o altri reagenti abbiano un impatto sull'imaging dei lipidi CARS, possono essere giustificati controlli aggiuntivi con specifici mezzi anticorpali.
- Proteggere le sezioni dalla luce utilizzando un foglio di alluminio e/o una copertura. Le lunghezze d'onda di 550 nm o inferiori sono compatibili con l'imaging CARS (Figura 1).
- PUNTO DI PAUSA: conservare le sezioni fluttuanti (protette dalla luce) in PBS fino all'imaging. Una volta sezionate, immagini sezioni cerebrali entro 2 settimane.

Figura 1: L'imaging CARS può essere combinato con l'imaging immunofluorescente. I grafici mostrano che l'imaging di CARS avviene a 660/640 nm con lo spettro del segnale rosso26. Questa lunghezza d'onda è sufficientemente lontana dalla gamma verde, blu o UV, consentendo la combinazione del segnale CARS con l'immunofluorescenza in questi intervalli. In particolare, il grafico indica anche l'eccitazione e l'emissione di Nissl etichettato con fluoroforo blu, che è stato combinato con CARS durante la raccolta dei risultati rappresentativi per questa pubblicazione. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Imaging
NOTA: Il set up laser CARS contiene un laser a fibra che fornisce l'orologio a 80 MHz e un laser OPO (Optical Parametric Oscillator) con una gamma sintonizzabile di 770-990 nm con il fascio Stokes fissato a 1031 nm, necessari per la raccolta del segnale CARS. C'è un'apertura per entrambi i raggi.
- Prima di portare i campioni al microscopio, accendere e riscaldare il laser CARS per almeno 1 ora, allineare il laser CARS e Koehler l'ottica del condensatore e il diaframma del microscopio per l'imaging CARS in avanti.
NOTA: Questo passaggio è fondamentale per il corretto funzionamento della microscopia CARS.- Per l'allineamento spaziale dei due raggi laser (pompa e stokes), accedere ai due PSD interni (rilevatori sensibili alla posizione) tramite la GUI laser CARS.
- Ottenere l'allineamento temporale utilizzando la funzione di ritardo nella GUI laser CARS, che può aiutare a sovrapporre gli impulsi dei due laser (pompa e stokes) che hanno dispersioni diverse a causa delle loro diverse lunghezze d'onda. Pertanto, sia la sovrapposizione temporale che spaziale dei fasci di pompa e stokes viene eseguita con l'input dell'utente tramite la GUI.
- Regolare il periscopio esterno (ultimi due specchi della configurazione) per centrare i due laser spazialmente sovrapposti sugli specchi della testa di scansione del microscopio.
- Per il miglior rilevamento CARS non descanizzato in avanti, assicurarsi che il condensatore sia Koehler-ed (il che significa che il condensatore è centrato e focalizzato sul diaframma per ottenere un'illuminazione uniforme)
- Per l'imaging confocale a immunofluorescenza e l'imaging CARS, montare il laser CARS, con rivelatori non desscansionati (NDD) sia in avanti che epi CARS, incorporando un microscopio confocale dotato di laser visibili per l'imaging a fluorescenza (Figura 2).
- Posizionare le sezioni in un piatto di coltura con coprislip (per microscopia invertita), PBS per evitare che il tessuto si secchi e un peso di vetro per mantenere il tessuto vicino al coprifoglio.
- Prendi z-stack o immagini singole con un obiettivo d'acqua corretto a infrarossi 60X, 1,2 NA, che serve per la raccolta del segnale CARS nella direzione epi e attraverso un condensatore da 0,55 NA nella direzione in avanti per l'imaging di aree cerebrali come il nucleo mediale del corpo trapezoidale (MNTB).
- Scatta le immagini CARS a circa 600 mW di pompa/sonda e 300 mW di Stokes, utilizzando la GUI laser CARS. Questi valori di potenza laser vengono misurati internamente dal sistema. Le potenze di entrambi i laser nella posizione del campione sono inferiori a 25 mW e sicure per il campione di tessuto.
- Sovrapponi la pompa e i raggi di Stokes spazialmente e temporalmente. Regolare l'OPO su 797,2 nm. Ciò produce una lunghezza d'onda CARS di 650 nm. A causa del livello di energia più elevato, il conseguente ritorno allo stato fondamentale è anti-Stokes (blu spostato) all'eccitazione.
- Catturare il segnale CARS in rivelatori epi o forward non descan utilizzando filtri passa-banda (640-680 nm) seguiti dal rilevamento sequenziale dell'etichetta di immunofluorescenza (in questo caso marcata fluorescentemente Nissl).
NOTA: Il marcatore neuronale del soma Nissl non viene catturato nel filtro passa-banda CARS 640-680 nm, consentendo la combinazione di fluorescenza e imaging CARS nelle immagini presentate di seguito. - Il CARS e la fluorescenza non condividono PMT. Utilizzare queste impostazioni per un segnale lipidico ottimale per visualizzare selettivamente la mielinizzazione nell'area del cervello.
ATTENZIONE: Schermare l'utente dal raggio laser
- Salvare le immagini come file .oib, che possono essere importati in un programma di analisi delle immagini per ulteriori quantificazioni (Figura 3).
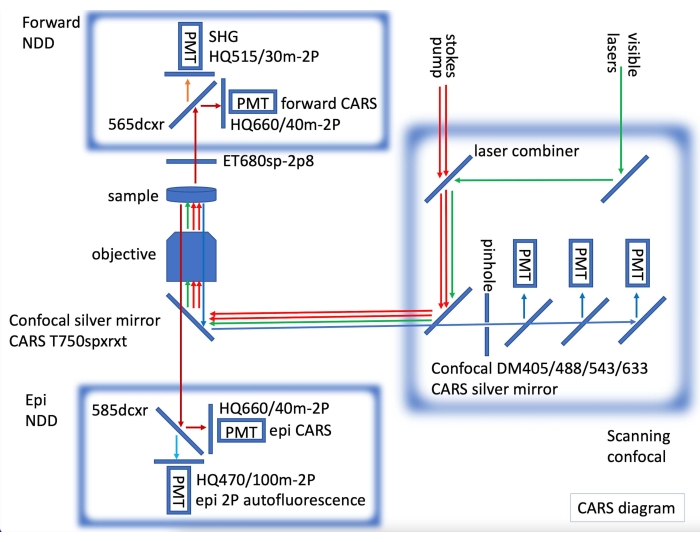
Figura 2: Diagramma dello strumento CARS che mostra i laser CARS (frecce rosse) e il rilevamento epi e forward non descan (NDD) incorporati in una confocale a scansione laser. In NDD forward acquisiamo CARS per legami C-H (frecce rosso scuro) e SHG (seconda generatioina armonica) a 515 nm (freccia arancione). In epi NDD, acquisiamo CARS per legami C-H (frecce rosso scuro) e autofluorescenza 2PE (emissione di due fotoni) (freccia azzurra). Sequenzialmente, è possibile acquisire immagini confocali a fluorescenza (frecce verdi per laser visibile, frecce blu per il rilevamento confocale). Fare clic qui per visualizzare una versione ingrandita di questa figura.
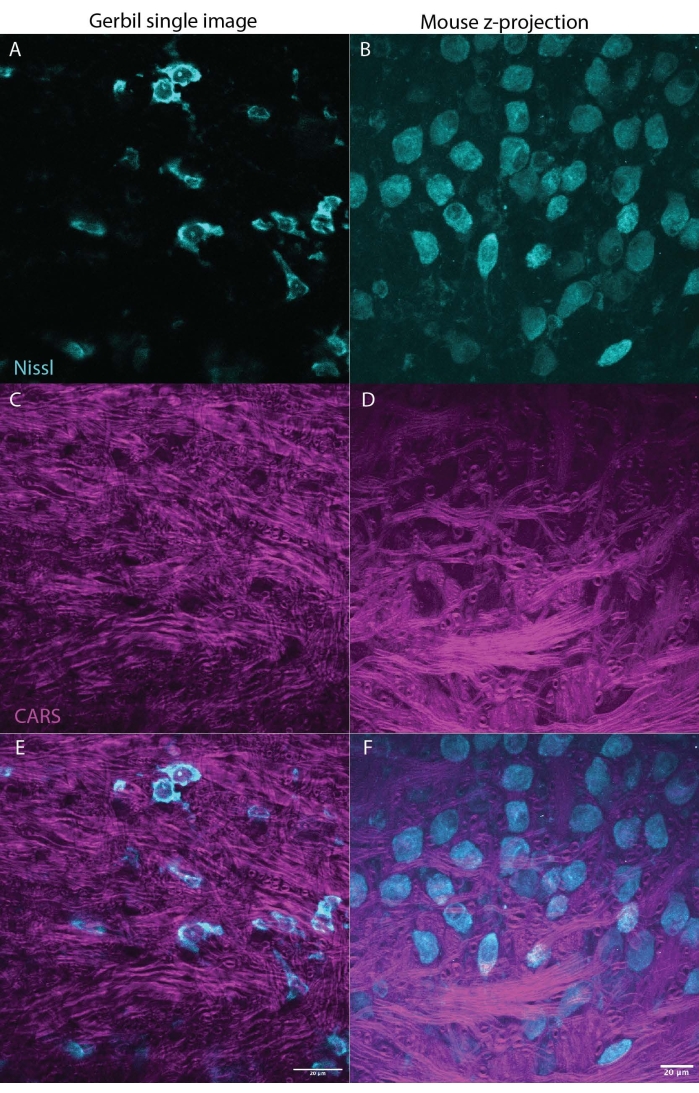
Figura 3: CARS può illuminare la mielina (magenta) nel tessuto cerebrale (tronco cerebrale) mentre anche l'imaging di Nissl (ciano) o marcatori fluorescenti. I due pannelli mostrano risultati rappresentativi di un gerbillo mongolo (immagine singola M. unguiculatus, Figura 3A,C,E) e di topo (proiezione massima z-stack M. musculus, Figura 2B,D,F), indicando che questa tecnica può essere utilizzata in tutte le specie. La Figura 3A,B mostra Nissl in ciano, C,D mostra il segnale CARS in magenta, E,F combina i segnali Nissl e CARS con ciascun pannello rispettivamente per gerbillo o mouse. Entrambe le serie di immagini mostrano una sezione del nucleo mediale del corpo trapezoidale (MNTB) nel tronco cerebrale. I neuroni nel MNTB ricevono input da assoni fortemente mielinici, che terminano nel calice di held, un tipo di sinapsi gigante27. La barra della scala è di 20 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Uno dei maggiori vantaggi della microscopia CARS rispetto ad altre tecniche è la compatibilità con l'imaging fluorescente23. La Figura 1 mostra gli spettri CARS confrontati con Nissl marcati con marcatori immunofluorescenti che mostrano poca o nessuna sovrapposizione negli spettri. La figura 2 illustra la configurazione laser per CARS in combinazione con la microscopia confocale. La Figura 3 mostra due immagini rappresentative, una come una singola pila e una proiezione z-stack max da gerbillo e topo che potrebbero essere ottenute utilizzando l'imaging CARS che mostra sia i corpi cellulari (ciano) che il segnale mielinico (magenta).
Discussione
Un crescente corpo di letteratura sottolinea il ruolo della mielina nella funzione cerebrale 13,16,21,28. Inoltre, sappiamo che lo spessore della mielinizzazione e il modello di mielinizzazione possono cambiare in diverse condizioni neurologiche come la sclerosi multipla (rivista in29), l'invecchiamento (rivisto in 30), l'autismo20,31 e molti altri. Non sorprende quindi che sempre più ricercatori debbano valutare la mielinizzazione attraverso tessuti cerebrali e modelli animali, in diverse condizioni mediche e in un numero crescente di situazioni sperimentali. I metodi tradizionali per visualizzare la mielinizzazione nel tessuto cerebrale includono l'etichettatura degli anticorpi seguita dalla microscopia ottica e dalla microscopia elettronica (EM). Entrambe le tecniche richiedono molto tempo e richiedono protocolli di preparazione dei tessuti in più fasi, associati a possibili errori e modifiche alla composizione del tessuto. Abbiamo dimostrato un metodo alternativo che può produrre risultati simili molto più rapidamente grazie alla capacità di visualizzare la mielina molto più velocemente e che può essere combinato con una microscopia a luce di fluorescenza aggiuntiva. È importante sottolineare che questa tecnica può essere utilizzata per visualizzare i lipidi nel tessuto cerebrale senza la necessità di ulteriori marcatori o etichette. Questa tecnica non solo consente l'imaging della mielina lungo assoni intatti, ma consente l'imaging di prodotti di degradazione della mielina come placche o goccioline liquide32, che hanno dimostrato di verificarsi, ad esempio, nella sclerosi multipla33.
La frequenza con cui è stato sintonizzato il laser CARS era adatta a polarizzare pesantemente l'immagine a favore dei lipidi, risultando in immagini complessive di alta qualità della mielinizzazione, poiché la mielina è di gran lunga la sostanza ricca di lipidi più comune nel cervello. Il principio di questa tecnica è che un laser CARS, che può essere sintonizzato su varie frequenze, è sintonizzato su 792,2 nm, che è una frequenza adatta ad eccitare i legami CH2 . Questi sono abbondanti nei lipidi, che contengono lunghe catene di gruppi CH2 collegati da legami carbonio-carbonio con un gruppo acido carbossilico terminale alla fine. I lipidi eccitanti con questa frequenza hanno prodotto un segnale che potrebbe quindi essere ripreso con la tecnologia di rilevamento del microscopio confocale standard. La qualità delle immagini risultanti supporta analisi quantitative che possono essere eseguite da un osservatore umano o da algoritmi automatizzati34. Tuttavia, questo metodo non etichetta esclusivamente la mielina poiché i legami CH2 non sono esclusivi della mielina, e quindi CARS è meno specifico di un anticorpo. Di conseguenza, le immagini mostrano alcune etichette, che non sono associate alla mielina. È importante sottolineare che questa etichetta di fondo non compromette la qualità delle misurazioni o la capacità di analisi quantitative.
La risoluzione dell'imaging CARS è limitata alla diffrazione e simile alla microscopia a due fotoni (~250 nm) e quindi inferiore a quella di EM. Pertanto, i ricercatori che mirano a valutare differenze molto piccole nello spessore della mielinizzazione come si verifica, ad esempio, in determinate condizioni mediche, devono essere consapevoli di questa limitazione. Ulteriori controlli EM in un piccolo campione possono confermare che la risoluzione è sufficiente per il loro obiettivo di ricerca.
Uno dei principali vantaggi di CARS per l'imaging della mielina, oltre alla velocità e alla facilità, è la capacità di combinare l'imaging lipidico label-free con la microscopia confocale a fluorescenza. A seconda del microscopio utilizzato per CARS, è possibile visualizzare due o anche tre canali aggiuntivi in modo tale che l'imaging della mielina possa essere combinato con l'etichettatura degli anticorpi, la colorazione Nissl, le linee di topo transgeniche che esprimono proteine fluorescenti o simili. Le potenziali limitazioni che utilizzano fluorofori a lunghezza d'onda più lunga sono principalmente dovute al fatto che il segnale CARS viene osservato attraverso filtri passa-banda 640-680 nm che possono catturare l'emissione di fluorofori verdi e / o rossi. Tuttavia, il laser a picosecondi utilizzato per l'eccitazione CARS ha un'energia di impulso di picco di ~ 10 volte inferiore rispetto al laser a femtosecondi standard utilizzato per l'eccitazione a due fotoni, tradotto in ~ 100 in meno di fluorescenza. Inoltre, il laser a picosecondi a impulsi da 797,2 nm utilizzato per l'eccitazione di CARS è spettralmente lontano dal picco dell'assorbimento della sezione d'urto a due fotoni dei fluorofori visibili. Pertanto, il laser a picosecondi CARS è molto inefficiente per l'eccitazione a due fotoni dei fluorofori visibili, rendendo il segnale fluorescente trascurabile per l'attraversamento nel rilevamento CARS. Tuttavia, questo dovrebbe essere testato mediante l'imaging di un campione di controllo negativo che non ha etichette fluorescenti rispetto a un campione con marcatori fluorescenti.
In conclusione, l'imaging CARS è una tecnica adatta per visualizzare la mielina nel tessuto cerebrale. Mentre la risoluzione è paragonabile alla microscopia ottica standard e quindi è inferiore a EM, la velocità e la facilità d'uso rendono questa tecnica un'alternativa interessante ai metodi esistenti.
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Supportato da NIH R01 DC 17924, R01 DC 18401 (Klug) e NIH 1R15HD105231-01, T32DC012280 e FRAXA (McCullagh). L'imaging CARS è stato eseguito nella parte Advanced Light Microscopy Core del NeuroTechnology Center presso l'Anschutz Medical Campus dell'Università del Colorado, supportata in parte da NIH P30 NS048154 e NIH P30 DK116073.
Materiali
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| 1 mL disposable syringe with needle 27 GA x 0.5" | Exel int | 260040 | |
| Fatal + | Vortech | ||
| Surgery: | |||
| Spring Scissors - 8mm Cutting Edge | Fine Science Tools | 15024-10 | |
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Perfusion: | |||
| 4% Paraformaldehyde | Fisher Chemical | SF994 (CS) | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Kelly hemostats | Fine Science Tools | 13019-14 | |
| Millipore H2O | |||
| Needle tip, 23 GA x 1" | BD precision glide | 305193 | |
| Phosphate buffered saline (PBS): | |||
| Potassium chloride | Sigma | P9333 | |
| Potassium phosphate monobase | Sigma | P5655 | |
| pump with variable flow or equivalent | |||
| Sodium chloride | Fisher Chemical | s271-1 | |
| Sodiumphosphate dibasic | Sigma | S7907 | |
| Dissection: | |||
| 50 mL vial with 4% PFA | |||
| Bochem Chemical Spoon 180mm | Bochem | 230331000 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Noyes Spring Scissors | Fine Science Tools | 15011-12 | |
| Pair of fine (Graefe) tweezers | Fine Science Tools | 11050-10 | |
| Shallow glass or plastic tray, approximately 10" x 10" | |||
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Surgical Scissors - Blunt | Fine Science Tools | 14000-20 | |
| Slicing: | |||
| Agar, plant | RPI | 9002-18-0 | |
| Vibratome | Leica | VT1000s | |
| well plate | Alkali Sci. | TPN1048-NT | |
| Staining: | |||
| AB Media: | 1n 1,000 mL of Millipore H2O | ||
| Phosphate buffered (PB): | |||
| Potassium Phosphate Monobase | Sigma | P5655 | |
| Sodium Phosohate Dibasic | Sigma | S7907 | |
| BSA (Bovine serum albumin) | Sigma life science | A2153-100g | |
| Sodium Chloride | Fisher Chemical | s271-1 | |
| Triton X-100 | Sigma - Aldrich | x100-500ml | |
| Nissl 435/455 | Invitrogen | N21479 | |
| CARS: | |||
| APE picoemerald laser | Angewandte Physik & Elektronik GmbH | ||
| bandpass filter (420-520 nm) | Chroma Technology | HQ470/100m-2P | |
| bandpass filter (500-530 nm) | Chroma Technology | HQ515/30m-2P | |
| bandpass filters (640-680 nm) | Chroma Technology | HQ660/40m-2P | |
| Confocal microscope | Olympus | FV1000 | |
| Cut Transfer pipet | Fisher | 13-711-7M | |
| dichroic longpass 565 nm | Chroma Technology | 565dcxr | |
| dichroic longpass 585 nm | Chroma Technology | 585dcxr | |
| dichroic shortpass 750 nm | Chroma Technology | T750spxrxt | |
| glass bottom culture dish | MatTek | P35G-0-10-C | |
| glass weight (10 mm x 10 mm boro rod) | Allen Scientific Glass Inc | ||
| multiphoton shortpass emission filter 680 nm | Chroma Technology | ET680sp-2p8 | |
| PBS |
Riferimenti
- Cole, K., Curtis, H. Electric impedance of the squid giant axon during activity. The Journal of General Physiology. 22 (5), 649-670 (1939).
- Cole, K. S., Curtis, H. J. Membrane potential of the squid giant axon during current flow. Journal of General Physiology. 24 (4), 551-563 (1941).
- Alcami, P., El Hady, A. Axonal computations. Frontiers in Cellular Neuroscience. 13, 413(2019).
- Neumann, E., Nachmansohn, D. Nerve excitability-Toward an integrating concept. Aharon Katzir Memorial Volume. , 99-166 (1975).
- Waxman, S. G. Integrative properties and design principles of axons. International Review of Neurobiology. 18, 1-40 (1975).
- Fitzhugh, R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophysical Journal. 2 (1), 11-21 (1962).
- Zalc, B. The acquisition of myelin: a success story. Novartis Foundation Symposium. 276, 275-281 (2006).
- Salzer, J. L., Zalc, B. Myelination. Current Biology. 26 (20), 971-975 (2016).
- Boullerne, A. I. The history of myelin. Experimental Neurology. 283, 431-445 (2016).
- Kuhn, S., Gritti, L., Crooks, D., Dombrowski, Y. Oligodendrocytes in development, myelin generation and beyond. Cells. 8 (11), 1424(2019).
- Saab, A. S., Nave, K. -A. Myelin dynamics: protecting and shaping neuronal functions. Current Opinion in Neurobiology. 47, 104-112 (2017).
- Chomiak, T., Hu, B. What is the optimal value of the g-Ratio for myelinated fibers in the rat CNS? A theoretical approach. PLOS ONE. 4 (11), 7754(2009).
- Ford, M. C., et al. Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications. 6, 8073(2015).
- Stange-Marten, A., et al. Input timing for spatial processing is precisely tuned via constant synaptic delays and myelination patterns in the auditory brainstem. Proceedings of the National Academy of Sciences of the United States of America. 114 (24), 4851-4858 (2017).
- Bu, J., Banki, A., Wu, Q., Nishiyama, A. Increased NG2+ glial cell proliferation and oligodendrocyte generation in the hypomyelinating mutant shiverer. Glia. 48 (1), 51-63 (2004).
- Pacey, L. K. K., et al. Delayed myelination in a mouse model of fragile X syndrome. Human Molecular Genetics. 22 (19), 3920-3930 (2013).
- Green, A. J., et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet. 390 (10111), London, England. 2481-2489 (2017).
- Jeon, S. J., Ryu, J. H., Bahn, G. H. Altered translational control of fragile X mental retardation protein on myelin proteins in neuropsychiatric disorders. Biomolecules & Therapeutics. 25 (3), 231-238 (2017).
- Barak, B., et al. Neuronal deletion of Gtf2i, associated with Williams syndrome, causes behavioral and myelin alterations rescuable by a remyelinating drug. Nature Neuroscience. 22 (5), 700-708 (2019).
- Phan, B. N., et al. A myelin-related transcriptomic profile is shared by Pitt-Hopkins syndrome models and human autism spectrum disorder. Nature Neuroscience. 23 (3), 375-385 (2020).
- Lucas, A., Poleg, S., Klug, A., McCullagh, E. A. Myelination deficits in the auditory brainstem of a mouse model of fragile X syndrome. Frontiers in Neuroscience. 15, 1536(2021).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. -X. Coherent anti-stokes raman scattering imaging of axonal myelin in live spinal ttissues. Biophysical Journal. 89 (1), 581-591 (2005).
- Kim, S. -H., et al. Multiplex coherent anti-stokes raman spectroscopy images intact atheromatous lesions and concomitantly identifies distinct chemical profiles of atherosclerotic lipids. Circulation Research. 106 (8), 1332-1341 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Tu, L., et al. Free-floating Immunostaining of Mouse Brains. Journal of Visualized Experiments. (176), e62876(2021).
- Fluorescence SpectraViewer. , Available from: https://www.thermofisher.com/order/fluorescence-spectraviewer (2022).
- Held, H. Die centrale gehörleitung. Arch Anat Physiol Anat Abt. 17, 201-248 (1893).
- Sherman, D. L., Brophy, P. J. Mechanisms of axon ensheathment and myelin growth. Nature Reviews Neuroscience. 6 (9), 683-690 (2005).
- Gruchot, J., et al. The molecular basis for remyelination failure in multiple sclerosis. Cells. 8 (8), 825(2019).
- Rivera, A. D., et al. Epidermal growth factor pathway in the age-related decline of oligodendrocyte regeneration. Frontiers in Cellular Neuroscience. 16, 838007(2022).
- Kútna, V., O'Leary, V. B., Hoschl, C., Ovsepian, S. V. Cerebellar demyelination and neurodegeneration associated with mTORC1 hyperactivity may contribute to the developmental onset of autism-like neurobehavioral phenotype in a rat model. Autism Research: Official Journal of the International Society for Autism Research. 15 (5), 791-805 (2022).
- Ozsvár, A., et al. Quantitative analysis of lipid debris accumulation caused by cuprizone induced myelin degradation in different CNS areas. Brain Research Bulletin. 137, 277-284 (2018).
- Prineas, J. W., Graham, J. S. Multiple sclerosis: capping of surface immunoglobulin G on macrophages engaged in myelin breakdown. Annals of Neurology. 10 (2), 149-158 (1981).
- Bégin, S., et al. Automated method for the segmentation and morphometry of nerve fibers in large-scale CARS images of spinal cord tissue. Biomedical Optics Express. 5 (12), 4145-4161 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon