Method Article
تطبيق التحليل الطيفي رامان المتماسك المضاد لستوكس (CARS) لتصوير الميالين في شرائح الدماغ
In This Article
Summary
يعد تصور الميالين هدفا مهما للعديد من الباحثين الذين يدرسون الجهاز العصبي. CARS هي تقنية متوافقة مع التألق المناعي الذي يمكنه تصوير الدهون داخل الأنسجة مثل الدماغ الذي يضيء الهياكل المتخصصة مثل المايلين.
Abstract
التحليل الطيفي المتماسك المضاد لستوكس رامان (CARS) هو تقنية يستخدمها الكيميائيون والفيزيائيون بشكل كلاسيكي لإنتاج إشارة متماسكة من الاهتزازات المميزة للجزيئات. ومع ذلك ، فإن هذه التوقيعات الاهتزازية هي أيضا سمة مميزة للجزيئات داخل الأنسجة التشريحية مثل الدماغ ، مما يجعلها مفيدة بشكل متزايد وقابلة للتطبيق على تطبيقات علم الأعصاب. على سبيل المثال ، يمكن ل CARS قياس الدهون عن طريق الروابط الكيميائية المثيرة على وجه التحديد داخل هذه الجزيئات ، مما يسمح بتحديد الجوانب المختلفة للأنسجة ، مثل المايلين المشارك في النقل العصبي. بالإضافة إلى ذلك ، بالمقارنة مع التقنيات الأخرى المستخدمة عادة لتحديد كمية المايلين ، يمكن أيضا إعداد CARS لتكون متوافقة مع تقنيات الفلورسنت المناعي ، مما يسمح بوضع العلامات المشتركة مع علامات أخرى مثل قنوات الصوديوم أو المكونات الأخرى للانتقال المشبكي. تغيرات الميالين هي آلية مهمة بطبيعتها في إزالة الميالين من الأمراض مثل التصلب المتعدد أو الحالات العصبية الأخرى مثل متلازمة X الهشة أو اضطرابات طيف التوحد هي مجال ناشئ من مجالات البحث. في الختام ، يمكن استخدام CARS بطرق مبتكرة للإجابة على الأسئلة الملحة في علم الأعصاب وتقديم أدلة على الآليات الأساسية المتعلقة بالعديد من الحالات العصبية المختلفة.
Introduction
إمكانات العمل هي الوحدة الأساسية للمعلومات في الدماغ ، ويشكل الانتشار المحتمل للعمل من خلال المحاور العصبية أحد أعمدة معالجة المعلومات1،2،3. تتلقى الخلايا العصبية عادة مدخلات قريبة من خلايا عصبية أخرى متعددة وتدمج هذه المدخلات ضمن نافذة زمنية ضيقة معينة 4,5. لذلك ، تلقت آليات الانتشار المحتمل للعمل في المحاور العصبية قدرا كبيرا من الاهتمام من المحققين.
عند الانتشار من خلال محور عصبي ، يتم تجديد إمكانات العمل بشكل متكرر على طول المحور العصبي لضمان انتشار موثوق به6. في معظم الخلايا العصبية للفقاريات ذات الفكين (gnathostomes) ، تحيط المحاور العصبية بغمد من المايلين ، وهي مادة غنية بالدهون تنتجها الخلايا قليلة التغصن القريبة أو خلايا شوان ، وهي أنواع من الخلايا الدبقية (تمت مراجعتها في 7,8). يعزل غمد المايلين هذا المحور العصبي كهربائيا ، مما يقلل من سعته ويسمح بالانتشار المحتمل للعمل بكفاءة وسرعة واستهلاك أقل للطاقة. لا يغطي المايلين المحور العصبي بشكل موحد ، ولكنه يغمد المحور العصبي في أجزاء تحتوي على فجوات قصيرة بينهما ، تسمى عقد رانفييه (تمت مراجعتها في 9,10). يؤثر كل من سمك الميالين ، الذي يتحكم في مستوى العزل الكهربائي للمحور العصبي ، وتباعد عقد رانفييه ، التي تتحكم في التردد الذي يتم به تجديد إمكانات الفعل على طول محور عصبي ، على سرعة انتشار إمكانات العمل (تمت مراجعته في11).
هناك مجموعة كبيرة من الأدبيات التي تشير إلى أن سمك الميالين يؤثر على سرعة الانتشار المحتمل للعمل في المحاورالعصبية 12،13،14. علاوة على ذلك ، يمكن أن تؤدي التغييرات في الميالين المحوري إلى عدد من عجز CNS 15,16,17,18,19,20,21. لذلك ليس من المستغرب أن تركيز العديد من الجهود البحثية ينطوي على قياس وتوصيف الميالين المحوري. تم إجراء قياسات سمك المايلين بشكل شائع باستخدام المجهر الإلكتروني ، وهي تقنية تتطلب قدرا كبيرا من إعداد الأنسجة ويصعب استخدامها مع الكيمياء النسيجية المناعية. ومع ذلك ، هناك أيضا تقنية أسرع وأبسط لقياس الميالين المحوري الذي يعتمد على التحليل الطيفي المضاد لستوكس (CARS). يمكن ضبط ليزر CARS على ترددات مختلفة وعند ضبطه على ترددات مناسبة لإثارة الدهون ، يمكن تصوير المايلين دون الحاجة إلى أي ملصقات إضافية22. يمكن دمج تصوير الدهون مع الكيمياء النسيجية المناعية القياسية بحيث يمكن تصوير الدهون مع العديد من قنوات الفلورسنت23. التصوير الميالين باستخدام CARS أسرع بكثير من المجهر الإلكتروني وله دقة ، وإن كانت أقل من EM ، كافية للكشف عن الاختلافات الصغيرة في الميالين في نفس النوع من المحاور العصبية.
Protocol
امتثلت جميع التجارب لجميع القوانين المعمول بها ، والمبادئ التوجيهية للمعاهد الوطنية للصحة ، وتمت الموافقة عليها من قبل لجنة جامعة كولورادو أنشوتز المؤسسية لرعاية الحيوانات واستخدامها.
1. الحيوانات
- استخدم C57BL/6J (المخزون رقم 000664) الفئران (Mus musculus ) التي تم الحصول عليها من مختبر جاكسون أو الجربلات المنغولية (Meriones unguiculatus) التي تم الحصول عليها في الأصل من نهر تشارلز.
2. إعداد الأنسجة
- بالنسبة للإرواء عبر القلب ، جرعة زائدة من أنواع القوارض ذات الأهمية مع البنتوباربيتال (120 مجم / كجم من وزن الجسم) وتطهيرها عبر القلب بمحلول ملحي مخزن بالفوسفات (PBS ؛ 137 mM NaCl ، 2.7 mM KCl ، 1.76 mM KH 2 PO 4 ،10 mM Na2HPO 4) تليها4٪ paraformaldehyde (PFA)24.
- على وجه التحديد ، افتح البطن والقفص الصدري باستخدام المقص وثبت القفص الصدري في مكانه باستخدام ملقط مرقئ كيلي لفضح القلب.
- أدخل إبرة 23 GA متصلة بمضخة تروية في البطين الأيسر وقطع الأذين الأيمن بسرعة باستخدام مقص دقيق.
- إدارة PBS من خلال مضخة التروية والإبرة في القلب لمدة 10 دقائق لتطهير الدماغ والجسم من الدم.
- قم بتبديل مضخة التروية إلى 4٪ PFA لمدة 10 دقائق وتحقق من صلابة الأطراف والذيل لتأكيد نجاح التروية.
- بعد التروية ، قم بقطع رؤوس الحيوانات وإزالة دماغها من الجمجمة. حافظ على الأدمغة بين عشية وضحاها في 4٪ PFA قبل نقلها إلى PBS. تضمين جذع الدماغ في 4٪ من الأغاروز (في PBS) وتقطيعه بشكل كروني باستخدام اهتزاز بسماكة 200 ميكرومتر.
3. تلطيخ
- أقسام عائمة خالية من البقع ل Nissl ، لتصور أجسام الخلايا (1:100) ، في وسائط الأجسام المضادة (وسائط AB: 0.1 M الفوسفات العازلة (PB: 50 mM KH2 PO 4 ، 150 mM Na2HPO4) ، 150 mM NaCl ، 3 mM Triton-X ، 1٪ ألبومين مصل البقر (BSA)) لمدة 30 دقيقة في درجة حرارة الغرفة على شاكر مختبر قياسي25.
- حماية الأقسام من الضوء باستخدام رقائق الألومنيوم و / أو الغطاء. 550 نانومتر أو أقل من الأطوال الموجية متوافقة مع تصوير CARS (الشكل 1).
ملاحظة: على الرغم من أننا لا نتوقع أن يكون ل Triton-X أو الكواشف الأخرى تأثير على تصوير CARS للدهون ، فقد يكون هناك ما يبرر وجود ضوابط إضافية مع وسائط أجسام مضادة محددة.
- حماية الأقسام من الضوء باستخدام رقائق الألومنيوم و / أو الغطاء. 550 نانومتر أو أقل من الأطوال الموجية متوافقة مع تصوير CARS (الشكل 1).
- نقطة التوقف: قم بتخزين الأقسام العائمة المجانية (أثناء حمايتها من الضوء) في PBS حتى التصوير. مرة واحدة مقسمة، وأقسام الدماغ الصورة في غضون 2 أسابيع.

الشكل 1: يمكن الجمع بين تصوير CARS والتصوير الفلوري المناعي. توضح الرسوم البيانية أن تصوير CARS يحدث عند 660/640 نانومتر طيف إشارة حمراء26. هذا الطول الموجي بعيد بما فيه الكفاية عن نطاق الأخضر أو الأزرق أو الأشعة فوق البنفسجية ، مما يسمح بمزيج من إشارة CARS مع التألق المناعي في هذه النطاقات. على وجه التحديد ، يشير الرسم البياني أيضا إلى الإثارة والانبعاثات ل Nissl الموسومة بالفلوروفور الأزرق ، والتي تم دمجها مع CARS أثناء جمع النتائج التمثيلية لهذا المنشور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. التصوير
ملاحظة: يحتوي إعداد ليزر CARS على ليزر ألياف يوفر ساعة 80 ميجاهرتز ، وليزر OPO (مذبذب بارامتري بصري) مع نطاق قابل للضبط يتراوح بين 770-990 نانومتر مع شعاع ستوكس مثبت عند 1031 نانومتر ، وهي ضرورية لجمع إشارة CARS. هناك فتحة واحدة لكلا الحزمتين.
- قبل إحضار العينات إلى المجهر ، قم بتشغيل وتسخين ليزر CARS لمدة 1 ساعة على الأقل ، ومحاذاة ليزر CARS ، و Koehler البصريات المكثفة والحجاب الحاجز للمجهر لتصوير CARS إلى الأمام.
ملاحظة: هذه الخطوة ضرورية للوظيفة المناسبة للفحص المجهري CARS.- للمحاذاة المكانية لشعاعي الليزر (المضخة والستوكس) ، قم بالوصول إلى اثنين من PSDs الداخلية (كاشفات حساسة للموقع) عبر واجهة المستخدم الرسومية الليزرية CARS.
- حقق المحاذاة الزمنية باستخدام وظيفة التأخير في واجهة المستخدم الرسومية الليزرية CARS ، والتي يمكن أن تساعد في تداخل نبضات الليزري (المضخة و stokes) التي لها تشتتات مختلفة بسبب اختلاف أطوالها الموجية. لذلك ، يتم كل من التداخل الزمني والمكاني للمضخة وعوارض stokes باستخدام إدخال المستخدم من خلال واجهة المستخدم الرسومية.
- اضبط المنظار الخارجي (آخر مرآتين من الإعداد) لتوسيط اثنين من أشعة الليزر المتداخلة مكانيا على مرايا رأس المسح الضوئي للمجهر.
- للحصول على أفضل كشف أمامي غير منزوع السكاكين من CARS ، تأكد من أن المكثف هو Koehler-ed (مما يعني أن المكثف يتمركز ويركز على الحجاب الحاجز لتحقيق إضاءة موحدة)
- بالنسبة للتصوير البؤري المناعي التألق وتصوير CARS ، قم بتركيب ليزر CARS ، مع كل من أجهزة الكشف الأمامية و epi CARS غير الممسكبة (NDDs) ، من خلال دمج مجهر متحد البؤرة مجهز بليزر مرئي للتصوير الفلوري (الشكل 2).
- ضع مقاطع في طبق مستنبت مع غطاء (للمجهر المقلوب) ، PBS لتجنب جفاف الأنسجة ، ووزن زجاجي للحفاظ على الأنسجة بالقرب من الغطاء.
- التقط مكدسات z أو صورا مفردة مع هدف مائي مصحح بالأشعة تحت الحمراء 60X ، 1.2 NA ، والذي يعمل على جمع إشارة CARS في اتجاه epi ومن خلال مكثف 0.55 NA في الاتجاه الأمامي لتصوير مناطق الدماغ مثل النواة الإنسية للجسم شبه المنحرف (MNTB).
- التقط صور CARS عند حوالي 600 ميجاوات مضخة / مسبار و 300 ميجاوات ستوكس ، باستخدام واجهة المستخدم الرسومية الليزرية CACARS. يتم قياس قيم طاقة الليزر هذه داخليا بواسطة النظام. كل من قوى الليزر في موقع العينة أقل من 25 ميجاوات وآمنة لعينة الأنسجة.
- تداخل المضخة مع حزم ستوكس مكانيا وزمنيا. ضبط OPO إلى 797.2 نانومتر. ينتج عن ذلك طول موجي CARS يبلغ 650 نانومتر. بسبب ارتفاع مستوى الطاقة ، فإن العودة الناتجة إلى الحالة الأرضية هي anti-Stokes (تحول أزرق) إلى الإثارة.
- التقط إشارة CARS في أجهزة الكشف عن EPI أو الأمامية غير المنزوعة المعلبة باستخدام مرشحات تمرير النطاق الترددي (640-680 نانومتر) متبوعة بالكشف المتسلسل عن ملصق التألق المناعي (في هذه الحالة المسمى بالفلورسنت Nissl).
ملاحظة: لم يتم التقاط علامة سوما الخلايا العصبية Nissl في مرشح الممر الترددي CARS 640-680 نانومتر ، مما يسمح بالجمع بين التألق وتصوير CARS في الصور المعروضة أدناه. - لا تشترك CARS والتألق في PMTs. استخدم هذه الإعدادات للحصول على إشارة الدهون المثلى لتصوير الميالين بشكل انتقائي في منطقة الدماغ.
تنبيه: حماية المستخدم من شعاع الليزر
- احفظ الصور كملفات .oib ، والتي يمكن استيرادها إلى برنامج تحليل الصور لمزيد من التحديد الكمي (الشكل 3).
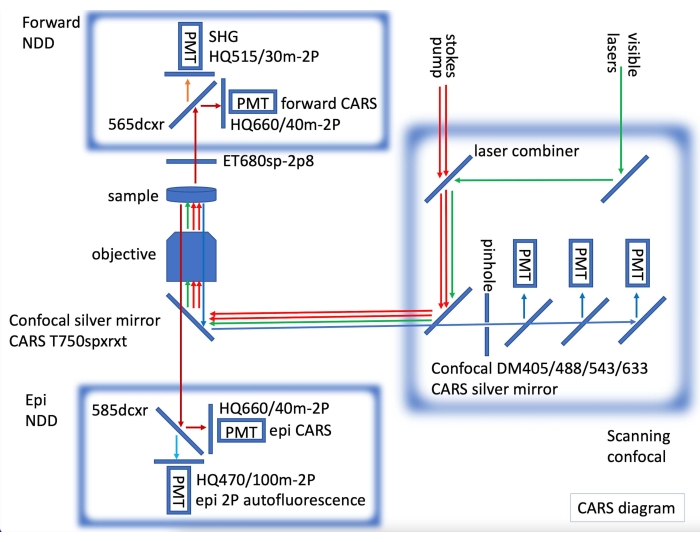
الشكل 2: رسم تخطيطي لأداة CARS يوضح ليزر CARS (الأسهم الحمراء) والكشف عن الليزر غير المنزوع (NDD) والكشف الأمامي المدمجين في مؤتمر المسح الضوئي بالليزر. في NDD إلى الأمام ، نحصل على CARS لسندات C-H (الأسهم الحمراء الداكنة) و SHG (الجينات التوافقية الثانية) عند 515 نانومتر (السهم البرتقالي). في epi NDD ، نحصل على CARS لروابط C-H (الأسهم الحمراء الداكنة) و 2PE (انبعاث الفوتون المزدوج) التألق الذاتي (سهم أزرق فاتح). بالتتابع ، يمكن الحصول على صور متحدة البؤرة الفلورية (الأسهم الخضراء لليزر المرئي ، والأسهم الزرقاء للكشف عن البؤرة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
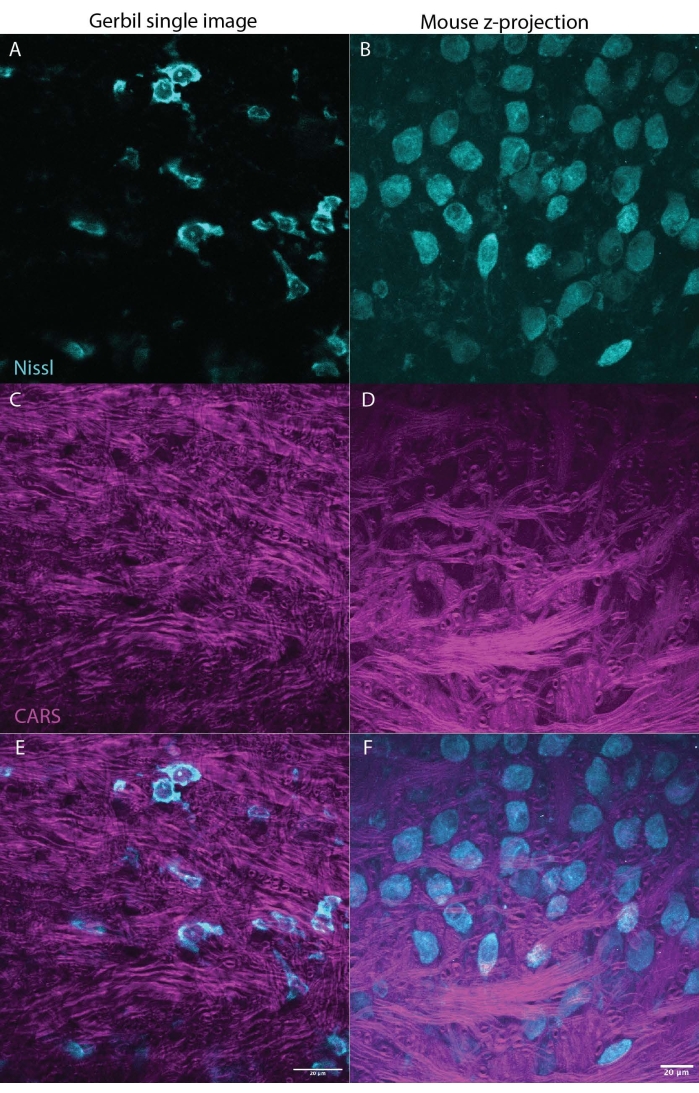
الشكل 3: يمكن ل CARS إلقاء الضوء على المايلين (الأرجواني) في أنسجة المخ (جذع الدماغ) أثناء تصوير علامات Nissl (السماوية) أو الفلورسنت. وتظهر اللوحتان نتائج تمثيلية من جربيل منغولي (صورة واحدة M. unguiculatus، الشكل 3A، C، E) والفأر (z-stack max projection M. musculus، الشكل 2B، D، F)، مما يشير إلى أنه يمكن استخدام هذه التقنية عبر الأنواع. يوضح الشكل 3A و B Nissl باللون السماوي ، C ، D إشارة CARS باللون الأرجواني ، E ، F يجمع بين إشارات Nissl و CARS مع كل لوحة للجربيل أو الماوس ، على التوالي. تظهر كلتا المجموعتين من الصور قسما من النواة الإنسية للجسم شبه المنحرف (MNTB) في جذع الدماغ. تتلقى الخلايا العصبية في MNTB مدخلات من محاور عصبية شديدة الميالين ، والتي تنتهي في كأس عقد ، وهو نوع من المشبك العملاق27. شريط المقياس هو 20 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
واحدة من أكبر مزايا المجهر CARS على التقنيات الأخرى هي التوافق مع التصوير الفلوري23. ويبين الشكل 1 أطياف CARS مقارنة ب Nissl الموسومة بعلامة الفلورسنت المناعي التي تظهر تداخلا ضئيلا / معدوما في الأطياف. يوضح الشكل 2 الليزر الذي تم إعداده ل CARS بالاقتران مع المجهر البؤري. يوضح الشكل 3 صورتين تمثيليتين ، واحدة ككومة واحدة وواحدة z-stack max الإسقاط من الجربيل والماوس التي يمكن الحصول عليها باستخدام تصوير CARS تظهر كلا من أجسام الخلايا (سماوي) وإشارة المايلين (أرجواني).
Discussion
تؤكد مجموعة متزايدة من الأدبيات على دور المايلين في وظائف الدماغ13،16،21،28. علاوة على ذلك ، نحن نعلم أن سمك الميالين ونمط الميالين يمكن أن يتغير في العديد من الحالات العصبية مثل التصلب المتعدد (تمت مراجعته في29) ، والشيخوخة (تمت مراجعته في 30) ، والتوحد20،31 ، وغيرها الكثير. لذلك ليس من المستغرب أن يحتاج المزيد والمزيد من الباحثين إلى تقييم الميالين عبر أنسجة المخ والنماذج الحيوانية ، في العديد من الحالات الطبية ، وفي عدد متزايد من المواقف التجريبية. تشمل الطرق التقليدية لتصوير الميالين في أنسجة المخ وضع العلامات على الأجسام المضادة متبوعة بالمجهر الضوئي والمجهر الإلكتروني (EM). تستغرق كلتا التقنيتين وقتا طويلا وتتطلبان بروتوكولات إعداد الأنسجة متعددة الخطوات ، والتي ترتبط بالأخطاء المحتملة والتغييرات في تكوين الأنسجة. لقد أظهرنا طريقة بديلة يمكن أن تسفر عن نتائج مماثلة بشكل أسرع بكثير بسبب القدرة على تصوير المايلين بشكل أسرع بكثير ، والتي يمكن دمجها مع المجهر الضوئي الفلوري الإضافي. الأهم من ذلك ، يمكن استخدام هذه التقنية لتصوير الدهون في أنسجة المخ دون الحاجة إلى علامات أو ملصقات إضافية. لا تسمح هذه التقنية فقط بتصوير المايلين على طول محاور سليمة ، ولكنها تسمح بتصوير منتجات انهيار المايلين مثل اللويحات أو القطرات السائلة32 ، والتي ثبت أنها تحدث ، على سبيل المثال ، في التصلب المتعدد33.
كان التردد الذي تم ضبط ليزر CARS عليه مناسبا لتحيز الصورة بشكل كبير لصالح الدهون ، مما أدى إلى صور عالية الجودة بشكل عام للميالين ، لأن المايلين هو إلى حد بعيد المادة الغنية بالدهون الأكثر شيوعا في الدماغ. مبدأ هذه التقنية هو أن ليزر CARS ، الذي يمكن ضبطه على ترددات مختلفة ، يتم ضبطه على 792.2 نانومتر ، وهو تردد مناسب لإثارة روابط CH2 . هذه وفيرة في الدهون ، والتي تحتوي على سلاسل طويلة من مجموعات CH2 المرتبطة بروابط الكربون والكربون مع مجموعة واحدة من حمض الكربوكسيل الطرفي في النهاية. أدت الدهون المثيرة مع هذا التردد إلى إشارة يمكن تصويرها بعد ذلك باستخدام تقنية الكشف عن المجهر البؤري القياسي. تدعم جودة الصور الناتجة التحليلات الكمية التي يمكن إجراؤها إما بواسطة مراقب بشري أو خوارزميات آلية34. ومع ذلك ، فإن هذه الطريقة لا تصنف المايلين حصريا لأن روابط CH2 ليست حصرية للمايلين ، وبالتالي فإن CARS أقل تحديدا من الجسم المضاد. نتيجة لذلك ، تظهر الصور بعض الملصقات ، والتي لا ترتبط بالمايلين. الأهم من ذلك ، أن تسمية الخلفية هذه لا تضر بجودة القياسات أو القدرة على التحليلات الكمية.
دقة تصوير CARS محدودة الحيود وتشبه اثنين من المجهر الفوتوني (~ 250 نانومتر) وبالتالي أقل من دقة EM. لذلك ، يجب على الباحثين الذين يهدفون إلى تقييم الاختلافات الصغيرة جدا في سمك الميالين عند حدوثه ، على سبيل المثال ، في بعض الحالات الطبية ، أن يكونوا على دراية بهذا القيد. يمكن أن تؤكد عناصر التحكم الإضافية في EM في عينة صغيرة أن الدقة كافية لهدف البحث الخاص بهم.
تتمثل إحدى المزايا الرئيسية ل CARS لتصوير المايلين ، إلى جانب السرعة والسهولة ، في القدرة على الجمع بين تصوير الدهون الخالي من الملصقات والمجهر البؤري الفلوري. اعتمادا على المجهر المستخدم في CARS ، يمكن تصوير قناتين أو حتى ثلاث قنوات إضافية بحيث يمكن دمج تصوير المايلين مع وضع العلامات على الأجسام المضادة ، أو بقعة Nissl ، أو خطوط الماوس المعدلة وراثيا التي تعبر عن بروتينات الفلورسنت ، أو ما شابه ذلك. القيود المحتملة باستخدام الفلوروفور الطول الموجي الأطول هي في الغالب لأن إشارة CARS يتم ملاحظتها من خلال مرشحات ممر النطاق الترددي 640-680 نانومتر التي يمكن أن تلتقط انبعاث الفلوروفورات الخضراء و / أو الحمراء. ومع ذلك ، فإن ليزر بيكو ثانية المستخدم في إثارة CARS لديه طاقة نبض ذروة ~ 10 مرات أقل من ليزر الفيمتو ثانية القياسي المستخدم في إثارة الفوتونين ، ويترجم إلى ~ 100 أقل من التألق. علاوة على ذلك ، فإن ليزر بيكو ثانية النبضي 797.2 نانومتر المستخدم في إثارة CARS بعيد طيفيا عن ذروة امتصاص المقطع العرضي ثنائي الفوتون للفلوروفورات المرئية. لذلك ، فإن ليزر بيكو ثانية CARS غير فعال للغاية لإثارة الفوتون المزدوج للفلوروفورات المرئية ، مما يجعل إشارة الفلورسنت لا تذكر للعبور إلى اكتشاف CACARS. ومع ذلك ، يجب اختبار ذلك عن طريق تصوير عينة تحكم سلبية لا تحتوي على أي ملصقات فلورسنت مقارنة بعينة ذات علامات فلورسنت.
في الختام ، يعد تصوير CARS تقنية مناسبة لتصوير المايلين في أنسجة المخ. في حين أن الدقة قابلة للمقارنة مع المجهر الضوئي القياسي وبالتالي فهي أقل من EM ، فإن السرعة وسهولة الاستخدام تجعل هذه التقنية بديلا جذابا للطرق الحالية.
Disclosures
ويعلن صاحبا البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
بدعم من NIH R01 DC 17924 و R01 DC 18401 (Klug) و NIH 1R15HD105231-01 و T32DC012280 و FRAXA (McCullagh). تم إجراء تصوير CARS في الجزء الأساسي من المجهر الضوئي المتقدم من مركز NeuroTechnology في الحرم الجامعي الطبي بجامعة كولورادو Anschutz المدعوم جزئيا من NIH P30 NS048154 و NIH P30 DK116073.
Materials
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| 1 mL disposable syringe with needle 27 GA x 0.5" | Exel int | 260040 | |
| Fatal + | Vortech | ||
| Surgery: | |||
| Spring Scissors - 8mm Cutting Edge | Fine Science Tools | 15024-10 | |
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Perfusion: | |||
| 4% Paraformaldehyde | Fisher Chemical | SF994 (CS) | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Kelly hemostats | Fine Science Tools | 13019-14 | |
| Millipore H2O | |||
| Needle tip, 23 GA x 1" | BD precision glide | 305193 | |
| Phosphate buffered saline (PBS): | |||
| Potassium chloride | Sigma | P9333 | |
| Potassium phosphate monobase | Sigma | P5655 | |
| pump with variable flow or equivalent | |||
| Sodium chloride | Fisher Chemical | s271-1 | |
| Sodiumphosphate dibasic | Sigma | S7907 | |
| Dissection: | |||
| 50 mL vial with 4% PFA | |||
| Bochem Chemical Spoon 180mm | Bochem | 230331000 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Noyes Spring Scissors | Fine Science Tools | 15011-12 | |
| Pair of fine (Graefe) tweezers | Fine Science Tools | 11050-10 | |
| Shallow glass or plastic tray, approximately 10" x 10" | |||
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Surgical Scissors - Blunt | Fine Science Tools | 14000-20 | |
| Slicing: | |||
| Agar, plant | RPI | 9002-18-0 | |
| Vibratome | Leica | VT1000s | |
| well plate | Alkali Sci. | TPN1048-NT | |
| Staining: | |||
| AB Media: | 1n 1,000 mL of Millipore H2O | ||
| Phosphate buffered (PB): | |||
| Potassium Phosphate Monobase | Sigma | P5655 | |
| Sodium Phosohate Dibasic | Sigma | S7907 | |
| BSA (Bovine serum albumin) | Sigma life science | A2153-100g | |
| Sodium Chloride | Fisher Chemical | s271-1 | |
| Triton X-100 | Sigma - Aldrich | x100-500ml | |
| Nissl 435/455 | Invitrogen | N21479 | |
| CARS: | |||
| APE picoemerald laser | Angewandte Physik & Elektronik GmbH | ||
| bandpass filter (420-520 nm) | Chroma Technology | HQ470/100m-2P | |
| bandpass filter (500-530 nm) | Chroma Technology | HQ515/30m-2P | |
| bandpass filters (640-680 nm) | Chroma Technology | HQ660/40m-2P | |
| Confocal microscope | Olympus | FV1000 | |
| Cut Transfer pipet | Fisher | 13-711-7M | |
| dichroic longpass 565 nm | Chroma Technology | 565dcxr | |
| dichroic longpass 585 nm | Chroma Technology | 585dcxr | |
| dichroic shortpass 750 nm | Chroma Technology | T750spxrxt | |
| glass bottom culture dish | MatTek | P35G-0-10-C | |
| glass weight (10 mm x 10 mm boro rod) | Allen Scientific Glass Inc | ||
| multiphoton shortpass emission filter 680 nm | Chroma Technology | ET680sp-2p8 | |
| PBS |
References
- Cole, K., Curtis, H. Electric impedance of the squid giant axon during activity. The Journal of General Physiology. 22 (5), 649-670 (1939).
- Cole, K. S., Curtis, H. J. Membrane potential of the squid giant axon during current flow. Journal of General Physiology. 24 (4), 551-563 (1941).
- Alcami, P., El Hady, A. Axonal computations. Frontiers in Cellular Neuroscience. 13, 413(2019).
- Neumann, E., Nachmansohn, D. Nerve excitability-Toward an integrating concept. Aharon Katzir Memorial Volume. , 99-166 (1975).
- Waxman, S. G. Integrative properties and design principles of axons. International Review of Neurobiology. 18, 1-40 (1975).
- Fitzhugh, R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophysical Journal. 2 (1), 11-21 (1962).
- Zalc, B. The acquisition of myelin: a success story. Novartis Foundation Symposium. 276, 275-281 (2006).
- Salzer, J. L., Zalc, B. Myelination. Current Biology. 26 (20), 971-975 (2016).
- Boullerne, A. I. The history of myelin. Experimental Neurology. 283, 431-445 (2016).
- Kuhn, S., Gritti, L., Crooks, D., Dombrowski, Y. Oligodendrocytes in development, myelin generation and beyond. Cells. 8 (11), 1424(2019).
- Saab, A. S., Nave, K. -A. Myelin dynamics: protecting and shaping neuronal functions. Current Opinion in Neurobiology. 47, 104-112 (2017).
- Chomiak, T., Hu, B. What is the optimal value of the g-Ratio for myelinated fibers in the rat CNS? A theoretical approach. PLOS ONE. 4 (11), 7754(2009).
- Ford, M. C., et al. Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications. 6, 8073(2015).
- Stange-Marten, A., et al. Input timing for spatial processing is precisely tuned via constant synaptic delays and myelination patterns in the auditory brainstem. Proceedings of the National Academy of Sciences of the United States of America. 114 (24), 4851-4858 (2017).
- Bu, J., Banki, A., Wu, Q., Nishiyama, A. Increased NG2+ glial cell proliferation and oligodendrocyte generation in the hypomyelinating mutant shiverer. Glia. 48 (1), 51-63 (2004).
- Pacey, L. K. K., et al. Delayed myelination in a mouse model of fragile X syndrome. Human Molecular Genetics. 22 (19), 3920-3930 (2013).
- Green, A. J., et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet. 390 (10111), London, England. 2481-2489 (2017).
- Jeon, S. J., Ryu, J. H., Bahn, G. H. Altered translational control of fragile X mental retardation protein on myelin proteins in neuropsychiatric disorders. Biomolecules & Therapeutics. 25 (3), 231-238 (2017).
- Barak, B., et al. Neuronal deletion of Gtf2i, associated with Williams syndrome, causes behavioral and myelin alterations rescuable by a remyelinating drug. Nature Neuroscience. 22 (5), 700-708 (2019).
- Phan, B. N., et al. A myelin-related transcriptomic profile is shared by Pitt-Hopkins syndrome models and human autism spectrum disorder. Nature Neuroscience. 23 (3), 375-385 (2020).
- Lucas, A., Poleg, S., Klug, A., McCullagh, E. A. Myelination deficits in the auditory brainstem of a mouse model of fragile X syndrome. Frontiers in Neuroscience. 15, 1536(2021).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. -X. Coherent anti-stokes raman scattering imaging of axonal myelin in live spinal ttissues. Biophysical Journal. 89 (1), 581-591 (2005).
- Kim, S. -H., et al. Multiplex coherent anti-stokes raman spectroscopy images intact atheromatous lesions and concomitantly identifies distinct chemical profiles of atherosclerotic lipids. Circulation Research. 106 (8), 1332-1341 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Tu, L., et al. Free-floating Immunostaining of Mouse Brains. Journal of Visualized Experiments. (176), e62876(2021).
- Fluorescence SpectraViewer. , Available from: https://www.thermofisher.com/order/fluorescence-spectraviewer (2022).
- Held, H. Die centrale gehörleitung. Arch Anat Physiol Anat Abt. 17, 201-248 (1893).
- Sherman, D. L., Brophy, P. J. Mechanisms of axon ensheathment and myelin growth. Nature Reviews Neuroscience. 6 (9), 683-690 (2005).
- Gruchot, J., et al. The molecular basis for remyelination failure in multiple sclerosis. Cells. 8 (8), 825(2019).
- Rivera, A. D., et al. Epidermal growth factor pathway in the age-related decline of oligodendrocyte regeneration. Frontiers in Cellular Neuroscience. 16, 838007(2022).
- Kútna, V., O'Leary, V. B., Hoschl, C., Ovsepian, S. V. Cerebellar demyelination and neurodegeneration associated with mTORC1 hyperactivity may contribute to the developmental onset of autism-like neurobehavioral phenotype in a rat model. Autism Research: Official Journal of the International Society for Autism Research. 15 (5), 791-805 (2022).
- Ozsvár, A., et al. Quantitative analysis of lipid debris accumulation caused by cuprizone induced myelin degradation in different CNS areas. Brain Research Bulletin. 137, 277-284 (2018).
- Prineas, J. W., Graham, J. S. Multiple sclerosis: capping of surface immunoglobulin G on macrophages engaged in myelin breakdown. Annals of Neurology. 10 (2), 149-158 (1981).
- Bégin, S., et al. Automated method for the segmentation and morphometry of nerve fibers in large-scale CARS images of spinal cord tissue. Biomedical Optics Express. 5 (12), 4145-4161 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved