Method Article
Aplicação coerente de espectroscopia Raman anti-Stokes (CARS) para mielinização por imagem em fatias cerebrais
Neste Artigo
Resumo
Visualizar a mielinização é um objetivo importante para muitos pesquisadores que estudam o sistema nervoso. CARS é uma técnica compatível com a imunofluorescência que pode fotografar nativamente lipídios dentro do tecido, como o cérebro, iluminando estruturas especializadas, como a mielina.
Resumo
A espectroscopia Raman anti-Stokes coerente (CARS) é uma técnica classicamente empregada por químicos e físicos para produzir um sinal coerente de vibrações de assinatura de moléculas. No entanto, essas assinaturas vibracionais também são características de moléculas dentro do tecido anatômico, como o cérebro, tornando-o cada vez mais útil e aplicável para aplicações de Neurociência. Por exemplo, o CARS pode medir lipídios por ligações químicas especificamente excitantes dentro dessas moléculas, permitindo a quantificação de diferentes aspectos do tecido, como a mielina envolvida na neurotransmissão. Além disso, em comparação com outras técnicas tipicamente usadas para quantificar a mielina, o CARS também pode ser configurado para ser compatível com técnicas de imunofluorescência, permitindo a co-marcação com outros marcadores, como canais de sódio ou outros componentes da transmissão sináptica. As alterações da mielinização são um mecanismo inerentemente importante em doenças desmielinizantes, como a esclerose múltipla ou outras condições neurológicas, como a Síndrome do X Frágil ou os transtornos do espectro do autismo, é uma área emergente de pesquisa. Em conclusão, o CARS pode ser utilizado de maneiras inovadoras para responder a questões prementes em Neurociência e fornecer evidências de mecanismos subjacentes relacionados a muitas condições neurológicas diferentes.
Introdução
Os potenciais de ação são a unidade básica de informação no cérebro, e a propagação do potencial de ação através dos axônios constitui um pilar do processamento da informação 1,2,3. Os neurônios normalmente recebem entradas aferentes de vários outros neurônios e integram essas entradas dentro de uma determinada janela de tempo estreita 4,5. Portanto, os mecanismos de propagação do potencial de ação nos axônios têm recebido uma quantidade significativa de atenção dos pesquisadores.
Ao se propagar através de um axônio, um potencial de ação é regenerado repetidamente ao longo do axônio para garantir uma propagação confiável6. Na maioria dos neurônios de vertebrados mandibulares (gnatohostomas) os axônios são cercados por uma bainha de mielina, que é uma substância rica em lipídios produzida por oligodendrócitos próximos ou células de Schwann, que são tipos de células gliais (revisadas em 7,8). Esta bainha de mielina isola eletricamente o axônio, reduzindo sua capacitância e permitindo a propagação do potencial de ação de forma eficiente, rápida e com menor consumo de energia. A mielina não cobre o axônio uniformemente, mas revestia o axônio em segmentos que têm lacunas curtas entre eles, chamados de nós de Ranvier (revisado em 9,10). Tanto a espessura da mielinização, que controla o nível de isolamento elétrico de um axônio, quanto o espaçamento dos nós de Ranvier, que controlam a frequência com que os potenciais de ação são regenerados ao longo de um axônio, influenciam a velocidade de propagação do potencial de ação (revisado em11).
Há um grande corpo de literatura sugerindo que a espessura da mielinização afeta a velocidade de propagação do potencial de ação em axônios12,13,14. Além disso, alterações na mielinização axônica podem resultar em vários déficits do SNC 15,16,17,18,19,20,21. Portanto, não é surpreendente que o foco de muitos esforços de pesquisa envolva a medição e caracterização da mielinização axônica. As medições da espessura da mielina têm sido mais comumente feitas com microscopia eletrônica, uma técnica que requer uma quantidade significativa de preparação tecidual e é difícil de usar em combinação com a imuno-histoquímica. No entanto, existe também uma técnica mais rápida e simples para medir a mielinização axônica que é baseada na Espectroscopia Raman Anti-Stokes Coerente (CARS). Um laser CARS pode ser sintonizado em várias frequências e, quando sintonizado em frequências adequadas para excitar lipídios, a mielina pode ser fotografada sem a necessidade de rótulos adicionais22. A imagem lipídica pode ser combinada com imuno-histoquímica padrão, de modo que os lipídios possam ser fotografados juntamente com vários canais fluorescentes23. A mielinização por imagem com CARS é significativamente mais rápida do que a microscopia eletrônica e tem uma resolução que é, embora menor que a EM, suficiente para detectar até mesmo pequenas diferenças na mielinização no mesmo tipo de axônios.
Protocolo
Todos os experimentos cumpriram todas as leis aplicáveis, diretrizes do National Institutes of Health e foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade do Colorado em Anschutz.
1. Animais
- Use camundongos C57BL/6J (estoque #000664) (Mus musculus ) obtidos do Laboratório Jackson ou gerbilos mongóis (Meriones unguiculatus) originalmente obtidos do rio Charles.
2. Preparação de tecidos
- Para perfusão transcárdica, overdose de espécies de roedores de interesse com pentobarbital (120 mg/kg de peso corporal) e transcardialmente perfundi-los com solução salina tamponada com fosfato (PBS; 137 mM NaCl, 2,7 mM KCl, 1,76 mM KH 2 PO 4, 10 mM Na2HPO 4) seguido de4% de paraformaldeído (PFA)24.
- Especificamente, abra o abdômen e a caixa torácica usando uma tesoura e segure a caixa torácica no lugar com pinça hemostática de Kelly para expor o coração.
- Insira uma agulha de 23 GA conectada a uma bomba de perfusão no ventrículo esquerdo e corte rapidamente o átrio direito usando uma tesoura fina.
- Administrar PBS através da bomba de perfusão e da agulha no coração por 10 minutos para limpar o cérebro e o corpo de sangue.
- Mude a bomba de perfusão para PFA a 4% por 10 minutos e verifique a rigidez dos membros e da cauda para confirmar o sucesso da perfusão.
- Após a perfusão, decapite os animais e remova o cérebro do crânio. Mantenha os cérebros durante a noite em 4% de PFA antes de transferir para PBS. Incorpore os caules cerebrais em agarose a 4% (em PBS) e corte coronalmente usando um vibratome de 200 μm de espessura.
3. Coloração
- Corte livre de cortes flutuantes para Nissl, para visualizar corpos celulares (1:100), em meio de anticorpos (meio AB: tampão fosfato 0,1 M (PB: 50 mM KH 2 PO 4,150 mM Na2HPO4), NaCl 150 mM, Triton-X 3 mM, albumina sérica bovina a 1% (BSA)) por 30 min à temperatura ambiente em um agitador de laboratório padrão25.
- Proteja as seções da luz usando papel alumínio e/ou uma tampa. Comprimentos de onda de 550 nm ou menos são compatíveis com imagens CARS (Figura 1).
NOTA: Embora não esperemos que o Triton-X ou outros reagentes tenham um impacto na imagem CARS de lipídios, controles adicionais com meios de anticorpos específicos podem ser justificados.
- Proteja as seções da luz usando papel alumínio e/ou uma tampa. Comprimentos de onda de 550 nm ou menos são compatíveis com imagens CARS (Figura 1).
- PONTO DE PAUSA: Armazene seções flutuantes livres (enquanto protegidas da luz) no PBS até a geração de imagens. Uma vez seccionado, imagens do cérebro seções dentro de 2 semanas.

Figura 1: A imagem CARS pode ser combinada com imagens imunofluorescentes. Os gráficos mostram que a imagem CARS ocorre no espectro de sinal vermelho de 660/640 nm26. Esse comprimento de onda está suficientemente distante da faixa verde, azul ou UV, permitindo a combinação do sinal CARS com a imunofluorescência nessas faixas. Especificamente, o gráfico também indica a excitação e a emissão de Nissl marcada com fluoróforo azul, que foi combinado com CARS durante a coleta de resultados representativos para esta publicação. Por favor, clique aqui para ver uma versão maior desta figura.
4. Imagens
NOTA: A configuração do laser CARS contém um laser de fibra que fornece o relógio de 80 MHz e um laser OPO (Optical Parametric Oscillator) com uma faixa ajustável de 770-990 nm com o feixe Stokes fixado em 1031 nm, que são necessários para coletar o sinal CARS. Há uma abertura para ambos os feixes.
- Antes de trazer amostras para o microscópio, ligue e aqueça o laser CARS por pelo menos 1 h, alinhe o laser CARS e Koehler a óptica do condensador e o diafragma do microscópio para imagens CARS para frente.
NOTA: Esta etapa é fundamental para o bom funcionamento da microscopia CARS.- Para o alinhamento espacial dos dois feixes de laser (bomba e stokes), acesse os dois PSDs internos (detectores sensíveis à posição) através da GUI do laser CARS.
- Alcance o alinhamento temporal usando a função de atraso na GUI do laser CARS, que pode ajudar a sobrepor os pulsos dos dois lasers (bomba e stokes) que têm dispersões diferentes devido aos seus diferentes comprimentos de onda. Portanto, tanto a sobreposição temporal quanto a espacial dos feixes de bomba e stokes são feitas com a entrada do usuário através da GUI.
- Ajuste o periscópio externo (dois últimos espelhos da configuração) para centralizar os dois lasers espacialmente sobrepostos nos espelhos de cabeça de varredura do microscópio.
- Para uma melhor detecção CARS não descarada, certifique-se de que o condensador é Koehler-ed (o que significa que o condensador está centrado e focado no diafragma para obter iluminação uniforme)
- Para imagens confocais de imunofluorescência e imagens CARS, ajuste o laser CARS, com detectores não descantados (NDDs) CARS para frente e epi, incorporando um microscópio confocal equipado com lasers visíveis para imagem de fluorescência (Figura 2).
- Coloque seções em um prato de cultura com coverslip (para microscopia invertida), PBS para evitar que o tecido seque e um peso de vidro para manter o tecido perto do coverslip.
- Tire z-stacks ou imagens únicas com um objetivo de água corrigido no infravermelho de 60X, 1,2 NA, que serve para a coleta do sinal CARS na direção epi e através de um condensador de 0,55 NA na direção para a frente para imagens de áreas cerebrais, como o núcleo medial do corpo trapézio (MNTB).
- Tire as imagens CARS em aproximadamente 600 mW de bomba/sonda e 300 mW de Stokes, usando a GUI do laser CARS. Esses valores de potência do laser são medidos internamente pelo sistema. As potências de ambos os lasers no local da amostra são inferiores a 25 mW e seguras para a amostra de tecido.
- Sobreponha a bomba e os feixes de Stokes espacial e temporalmente. Ajuste o OPO para 797,2 nm. Isso produz um comprimento de onda CARS de 650 nm. Devido ao nível de energia mais alto, o retorno resultante ao estado fundamental é anti-Stokes (deslocado para o azul) para a excitação.
- Capture o sinal CARS em detectores epi ou encaminhados não desdecantados usando filtros passa-banda (640-680 nm) seguidos de detecção sequencial do rótulo de imunofluorescência (neste caso, marcado fluorescentemente Nissl).
NOTA: O marcador de soma neuronal Nissl não é capturado no filtro passa-banda CARS 640-680 nm, permitindo a combinação de fluorescência e imagem CARS nas imagens apresentadas abaixo. - O CARS e a fluorescência não compartilham PMTs. Use essas configurações para obter o sinal lipídico ideal para visualizar seletivamente a mielinização na área do cérebro.
CUIDADO: Proteja o usuário do feixe de laser
- Salve as imagens como arquivos .oib, que podem ser importados para um programa de análise de imagem para quantificação adicional (Figura 3).
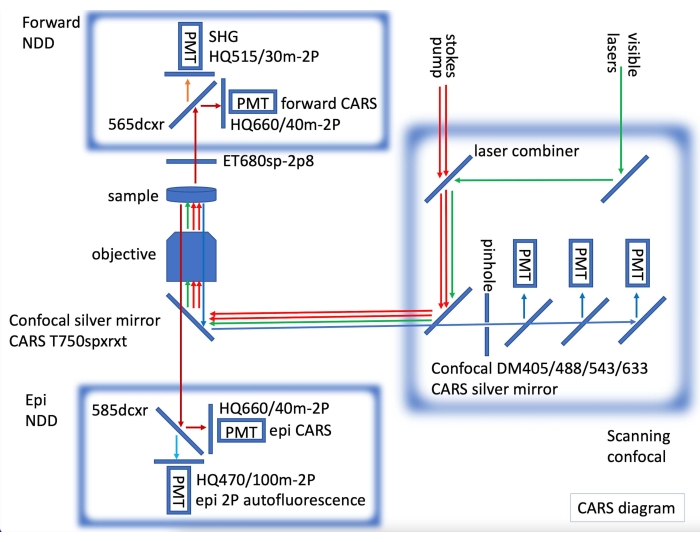
Figura 2: Diagrama de instrumentos CARS mostrando lasers CARS (setas vermelhas) e detecção epi e forward não descanned (NDD) incorporados em uma varredura a laser confocal. No NDD para a frente adquirimos CARS para ligações C-H (setas vermelhas escuras) e SHG (segunda generatina harmônica) a 515 nm (seta laranja). Em epi NDD, adquirimos CARS para ligações C-H (setas vermelhas escuras) e autofluorescência 2PE (emissão de dois fótons) (seta azul clara). Sequencialmente, imagens confocais de fluorescência podem ser adquiridas (setas verdes para laser visível, setas azuis para detecção confocal). Por favor, clique aqui para ver uma versão maior desta figura.
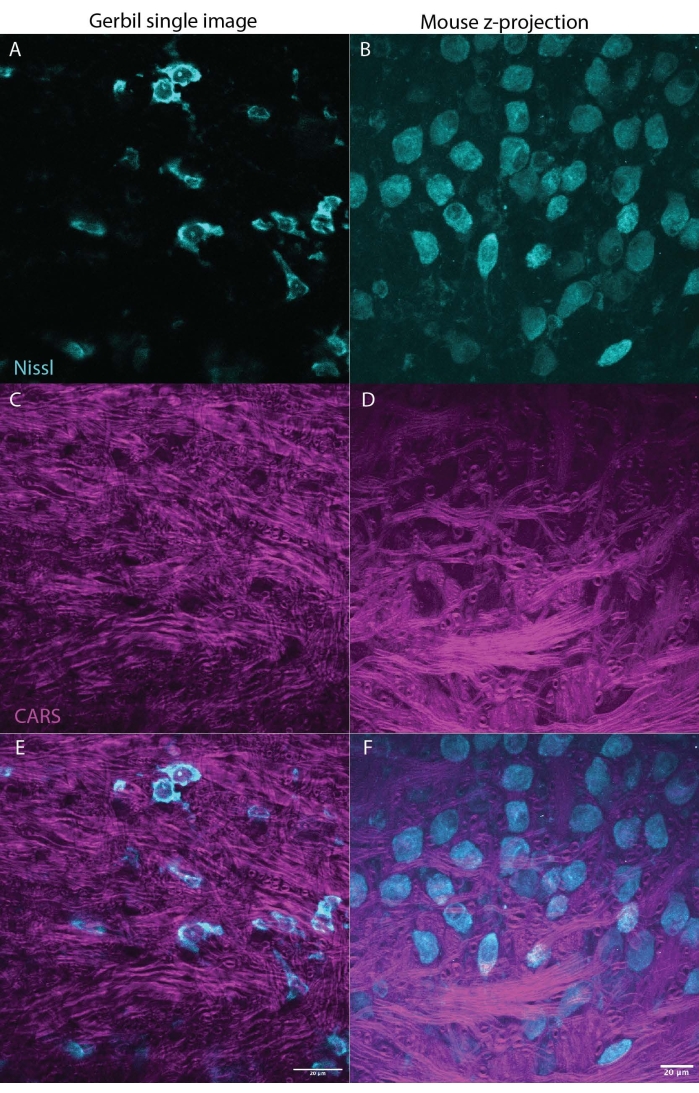
Figura 3: O CARS pode iluminar a mielina (magenta) no tecido cerebral (tronco encefálico) enquanto também cria imagens de Nissl (ciano) ou marcadores fluorescentes. Os dois painéis mostram resultados representativos de um cérebro de gerbil mongol (imagem única M. unguiculatus, Figura 3A,C,E) e rato (projeção máxima de pilha z M. musculus, Figura 2B,D,F), indicando que esta técnica pode ser usada em todas as espécies. Figura 3A,B mostrando Nissl em ciano, C,D mostram o sinal CARS em magenta, E,F combinam os sinais Nissl e CARS com cada painel para gerbil ou mouse, respectivamente. Ambos os conjuntos de imagens mostram uma seção do núcleo medial do corpo trapézio (MNTB) no tronco cerebral. Os neurônios do MNTB recebem entradas de axônios fortemente mielinizados, que terminam no cálice de held, um tipo de sinapse gigante27. A barra de escala é de 20 μm. Clique aqui para ver uma versão maior desta figura.
Resultados
Uma das maiores vantagens da microscopia CARS em relação a outras técnicas é a compatibilidade com imagens fluorescentes23. A Figura 1 mostra os espectros CARS em comparação com o Nissl marcado com marcador imunofluorescente mostrando pouca ou nenhuma sobreposição nos espectros. A Figura 2 ilustra a configuração do laser para o CARS em combinação com a microscopia confocal. A Figura 3 demonstra duas imagens representativas, uma como uma única pilha e uma projeção z-stack max de gerbil e camundongo que podem ser obtidas usando imagens CARS mostrando ambos os corpos celulares (ciano) e sinal de mielina (magenta).
Discussão
Um crescente corpo de literatura enfatiza o papel da mielina na função cerebral 13,16,21,28. Além disso, sabemos que a espessura da mielinização e o padrão de mielinização podem mudar em várias condições neurológicas, como esclerose múltipla (revisada em29), envelhecimento (revisada em30), autismo 20,31 e muitas outras. Portanto, não é surpreendente que mais e mais investigadores precisem avaliar a mielinização em tecidos cerebrais e modelos animais, em várias condições médicas e em um número crescente de situações experimentais. Os métodos tradicionais para mielinização de imagens no tecido cerebral incluem marcação de anticorpos seguida de microscopia de luz e microscopia eletrônica (EM). Ambas as técnicas são demoradas e requerem protocolos de preparação tecidual de várias etapas, que estão associados a possíveis erros e alterações na composição tecidual. Demonstramos um método alternativo que pode produzir resultados semelhantes muito mais rapidamente devido à capacidade de visualizar a mielina muito mais rapidamente, e que pode ser combinado com microscopia de luz de fluorescência adicional. É importante ressaltar que essa técnica pode ser usada para visualizar lipídios no tecido cerebral sem a necessidade de marcadores ou rótulos adicionais. Essa técnica não apenas permite a imagem da mielina ao longo de axônios intactos, mas também permite a imagem de produtos de degradação da mielina, como placas ou gotículas líquidas32, que demonstraram ocorrer, por exemplo, na esclerose múltipla33.
A frequência com que o laser CARS foi ajustado foi adequada para enviesar a imagem fortemente em favor dos lipídios, resultando em imagens gerais de alta qualidade de mielinização, uma vez que a mielina é de longe a substância rica em lipídios mais comum no cérebro. O princípio desta técnica é que um laser CARS, que pode ser sintonizado em várias frequências, é sintonizado a 792,2 nm, que é uma frequência adequada para excitar ligações CH2 . Estes são abundantes em lipídios, que contêm longas cadeias de grupos CH2 ligados por ligações carbono-carbono com um grupo de ácido carboxílico terminal no final. Lipídios excitantes com essa frequência resultaram em um sinal que poderia então ser fotografado com a tecnologia padrão de detecção de microscópio confocal. A qualidade das imagens resultantes suporta análises quantitativas que podem ser feitas por um observador humano ou algoritmos automatizados34. No entanto, este método não rotula exclusivamente a mielina, uma vez que as ligações CH2 não são exclusivas da mielina e, portanto, o CARS é menos específico do que um anticorpo seria. Como resultado, as imagens mostram algum rótulo, que não está associado à mielina. É importante ressaltar que esse rótulo de fundo não compromete a qualidade das medições ou a capacidade de análises quantitativas.
A resolução da imagem CARS é limitada à difração e semelhante a duas microscopias de fótons (~ 250 nm) e, portanto, menor que a da EM. Portanto, os pesquisadores que visam avaliar diferenças muito pequenas na espessura da mielinização como ocorre, por exemplo, em certas condições médicas, precisam estar cientes dessa limitação. Controles EM adicionais em uma pequena amostra podem confirmar que a resolução é suficiente para o objetivo de pesquisa.
Uma grande vantagem do CARS para a imagem da mielina, além da velocidade e facilidade, é a capacidade de combinar a imagem lipídica livre de rótulo com a microscopia confocal de fluorescência. Dependendo do microscópio usado para o CARS, dois ou até três canais adicionais podem ser fotografados de tal forma que a imagem da mielina pode ser combinada com marcação de anticorpos, coloração de Nissl, linhas de camundongos transgênicos expressando proteínas fluorescentes ou similares. As limitações potenciais usando fluoróforo de comprimento de onda mais longo são principalmente porque o sinal CARS é observado através de filtros passa-banda de 640-680 nm que podem capturar a emissão de fluoróforos verdes e / ou vermelhos. No entanto, o laser de picossegundos usado para excitação CARS tem uma energia de pulso de pico de ~ 10 vezes menor do que o laser de femtossegundos padrão usado para excitação de dois fótons, traduzido em ~ 100 a menos de fluorescência. Além disso, o laser de picossegundos de pulso de 797,2 nm usado para excitação CARS está espectralmente longe do pico da absorção de seção transversal de dois fótons dos fluoróforos visíveis. Portanto, o laser de picossegundos CARS é muito ineficiente para a excitação de dois fótons de fluoróforos visíveis, tornando o sinal fluorescente insignificante para cruzar para a detecção CARS. No entanto, isso deve ser testado por imagem de uma amostra de controle negativo que não tenha rótulos fluorescentes em comparação com uma amostra com marcadores fluorescentes.
Em conclusão, a imagem CARS é uma técnica adequada para a imagem da mielina no tecido cerebral. Embora a resolução seja comparável à microscopia de luz padrão e, portanto, seja menor que a EM, a velocidade e a facilidade de uso tornam essa técnica uma alternativa atraente aos métodos existentes.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Suportado por NIH R01 DC 17924, R01 DC 18401 (Klug) e NIH 1R15HD105231-01, T32DC012280 e FRAXA (McCullagh). A imagem CARS foi realizada na parte do núcleo de microscopia de luz avançada do Centro de Neurotecnologia do Campus Médico Anschutz da Universidade do Colorado, apoiada em parte pelo NIH P30 NS048154 e NIH P30 DK116073.
Materiais
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| 1 mL disposable syringe with needle 27 GA x 0.5" | Exel int | 260040 | |
| Fatal + | Vortech | ||
| Surgery: | |||
| Spring Scissors - 8mm Cutting Edge | Fine Science Tools | 15024-10 | |
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Perfusion: | |||
| 4% Paraformaldehyde | Fisher Chemical | SF994 (CS) | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Kelly hemostats | Fine Science Tools | 13019-14 | |
| Millipore H2O | |||
| Needle tip, 23 GA x 1" | BD precision glide | 305193 | |
| Phosphate buffered saline (PBS): | |||
| Potassium chloride | Sigma | P9333 | |
| Potassium phosphate monobase | Sigma | P5655 | |
| pump with variable flow or equivalent | |||
| Sodium chloride | Fisher Chemical | s271-1 | |
| Sodiumphosphate dibasic | Sigma | S7907 | |
| Dissection: | |||
| 50 mL vial with 4% PFA | |||
| Bochem Chemical Spoon 180mm | Bochem | 230331000 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Noyes Spring Scissors | Fine Science Tools | 15011-12 | |
| Pair of fine (Graefe) tweezers | Fine Science Tools | 11050-10 | |
| Shallow glass or plastic tray, approximately 10" x 10" | |||
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Surgical Scissors - Blunt | Fine Science Tools | 14000-20 | |
| Slicing: | |||
| Agar, plant | RPI | 9002-18-0 | |
| Vibratome | Leica | VT1000s | |
| well plate | Alkali Sci. | TPN1048-NT | |
| Staining: | |||
| AB Media: | 1n 1,000 mL of Millipore H2O | ||
| Phosphate buffered (PB): | |||
| Potassium Phosphate Monobase | Sigma | P5655 | |
| Sodium Phosohate Dibasic | Sigma | S7907 | |
| BSA (Bovine serum albumin) | Sigma life science | A2153-100g | |
| Sodium Chloride | Fisher Chemical | s271-1 | |
| Triton X-100 | Sigma - Aldrich | x100-500ml | |
| Nissl 435/455 | Invitrogen | N21479 | |
| CARS: | |||
| APE picoemerald laser | Angewandte Physik & Elektronik GmbH | ||
| bandpass filter (420-520 nm) | Chroma Technology | HQ470/100m-2P | |
| bandpass filter (500-530 nm) | Chroma Technology | HQ515/30m-2P | |
| bandpass filters (640-680 nm) | Chroma Technology | HQ660/40m-2P | |
| Confocal microscope | Olympus | FV1000 | |
| Cut Transfer pipet | Fisher | 13-711-7M | |
| dichroic longpass 565 nm | Chroma Technology | 565dcxr | |
| dichroic longpass 585 nm | Chroma Technology | 585dcxr | |
| dichroic shortpass 750 nm | Chroma Technology | T750spxrxt | |
| glass bottom culture dish | MatTek | P35G-0-10-C | |
| glass weight (10 mm x 10 mm boro rod) | Allen Scientific Glass Inc | ||
| multiphoton shortpass emission filter 680 nm | Chroma Technology | ET680sp-2p8 | |
| PBS |
Referências
- Cole, K., Curtis, H. Electric impedance of the squid giant axon during activity. The Journal of General Physiology. 22 (5), 649-670 (1939).
- Cole, K. S., Curtis, H. J. Membrane potential of the squid giant axon during current flow. Journal of General Physiology. 24 (4), 551-563 (1941).
- Alcami, P., El Hady, A. Axonal computations. Frontiers in Cellular Neuroscience. 13, 413(2019).
- Neumann, E., Nachmansohn, D. Nerve excitability-Toward an integrating concept. Aharon Katzir Memorial Volume. , 99-166 (1975).
- Waxman, S. G. Integrative properties and design principles of axons. International Review of Neurobiology. 18, 1-40 (1975).
- Fitzhugh, R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophysical Journal. 2 (1), 11-21 (1962).
- Zalc, B. The acquisition of myelin: a success story. Novartis Foundation Symposium. 276, 275-281 (2006).
- Salzer, J. L., Zalc, B. Myelination. Current Biology. 26 (20), 971-975 (2016).
- Boullerne, A. I. The history of myelin. Experimental Neurology. 283, 431-445 (2016).
- Kuhn, S., Gritti, L., Crooks, D., Dombrowski, Y. Oligodendrocytes in development, myelin generation and beyond. Cells. 8 (11), 1424(2019).
- Saab, A. S., Nave, K. -A. Myelin dynamics: protecting and shaping neuronal functions. Current Opinion in Neurobiology. 47, 104-112 (2017).
- Chomiak, T., Hu, B. What is the optimal value of the g-Ratio for myelinated fibers in the rat CNS? A theoretical approach. PLOS ONE. 4 (11), 7754(2009).
- Ford, M. C., et al. Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications. 6, 8073(2015).
- Stange-Marten, A., et al. Input timing for spatial processing is precisely tuned via constant synaptic delays and myelination patterns in the auditory brainstem. Proceedings of the National Academy of Sciences of the United States of America. 114 (24), 4851-4858 (2017).
- Bu, J., Banki, A., Wu, Q., Nishiyama, A. Increased NG2+ glial cell proliferation and oligodendrocyte generation in the hypomyelinating mutant shiverer. Glia. 48 (1), 51-63 (2004).
- Pacey, L. K. K., et al. Delayed myelination in a mouse model of fragile X syndrome. Human Molecular Genetics. 22 (19), 3920-3930 (2013).
- Green, A. J., et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet. 390 (10111), London, England. 2481-2489 (2017).
- Jeon, S. J., Ryu, J. H., Bahn, G. H. Altered translational control of fragile X mental retardation protein on myelin proteins in neuropsychiatric disorders. Biomolecules & Therapeutics. 25 (3), 231-238 (2017).
- Barak, B., et al. Neuronal deletion of Gtf2i, associated with Williams syndrome, causes behavioral and myelin alterations rescuable by a remyelinating drug. Nature Neuroscience. 22 (5), 700-708 (2019).
- Phan, B. N., et al. A myelin-related transcriptomic profile is shared by Pitt-Hopkins syndrome models and human autism spectrum disorder. Nature Neuroscience. 23 (3), 375-385 (2020).
- Lucas, A., Poleg, S., Klug, A., McCullagh, E. A. Myelination deficits in the auditory brainstem of a mouse model of fragile X syndrome. Frontiers in Neuroscience. 15, 1536(2021).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. -X. Coherent anti-stokes raman scattering imaging of axonal myelin in live spinal ttissues. Biophysical Journal. 89 (1), 581-591 (2005).
- Kim, S. -H., et al. Multiplex coherent anti-stokes raman spectroscopy images intact atheromatous lesions and concomitantly identifies distinct chemical profiles of atherosclerotic lipids. Circulation Research. 106 (8), 1332-1341 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Tu, L., et al. Free-floating Immunostaining of Mouse Brains. Journal of Visualized Experiments. (176), e62876(2021).
- Fluorescence SpectraViewer. , Available from: https://www.thermofisher.com/order/fluorescence-spectraviewer (2022).
- Held, H. Die centrale gehörleitung. Arch Anat Physiol Anat Abt. 17, 201-248 (1893).
- Sherman, D. L., Brophy, P. J. Mechanisms of axon ensheathment and myelin growth. Nature Reviews Neuroscience. 6 (9), 683-690 (2005).
- Gruchot, J., et al. The molecular basis for remyelination failure in multiple sclerosis. Cells. 8 (8), 825(2019).
- Rivera, A. D., et al. Epidermal growth factor pathway in the age-related decline of oligodendrocyte regeneration. Frontiers in Cellular Neuroscience. 16, 838007(2022).
- Kútna, V., O'Leary, V. B., Hoschl, C., Ovsepian, S. V. Cerebellar demyelination and neurodegeneration associated with mTORC1 hyperactivity may contribute to the developmental onset of autism-like neurobehavioral phenotype in a rat model. Autism Research: Official Journal of the International Society for Autism Research. 15 (5), 791-805 (2022).
- Ozsvár, A., et al. Quantitative analysis of lipid debris accumulation caused by cuprizone induced myelin degradation in different CNS areas. Brain Research Bulletin. 137, 277-284 (2018).
- Prineas, J. W., Graham, J. S. Multiple sclerosis: capping of surface immunoglobulin G on macrophages engaged in myelin breakdown. Annals of Neurology. 10 (2), 149-158 (1981).
- Bégin, S., et al. Automated method for the segmentation and morphometry of nerve fibers in large-scale CARS images of spinal cord tissue. Biomedical Optics Express. 5 (12), 4145-4161 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados