Method Article
Kohärente Anti-Stokes-Raman-Spektroskopie (CARS) Anwendung zur Bildgebung der Myelinisierung in Gehirnschnitten
In diesem Artikel
Zusammenfassung
Die Visualisierung der Myelinisierung ist ein wichtiges Ziel für viele Forscher, die das Nervensystem untersuchen. CARS ist eine Technik, die mit der Immunfluoreszenz kompatibel ist und nativ Lipide in Geweben wie dem Gehirn abbilden kann, die spezialisierte Strukturen wie Myelin beleuchten.
Zusammenfassung
Die kohärente Anti-Stokes-Raman-Spektroskopie (CARS) ist eine Technik, die klassischerweise von Chemikern und Physikern eingesetzt wird, um ein kohärentes Signal von Signaturschwingungen von Molekülen zu erzeugen. Diese Schwingungssignaturen sind jedoch auch charakteristisch für Moleküle in anatomischem Gewebe wie dem Gehirn, was sie zunehmend nützlich und anwendbar für neurowissenschaftliche Anwendungen macht. Zum Beispiel kann CARS Lipide messen, indem es chemische Bindungen innerhalb dieser Moleküle spezifisch anregt, was die Quantifizierung verschiedener Aspekte des Gewebes ermöglicht, wie Myelin, das an der Neurotransmission beteiligt ist. Darüber hinaus kann CARS im Vergleich zu anderen Techniken, die typischerweise zur Quantifizierung von Myelin verwendet werden, auch so eingerichtet werden, dass sie mit immunfluoreszierenden Techniken kompatibel sind, was eine Co-Markierung mit anderen Markern wie Natriumkanälen oder anderen Komponenten der synaptischen Übertragung ermöglicht. Myelinisierungsveränderungen sind ein inhärent wichtiger Mechanismus bei demyelinisierenden Krankheiten wie Multipler Sklerose oder anderen neurologischen Erkrankungen wie dem Fragile-X-Syndrom oder Autismus-Spektrum-Störungen ist ein aufstrebendes Forschungsgebiet. Zusammenfassend lässt sich sagen, dass CARS auf innovative Weise eingesetzt werden kann, um drängende Fragen in den Neurowissenschaften zu beantworten und Beweise für die zugrunde liegenden Mechanismen im Zusammenhang mit vielen verschiedenen neurologischen Erkrankungen zu liefern.
Einleitung
Aktionspotentiale sind die grundlegende Informationseinheit im Gehirn, und die Ausbreitung des Aktionspotentials durch Axone bildet eine Säule der Informationsverarbeitung 1,2,3. Neuronen erhalten typischerweise afferente Eingaben von mehreren anderen Neuronen und integrieren diese Eingaben innerhalb eines bestimmten engen Zeitfensters 4,5. Daher haben die Mechanismen der potenziellen Ausbreitung von Axonen eine signifikante Aufmerksamkeit von Forschern erhalten.
Bei der Ausbreitung durch ein Axon wird ein Aktionspotential wiederholt entlang des Axons regeneriert, um eine zuverlässige Ausbreitungzu gewährleisten 6. In den meisten Neuronen von Kieferwirbeltieren (Gnathostomen) sind die Axone von einer Hülle aus Myelin umgeben, einer lipidreichen Substanz, die von nahe gelegenen Oligodendrozyten oder Schwann-Zellen produziert wird, die Arten von Gliazellen sind (überprüft in 7,8). Diese Myelinhülle isoliert das Axon elektrisch, reduziert seine Kapazität und ermöglicht eine effiziente, schnelle und mit geringerem Energieverbrauch ausbreitende Ausbreitung des Aktionspotentials. Myelin bedeckt das Axon nicht gleichmäßig, aber es umhüllt das Axon in Segmente, die kurze Lücken zwischen ihnen haben, die sogenannten Knoten von Ranvier (überprüft in 9,10). Sowohl die Myelinisierungsdicke, die das Niveau der elektrischen Isolierung eines Axons steuert, als auch der Abstand der Knoten von Ranvier, die die Frequenz steuern, mit der Aktionspotentiale entlang eines Axons regeneriert werden, beeinflussen die Geschwindigkeit der Ausbreitung des Aktionspotentials (überprüft in11).
Es gibt eine große Menge an Literatur, die darauf hindeutet, dass die Myelinisierungsdicke die Geschwindigkeit der Aktionspotentialausbreitung in den Axonenbeeinflusst 12,13,14. Darüber hinaus können Veränderungen in der Axonmyelinisierung zu einer Reihe von ZNS-Defizitenführen 15,16,17,18,19,20,21. Es ist daher nicht verwunderlich, dass der Schwerpunkt vieler Forschungsbemühungen auf der Messung und Charakterisierung der Axonmyelinisierung liegt. Messungen der Myelindicke wurden am häufigsten mit Elektronenmikroskopie durchgeführt, einer Technik, die eine erhebliche Menge an Gewebevorbereitung erfordert und in Kombination mit Immunhistochemie schwierig zu verwenden ist. Es gibt jedoch auch eine schnellere und einfachere Technik zur Messung der Axonmyelinisierung, die auf der kohärenten Anti-Stokes-Raman-Spektroskopie (CARS) basiert. Ein CARS-Laser kann auf verschiedene Frequenzen abgestimmt werden, und wenn er auf Frequenzen abgestimmt ist, die geeignet sind, Lipide anzuregen, kann Myelin ohne zusätzliche Markierungen abgebildet werden22. Die Lipidbildgebung kann mit der Standard-Immunhistochemie kombiniert werden, so dass Lipide zusammen mit mehreren Fluoreszenzkanälen abgebildet werden können23. Die Bildgebung der Myelinisierung mit CARS ist signifikant schneller als die Elektronenmikroskopie und hat eine Auflösung, die, wenn auch niedriger als EM, ausreicht, um selbst kleine Unterschiede in der Myelinisierung in der gleichen Art von Axonen zu erkennen.
Protokoll
Alle Experimente entsprachen allen geltenden Gesetzen, den Richtlinien der National Institutes of Health und wurden vom University of Colorado Anschutz Institutional Animal Care and Use Committee genehmigt.
1. Tiere
- Verwenden Sie C57BL / 6J (Stock # 000664) Mäuse (Mus musculus), die vom Jackson Laboratory stammen, oder mongolische Rennmäuse (Meriones unguiculatus), die ursprünglich aus Charles River stammen.
2. Gewebevorbereitung
- Für die transkardiale Perfusion wird eine Überdosierung von Nagetierarten mit Pentobarbital (120 mg/kg Körpergewicht) und eine transkardiale Perfusion mit phosphatgepufferter Kochsalzlösung (PBS; 137 mM NaCl, 2,7 mM KCl, 1,76 mM KH 2 PO 4, 10 mM Na2HPO 4) gefolgt von4% Paraformaldehyd (PFA)24 durchgeführt.
- Öffnen Sie insbesondere den Bauch und den Brustkorb mit einer Schere und halten Sie den Brustkorb mit einer blutstillenden Kelly-Pinzette fest, um das Herz freizulegen.
- Führen Sie eine 23 GA-Nadel, die mit einer Perfusionspumpe verbunden ist, in den linken Ventrikel ein und schneiden Sie schnell den rechten Vorhof mit einer feinen Schere.
- Verabreichen Sie PBS durch die Perfusionspumpe und die Nadel im Herzen für 10 Minuten, um das Gehirn und den Körper von Blut zu befreien.
- Schalten Sie die Perfusionspumpe für 10 Minuten auf 4% PFA und überprüfen Sie die Steifigkeit der Gliedmaßen und des Schwanzes, um eine erfolgreiche Perfusion zu bestätigen.
- Enthaupten Sie die Tiere nach der Durchblutung und entfernen Sie ihr Gehirn aus dem Schädel. Halten Sie das Gehirn über Nacht in 4% PFA, bevor Sie auf PBS übertragen. Hirnstängel in 4% Agarose (in PBS) einbetten und koronal mit einem Vibratom in 200 μm Dicke schneiden.
3. Färbung
- Fleckenfrei schwimmende Abschnitte für Nissl, zur Visualisierung von Zellkörpern (1:100), in Antikörpermedien (AB-Medien: 0,1 M Phosphatpuffer (PB: 50 mM KH 2PO 4, 150 mM Na2HPO4), 150 mM NaCl, 3 mM Triton-X, 1% Rinderserumalbumin (BSA)) für 30 min bei Raumtemperatur auf einem Standard-Laborschüttler25.
- Schützen Sie Abschnitte mit Aluminiumfolie und/oder einer Abdeckung vor Licht. Wellenlängen von 550 nm oder darunter sind mit der CARS-Bildgebung kompatibel (Abbildung 1).
HINWEIS: Obwohl wir nicht erwarten, dass Triton-X oder andere Reagenzien einen Einfluss auf die CARS-Bildgebung von Lipiden haben, können zusätzliche Kontrollen mit spezifischen Antikörpermedien gerechtfertigt sein.
- Schützen Sie Abschnitte mit Aluminiumfolie und/oder einer Abdeckung vor Licht. Wellenlängen von 550 nm oder darunter sind mit der CARS-Bildgebung kompatibel (Abbildung 1).
- PAUSENPUNKT: Speichern Sie frei schwebende Abschnitte (während sie vor Licht geschützt sind) in PBS bis zur Bildgebung. Nach dem Schneiden Bildhirnschnitte innerhalb von 2 Wochen.

Abbildung 1: CARS-Bildgebung kann mit Immunfluoreszenzbildgebung kombiniert werden. Die Grafiken zeigen, dass die CARS-Bildgebung bei 660/640 nm rotem Signalspektrum26 erfolgt. Diese Wellenlänge ist ausreichend weit vom grünen, blauen oder UV-Bereich entfernt, so dass das CARS-Signal mit Immunfluoreszenz in diesen Bereichen kombiniert werden kann. Insbesondere zeigt die Grafik auch die Anregung und Emission für Nissl, das mit blauem Fluorophor markiert ist, das mit CARS während der Sammlung repräsentativer Ergebnisse für diese Publikation kombiniert wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Bildgebung
HINWEIS: Der CARS-Laseraufbau enthält einen Faserlaser, der den 80-MHz-Takt liefert, und einen OPO-Laser (Optical Parametric Oscillator) mit einem abstimmbaren Bereich von 770-990 nm, wobei der Stokes-Strahl auf 1031 nm festgelegt ist, die zum Erfassen des CARS-Signals benötigt werden. Es gibt eine Blende für beide Strahlen.
- Bevor Sie Proben zum Mikroskop bringen, schalten Sie den CARS-Laser ein und erwärmen Sie ihn für mindestens 1 Stunde, richten Sie den CARS-Laser und Koehler die Kondensatoroptik und die Membran des Mikroskops für die CARS-Bildgebung aus.
HINWEIS: Dieser Schritt ist entscheidend für die ordnungsgemäße Funktion der CARS-Mikroskopie.- Für die räumliche Ausrichtung der beiden Laserstrahlen (Pump und Stokes) greifen Sie über die CARS-Laser-GUI auf die beiden internen PSDs (positionsempfindliche Detektoren) zu.
- Erreichen Sie eine zeitliche Ausrichtung mithilfe der Verzögerungsfunktion in der CARS-Laser-GUI, die dazu beitragen kann, die Pulse der beiden Laser (Pump und Stokes) zu überlappen, die aufgrund ihrer unterschiedlichen Wellenlängen unterschiedliche Dispersionen aufweisen. Daher erfolgt sowohl die zeitliche als auch die räumliche Überlappung der Pumpen- und Stokes-Strahlen mit der Benutzereingabe über die GUI.
- Stellen Sie das externe Periskop (die letzten beiden Spiegel des Aufbaus) so ein, dass die räumlich überlappenden zwei Laser auf die Rasterkopfspiegel des Mikroskops zentriert werden.
- Stellen Sie sicher, dass der Kondensator Koehler-ed ist (d. h. der Kondensator ist zentriert und auf die Membran fokussiert, um eine gleichmäßige Ausleuchtung zu erzielen).
- Für die konfokale Immunfluoreszenz- und CARS-Bildgebung ist der CARS-Laser mit nicht descannten Vorwärts- und epi-CARS-Detektoren (NDDs) ausgestattet, indem ein konfokales Mikroskop mit sichtbaren Lasern für die Fluoreszenzbildgebung integriert wird (Abbildung 2).
- Legen Sie Abschnitte in eine Kulturschale mit Deckglas (für invertierte Mikroskopie), PBS, um das Austrocknen des Gewebes zu vermeiden, und einem Glasgewicht, um Gewebe in der Nähe von Deckglas zu halten.
- Nehmen Sie Z-Stacks oder Einzelbilder mit einem 60X, 1,2 NA infrarotkorrigierten Wasserobjektiv auf, das zur Erfassung des CARS-Signals in epi-Richtung und durch einen 0,55 NA-Kondensator in Vorwärtsrichtung zur Abbildung von Gehirnbereichen wie dem medialen Kern des Trapezkörpers (MNTB) dient.
- Nehmen Sie die CARS-Bilder mit ca. 600 mW Pumpe/Sonde und 300 mW Stokes mit der CARS-Laser-GUI auf. Diese Laserleistungswerte werden systemintern gemessen. Die Leistungen beider Laser am Probenort betragen weniger als 25 mW und sind sicher für die Gewebeprobe.
- Überlappen Sie die Pumpen- und Stokes-Strahlen räumlich und zeitlich. Stellen Sie das OPO auf 797,2 nm ein. Dies ergibt eine CARS-Wellenlänge von 650 nm. Aufgrund des höheren Energieniveaus ist die resultierende Rückkehr in den Grundzustand Anti-Stokes (blau verschoben) zur Anregung.
- Erfassung des CARS-Signals in epi- oder vorwärts nicht descannten Detektoren mit Bandpassfiltern (640-680 nm), gefolgt von sequentieller Detektion der Immunfluoreszenzmarkierung (in diesem Fall fluoreszenzmarkiert Nissl).
HINWEIS: Der neuronale Nissl-Soma-Marker wird nicht im Bandpassfilter CARS 640-680 nm erfasst, was die Kombination von Fluoreszenz und CARS-Bildgebung in den unten dargestellten Bildern ermöglicht. - Die CARS und die Fluoreszenz teilen sich keine PMTs. Verwenden Sie diese Einstellungen für ein optimales Lipidsignal, um die Myelinisierung im Gehirnbereich selektiv abzubilden.
ACHTUNG: Schützen Sie den Benutzer vor dem Laserstrahl
- Speichern Sie die Bilder als OIB-Dateien, die zur weiteren Quantifizierung in ein Bildanalyseprogramm importiert werden können (Abbildung 3).
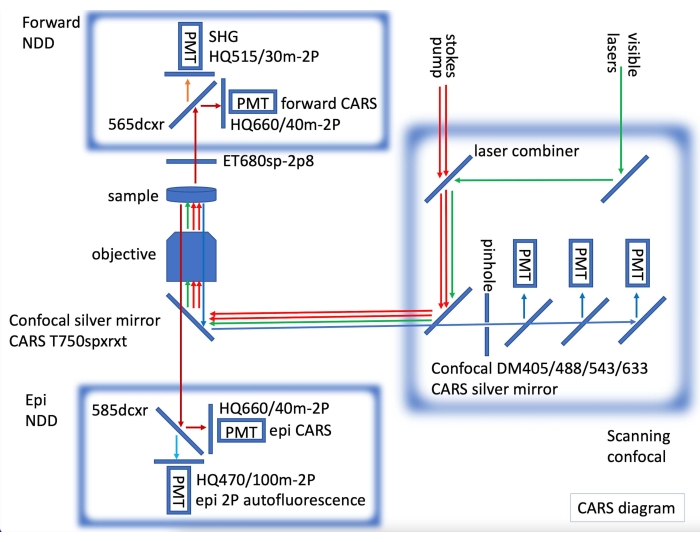
Abbildung 2: CARS-Instrumentendiagramm mit CARS-Lasern (rote Pfeile) und nicht gescannter (NDD) Epi- und Vorwärtsdetektion, die in ein Laserscanning-Konfokal integriert sind. In Forward NDD erwerben wir CARS für C-H-Bindungen (dunkelrote Pfeile) und SHG (zweite harmonische Generatioin) bei 515 nm (oranger Pfeil). In epi NDD erwerben wir CARS für C-H-Bindungen (dunkelrote Pfeile) und 2PE (Zwei-Photonen-Emission) Autofluoreszenz (hellblauer Pfeil). Sequentiell können konfokale Fluoreszenzbilder aufgenommen werden (grüne Pfeile für sichtbaren Laser, blaue Pfeile für konfokale Detektion). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
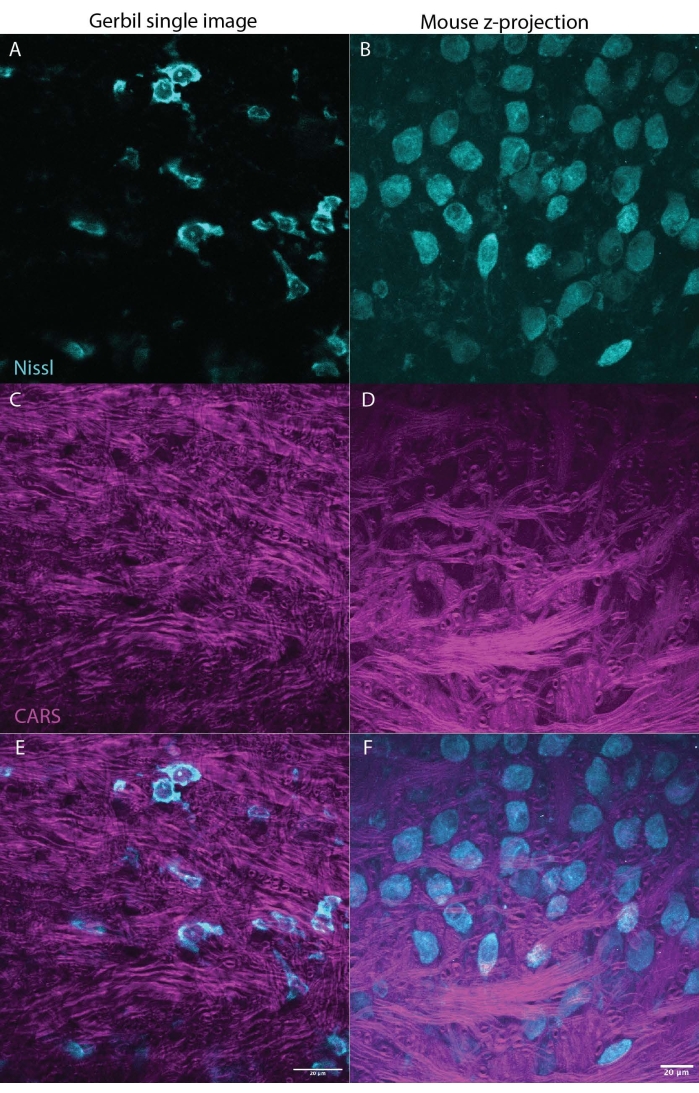
Abbildung 3: CARS kann Myelin (Magenta) im Hirngewebe (Hirnstamm) beleuchten und gleichzeitig Nissl (Cyan) oder fluoreszierende Marker abbilden. Die beiden Panels zeigen repräsentative Ergebnisse einer mongolischen Rennmaus (Einzelbild M. unguiculatus, Abbildung 3A,C,E) und Maus (z-stack max projection M. musculus, Abbildung 2B,D,F), was darauf hindeutet, dass diese Technik artübergreifend angewendet werden kann. Abbildung 3A,B zeigt Nissl in Cyan, C,D zeigt das CARS-Signal in Magenta, E,F kombiniert die Nissl- und CARS-Signale mit jedem Panel für Rennmaus bzw. Maus. Beide Bildsätze zeigen einen Ausschnitt des medialen Kerns des Trapezkörpers (MNTB) im Hirnstamm. Neuronen im MNTB erhalten Eingaben von stark myelinisierten Axonen, die im Kelch von Held, einer Art Riesensynapse27, enden. Der Maßstabsbalken beträgt 20 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Einer der größten Vorteile der CARS-Mikroskopie gegenüber anderen Techniken ist die Kompatibilität mit der Fluoreszenzbildgebung23. Abbildung 1 zeigt die CARS-Spektren im Vergleich zu Nissl, markiert mit Immunfluoreszenzmarker, die eine geringe / keine Überlappung der Spektren aufweisen. Abbildung 2 zeigt den Laseraufbau für CARS in Kombination mit konfokaler Mikroskopie. Abbildung 3 zeigt zwei repräsentative Bilder, eines als einzelner Stapel und eine z-Stack-Maximalprojektion von Rennmaus und Maus, die mit CARS-Bildgebung erhalten werden können, die sowohl Zellkörper (Cyan) als auch Myelinsignal (Magenta) zeigt.
Diskussion
Eine wachsende Anzahl von Literatur betont die Rolle von Myelin in der Gehirnfunktion 13,16,21,28. Darüber hinaus wissen wir, dass sich die Myelinisierungsdicke und das Myelinisierungsmuster bei verschiedenen neurologischen Erkrankungen wie Multipler Sklerose (überprüft in29), Alterung (überprüft in 30), Autismus20, 31 und vielen anderen ändern können. Es ist daher nicht verwunderlich, dass immer mehr Forscher die Myelinisierung über Hirngewebe und Tiermodelle, unter verschiedenen medizinischen Bedingungen und in einer wachsenden Anzahl von experimentellen Situationen untersuchen müssen. Traditionelle Methoden zur Abbildung der Myelinisierung im Hirngewebe umfassen die Antikörpermarkierung, gefolgt von Lichtmikroskopie und Elektronenmikroskopie (EM). Beide Techniken sind zeitaufwendig und erfordern mehrstufige Gewebevorbereitungsprotokolle, die mit möglichen Fehlern und Änderungen der Gewebezusammensetzung verbunden sind. Wir demonstrierten eine alternative Methode, die ähnliche Ergebnisse viel schneller liefern kann, da Myelin viel schneller abgebildet werden kann, und die mit zusätzlicher Fluoreszenzlichtmikroskopie kombiniert werden kann. Wichtig ist, dass diese Technik verwendet werden kann, um Lipide im Hirngewebe abzubilden, ohne dass zusätzliche Marker oder Markierungen erforderlich sind. Diese Technik ermöglicht nicht nur die Bildgebung von Myelin entlang intakter Axone, sondern auch die Bildgebung von Myelinabbauprodukten wie Plaques oder Flüssigkeitströpfchen32, die beispielsweise bei Multipler Sklerose33 auftreten.
Die Frequenz, auf die der CARS-Laser abgestimmt wurde, war geeignet, das Bild stark zugunsten von Lipiden zu verzerren, was zu insgesamt qualitativ hochwertigen Myelinisierungsbildern führte, da Myelin bei weitem die häufigste lipidreiche Substanz im Gehirn ist. Das Prinzip dieser Technik ist, dass ein CARS-Laser, der auf verschiedene Frequenzen abgestimmt werden kann, auf 792,2 nm abgestimmt wird, was eine Frequenz ist, die geeignet ist, CH2-Bindungen anzuregen. Diese sind reich an Lipiden, die lange Ketten von CH2-Gruppen enthalten, die durch Kohlenstoff-Kohlenstoff-Bindungen mit einer terminalen Carbonsäuregruppe am Ende verbunden sind. Angeregte Lipide mit dieser Frequenz führten zu einem Signal, das dann mit der üblichen konfokalen Mikroskop-Detektionstechnologie abgebildet werden konnte. Die Qualität der resultierenden Bilder unterstützt quantitative Analysen, die entweder von einem menschlichen Beobachter oder automatisierten Algorithmen durchgeführt werden können34. Diese Methode markiert jedoch nicht ausschließlich Myelin, da CH2-Bindungen nicht exklusiv für Myelin sind und daher CARS weniger spezifisch ist als ein Antikörper. Als Ergebnis zeigen die Bilder ein Label, das nicht mit Myelin verbunden ist. Wichtig ist, dass dieses Hintergrundetikett die Qualität der Messungen oder die Fähigkeit zu quantitativen Analysen nicht beeinträchtigt.
Die Auflösung der CARS-Bildgebung ist beugungsbegrenzt und ähnelt der Zwei-Photonen-Mikroskopie (~250 nm) und ist damit niedriger als die von EM. Daher müssen sich Forscher, die sehr kleine Unterschiede in der Myelinisierungsdicke beurteilen möchten, wie sie beispielsweise bei bestimmten Erkrankungen auftreten, dieser Einschränkung bewusst sein. Zusätzliche EM-Kontrollen in einer kleinen Stichprobe können bestätigen, dass die Auflösung für ihr Forschungsziel ausreichend ist.
Ein großer Vorteil von CARS für die Bildgebung von Myelin ist neben der Geschwindigkeit und Einfachheit die Möglichkeit, die markierungsfreie Lipidbildgebung mit der konfokalen Fluoreszenzmikroskopie zu kombinieren. Je nachdem, welches Mikroskop für CARS verwendet wird, können zwei oder sogar drei zusätzliche Kanäle so abgebildet werden, dass die Myelin-Bildgebung mit Antikörpermarkierung, Nissl-Färbung, transgenen Mauslinien, die fluoreszierende Proteine exprimieren, oder ähnlichem kombiniert werden kann. Mögliche Einschränkungen bei der Verwendung von Fluorophoren mit längeren Wellenlängen bestehen hauptsächlich darin, dass das CARS-Signal durch 640-680 nm Bandpassfilter beobachtet wird, die die Emission von grünen und / oder roten Fluorophoren auffangen können. Der Pikosekundenlaser, der für die CARS-Anregung verwendet wird, hat jedoch eine Spitzenpulsenergie von ~ 10 mal weniger als der Standard-Femtosekundenlaser, der für die Zwei-Photonen-Anregung verwendet wird, übersetzt in ~ 100 weniger Fluoreszenz. Darüber hinaus ist der 797,2 nm Pulspikosekundenlaser, der für die CARS-Anregung verwendet wird, spektral weit vom Höhepunkt der Zwei-Photonen-Querschnittsabsorption der sichtbaren Fluorophore entfernt. Daher ist der CARS-Pikosekundenlaser sehr ineffizient für die Zwei-Photonen-Anregung sichtbarer Fluorophore, wodurch das Fluoreszenzsignal für den Übergang in die CARS-Detektion vernachlässigbar ist. Dies sollte jedoch getestet werden, indem eine negative Kontrollprobe abgebildet wird, die im Vergleich zu einer Probe mit fluoreszierenden Markern keine fluoreszierenden Markierungen aufweist.
Zusammenfassend lässt sich sagen, dass die CARS-Bildgebung eine geeignete Technik ist, um Myelin im Hirngewebe abzubilden. Während die Auflösung mit der Standardlichtmikroskopie vergleichbar und damit niedriger als bei EM ist, machen die Geschwindigkeit und Benutzerfreundlichkeit diese Technik zu einer attraktiven Alternative zu bestehenden Methoden.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Unterstützt von NIH R01 DC 17924, R01 DC 18401 (Klug) und NIH 1R15HD105231-01, T32DC012280 und FRAXA (McCullagh). Die CARS-Bildgebung wurde im Advanced Light Microscopy Core-Teil des NeuroTechnology Center am Anschutz Medical Campus der University of Colorado durchgeführt, der teilweise von NIH P30 NS048154 und NIH P30 DK116073 unterstützt wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| Anesthetic: | |||
| 1 mL disposable syringe with needle 27 GA x 0.5" | Exel int | 260040 | |
| Fatal + | Vortech | ||
| Surgery: | |||
| Spring Scissors - 8mm Cutting Edge | Fine Science Tools | 15024-10 | |
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Perfusion: | |||
| 4% Paraformaldehyde | Fisher Chemical | SF994 (CS) | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Kelly hemostats | Fine Science Tools | 13019-14 | |
| Millipore H2O | |||
| Needle tip, 23 GA x 1" | BD precision glide | 305193 | |
| Phosphate buffered saline (PBS): | |||
| Potassium chloride | Sigma | P9333 | |
| Potassium phosphate monobase | Sigma | P5655 | |
| pump with variable flow or equivalent | |||
| Sodium chloride | Fisher Chemical | s271-1 | |
| Sodiumphosphate dibasic | Sigma | S7907 | |
| Dissection: | |||
| 50 mL vial with 4% PFA | |||
| Bochem Chemical Spoon 180mm | Bochem | 230331000 | |
| Fine Scissors - Sharp | Fine Science Tools | 14063-11 | |
| Noyes Spring Scissors | Fine Science Tools | 15011-12 | |
| Pair of fine (Graefe) tweezers | Fine Science Tools | 11050-10 | |
| Shallow glass or plastic tray, approximately 10" x 10" | |||
| Standard tweezers | Fine Science Tools | 11027-12 | |
| Surgical Scissors - Blunt | Fine Science Tools | 14000-20 | |
| Slicing: | |||
| Agar, plant | RPI | 9002-18-0 | |
| Vibratome | Leica | VT1000s | |
| well plate | Alkali Sci. | TPN1048-NT | |
| Staining: | |||
| AB Media: | 1n 1,000 mL of Millipore H2O | ||
| Phosphate buffered (PB): | |||
| Potassium Phosphate Monobase | Sigma | P5655 | |
| Sodium Phosohate Dibasic | Sigma | S7907 | |
| BSA (Bovine serum albumin) | Sigma life science | A2153-100g | |
| Sodium Chloride | Fisher Chemical | s271-1 | |
| Triton X-100 | Sigma - Aldrich | x100-500ml | |
| Nissl 435/455 | Invitrogen | N21479 | |
| CARS: | |||
| APE picoemerald laser | Angewandte Physik & Elektronik GmbH | ||
| bandpass filter (420-520 nm) | Chroma Technology | HQ470/100m-2P | |
| bandpass filter (500-530 nm) | Chroma Technology | HQ515/30m-2P | |
| bandpass filters (640-680 nm) | Chroma Technology | HQ660/40m-2P | |
| Confocal microscope | Olympus | FV1000 | |
| Cut Transfer pipet | Fisher | 13-711-7M | |
| dichroic longpass 565 nm | Chroma Technology | 565dcxr | |
| dichroic longpass 585 nm | Chroma Technology | 585dcxr | |
| dichroic shortpass 750 nm | Chroma Technology | T750spxrxt | |
| glass bottom culture dish | MatTek | P35G-0-10-C | |
| glass weight (10 mm x 10 mm boro rod) | Allen Scientific Glass Inc | ||
| multiphoton shortpass emission filter 680 nm | Chroma Technology | ET680sp-2p8 | |
| PBS |
Referenzen
- Cole, K., Curtis, H. Electric impedance of the squid giant axon during activity. The Journal of General Physiology. 22 (5), 649-670 (1939).
- Cole, K. S., Curtis, H. J. Membrane potential of the squid giant axon during current flow. Journal of General Physiology. 24 (4), 551-563 (1941).
- Alcami, P., El Hady, A. Axonal computations. Frontiers in Cellular Neuroscience. 13, 413(2019).
- Neumann, E., Nachmansohn, D. Nerve excitability-Toward an integrating concept. Aharon Katzir Memorial Volume. , 99-166 (1975).
- Waxman, S. G. Integrative properties and design principles of axons. International Review of Neurobiology. 18, 1-40 (1975).
- Fitzhugh, R. Computation of impulse initiation and saltatory conduction in a myelinated nerve fiber. Biophysical Journal. 2 (1), 11-21 (1962).
- Zalc, B. The acquisition of myelin: a success story. Novartis Foundation Symposium. 276, 275-281 (2006).
- Salzer, J. L., Zalc, B. Myelination. Current Biology. 26 (20), 971-975 (2016).
- Boullerne, A. I. The history of myelin. Experimental Neurology. 283, 431-445 (2016).
- Kuhn, S., Gritti, L., Crooks, D., Dombrowski, Y. Oligodendrocytes in development, myelin generation and beyond. Cells. 8 (11), 1424(2019).
- Saab, A. S., Nave, K. -A. Myelin dynamics: protecting and shaping neuronal functions. Current Opinion in Neurobiology. 47, 104-112 (2017).
- Chomiak, T., Hu, B. What is the optimal value of the g-Ratio for myelinated fibers in the rat CNS? A theoretical approach. PLOS ONE. 4 (11), 7754(2009).
- Ford, M. C., et al. Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nature Communications. 6, 8073(2015).
- Stange-Marten, A., et al. Input timing for spatial processing is precisely tuned via constant synaptic delays and myelination patterns in the auditory brainstem. Proceedings of the National Academy of Sciences of the United States of America. 114 (24), 4851-4858 (2017).
- Bu, J., Banki, A., Wu, Q., Nishiyama, A. Increased NG2+ glial cell proliferation and oligodendrocyte generation in the hypomyelinating mutant shiverer. Glia. 48 (1), 51-63 (2004).
- Pacey, L. K. K., et al. Delayed myelination in a mouse model of fragile X syndrome. Human Molecular Genetics. 22 (19), 3920-3930 (2013).
- Green, A. J., et al. Clemastine fumarate as a remyelinating therapy for multiple sclerosis (ReBUILD): a randomised, controlled, double-blind, crossover trial. Lancet. 390 (10111), London, England. 2481-2489 (2017).
- Jeon, S. J., Ryu, J. H., Bahn, G. H. Altered translational control of fragile X mental retardation protein on myelin proteins in neuropsychiatric disorders. Biomolecules & Therapeutics. 25 (3), 231-238 (2017).
- Barak, B., et al. Neuronal deletion of Gtf2i, associated with Williams syndrome, causes behavioral and myelin alterations rescuable by a remyelinating drug. Nature Neuroscience. 22 (5), 700-708 (2019).
- Phan, B. N., et al. A myelin-related transcriptomic profile is shared by Pitt-Hopkins syndrome models and human autism spectrum disorder. Nature Neuroscience. 23 (3), 375-385 (2020).
- Lucas, A., Poleg, S., Klug, A., McCullagh, E. A. Myelination deficits in the auditory brainstem of a mouse model of fragile X syndrome. Frontiers in Neuroscience. 15, 1536(2021).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. -X. Coherent anti-stokes raman scattering imaging of axonal myelin in live spinal ttissues. Biophysical Journal. 89 (1), 581-591 (2005).
- Kim, S. -H., et al. Multiplex coherent anti-stokes raman spectroscopy images intact atheromatous lesions and concomitantly identifies distinct chemical profiles of atherosclerotic lipids. Circulation Research. 106 (8), 1332-1341 (2010).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564(2012).
- Tu, L., et al. Free-floating Immunostaining of Mouse Brains. Journal of Visualized Experiments. (176), e62876(2021).
- Fluorescence SpectraViewer. , Available from: https://www.thermofisher.com/order/fluorescence-spectraviewer (2022).
- Held, H. Die centrale gehörleitung. Arch Anat Physiol Anat Abt. 17, 201-248 (1893).
- Sherman, D. L., Brophy, P. J. Mechanisms of axon ensheathment and myelin growth. Nature Reviews Neuroscience. 6 (9), 683-690 (2005).
- Gruchot, J., et al. The molecular basis for remyelination failure in multiple sclerosis. Cells. 8 (8), 825(2019).
- Rivera, A. D., et al. Epidermal growth factor pathway in the age-related decline of oligodendrocyte regeneration. Frontiers in Cellular Neuroscience. 16, 838007(2022).
- Kútna, V., O'Leary, V. B., Hoschl, C., Ovsepian, S. V. Cerebellar demyelination and neurodegeneration associated with mTORC1 hyperactivity may contribute to the developmental onset of autism-like neurobehavioral phenotype in a rat model. Autism Research: Official Journal of the International Society for Autism Research. 15 (5), 791-805 (2022).
- Ozsvár, A., et al. Quantitative analysis of lipid debris accumulation caused by cuprizone induced myelin degradation in different CNS areas. Brain Research Bulletin. 137, 277-284 (2018).
- Prineas, J. W., Graham, J. S. Multiple sclerosis: capping of surface immunoglobulin G on macrophages engaged in myelin breakdown. Annals of Neurology. 10 (2), 149-158 (1981).
- Bégin, S., et al. Automated method for the segmentation and morphometry of nerve fibers in large-scale CARS images of spinal cord tissue. Biomedical Optics Express. 5 (12), 4145-4161 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten