Method Article
Vakumla Stabilize Edilmiş Bir Görüntüleme Sistemi Kullanılarak Deneysel Akut Akciğer Hasarında Pulmoner Mikrosirkülasyonun İntravital Geniş Alan Floresan Mikroskopisi
Bu Makalede
Özet
İntravital floresan mikroskopi, lökosit-endotel etkileşimlerini ve kılcal perfüzyonu gerçek zamanlı olarak incelemek için kullanılabilir. Bu protokol, vakumla stabilize edilmiş bir akciğer görüntüleme sistemi kullanarak pulmoner mikrosirkülasyondaki bu parametreleri görüntüleme ve ölçme yöntemlerini açıklar.
Özet
Lökosit-endotel etkileşimlerinin intravital görüntülemesi, canlı hayvanlarda immün aracılı hastalık hakkında değerli bilgiler sunmaktadır. Akut akciğer hasarı (ALI)/akut solunum sıkıntısı sendromu (ARDS) ve diğer solunum patolojilerinin in vivo olarak incelenmesi, akciğerlerin sınırlı erişilebilirliği ve doğal hareket artefaktları nedeniyle zordur. Bununla birlikte, bu zorlukların üstesinden gelmek için çeşitli yaklaşımlar geliştirilmiştir. Bu protokol, deneysel bir ALI modelinde pulmoner mikrosirkülasyondaki gerçek zamanlı lökosit-endotel etkileşimlerini incelemek için intravital floresan mikroskopi için bir yöntemi açıklamaktadır. İn vivo akciğer görüntüleme sistemi ve 3 boyutlu baskılı intravital mikroskopi platformu, anestezi uygulanan fareyi sabitlemek ve akciğeri stabilize etmek ve kafa karıştırıcı akciğer hasarını en aza indirmek için kullanılır. Hazırlığı takiben, lökosit yapışması, lökosit haddeleme ve kılcal fonksiyonu incelemek için geniş alan floresan mikroskobu kullanılır. Burada sunulan protokol, enflamatuar akciğer hastalığının akut bir modelinde görüntülemeye odaklanırken, akciğerdeki diğer patolojik ve fizyolojik süreçleri incelemek için de uyarlanabilir.
Giriş
İntravital mikroskopi (IVM), çeşitli biyofiziksel süreçleri in vivo olarak görselleştirmek ve incelemek için yararlı bir görüntüleme aracıdır. Akciğer, kapalı konumu, dokusunun kırılgan doğası ve solunum ve kalp atışı 1,2 tarafından indüklenen hareket artefaktları nedeniyle in vivo olarak görüntülenmesi oldukça zordur. Bu zorlukların üstesinden gelmek için pulmoner mikrosirkülasyonda lökosit-endotel etkileşimlerinin gerçek zamanlı görüntülenmesi için çeşitli intravital mikroskopi (IVM) kurulumları geliştirilmiştir. Bu tür yaklaşımlar, görüntüleme için akciğerin cerrahi olarak açığa çıkarılmasına ve stabilize edilmesine dayanır.
Hayvanlar tipik olarak cerrahi prosedürlerle akciğer IVM'si için hazırlanır. İlk olarak, hayvanlar entübe edilir ve havalandırılır, bu da torasik bir pencerenin cerrahi eksizyonuna ve daha sonra görüntüleme için akciğeri stabilize etmek için müdahalelere izin verir. Bir teknik, parankimin bir cam kapak kayması3'e yapıştırılmasını içerir; bu, görüntülenen dokuya önemli fiziksel travma riski taşıyan bir prosedürdür. Daha gelişmiş olanı, akciğeri cam bir pencere altında stabilize etmek için bir vakum sisteminin kullanılmasıdır4. Bu kurulum, geniş bir lokal alana yayılmış geri dönüşümlü bir vakum yoluyla akciğer yüzeyinin kapak kaymasına gevşek yapışmasını kolaylaştırır ve x, y ve z boyutlarında hareketi sınırlandırırken akciğeri genişletir4. Vakum, kurulumun görüntüleme alanını çevreleyen bir kanaldan eşit olarak uygulanır ve dokuyu görüntüleme sınıfı kapak kayması4'e bakan sığ bir konik bölgeye çeker. Bu görüntüleme penceresinden, akciğer mikrosirkülasyonu çeşitli optik görüntüleme yöntemleri kullanılarak incelenebilir.
Akciğer IVM, çok sayıda mikrodolaşım parametresinin kantitatif görüntülenmesini sağlar. Bunlar arasında lökosit iz hızı ve uzunluğu5, kırmızı kan hücresi akış hızı6 ve oksijenasyon7, tümör metastazları8, immün hücre alt popülasyonlarının ayrımı 9,10,11, mikropartiküllerin görselleştirilmesi 12, alveolar dinamikler 13,14, vasküler geçirgenlik 15 ve kılcal fonksiyon 16 gibi ölçümler bulunmaktadır. . Buradaki odak noktası lökosit alımı ve kılcal fonksiyondur. Pulmoner mikrosirkülasyonda lökosit alımının başlatılması, her ikisi de enflamatuar koşullar altında artmış olan lökositler ve endotel hücreleri arasındaki geçici yuvarlanma etkileşimlerini ve sıkı yapışkan etkileşimleri içerir16,17. Tipik olarak, haddeleme, operatör tarafından tanımlanan bir referans çizgisini geçen lökositlerin sayısı ile ölçülürken, adezyon endotel16 üzerinde hareketsiz olan lökositlerin sayısı ile ölçülür. Kılcal fonksiyon da enflamatuar durumlarda etkilenebilir ve sıklıkla perfüzyonun azalmasına neden olur. Bu, kırmızı kan hücresi deforme edilebilirliğinin azaltılması18 ve endotel hücreleri tarafından indüklenebilir NO sentazın alacalı ekspresyonu da dahil olmak üzere çeşitli faktörlere bağlanabilir ve patolojik şant19 ile sonuçlanır. Tipik olarak, perfüze edilmiş kılcal damarların alan başına toplam uzunluğu ölçülür ve fonksiyonel kılcal yoğunluk (FCD) olarak rapor edilir.
Akciğerlerde lökosit alımını gerçek zamanlı olarak incelemek, biyolojik hedeflerin floresan boyalar veya floresan etiketli antikorlarla etiketlenmesini gerektirir20. Alternatif olarak, lizozim M-yeşil floresan protein (LysM-GFP) fareleri gibi çeşitli transgenik fare suşları, nötrofiller21,22 gibi spesifik bağışıklık hücresi alt kümelerini görüntülemek için kullanılabilir. Floresan etiketli lökositler daha sonra geniş alan floresan mikroskopisi, konfokal mikroskopi veya multifoton mikroskobu kullanılarak görselleştirilebilir. Bu teknikler, belirli uyarma dalga boylarını kullanarak ve yayılan floresanı tespit ederken, aynı zamanda uyarma dalga boyunun algılanmasını bloke ederek kontrast elde eder ve böylece etiketli nesneyi vurgular.
Murin akciğerinde lökosit haddeleme, adezyon ve fonksiyonel kılcal yoğunluğun miktarının belirlenmesi ile ilgili mevcut araştırmalar öncelikle manuel video analizine dayanmaktadır. Bu, Fiji 6,23 gibi açık kaynaklı yazılımlar, CapImage12 gibi özel mülk yazılımlar veya ısmarlama görüntü işleme sistemleri 24 aracılığıyla mümkün olmaktadır. Tersine, çeşitli özel mülk yazılım platformları (örneğin, NIS Element, Imaris, Volocity, MetaMorph), burada daha önce bahsedilenlerin birçoğu da dahil olmak üzere çok çeşitli diğer fizyolojik parametrelerin otomatik olarak ölçülmesini sağlar 5,6,7,8,9,10,11,12,13,15.
Akciğer IVM kullanılarak akut akciğer hasarı (ALI) ve akut solunum sıkıntısı sendromu (ARDS) patolojisi ile ilgili önemli gözlemler yapılmıştır. ARDS, endotel ve epitel bariyerinin işlev bozukluğunun neden olduğu pulmoner ödem ve alveoler hasar dahil olmak üzere akciğerde bir dizi patofizyolojik süreç ile karakterizedir25. Bir murin modeli kullanılarak, sepsis kaynaklı ALI'nın akciğer ortamında immün hücre kaçakçılığında önemli zararlı değişikliklerle ilişkili olduğu bulunmuştur26. Sepsis kaynaklı ALI ile farelerin kılcal damarlarına alınan nötrofillerin mikrosirkülasyonu engellediği ve böylece ALI26'da hipoksiyi arttırdığı bulunmuştur. Ek olarak, IVM, ARDS27'nin başlangıcını takiben altta yatan onarım mekanizması hakkında fikir edinmek için kullanılmıştır. Akciğer IVM, çeşitli obstrüktif akciğer hastalıklarındaki patofizyolojik değişiklikleri anlamada da değerli bir araç olmuştur. Örneğin, kistik fibroz (KF) ve kronik obstrüktif akciğer hastalığı (KOAH) gibi hastalıklarda mukus transportunun görselleştirilmesi, mukoza klerensi için yeni ve mevcut tedavilerin incelenmesini kolaylaştırmıştır28. Bu koşullar altında lökosit kaçakçılığı daanaliz edilmiştir 17.
Bu protokol, geleneksel floresan mikroskobu kullanarak lökosit-endotel etkileşimlerini incelemek için başlangıçta Lamm ve ark.29 tarafından tanımlanan yaklaşımı genişletmektedir. Tarif edilen prosedürler, 16.5 cm x 12.7 cm metal taban, mikromanipülatör ve vakum görüntüleme penceresi içeren bir in vivo akciğer görüntüleme sistemi kullanmaktadır (Şekil 1). Sistem, vantilatör borusu ve ısıtma yastığı için güvenli bağlantı sağlamak üzere 20 cm x 23,5 cm 3D baskılı bir platforma (Ek Dosya 1) monte edilmiştir. Bu yöntem, murin pulmoner mikrosirkülasyonun in vivo olarak tekrarlanabilir ve ölçülebilir görüntülenmesini sağlar. Cerrahi preparatın önemli yönleri ve vakumla stabilize edilmiş akciğer görüntüleme sisteminin doğru kullanımı ayrıntılı olarak açıklanmaktadır. Son olarak, değiştirilmiş lökosit haddeleme, lökosit yapışması ve inflamasyonla ilişkili kılcal perfüzyonun temsili görüntülemesini ve analizini sağlamak için deneysel bir ALI modeli kullanılmıştır. Bu protokolün kullanımı, akut hastalık durumları sırasında pulmoner mikrosirkülasyondaki patofizyolojik değişiklikler üzerine daha önemli araştırmaları kolaylaştırmalıdır.
Protokol
Burada açıklanan tüm prosedürler, Dalhousie Üniversitesi Laboratuvar Hayvanları Komitesi (UCLA) tarafından önceden onaylanarak gerçekleştirilmiştir.
1. Hazırlık
- Akciğer görüntüleme sistemi: Pencereyi hazırlamak için, vakum kanalının kirlenmesini önlerken dış halkanın üstüne ince bir vakum gresi tabakası uygulayın. Pencereye temiz bir 8 mm'lik cam kapak kayması yerleştirin ve bir conta oluşturmak için yavaşça aşağı bastırın.
- Geniş Alan Floresan Mikroskobu: 20x/0,40 uzun çalışma mesafesi hedefi ve 25 FPS kare hızına sahip siyah beyaz şarj bağlantılı cihaz (CCD) kamera ile donatılmış geleneksel bir geniş alan floresan mikroskobu ile görüntüleme gerçekleştirin. Rhodamine-6G'yi uyarmak için 530-550 nm bandpass uyarma filtresi ve Floresein İzotiyosiyanat'ı (FITC) uyarmak için 460-490 nm bandpass filtresi uygulayın.
- Vakum sistemi: Görüntüleme penceresini, Ek Şekil 1'de gösterildiği gibi 50-60 mmHg sabit emiş sağlayabilen dijital bir basınç göstergesi ile donatılmış bir vakum pompasına bağlayın. Kısacası, görüntüleme penceresini pompaya 1,0 mm I.D. polietilen boru, 1,0 cm I.D. polietilen boru, bir vakum şişesi ve bir sıralı 0,2 μm filtre ile bağlayın.
- Vantilatör: Farenin ağırlığına göre hesaplanan bir hızda ve hacimde basınç kontrollü ventilasyon sağlamak için küçük bir kemirgen vantilatör ayarlayın. Deney süresince 5 cmH2O'da pozitif bir ekspiratuar basınç (PEEP) sağlayın ve hedef basıncı 20 cmH2 O'yaayarlayın.
- Anestezik: Düşük akışlı bir anestezi dağıtım sistemi kullanarak,% 99.9 izofluran ile 5.0 mL'lik bir şırıngayı astarlayın. Cerrah tarafından solunma riskini en aza indirmek için bir atık gaz süpürme sistemi kullanın.
2. Anestezi
- 20-25 g 12 haftalık erkek C57Bl/6 fareyi anestezi indüksiyon odasına yerleştirin. Oda güvenli bir şekilde kapalıyken,% 3'lük bir konsantrasyonda ve 500 mL / dak'lık bir akış hızında izofluran gazı ile indüksiyona başlayın.
- Fare anestezi altına alındıktan sonra (yavaşlamış solunum hızı ile görselleştirilir), entübasyon standına aktarın ve üst kesici dişleri asılı dikişe sabitleyin.
- Burnun burun konisinin içine sabitlenmesi için dikişi sıkın. Burun konisinden gaz akışına% 2.5'lik bir konsantrasyonda başlayın.
- Bir sonraki adıma geçmeden önce ayak parmağı sıkışması yoluyla yeterli anestezi derinliğini onaylayın.
3. Entübasyon
- Standı, standın arkası ve farenin sırt tarafı cerraha doğru bakacak şekilde döndürün.
- 20 cm uzunluğundaki fiber optik kablonun ucunu 20 G endotrakeal kanülden geçirin ve kablonun larinksten geçişini kolaylaştırmak için ucu Lidokain HCl'ye (% 1) batırın.
- Künt forseps kullanarak, alt çeneyi kaldırın ve solunum sistemine net bir geçiş sağlamak için dili yerinden çıkarın.
- Üst kesici dişler spekulumdaki boşluğa sığacak şekilde modifiye edilmiş bir otoskop (~ 60 ° spekulum çevresi çıkarılmış) yerleştirin. Epiglottis ve ses telleri açıkça görülebilene kadar kapsamı ve dil pozisyonunu ayarlayın.
- Endotrakeal kanül yüklü fiber optik kabloyu spekulumdaki boşluktan ve gırtlak içine yerleştirin. Küçük dairesel hareketler kullanarak, kabloyu ses tellerinden ve trakeaya geçirin.
- Kanülü fiber optik kablo boyunca itin, ses telleri arasından ve trakeaya geçin.
4. Havalandırma
- Fareyi entübasyon standından alın ve sağ yanal dekübit pozisyonunda bir ısıtma yastığına yerleştirin.
- Kanülü ventilatör borusuna bağlayın ve ventilatörü başlatın. Anestezik konsantrasyonu% 1,5'e düşürün ve pedal refleksini test ederek derinliği izleyin. Refleks devam ederse, konsantrasyonu kademeli olarak% 2'ye kadar yükseltin.
- Kurumasını önlemek için farenin gözlerine gözyaşı jeli yerleştirin.
- Tıbbi bant kullanarak, kanülü burnuna sabitleyin. Etiketleme bandını kullanarak, sağ ön pençeyi yaklaşık olarak saat 9 konumunda ısıtma yastığına sabitleyin. Sol arka pençeyi kaudal olarak uzatın ve yaklaşık olarak saat 6 pozisyonunda sabitleyin.
- Bir bez bant kullanarak, sol ön pençeyi hafifçe saat 12 pozisyonuna kadar gerin ve bandın diğer ucunu Şekil 2A'da gösterildiği gibi IVM platformunun tepesine sabitleyin (burada hafif gerginliğin korunması müteakip torakotomiyi kolaylaştırır).
- Bir rektal sıcaklık probu takın ve probu ısıtma yastığına bantlayarak sabitleyin. Sağ arka pençeye bir nabız oksimetresi yerleştirin ve dolaşımı bozmamaya dikkat ederek ısıtma yastığına sabitleyin.
- Sıcaklık 37.0 ° C'de ± 0.1 ° C'de sabit kaldıktan sonra, torakotomi yapmaya devam edin.
5. Torakotomi
- Toraks ve karnını% 70 alkollü mendil ile sterilize edin. Farenin sol tarafındaki saçları nemlendirmek için hafif bir kat mineral yağ uygulayın - sternumdan vertebral kolona ve omuzdan göğüs kafesinin dibine kadar.
- Künt forseps ve düz makas ile, altta yatan kas tabakasını ortaya çıkarmak için göğüs kafesinin dibine yakın küçük bir uzunlamasına kesi yapın.
- Ventral hareket ederek, epitel ve yağ dokusunu kas tabakasından ayırmak için künt diseksiyon kullanın. Maruz kalan kan damarlarını koterize edin. Kan kaybı riski hafifletildikten sonra, orijinal insizyonu ksifoid sürece kadar ventralal olarak uzatın.
- Bu işlemi vertebral kolona ~ 5 mm lateral olana kadar dorsal olarak tekrarlayın.
- Kraniyal olarak hareket ederek, göğüs kafesini açığa çıkarmak için künt diseksiyon kullanın. Hemodinamik stabiliteyi korumak için maruz kalan kan damarlarını koterize edin.
- Kan kaybı riski hafifletildikten sonra, insizyonu ksifoid süreçten aksillaya kadar uzatın.
- Bu işlemi insizyonun dorsal tarafında, sol kulağa ~ 1 cm daha düşük olana kadar tekrarlayın.
- Hemostatik forseps kullanarak disseke edilmiş epitel ve yağ dokusunu kavrayın ve cerrahi alandan uzak tutun (Şekil 2B).
- Lökositlerin görselleştirilmesi için bir Rhodamine-6G (0.5 mg / mL; 1.5 mL / kg) ve kuyruk damarı yoluyla kılcal perfüzyonun görüntülenmesi için Sığır FITC-albümini (50 mg / mL; 1 mL / kg) enjekte edin.
- Dişli forseps kullanarak, kaburgayı son inspirasyonda akciğer tabanının konumundan hemen daha düşük bir seviyede tutun ve kaburgayı akciğerden uzaklaştırmak için hafifçe geri çekin. Bir pnömotoraksı indüklemek için kaburgayı kesin.
- İnsizyonu interkostal kas boyunca her iki yönde de yanal olarak uzatın, maruz kalan akciğer yüzeyine dokunmamaya dikkat edin.
- Künt forseps kullanarak, bir sonraki en yüksek kaburgayı tutun ve akciğerin göğüs duvarından düşmesine izin vermek için hafifçe geri çekin. Akciğer ayrılmazsa, akciğerin altta yatan plevraya yapışmasına ve böylece daha kolay düşmesine neden olmak için göğüs duvarını akciğere hafifçe bastırın.
- Orijinal insizyona sternuma kadar ventral, akciğerin tepesi açığa çıkana kadar kraniyal olarak devam edin. Ortaya çıkan kanamayı hafifletmek için pamuklu aplikatörler ve gazlı bez kullanın.
- Göğüs boşluğunun dorsal kısmındaki interkostal kan damarlarını ortaya çıkarmak için göğüs kafesini kaldırın. Akciğere zarar vermemeye dikkat ederek, omurgaya yakın en inferior interkostal damarı koterize edin ve ardından kaburgayı kesin. Kraniyal ve ventralal olarak hareket ederek, göğüs kafesinin yaklaşık 1 cm x 1,5 cm'lik bir kısmı eksize edilene kadar tekrarlayın (Şekil 2C).
- Küçük gazlı bez şeritleri kullanarak kılcal etki yoluyla göğüs boşluğundaki fazla sıvı birikimini giderin.
- Mikroskopiye devam ederken, akciğer ve görüntüleme penceresi arasında daha güvenli bir arayüz için intraplevral sıvının dağılması için ~ 5 dakika bekleyin.
6. Mikroskopi
- Vakum pompasını açın ve basıncı ~ 50–60 mmHg'ye ayarlayın.
- IVM platformunu mikroskop aşamasına aktarın. Metal direği ve mikromanipülatörü, görüntüleme penceresi doğrudan maruz kalan akciğerin üzerinde olacak ve pencere kolu akciğere yaklaşık olarak saat 3 konumundan yaklaşacak şekilde konumlandırın.
- Mikromanipülatörü kullanarak, görüntüleme penceresini akciğer yüzeyine yapışana ve stabilize edene kadar dikkatlice indirin (Şekil 3A).
- 20x hedefini ve 460-490 nm bandpass uyarma filtresini kullanarak, kan akışının yakınsak modeline dayanan bir pulmoner venül tanımlayın. Gemiyi görüş alanında ortalayın ve 30 sn video kaydedin.
- 530-550 nm bandpass uyarma filtresine geçin ve aynı görüş alanına 30 sn video kaydedin.
- Beş pulmoner venül görüntülenene kadar önceki adımı tekrarlayın.
- 460-490 nm bandpass uyarma filtresini kullanarak, farklı kan akışı modeline dayanan bir pulmoner arteriol tanımlayın. Gemiyi görüş alanında ortalayın ve 30 sn video kaydedin.
- 530-550 nm bandpass uyarma filtresine geçin ve aynı görüş alanına 30 sn video kaydedin.
- Beş pulmoner arteriol görüntülenene kadar önceki adımı tekrarlayın.
- 460-490 nm bandpass uyarma filtresini kullanarak, daha büyük damarlarla kesişmeyen bir alveol ve kılcal damar bölgesi bulun ve 30 s video kaydedin.
- 530-550 nm bandpass uyarma filtresine geçin ve aynı görüş alanına 30 sn video kaydedin.
- Beş kılcal bölge görüntülenene kadar önceki adımı tekrarlayın.
7. Ötenazi ve temizlik protokolü
- IVM platformunu mikroskop aşamasından çıkarın ve fareyi ötenazi yapmak için izofluran dağıtımını 5 dakika boyunca% 5'e ayarlayın.
- Beklerken kapak camını atın ve görüntüleme penceresini platformdan çıkarın. Görüntüleme penceresini küçük bir fırçayla temizleyin ve birkaç kez damıtılmış suyla yıkamak için kanala yerleştirilmiş 30 G'lık bir şırınga kullanın. Ardından, vakum pompasını kullanarak% 95 etanol ile yıkayın.
- 5 dakika geçtikten sonra, ventilatörü durdurun ve servikal çıkık yoluyla tam ötenazi sağlayın.
Sonuçlar
Bu protokolle elde edilebilecek sonuçları göstermek için, akut akciğer hasarı (ALI), intranazal bakteriyel lipopolisakkarit (LPS) damlatma modeli kullanılarak görüntülemeden 6 saat önce indüklendi. Kısaca, fareler (n = 3) izofluran ile uyuşturuldu ve steril salin (10 mg / mL) içindeki Pseudomonas aeruginosa'dan küçük LPS damlacıkları sol narise 5 mg / kg'lık bir dozajda pipetlendi. Bu, naif farelerle karşılaştırıldı (n = 3; burun içi uygulama yok).
Görüntüleme üzerine, başarılı bir cerrahi preparat çeşitli faktörlerle tanımlanabilir. Akciğer, 25 μm'den büyük olmayan siklik çerçeve kaymalarına neden olan solunum ile nispeten stabil olmalıdır. Alveoller açıkça görülebilmeli ve gelgit distansiyonu / kasılma gösterebilir. Mavi ışıkla uyarma (450-490 nm dalga boyu), kan akışı yönlülüğünün görselleştirilmesine izin verir ve bireysel kırmızı kan hücrelerini ayırt etmek mümkün olabilir (Ek Film 1, Ek Film 3 ve Ek Film 5). Lökositler, yeşil ışıkla uyarıldığında açıkça tanımlanacaktır (530-560 nm dalga boyu, Ek Film 2, Ek Film 4 ve Ek Film 6). Görüntülemenin tamamlanmasından ve emme penceresinin çıkarılmasından sonra, Şekil 3B'de gösterildiği gibi, görüntülenen alanda olmasa da, akciğer yüzeyinde hafif morarma olabilir.
Çeşitli teknik zorluklar deneysel uygulanabilirliği engelleyebilir. Akciğer yüzeyinde kan birikmesi vakum stabilizasyonunu tehlikeye atacak ve hatta kanalı tıkayabilir. Bunu önlemek için, her cerrahi adımda çok dikkatli olunmalıdır. Aşırı yüksek vakum basıncı akciğere zarar verebilir ve mikrosirkülasyonu etkileyebilir. Bu, alveoler staz veya pulmoner yüzeyde aşırı morarma (Şekil 3C) ile tanımlanabilir ve vakum pompasından gelen basıncı azaltarak düzeltilebilir. Ayrıca, intravenöz florofor enjeksiyonundaki hatalar, lökosit kaçakçılığının ve kan akışının zayıf bir şekilde görselleştirilmesine neden olabilir.
Protokolün tamamlanmasını takiben, Fiji 21 kullanılarak önceki literatür28'den uyarlanmış bir şekildekörleştirilmiş manuel analiz yapıldı. Her hayvandan beş venül, arterioller ve kılcal bölgeler (ROI) analiz edildi. Venüllerde ve arteriollerde lökosit adezyonu endotel yüzeyinin alanı başına 30 sn gözlem sırasında vasküler endotele yapışmış olarak kalan hücre sayısı olarak tanımlandı. Bu, hücreler /mm2 olarak iletilir. Kılcal damarlarda lökosit adezyonu ROI içinde toplam analiz edilen alan başına 30 sn gözlem sırasında vasküler endotele yapışmış kalan hücre sayısı olarak tanımlandı. Bu aynı zamanda hücreler /mm2 olarak da aktarılır. Lökosit yuvarlanması, 30'lu yılların gözlem döneminde damardaki bir referans noktasından geçen hücre sayısının iki katı olarak tanımlanmıştır. Serbest akan lökositler, geçiş hızı kırmızı kan hücresi akışınınkiyle karşılaştırılarak dışlandı ve bu hücreler / dak olarak iletildi. Mikrodolaşım perfüzyonunu ölçmek için FCD, gözlem alanı başına kırmızı kan hücresi perfüze edilmiş kılcal damarların uzunluklarının toplamı olarak tanımlandı. Bu cm/cm2 cinsinden aktarılır. Her parametre, her hayvan için ortalama bir değer olarak raporlanır.
Pulmoner venüllerde lökosit alımında yaygın bir eğilim gözlenmiş, LPS ile tedavi edilen farelerde naif olanlara kıyasla daha fazla adezyon ve yuvarlanma gözlenmiştir (Şekil 4C, D). Bu eğilim arteriyoler lökosit adezyonu ile özetlenmiştir, ancak naif grupta hem yuvarlanma hem de adezyon seviyeleri oldukça değişkendir (Şekil 5C, D). Özellikle, LPS uygulaması, pulmoner kapiller ROI'lerde lökosit yapışıklığında önemli bir artışa neden olmuştur (Şekil 6C). LPS fareleri ayrıca naif farelere karşı azalmış bir FCD göstermiştir (Şekil 7C). Pulmoner kılcal damarlardaki bu etkiler, görüş alanı başına immün hücrelerdeki artışları ve çeşitli inflamatuar uyaranları takiben normal kılcal perfüzyonun dengesizliğini tanımlayan önceki literatürle tutarlıdır 4,5,16.

Resim 1: Akciğer görüntüleme sistemi. Özel sipariş sistemi (1) eloksallı metal taban, (2) görüntüleme penceresi, (3) vakum girişi, (4) mikromanipülatör içerir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Cerrahi hazırlık . (A) Fare, IVM platformuna sağ lateral dekübit pozisyonunda sabitlenir. (B) Göğüs kafesi, hemodinamiği korumak için künt diseksiyon kullanılarak açığa çıkarılır. (C) Torakotomi sol akciğeri açığa çıkarmak için yapılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
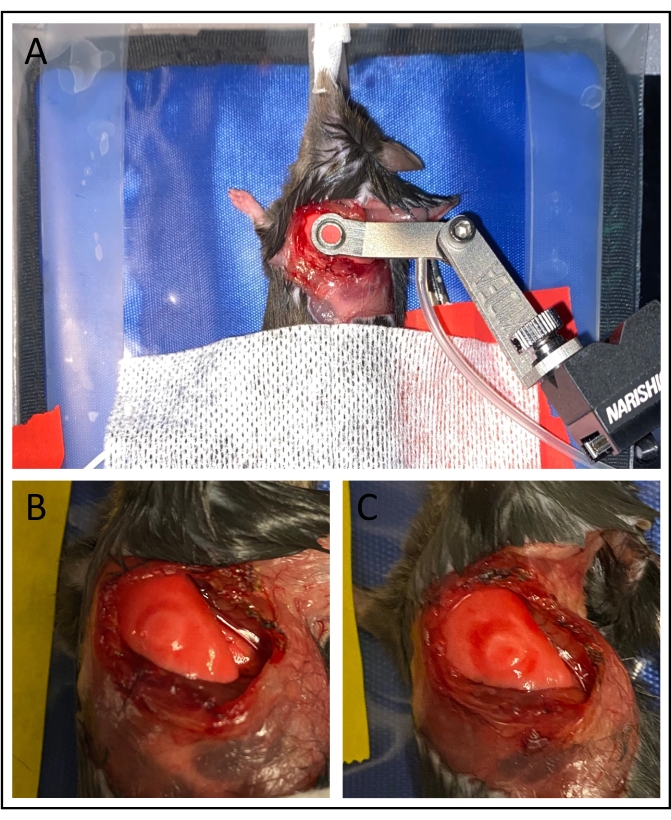
Şekil 3: Vakum stabilizasyonu . (A) Vakum görüntüleme penceresinin uygulanması pulmoner yüzeyi stabilize eder. (B) 75 mmHg'nin altındaki vakum basınçlarının kullanılması, özellikle görüntülenen alanda akciğere verilen hasarı en aza indirir. (C) Daha yüksek vakum basınçları önemli morarmalara neden olabilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
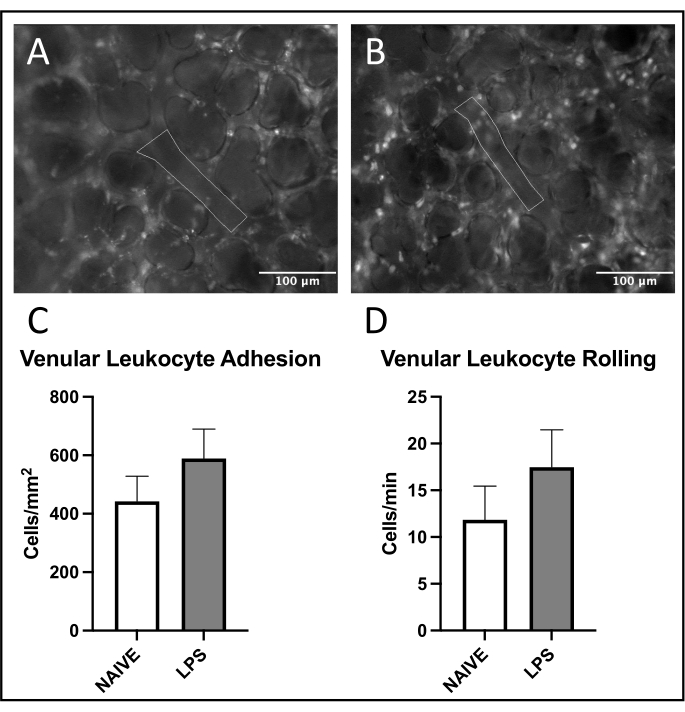
Şekil 4: Pulmoner venüllerde lökosit kaçakçılığı. Rhodamine 6G'nin uyarılması, yapışkan ve yuvarlanan lökositlerin görselleştirilmesine izin verir. Özetlenen alanlar, (A) naif ve (B) LPS ile tedavi edilen farelerde FITC-albüminin uyarılması ile doğrulanan vasküler endotelin analiz edilen kısımlarını temsil eder. (C,D) İntranazal LPS uygulaması pulmoner venüllerde lökosit yuvarlanmasını ve adezyonu etkiler. Değerler ortalama ± SD olarak verilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
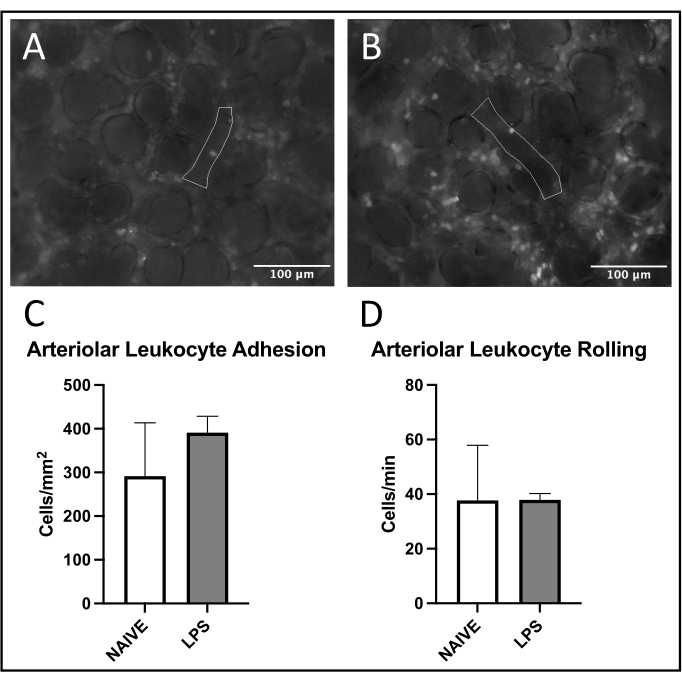
Şekil 5: Pulmoner arteriollerde lökosit kaçakçılığı. Rhodamine 6G'nin uyarılması, yapışkan ve yuvarlanan lökositlerin görselleştirilmesine izin verir. Özetlenen alanlar, (A) naif ve (B) LPS ile tedavi edilen farelerde FITC-albüminin uyarılması ile doğrulanan vasküler endotelin analiz edilen kısımlarını temsil eder. (C,D) İntranazal LPS uygulaması pulmoner arteriollerde lökosit yuvarlanmasını ve adezyonu etkiler. Değerler ortalama ± SD olarak verilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6: Pulmoner kılcal damarlarda yapışık lökositler. Rodamin 6G'nin uyarılması, (A) naif ve (B) LPS ile muamele edilmiş farelerde ROI'ler içindeki lökositlerin görselleştirilmesine izin verir. (C) İntranazal LPS uygulaması, LPS ile tedavi edilen farelerde lökosit yapışmasını etkiler. Değerler ortalama ± SD olarak verilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
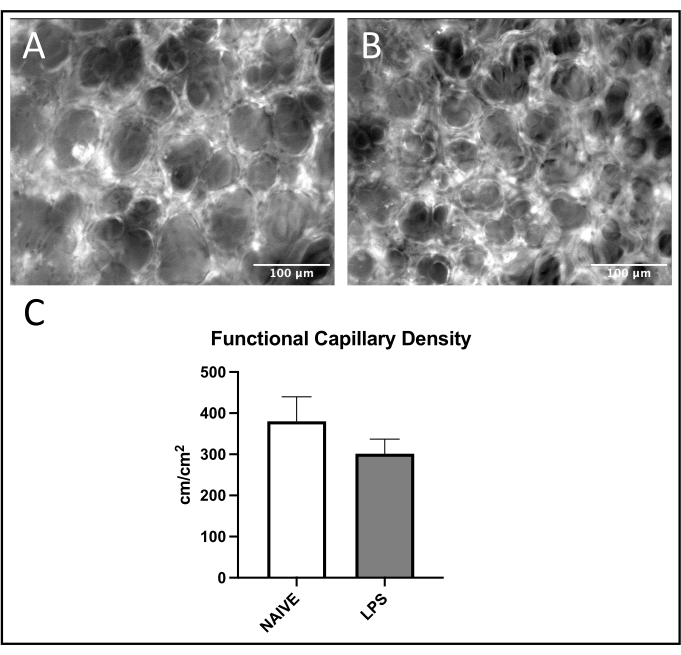
Şekil 7: Pulmoner kılcal fonksiyon. FITC-albüminin uyarılması, (A) naif ve (B) LPS ile tedavi edilen farelerde ROI'ler içindeki kılcal kan akışının görselleştirilmesine izin verir. (C) İntranazal LPS uygulaması pulmoner kılcal damarlarda FCD'yi etkiler. Değerler ortalama ± SD olarak verilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Dosya: 3D yazdırılabilir IVM platformu için dosya. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 1: Vakum sisteminin diyagramı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Film 1: Pulmoner venüldeki kan akışının örnek videosu. Yeşil ok, kan akışının yönünü gösterir. Bu Filmi indirmek için lütfen tıklayınız.
Ek Film 2: Pulmoner venülde lökosit kaçakçılığının örnek videosu. Kırmızı oklar, damar içindeki yapışkan lökositleri gösterir. Bu Filmi indirmek için lütfen tıklayınız.
Ek Film 3: Pulmoner arterioldeki kan akışının örnek videosu. Yeşil ok, kan akışının yönünü gösterir. Bu Filmi indirmek için lütfen tıklayınız.
Ek Film 4: Pulmoner arteriolde lökosit kaçakçılığının örnek videosu. Kırmızı oklar, bir damar içindeki yapışkan lökositleri gösterir. Bu Filmi indirmek için lütfen tıklayınız.
Ek Film 5: Pulmoner kılcal damarlardaki kan akışının örnek videosu. Yeşil oklar, kırmızı kan hücresi geçirgen kılcal damarların iyi görselleştirilmiş birkaç alanını gösterir. Bu Filmi indirmek için lütfen tıklayınız.
Ek Film 6: Pulmoner kılcal damarlarda lökosit kaçakçılığının örnek videosu. Kırmızı oklar, görüş alanındaki yapışkan lökositleri gösterir. Bu Filmi indirmek için lütfen tıklayınız.
Tartışmalar
Burada sunulan protokol, birkaç kritik adıma pratik ve dikkat gerektirir. İlk olarak, entübasyon ve cerrahiye başlamadan önce görüntüleme penceresini hazırlamak önemlidir. Görüntüleme penceresinin dış halkasını kaplamak, kapak camını uygulamak ve bir damla damıtılmış su ile emiş testi yapmak için minimum miktarda vakum gresi kullanın. Bunu önceden hazırlamak, aksi takdirde kurulum sırasında maruz kalan akciğerin kurumasını önleyecektir. Sıcak salin ile yıkamak mümkün olsa da, bunu yapmak kırılgan akciğer dokusuna zarar verme riski taşıyabilir.
Entübasyondan sonra, fareyi IVM platformuna aktarırken, kanül bazen yer değiştirebilir. Bunu önlemek için, kanülü farenin ön dişlerine bağlamayı veya ağzının etrafındaki cilde dikmeyi düşünün. Basınç kontrollü ventilasyon kullanılıyorsa, gelgit hacmi prosedür boyunca dikkatle izlenmelidir. Yaklaşık 0.20 mL'de sabit kalmalıdır, çünkü önemli ölçüde daha düşük değerler (örneğin, ~ 0.10 mL) tek akciğer ventilasyonunu gösterebilir. Bu durumda, endotrakeal kanülün hafifçe geri çekilmesi sorunu çözebilir. İnhalan anestezi (izofluran) kullanımı, fare havalandırılırken anestezik derinliğin kontrolünü kolaylaştırır. Diğer anestezi araçları (örneğin, intravenöz ketamin / ksilazin10,11) diğer laboratuvarlar tarafından kullanılmıştır ve her biri kendi avantajlarını ve dezavantajlarını taşır.
Ameliyat sırasında, kan damarlarının kopma riskini en aza indirmek için künt diseksiyon kullanılır. Bu, omuz yakınındaki kalın ve ağır vaskülarize yağ dokusunu diseke ederken özellikle önemlidir. Göğüs kafesinin rezeksiyonu hem hız hem de doğruluk gerektirir. Koterizörden gelen ısı, aşırı kullanıldığında akciğeri yakacak kadar yoğundur. Göğüs kafesini rezeke ederken, akciğer ile göğüs duvarı arasında boş boşluk olmalıdır. Akciğer göğüs duvarına yapışırsa, göğüs kafesinin dışına hafifçe bastırmak, altta yatan parietal plevraya yapışmayı teşvik edecektir. Alternatif olarak, serbest bırakmayı kolaylaştırmak için akciğer ve göğüs kafesi arasına az miktarda ılık salin enjekte etmek için künt bir iğne kullanın. Görüntüleme sırasında kaburgalar üzerinde istenmeyen baskıyı önlemek için pencere kolunun saat 3 pozisyonunda konumlandırılması önerilir (Şekil 3A). Ayrıca mikromanipülatör ve mikroskop hedefi arasında daha fazla boşluk bırakacak ve manipülasyonlar için daha kolay erişim sağlayacaktır. Görüntüleme penceresini alçaltırken, akciğerin merkezi bölgesini hedeflemek çok önemlidir, çünkü kenarla temas, görüntüleme sırasında yetersiz bir sızdırmazlığa ve aşırı hareket artefaktına neden olacaktır. Ayrıca, pencereyi indirmek için birden fazla girişim akciğere zarar verebilir. Benzer şekilde, ayrılma ve yeniden stabilizasyon döngüleri akciğer hasarına katkıda bulunacak ve deneysel doğruluğu tehlikeye atabilir. Bununla birlikte, doğru bir şekilde gerçekleştirildiğinde, burada sunulan preparat, 20x objektif ile yüksek çözünürlüklü intravital görüntülemeyi mümkün kılacak kadar kararlıdır.
Görüntüleme penceresindeki vakum kanalının kirlenmesini ve tıkanmasını önlemek için titiz bir temizleme protokolü gereklidir. Damıtılmış suyla tekrar tekrar yıkamak için deneylerden hemen sonra 30 G'lık bir iğne kullanmak, çoğu kirleticinin giderilmesinde etkilidir. Bunu, konsantre etanol ile yıkama ve nemi gidermek için vakum hattına tekrar bağlanmadan önce damıtılmış suyla son bir yıkama izler. Aseton veya güçlü deterjanlar kullanmak, meydana gelmeleri durumunda ciddi tıkanıklıkları gidermek için yeterli olabilir.
Özellikle, bu protokol, bildirilen diğer bazı yöntemlere kıyasla daha yüksek bir vakum basıncı okuması kullanır 4,11 ve bu, akciğer dokusuna zarar verme endişelerini artırabilir. Bununla birlikte, önemli bir ayrım, burada kullanılan dijital göstergenin yalnızca vakum pompasındaki basıncı ölçmesidir. Bu basınç, akciğerin daha geniş bir yüzey alanına dağılmadan önce dar borulardan ve görüntüleme penceresinin son derece dar kanalından geçirilir. Bu nedenle, intravital seansları takiben bu deneylerde görüntülenen bölgeye zarar verdiğine dair hiçbir kanıt gözlenmemiştir. Ayrıca, görüntülenen alveoller gelgit distansiyonu ve kasılma sergiledi ve bu fizyolojik fenomenin önemli ölçüde bozulmadığını gösterdi.
Akciğer IVM'nin in vivo hastalığı incelemek için bir araç olarak artan popülaritesine rağmen, bu tekniğin sınırlamaları vardır. İlk olarak, ameliyatın invaziv ve terminal doğası, farenin fizyolojik durumu üzerinde ihmal edilemez bir etkiye neden olur ve prosedürü tek bir görüntüleme seansıyla sınırlar. Bununla birlikte, birkaç uzunlamasına akciğer IVM yaklaşımının geliştirildiği belirtilmelidir30. İkincisi, mekanik ventilasyon kullanımı bir dereceye kadar ventilatörle ilişkili akciğer hasarına (VALI) neden olabilir31, ancak bu prosedürün kısa süresi ile sınırlıdır. Üçüncüsü, viseral plevra ve cam kapak kayması arasındaki temas ve vakum basıncının uygulanması mikrovasküler kan akışının değişmesine neden olabilir. Son olarak, bu yaklaşımın belki de en önemli sınırlaması, görüntülemenin tüm akciğer32'yi temsil etmeyen bağımlı olmayan pulmoner bölgelerde subplevral alveollerle sınırlı olmasıdır.
Özetle, bu protokol intravital floresan mikroskopi kullanılarak pulmoner mikrovaskülatürdeki lökosit-endotel etkileşimlerini incelemek için kullanılabilir. Bu deneyler, önceki araştırmalara dayanarak seçilen akut bir model olan endotoksin kaynaklı akciğer hasarını kullanırken, bu protokol akciğerdeki diğer patolojik ve fizyolojik süreçleri incelemek için de uyarlanabilir. Ayrıca, burada kullanılan akciğer görüntüleme sistemi bir dizi mikroskopi yaklaşımına uygulanabilir ve görüntüleme penceresi yüksek sayısal açıklıklı yağ daldırma hedeflerini karşılayacak kadar büyüktür. Bu nedenle, açıklanan prosedürler, çeşitli hastalık durumlarının pulmoner mikrosirkülasyon üzerindeki etkisine dair daha fazla araştırmayı kolaylaştırmalıdır.
Açıklamalar
Dr. Kamala D. Patel, bu deneyde kullanılan görüntüleme penceresinin satın alındığı Luxidea'nın başkanı ve kurucu ortağıdır.
Teşekkürler
Yazarlar, bu makalenin düzenlenmesi ve gözden geçirilmesinde önemli uzmanlık sağlayan Dr. Pina Colarusso'ya teşekkür eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL BD Luer Slip Tip Syringe sterile, single use | Becton, Dickinson and Company | 309659 | 1 mL syringe |
| ADSON Dressing Forceps, Tip width 0.6 mm, teeth length 11.5 mm, 12 cm | RWD Life Science Co. | F12002-12 | Blunt forceps |
| Albumin-Fluorescein Isothiocyanate | Sigma-Aldrich | A9771-1G | FITC-albumin |
| Alcohol Swab Isopropyl Alcohol 70% v/v | Canadian Custom Packaging Company | 80002455 | Alcohol wipe |
| AVDC110 Advanced Digital Video Converter | Canopus | 00631069602029 | Digital video converter |
| B/W - CCD - Camera | Horn Imaging | BC-71 | Camera |
| Bovie Deluxe High Temperature Cautery Kit | Fine Science Tools | 18010-00 | Cauterizer |
| C57BL/6 Mice | Charles River Laboratories International | C57BL/6NCrl | C57BL/6 Mice |
| Cotton Tipped Applicators | Puritan | 806-WC | Cotton applicator |
| CS-8R 8mm Round Glass Coverslip | Warner Instruments | 64-0701 | Glass coverslip |
| Digital Pressure Gauge | ITM Instruments Inc. | DG2551L0NAM02L0IM&V | Digital Pressure Gauge |
| Dr Mom Slimline Stainless LED Otoscope | Dr. Mom Otoscopes | 1001 | Otoscope |
| Ethyl Alchohol 95% Vol | Commercial Alcohols | P016EA95 | 95% ethanol |
| Fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | Scissors |
| Fisherbrand Colored Labeling Tape | Fisher Scientific | 1590110 | Labeling tape |
| Gast DOA-P704-AA High-Capacity Vacuum Pump | Cole-Parmer Canada Company | ZA-07061-40 | Vacuum pump |
| Hartman Hemostats | Fine Science Tools | 13003-10 | Hemostatic forceps |
| High Vacuum Grease | Dow Corning | DC976VF | Vacuum grease |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Isoflurane |
| LIDOcaine HCl Injection 1% 50 mg/5 mL | Teligent Canada | 0121AD01 | Lidocaine HCl 1% |
| Lung SurgiBoard | Luxidea, Inc. | IMCH-0001 | Designed for intravital microscopy of the lung |
| Mineral Oil | Teva Canada | 00485802 | Mineral oil |
| Mouse Endotracheal Intubation Kit | Kent Scientific Corporation | ETI-MSE | Intubation stand, anesthesia mask, 20 G endotracheal cannula, fibre optic cable |
| MST49 Fluorescence Microscope | Leica Microsystems | 10 450 022 | Fluorescence Microscope |
| N Plan L 20x/0.40 Long Working Distance Microscope Objective | Leica Microsystems | 566035 | 20x objective |
| Non-Woven Sponges 2" x 2" | AMD-Ritmed | A2101-CH | Gauze |
| Optixcare Eye Lube Plus | Aventix | 5914322 | Tear gel |
| Original Prusa i3 MK3S+ 3D Printer | Prusa Research | PRI-MK3S-KIT-ORG-PEI | 3D printer |
| Oxygen, Compressed | Linde Canada Inc. | Oxygen | |
| PrecisionGlide Needle 30 G x 1/2 (0.3 mm x 13 mm) | Becton, Dickinson and Company | 305106 | 30 G needle |
| Pyrex 5340-2L 5340 Filtering Flasks, 2000 mL | Cole-Parmer Canada Company | 5340-2L | Vacuum flask |
| Rhodamine 6 G | Sigma-Aldrich | 252433 | Rhodamine 6G |
| Secure Soft Cloth Medical Tape - 3" | Primed | PM5-630709 | Cloth tape |
| Silastic Medical Grade Tubing .040 in. ID x .085 in. OD | Dow Corning | 602-205 | 1.0 mm I.D. polyethylene tubing |
| Somnosuite Low-Flow Anesthesia System | Kent Scientific Corporation | SS-01, SS-04-module | Small rodent ventilator, Low-flow anesthesia system, Heating pad, Rectal temperature probe, Pulse oximeter |
| Tissue Forceps, 12.5cm long, Curved, 1 x 2 Teeth | World Precision Instruments | 501216 | Toothed forceps |
| Transpore Medical Tape, 1527-1, 1 in x 10 yd (2.5 cm x 9.1 m) | 3M | 7000002795 | Medical tape |
| Tubing,Clear,3/8 in Inside Dia. | Grainger Canada | USSZUSA-HT3314 | 1.0 cm I.D. polyethylene tubing |
| Whatman 6720-5002 50 mm In-Line Filters, PTFE, 0.2 µm | Cole-Parmer Canada Company | 6720-5002 | Inline 0.2µm filter |
Referanslar
- Alizadeh-Tabrizi, N., Hall, S., Lehmann, C. Intravital imaging of pulmonary immune response in inflammation and infection. Frontiers in Cell and Developmental Biology. 8, 620471(2021).
- Gaertner, M., et al. Toward a comprehensive interpretation of intravital microscopy images in studies of lung tissue dynamics. Journal of Biomedical Optics. 20 (6), 066009(2015).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Looney, M., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature Methods. 8 (2), 91-96 (2011).
- Bennewitz, M. F., Watkins, S. C., Sundda, P. Quantitative intravital two-photon excitation microscopy reveals absence of pulmonary vasoocclusion in unchallenged sickle cell disease mice. IntraVital. 3 (2), 29748(2014).
- Blueschke, G., et al. Automated measurement of microcirculatory blood flow velocity in pulmonary metastases of rats. Journal of Visualized Experiments: JoVE. (93), e51630(2014).
- Tabuchi, A., et al. Precapillary oxygenation contributes relevantly to gas exchange in the intact lung. American Journal of Respiratory and Critical Care Medicine. 188 (4), 474-481 (2013).
- Rodriguez-Tirado, C., et al. Long-term high-resolution intravital microscopy in the lung with a vacuum stabilized imaging window. Journal of Visualized Experiments: JoVE. (116), e54603(2016).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and Immunity. 82 (2), 864-872 (2014).
- Thanabalasuriar, A., Neupane, A. S., Wang, J., Krummel, M. F., Kubes, P. iNKT cell emigration out of the lung vasculature requires neutrophils and monocyte-derived dendritic cells in inflammation. Cell Reports. 16 (12), 3260-3272 (2016).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Tschernig, T., et al. Direct visualisation of microparticles in the living lung. Experimental and Toxicologic Pathology. 65 (6), 883-886 (2013).
- Mertens, M., et al. Alveolar dynamics in acute lung injury: Heterogeneous distension rather than cyclic opening and collapse. Critical Care Medicine. 37 (9), 2604-2611 (2009).
- Matuszak, J., Tabuchi, A., Kuebler, W. M. Ventilation and perfusion at the alveolar level: Insights from lung intravital microscopy. Frontiers in Physiology. 11, 291(2020).
- Margraf, A., et al. 6% Hydroxyethyl starch (HES 130/0.4) diminishes glycocalyx degradation and decreases vascular permeability during systemic and pulmonary inflammation in mice. Critical Care. 22 (1), 1-12 (2018).
- Roller, J., et al. Direct in vivo observations of P-selectin glycoprotein ligand-1-mediated leukocyte-endothelial cell interactions in the pulmonary microvasculature in abdominal sepsis in mice. Inflammation Research. 62 (3), 275-282 (2012).
- Marques, P., et al. Cigarette smoke increases endothelial CXCL16-leukocyte CXCR6 adhesion in vitro and in vivo. Potential consequences in chronic obstructive pulmonary disease. Frontiers in Immunology. 8, 1766(2017).
- Condon, M. R., Kim, J. E., Deitch, E. A., Machiedo, G. W., Spolarics, Z. Appearance of an erythrocyte population with decreased deformability and hemoglobin content following sepsis. American Journal of Physiology-Heart and Circulatory Physiology. 284 (6), 2177-2184 (2003).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: Relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Kim, Y. M., Jeong, S., Choe, Y. H., Hyun, Y. M. Two-photon intravital imaging of leukocyte migration during inflammation in the respiratory system. Acute and Critical Care. 34 (2), 101-107 (2019).
- Faust, N., Varas, F., Kelly, L. M., Heck, S., Graf, T. Insertion of enhanced green fluorescent protein into the lysozyme gene creates mice with green fluorescent granulocytes and macrophages. Blood. 96 (2), 719-726 (2000).
- Orthgiess, J., et al. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. European Journal of Immunology. 46 (6), 1529-1532 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Butt, Y., Kurdowska, A., Allen, T. C. Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine. 140 (4), 345-350 (2016).
- Park, I., et al. Neutrophils disturb pulmonary microcirculation in sepsis-induced acute lung injury. European Respiratory Journal. 53 (3), 1800786(2019).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American Journal of Respiratory Cell and Molecular Biology. 47 (6), 864-868 (2012).
- Pieper, M., Schulz-Hildebrandt, H., Mall, M. A., Hüttmann, G., König, P. Intravital microscopic optical coherence tomography imaging to assess mucus-mobilizing interventions for muco-obstructive lung disease in mice. American Journal of Physiology - Lung Cellular and Molecular Physiology. 318 (3), 518-524 (2020).
- Lamm, W. J. E., Bernard, S. L., Wiltz, W., Wagner, J., Glenny, R. W. Intravital microscopic observations of 15-µm microspheres lodging in the pulmonary microcirculation. Journal of Applied Physiology. 98 (6), 2242-2248 (2005).
- Entenberg, D., et al. A permanent window for the murine lung enables high-resolution imaging of cancer metastasis. Nature Methods. 15 (1), 73-80 (2018).
- Amato, M. B. P., et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. New England Journal of Medicine. 338 (6), 347-354 (2009).
- Looney, M. R., Bhattacharya, J. Live imaging of the lung. Annual Review of Physiology. 76, 431-445 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır