Method Article
使用真空稳定成像系统的实验性急性肺损伤中肺微循环的活体内宽视场荧光显微镜
摘要
活体荧光显微镜可用于实时研究白细胞 - 内皮相互作用和毛细血管灌注。该协议描述了使用真空稳定的肺成像系统在肺微循环中对这些参数进行成像和量化的方法。
摘要
白细胞-内皮相互作用的活体成像为活体动物免疫介导的疾病提供了有价值的见解。急性肺损伤(ALI)/急性呼吸窘迫综合征(ARDS)和其他体内 呼吸系统疾病 的研究由于肺部的可及性和固有的运动伪影有限而很困难。尽管如此,已经制定了各种方法来克服这些挑战。该协议描述了一种用于玻璃体内荧光显微镜的方法,用于在ALI的实验模型中研究肺微循环中的实时白细胞 - 内皮相互作用。使用 体内 肺成像系统和3D打印的活体内显微镜平台来保护麻醉小鼠并稳定肺部,同时最大限度地减少混杂的肺损伤。制备后,使用宽视场荧光显微镜研究白细胞粘附,白细胞滚动和毛细管功能。虽然这里介绍的方案侧重于炎症性肺病急性模型中的成像,但它也可能适用于研究肺部的其他病理和生理过程。
引言
活体显微镜(IVM)是一种有用的成像工具,用于可视化和研究 体内各种生物物理过程。肺 在体内 成像是非常具有挑战性的,因为它的封闭位置,其组织的脆弱性以及呼吸和心跳引起的运动伪影1,2。已经开发了各种活体显微镜(IVM)装置,用于肺微循环中白细胞 - 内皮相互作用的实时成像,以克服这些挑战。这些方法基于手术暴露和稳定肺部以进行成像。
动物通常通过外科手术为肺病媒体移植做准备。首先,对动物进行插管和通气,这允许手术切除胸窗并随后进行干预以稳定肺部以进行成像。一种技术涉及将实质粘附在玻璃盖玻片3上,该过程可能会对成像组织造成重大的物理创伤。更先进的是利用真空系统在玻璃窗4下稳定肺部。这种设置有助于通过分布在大面积区域的可逆真空将肺表面松散地粘附到盖玻片上,并扩大肺,同时仍然限制x,y和z尺寸4的运动。真空通过围绕装置成像区域的通道均匀施加,并将组织拉入面向成像级盖玻片4的浅锥形区域。通过这个观察窗,可以使用各种光学成像方式研究肺微循环。
肺病媒体能对多种微循环参数进行定量成像。这些包括诸如白细胞轨迹速度和长度5,红细胞流速6和氧合7,肿瘤转移8,免疫细胞亚群9,10,11的区别,微粒的可视化12,肺泡动力学13,14,血管通透性15和毛细血管功能16的测量.这里的重点是白细胞募集和毛细血管功能。肺微循环中白细胞募集的开始涉及白细胞和内皮细胞之间的瞬时滚动相互作用和牢固的粘附相互作用,两者在炎症条件下均增加16,17。通常,滚动通过操作员定义的参考线的白细胞数量来量化,而粘附则通过内皮16上不动的白细胞数量来量化。毛细血管功能也可能在炎症状态下受到影响,通常导致灌注减少。这可以归因于几个因素,包括红细胞变形性的降低18和内皮细胞诱导的NO合酶的杂交表达导致病理性分流19。通常,测量每个区域灌注毛细血管的聚集长度,并将其报告为功能性毛细血管密度(FCD)。
实时研究肺部白细胞募集需要用荧光染料或荧光标记抗体标记生物靶标20。或者,各种转基因小鼠菌株如溶菌酶M-green荧光蛋白(LysM-GFP)小鼠可用于对特异性免疫细胞亚群(如嗜中性粒细胞21,22)进行成像。然后可以使用宽视场荧光显微镜,共聚焦显微镜或多光子显微镜观察荧光标记的白细胞。这些技术通过利用特定的激发波长和检测发射的荧光来实现对比度,同时阻断激发波长的检测,从而突出显示标记的物体。
关于小鼠肺白细胞滚动、粘附和功能毛细血管密度量化的现有研究主要依赖于手动视频分析。这是通过开源软件(如斐济6,23)、专有软件(如CapImage12)或定制图像处理系统24实现的。相反,各种专有软件平台(例如,NIS Element,Imaris,Volocity,MetaMorph)可以自动测量各种其他生理参数,包括前面提到的许多5,6,7,8,9,10,11,12,13,15。
关于使用肺病媒的急性肺损伤 (ALI) 和急性呼吸窘迫综合征 (ARDS) 的病理学,已经做出了重要的观察结果。ARDS的特征在于肺部的一系列病理生理过程,包括由内皮和上皮屏障25功能障碍引起的肺水肿和肺泡损伤。使用小鼠模型,已经发现脓毒症诱导的ALI与肺环境中免疫细胞运输的显着有害变化有关26。发现招募到脓毒症诱导的ALI小鼠毛细血管的嗜中性粒细胞阻碍微循环,从而增加ALI26的缺氧。此外,IVM已被用于深入了解ARDS27发作后的潜在修复机制。肺病媒综合防治也是了解各种阻塞性肺疾病病理生理学变化的宝贵工具。例如,囊性纤维化(CF)和慢性阻塞性肺疾病(COPD)等疾病中粘液运输的可视化促进了对粘液清除的新型和现有治疗方法的研究28。这些条件下的白细胞运输也进行了分析17.
该协议扩展了Lamm等人最初描述的方法,以 使用常规荧光显微镜研究白细胞 - 内皮相互作用。所描述的程序采用 体内 肺成像系统,其中包括16.5 cm x 12.7cm金属底座,显微操作器和真空成像窗口(图1)。该系统安装在20 cm x 23.5 cm的3D打印平台(补充文件1)中,为通风机管和加热垫提供安全连接。该方法为小鼠肺微循环 在体内提供了可重复和可量化的成像。详细解释了手术准备的重要方面以及真空稳定肺成像系统的正确利用。最后,利用ALI实验模型对改变的白细胞滚动、白细胞粘连和与炎症相关的毛细血管灌注进行有代表性的成像和分析。使用该方案应有助于进一步重要研究急性疾病状态下肺部微循环的病理生理学变化。
研究方案
这里描述的所有程序都是在达尔豪斯大学实验动物委员会(UCLA)的事先批准下进行的。
1. 准备工作
- 肺部成像系统:为了准备窗口,在外圈顶部施用一层薄薄的真空润滑脂,同时避免真空通道的污染。将干净的8毫米玻璃盖玻片放在窗户上,然后轻轻按下以形成密封。
- 宽视场荧光显微镜:使用配备20x/0.40长工作距离物镜和帧速率为25 FPS的黑白电荷耦合器件(CCD)相机的传统宽视场荧光显微镜进行成像。应用530-550 nm带通激发滤光片以激发Rhodamine-6G,并使用460-490 nm带通滤光片以激发荧光素异硫氰酸酯(FITC)。
- 真空系统:将成像窗口连接到装有数字压力表的真空泵,该压力表能够提供50-60 mmHg的恒定抽吸,如 补充图1所示。简而言之,通过内径为 1.0 mm 的聚乙烯管、内径为 1.0 cm 的聚乙烯管、真空瓶和在线 0.2 μm 过滤器将成像窗口连接到泵。
- 呼吸机:设置一个小型啮齿动物呼吸机,以根据小鼠体重计算的速率和体积提供压力控制的通气。在实验期间,在5 cmH2O下提供呼气末正压(PEEP),并将目标压力设置为20 cmH2O。
- 麻醉剂:使用低流量麻醉输送系统,用99.9%异氟醚启动5.0 mL注射器。使用废气清除系统,以最大限度地降低外科医生吸入的风险。
2. 麻醉
- 将一只20-25g 12周龄的雄性C57Bl / 6小鼠置于麻醉诱导室中。在腔室牢固关闭的情况下,开始以3%浓度和500 mL / min的流速的异氟醚气体进行诱导。
- 一旦小鼠被麻醉(通过减缓的呼吸速率可视化),将其转移到插管台,并将上门牙固定在悬挂的缝合线上。
- 拧紧缝合线,将鼻子固定在鼻锥内。气体开始以2.5%的浓度流过鼻锥。
- 在进入下一步之前,通过脚趾捏合确认足够的麻醉深度。
3. 插管
- 旋转支架,使支架的背面和鼠标的背侧朝向外科医生。
- 将20厘米长的光纤电缆的尖端穿过20 G气管插管,并将尖端浸入盐酸利多卡因(1%)中,以促进电缆通过喉部。
- 使用钝镊子,抬起下颌并移位舌头,以提供进入呼吸道的清晰通道。
- 插入修改后的耳镜(去除约60°的窥器周长),使上门牙适合窥器的间隙。调整镜面和舌头位置,直到会厌,声带清晰可见。
- 将装有气管插管的光纤电缆穿过窥器中的间隙插入喉部。使用小的圆周运动,将电缆穿过声带并进入气管。
- 沿着光纤电缆推动套管,在声带之间穿过并进入气管。
4. 通风
- 从插管架上取回鼠标,并将其放在右侧侧卧位的加热垫上。
- 将套管连接到呼吸机管,然后启动呼吸机。将麻醉浓度降低到1.5%,并通过测试踏板反射来监测深度。如果反射持续,则逐渐将浓度提高到高达2%。
- 将泪水凝胶放在小鼠的眼睛中以防止干燥。
- 使用医用胶带将插管固定在鼻子上。使用贴标胶带,将右前爪固定在加热垫上,大约在9点钟位置。将左后爪向尾部伸出,并固定在大约6点钟位置。
- 使用布胶带,轻轻地将左前爪拉伸到12点钟位置,并将胶带的另一端固定在IVM平台的顶部,如图 2A所示(此处保持轻微的张力有助于随后的开胸术)。
- 插入直肠温度探头,并通过将探头贴在加热垫上来固定探头。将脉搏血氧仪放在右后爪上,并固定在加热垫上,注意不要破坏血液循环。
- 一旦温度稳定在37.0°C±0.1°C,继续进行开胸手术。
5. 开胸术
- 用70%酒精擦拭消毒胸部和腹部。涂上一层薄薄的矿物油,以抑制小鼠左侧的头发 - 从胸骨到脊柱,从肩膀到肋骨底部。
- 用钝镊子和直剪刀,在肋骨底部附近做一个小的纵向切口,以暴露下面的肌肉层。
- 腹侧移动,使用钝性夹层将上皮和脂肪组织与肌肉层分开。烧灼任何暴露的血管。一旦失血风险得到缓解,将原始切口腹侧延伸至 xiphoid 过程。
- 在背部重复此过程,直到脊柱外侧约5mm。
- 颅骨移动,使用钝性夹层暴露肋骨。烧灼任何暴露的血管以保持血流动力学稳定性。
- 一旦失血的风险得到缓解,将切口从剑突延伸到腋窝。
- 在切口的背侧重复此过程,直到左耳下约1厘米。
- 使用止血镊子,抓住解剖的上皮和脂肪组织,并远离手术区域(图2B)。
- 注射罗丹明-6G溶液(0.5 mg / mL; 1.5 mL / kg)以可视化白细胞和牛FITC-白蛋白(50 mg / mL; 1 mL / kg),以通过尾静脉可视化毛细血管灌注。
- 使用齿镊子,在末端吸气时抓住紧挨着肺根部位置的肋骨,并稍微缩回以将肋骨从肺部拉开。切开肋骨以诱发气胸。
- 沿肋间肌向两个方向横向延伸切口,注意不要接触暴露的肺表面。
- 使用钝镊子,抓住下一个最高的肋骨并稍微缩回,以使肺从胸壁上脱落。如果肺没有脱离,将胸壁轻轻压在肺上,使肺粘附在下面的胸膜上,从而更容易脱落。
- 继续腹侧原始切口,直到胸骨和颅骨,直到肺顶暴露。使用棉花涂抹器和纱布来减轻任何出血。
- 抬高胸腔,露出胸腔背侧的肋间血管。注意不要损伤肺部,烧灼靠近脊柱的最下肋间血管,然后切开肋骨。颅骨和腹侧移动,重复直至切除约1 cm x 1.5 cm的肋骨部分(图2C)。
- 使用小条纱布通过毛细管作用去除胸腔中任何多余的液体积聚。
- 在进行显微镜检查时,允许胸腔内液体消散约5分钟,以使肺和成像窗口之间的界面更安全。
6. 显微镜
- 打开真空泵,将压力调节至 ~50–60 mmHg。
- 将IVM平台转移到显微镜载物台。将金属柱和显微操作器放置在成像窗口的正上方,并且窗臂从大约3点钟位置接近肺。
- 使用显微操作器,小心地降低成像窗口,直到它粘附并稳定肺表面(图3A)。
- 使用20x物镜和460-490nm带通激发滤光片,根据血流的收敛模式识别肺静脉。将容器居中在视野中并录制30秒的视频。
- 切换到 530-550 nm 带通激励滤波器,并在同一视场内录制 30 秒的视频。
- 重复上一步,直到对五个肺小静脉进行成像。
- 使用460-490 nm带通激发滤光片,根据血流的发散模式识别肺小动脉。将容器居中在视野中并录制30秒的视频。
- 切换到 530-550 nm 带通激励滤波器,并在同一视场内录制 30 秒的视频。
- 重复上一步,直到对五条肺小动脉进行成像。
- 使用460-490 nm带通激励滤波器,定位与较大血管不相交的肺泡和毛细管区域,并记录30秒的视频。
- 切换到 530-550 nm 带通激励滤波器,并在同一视场内录制 30 秒的视频。
- 重复上一步,直到对五个毛细管区域进行成像。
7. 安乐死和清洁规程
- 从显微镜载物台上取下IVM平台,并将异氟醚递送调整至5%5分钟以对小鼠实施安乐死。
- 等待时,丢弃盖板玻璃,断开成像窗口与平台的连接。用小刷子清洁成像窗口,并使用插入通道的30 G注射器用蒸馏水冲洗几次。然后,使用真空泵用95%乙醇冲洗。
- 5分钟后,停止呼吸机,并确保通过宫颈脱位完全安乐死。
结果
为了说明通过该方案可以获得的结果,在成像前6小时使用鼻内细菌脂多糖(LPS)滴注模型诱导急性肺损伤(ALI)。简而言之,用异氟醚麻醉小鼠(n = 3),并将来自铜 绿假单胞菌 在无菌盐水(10mg / mL)中的LPS小液滴以5mg / kg的剂量移液到左肾上腺素中。将其与幼稚小鼠(n = 3;无鼻内给药)进行比较。
在影像学检查后,成功的手术准备可以通过几个因素来识别。肺应相对稳定,呼吸引起不大于 25 μm 的循环帧移位。肺泡应清晰可见,并可能出现潮气膨胀/收缩。蓝光(450-490nm波长)的激发将允许血流方向性的可视化,并且有可能区分单个红细胞(补充电影1,补充电影3和补充电影5)。白细胞在绿光(530-560nm波长,补充电影2,补充电影4和补充电影6)激发时将清晰可辨。在完成成像并移除吸引窗口后,尽管不在成像区域内,但肺表面可能会有轻微的瘀伤,如图3B所示。
一些技术挑战可能会干扰实验可行性。血液积聚在肺表面会损害真空稳定性,甚至可能堵塞通道。为了避免这种情况,在每个手术步骤中应格外小心。过高的真空压力可能会损害肺部并影响微循环。这可以通过肺泡淤滞或肺表面过度瘀伤来识别(图3C),并且可以通过降低真空泵的压力来补救。同样,静脉注射荧光团的错误可能导致白细胞运输和血流的可视化不良。
在方案完成后,使用斐济21 以改编自先前文献28的方式进行盲法手动分析。分析了每种动物的五个小静脉,小动脉和毛细血管感兴趣区域(ROI)。小静脉和小动脉中的白细胞粘附被定义为在观察内皮表面30s期间保持粘附在血管内皮上的细胞数量。这是在单元格/ mm2中继的。毛细血管中的白细胞粘附定义为ROI内每个总分析区域在观察30s期间保持粘附在血管内皮上的细胞数量。这也在细胞/ mm2中继。白细胞滚动被定义为在30秒观察期间通过血管中参考点的细胞数量的两倍。通过比较传代速度和红细胞流动速度来排除自由流动的白细胞,并将其以细胞/分钟为单位进行中继。为了测量微循环灌注,FCD被定义为每个观察区域红细胞灌注毛细血管长度的总和。这是以厘米/平方厘米2为单位的。每个参数都报告为每只动物的平均值。
在肺小静脉中观察到白细胞募集的常见趋势,与幼稚小鼠相比,LPS处理的小鼠的粘附和滚动增加(图4C,D)。小动脉白细胞粘附概括了这一趋势,尽管在幼稚组中滚动和粘附水平都高度可变(图5C,D)。值得注意的是,LPS给药导致肺毛细血管ROI中白细胞粘附的显着增加(图6C)。LPS小鼠还表现出与幼稚小鼠相比FCD降低(图7C)。肺毛细血管内的这些影响与先前文献一致,该文献确定了每个视场免疫细胞的增加以及各种炎症刺激后正常毛细血管灌注紊乱4,5,16。

图1:肺部成像系统。 定制系统包括(1)阳极氧化金属底座,(2)成像窗口,(3)真空入口,(4)显微操纵器。 请点击此处查看此图的大图。

图2:手术准备。 (A)将鼠标固定在IVM平台上的右侧侧卧位。(B)使用钝性夹层暴露肋骨以保持血流动力学。(C)进行开胸术以暴露左肺。 请点击此处查看此图的大图。
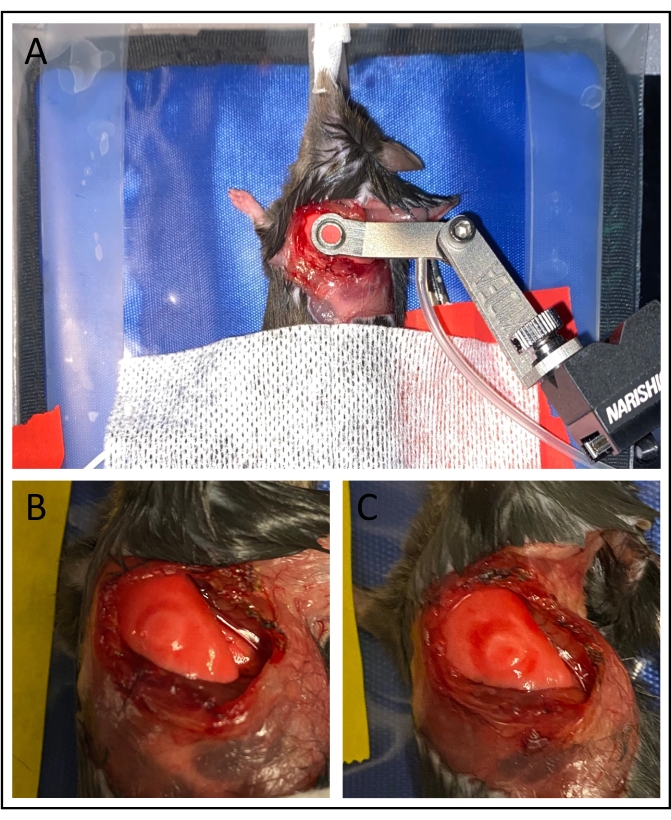
图3:真空稳定。 (A)应用真空成像窗口稳定肺表面。(B) 利用低于 75 mmHg 的真空压力可最大限度地减少对肺部的损害,特别是在成像区域内。(C)较高的真空压力可能导致严重的瘀伤。 请点击此处查看此图的大图。
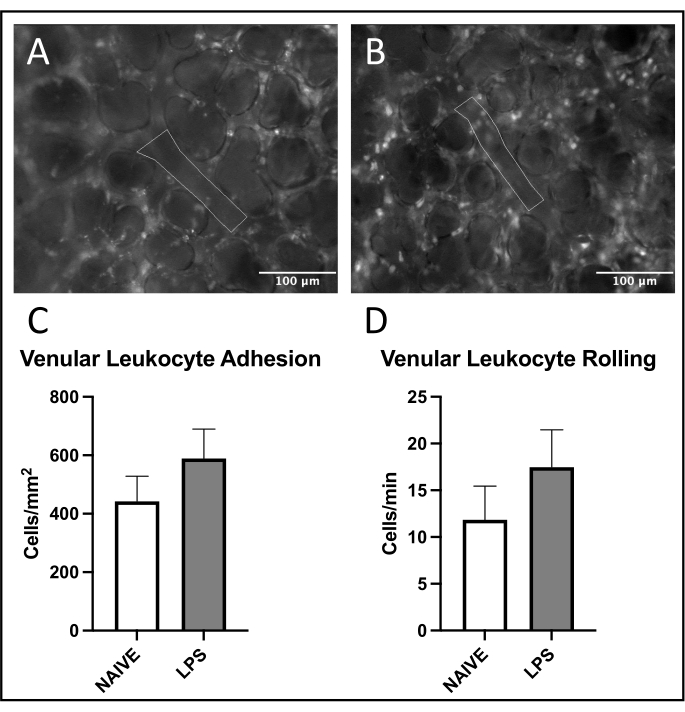
图4:肺小静脉中的白细胞运输。 罗丹明6G的激发允许粘附和滚动白细胞的可视化。概述的区域代表血管内皮的分析部分,通过激发(A)幼稚和(B)LPS处理的小鼠中的FITC-白蛋白来证实。(C,D)鼻内 LPS 给药会影响白细胞滚动和肺小静脉粘连。值± SD 给出。 请点击此处查看此图的大图。
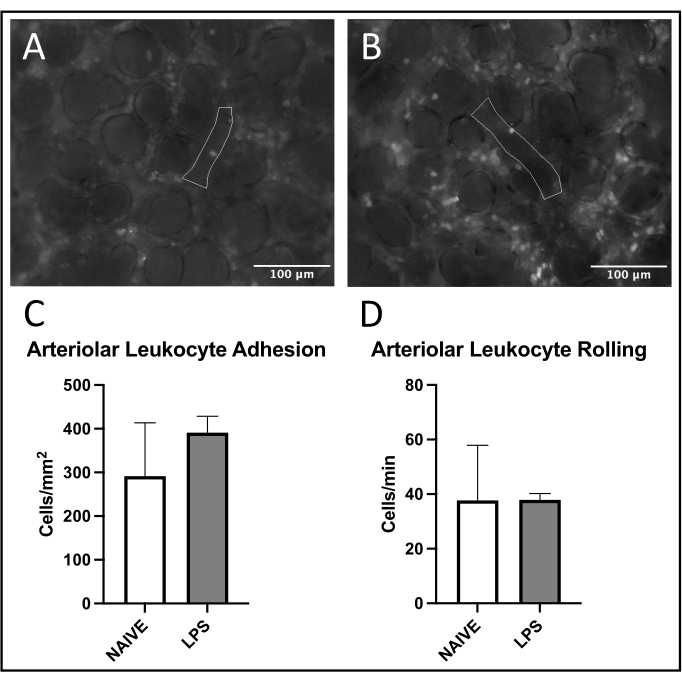
图5:肺小动脉中的白细胞运输。 罗丹明6G的激发允许粘附和滚动白细胞的可视化。概述的区域代表血管内皮的分析部分,通过激发(A)幼稚和(B)LPS处理的小鼠中的FITC-白蛋白来证实。(C,D)鼻内LPS给药影响白细胞滚动和肺小动脉粘连。值± SD 给出。 请点击此处查看此图的大图。

图6:肺毛细血管中的粘附白细胞。 罗丹明6G的激发允许在(A)幼稚和(B)LPS处理的小鼠中ROI中的白细胞可视化。(C)鼻内LPS给药影响LPS处理的小鼠的白细胞粘附。值是± SD 的平均值给出 的。请点击此处查看此图的大图。
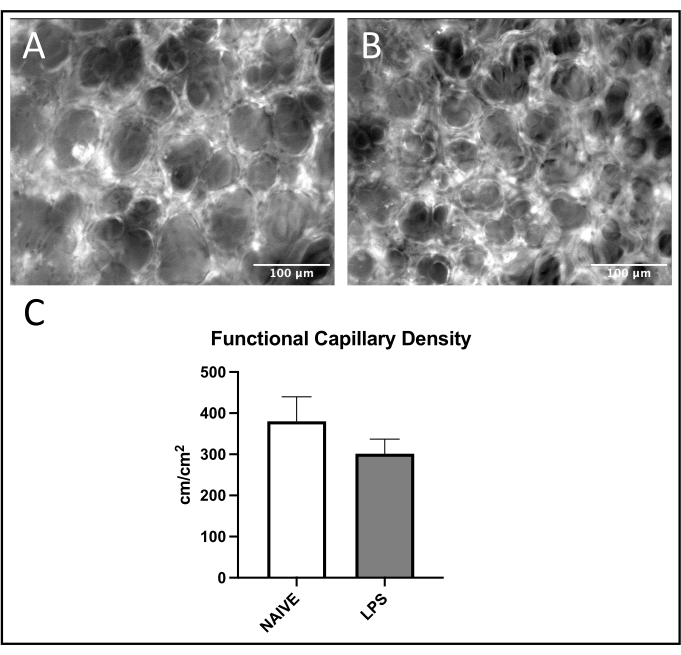
图7:肺毛细血管功能。 FITC白蛋白的激发允许(A)幼稚和(B)LPS处理的小鼠中ROI内的毛细血管血流可视化。(C)鼻内LPS给药影响肺毛细血管中的FCD。值是± SD 的平均值给出 的。请点击此处查看此图的大图。
补充文件:用于 3D 打印 IVM 平台的文件。请点击此处下载此文件。
补充图1:真空系统示意图。请点击此处下载此文件。
补充电影1:肺静脉血流的样本视频。 绿色箭头表示血流的方向。 请点击这里下载这部电影。
补充影片2:肺小静脉中白细胞运载的样本视频。 红色箭头表示血管内的贴壁白细胞。 请点击这里下载这部电影。
补充电影3:肺小动脉血流的样本视频。 绿色箭头表示血流的方向。 请点击这里下载这部电影。
补充影片4:肺小动脉中白细胞运输的样本视频。 红色箭头表示血管内的粘附白细胞。 请点击这里下载这部电影。
补充电影5:肺毛细血管血流的样本视频。 绿色箭头表示红细胞灌注毛细血管的几个可视化区域。 请点击这里下载这部电影。
补充影片6:肺毛细血管中白细胞运输的样本视频。 红色箭头表示视野内的贴壁白细胞。 请点击这里下载这部电影。
讨论
这里介绍的协议需要练习并注意几个关键步骤。首先,在开始插管和手术之前准备成像窗口很重要。使用最少量的真空润滑脂涂覆成像窗口的外环,涂上盖玻片,并用一滴蒸馏水测试吸力。提前准备可以防止暴露的肺在设置过程中变干。虽然可以用温盐水冲洗,但这样做可能会损害脆弱的肺组织。
插管后,在将鼠标转移到IVM平台时,插管可能偶尔会移位。为了防止这种情况,请考虑将插管绑在小鼠的门牙上,或将其缝合到嘴巴周围的皮肤上。如果使用压力控制通气,应在整个过程中仔细监测潮气量。它应保持稳定在约 0.20 mL,因为显著较低的值(例如,~0.10 mL)可能提示单肺通气。如果发生这种情况,稍微缩回气管插管可能会解决问题。使用吸入剂麻醉(异氟醚)有助于在小鼠通气时控制麻醉深度。其他实验室也采用了其他麻醉手段(例如,静脉注射氯胺酮/甲苯噻嗪10,11),每种方法都有各自的优点和缺点。
在手术过程中,采用钝性夹层以尽量减少切断血管的风险。在解剖肩部附近厚厚且血管严重的脂肪组织时,这一点尤其重要。胸腔切除术需要速度和准确性。烧灼器产生的热量足够强烈,如果过度使用,会灼伤肺部。切除胸腔时,肺和胸壁之间应该有空的空间。如果肺粘附在胸壁上,轻轻按压肋骨笼的外侧会促进对下层壁胸膜的粘附。或者,使用钝针在肺和胸腔之间注射少量温盐水,以促进释放。建议将窗臂定位在3点钟位置,以避免在成像过程中对肋骨造成不必要的压力(图3A)。它还将在显微操纵器和显微镜物镜之间留出更多的间隙,从而更容易地进行操作。当降低成像窗口时,瞄准肺部的中心区域至关重要,因为在成像过程中,与边缘的接触会导致密封不足和运动伪影过多。此外,多次尝试降低窗口可能会损害肺部。同样,脱离和重新稳定的循环会导致肺损伤,并可能损害实验准确性。然而,如果操作正确,这里介绍的制剂足够稳定,可以使用20倍物镜进行高分辨率活体内成像。
严格的清洁方案对于防止成像窗口内真空通道的污染和堵塞是必要的。在实验后立即使用30 G针头用蒸馏水反复冲洗可有效去除大多数污染物。然后用浓缩乙醇冲洗,最后用蒸馏水冲洗,然后重新连接到真空管路以除去水分。如果发生严重阻塞,使用丙酮或强力洗涤剂可能足以解决严重堵塞。
值得注意的是,与其他一些报道的方法4,11相比,该方案采用更高的真空压力读数,这可能会引起对肺组织损伤的担忧。然而,一个重要的区别是,这里使用的数字仪表仅测量真空泵处的压力。该压力通过狭窄的导管和成像窗口本身的极窄通道传递,然后分布在更大的肺表面积上。因此,在活体内会议后的这些实验中没有观察到成像区域受损的证据。此外,成像的肺泡表现出潮气膨胀和收缩,表明这种生理现象没有受到显着破坏。
尽管肺病媒综合防治作为研究 体内疾病的工具越来越受欢迎,但这种技术存在局限性。首先,手术的侵入性和终末性诱导对小鼠生理状态产生不可忽视的影响,并将手术限制在单个成像过程中。然而,应该指出的是,已经开发了几种纵向肺病媒综合防治方法30种。其次,使用机械通气可能会诱发一定程度的呼吸机相关肺损伤 (VALI)31,尽管这受到手术持续时间短的限制。第三,内脏胸膜与玻璃盖玻片之间的接触和施加真空压力可能导致微血管血流量改变。最后,也许这种方法最显著的局限性是,影像学检查仅限于非依赖性肺区域的胸膜下肺泡,其不能代表整个肺32。
总之,该方案可用于使用活体内荧光显微镜研究肺微血管系统中的白细胞 - 内皮相互作用。虽然这些实验采用内毒素诱导的肺损伤,这是一种基于先前研究选择的急性模型,但该方案也可以适应于研究肺部的其他病理和生理过程。此外,这里采用的肺成像系统适用于一系列显微镜方法,并且成像窗口足够大,可以容纳高数值孔径油浸物镜。因此,所描述的程序应有助于进一步研究各种疾病状态对肺微循环的影响。
披露声明
Kamala D. Patel博士是Luxidea的总裁兼联合创始人,Luxidea是购买本实验中使用的成像窗口的企业。
致谢
作者要感谢Pina Colarusso博士,他在编辑和修订本手稿方面提供了丰富的专业知识。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL BD Luer Slip Tip Syringe sterile, single use | Becton, Dickinson and Company | 309659 | 1 mL syringe |
| ADSON Dressing Forceps, Tip width 0.6 mm, teeth length 11.5 mm, 12 cm | RWD Life Science Co. | F12002-12 | Blunt forceps |
| Albumin-Fluorescein Isothiocyanate | Sigma-Aldrich | A9771-1G | FITC-albumin |
| Alcohol Swab Isopropyl Alcohol 70% v/v | Canadian Custom Packaging Company | 80002455 | Alcohol wipe |
| AVDC110 Advanced Digital Video Converter | Canopus | 00631069602029 | Digital video converter |
| B/W - CCD - Camera | Horn Imaging | BC-71 | Camera |
| Bovie Deluxe High Temperature Cautery Kit | Fine Science Tools | 18010-00 | Cauterizer |
| C57BL/6 Mice | Charles River Laboratories International | C57BL/6NCrl | C57BL/6 Mice |
| Cotton Tipped Applicators | Puritan | 806-WC | Cotton applicator |
| CS-8R 8mm Round Glass Coverslip | Warner Instruments | 64-0701 | Glass coverslip |
| Digital Pressure Gauge | ITM Instruments Inc. | DG2551L0NAM02L0IM&V | Digital Pressure Gauge |
| Dr Mom Slimline Stainless LED Otoscope | Dr. Mom Otoscopes | 1001 | Otoscope |
| Ethyl Alchohol 95% Vol | Commercial Alcohols | P016EA95 | 95% ethanol |
| Fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | Scissors |
| Fisherbrand Colored Labeling Tape | Fisher Scientific | 1590110 | Labeling tape |
| Gast DOA-P704-AA High-Capacity Vacuum Pump | Cole-Parmer Canada Company | ZA-07061-40 | Vacuum pump |
| Hartman Hemostats | Fine Science Tools | 13003-10 | Hemostatic forceps |
| High Vacuum Grease | Dow Corning | DC976VF | Vacuum grease |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Isoflurane |
| LIDOcaine HCl Injection 1% 50 mg/5 mL | Teligent Canada | 0121AD01 | Lidocaine HCl 1% |
| Lung SurgiBoard | Luxidea, Inc. | IMCH-0001 | Designed for intravital microscopy of the lung |
| Mineral Oil | Teva Canada | 00485802 | Mineral oil |
| Mouse Endotracheal Intubation Kit | Kent Scientific Corporation | ETI-MSE | Intubation stand, anesthesia mask, 20 G endotracheal cannula, fibre optic cable |
| MST49 Fluorescence Microscope | Leica Microsystems | 10 450 022 | Fluorescence Microscope |
| N Plan L 20x/0.40 Long Working Distance Microscope Objective | Leica Microsystems | 566035 | 20x objective |
| Non-Woven Sponges 2" x 2" | AMD-Ritmed | A2101-CH | Gauze |
| Optixcare Eye Lube Plus | Aventix | 5914322 | Tear gel |
| Original Prusa i3 MK3S+ 3D Printer | Prusa Research | PRI-MK3S-KIT-ORG-PEI | 3D printer |
| Oxygen, Compressed | Linde Canada Inc. | Oxygen | |
| PrecisionGlide Needle 30 G x 1/2 (0.3 mm x 13 mm) | Becton, Dickinson and Company | 305106 | 30 G needle |
| Pyrex 5340-2L 5340 Filtering Flasks, 2000 mL | Cole-Parmer Canada Company | 5340-2L | Vacuum flask |
| Rhodamine 6 G | Sigma-Aldrich | 252433 | Rhodamine 6G |
| Secure Soft Cloth Medical Tape - 3" | Primed | PM5-630709 | Cloth tape |
| Silastic Medical Grade Tubing .040 in. ID x .085 in. OD | Dow Corning | 602-205 | 1.0 mm I.D. polyethylene tubing |
| Somnosuite Low-Flow Anesthesia System | Kent Scientific Corporation | SS-01, SS-04-module | Small rodent ventilator, Low-flow anesthesia system, Heating pad, Rectal temperature probe, Pulse oximeter |
| Tissue Forceps, 12.5cm long, Curved, 1 x 2 Teeth | World Precision Instruments | 501216 | Toothed forceps |
| Transpore Medical Tape, 1527-1, 1 in x 10 yd (2.5 cm x 9.1 m) | 3M | 7000002795 | Medical tape |
| Tubing,Clear,3/8 in Inside Dia. | Grainger Canada | USSZUSA-HT3314 | 1.0 cm I.D. polyethylene tubing |
| Whatman 6720-5002 50 mm In-Line Filters, PTFE, 0.2 µm | Cole-Parmer Canada Company | 6720-5002 | Inline 0.2µm filter |
参考文献
- Alizadeh-Tabrizi, N., Hall, S., Lehmann, C. Intravital imaging of pulmonary immune response in inflammation and infection. Frontiers in Cell and Developmental Biology. 8, 620471 (2021).
- Gaertner, M., et al. Toward a comprehensive interpretation of intravital microscopy images in studies of lung tissue dynamics. Journal of Biomedical Optics. 20 (6), 066009 (2015).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Looney, M., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature Methods. 8 (2), 91-96 (2011).
- Bennewitz, M. F., Watkins, S. C., Sundda, P. Quantitative intravital two-photon excitation microscopy reveals absence of pulmonary vasoocclusion in unchallenged sickle cell disease mice. IntraVital. 3 (2), 29748 (2014).
- Blueschke, G., et al. Automated measurement of microcirculatory blood flow velocity in pulmonary metastases of rats. Journal of Visualized Experiments: JoVE. (93), e51630 (2014).
- Tabuchi, A., et al. Precapillary oxygenation contributes relevantly to gas exchange in the intact lung. American Journal of Respiratory and Critical Care Medicine. 188 (4), 474-481 (2013).
- Rodriguez-Tirado, C., et al. Long-term high-resolution intravital microscopy in the lung with a vacuum stabilized imaging window. Journal of Visualized Experiments: JoVE. (116), e54603 (2016).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and Immunity. 82 (2), 864-872 (2014).
- Thanabalasuriar, A., Neupane, A. S., Wang, J., Krummel, M. F., Kubes, P. iNKT cell emigration out of the lung vasculature requires neutrophils and monocyte-derived dendritic cells in inflammation. Cell Reports. 16 (12), 3260-3272 (2016).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Tschernig, T., et al. Direct visualisation of microparticles in the living lung. Experimental and Toxicologic Pathology. 65 (6), 883-886 (2013).
- Mertens, M., et al. Alveolar dynamics in acute lung injury: Heterogeneous distension rather than cyclic opening and collapse. Critical Care Medicine. 37 (9), 2604-2611 (2009).
- Matuszak, J., Tabuchi, A., Kuebler, W. M. Ventilation and perfusion at the alveolar level: Insights from lung intravital microscopy. Frontiers in Physiology. 11, 291 (2020).
- Margraf, A., et al. 6% Hydroxyethyl starch (HES 130/0.4) diminishes glycocalyx degradation and decreases vascular permeability during systemic and pulmonary inflammation in mice. Critical Care. 22 (1), 1-12 (2018).
- Roller, J., et al. Direct in vivo observations of P-selectin glycoprotein ligand-1-mediated leukocyte-endothelial cell interactions in the pulmonary microvasculature in abdominal sepsis in mice. Inflammation Research. 62 (3), 275-282 (2012).
- Marques, P., et al. Cigarette smoke increases endothelial CXCL16-leukocyte CXCR6 adhesion in vitro and in vivo. Potential consequences in chronic obstructive pulmonary disease. Frontiers in Immunology. 8, 1766 (2017).
- Condon, M. R., Kim, J. E., Deitch, E. A., Machiedo, G. W., Spolarics, Z. Appearance of an erythrocyte population with decreased deformability and hemoglobin content following sepsis. American Journal of Physiology-Heart and Circulatory Physiology. 284 (6), 2177-2184 (2003).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: Relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Kim, Y. M., Jeong, S., Choe, Y. H., Hyun, Y. M. Two-photon intravital imaging of leukocyte migration during inflammation in the respiratory system. Acute and Critical Care. 34 (2), 101-107 (2019).
- Faust, N., Varas, F., Kelly, L. M., Heck, S., Graf, T. Insertion of enhanced green fluorescent protein into the lysozyme gene creates mice with green fluorescent granulocytes and macrophages. Blood. 96 (2), 719-726 (2000).
- Orthgiess, J., et al. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. European Journal of Immunology. 46 (6), 1529-1532 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Butt, Y., Kurdowska, A., Allen, T. C. Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine. 140 (4), 345-350 (2016).
- Park, I., et al. Neutrophils disturb pulmonary microcirculation in sepsis-induced acute lung injury. European Respiratory Journal. 53 (3), 1800786 (2019).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American Journal of Respiratory Cell and Molecular Biology. 47 (6), 864-868 (2012).
- Pieper, M., Schulz-Hildebrandt, H., Mall, M. A., Hüttmann, G., König, P. Intravital microscopic optical coherence tomography imaging to assess mucus-mobilizing interventions for muco-obstructive lung disease in mice. American Journal of Physiology - Lung Cellular and Molecular Physiology. 318 (3), 518-524 (2020).
- Lamm, W. J. E., Bernard, S. L., Wiltz, W., Wagner, J., Glenny, R. W. Intravital microscopic observations of 15-µm microspheres lodging in the pulmonary microcirculation. Journal of Applied Physiology. 98 (6), 2242-2248 (2005).
- Entenberg, D., et al. A permanent window for the murine lung enables high-resolution imaging of cancer metastasis. Nature Methods. 15 (1), 73-80 (2018).
- Amato, M. B. P., et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. New England Journal of Medicine. 338 (6), 347-354 (2009).
- Looney, M. R., Bhattacharya, J. Live imaging of the lung. Annual Review of Physiology. 76, 431-445 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。