Method Article
真空安定化イメージングシステムを用いた実験的急性肺損傷における肺微小循環の生体内広視野蛍光顕微鏡
要約
生体内蛍光顕微鏡は、白血球 - 内皮相互作用および毛細血管灌流をリアルタイムで研究するために利用することができる。このプロトコルは、真空安定化肺画像化システムを使用して肺微小循環におけるこれらのパラメータを画像化および定量化する方法を記載する。
要約
白血球-内皮相互作用の生体内イメージングは、生きた動物における免疫媒介性疾患に関する貴重な洞察を提供する。急性肺損傷(ALI)/急性呼吸窮迫症候群(ARDS)および他の呼吸器病変の インビボでの 研究は、肺のアクセスが限られており、固有の運動アーチファクトのために困難である。しかし、これらの課題を克服するために、様々なアプローチが開発されてきた。このプロトコールは、ALIの実験モデルにおいて肺微小循環におけるリアルタイムの白血球 - 内皮相互作用を研究するための生体内蛍光顕微鏡法の方法を記載している。 in vivo 肺イメージングシステムと3Dプリントされた生体内顕微鏡プラットフォームを使用して、麻酔をかけられたマウスを固定し、肺の交絡損傷を最小限に抑えながら肺を安定させます。調製後、広視野蛍光顕微鏡を用いて、白血球接着、白血球圧延、毛細血管機能を研究する。ここで提示されるプロトコルは、炎症性肺疾患の急性モデルにおける画像化に焦点を当てているが、肺における他の病理学的および生理学的プロセスを研究するためにも適合され得る。
概要
インバイタル顕微鏡(IVM)は、生体内のさまざまな生物物理学的プロセスを視覚化および研究するための有用なイメージングツールです。肺は、その囲まれた位置、その組織の脆弱な性質、および呼吸および心拍によって誘発される運動アーチファクトのために、インビボで画像化することは非常に困難である1,2。これらの課題を克服するために、肺微小循環における白血球-内皮相互作用のリアルタイムイメージングのために、さまざまな生体内顕微鏡(IVM)セットアップが開発されています。このようなアプローチは、画像化のために肺を外科的に露出させ、安定化させることに基づいている。
動物は、典型的には、外科的処置によって肺IVMのために調製される。まず、動物を挿管して換気し、胸部窓の外科的切除とその後の介入を可能にして、画像化のために肺を安定させる。1つの技法は、実質をガラスカバースリップ3に接着することを含み、これは、画像化された組織に重大な物理的外傷のリスクを冒す手順である。より高度なのは、ガラス窓4の下で肺を安定させるための真空システムの利用である。このセットアップは、広い局所領域に広がる可逆的真空を介して肺表面のカバースリップへの緩やかな接着を容易にし、x、y、およびz寸法4での動きを制限しながら肺を膨張させる。真空は、セットアップの撮像領域を囲むチャネルを介して均等に適用され、組織を撮像グレードのカバースリップ4に面した浅い円錐形領域に引き込む。この覗き窓を通して、肺微小循環は、様々な光学画像化モダリティを用いて研究することができる。
肺IVMは、多数の微小循環パラメータの定量的イメージングを可能にします。これらには、白血球トラック速度および長さ5、赤血球流速6および酸素化7、腫瘍転移8、免疫細胞亜集団9、10、11の区別、微粒子12の可視化、肺胞動態13、14、血管透過性15、および毛細血管機能16などの測定が含まれる。.ここでの焦点は、白血球の動員と毛細血管機能にあります。肺微小循環における白血球動員の開始は、白血球と内皮細胞との間の一過性の転がり相互作用および強固な接着相互作用を伴い、どちらも炎症条件下で増加する16,17。典型的には、圧延は、オペレータ定義の基準線を通過する白血球の数によって定量化され、一方、接着は、内皮16上で不動である白血球の数によって定量化される。毛細血管機能はまた、炎症状態において影響を受ける可能性があり、しばしば灌流の減少をもたらす。これは、赤血球変形能の低下18および病理学的シャント19をもたらす内皮細胞による誘導性NO合成酵素の多彩な発現を含むいくつかの要因に起因し得る。典型的には、面積当たりの灌流毛細血管の凝集体長が測定され、機能的毛細血管密度(FCD)として報告される。
肺における白血球動員をリアルタイムで研究するには、蛍光色素または蛍光標識抗体20で生物学的標的を標識する必要がある。あるいは、リゾチームM−green蛍光タンパク質(LysM−GFP)マウスなどの様々なトランスジェニックマウス系統を利用して、好中球21、22などの特異的免疫細胞サブセットを画像化することができる。蛍光標識された白血球は、次いで、広視野蛍光顕微鏡、共焦点顕微鏡、または多光子顕微鏡を用いて可視化することができる。これらの技術は、特定の励起波長を利用し、放出された蛍光を検出すると同時に、励起波長の検出を遮断することによってコントラストを達成し、標識された物体を強調する。
マウス肺における白血球の転がり、接着、および機能的毛細血管密度の定量化に関する既存の研究は、主に手動ビデオ分析に依存してきた。これは、Fiji 6,23などのオープンソースソフトウェア、CapImage12などの独自のソフトウェア、またはカスタムメイドの画像処理システム24によって可能になります。逆に、様々なプロプライエタリなソフトウェアプラットフォーム(例えば、NIS Element、Imaris、Volocity、MetaMorph)は、ここで以前に言及したものの多くを含む、広範囲の他の生理学的パラメータの自動測定を可能にする5、6、7、8、9、10、11、12、13、15。
肺IVMを用いた急性肺損傷(ALI)および急性呼吸窮迫症候群(ARDS)の病理に関して重要な観察がなされている。ARDSは、肺水腫および肺胞障害を含む肺における多数の病態生理学的プロセスによって特徴付けられる、内皮および上皮障壁25の機能不全によって引き起こされる。マウスモデルを用いて、敗血症誘発性ALIが肺環境における免疫細胞輸送における有意な有害な変化と関連していることが見出された26。敗血症誘発性ALIを有するマウスの毛細血管に動員された好中球は、微小循環を妨害し、それによってALI26における低酸素症を増加させることが見出された。さらに、IVMは、ARDS27の発症後の修復の根底にあるメカニズムについての洞察を得るために使用されている。肺IVMはまた、様々な閉塞性肺疾患における病態生理学的変化を理解する上で貴重なツールとなっている。例えば、嚢胞性線維症(CF)および慢性閉塞性肺疾患(COPD)などの疾患における粘液輸送の可視化は、粘液クリアランスに対する新規および既存の治療法の研究を促進している28。これらの条件下での白血球の密売も分析されている17.
このプロトコールは、Lammら29 によって最初に記載されたアプローチを拡張し、従来の蛍光顕微鏡を用いて白血球-内皮相互作用を研究する。説明されている手順は、16.5 cm x 12.7 cmの金属ベース、マイクロマニピュレータ、および真空イメージングウィンドウを含む in vivo 肺イメージングシステムを採用しています(図1)。このシステムは、20 cm x 23.5 cm の3Dプリントプラットフォーム(補足ファイル1)に取り付けられ、換気チューブと加熱パッドにしっかりと取り付けることができます。この方法は、 インビボでのマウス肺微小循環の再現性および定量化可能なイメージングを提供する。外科的準備の重要な側面、ならびに真空安定化肺画像化システムの適切な利用について詳細に説明される。最後に、ALIの実験モデルを用いて、炎症に関連する変化した白血球転がり、白血球接着、および毛細血管灌流の代表的な画像化および分析を提供する。このプロトコールの使用は、急性疾患状態における肺微小循環の病態生理学的変化に関するさらなる重要な調査を容易にするはずである。
プロトコル
ここで説明するすべての手順は、ダルハウジー大学実験動物委員会(UCLA)の事前承認を得て実施されました。
1. 準備
- 肺イメージングシステム:窓を準備するには、真空チャンネルの汚染を避けながら、外輪の上部に真空グリースの薄い層を投与します。清潔な8 mmガラスのカバースリップを窓の上に置き、静かに押し下げてシールを作成します。
- 広視野蛍光顕微鏡:20x/0.40の長い作動距離対物レンズと25FPSの白黒電荷結合素子(CCD)カメラを備えた従来の広視野蛍光顕微鏡でイメージングを行います。530-550 nmのバンドパス励起フィルタを適用してRhodamine-6Gを励起し、460-490 nmのバンドパスフィルタを適用してフルオレセインイソチオシアネート(FITC)を励起します。
- 真空システム: 補足図1に示すように、50-60mmHgの一定の吸引を提供できるデジタル圧力計を備えた真空ポンプにイメージングウィンドウを接続します。要するに、1.0 mm の内径ポリエチレンチューブ、1.0 cm の内径ポリエチレンチューブ、真空フラスコ、およびインライン 0.2 μm フィルターを介してイメージングウィンドウをポンプに接続します。
- 人工呼吸器:マウスの体重に基づいて計算された速度と体積で圧力制御換気を提供するために、小さなげっ歯類人工呼吸器を設定します。実験期間中、5 cmH2O で正の呼気終末圧力 (PEEP) を提供し、目標圧力を 20 cmH2O に設定します。
- 麻酔薬:低流量麻酔送達システムを使用して、5.0mLシリンジに99.9%イソフルランを注油する。廃ガス捕捉システムを使用して、外科医による吸入のリスクを最小限に抑えます。
2.麻酔
- 20〜25gの12週齢の雄性C57Bl/6マウスを麻酔誘導チャンバーに入れる。チャンバーをしっかりと閉じた状態で、3%の濃度および500mL/minの流量のイソフルランガスで誘導を開始します。
- マウスを麻酔をかけたら(呼吸速度が遅くなったことで視覚化)、挿管スタンドに移し、上部切歯を吊り下げた縫合糸に固定します。
- 縫合糸を締めて鼻錐の内側に鼻を固定します。2.5%の濃度でノーズコーンを通るガスの流れを開始します。
- 次のステップに進む前に、つま先のピンチで麻酔の適切な深さを確認してください。
3. 挿管
- スタンドの背面とマウスの背側が外科医の方を向くようにスタンドを回転させます。
- 長さ20cmの光ファイバーケーブルの先端を20Gの気管内カニューレに通し、先端をリドカインHCl(1%)に沈めて、喉頭を通るケーブルの通過を容易にします。
- 鈍い鉗子を使用して、下顎を持ち上げ、舌を置換して気道への明確な通過を提供します。
- 上部切歯が鏡の隙間に収まるように修正された耳鏡(鏡面円周の〜60°が取り除かれた)を挿入します。喉頭蓋がはっきりと見えるまでスコープと舌の位置を調整します。
- 気管内カニューレを装填した光ファイバーケーブルを鏡面の隙間から喉頭に挿入します。小さな円形の動きを使用して、ケーブルを声帯と気管に通します。
- カニューレを光ファイバーケーブルに沿って押し、声帯の間を通って気管に入ります。
4. 換気
- 挿管スタンドからマウスを取り出し、右側の横褥瘡位置にある加熱パッドに置きます。
- カニューレを人工呼吸器チューブに接続し、人工呼吸器を起動します。麻酔薬濃度を1.5%に下げ、ペダル反射をテストして深さを監視します。反射が続く場合は、濃度を徐々に上げて2%まで高めます。
- 乾燥を防ぐために、マウスの目に涙液を置きます。
- 医療用テープを使用して、カニューレを鼻に固定します。ラベリングテープを使用して、右前足を加熱パッドに約9時の位置に固定します。左後足を尾側に伸ばし、およそ6時の位置で固定します。
- 布テープを使用して、左前足を12時位置まで軽く伸ばし、テープのもう一方の端を 図2Aに示すようにIVMプラットフォームの上部に固定します(ここでわずかな張力を維持すると、その後の開胸術が容易になります)。
- 直腸温度プローブを挿入し、加熱パッドにテーピングしてプローブを固定します。パルスオキシメーターを右後足に置き、循環を乱さないように注意しながら加熱パッドに固定します。
- 温度が37.0°C±0.1°Cで安定したら、開胸術に進みます。
5.胸部切除術
- 胸郭と腹部を70%アルコールワイプで滅菌します。ミネラルオイルの軽いコートを塗って、胸骨から椎骨柱まで、そして肩から胸郭の底まで、マウスの左側の髪を湿らせます。
- 鈍い鉗子とまっすぐなはさみで、胸郭の底の近くに小さな縦方向の切開を行い、下にある筋肉層を露出させます。
- 腹側を移動し、鈍い郭清を使用して上皮および脂肪組織を筋肉層から分離する。露出した血管を焼灼する。失血のリスクが軽減されたら、元の切開を剣状突起まで腹側に延長する。
- このプロセスを、椎骨柱の横方向に約5mmまで背側で繰り返す。
- 頭蓋を動かし、鈍い解剖を使用して胸郭を露出させます。血行動態安定性を維持するために、露出した血管を焼灼する。
- 失血のリスクが軽減されたら、切開部を剣状突起から腋窩まで広げます。
- 切り込みの背側で、左耳より約1cm下になるまでこのプロセスを繰り返します。
- 止血鉗子を用いて、解剖した上皮および脂肪組織をつかみ、手術領域の透明な場所に置く(図2B)。
- 白血球の可視化のためにローダミン-6G(0.5mg/mL; 1.5mL/kg)の溶液を注入し、尾静脈を介した毛細血管灌流の可視化のためにウシFITCアルブミン(50mg/mL;1mL/kg)を注入する。
- 歯付き鉗子を使用して、エンドインスピレーションで肺の基部の位置のすぐ下の肋骨をつかみ、わずかに引っ込めて肋骨を肺から引き離します。肋骨を切って気胸を誘発する。
- 切開部を肋間筋に沿って両方向に横方向に伸ばし、露出した肺表面に触れないように注意してください。
- 鈍い鉗子を使用して、次に高い肋骨をつかみ、肺が胸壁から離れるようにわずかに引っ込めます。肺が外れない場合は、胸壁を肺に軽く押し付けて、肺が下の胸膜に付着し、より簡単に脱落させます。
- 胸骨まで腹側および肺の頂点が露出するまで頭蓋に元の切開を続ける。綿のアプリケーターとガーゼを使用して、発生する出血を減衰させます。
- 胸郭を上げて、胸腔の背側の側面に肋間血管を露出させる。肺を傷つけないように注意し、脊柱の近くにある最も劣った肋間血管を焼灼し、肋骨を切断する。頭蓋および腹側に移動し、胸郭の約1 cm x 1.5 cm部分が切除されるまで繰り返す(図2C)。
- ガーゼの小さなストリップを使用して毛細血管作用を介して胸腔内の余分な流体蓄積を除去します。
- 顕微鏡検査を進めている間、胸水が肺とイメージングウィンドウの間のより安全な界面のために散逸するまで約5分間待ちます。
6. 顕微鏡検査
- 真空ポンプの電源を入れ、圧力を約50~60mmHgに調整します。
- IVMプラットフォームを顕微鏡ステージに移します。金属製の支柱とマイクロマニピュレーターを、イメージングウィンドウが露出した肺の真上にあり、ウィンドウアームがおよそ3時の位置から肺に近づくように配置します。
- マイクロマニピュレータを使用して、肺表面に接着して安定するまで、イメージングウィンドウを慎重に下げます(図3A)。
- 20倍の対物レンズと460-490nmのバンドパス励起フィルターを使用して、血流の収束パターンに基づいて肺静脈を特定します。容器を視野の中央に配置し、30秒のビデオを録画します。
- 530-550nmのバンドパス励起フィルタに切り替えて、同じ視野に30秒のビデオを録画します。
- 5つの肺静脈が画像化されるまで、前の手順を繰り返します。
- 460-490nmバンドパス励起フィルターを使用して、血流の発散パターンに基づいて肺細動脈を同定する。容器を視野の中央に配置し、30秒のビデオを録画します。
- 530-550nmのバンドパス励起フィルタに切り替えて、同じ視野に30秒のビデオを録画します。
- 5つの肺細動脈が画像化されるまで、前のステップを繰り返します。
- 460~490nmのバンドパス励起フィルターを使用して、より大きな血管と交差していない肺胞と毛細血管の領域を特定し、30秒のビデオを記録します。
- 530-550nmのバンドパス励起フィルタに切り替えて、同じ視野に30秒のビデオを録画します。
- 5つの毛細血管領域が画像化されるまで、前の手順を繰り返します。
7. 安楽死と清掃プロトコル
- 顕微鏡ステージからIVMプラットフォームを取り外し、イソフルラン送達を5分間5%に調整してマウスを安楽死させた。
- 待機中は、カバーガラスを捨て、イメージングウィンドウをプラットフォームから外します。小さなブラシでイメージングウィンドウを清掃し、チャネルに挿入された30Gシリンジを使用して、蒸留水で数回フラッシュします。次いで、真空ポンプを用いて95%エタノールでフラッシュする。
- 5分が経過したら、人工呼吸器を停止し、子宮頸部脱臼による完全な安楽死を確実にする。
結果
このプロトコールを通じて達成可能な結果を例示するために、急性肺損傷(ALI)は、鼻腔内細菌性リポ多糖(LPS)点眼のモデルを用いた画像化の6時間前に誘導された。簡単に言えば、マウス(n = 3)をイソフルランで麻酔し、滅菌生理食塩水(10mg / mL)中の 緑膿菌 からのLPSの小さな液滴を5mg / kgの用量で左ナリスにピペットで移した。これをナイーブマウスと比較した(n=3;鼻腔内投与なし)。
画像化により、成功した外科的準備は、いくつかの要因によって識別可能である。肺は比較的安定で、呼吸は25μm以下の周期的なフレームシフトを引き起こすはずです。肺胞ははっきりと見えるはずであり、潮汐膨張/収縮を示すことがある。青色光(波長450~490nm)による励起により、血流の方向性を可視化でき、個々の赤血球を区別できる可能性があります(補足動画1、補足動画3、補足動画5)。白血球は緑色光(波長530~560nm、補足動画2、補足動画4、補足動画6)で励起すると明瞭に識別できます。画像化の完了および吸引窓の除去後、図3Bに示すように、画像化された領域内にはないが、肺表面のわずかな打撲傷がある可能性がある。
いくつかの技術的課題が実験の実行可能性を妨げる可能性がある。肺表面への血液の蓄積は、真空の安定化を損ない、チャネルを詰まらせることさえあります。これを避けるために、各外科的ステップの間に細心の注意が払われるべきである。真空圧力が過度に高いと、肺が損傷し、微小循環に影響を与える可能性があります。これは、肺胞の停滞または肺表面の過度の打撲傷(図3C)によって識別可能であり、真空ポンプからの減圧によって改善することができる。同様に、静脈内蛍光色素分子注射の誤りは、白血球の輸送および血流の視覚化不良につながる可能性があります。
プロトコールの完了に続いて、盲検化された手動分析を、以前の文献28 から適合した様式でフィジー21を用いて実施した。5つの小静脈、細動脈、および毛細血管関心領域(ROI)を各動物から分析した。小静脈および細動脈における白血球接着は、内皮表面の面積当たりの30秒間の観察の間に血管内皮に接着したままの細胞数として定義した。これはセル/mm2で中継されます。毛細血管における白血球接着は、全分析領域当たりの30秒間の観察の間に血管内皮に接着したままのROI内の細胞の数として定義した。これもセル/mm2で中継されます。白血球圧延は、30秒の観察期間中に容器内の基準点を通過する細胞数の2倍と定義した。自由流動性の白血球は、通過速度を赤血球の流れの速度と比較することによって除外され、これは細胞/分で中継される。微小循環灌流を測定するために、FCDは、観察領域当たりの赤血球灌流毛細血管の長さの合計として定義した。これはcm/cm2で中継されます。各パラメータは、各動物の平均値として報告されます。
肺静脈では、LPS処理マウスではナイーブマウスと比較して接着および転がりが増加し、白血球動員の一般的な傾向が観察された(図4C、D)。この傾向は、動脈白血球接着によって再現されたが、圧延および接着の両方のレベルは、ナイーブ群において非常に可変であった(図5C、D)。注目すべきことに、LPS投与は、肺毛細血管ROIにおける白血球接着の実質的な増加をもたらした(図6C)。LPSマウスはまた、ナイーブマウスと比較してFCDの減少を実証した(図7C)。肺毛細血管内のこれらの効果は、様々な炎症刺激に続く正常な毛細血管灌流の視野当たりの免疫細胞の増加および狂乱を同定する以前の文献4、5、16と一致する。

図1:肺イメージングシステム カスタムオーダーシステムは、(1)陽極酸化金属ベース、(2)イメージングウィンドウ、(3)真空入口、(4)マイクロマニピュレータを含む。 この図の拡大版を表示するには、ここをクリックしてください。

図2:外科的準備。 (A)マウスは、右側方褥瘡位置でIVMプラットフォームに固定される。(B)リブケージは、血行動態を保存するために鈍的解剖を用いて露出する。(c)左肺を露出させるために開胸術を行う。 この図の拡大版を表示するには、ここをクリックしてください。
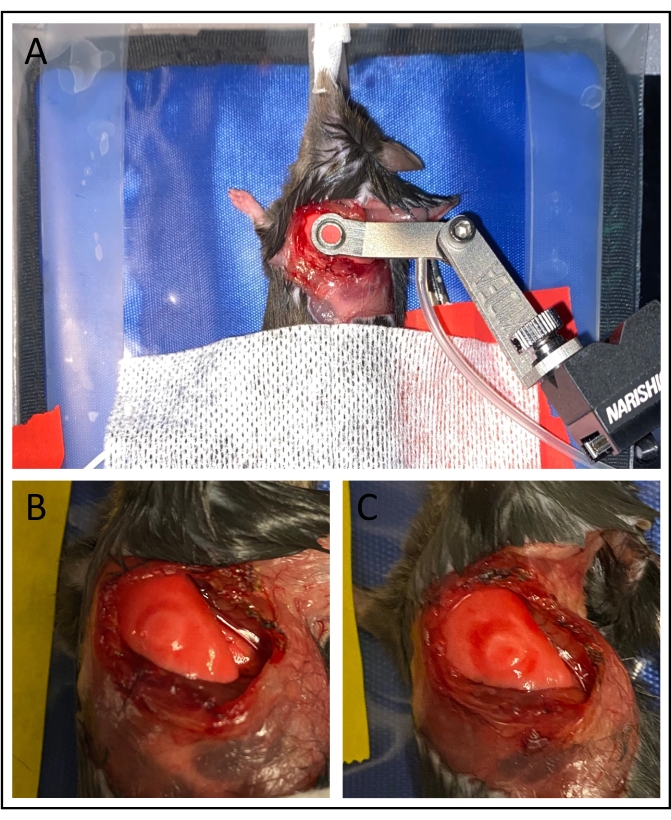
図3:真空安定化。 (A)真空イメージングウィンドウを適用すると肺表面が安定します。(B)75mmHg未満の真空圧力を利用すると、特に画像化された領域内での肺への損傷が最小限に抑えられる。(C)真空圧力が高いと、著しい打撲傷を引き起こす可能性がある。 この図の拡大版を表示するには、ここをクリックしてください。
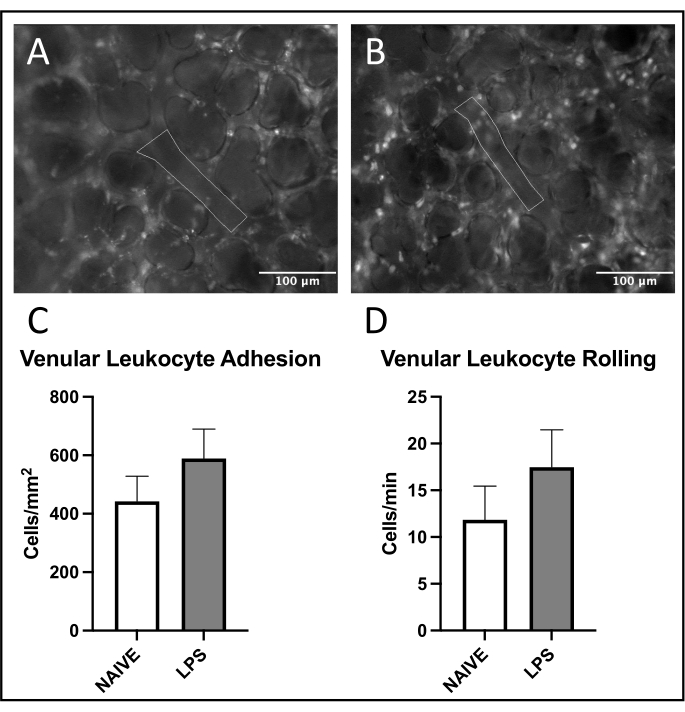
図4:肺細静脈における白血球の密売 ローダミン6Gの励起は、付着性および転動白血球の可視化を可能にする。概説された領域は、(A)ナイーブおよび(B)LPS処置マウスにおけるFITC−アルブミンの興奮によって確認された血管内皮の分析された部分を表す。(C、D)鼻腔内LPS投与は、肺静脈における白血球の転がりおよび接着に影響を及ぼす。値は SD の平均値として示され±います 。この図の拡大版を表示するには、ここをクリックしてください。
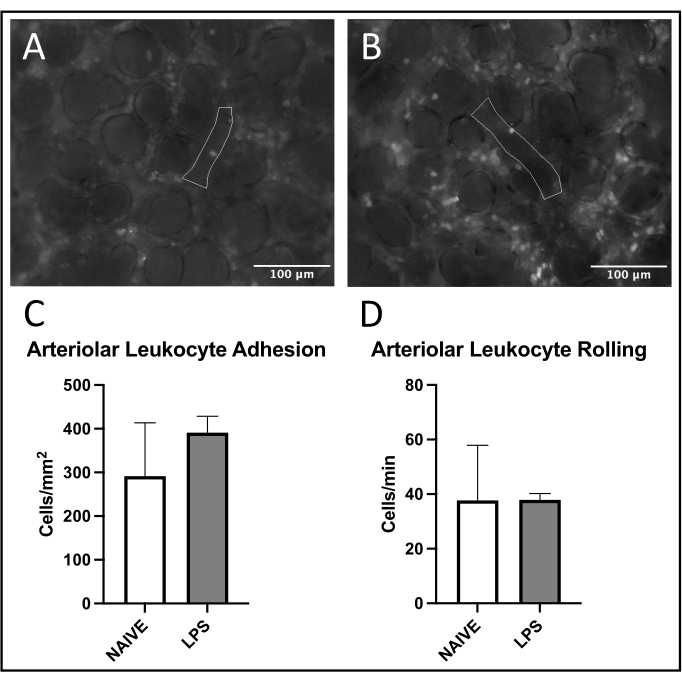
図5:肺細動脈における白血球の密売。 ローダミン6Gの励起は、付着性および転動白血球の可視化を可能にする。概説された領域は、(A)ナイーブおよび(B)LPS処置マウスにおけるFITC−アルブミンの興奮によって確認された血管内皮の分析された部分を表す。(C、D)鼻腔内LPS投与は、肺細動脈における白血球転動および接着に影響を及ぼす。値は SD の平均値として示され±います 。この図の拡大版を表示するには、ここをクリックしてください。

図6:肺毛細血管における付着性白血球。 ローダミン6Gの励起は、(A)ナイーブおよび(B)LPS処理マウスにおけるROI内の白血球の可視化を可能にする。(c)LPSの鼻腔内投与は、LPS処置マウスにおける白血球接着に影響を及ぼす。値は SD の平均値として示され±います 。この図の拡大版を表示するには、ここをクリックしてください。
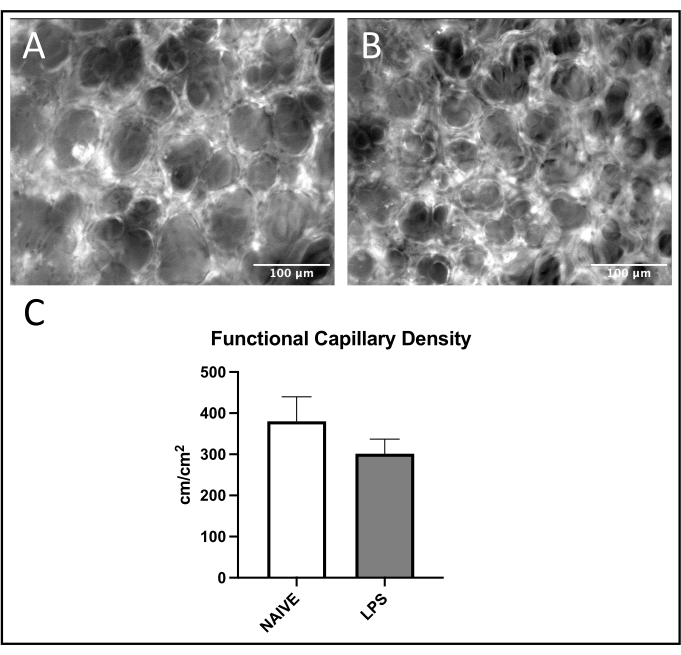
図7:肺毛細血管機能 FITC−アルブミンの励起は、(A)ナイーブおよび(B)LPS処置マウスにおけるROI内の毛細血管血流の視覚化を可能にする。(C)鼻腔内LPS投与は、肺毛細血管におけるFCDに影響を及ぼす。値は SD の平均値として示され±います 。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル: 3D 印刷可能な IVM プラットフォーム用のファイル。このファイルをダウンロードするには、ここをクリックしてください。
補足図1:真空システムの図。このファイルをダウンロードするには、ここをクリックしてください。
補足ムービー1:肺静脈内の血流のサンプルビデオ。 緑色の矢印は血流の方向を示す。 この映画をダウンロードするには、ここをクリックしてください。
補足ムービー2:肺静脈における白血球の密売のサンプルビデオ。 赤い矢印は、血管内の付着性白血球を示す。 この映画をダウンロードするには、ここをクリックしてください。
補足動画3:肺細動脈の血流のサンプル映像。 緑色の矢印は血流の方向を示す。 この映画をダウンロードするには、ここをクリックしてください。
補足ムービー4:肺細動脈における白血球密売のサンプルビデオ。 赤い矢印は、血管内の付着性白血球を示す。 この映画をダウンロードするには、ここをクリックしてください。
補足ムービー5:肺毛細血管の血流のサンプルビデオ。 緑色の矢印は、赤血球灌流毛細血管のいくつかのよく視覚化された領域を示す。 この映画をダウンロードするには、ここをクリックしてください。
補足ムービー6:肺毛細血管における白血球密売のサンプルビデオ。 赤い矢印は、視野内の付着性白血球を示す。 この映画をダウンロードするには、ここをクリックしてください。
ディスカッション
ここで紹介するプロトコルでは、いくつかの重要なステップに練習と注意が必要です。まず、挿管や手術を開始する前にイメージングウィンドウを準備することが重要です。最小限の量の真空グリースを使用して、イメージングウィンドウの外輪をコーティングし、カバーガラスを塗布し、蒸留水1滴で吸引をテストします。これを事前に準備しておくと、そうでなければセットアップ中に露出した肺が乾燥するのを防ぐことができます。温かい生理食塩水で洗い流すことは可能ですが、そうすることで壊れやすい肺組織を損傷する危険性があります。
挿管後、マウスをIVMプラットフォームに移すと、カニューレが時折変位することがある。これを防ぐには、カニューレをマウスの前歯に縛るか、口の周りの皮膚に縫合することを検討してください。圧力制御換気を使用する場合は、手順全体を通して一回換気量を注意深く監視する必要があります。有意に低い値(例えば、〜0.10mL)が単一肺換気を示す可能性があるため、約0.20mLで安定しているべきである。このような場合は、気管内カニューレをわずかに引っ込めることで問題が解決する場合があります。吸入麻酔(イソフルラン)の使用は、マウスが換気されている間の麻酔薬の深さの制御を容易にする。麻酔の他の手段(例えば、静脈内ケタミン/キシラジン10,11)は、他の研究室によって採用されており、それぞれがそれぞれの長所と短所を有する。
手術中は、血管を切断するリスクを最小限に抑えるために鈍的解剖が使用されます。これは、肩の近くの厚くて血管新生脂肪組織を解剖するときに特に重要です。胸郭の切除には、速度と精度の両方が必要です。焼灼器からの熱は、過度に使用すると肺を燃やすのに十分強いです。胸郭を切除するときは、肺と胸壁の間に空きスペースがあるはずです。肺が胸壁に付着している場合、胸郭の外側を軽く押さえると、根底にある頭頂胸膜への接着が促進されます。あるいは、鈍い針を使用して、肺と胸郭の間に少量の暖かい生理食塩水を注入して、放出を容易にする。ウィンドウアームを3時の位置に配置すると、イメージング中にリブに不要な圧力がかかるのを避けることをお勧めします(図3A)。また、マイクロマニピュレータと顕微鏡対物レンズの間により多くのクリアランスが残され、操作のためのアクセスが容易になります。画像化窓を下げるときは、縁部との接触が画像化中に不適切なシールおよび過剰な運動アーチファクトをもたらすので、肺の中央領域を標的にすることが重要です。また、窓を下げようとする試みが複数回行われると、肺が損傷する可能性があります。同様に、剥離と再安定化のサイクルは肺損傷に寄与し、実験精度を損なう可能性があります。しかし、正しく実行すれば、ここで紹介する準備は十分に安定しており、20倍の対物レンズで高解像度の生体内イメージングが可能です。
イメージングウィンドウ内の真空チャネルの汚染や閉塞を防ぐためには、厳格な洗浄プロトコルが必要です。実験の直後に30G針を使用して蒸留水を繰り返し洗い流すことは、ほとんどの汚染物質を除去するのに効果的です。これに続いて、濃縮エタノールでフラッシュし、蒸留水で最後にフラッシュしてから、真空ラインに再取り付けして水分を除去します。アセトンまたは強力な洗剤を使用すると、深刻な閉塞が発生した場合に解決するのに十分かもしれません。
特に、このプロトコルは、他のいくつかの報告された方法4,11と比較して真空圧力のより高い読み出しを採用しており、これは肺組織への損傷の懸念を生じさせる可能性がある。しかし、重要な違いは、ここで使用されているデジタルゲージが真空ポンプでのみ圧力を測定することです。この圧力は、肺のより大きな表面積にわたって分布する前に、狭いチューブおよび画像窓自体の非常に狭いチャネルを介して送達される。そのため、画像化された領域への損傷の証拠は、生命内セッション後のこれらの実験では観察されなかった。さらに、画像化された肺胞は潮汐膨張および収縮を示し、この生理現象が有意に破壊されなかったことを示している。
インビボで疾患を研究するためのツールとしての肺IVMの人気が高まっているにもかかわらず、この技術には限界がある。第一に、手術の侵襲的および終末的な性質は、マウスの生理学的状態に無視できない影響を誘発し、手順を単一の画像化セッションに制限する。しかしながら、いくつかの縦肺IVMアプローチが開発されていることに留意すべきである30。第2に、機械的換気の使用は、ある程度の人工呼吸器関連肺損傷(VALI)31を誘発し得るが、これは処置の短い持続時間によって制限される。第三に、内臓胸膜とガラスカバースリップとの接触および真空圧力の印加は、微小血管血流の変化をもたらし得る。最後に、おそらくこのアプローチの最も重要な制限は、画像化が、肺32全体を代表していない非依存性肺領域における胸膜下肺胞に限定されることである。
要約すると、このプロトコルは、肺内蛍光顕微鏡を用いて肺微小血管系における白血球-内皮相互作用を研究するために使用することができる。これらの実験は、以前の研究に基づいて選択された急性モデルであるエンドトキシン誘発肺損傷を使用するが、このプロトコルは、肺における他の病理学的および生理学的プロセスを研究するためにも適合され得る。さらに、ここで採用されている肺イメージングシステムは、さまざまな顕微鏡アプローチに適用可能であり、イメージングウィンドウは、高い開口数油浸目標を収容するのに十分な大きさである。したがって、記載された手順は、肺微小循環に対する様々な疾患状態の影響に関するさらなる研究を容易にするはずである。
開示事項
Kamala D. Patel博士は、この実験で使用されたイメージングウィンドウが購入されたLuxideaの社長兼共同設立者です。
謝辞
著者らは、この原稿の編集と改訂において重要な専門知識を提供してくれたピナ・コラルッソ博士に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL BD Luer Slip Tip Syringe sterile, single use | Becton, Dickinson and Company | 309659 | 1 mL syringe |
| ADSON Dressing Forceps, Tip width 0.6 mm, teeth length 11.5 mm, 12 cm | RWD Life Science Co. | F12002-12 | Blunt forceps |
| Albumin-Fluorescein Isothiocyanate | Sigma-Aldrich | A9771-1G | FITC-albumin |
| Alcohol Swab Isopropyl Alcohol 70% v/v | Canadian Custom Packaging Company | 80002455 | Alcohol wipe |
| AVDC110 Advanced Digital Video Converter | Canopus | 00631069602029 | Digital video converter |
| B/W - CCD - Camera | Horn Imaging | BC-71 | Camera |
| Bovie Deluxe High Temperature Cautery Kit | Fine Science Tools | 18010-00 | Cauterizer |
| C57BL/6 Mice | Charles River Laboratories International | C57BL/6NCrl | C57BL/6 Mice |
| Cotton Tipped Applicators | Puritan | 806-WC | Cotton applicator |
| CS-8R 8mm Round Glass Coverslip | Warner Instruments | 64-0701 | Glass coverslip |
| Digital Pressure Gauge | ITM Instruments Inc. | DG2551L0NAM02L0IM&V | Digital Pressure Gauge |
| Dr Mom Slimline Stainless LED Otoscope | Dr. Mom Otoscopes | 1001 | Otoscope |
| Ethyl Alchohol 95% Vol | Commercial Alcohols | P016EA95 | 95% ethanol |
| Fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | Scissors |
| Fisherbrand Colored Labeling Tape | Fisher Scientific | 1590110 | Labeling tape |
| Gast DOA-P704-AA High-Capacity Vacuum Pump | Cole-Parmer Canada Company | ZA-07061-40 | Vacuum pump |
| Hartman Hemostats | Fine Science Tools | 13003-10 | Hemostatic forceps |
| High Vacuum Grease | Dow Corning | DC976VF | Vacuum grease |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Isoflurane |
| LIDOcaine HCl Injection 1% 50 mg/5 mL | Teligent Canada | 0121AD01 | Lidocaine HCl 1% |
| Lung SurgiBoard | Luxidea, Inc. | IMCH-0001 | Designed for intravital microscopy of the lung |
| Mineral Oil | Teva Canada | 00485802 | Mineral oil |
| Mouse Endotracheal Intubation Kit | Kent Scientific Corporation | ETI-MSE | Intubation stand, anesthesia mask, 20 G endotracheal cannula, fibre optic cable |
| MST49 Fluorescence Microscope | Leica Microsystems | 10 450 022 | Fluorescence Microscope |
| N Plan L 20x/0.40 Long Working Distance Microscope Objective | Leica Microsystems | 566035 | 20x objective |
| Non-Woven Sponges 2" x 2" | AMD-Ritmed | A2101-CH | Gauze |
| Optixcare Eye Lube Plus | Aventix | 5914322 | Tear gel |
| Original Prusa i3 MK3S+ 3D Printer | Prusa Research | PRI-MK3S-KIT-ORG-PEI | 3D printer |
| Oxygen, Compressed | Linde Canada Inc. | Oxygen | |
| PrecisionGlide Needle 30 G x 1/2 (0.3 mm x 13 mm) | Becton, Dickinson and Company | 305106 | 30 G needle |
| Pyrex 5340-2L 5340 Filtering Flasks, 2000 mL | Cole-Parmer Canada Company | 5340-2L | Vacuum flask |
| Rhodamine 6 G | Sigma-Aldrich | 252433 | Rhodamine 6G |
| Secure Soft Cloth Medical Tape - 3" | Primed | PM5-630709 | Cloth tape |
| Silastic Medical Grade Tubing .040 in. ID x .085 in. OD | Dow Corning | 602-205 | 1.0 mm I.D. polyethylene tubing |
| Somnosuite Low-Flow Anesthesia System | Kent Scientific Corporation | SS-01, SS-04-module | Small rodent ventilator, Low-flow anesthesia system, Heating pad, Rectal temperature probe, Pulse oximeter |
| Tissue Forceps, 12.5cm long, Curved, 1 x 2 Teeth | World Precision Instruments | 501216 | Toothed forceps |
| Transpore Medical Tape, 1527-1, 1 in x 10 yd (2.5 cm x 9.1 m) | 3M | 7000002795 | Medical tape |
| Tubing,Clear,3/8 in Inside Dia. | Grainger Canada | USSZUSA-HT3314 | 1.0 cm I.D. polyethylene tubing |
| Whatman 6720-5002 50 mm In-Line Filters, PTFE, 0.2 µm | Cole-Parmer Canada Company | 6720-5002 | Inline 0.2µm filter |
参考文献
- Alizadeh-Tabrizi, N., Hall, S., Lehmann, C. Intravital imaging of pulmonary immune response in inflammation and infection. Frontiers in Cell and Developmental Biology. 8, 620471 (2021).
- Gaertner, M., et al. Toward a comprehensive interpretation of intravital microscopy images in studies of lung tissue dynamics. Journal of Biomedical Optics. 20 (6), 066009 (2015).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Looney, M., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature Methods. 8 (2), 91-96 (2011).
- Bennewitz, M. F., Watkins, S. C., Sundda, P. Quantitative intravital two-photon excitation microscopy reveals absence of pulmonary vasoocclusion in unchallenged sickle cell disease mice. IntraVital. 3 (2), 29748 (2014).
- Blueschke, G., et al. Automated measurement of microcirculatory blood flow velocity in pulmonary metastases of rats. Journal of Visualized Experiments: JoVE. (93), e51630 (2014).
- Tabuchi, A., et al. Precapillary oxygenation contributes relevantly to gas exchange in the intact lung. American Journal of Respiratory and Critical Care Medicine. 188 (4), 474-481 (2013).
- Rodriguez-Tirado, C., et al. Long-term high-resolution intravital microscopy in the lung with a vacuum stabilized imaging window. Journal of Visualized Experiments: JoVE. (116), e54603 (2016).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and Immunity. 82 (2), 864-872 (2014).
- Thanabalasuriar, A., Neupane, A. S., Wang, J., Krummel, M. F., Kubes, P. iNKT cell emigration out of the lung vasculature requires neutrophils and monocyte-derived dendritic cells in inflammation. Cell Reports. 16 (12), 3260-3272 (2016).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Tschernig, T., et al. Direct visualisation of microparticles in the living lung. Experimental and Toxicologic Pathology. 65 (6), 883-886 (2013).
- Mertens, M., et al. Alveolar dynamics in acute lung injury: Heterogeneous distension rather than cyclic opening and collapse. Critical Care Medicine. 37 (9), 2604-2611 (2009).
- Matuszak, J., Tabuchi, A., Kuebler, W. M. Ventilation and perfusion at the alveolar level: Insights from lung intravital microscopy. Frontiers in Physiology. 11, 291 (2020).
- Margraf, A., et al. 6% Hydroxyethyl starch (HES 130/0.4) diminishes glycocalyx degradation and decreases vascular permeability during systemic and pulmonary inflammation in mice. Critical Care. 22 (1), 1-12 (2018).
- Roller, J., et al. Direct in vivo observations of P-selectin glycoprotein ligand-1-mediated leukocyte-endothelial cell interactions in the pulmonary microvasculature in abdominal sepsis in mice. Inflammation Research. 62 (3), 275-282 (2012).
- Marques, P., et al. Cigarette smoke increases endothelial CXCL16-leukocyte CXCR6 adhesion in vitro and in vivo. Potential consequences in chronic obstructive pulmonary disease. Frontiers in Immunology. 8, 1766 (2017).
- Condon, M. R., Kim, J. E., Deitch, E. A., Machiedo, G. W., Spolarics, Z. Appearance of an erythrocyte population with decreased deformability and hemoglobin content following sepsis. American Journal of Physiology-Heart and Circulatory Physiology. 284 (6), 2177-2184 (2003).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: Relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Kim, Y. M., Jeong, S., Choe, Y. H., Hyun, Y. M. Two-photon intravital imaging of leukocyte migration during inflammation in the respiratory system. Acute and Critical Care. 34 (2), 101-107 (2019).
- Faust, N., Varas, F., Kelly, L. M., Heck, S., Graf, T. Insertion of enhanced green fluorescent protein into the lysozyme gene creates mice with green fluorescent granulocytes and macrophages. Blood. 96 (2), 719-726 (2000).
- Orthgiess, J., et al. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. European Journal of Immunology. 46 (6), 1529-1532 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Butt, Y., Kurdowska, A., Allen, T. C. Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine. 140 (4), 345-350 (2016).
- Park, I., et al. Neutrophils disturb pulmonary microcirculation in sepsis-induced acute lung injury. European Respiratory Journal. 53 (3), 1800786 (2019).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American Journal of Respiratory Cell and Molecular Biology. 47 (6), 864-868 (2012).
- Pieper, M., Schulz-Hildebrandt, H., Mall, M. A., Hüttmann, G., König, P. Intravital microscopic optical coherence tomography imaging to assess mucus-mobilizing interventions for muco-obstructive lung disease in mice. American Journal of Physiology - Lung Cellular and Molecular Physiology. 318 (3), 518-524 (2020).
- Lamm, W. J. E., Bernard, S. L., Wiltz, W., Wagner, J., Glenny, R. W. Intravital microscopic observations of 15-µm microspheres lodging in the pulmonary microcirculation. Journal of Applied Physiology. 98 (6), 2242-2248 (2005).
- Entenberg, D., et al. A permanent window for the murine lung enables high-resolution imaging of cancer metastasis. Nature Methods. 15 (1), 73-80 (2018).
- Amato, M. B. P., et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. New England Journal of Medicine. 338 (6), 347-354 (2009).
- Looney, M. R., Bhattacharya, J. Live imaging of the lung. Annual Review of Physiology. 76, 431-445 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved