Method Article
Microscopia a fluorescenza intravitale a campo largo della microcircolazione polmonare polmonare polmonare acuta sperimentale utilizzando un sistema di imaging stabilizzato sotto vuoto
In questo articolo
Riepilogo
La microscopia a fluorescenza intravitale può essere utilizzata per studiare le interazioni leucocita-endoteliali e la perfusione capillare in tempo reale. Questo protocollo descrive i metodi per visualizzare e quantificare questi parametri nel microcircolo polmonare utilizzando un sistema di imaging polmonare stabilizzato nel vuoto.
Abstract
L'imaging intravitale delle interazioni leucocita-endoteliali offre preziose informazioni sulla malattia immuno-mediata negli animali vivi. Lo studio della lesione polmonare acuta (ALI) / sindrome da distress respiratorio acuto (ARDS) e di altre patologie respiratorie in vivo è difficile a causa della limitata accessibilità e degli artefatti di movimento intrinseci dei polmoni. Tuttavia, sono stati sviluppati vari approcci per superare queste sfide. Questo protocollo descrive un metodo per la microscopia a fluorescenza intravitale per studiare in tempo reale le interazioni leucocita-endoteliale nella microcircolazione polmonare in un modello sperimentale di ALI. Un sistema di imaging polmonare in vivo e una piattaforma di microscopia intravitale stampata in 3D vengono utilizzati per proteggere il topo anestetizzato e stabilizzare il polmone riducendo al minimo le lesioni polmonari confondenti. Dopo la preparazione, la microscopia a fluorescenza a campo largo viene utilizzata per studiare l'adesione dei leucociti, il rotolamento dei leucociti e la funzione capillare. Mentre il protocollo qui presentato si concentra sull'imaging in un modello acuto di malattia polmonare infiammatoria, può anche essere adattato per studiare altri processi patologici e fisiologici nel polmone.
Introduzione
La microscopia intravitale (IVM) è un utile strumento di imaging per visualizzare e studiare vari processi biofisici in vivo. Il polmone è molto difficile da fotografare in vivo a causa della sua posizione chiusa, della natura fragile del suo tessuto e degli artefatti di movimento indotti dalla respirazione e dal battito cardiaco 1,2. Sono state sviluppate varie configurazioni di microscopia intravitale (IVM) per l'imaging in tempo reale delle interazioni leucocita-endoteliali nella microcircolazione polmonare per superare queste sfide. Tali approcci si basano sull'esposizione chirurgica e sulla stabilizzazione del polmone per l'imaging.
Gli animali sono in genere preparati per l'IVM polmonare mediante procedure chirurgiche. In primo luogo, gli animali vengono intubati e ventilati, il che consente l'escissione chirurgica di una finestra toracica e successivi interventi per stabilizzare il polmone per l'imaging. Una tecnica prevede l'incollaggio del parenchima su un coverslip3 di vetro, una procedura che rischia un trauma fisico significativo al tessuto ripreso. Più avanzato è l'utilizzo di un sistema di vuoto per stabilizzare il polmone sotto una finestra di vetro4. Questa configurazione facilita l'aderenza sciolta della superficie polmonare al coverslip tramite un vuoto reversibile distribuito su una vasta area locale ed espande il polmone limitando comunque il movimento nelle dimensioni x, y e z4. Il vuoto viene applicato uniformemente attraverso un canale che circonda l'area di imaging della configurazione e tira il tessuto in una regione conica poco profonda di fronte al coverslip4 di grado di imaging. Attraverso questa finestra di visualizzazione, la microcircolazione polmonare può essere studiata utilizzando varie modalità di imaging ottico.
Lung IVM consente l'imaging quantitativo di una moltitudine di parametri microcircolatori. Questi includono misurazioni come la velocità e la lunghezza della traccia leucocitaria5, la velocità del flusso dei globuli rossi6 e l'ossigenazione7, le metastasi tumorali8, la distinzione delle sottopopolazioni di cellule immunitarie 9,10,11, la visualizzazione delle microparticelle12, la dinamica alveolare 13,14, la permeabilità vascolare15 e la funzione capillare 16 . L'attenzione qui è sul reclutamento dei leucociti e sulla funzione capillare. L'inizio del reclutamento dei leucociti nella microcircolazione polmonare comporta interazioni transitorie di rotolamento e interazioni adesive solide tra leucociti e cellule endoteliali, entrambe aumentate in condizioni infiammatorie16,17. Tipicamente, il rotolamento è quantificato dal numero di leucociti che passano una linea di riferimento definita dall'operatore, mentre l'adesione è quantificata dal numero di leucociti che sono immobili sull'endotelio16. La funzione capillare può anche essere influenzata negli stati infiammatori, spesso con conseguente diminuzione della perfusione. Ciò può essere attribuito a diversi fattori, tra cui una riduzione della deformabilità dei globuli rossi18 e l'espressione variegata di NO sintasi inducibile da parte delle cellule endoteliali con conseguente smistamento patologico19. Tipicamente, la lunghezza aggregata dei capillari perfusi per area viene misurata e riportata come densità capillare funzionale (FCD).
Studiare il reclutamento dei leucociti nei polmoni in tempo reale richiede l'etichettatura di bersagli biologici con coloranti fluorescenti o anticorpi marcati fluorescenti20. In alternativa, vari ceppi di topo transgenico come i topi lysozyme M-green fluorescent protein (LysM-GFP) possono essere utilizzati per visualizzare specifici sottoinsiemi di cellule immunitarie come i neutrofili21,22. I leucociti marcati fluorescenti possono quindi essere visualizzati utilizzando la microscopia a fluorescenza a campo largo, la microscopia confocale o la microscopia multifotonica. Queste tecniche raggiungono il contrasto utilizzando specifiche lunghezze d'onda di eccitazione e rilevando la fluorescenza emessa, bloccando contemporaneamente il rilevamento della lunghezza d'onda di eccitazione, evidenziando così l'oggetto etichettato.
La ricerca esistente riguardante la quantificazione del rotolamento dei leucociti, l'adesione e la densità capillare funzionale nel polmone murino si è basata principalmente sull'analisi video manuale. Ciò è reso possibile da software open source come Fiji 6,23, software proprietario come CapImage12 o sistemi di elaborazione delle immagini personalizzati24. Al contrario, varie piattaforme software proprietarie (ad esempio, NIS Element, Imaris, Volocity, MetaMorph) consentono la misurazione automatizzata di una vasta gamma di altri parametri fisiologici, tra cui molti di quelli precedentemente menzionati qui 5,6,7,8,9,10,11,12,13,15.
Importanti osservazioni sono state fatte per quanto riguarda la patologia della lesione polmonare acuta (ALI) e della sindrome da distress respiratorio acuto (ARDS) utilizzando IVM polmonare. L'ARDS è caratterizzata da una serie di processi fisiopatologici nel polmone, tra cui edema polmonare e danno alveolare causato da disfunzione dell'endotelio e della barriera epiteliale25. Utilizzando un modello murino, è stato scoperto che l'ALI indotta dalla sepsi è associata a significativi cambiamenti dannosi nel traffico di cellule immunitarie nell'ambiente polmonare26. I neutrofili reclutati nei capillari dei topi con ALI indotta da sepsi sono stati trovati per impedire la microcircolazione, aumentando così l'ipossia in ALI26. Inoltre, IVM è stato utilizzato per ottenere informazioni sul meccanismo di riparazione sottostante dopo l'inizio di ARDS27. Lung IVM è stato anche uno strumento prezioso per comprendere i cambiamenti fisiopatologici in varie malattie polmonari ostruttive. Ad esempio, la visualizzazione del trasporto di muco in malattie come la fibrosi cistica (FC) e la broncopneumopatia cronica ostruttiva (BPCO) ha facilitato lo studio di trattamenti nuovi ed esistenti per la clearance mucosa28. Il traffico di leucociti in queste condizioni è stato analizzato anche17.
Questo protocollo espande l'approccio inizialmente descritto da Lamm et al.29 per studiare le interazioni leucocita-endoteliali utilizzando la microscopia a fluorescenza convenzionale. Le procedure descritte impiegano un sistema di imaging polmonare in vivo , che include una base metallica di 16,5 cm x 12,7 cm, un micromanipolatore e una finestra di imaging a vuoto (Figura 1). Il sistema è montato in una piattaforma stampata 3D di 20 cm x 23,5 cm (file supplementare 1) per fornire un fissaggio sicuro per il tubo del ventilatore e la piastra riscaldante. Questo metodo offre immagini riproducibili e quantificabili della microcircolazione polmonare murina in vivo. Aspetti importanti della preparazione chirurgica e il corretto utilizzo di un sistema di imaging polmonare stabilizzato sotto vuoto sono spiegati in dettaglio. Infine, un modello sperimentale di ALI viene utilizzato per fornire immagini e analisi rappresentative del rotolamento alterato dei leucociti, dell'adesione dei leucociti e della perfusione capillare associata all'infiammazione. L'uso di questo protocollo dovrebbe facilitare ulteriori importanti indagini sui cambiamenti fisiopatologici nella microcircolazione polmonare durante gli stati di malattia acuta.
Protocollo
Tutte le procedure qui descritte sono state eseguite previa approvazione da parte del Comitato per gli animali da laboratorio dell'Università di Dalhousie (UCLA).
1. Preparazione
- Sistema di imaging polmonare: per preparare la finestra, somministrare un sottile strato di grasso sottovuoto nella parte superiore dell'anello esterno evitando la contaminazione del canale del vuoto. Posizionare un coperchio di vetro pulito da 8 mm sulla finestra e premere delicatamente verso il basso per creare una guarnizione.
- Microscopio a fluorescenza a campo largo: consente di eseguire l'imaging con un microscopio a fluorescenza a campo largo convenzionale dotato di un obiettivo a lunga distanza di lavoro 20x/0,40 e di una telecamera CCD (Charge-Coupled Device) in bianco e nero con un frame-rate di 25 FPS. Applicare un filtro di eccitazione passa-banda da 530-550 nm per eccitare Rhodamine-6G e un filtro passa-banda da 460-490 nm per eccitare l'isotiocianato di fluoresceina (FITC).
- Sistema per vuoto: collegare la finestra di imaging a una pompa per vuoto dotata di un manometro digitale in grado di fornire un'aspirazione costante di 50-60 mmHg, come mostrato nella Figura 1 supplementare. In breve, collegare la finestra di imaging alla pompa tramite un tubo in polietilene ID da 1,0 mm, un tubo in polietilene ID da 1,0 cm, un pallone sottovuoto e un filtro in linea da 0,2 μm.
- Ventilatore: consente di impostare un piccolo ventilatore per roditori per fornire una ventilazione a pressione controllata a una velocità e un volume calcolati in base al peso del mouse. Fornire una pressione positiva di fine espirazione (PEEP) a 5 cmH2O per tutta la durata dell'esperimento e impostare la pressione target su 20 cmH2O.
- Anestetico: utilizzando un sistema di somministrazione di anestesia a basso flusso, innescare una siringa da 5,0 ml con isoflurano al 99,9%. Utilizzare un sistema di evacuazione dei gas di scarico per ridurre al minimo il rischio di inalazione da parte del chirurgo.
2. Anestesia
- Posizionare un topo C57Bl/6 maschio di 20-25 g di 12 settimane nella camera di induzione dell'anestesia. Con la camera saldamente chiusa, iniziare l'induzione con gas isoflurano ad una concentrazione del 3% e una portata di 500 ml/min.
- Una volta che il mouse è anestetizzato (visualizzato dalla frequenza respiratoria rallentata), trasferirlo al supporto di intubazione e fissare gli incisivi superiori alla sutura pendente.
- Stringere la sutura per fissare il muso all'interno del cono del naso. Iniziare il flusso di gas attraverso il cono del naso ad una concentrazione del 2,5%.
- Confermare un'adeguata profondità di anestesia tramite pizzicamento della punta prima di passare al passaggio successivo.
3. Intubazione
- Ruotare il supporto in modo tale che la parte posteriore del supporto e il lato dorsale della faccia del topo verso il chirurgo.
- Passare la punta di un cavo in fibra ottica lungo 20 cm attraverso una cannula endotracheale da 20 G e immergere la punta in Lidocaina HCl (1%) per facilitare il passaggio del cavo attraverso la laringe.
- Usando una pinza smussata, sollevare la mascella inferiore e spostare la lingua per fornire un passaggio chiaro nel tratto respiratorio.
- Inserire un otoscopio modificato (~ 60 ° di circonferenza dello speculum rimosso) in modo tale che gli incisivi superiori si inseriscano nello spazio nello speculum. Regolare l'ambito e la posizione della lingua fino a quando l'epiglottide e le corde vocali sono chiaramente visibili.
- Inserire il cavo in fibra ottica caricato con la cannula endotracheale attraverso lo spazio nello speculum e nella laringe. Usando piccoli movimenti circolari, passa il cavo attraverso le corde vocali e nella trachea.
- Spingere la cannula lungo il cavo in fibra ottica, passando tra le corde vocali e nella trachea.
4. Ventilazione
- Recupera il mouse dal supporto per l'intubazione e posizionalo su una piastra riscaldante nella posizione di decubito laterale destro.
- Collegare la cannula al tubo del ventilatore e avviare il ventilatore. Ridurre la concentrazione di anestetico all'1,5% e monitorare la profondità testando il riflesso del pedale. Se il riflesso persiste, aumentare la concentrazione in modo incrementale fino al 2%.
- Metti il gel lacrimale negli occhi del mouse per evitare l'essiccazione.
- Usando il nastro adesivo, fissare la cannula al muso. Usando il nastro adesivo, fissare la zampa anteriore destra alla piastra riscaldante approssimativamente a ore 9. Estendere caudalmente la zampa posteriore sinistra e fissarla approssimativamente a ore 6.
- Usando un nastro di stoffa, allungare leggermente la zampa anteriore sinistra fino alla posizione a ore 12 e fissare l'altra estremità del nastro alla parte superiore della piattaforma IVM come mostrato nella Figura 2A (mantenere una leggera tensione qui facilita la toracotomia successiva).
- Inserire una sonda di temperatura rettale e fissare la sonda fissandola alla piastra riscaldante. Posizionare un pulsossimetro sulla zampa posteriore destra e fissarlo alla piastra riscaldante, facendo attenzione a non interrompere la circolazione.
- Una volta che la temperatura è stabile a 37,0 °C ± 0,1 °C, procedere all'esecuzione della toracotomia.
5. Toracotomia
- Sterilizzare il torace e l'addome con una salvietta alcolica al 70%. Applicare una leggera mano di olio minerale per inumidire i capelli sul lato sinistro del topo, dallo sterno alla colonna vertebrale e dalla spalla al fondo della gabbia toracica.
- Con pinze smussate e forbici dritte, fai una piccola incisione longitudinale vicino al fondo della gabbia toracica per esporre lo strato muscolare sottostante.
- Muovendosi ventralmente, utilizzare la dissezione smussata per separare il tessuto epiteliale e adiposo dallo strato muscolare. Cauterizzare eventuali vasi sanguigni esposti. Una volta che il rischio di perdita di sangue è stato mitigato, estendere l'incisione originale ventralmente fino al processo xifoide.
- Ripetere questo processo dorsalmente fino a ~ 5 mm lateralmente alla colonna vertebrale.
- Muovendosi cranicamente, utilizzare la dissezione smussata per esporre la gabbia toracica. Cauterizzare eventuali vasi sanguigni esposti per preservare la stabilità emodinamica.
- Una volta che il rischio di perdita di sangue è stato mitigato, estendere l'incisione dal processo xifoide all'ascella.
- Ripetere questo processo sul lato dorsale dell'incisione fino a ~ 1 cm inferiore all'orecchio sinistro.
- Utilizzando una pinza emostatica, afferrare il tessuto epiteliale e adiposo sezionato e posizionarlo libero dall'area chirurgica (Figura 2B).
- Iniettare una soluzione di Rhodamine-6G (0,5 mg/mL; 1,5 mL/kg) per la visualizzazione dei leucociti e della FITC-albumina bovina (50 mg/mL; 1 mL/kg) per la visualizzazione della perfusione capillare attraverso la vena della coda.
- Usando una pinza dentata, afferrare la costola immediatamente inferiore alla posizione della base del polmone all'estremità dell'ispirazione e ritrarre leggermente per allontanare la costola dal polmone. Tagliare la costola per indurre uno pneumotorace.
- Estendere l'incisione lateralmente lungo il muscolo intercostale in entrambe le direzioni, facendo attenzione a non toccare la superficie polmonare esposta.
- Usando una pinza smussata, afferrare la costola successiva più alta e ritrarsi leggermente per consentire al polmone di allontanarsi dalla parete toracica. Se il polmone non si stacca, premere leggermente la parete toracica contro il polmone per far sì che il polmone aderisca alla pleura sottostante e quindi cada più facilmente.
- Continuare l'incisione originale ventralmente fino allo sterno e cranicamente fino a quando l'apice del polmone è esposto. Utilizzare applicatori di cotone e garze per attenuare qualsiasi sanguinamento che si presenta.
- Sollevare la cassa toracica per esporre i vasi sanguigni intercostali sull'aspetto dorsale della cavità toracica. Fare attenzione a non danneggiare il polmone, cauterizzare il vaso intercostale più inferiore vicino alla colonna vertebrale e quindi tagliare la costola. Muovendosi cranicamente e ventralmente, ripetere fino a quando una porzione di circa 1 cm x 1,5 cm della cassa toracica viene asportata (Figura 2C).
- Rimuovere qualsiasi accumulo di liquidi in eccesso nella cavità toracica tramite azione capillare utilizzando piccole strisce di garza.
- Mentre si procede alla microscopia, consentire ~ 5 minuti per il fluido intrapleurico di dissiparsi per un'interfaccia più sicura tra il polmone e la finestra di imaging.
6. Microscopia
- Accendere la pompa per vuoto e regolare la pressione a ~ 50-60 mmHg.
- Trasferire la piattaforma IVM allo stadio del microscopio. Posizionare il palo metallico e il micromanipolatore in modo tale che la finestra di imaging si trovi direttamente sopra il polmone esposto e il braccio della finestra si avvicini al polmone da, approssimativamente, la posizione a ore 3.
- Utilizzando il micromanipolatore, abbassare attentamente la finestra di imaging fino a quando non aderisce e stabilizza la superficie polmonare (Figura 3A).
- Utilizzando l'obiettivo 20x e il filtro di eccitazione passa-banda 460-490 nm, identificare una venula polmonare in base al modello convergente del flusso sanguigno. Centra la nave nel campo visivo e registra 30 s di video.
- Passa al filtro di eccitazione passa-banda 530-550 nm e registra 30 s di video nello stesso campo visivo.
- Ripetere il passaggio precedente fino a quando non sono state riprodotte cinque venule polmonari.
- Utilizzando il filtro di eccitazione passa-banda 460-490 nm, identificare un'arteriola polmonare in base al modello divergente del flusso sanguigno. Centra la nave nel campo visivo e registra 30 s di video.
- Passa al filtro di eccitazione passa-banda 530-550 nm e registra 30 s di video nello stesso campo visivo.
- Ripetere il passaggio precedente fino a quando cinque arteriole polmonari sono state riprese.
- Utilizzando il filtro di eccitazione passa-banda 460-490 nm, individuare una regione di alveoli e capillari non intersecati da vasi più grandi e registrare 30 s di video.
- Passa al filtro di eccitazione passa-banda 530-550 nm e registra 30 s di video nello stesso campo visivo.
- Ripetere il passaggio precedente fino a quando non sono state visualizzate cinque regioni capillari.
7. Eutanasia e protocollo di pulizia
- Rimuovere la piattaforma IVM dallo stadio del microscopio e regolare la consegna dell'isoflurano al 5% per 5 minuti per eutanasizzare il mouse.
- Durante l'attesa, scartare il vetro di copertura e scollegare la finestra di imaging dalla piattaforma. Pulire la finestra di imaging con un piccolo pennello e utilizzare una siringa da 30 G inserita nel canale per sciacquarla più volte con acqua distillata. Quindi, sciacquare con etanolo al 95% utilizzando la pompa per vuoto.
- Dopo 5 minuti, arrestare il ventilatore e garantire l'eutanasia completa tramite lussazione cervicale.
Risultati
Per illustrare i risultati ottenibili attraverso questo protocollo, la lesione polmonare acuta (ALI) è stata indotta 6 ore prima dell'imaging utilizzando un modello di instillazione batterica intranasale di lipopolisaccaride (LPS). In breve, i topi (n = 3) sono stati anestetizzati con isoflurano e piccole goccioline di LPS da Pseudomonas aeruginosa in soluzione salina sterile (10 mg / mL) sono state pipettate nel naris sinistro alla dose di 5 mg / kg. Questo è stato confrontato con topi naïve (n = 3; nessuna somministrazione intranasale).
Al momento dell'imaging, una preparazione chirurgica di successo è identificabile da diversi fattori. Il polmone dovrebbe essere relativamente stabile con la respirazione che causa spostamenti ciclici del frame non superiori a 25 μm. Gli alveoli devono essere chiaramente visibili e possono presentare distensione/contrazione delle maree. L'eccitazione da parte della luce blu (lunghezza d'onda 450-490 nm) consentirà la visualizzazione della direzionalità del flusso sanguigno e potrebbe essere possibile distinguere i singoli globuli rossi (Film supplementare 1, Filmato supplementare 3 e Film supplementare 5). I leucociti saranno chiaramente identificabili dopo l'eccitazione con luce verde (lunghezza d'onda 530-560 nm, Film supplementare 2, Film supplementare 4 e Film supplementare 6). Dopo il completamento dell'imaging e la rimozione della finestra di aspirazione, potrebbero esserci lievi lividi della superficie polmonare, anche se non all'interno dell'area ripresa, come mostrato nella Figura 3B.
Diverse sfide tecniche possono interferire con la fattibilità sperimentale. L'accumulo di sangue sulla superficie polmonare comprometterà la stabilizzazione del vuoto e potrebbe persino ostruire il canale. Per evitare ciò, è necessario esercitare estrema cautela durante ogni fase chirurgica. Una pressione del vuoto eccessivamente elevata può danneggiare il polmone e influenzare la microcircolazione. Ciò può essere identificabile da stasi alveolare o ecchimosi eccessive sulla superficie polmonare (Figura 3C) e può essere risolto riducendo la pressione dalla pompa per vuoto. Inoltre, gli errori nell'iniezione endovenosa di fluoroforo possono portare a una scarsa visualizzazione del traffico di leucociti e del flusso sanguigno.
Dopo il completamento del protocollo, l'analisi manuale in cieco è stata eseguita utilizzando Fiji21 in un modo adattato dalla precedente letteratura28. Cinque venule, arteriole e regioni di interesse capillare (ROI) sono state analizzate da ciascun animale. L'adesione dei leucociti nelle venule e nelle arteriole è stata definita come il numero di cellule che rimangono aderenti all'endotelio vascolare durante 30 s di osservazione per area della superficie endoteliale. Questo viene trasmesso in celle/mm2. L'adesione dei leucociti nei capillari è stata definita come il numero di cellule all'interno del ROI che rimangono aderenti all'endotelio vascolare durante 30 s di osservazione per area totale analizzata. Anche questo viene trasmesso in celle/mm2. Il rotolamento dei leucociti è stato definito come il doppio del numero di cellule che passano un punto di riferimento nel vaso durante il periodo di osservazione di 30 s. I leucociti a flusso libero sono stati esclusi confrontando la velocità di passaggio con quella del flusso dei globuli rossi, e questo viene trasmesso in cellule / min. Per misurare la perfusione microcircolatoria, la FCD è stata definita come la somma delle lunghezze dei capillari perfusi di globuli rossi per area di osservazione. Questo è trasmesso in cm / cm2. Ogni parametro è riportato come valore medio per ogni animale.
Una tendenza comune al reclutamento dei leucociti è stata osservata nelle venule polmonari, con aumento dell'adesione e del rotolamento nei topi trattati con LPS rispetto a quelli naïve (Figure 4C, D). Questa tendenza è stata ricapitolata dall'adesione dei leucociti arteriolari, sebbene entrambi i livelli di rotolamento e adesione fossero altamente variabili nel gruppo naïve (Figure 5C,D). In particolare, la somministrazione di LPS ha comportato un sostanziale aumento dell'adesione dei leucociti nei ROI capillari polmonari (Figura 6C). I topi LPS hanno anche dimostrato una FCD ridotta rispetto ai topi naïve (Figura 7C). Questi effetti all'interno dei capillari polmonari sono coerenti con la letteratura precedente che identifica aumenti delle cellule immunitarie per campo visivo e squilibrio della normale perfusione capillare a seguito di vari stimoli infiammatori 4,5,16.

Figura 1: Sistema di imaging polmonare. Il sistema di ordinazione personalizzato include (1) una base in metallo anodizzato, (2) finestra di imaging, (3) ingresso vuoto, (4) micromanipolatore. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione chirurgica. (A) Il mouse è fissato alla piattaforma IVM nella posizione di decubito laterale destro. (B) La gabbia toracica viene esposta utilizzando la dissezione smussata per preservare l'emodinamica. (C) La toracotomia viene eseguita per esporre il polmone sinistro. Fare clic qui per visualizzare una versione più grande di questa figura.
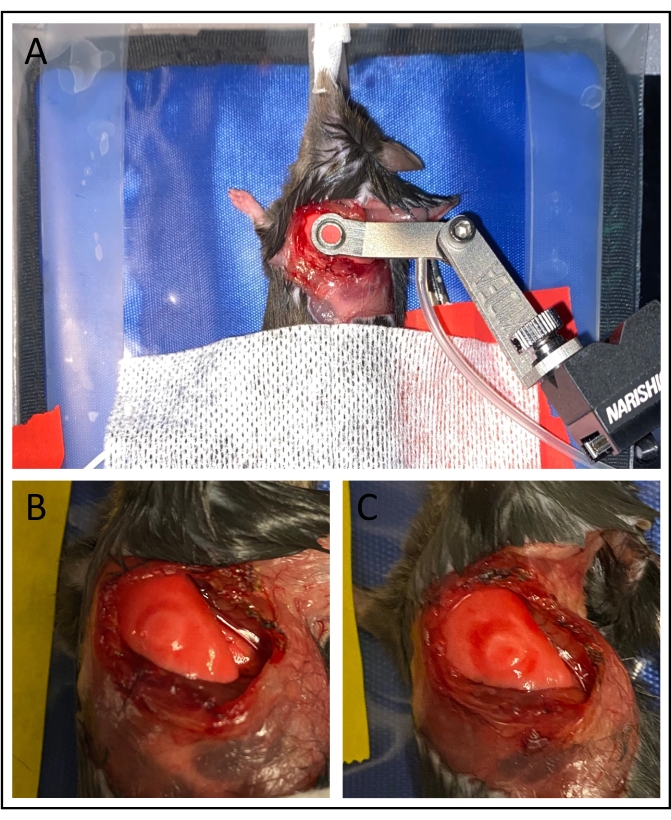
Figura 3: Stabilizzazione del vuoto. (A) L'applicazione della finestra di imaging a vuoto stabilizza la superficie polmonare. (B) L'utilizzo di pressioni del vuoto inferiori a 75 mmHg riduce al minimo i danni al polmone, in particolare all'interno dell'area ripresa. (C) Pressioni del vuoto più elevate possono causare lividi significativi. Fare clic qui per visualizzare una versione più grande di questa figura.
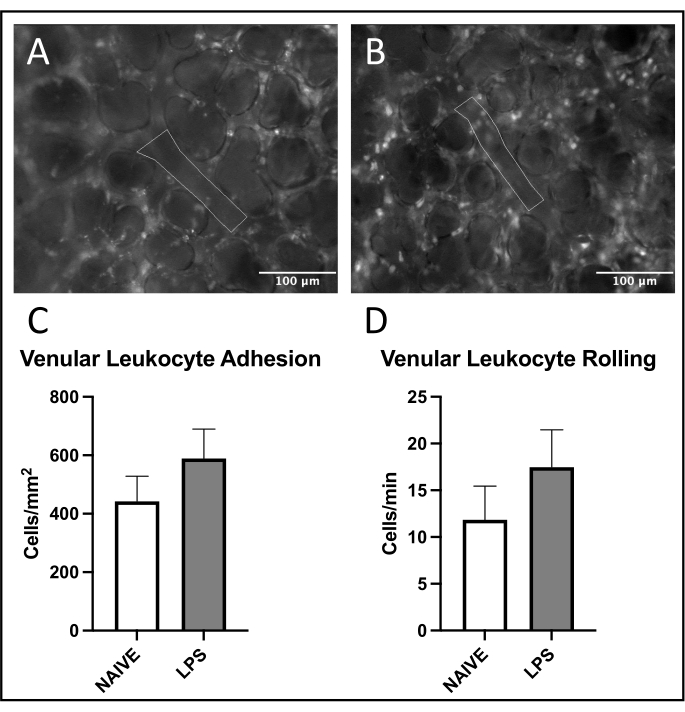
Figura 4: Traffico leucocitario di venule polmonari. L'eccitazione della rodamina 6G consente la visualizzazione di leucociti aderenti e rotolanti. Le aree delineate rappresentano porzioni analizzate di endotelio vascolare come confermato dall'eccitazione di FITC-albumina in topi (A) naïve e (B) trattati con LPS. (C,D) La somministrazione intranasale di LPS influisce sul rotolamento e sull'adesione dei leucociti nelle venule polmonari. I valori sono indicati come ± SD. Fare clic qui per visualizzare una versione più grande di questa figura.
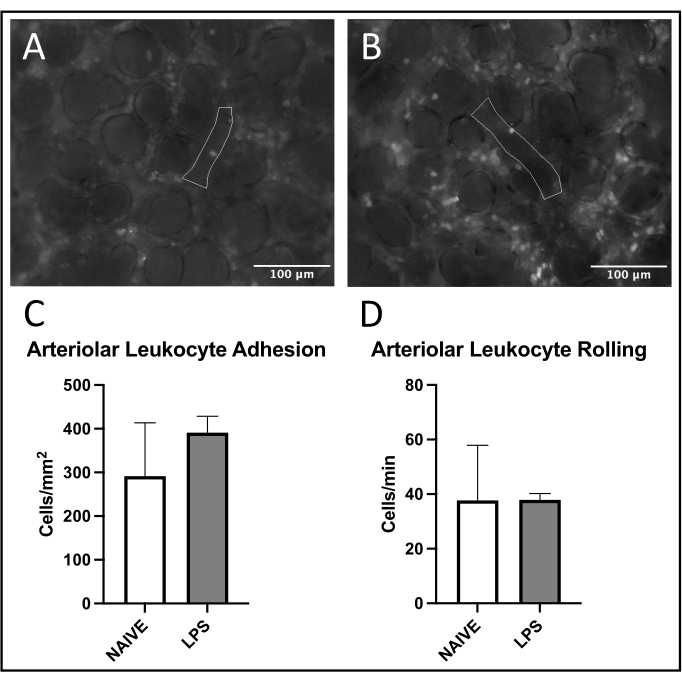
Figura 5: Traffico leucocitario nelle arteriole polmonari. L'eccitazione della rodamina 6G consente la visualizzazione di leucociti aderenti e rotolanti. Le aree delineate rappresentano porzioni analizzate di endotelio vascolare come confermato dall'eccitazione di FITC-albumina in topi (A) naïve e (B) trattati con LPS. (C,D) La somministrazione intranasale di LPS influisce sul rotolamento e sull'adesione dei leucociti nelle arteriole polmonari. I valori sono indicati come ± SD. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Leucociti aderenti nei capillari polmonari. L'eccitazione della rodamina 6G consente la visualizzazione dei leucociti all'interno dei ROI in topi (A) naïve e (B) trattati con LPS. (C) La somministrazione intranasale di LPS influisce sull'adesione leucocitaria nei topi trattati con LPS. I valori sono indicati come ± SD. Fare clic qui per visualizzare una versione più grande di questa figura.
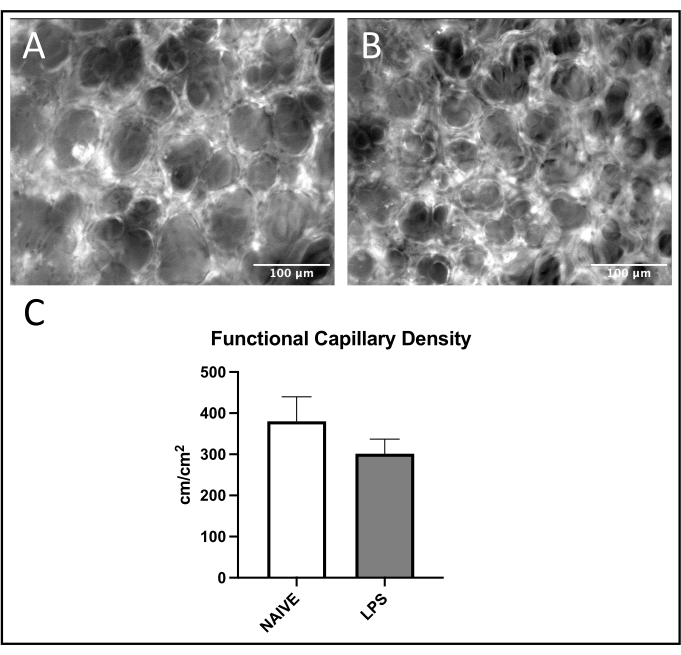
Figura 7: Funzione capillare polmonare. L'eccitazione dell'albumina FITC consente la visualizzazione del flusso sanguigno capillare all'interno dei ROI in topi (A) naïve e (B) trattati con LPS. (C) La somministrazione intranasale di LPS influisce sulla FCD nei capillari polmonari. I valori sono indicati come ± SD. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare: file per la piattaforma IVM stampabile in 3D. Fare clic qui per scaricare questo file.
Figura supplementare 1: Diagramma del sistema del vuoto. Fare clic qui per scaricare questo file.
Film supplementare 1: Video di esempio del flusso sanguigno nella venula polmonare. La freccia verde indica la direzione del flusso sanguigno. Clicca qui per scaricare questo film.
Film supplementare 2: Video di esempio del traffico di leucociti nella venula polmonare. Le frecce rosse denotano leucociti aderenti all'interno della nave. Clicca qui per scaricare questo film.
Film supplementare 3: Video di esempio del flusso sanguigno nell'arteriola polmonare. La freccia verde indica la direzione del flusso sanguigno. Clicca qui per scaricare questo film.
Film supplementare 4: Video di esempio del traffico di leucociti nell'arteriola polmonare. Le frecce rosse denotano leucociti aderenti all'interno di un vaso. Clicca qui per scaricare questo film.
Filmato supplementare 5: Video di esempio del flusso sanguigno nei capillari polmonari. Le frecce verdi denotano diverse aree ben visualizzate dei capillari perfusi dei globuli rossi. Clicca qui per scaricare questo film.
Filmato supplementare 6: Video di esempio del traffico di leucociti nei capillari polmonari. Le frecce rosse denotano leucociti aderenti all'interno del campo visivo. Clicca qui per scaricare questo film.
Discussione
Il protocollo qui presentato richiede pratica e attenzione ad alcuni passaggi critici. In primo luogo, è importante preparare la finestra di imaging prima di iniziare l'intubazione e la chirurgia. Utilizzare una quantità minima di grasso sottovuoto per rivestire l'anello esterno della finestra di imaging, applicare il vetro di copertura e testare l'aspirazione con una goccia di acqua distillata. Prepararlo in anticipo impedirà al polmone esposto di asciugarsi durante l'installazione, altrimenti. Mentre è possibile lavare con soluzione salina calda, così facendo si può rischiare di danneggiare il fragile tessuto polmonare.
Dopo l'intubazione, durante il trasferimento del mouse sulla piattaforma IVM, la cannula può occasionalmente essere spostata. Per evitare ciò, considera di legare la cannula ai denti anteriori del topo o di suturarla alla pelle intorno alla bocca. Se si utilizza la ventilazione a pressione controllata, il volume di marea deve essere attentamente monitorato durante tutta la procedura. Dovrebbe rimanere stabile a circa 0,20 ml, poiché valori significativamente più bassi (ad esempio, ~ 0,10 ml) possono indicare una singola ventilazione polmonare. In questo caso, la legger retrazione della cannula endotracheale può risolvere il problema. L'uso dell'anestesia inalante (isoflurano) facilita il controllo della profondità anestetica mentre il topo è ventilato. Altri mezzi di anestesia (ad esempio, ketamina per via endovenosa / xilazina10,11) sono stati impiegati da altri laboratori e ciascuno presenta i rispettivi vantaggi e svantaggi.
Durante l'intervento chirurgico, viene utilizzata una dissezione smussata per ridurre al minimo il rischio di tagliare i vasi sanguigni. Questo è di particolare importanza quando si seziona il tessuto adiposo denso e fortemente vascolarizzato vicino alla spalla. La resezione della gabbia toracica richiede sia velocità che precisione. Il calore del cauterizzatore è abbastanza intenso da bruciare il polmone se usato eccessivamente. Quando si reseca la gabbia toracica, ci dovrebbe essere spazio vuoto tra il polmone e la parete toracica. Se il polmone aderisce alla parete toracica, premendo leggermente verso il basso all'esterno della gabbia toracica incoraggerà l'adesione alla pleura parietale sottostante. In alternativa, utilizzare un ago smussato per iniettare una piccola quantità di soluzione salina calda tra il polmone e la cassa toracica per facilitare il rilascio. Si consiglia di posizionare il braccio della finestra a ore 3 per evitare pressioni indesiderate sulle costole durante l'imaging (Figura 3A). Lascerà anche più spazio tra il micromanipolatore e l'obiettivo del microscopio, consentendo un accesso più facile alle manipolazioni. Quando si abbassa la finestra di imaging, è fondamentale mirare alla regione centrale del polmone poiché il contatto con il bordo comporterà una tenuta inadeguata e un artefatto di movimento eccessivo durante l'imaging. Inoltre, più tentativi di abbassare la finestra possono danneggiare il polmone. Allo stesso modo, i cicli di distacco e ristabilizzazione contribuiranno alla lesione polmonare e potrebbero compromettere l'accuratezza sperimentale. Se eseguita correttamente, tuttavia, la preparazione qui presentata è abbastanza stabile da consentire l'imaging intravitale ad alta risoluzione con un obiettivo 20x.
È necessario un rigoroso protocollo di pulizia per prevenire la contaminazione e il blocco del canale del vuoto all'interno della finestra di imaging. L'uso di un ago da 30 G immediatamente dopo gli esperimenti per lavare ripetutamente con acqua distillata è efficace per rimuovere la maggior parte dei contaminanti. Questo è seguito da un lavaggio con etanolo concentrato e un lavaggio finale con acqua distillata prima di riattaccare alla linea del vuoto per rimuovere l'umidità. L'uso di acetone o detergenti forti può essere adeguato per risolvere gravi blocchi, se si verificano.
In particolare, questo protocollo impiega una lettura più elevata della pressione del vuoto rispetto ad altri metodi riportati 4,11, e questo può sollevare preoccupazioni di danni al tessuto polmonare. Una distinzione importante, tuttavia, è che il manometro digitale utilizzato qui misura la pressione solo alla pompa per vuoto. Questa pressione viene erogata attraverso tubi stretti e il canale estremamente stretto della finestra di imaging stessa prima della distribuzione su una superficie più ampia del polmone. Pertanto, nessuna evidenza di danni alla regione ripresa è stata osservata in questi esperimenti dopo sessioni intravitali. Inoltre, gli alveoli ripresi hanno mostrato distensione e contrazione delle maree, indicando che questo fenomeno fisiologico non è stato significativamente interrotto.
Nonostante la crescente popolarità dell'IVM polmonare come strumento per studiare la malattia in vivo, ci sono limitazioni a questa tecnica. In primo luogo, la natura invasiva e terminale dell'intervento induce un effetto non trascurabile sullo stato fisiologico del topo e limita la procedura a una singola sessione di imaging. Tuttavia, va notato che sono stati sviluppati diversi approcci IVM polmonari longitudinali30. In secondo luogo, l'uso della ventilazione meccanica può indurre un certo grado di lesione polmonare associata al ventilatore (VALI)31, sebbene ciò sia limitato dalla breve durata della procedura. In terzo luogo, il contatto tra la pleura viscerale e il coverslip di vetro e l'applicazione della pressione del vuoto possono causare un'alterazione del flusso sanguigno microvascolare. Infine, forse il limite più significativo di questo approccio è che l'imaging è limitato agli alveoli subpleurici nelle regioni polmonari non dipendenti, che non sono rappresentative dell'intero polmone32.
In sintesi, questo protocollo può essere utilizzato per studiare le interazioni leucocita-endoteliali nella microvascolarizzazione polmonare utilizzando la microscopia a fluorescenza intravitale. Mentre questi esperimenti impiegano lesioni polmonari indotte da endotossine, un modello acuto che è stato selezionato sulla base di ricerche precedenti, questo protocollo può anche essere adattato per studiare altri processi patologici e fisiologici nel polmone. Inoltre, il sistema di imaging polmonare qui impiegato è applicabile a una serie di approcci di microscopia e la finestra di imaging è abbastanza grande da ospitare obiettivi di immersione in olio ad alta apertura numerica. Pertanto, le procedure descritte dovrebbero facilitare ulteriori ricerche sull'impatto di vari stati patologici sulla microcircolazione polmonare.
Divulgazioni
La dott.ssa Kamala D. Patel è presidente e co-fondatrice di Luxidea, l'impresa da cui è stata acquistata la finestra di imaging utilizzata in questo esperimento.
Riconoscimenti
Gli autori desiderano ringraziare la dott.ssa Pina Colarusso, che ha fornito una significativa esperienza nella redazione e revisione di questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL BD Luer Slip Tip Syringe sterile, single use | Becton, Dickinson and Company | 309659 | 1 mL syringe |
| ADSON Dressing Forceps, Tip width 0.6 mm, teeth length 11.5 mm, 12 cm | RWD Life Science Co. | F12002-12 | Blunt forceps |
| Albumin-Fluorescein Isothiocyanate | Sigma-Aldrich | A9771-1G | FITC-albumin |
| Alcohol Swab Isopropyl Alcohol 70% v/v | Canadian Custom Packaging Company | 80002455 | Alcohol wipe |
| AVDC110 Advanced Digital Video Converter | Canopus | 00631069602029 | Digital video converter |
| B/W - CCD - Camera | Horn Imaging | BC-71 | Camera |
| Bovie Deluxe High Temperature Cautery Kit | Fine Science Tools | 18010-00 | Cauterizer |
| C57BL/6 Mice | Charles River Laboratories International | C57BL/6NCrl | C57BL/6 Mice |
| Cotton Tipped Applicators | Puritan | 806-WC | Cotton applicator |
| CS-8R 8mm Round Glass Coverslip | Warner Instruments | 64-0701 | Glass coverslip |
| Digital Pressure Gauge | ITM Instruments Inc. | DG2551L0NAM02L0IM&V | Digital Pressure Gauge |
| Dr Mom Slimline Stainless LED Otoscope | Dr. Mom Otoscopes | 1001 | Otoscope |
| Ethyl Alchohol 95% Vol | Commercial Alcohols | P016EA95 | 95% ethanol |
| Fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | Scissors |
| Fisherbrand Colored Labeling Tape | Fisher Scientific | 1590110 | Labeling tape |
| Gast DOA-P704-AA High-Capacity Vacuum Pump | Cole-Parmer Canada Company | ZA-07061-40 | Vacuum pump |
| Hartman Hemostats | Fine Science Tools | 13003-10 | Hemostatic forceps |
| High Vacuum Grease | Dow Corning | DC976VF | Vacuum grease |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Isoflurane |
| LIDOcaine HCl Injection 1% 50 mg/5 mL | Teligent Canada | 0121AD01 | Lidocaine HCl 1% |
| Lung SurgiBoard | Luxidea, Inc. | IMCH-0001 | Designed for intravital microscopy of the lung |
| Mineral Oil | Teva Canada | 00485802 | Mineral oil |
| Mouse Endotracheal Intubation Kit | Kent Scientific Corporation | ETI-MSE | Intubation stand, anesthesia mask, 20 G endotracheal cannula, fibre optic cable |
| MST49 Fluorescence Microscope | Leica Microsystems | 10 450 022 | Fluorescence Microscope |
| N Plan L 20x/0.40 Long Working Distance Microscope Objective | Leica Microsystems | 566035 | 20x objective |
| Non-Woven Sponges 2" x 2" | AMD-Ritmed | A2101-CH | Gauze |
| Optixcare Eye Lube Plus | Aventix | 5914322 | Tear gel |
| Original Prusa i3 MK3S+ 3D Printer | Prusa Research | PRI-MK3S-KIT-ORG-PEI | 3D printer |
| Oxygen, Compressed | Linde Canada Inc. | Oxygen | |
| PrecisionGlide Needle 30 G x 1/2 (0.3 mm x 13 mm) | Becton, Dickinson and Company | 305106 | 30 G needle |
| Pyrex 5340-2L 5340 Filtering Flasks, 2000 mL | Cole-Parmer Canada Company | 5340-2L | Vacuum flask |
| Rhodamine 6 G | Sigma-Aldrich | 252433 | Rhodamine 6G |
| Secure Soft Cloth Medical Tape - 3" | Primed | PM5-630709 | Cloth tape |
| Silastic Medical Grade Tubing .040 in. ID x .085 in. OD | Dow Corning | 602-205 | 1.0 mm I.D. polyethylene tubing |
| Somnosuite Low-Flow Anesthesia System | Kent Scientific Corporation | SS-01, SS-04-module | Small rodent ventilator, Low-flow anesthesia system, Heating pad, Rectal temperature probe, Pulse oximeter |
| Tissue Forceps, 12.5cm long, Curved, 1 x 2 Teeth | World Precision Instruments | 501216 | Toothed forceps |
| Transpore Medical Tape, 1527-1, 1 in x 10 yd (2.5 cm x 9.1 m) | 3M | 7000002795 | Medical tape |
| Tubing,Clear,3/8 in Inside Dia. | Grainger Canada | USSZUSA-HT3314 | 1.0 cm I.D. polyethylene tubing |
| Whatman 6720-5002 50 mm In-Line Filters, PTFE, 0.2 µm | Cole-Parmer Canada Company | 6720-5002 | Inline 0.2µm filter |
Riferimenti
- Alizadeh-Tabrizi, N., Hall, S., Lehmann, C. Intravital imaging of pulmonary immune response in inflammation and infection. Frontiers in Cell and Developmental Biology. 8, 620471 (2021).
- Gaertner, M., et al. Toward a comprehensive interpretation of intravital microscopy images in studies of lung tissue dynamics. Journal of Biomedical Optics. 20 (6), 066009 (2015).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Looney, M., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature Methods. 8 (2), 91-96 (2011).
- Bennewitz, M. F., Watkins, S. C., Sundda, P. Quantitative intravital two-photon excitation microscopy reveals absence of pulmonary vasoocclusion in unchallenged sickle cell disease mice. IntraVital. 3 (2), 29748 (2014).
- Blueschke, G., et al. Automated measurement of microcirculatory blood flow velocity in pulmonary metastases of rats. Journal of Visualized Experiments: JoVE. (93), e51630 (2014).
- Tabuchi, A., et al. Precapillary oxygenation contributes relevantly to gas exchange in the intact lung. American Journal of Respiratory and Critical Care Medicine. 188 (4), 474-481 (2013).
- Rodriguez-Tirado, C., et al. Long-term high-resolution intravital microscopy in the lung with a vacuum stabilized imaging window. Journal of Visualized Experiments: JoVE. (116), e54603 (2016).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and Immunity. 82 (2), 864-872 (2014).
- Thanabalasuriar, A., Neupane, A. S., Wang, J., Krummel, M. F., Kubes, P. iNKT cell emigration out of the lung vasculature requires neutrophils and monocyte-derived dendritic cells in inflammation. Cell Reports. 16 (12), 3260-3272 (2016).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Tschernig, T., et al. Direct visualisation of microparticles in the living lung. Experimental and Toxicologic Pathology. 65 (6), 883-886 (2013).
- Mertens, M., et al. Alveolar dynamics in acute lung injury: Heterogeneous distension rather than cyclic opening and collapse. Critical Care Medicine. 37 (9), 2604-2611 (2009).
- Matuszak, J., Tabuchi, A., Kuebler, W. M. Ventilation and perfusion at the alveolar level: Insights from lung intravital microscopy. Frontiers in Physiology. 11, 291 (2020).
- Margraf, A., et al. 6% Hydroxyethyl starch (HES 130/0.4) diminishes glycocalyx degradation and decreases vascular permeability during systemic and pulmonary inflammation in mice. Critical Care. 22 (1), 1-12 (2018).
- Roller, J., et al. Direct in vivo observations of P-selectin glycoprotein ligand-1-mediated leukocyte-endothelial cell interactions in the pulmonary microvasculature in abdominal sepsis in mice. Inflammation Research. 62 (3), 275-282 (2012).
- Marques, P., et al. Cigarette smoke increases endothelial CXCL16-leukocyte CXCR6 adhesion in vitro and in vivo. Potential consequences in chronic obstructive pulmonary disease. Frontiers in Immunology. 8, 1766 (2017).
- Condon, M. R., Kim, J. E., Deitch, E. A., Machiedo, G. W., Spolarics, Z. Appearance of an erythrocyte population with decreased deformability and hemoglobin content following sepsis. American Journal of Physiology-Heart and Circulatory Physiology. 284 (6), 2177-2184 (2003).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: Relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Kim, Y. M., Jeong, S., Choe, Y. H., Hyun, Y. M. Two-photon intravital imaging of leukocyte migration during inflammation in the respiratory system. Acute and Critical Care. 34 (2), 101-107 (2019).
- Faust, N., Varas, F., Kelly, L. M., Heck, S., Graf, T. Insertion of enhanced green fluorescent protein into the lysozyme gene creates mice with green fluorescent granulocytes and macrophages. Blood. 96 (2), 719-726 (2000).
- Orthgiess, J., et al. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. European Journal of Immunology. 46 (6), 1529-1532 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Butt, Y., Kurdowska, A., Allen, T. C. Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine. 140 (4), 345-350 (2016).
- Park, I., et al. Neutrophils disturb pulmonary microcirculation in sepsis-induced acute lung injury. European Respiratory Journal. 53 (3), 1800786 (2019).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American Journal of Respiratory Cell and Molecular Biology. 47 (6), 864-868 (2012).
- Pieper, M., Schulz-Hildebrandt, H., Mall, M. A., Hüttmann, G., König, P. Intravital microscopic optical coherence tomography imaging to assess mucus-mobilizing interventions for muco-obstructive lung disease in mice. American Journal of Physiology - Lung Cellular and Molecular Physiology. 318 (3), 518-524 (2020).
- Lamm, W. J. E., Bernard, S. L., Wiltz, W., Wagner, J., Glenny, R. W. Intravital microscopic observations of 15-µm microspheres lodging in the pulmonary microcirculation. Journal of Applied Physiology. 98 (6), 2242-2248 (2005).
- Entenberg, D., et al. A permanent window for the murine lung enables high-resolution imaging of cancer metastasis. Nature Methods. 15 (1), 73-80 (2018).
- Amato, M. B. P., et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. New England Journal of Medicine. 338 (6), 347-354 (2009).
- Looney, M. R., Bhattacharya, J. Live imaging of the lung. Annual Review of Physiology. 76, 431-445 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon