Method Article
الفحص المجهري الفلوري واسع المجال داخل الحيوية لدوران الأوعية الدقيقة الرئوية في إصابات الرئة الحادة التجريبية باستخدام نظام تصوير مستقر بالفراغ
In This Article
Summary
يمكن استخدام المجهر الفلوري داخل الحيوية لدراسة التفاعلات بين الكريات البيض والبطانية والتروية الشعرية في الوقت الفعلي. يصف هذا البروتوكول طرق تصوير هذه المعلمات وتحديدها كميا في دوران الأوعية الدقيقة الرئوي باستخدام نظام تصوير رئوي مستقر بالفراغ.
Abstract
يقدم التصوير داخل الحيوية للتفاعلات بين الكريات البيض والبطانية رؤى قيمة حول الأمراض المناعية في الحيوانات الحية. من الصعب دراسة إصابة الرئة الحادة (ALI) / متلازمة الضائقة التنفسية الحادة (ARDS) وغيرها من أمراض الجهاز التنفسي في الجسم الحي بسبب محدودية إمكانية الوصول والتحف المتحركة المتأصلة في الرئتين. ومع ذلك، فقد وضعت نهج مختلفة للتغلب على هذه التحديات. يصف هذا البروتوكول طريقة للفحص المجهري الفلوري داخل الحيوية لدراسة التفاعلات البطانية الكريات البيض في الوقت الفعلي في دوران الأوعية الدقيقة الرئوية في نموذج تجريبي ل ALI. يتم استخدام نظام تصوير الرئة في الجسم الحي ومنصة الفحص المجهري داخل الحيوية المطبوعة 3-D لتأمين الماوس المخدر وتحقيق الاستقرار في الرئة مع تقليل إصابة الرئة المربكة. بعد التحضير ، يتم استخدام المجهر الفلوري واسع المجال لدراسة التصاق الكريات البيض ، وتدحرج الكريات البيض ، ووظيفة الشعيرات الدموية. في حين أن البروتوكول المعروض هنا يركز على التصوير في نموذج حاد لأمراض الرئة الالتهابية ، إلا أنه يمكن تكييفه أيضا لدراسة العمليات المرضية والفسيولوجية الأخرى في الرئة.
Introduction
المجهر داخل الحيوية (IVM) هو أداة تصوير مفيدة لتصور ودراسة العمليات الفيزيائية الحيوية المختلفة في الجسم الحي. الرئة صعبة للغاية للتصوير في الجسم الحي بسبب موقعها المغلق ، والطبيعة الهشة لأنسجتها ، والتحف المتحركة الناجمة عن التنفس وضربات القلب 1,2. تم تطوير العديد من إعدادات الفحص المجهري داخل الحيوية (IVM) للتصوير في الوقت الفعلي للتفاعلات بين الكريات البيض والبطانية في دوران الأوعية الدقيقة الرئوية للتغلب على هذه التحديات. وتستند هذه الأساليب على كشف الرئة جراحيا وتثبيتها للتصوير.
عادة ما يتم إعداد الحيوانات ل IVM الرئة عن طريق العمليات الجراحية. أولا ، يتم تنبيب الحيوانات وتهويتها ، مما يسمح بالاستئصال الجراحي للنافذة الصدرية والتدخلات اللاحقة لتحقيق الاستقرار في الرئة للتصوير. تتضمن إحدى التقنيات لصق الحمة على غطاء زجاجي3 ، وهو إجراء يخاطر بصدمة جسدية كبيرة للأنسجة المصورة. الأكثر تقدما هو استخدام نظام فراغ لتحقيق الاستقرار في الرئة تحت نافذة زجاجية4. يسهل هذا الإعداد الالتصاق الفضفاض لسطح الرئة بالغطاء عبر فراغ قابل للعكس ينتشر على مساحة محلية كبيرة ويوسع الرئة مع الاستمرار في الحد من الحركة في أبعاد x و y و z4. يتم تطبيق الفراغ بالتساوي من خلال قناة تحيط بمنطقة التصوير في الإعداد ويسحب الأنسجة إلى منطقة مخروطية ضحلة تواجه الغطاء4 من فئة التصوير. من خلال نافذة العرض هذه ، يمكن دراسة دوران الأوعية الدقيقة في الرئة باستخدام طرق التصوير البصري المختلفة.
يتيح Lung IVM التصوير الكمي للعديد من معلمات الدورة الدموية الدقيقة. وتشمل هذه القياسات مثل سرعة مسار الكريات البيض وطولها5 ، وسرعة تدفق خلايا الدم الحمراء6 والأوكسجين7 ، ونقائل الورم8 ، والتمييز بين المجموعات الفرعية للخلايا المناعية9،10،11 ، وتصور الجسيمات الدقيقة12 ، وديناميات السنخية 13،14 ، ونفاذية الأوعية الدموية 15 ، ووظيفة الشعيرات الدموية 16 . ينصب التركيز هنا على تجنيد الكريات البيض ووظيفة الشعيرات الدموية. بدء تجنيد الكريات البيض في دوران الأوعية الدقيقة الرئوية ينطوي على تفاعلات المتداول العابرة والتفاعلات اللاصقة الثابتة بين الكريات البيض والخلايا البطانية ، وكلاهما يزداد في ظل الظروف الالتهابية16,17. عادة ، يتم تحديد كمية المتداول من خلال عدد الكريات البيض التي تمر عبر خط مرجعي محدد من قبل المشغل ، في حين يتم تحديد الالتصاق كميا بعدد الكريات البيض غير المتحركة على البطانة16. قد تتأثر وظيفة الشعيرات الدموية أيضا في الحالات الالتهابية ، مما يؤدي في كثير من الأحيان إلى انخفاض التروية. يمكن أن يعزى ذلك إلى عدة عوامل ، بما في ذلك الحد من تشوه خلايا الدم الحمراء18 والتعبير المتنوع عن NO synthase المستحث بواسطة الخلايا البطانية مما يؤدي إلى تحويل مرضي19. عادة ، يتم قياس الطول الكلي للشعيرات الدموية المنصهرة لكل منطقة والإبلاغ عنها ككثافة شعرية وظيفية (FCD).
تتطلب دراسة تجنيد الكريات البيض في الرئتين في الوقت الفعلي وضع علامات على الأهداف البيولوجية باستخدام أصباغ الفلورسنت أو الأجسام المضادة التي تحمل علامة الفلورسنت20. بدلا من ذلك ، يمكن استخدام العديد من سلالات الفئران المعدلة وراثيا مثل الفئران الفلورية الليزوزيم M-green (LysM-GFP) لتصوير مجموعات فرعية محددة من الخلايا المناعية مثل العدلات21,22. يمكن بعد ذلك تصور الكريات البيض الموسومة بالفلورسنت باستخدام المجهر الفلوري واسع المجال أو المجهر البؤري أو المجهر متعدد الفوتونات. تحقق هذه التقنيات التباين من خلال استخدام أطوال موجية محددة للإثارة واكتشاف التألق المنبعث مع منع اكتشاف الطول الموجي للإثارة في نفس الوقت ، وبالتالي تسليط الضوء على الجسم الموسوم.
اعتمدت الأبحاث الحالية المتعلقة بتحديد كمية الكريات البيض المتداول والالتصاق والكثافة الشعرية الوظيفية في رئة الفئران بشكل أساسي على تحليل الفيديو اليدوي. أصبح هذا ممكنا من خلال برامج مفتوحة المصدر مثل فيجي6،23 ، أو برامج احتكارية مثل CapImage12 ، أو أنظمة معالجة الصور المخصصة24. وعلى العكس من ذلك، تتيح العديد من منصات البرمجيات الاحتكارية (مثل NIS Element، وImaris، وVolocity، وMetaMorph) القياس الآلي لمجموعة واسعة من المعلمات الفسيولوجية الأخرى، بما في ذلك العديد من تلك المذكورة سابقا هنا5،6،7،8،9،10،11،12،13،15.
تم تقديم ملاحظات مهمة فيما يتعلق بأمراض إصابة الرئة الحادة (ALI) ومتلازمة الضائقة التنفسية الحادة (ARDS) باستخدام IVM الرئة. يتميز ARDS بمجموعة من العمليات الفسيولوجية المرضية في الرئة ، بما في ذلك الوذمة الرئوية والضرر السنخي الناجم عن خلل في البطانة والحاجز الظهاري25. باستخدام نموذج الفئران ، وجد أن ALI الناجم عن الإنتان يرتبط بتغيرات ضارة كبيرة في الاتجار بالخلايا المناعية في بيئة الرئة26. تم العثور على العدلات التي تم تجنيدها في الشعيرات الدموية للفئران مع ALI الناجم عن الإنتان لإعاقة دوران الأوعية الدقيقة ، وبالتالي زيادة نقص الأكسجة في ALI26. بالإضافة إلى ذلك ، تم استخدام IVM للحصول على رؤى حول الآلية الأساسية للإصلاح بعد ظهور ARDS27. كان IVM الرئوي أيضا أداة قيمة في فهم التغيرات الفسيولوجية المرضية في مختلف أمراض الرئة الانسدادية. على سبيل المثال ، سهل تصور نقل المخاط في أمراض مثل التليف الكيسي (CF) ومرض الانسداد الرئوي المزمن (COPD) دراسة العلاجات الجديدة والحالية لإزالة المخاط28. كما تم تحليل الاتجار بالكريات البيض في ظل هذه الظروف وكذلك17.
يتوسع هذا البروتوكول في النهج الذي وصفه في البداية Lamm et al.29 لدراسة التفاعلات بين الكريات البيض والبطانيات باستخدام المجهر الفلوري التقليدي. تستخدم الإجراءات الموصوفة نظام تصوير الرئة في الجسم الحي ، والذي يتضمن قاعدة معدنية 16.5 سم × 12.7 سم ، ومناور دقيق ، ونافذة تصوير فراغية (الشكل 1). يتم تركيب النظام في منصة مطبوعة 3-D مقاس 20 سم × 23.5 سم (الملف التكميلي 1) لتوفير مرفق آمن لأنابيب التهوية ووسادة التدفئة. توفر هذه الطريقة تصويرا قابلا للتكرار وقابلا للقياس الكمي لدوران الأوعية الدقيقة الرئوية الفئرانية في الجسم الحي. يتم شرح الجوانب الهامة للتحضير الجراحي بالإضافة إلى الاستخدام السليم لنظام تصوير الرئة المستقر بالفراغ بالتفصيل. أخيرا ، يتم استخدام نموذج تجريبي من ALI لتوفير تصوير تمثيلي وتحليل لتغير الكريات البيض المتداولة ، والتصاق الكريات البيض ، والتروية الشعرية المرتبطة بالالتهاب. يجب أن يسهل استخدام هذا البروتوكول إجراء المزيد من التحقيقات المهمة في التغيرات الفسيولوجية المرضية في دوران الأوعية الدقيقة الرئوية أثناء حالات المرض الحاد.
Protocol
تم تنفيذ جميع الإجراءات الموضحة هنا بموافقة مسبقة من لجنة جامعة دالهوزي المعنية بالحيوانات المختبرية (UCLA).
1. التحضير
- نظام تصوير الرئة: لإعداد النافذة ، قم بإدارة طبقة رقيقة من الشحوم الفراغية إلى أعلى الحلقة الخارجية مع تجنب تلوث قناة التفريغ. ضع غطاء زجاجيا نظيفا مقاس 8 مم على النافذة واضغط برفق لأسفل لإنشاء ختم.
- المجهر الفلوري واسع المجال: قم بإجراء التصوير باستخدام مجهر فلوري تقليدي واسع المجال مزود بهدف مسافة عمل طويلة 20x/0.40 وكاميرا جهاز مقترن بالشحنة بالأبيض والأسود (CCD) بمعدل إطارات يبلغ 25 إطارا في الثانية. قم بتطبيق مرشح إثارة ممر النطاق الترددي 530-550 نانومتر لإثارة Rhodamine-6G ومرشح تمرير النطاق الترددي 460-490 نانومتر لإثارة Fluorescein Isothiocyanate (FITC).
- نظام التفريغ: قم بتوصيل نافذة التصوير بمضخة تفريغ مزودة بمقياس ضغط رقمي قادر على توفير شفط ثابت 50-60 مم زئبق ، كما هو موضح في الشكل التكميلي 1. باختصار ، قم بتوصيل نافذة التصوير بالمضخة من خلال أنابيب البولي إيثيلين 1.0 مم I.D ، وأنابيب البولي إيثيلين 1.0 سم ID، وقارورة فراغ ، وفلتر 0.2 ميكرومتر مضمن.
- جهاز التنفس الصناعي: اضبط جهاز تهوية صغير للقوارض لتوفير تهوية يتم التحكم فيها بالضغط بمعدل وحجم محسوب بناء على وزن الماوس. توفير ضغط انتهاء انتهاء الصلاحية الإيجابي (PEEP) عند 5 سم H 2 O طوال مدةالتجربة، وتعيين الضغط المستهدف إلى 20 cmH2O.
- التخدير: باستخدام نظام توصيل التخدير منخفض التدفق ، قم بتجهيز حقنة سعة 5.0 مل مع 99.9٪ من الأيزوفلوران. استخدم نظام إزالة غازات النفايات لتقليل خطر استنشاقها من قبل الجراح.
2. التخدير
- ضع فأرة C57Bl/6 الذكرية البالغة من العمر 20-25 جم والبالغ من العمر 12 أسبوعا في غرفة تحريض التخدير. مع إغلاق الغرفة بشكل آمن ، ابدأ الحث بغاز الأيزوفلوران بتركيز 3٪ ومعدل تدفق 500 مل / دقيقة.
- بمجرد تخدير الماوس (تصوره من خلال تباطؤ معدل التنفس) ، انقله إلى حامل التنبيب وقم بتأمين القواطع العلوية إلى الخياطة المعلقة.
- شد الخيط لتأمين الخطم داخل مخروط الأنف. ابدأ تدفق الغاز عبر مخروط الأنف بتركيز 2.5٪.
- تأكد من عمق التخدير الكافي عن طريق قرصة إصبع القدم قبل الانتقال إلى الخطوة التالية.
3. التنبيب
- قم بتدوير الحامل بحيث يكون الجزء الخلفي من الحامل والجانب الظهري من الماوس وجها نحو الجراح.
- مرر طرف كابل الألياف البصرية بطول 20 سم من خلال قنية القصبة الهوائية 20 جم واغمر الطرف في Lidocaine HCl (1٪) لتسهيل مرور الكابل عبر الحنجرة.
- باستخدام ملقط حاد، ارفع الفك السفلي وأزيح اللسان لتوفير ممر واضح إلى الجهاز التنفسي.
- أدخل منظار الأذن المعدل (~ 60 درجة من محيط المنظار إزالته) بحيث تتناسب القواطع العلوية داخل الفجوة في المنظار. اضبط النطاق وموضع اللسان حتى يصبح لسان المزمار والحبال الصوتية مرئية بوضوح.
- أدخل كابل الألياف البصرية المحمل بقنية القصبة الهوائية من خلال الفجوة الموجودة في المنظار وفي الحنجرة. باستخدام حركات دائرية صغيرة ، مرر الكابل عبر الحبال الصوتية وإلى القصبة الهوائية.
- ادفع القنية على طول كابل الألياف البصرية ، ومر بين الحبال الصوتية وإلى القصبة الهوائية.
4. التهوية
- استرجع الماوس من حامل التنبيب وضعه على وسادة تسخين في وضع الاستلقاء الجانبي الأيمن.
- قم بتوصيل القنية بأنابيب التهوية وابدأ تشغيل جهاز التنفس الصناعي. قلل تركيز المخدر إلى 1.5٪ وراقب العمق عن طريق اختبار رد فعل الدواسة. إذا استمر المنعكس ، فقم بزيادة التركيز تدريجيا إلى 2٪.
- ضع جل الدموع في عيون الماوس لمنع الجفاف.
- باستخدام شريط طبي ، قم بتأمين القنية على الخطم. باستخدام شريط وضع العلامات ، قم بتثبيت المخلب الأيمن على وسادة التدفئة في وضع الساعة 9 تقريبا. قم بتمديد مخلب الخلفية الأيسر بشكل سببي وآمن في وضع الساعة 6 تقريبا.
- باستخدام شريط من القماش، قم بتمديد المخلب الأمامي الأيسر برفق إلى موضع الساعة 12 وقم بتأمين الطرف الآخر من الشريط إلى أعلى منصة IVM كما هو موضح في الشكل 2A (الحفاظ على توتر طفيف هنا يسهل بضع الصدر اللاحق).
- أدخل مسبار درجة حرارة المستقيم وقم بتأمين المسبار عن طريق ربطه بوسادة التدفئة. ضع مقياس التأكسج النبضي على المخلب الخلفي الأيمن وقم بتأمينه على وسادة التدفئة ، مع الحرص على عدم تعطيل الدورة الدموية.
- بمجرد أن تكون درجة الحرارة مستقرة عند 37.0 درجة مئوية ± 0.1 درجة مئوية ، تابع إجراء بضع الصدر.
5. بضع الصدر
- تعقيم الصدر والبطن مع مسح الكحول 70 ٪. ضع طبقة خفيفة من الزيت المعدني لترطيب الشعر على الجانب الأيسر من الماوس - من القص إلى العمود الفقري ومن الكتف إلى أسفل القفص الصدري.
- باستخدام ملقط حاد ومقص مستقيم ، قم بعمل شق طولي صغير بالقرب من الجزء السفلي من القفص الصدري لفضح طبقة العضلات الأساسية.
- تتحرك بطنيا ، استخدم تشريحا حادا لفصل الأنسجة الظهارية والدهنية عن طبقة العضلات. قم بكي أي أوعية دموية مكشوفة. بمجرد تخفيف خطر فقدان الدم ، قم بتمديد الشق البطني الأصلي حتى عملية الخنازير.
- كرر هذه العملية ظهريا حتى ~ 5 مم جانبية إلى العمود الفقري.
- التحرك في الجمجمة ، استخدم تشريحا حادا لفضح القفص الصدري. قم بكي أي أوعية دموية مكشوفة للحفاظ على استقرار الدورة الدموية.
- بمجرد تخفيف خطر فقدان الدم ، قم بتمديد الشق من عملية الخناق إلى الإبطين.
- كرر هذه العملية على الجانب الظهري من الشق حتى ~ 1 سم أقل شأنا من الأذن اليسرى.
- باستخدام ملقط مرقئ ، أمسك الأنسجة الظهارية والدهنية المشوهة ووضعها بعيدا عن المنطقة الجراحية (الشكل 2B).
- حقن محلول من Rhodamine-6G (0.5 مجم / مل ؛ 1.5 مل / كجم) لتصور الكريات البيض وألبومين FITC-bovine (50 mg / mL ؛ 1 mL / kg) لتصور التروية الشعرية عبر الوريد الذيلي.
- باستخدام ملقط مسنن ، أمسك الضلع على الفور أدنى من موضع قاعدة الرئة في نهاية الإلهام وتراجع قليلا لسحب الضلع بعيدا عن الرئة. قطع الضلع للحث على استرواح الصدر.
- قم بتمديد الشق أفقيا على طول العضلة الوربية في كلا الاتجاهين ، مع الحرص على عدم لمس سطح الرئة المكشوف.
- باستخدام ملقط حاد، أمسك الضلع الأعلى التالي واتراجع قليلا للسماح للرئة بالسقوط بعيدا عن جدار الصدر. إذا لم تنفصل الرئة ، فاضغط على جدار الصدر بخفة ضد الرئة لجعل الرئة تلتصق بغشاء الجنب الأساسي وبالتالي تسقط بسهولة أكبر.
- استمر في الشق البطني الأصلي حتى القص والقحف حتى تنكشف قمة الرئة. استخدم أدوات تطبيق القطن والشاش لتخفيف أي نزيف ينشأ.
- ارفع القفص الصدري لفضح الأوعية الدموية الوربية على الجانب الظهري من التجويف الصدري. الحرص على عدم إتلاف الرئة ، قم بكي الوعاء الوربي الأكثر رديئة بالقرب من العمود الفقري ، ثم قطع الضلع. تحرك قحفيا وبطنيا ، كرر ذلك حتى يتم استئصال جزء واحد تقريبا × 1.5 سم من القفص الصدري (الشكل 2C).
- قم بإزالة أي تراكم فائض للسوائل في التجويف الصدري عن طريق العمل الشعري باستخدام شرائط صغيرة من الشاش.
- أثناء المتابعة إلى الفحص المجهري ، اسمح ل ~ 5 دقائق للسائل داخل الجنبي بالتبدد للحصول على واجهة أكثر أمانا بين الرئة ونافذة التصوير.
6. المجهر
- قم بتشغيل مضخة التفريغ واضبط الضغط على ~ 50-60 مم زئبق.
- نقل منصة IVM إلى مرحلة المجهر. ضع العمود المعدني و micromanipulator بحيث تكون نافذة التصوير مباشرة فوق الرئة المكشوفة ويقترب ذراع النافذة من الرئة تقريبا من موضع الساعة 3.
- باستخدام micromanipulator ، اخفض نافذة التصوير بعناية حتى تلتصق بسطح الرئة وتثبته (الشكل 3A).
- باستخدام هدف 20x ومرشح إثارة الممر الترددي 460-490 نانومتر ، حدد الوريد الرئوي بناء على النمط المتقارب لتدفق الدم. توسيط السفينة في مجال الرؤية وتسجيل 30 ثانية من الفيديو.
- قم بالتبديل إلى مرشح إثارة الممر الترددي 530-550 نانومتر وسجل 30 ثانية من الفيديو في نفس مجال الرؤية.
- كرر الخطوة السابقة حتى يتم تصوير خمسة أورام رئوية.
- باستخدام مرشح إثارة الممر الترددي 460-490 نانومتر، حدد شريانا رئويا بناء على النمط المتباعد لتدفق الدم. توسيط السفينة في مجال الرؤية وتسجيل 30 ثانية من الفيديو.
- قم بالتبديل إلى مرشح إثارة الممر الترددي 530-550 نانومتر وسجل 30 ثانية من الفيديو في نفس مجال الرؤية.
- كرر الخطوة السابقة حتى يتم تصوير خمسة شرايين رئوية.
- باستخدام مرشح إثارة الممر الترددي 460-490 نانومتر ، حدد منطقة من الحويصلات الهوائية والشعيرات الدموية التي لا تتقاطع مع أوعية أكبر وتسجيل 30 ثانية من الفيديو.
- قم بالتبديل إلى مرشح إثارة الممر الترددي 530-550 نانومتر وسجل 30 ثانية من الفيديو في نفس مجال الرؤية.
- كرر الخطوة السابقة حتى يتم تصوير خمس مناطق شعرية.
7. القتل الرحيم وبروتوكول التنظيف
- قم بإزالة منصة IVM من مرحلة المجهر واضبط تسليم الأيزوفلوران إلى 5٪ لمدة 5 دقائق للقتل الرحيم للماوس.
- أثناء الانتظار، تخلص من زجاج الغطاء وافصل نافذة التصوير عن المنصة. نظف نافذة التصوير بفرشاة صغيرة واستخدم حقنة 30 جم تم إدخالها في القناة لتنظيفها عدة مرات بالماء المقطر. ثم ، اغسل مع 95٪ من الإيثانول باستخدام مضخة التفريغ.
- بعد مرور 5 دقائق، أوقف جهاز التنفس الصناعي، وتأكد من القتل الرحيم الكامل عن طريق خلع عنق الرحم.
النتائج
لتوضيح النتائج التي يمكن تحقيقها من خلال هذا البروتوكول ، تم تحفيز إصابة الرئة الحادة (ALI) قبل 6 ساعات من التصوير باستخدام نموذج من تقطير عديد السكاريد الشحمي البكتيري داخل الأنف (LPS). باختصار ، تم تخدير الفئران (n = 3) باستخدام الأيزوفلوران ، وتم سحب قطرات صغيرة من LPS من Pseudomonas aeruginosa في محلول ملحي معقم (10 ملغ / مل) في ناريس الأيسر بجرعة 5 ملغ / كجم. تمت مقارنة هذا بالفئران الساذجة (n = 3 ؛ لا يوجد إعطاء عن طريق الأنف).
عند التصوير ، يمكن التعرف على التحضير الجراحي الناجح من خلال عدة عوامل. يجب أن تكون الرئة مستقرة نسبيا مع التنفس مما يسبب تحولات دورية لا تزيد عن 25 ميكرومتر. يجب أن تكون الحويصلات الهوائية مرئية بوضوح وقد تظهر انتفاخ / تقلص المد والجزر. سيسمح الإثارة بالضوء الأزرق (الطول الموجي 450-490 نانومتر) بتصور اتجاه تدفق الدم ، وقد يكون من الممكن التمييز بين خلايا الدم الحمراء الفردية (الفيلم التكميلي 1 ، الفيلم التكميلي 3 ، والفيلم التكميلي 5). سيتم التعرف بوضوح على الكريات البيض عند الإثارة عن طريق الضوء الأخضر (الطول الموجي 530-560 نانومتر ، الفيلم التكميلي 2 ، الفيلم التكميلي 4 ، والفيلم التكميلي 6). بعد الانتهاء من التصوير وإزالة نافذة الشفط ، قد يكون هناك كدمات طفيفة في سطح الرئة ، على الرغم من أنها ليست داخل المنطقة المصورة ، كما هو موضح في الشكل 3B.
قد تتداخل العديد من التحديات التقنية مع الجدوى التجريبية. تراكم الدم على سطح الرئة سيضر باستقرار الفراغ وقد يسد القناة. لتجنب ذلك ، يجب توخي الحذر الشديد خلال كل خطوة جراحية. قد يؤدي الضغط الفراغي المرتفع بشكل مفرط إلى تلف الرئة ويؤثر على دوران الأوعية الدقيقة. يمكن التعرف على ذلك عن طريق الركود السنخي أو الكدمات المفرطة على سطح الرئة (الشكل 3C) ويمكن علاجه عن طريق تقليل الضغط من مضخة التفريغ. كذلك، قد تؤدي الأخطاء في حقن الفلوروفور في الوريد إلى ضعف تصور الاتجار بالكريات البيض وتدفق الدم.
وبعد الانتهاء من البروتوكول، أجري تحليل يدوي أعمى باستخدام فيجي21 بطريقة مقتبسة من الأدبيات السابقة28. تم تحليل خمسة أوردة وشرايين ومناطق الشعيرات الدموية ذات الأهمية (ROIs) من كل. تم تعريف التصاق الكريات البيض في الأوردة والشرايين بأنه عدد الخلايا التي تظل ملتصقة بالبطانة الوعائية خلال 30 ثانية من المراقبة لكل منطقة من السطح البطاني. يتم ترحيل هذا في الخلايا / مم2. تم تعريف التصاق الكريات البيض في الشعيرات الدموية بأنه عدد الخلايا داخل عائد الاستثمار التي تظل ملتصقة بالبطانة الوعائية خلال 30 ثانية من المراقبة لكل منطقة تم تحليلها بالكامل. يتم ترحيل هذا أيضا في الخلايا / مم2. تم تعريف الكريات البيض المتداول على أنه ضعف عدد الخلايا التي تمر بنقطة مرجعية في الوعاء خلال فترة المراقبة 30 ثانية. تم استبعاد الكريات البيض المتدفقة بحرية من خلال مقارنة سرعة المرور مع سرعة تدفق خلايا الدم الحمراء ، ويتم ترحيل ذلك في الخلايا / دقيقة. لقياس تروية الدورة الدموية الدقيقة ، تم تعريف FCD على أنه مجموع أطوال الشعيرات الدموية المنصهرة في خلايا الدم الحمراء لكل منطقة مراقبة. يتم ترحيل هذا في سم / سم2. يتم الإبلاغ عن كل معلمة كقيمة متوسطة لكل.
ولوحظ اتجاه شائع لتجنيد الكريات البيض في الأوردة الرئوية، مع زيادة الالتصاق والدحرجة في الفئران المعالجة ب LPS مقابل الفئران الساذجة (الشكلان 4C، D). وقد لخص هذا الاتجاه عن طريق التصاق الكريات البيض الشريانية، على الرغم من أن كلا من مستويات المتداول والالتصاق كانت متغيرة للغاية في المجموعة الساذجة (الشكلان 5C، D). ومن الجدير بالذكر أن إدارة LPS أدت إلى زيادة كبيرة في التصاق الكريات البيض في عائد الاستثمار الشعري الرئوي (الشكل 6C). أظهرت فئران LPS أيضا انخفاض FCD مقابل الفئران الساذجة (الشكل 7C). تتوافق هذه التأثيرات داخل الشعيرات الدموية الرئوية مع الأدبيات السابقة التي تحدد الزيادات في الخلايا المناعية لكل مجال رؤية واختلال التروية الشعرية الطبيعية بعد المحفزات الالتهابية المختلفة 4,5,16.

الشكل 1: نظام تصوير الرئة. يتضمن نظام الطلب المخصص (1) قاعدة معدنية مؤكسدة ، (2) نافذة تصوير ، (3) مدخل فراغ ، (4) مناور دقيقة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التحضير الجراحي . (أ) يتم تأمين الماوس على منصة IVM في وضع الاستلقاء الجانبي الأيمن. (ب) يتعرض القفص الصدري باستخدام تشريح حاد للحفاظ على ديناميكا الدم. (ج) يتم إجراء بضع الصدر لفضح الرئة اليسرى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
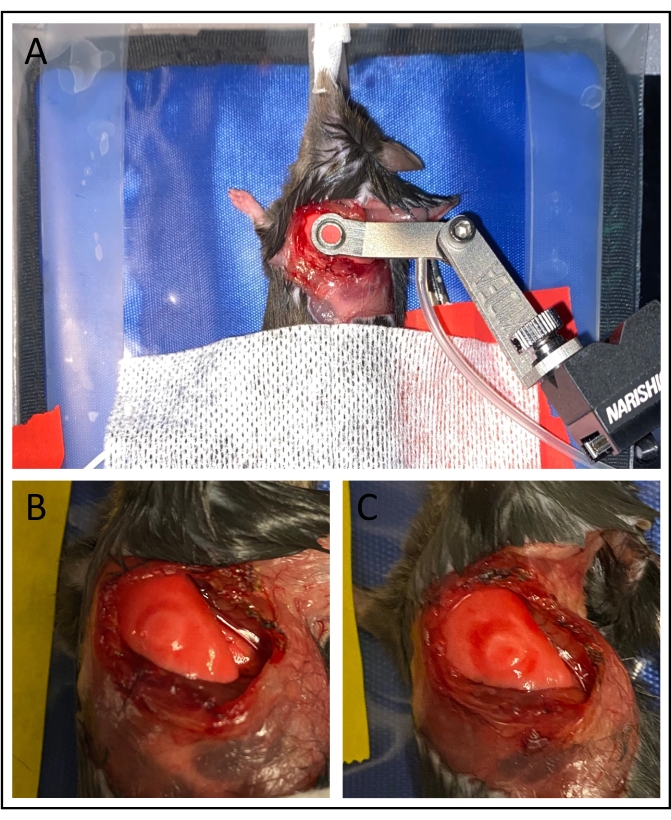
الشكل 3: تثبيت الفراغ . (أ) تطبيق نافذة التصوير الفراغي يستقر السطح الرئوي. (ب) استخدام ضغوط فراغ أقل من 75 مم زئبق يقلل إلى أدنى حد من الضرر الذي يلحق بالرئة، ولا سيما داخل المنطقة المصورة. (ج) قد تسبب ضغوط الفراغ العالية كدمات كبيرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
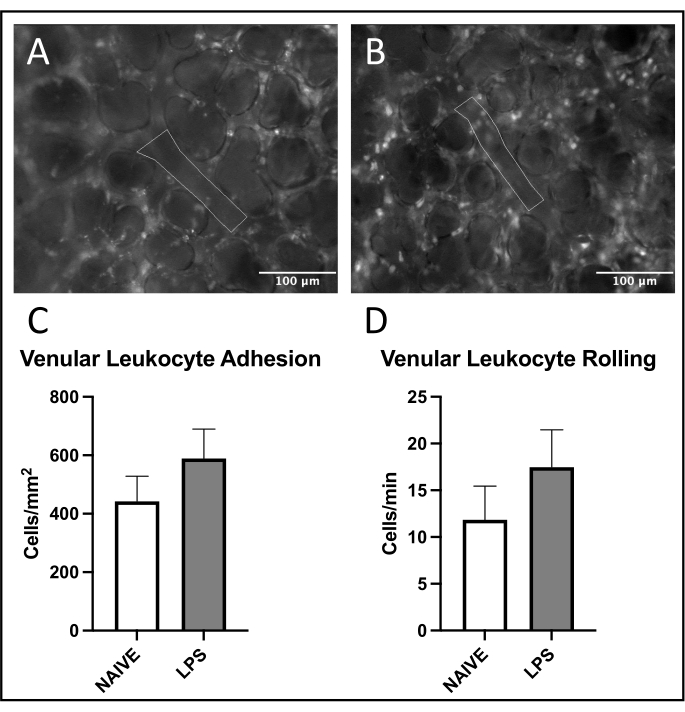
الشكل 4: الاتجار بالكريات البيض في الأوردة الرئوية. يسمح إثارة الرودامين 6G بتصور الكريات البيض الملتصقة والمتداولة. تمثل المناطق المحددة أجزاء تم تحليلها من بطانة الأوعية الدموية كما هو مؤكد من خلال إثارة FITC-albumin في (A) الفئران الساذجة و (B) المعالجة ب LPS. (ج، د) يؤثر إعطاء LPS داخل الأنف على تدحرج الكريات البيض والالتصاق في الأوردة الرئوية. يتم إعطاء القيم كمتوسط ± SD. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
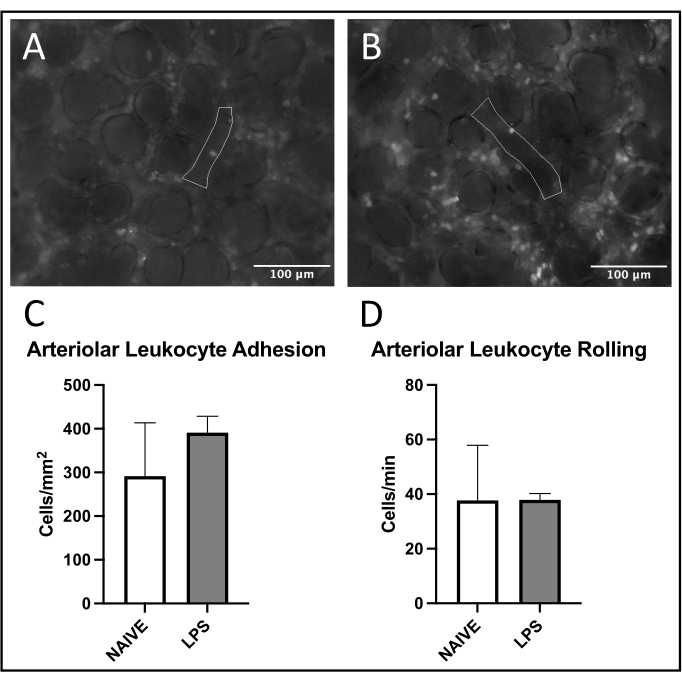
الشكل 5: الاتجار بالكريات البيض في الشرايين الرئوية. يسمح إثارة الرودامين 6G بتصور الكريات البيض الملتصقة والمتداولة. تمثل المناطق المحددة أجزاء تم تحليلها من بطانة الأوعية الدموية كما هو مؤكد من خلال إثارة FITC-albumin في (A) الفئران الساذجة و (B) المعالجة ب LPS. (ج، د) يؤثر إعطاء LPS داخل الأنف على تدحرج الكريات البيض والالتصاق في الشرايين الرئوية. يتم إعطاء القيم كمتوسط ± SD. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: الكريات البيض الملتصقة في الشعيرات الدموية الرئوية. يسمح إثارة الرودامين 6G بتصور الكريات البيض داخل عائد الاستثمار في (أ) الفئران الساذجة و (ب) المعالجة ب LPS. (ج) يؤثر إعطاء LPS داخل الأنف على التصاق الكريات البيض في الفئران المعالجة ب LPS. يتم إعطاء القيم كمتوسط ± SD. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
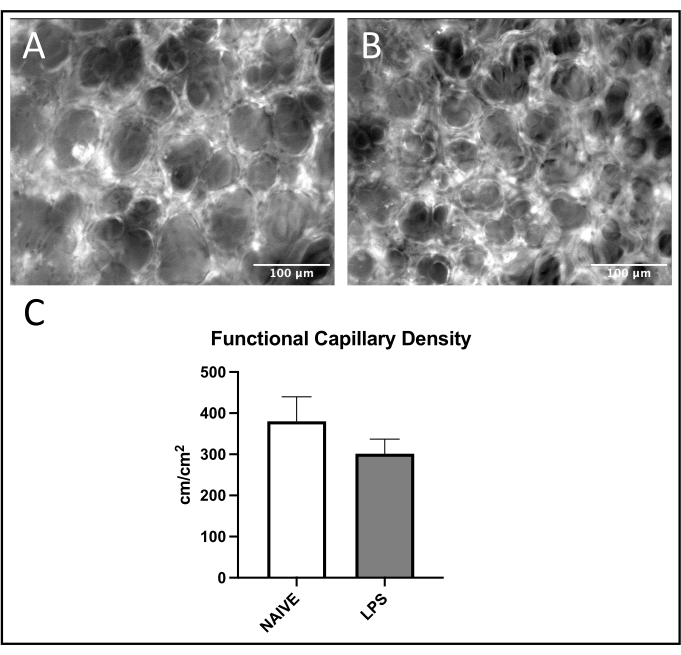
الشكل 7: وظيفة الشعيرات الدموية الرئوية. يسمح إثارة FITC-albumin بتصور تدفق الدم الشعري داخل عائد الاستثمار في (A) الفئران الساذجة و (B) المعالجة ب LPS. (ج) يؤثر إعطاء LPS داخل الأنف على FCD في الشعيرات الدموية الرئوية. يتم إعطاء القيم كمتوسط ± SD. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملف تكميلي: ملف لمنصة IVM القابلة للطباعة 3D. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 1: رسم تخطيطي لنظام التفريغ. يرجى النقر هنا لتنزيل هذا الملف.
الفيلم التكميلي 1: عينة فيديو لتدفق الدم في الوريد الرئوي. يشير السهم الأخضر إلى اتجاه تدفق الدم. يرجى النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 2: عينة فيديو للاتجار بالكريات البيض في الوريد الرئوي. تشير الأسهم الحمراء إلى الكريات البيض الملتصقة داخل السفينة. يرجى النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 3: عينة فيديو لتدفق الدم في الشريان الرئوي. يشير السهم الأخضر إلى اتجاه تدفق الدم. يرجى النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 4: عينة فيديو للاتجار بالكريات البيض في الشرايين الرئوية. تشير الأسهم الحمراء إلى الكريات البيض الملتصقة داخل السفينة. يرجى النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 5: عينة فيديو لتدفق الدم في الشعيرات الدموية الرئوية. تشير الأسهم الخضراء إلى العديد من المناطق المرئية جيدا من الشعيرات الدموية المنصهرة في خلايا الدم الحمراء. يرجى النقر هنا لتنزيل هذا الفيلم.
الفيلم التكميلي 6: عينة فيديو للاتجار بالكريات البيض في الشعيرات الدموية الرئوية. تشير الأسهم الحمراء إلى الكريات البيض الملتصقة داخل مجال الرؤية. يرجى النقر هنا لتنزيل هذا الفيلم.
Discussion
يتطلب البروتوكول المعروض هنا الممارسة والاهتمام ببعض الخطوات الحاسمة. أولا ، من المهم إعداد نافذة التصوير قبل البدء في التنبيب والجراحة. استخدم الحد الأدنى من الشحوم الفراغية لتغطية الحلقة الخارجية لنافذة التصوير ، وتطبيق زجاج الغطاء ، واختبار الشفط بقطرة من الماء المقطر. إعداد هذا مقدما سيمنع الرئة المكشوفة من الجفاف أثناء الإعداد خلاف ذلك. في حين أنه من الممكن غسل المياه المالحة الدافئة، فإن القيام بذلك قد يخاطر بإتلاف الأنسجة الرئوية الهشة.
بعد التنبيب ، أثناء نقل الماوس إلى منصة IVM ، قد تصبح القنية في بعض الأحيان نازحة. لمنع ذلك ، فكر في ربط القنية بالأسنان الأمامية للفأر أو خياطتها بالجلد حول فمه. في حالة استخدام تهوية يتم التحكم فيها بالضغط ، يجب مراقبة حجم المد والجزر بعناية طوال الإجراء. يجب أن يظل ثابتا عند حوالي 0.20 مل ، حيث أن القيم المنخفضة بشكل كبير (على سبيل المثال ، ~ 0.10 مل) قد تشير إلى تهوية الرئة الواحدة. إذا حدث ذلك، فإن التراجع قليلا عن قنية القصبة الهوائية قد يحل المشكلة. يسهل استخدام التخدير المستنشق (isoflurane) التحكم في عمق التخدير أثناء تهوية الماوس. تم استخدام وسائل أخرى للتخدير (على سبيل المثال ، الكيتامين عن طريق الوريد / زيلازين10,11) من قبل مختبرات أخرى ، ولكل منها مزاياها وعيوبها.
أثناء الجراحة ، يتم استخدام تشريح حاد لتقليل خطر قطع الأوعية الدموية. هذا له أهمية خاصة عند تشريح الأنسجة الدهنية السميكة والوعائية بشكل كبير بالقرب من الكتف. يتطلب استئصال القفص الصدري السرعة والدقة. الحرارة من الكي شديدة بما يكفي لحرق الرئة إذا استخدمت بشكل مفرط. عند استئصال القفص الصدري ، يجب أن تكون هناك مساحة فارغة بين الرئة وجدار الصدر. إذا التصقت الرئة بجدار الصدر ، فإن الضغط برفق على الجزء الخارجي من القفص الصدري سيشجع على الالتصاق بغشاء الجنب الجداري الأساسي. بدلا من ذلك ، استخدم إبرة حادة لحقن كمية صغيرة من المياه المالحة الدافئة بين الرئة والقفص الصدري لتسهيل الإفراج. ينصح بوضع ذراع النافذة في وضع الساعة 3 لتجنب الضغط غير المرغوب فيه على الأضلاع أثناء التصوير (الشكل 3A). كما أنه سيترك المزيد من الخلوص بين المتلاعب الدقيق وهدف المجهر ، مما يسمح بوصول أسهل للتلاعب. عند خفض نافذة التصوير ، من الأهمية بمكان استهداف المنطقة الوسطى من الرئة لأن الاتصال بالحافة سيؤدي إلى ختم غير كاف وقطعة أثرية مفرطة الحركة أثناء التصوير. أيضا ، يمكن أن تؤدي المحاولات المتعددة لخفض النافذة إلى تلف الرئة. وبالمثل ، فإن دورات الانفصال وإعادة الاستقرار ستسهم في إصابة الرئة وقد تضر بالدقة التجريبية. ومع ذلك ، عندما يتم تنفيذه بشكل صحيح ، يكون التحضير المعروض هنا مستقرا بما يكفي لتمكين التصوير عالي الدقة داخل الحيوية بهدف 20x.
من الضروري وجود بروتوكول تنظيف صارم لمنع تلوث وانسداد قناة التفريغ داخل نافذة التصوير. يعد استخدام إبرة 30 جم مباشرة بعد التجارب للتدفق المتكرر بالماء المقطر فعالا لإزالة معظم الملوثات. ويتبع ذلك تدفق مع الإيثانول المركز وتدفق نهائي بالماء المقطر قبل إعادة التوصيل بخط التفريغ لإزالة الرطوبة. قد يكون استخدام الأسيتون أو المنظفات القوية كافيا لحل الانسدادات الخطيرة ، في حالة حدوثها.
والجدير بالذكر أن هذا البروتوكول يستخدم قراءة أعلى لضغط الفراغ مقارنة ببعض الطرق الأخرى المبلغ عنها 4,11 ، وهذا قد يثير مخاوف من تلف أنسجة الرئة. ومع ذلك ، هناك فرق مهم هو أن المقياس الرقمي المستخدم هنا يقيس الضغط فقط في مضخة التفريغ. يتم توصيل هذا الضغط من خلال الأنابيب الضيقة والقناة الضيقة للغاية لنافذة التصوير نفسها قبل التوزيع على مساحة سطح أكبر من الرئة. على هذا النحو ، لم يلاحظ أي دليل على تلف المنطقة المصورة في هذه التجارب بعد جلسات داخل الحيوية. وعلاوة على ذلك، أظهرت الحويصلات الهوائية المصورة انتفاخا وانقباضا في المد والجزر، مما يشير إلى أن هذه الظاهرة الفسيولوجية لم تتعطل بشكل كبير.
على الرغم من الشعبية المتزايدة ل IVM الرئة كأداة لدراسة المرض في الجسم الحي ، إلا أن هناك قيودا على هذه التقنية. أولا ، الطبيعة الغازية والنهائية للجراحة تحفز تأثيرا لا يستهان به على الحالة الفسيولوجية للفأر وتقصر الإجراء على جلسة تصوير واحدة. ومع ذلك ، تجدر الإشارة إلى أنه تم تطوير العديد من نهج IVM الرئوية الطولية30. ثانيا، قد يؤدي استخدام التهوية الميكانيكية إلى درجة من إصابات الرئة المرتبطة بجهاز التنفس الصناعي (VALI)31، على الرغم من أن هذا محدود بسبب المدة القصيرة للإجراء. ثالثا ، قد يؤدي الاتصال بين غشاء الجنب الحشوي والغطاء الزجاجي وتطبيق ضغط الفراغ إلى تغيير تدفق الدم الوعائي الدقيق. أخيرا ، ربما يكون أهم قيد لهذا النهج هو أن التصوير يقتصر على الحويصلات الهوائية تحت الجنبية في المناطق الرئوية غير المعتمدة ، والتي لا تمثل الرئة بأكملها32.
باختصار ، يمكن استخدام هذا البروتوكول لدراسة التفاعلات بين الكريات البيض والبطانية في الأوعية الدموية الدقيقة الرئوية باستخدام المجهر الفلوري داخل الحيوية. في حين أن هذه التجارب تستخدم إصابة الرئة الناجمة عن السموم الداخلية ، وهو نموذج حاد تم اختياره بناء على أبحاث سابقة ، يمكن أيضا تكييف هذا البروتوكول لدراسة العمليات المرضية والفسيولوجية الأخرى في الرئة. علاوة على ذلك ، فإن نظام تصوير الرئة المستخدم هنا قابل للتطبيق على مجموعة من أساليب الفحص المجهري ، ونافذة التصوير كبيرة بما يكفي لاستيعاب أهداف غمر الزيت ذات الفتحة العددية العالية. وبالتالي ، يجب أن تسهل الإجراءات الموصوفة إجراء مزيد من الأبحاث حول تأثير الحالات المرضية المختلفة على دوران الأوعية الدقيقة الرئوية.
Disclosures
الدكتورة كامالا دي باتيل هي الرئيس والمؤسس المشارك لشركة Luxidea ، وهي المؤسسة التي تم شراء نافذة التصوير المستخدمة في هذه التجربة منها.
Acknowledgements
يود المؤلفون أن يشكروا الدكتورة بينا كولاروسو ، التي قدمت خبرة كبيرة في تحرير وتنقيح هذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL BD Luer Slip Tip Syringe sterile, single use | Becton, Dickinson and Company | 309659 | 1 mL syringe |
| ADSON Dressing Forceps, Tip width 0.6 mm, teeth length 11.5 mm, 12 cm | RWD Life Science Co. | F12002-12 | Blunt forceps |
| Albumin-Fluorescein Isothiocyanate | Sigma-Aldrich | A9771-1G | FITC-albumin |
| Alcohol Swab Isopropyl Alcohol 70% v/v | Canadian Custom Packaging Company | 80002455 | Alcohol wipe |
| AVDC110 Advanced Digital Video Converter | Canopus | 00631069602029 | Digital video converter |
| B/W - CCD - Camera | Horn Imaging | BC-71 | Camera |
| Bovie Deluxe High Temperature Cautery Kit | Fine Science Tools | 18010-00 | Cauterizer |
| C57BL/6 Mice | Charles River Laboratories International | C57BL/6NCrl | C57BL/6 Mice |
| Cotton Tipped Applicators | Puritan | 806-WC | Cotton applicator |
| CS-8R 8mm Round Glass Coverslip | Warner Instruments | 64-0701 | Glass coverslip |
| Digital Pressure Gauge | ITM Instruments Inc. | DG2551L0NAM02L0IM&V | Digital Pressure Gauge |
| Dr Mom Slimline Stainless LED Otoscope | Dr. Mom Otoscopes | 1001 | Otoscope |
| Ethyl Alchohol 95% Vol | Commercial Alcohols | P016EA95 | 95% ethanol |
| Fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | Scissors |
| Fisherbrand Colored Labeling Tape | Fisher Scientific | 1590110 | Labeling tape |
| Gast DOA-P704-AA High-Capacity Vacuum Pump | Cole-Parmer Canada Company | ZA-07061-40 | Vacuum pump |
| Hartman Hemostats | Fine Science Tools | 13003-10 | Hemostatic forceps |
| High Vacuum Grease | Dow Corning | DC976VF | Vacuum grease |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Isoflurane |
| LIDOcaine HCl Injection 1% 50 mg/5 mL | Teligent Canada | 0121AD01 | Lidocaine HCl 1% |
| Lung SurgiBoard | Luxidea, Inc. | IMCH-0001 | Designed for intravital microscopy of the lung |
| Mineral Oil | Teva Canada | 00485802 | Mineral oil |
| Mouse Endotracheal Intubation Kit | Kent Scientific Corporation | ETI-MSE | Intubation stand, anesthesia mask, 20 G endotracheal cannula, fibre optic cable |
| MST49 Fluorescence Microscope | Leica Microsystems | 10 450 022 | Fluorescence Microscope |
| N Plan L 20x/0.40 Long Working Distance Microscope Objective | Leica Microsystems | 566035 | 20x objective |
| Non-Woven Sponges 2" x 2" | AMD-Ritmed | A2101-CH | Gauze |
| Optixcare Eye Lube Plus | Aventix | 5914322 | Tear gel |
| Original Prusa i3 MK3S+ 3D Printer | Prusa Research | PRI-MK3S-KIT-ORG-PEI | 3D printer |
| Oxygen, Compressed | Linde Canada Inc. | Oxygen | |
| PrecisionGlide Needle 30 G x 1/2 (0.3 mm x 13 mm) | Becton, Dickinson and Company | 305106 | 30 G needle |
| Pyrex 5340-2L 5340 Filtering Flasks, 2000 mL | Cole-Parmer Canada Company | 5340-2L | Vacuum flask |
| Rhodamine 6 G | Sigma-Aldrich | 252433 | Rhodamine 6G |
| Secure Soft Cloth Medical Tape - 3" | Primed | PM5-630709 | Cloth tape |
| Silastic Medical Grade Tubing .040 in. ID x .085 in. OD | Dow Corning | 602-205 | 1.0 mm I.D. polyethylene tubing |
| Somnosuite Low-Flow Anesthesia System | Kent Scientific Corporation | SS-01, SS-04-module | Small rodent ventilator, Low-flow anesthesia system, Heating pad, Rectal temperature probe, Pulse oximeter |
| Tissue Forceps, 12.5cm long, Curved, 1 x 2 Teeth | World Precision Instruments | 501216 | Toothed forceps |
| Transpore Medical Tape, 1527-1, 1 in x 10 yd (2.5 cm x 9.1 m) | 3M | 7000002795 | Medical tape |
| Tubing,Clear,3/8 in Inside Dia. | Grainger Canada | USSZUSA-HT3314 | 1.0 cm I.D. polyethylene tubing |
| Whatman 6720-5002 50 mm In-Line Filters, PTFE, 0.2 µm | Cole-Parmer Canada Company | 6720-5002 | Inline 0.2µm filter |
References
- Alizadeh-Tabrizi, N., Hall, S., Lehmann, C. Intravital imaging of pulmonary immune response in inflammation and infection. Frontiers in Cell and Developmental Biology. 8, 620471(2021).
- Gaertner, M., et al. Toward a comprehensive interpretation of intravital microscopy images in studies of lung tissue dynamics. Journal of Biomedical Optics. 20 (6), 066009(2015).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Looney, M., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature Methods. 8 (2), 91-96 (2011).
- Bennewitz, M. F., Watkins, S. C., Sundda, P. Quantitative intravital two-photon excitation microscopy reveals absence of pulmonary vasoocclusion in unchallenged sickle cell disease mice. IntraVital. 3 (2), 29748(2014).
- Blueschke, G., et al. Automated measurement of microcirculatory blood flow velocity in pulmonary metastases of rats. Journal of Visualized Experiments: JoVE. (93), e51630(2014).
- Tabuchi, A., et al. Precapillary oxygenation contributes relevantly to gas exchange in the intact lung. American Journal of Respiratory and Critical Care Medicine. 188 (4), 474-481 (2013).
- Rodriguez-Tirado, C., et al. Long-term high-resolution intravital microscopy in the lung with a vacuum stabilized imaging window. Journal of Visualized Experiments: JoVE. (116), e54603(2016).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and Immunity. 82 (2), 864-872 (2014).
- Thanabalasuriar, A., Neupane, A. S., Wang, J., Krummel, M. F., Kubes, P. iNKT cell emigration out of the lung vasculature requires neutrophils and monocyte-derived dendritic cells in inflammation. Cell Reports. 16 (12), 3260-3272 (2016).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Tschernig, T., et al. Direct visualisation of microparticles in the living lung. Experimental and Toxicologic Pathology. 65 (6), 883-886 (2013).
- Mertens, M., et al. Alveolar dynamics in acute lung injury: Heterogeneous distension rather than cyclic opening and collapse. Critical Care Medicine. 37 (9), 2604-2611 (2009).
- Matuszak, J., Tabuchi, A., Kuebler, W. M. Ventilation and perfusion at the alveolar level: Insights from lung intravital microscopy. Frontiers in Physiology. 11, 291(2020).
- Margraf, A., et al. 6% Hydroxyethyl starch (HES 130/0.4) diminishes glycocalyx degradation and decreases vascular permeability during systemic and pulmonary inflammation in mice. Critical Care. 22 (1), 1-12 (2018).
- Roller, J., et al. Direct in vivo observations of P-selectin glycoprotein ligand-1-mediated leukocyte-endothelial cell interactions in the pulmonary microvasculature in abdominal sepsis in mice. Inflammation Research. 62 (3), 275-282 (2012).
- Marques, P., et al. Cigarette smoke increases endothelial CXCL16-leukocyte CXCR6 adhesion in vitro and in vivo. Potential consequences in chronic obstructive pulmonary disease. Frontiers in Immunology. 8, 1766(2017).
- Condon, M. R., Kim, J. E., Deitch, E. A., Machiedo, G. W., Spolarics, Z. Appearance of an erythrocyte population with decreased deformability and hemoglobin content following sepsis. American Journal of Physiology-Heart and Circulatory Physiology. 284 (6), 2177-2184 (2003).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: Relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Kim, Y. M., Jeong, S., Choe, Y. H., Hyun, Y. M. Two-photon intravital imaging of leukocyte migration during inflammation in the respiratory system. Acute and Critical Care. 34 (2), 101-107 (2019).
- Faust, N., Varas, F., Kelly, L. M., Heck, S., Graf, T. Insertion of enhanced green fluorescent protein into the lysozyme gene creates mice with green fluorescent granulocytes and macrophages. Blood. 96 (2), 719-726 (2000).
- Orthgiess, J., et al. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. European Journal of Immunology. 46 (6), 1529-1532 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Butt, Y., Kurdowska, A., Allen, T. C. Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine. 140 (4), 345-350 (2016).
- Park, I., et al. Neutrophils disturb pulmonary microcirculation in sepsis-induced acute lung injury. European Respiratory Journal. 53 (3), 1800786(2019).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American Journal of Respiratory Cell and Molecular Biology. 47 (6), 864-868 (2012).
- Pieper, M., Schulz-Hildebrandt, H., Mall, M. A., Hüttmann, G., König, P. Intravital microscopic optical coherence tomography imaging to assess mucus-mobilizing interventions for muco-obstructive lung disease in mice. American Journal of Physiology - Lung Cellular and Molecular Physiology. 318 (3), 518-524 (2020).
- Lamm, W. J. E., Bernard, S. L., Wiltz, W., Wagner, J., Glenny, R. W. Intravital microscopic observations of 15-µm microspheres lodging in the pulmonary microcirculation. Journal of Applied Physiology. 98 (6), 2242-2248 (2005).
- Entenberg, D., et al. A permanent window for the murine lung enables high-resolution imaging of cancer metastasis. Nature Methods. 15 (1), 73-80 (2018).
- Amato, M. B. P., et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. New England Journal of Medicine. 338 (6), 347-354 (2009).
- Looney, M. R., Bhattacharya, J. Live imaging of the lung. Annual Review of Physiology. 76, 431-445 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved