Method Article
Microscopía intravital de fluorescencia de campo ancho de la microcirculación pulmonar en la lesión pulmonar aguda experimental utilizando un sistema de imágenes estabilizado por vacío
En este artículo
Resumen
La microscopía de fluorescencia intravital se puede utilizar para estudiar las interacciones leucocitario-endotelial y la perfusión capilar en tiempo real. Este protocolo describe métodos para obtener imágenes y cuantificar estos parámetros en la microcirculación pulmonar utilizando un sistema de imágenes pulmonares estabilizadas por vacío.
Resumen
Las imágenes intravitales de las interacciones leucocitarios-endoteliales ofrecen información valiosa sobre la enfermedad inmunomediada en animales vivos. El estudio de la lesión pulmonar aguda (ALI) / síndrome de dificultad respiratoria aguda (SDRA) y otras patologías respiratorias in vivo es difícil debido a la accesibilidad limitada y los artefactos de movimiento inherentes de los pulmones. No obstante, se han desarrollado varios enfoques para superar estos desafíos. Este protocolo describe un método para la microscopía de fluorescencia intravital para estudiar las interacciones leucocitarios-endoteliales en tiempo real en la microcirculación pulmonar en un modelo experimental de ALI. Se utiliza un sistema de imágenes pulmonares in vivo y una plataforma de microscopía intravital impresa en 3D para asegurar el ratón anestesiado y estabilizar el pulmón al tiempo que minimiza la lesión pulmonar confusa. Después de la preparación, la microscopía de fluorescencia de campo ancho se utiliza para estudiar la adhesión de leucocitos, el laminado de leucocitos y la función capilar. Si bien el protocolo presentado aquí se centra en la obtención de imágenes en un modelo agudo de enfermedad pulmonar inflamatoria, también puede adaptarse para estudiar otros procesos patológicos y fisiológicos en el pulmón.
Introducción
La microscopía intravital (IVM) es una herramienta de imagen útil para visualizar y estudiar diversos procesos biofísicos in vivo. El pulmón es muy difícil de obtener imágenes in vivo debido a su ubicación cerrada, la naturaleza frágil de su tejido y los artefactos de movimiento inducidos por la respiración y los latidos del corazón 1,2. Se han desarrollado varias configuraciones de microscopía intravital (IVM) para obtener imágenes en tiempo real de las interacciones leucocitarios-endoteliales en la microcirculación pulmonar para superar estos desafíos. Tales enfoques se basan en exponer quirúrgicamente y estabilizar el pulmón para obtener imágenes.
Los animales generalmente se preparan para la IVM pulmonar mediante procedimientos quirúrgicos. En primer lugar, los animales son intubados y ventilados, lo que permite la escisión quirúrgica de una ventana torácica y las intervenciones posteriores para estabilizar el pulmón para la obtención de imágenes. Una técnica consiste en pegar el parénquima en una cubierta de vidrio3, un procedimiento que corre el riesgo de un trauma físico significativo en el tejido fotografiado. Más avanzada es la utilización de un sistema de vacío para estabilizar el pulmón bajo una ventana de vidrio4. Esta configuración facilita la adherencia suelta de la superficie pulmonar a la cubierta a través de un vacío reversible extendido sobre una gran área local y expande el pulmón al tiempo que limita el movimiento en las dimensiones x, y y z4. El vacío se aplica uniformemente a través de un canal que rodea el área de imagen de la configuración y tira del tejido hacia una región cónica poco profunda frente al cobertor de grado de imagen4. A través de esta ventana de visualización, la microcirculación pulmonar se puede estudiar utilizando varias modalidades de imágenes ópticas.
La IVM pulmonar permite la obtención de imágenes cuantitativas de una multitud de parámetros microcirculatorios. Estos incluyen mediciones como la velocidad y longitudde la pista de leucocitos 5, la velocidad del flujo de glóbulos rojos6 y la oxigenación7, las metástasis tumorales8, la distinción de las subpoblaciones de células inmunes 9,10,11, la visualización de micropartículas12, la dinámica alveolar 13,14, la permeabilidad vascular15 y la función capilar 16 . El enfoque aquí está en el reclutamiento de leucocitos y la función capilar. El inicio del reclutamiento de leucocitos en la microcirculación pulmonar implica interacciones transitorias de rodadura e interacciones adhesivas firmes entre leucocitos y células endoteliales, las cuales se incrementan en condiciones inflamatorias16,17. Típicamente, el laminado se cuantifica por el número de leucocitos que pasan por una línea de referencia definida por el operador, mientras que la adhesión se cuantifica por el número de leucocitos que están inmóviles en el endotelio16. La función capilar también puede verse afectada en estados inflamatorios, lo que a menudo resulta en una disminución de la perfusión. Esto se puede atribuir a varios factores, incluida una reducción de la deformabilidad de los glóbulos rojos18 y la expresión abigarrada de la NO sintasa inducible por las células endoteliales que resulta en una derivación patológica19. Por lo general, la longitud agregada de los capilares perfundidos por área se mide y se informa como densidad capilar funcional (FCD).
El estudio del reclutamiento de leucocitos en los pulmones en tiempo real requiere el etiquetado de objetivos biológicos con colorantes fluorescentes o anticuerpos marcados con fluorescentes20. Alternativamente, varias cepas de ratones transgénicos como los ratones de la proteína fluorescente M-green lisozima (LysM-GFP) se pueden utilizar para obtener imágenes de subconjuntos específicos de células inmunes como los neutrófilos21,22. Los leucocitos marcados con fluorescentes se pueden visualizar utilizando microscopía de fluorescencia de campo amplio, microscopía confocal o microscopía multifotónica. Estas técnicas logran el contraste mediante la utilización de longitudes de onda de excitación específicas y la detección de la fluorescencia emitida, al tiempo que bloquean la detección de la longitud de onda de excitación, destacando así el objeto etiquetado.
La investigación existente sobre la cuantificación del laminado de leucocitos, la adhesión y la densidad capilar funcional en el pulmón murino se ha basado principalmente en el análisis manual de video. Esto es posible gracias al software de código abierto como Fiji 6,23, el software propietario como CapImage12 o los sistemas de procesamiento de imágenes personalizados24. Por el contrario, varias plataformas de software propietario (por ejemplo, NIS Element, Imaris, Volocity, MetaMorph) permiten la medición automatizada de una amplia gama de otros parámetros fisiológicos, incluidos muchos de los mencionados anteriormente aquí 5,6,7,8,9,10,11,12,13,15.
Se han realizado observaciones importantes con respecto a la patología de la lesión pulmonar aguda (ALI) y el síndrome de dificultad respiratoria aguda (SDRA) utilizando la IVM pulmonar. El SDRA se caracteriza por una serie de procesos fisiopatológicos en el pulmón, incluyendo edema pulmonar y daño alveolar causado por la disfunción del endotelio y la barrera epitelial25. Utilizando un modelo murino, se ha encontrado que la ALI inducida por sepsis se asocia con cambios perjudiciales significativos en el tráfico de células inmunes en el entorno pulmonar26. Se encontró que los neutrófilos reclutados en los capilares de ratones con ALI inducida por sepsis impiden la microcirculación, lo que aumenta la hipoxia en ALI26. Además, la IVM se ha utilizado para obtener información sobre el mecanismo subyacente de reparación después de la aparición del SDRA27. La MIV pulmonar también ha sido una herramienta valiosa para comprender los cambios fisiopatológicos en diversas enfermedades pulmonares obstructivas. Por ejemplo, la visualización del transporte de moco en enfermedades como la fibrosis quística (FQ) y la enfermedad pulmonar obstructiva crónica (EPOC) ha facilitado el estudio de tratamientos novedosos y existentes para el aclaramiento mucoso28. También se ha analizado el tráfico de leucocitos en estas condiciones17.
Este protocolo amplía el enfoque descrito inicialmente por Lamm et al.29 para estudiar las interacciones leucocitarios-endoteliales mediante microscopía de fluorescencia convencional. Los procedimientos descritos emplean un sistema de imágenes pulmonares in vivo , que incluye una base metálica de 16,5 cm x 12,7 cm, un micromanipulador y una ventana de imágenes al vacío (Figura 1). El sistema está montado en una plataforma impresa en 3D de 20 cm x 23,5 cm (Archivo suplementario 1) para proporcionar una fijación segura para el tubo del ventilador y la almohadilla térmica. Este método ofrece imágenes reproducibles y cuantificables de la microcirculación pulmonar murina in vivo. Los aspectos importantes de la preparación quirúrgica, así como la utilización adecuada de un sistema de imágenes pulmonares estabilizadas al vacío se explican en detalle. Finalmente, se utiliza un modelo experimental de ALI para proporcionar imágenes representativas y análisis de la alteración del laminado de leucocitos, la adhesión leucocitaria y la perfusión capilar asociada con la inflamación. El uso de este protocolo debería facilitar otras investigaciones importantes sobre los cambios fisiopatológicos en la microcirculación pulmonar durante los estados de enfermedad aguda.
Protocolo
Todos los procedimientos descritos aquí se realizaron con la aprobación previa del Comité de Animales de Laboratorio de la Universidad de Dalhousie (UCLA).
1. Preparación
- Sistema de imágenes pulmonares: Para preparar la ventana, administre una capa delgada de grasa al vacío en la parte superior del anillo exterior mientras evita la contaminación del canal de vacío. Coloque una cubierta de vidrio limpia de 8 mm en la ventana y presione suavemente hacia abajo para crear un sello.
- Microscopio de fluorescencia de campo ancho: realice imágenes con un microscopio de fluorescencia de campo ancho convencional equipado con un objetivo de larga distancia de trabajo de 20x / 0.40 y una cámara de dispositivo de carga acoplada (CCD) en blanco y negro con una velocidad de fotogramas de 25 FPS. Aplique un filtro de excitación de paso de banda de 530-550 nm para excitar rhodamine-6G y un filtro de paso de banda de 460-490 nm para excitar el isotiocianato de fluoresceína (FITC).
- Sistema de vacío: Conecte la ventana de imagen a una bomba de vacío equipada con un manómetro digital capaz de proporcionar una succión constante de 50-60 mmHg, como se muestra en la Figura Suplementaria 1. En resumen, conecte la ventana de imagen a la bomba a través de tubos de polietileno I.D. de 1,0 mm, tubos de polietileno I.D. de 1,0 cm, un matraz de vacío y un filtro en línea de 0,2 μm.
- Ventilador: Configure un ventilador de roedor pequeño para proporcionar ventilación controlada por presión a una velocidad y volumen calculados en función del peso del ratón. Proporcione una presión positiva al final de la espiración (PEEP) a 5 cmH2O durante la duración del experimento y establezca la presión objetivo en 20 cmH2O.
- Anestésico: Utilizando un sistema de administración de anestesia de bajo flujo, prepare una jeringa de 5.0 ml con 99.9% de isoflurano. Use un sistema de eliminación de gases residuales para minimizar el riesgo de inhalación por parte del cirujano.
2. Anestesia
- Coloque un ratón macho C57Bl/6 de 20-25 g de 12 semanas de edad en la cámara de inducción de anestesia. Con la cámara bien cerrada, comience la inducción con gas isoflurano a una concentración del 3% y un caudal de 500 ml/min.
- Una vez que el ratón esté anestesiado (visualizado por la frecuencia respiratoria lenta), transfiéralo al soporte de intubación y asegure los incisivos superiores a la sutura colgante.
- Apriete la sutura para asegurar el hocico dentro del cono de la nariz. Comience el flujo de gas a través del cono de la nariz a una concentración del 2,5%.
- Confirme la profundidad adecuada de la anestesia mediante pellizco del dedo del pie antes de pasar al siguiente paso.
3. Intubación
- Gire el soporte de tal manera que la parte posterior del soporte y el lado dorsal del ratón miren hacia el cirujano.
- Pasar la punta de un cable de fibra óptica de 20 cm de longitud a través de una cánula endotraqueal de 20 G y sumergir la punta en Lidocaína HCl (1%) para facilitar el paso del cable a través de la laringe.
- Usando fórceps contundentes, levante la mandíbula inferior y desplace la lengua para proporcionar un paso claro hacia el tracto respiratorio.
- Inserte un otoscopio modificado (~ 60 ° de circunferencia del espéculo eliminado) de modo que los incisivos superiores quepan dentro del espacio en el espéculo. Ajuste el endoscopio y la posición de la lengua hasta que la epiglotis y las cuerdas vocales sean claramente visibles.
- Inserte el cable de fibra óptica cargado con la cánula endotraqueal a través del espacio en el espéculo y en la laringe. Usando pequeños movimientos circulares, pase el cable a través de las cuerdas vocales y hacia la tráquea.
- Empuje la cánula a lo largo del cable de fibra óptica, pasando entre las cuerdas vocales y hacia la tráquea.
4. Ventilación
- Recupere el ratón del soporte de intubación y colóquelo en una almohadilla térmica en la posición de decúbito lateral derecho.
- Conecte la cánula a los tubos del ventilador y encienda el ventilador. Reduzca la concentración de anestésico al 1,5% y controle la profundidad mediante la prueba del reflejo del pedal. Si el reflejo persiste, aumente la concentración incrementalmente hasta un 2%.
- Coloque gel lagrimal en los ojos del ratón para evitar que se seque.
- Con cinta adhesiva médica, asegure la cánula al hocico. Usando cinta de etiquetado, asegure la pata delantera derecha a la almohadilla térmica en, aproximadamente, la posición de las 9 en punto. Extienda la pata trasera izquierda caudalmente y asegure en, aproximadamente, la posición de las 6 en punto.
- Usando una cinta de tela, estire ligeramente la pata delantera izquierda hasta la posición de las 12 en punto y asegure el otro extremo de la cinta hasta la parte superior de la plataforma IVM como se muestra en la Figura 2A (mantener una ligera tensión aquí facilita la toracotomía posterior).
- Inserte una sonda de temperatura rectal y asegure la sonda pegándola con cinta adhesiva a la almohadilla térmica. Coloque un oxímetro de pulso en la pata trasera derecha y asegúrelo a la almohadilla térmica, teniendo cuidado de no interrumpir la circulación.
- Una vez que la temperatura esté estable a 37.0 °C ± 0.1 °C, proceda a realizar la toracotomía.
5. Toracotomía
- Esteriliza el tórax y el abdomen con una toallita con alcohol al 70%. Aplique una capa ligera de aceite mineral para humedecer el cabello en el lado izquierdo del ratón, desde el esternón hasta la columna vertebral y desde el hombro hasta la parte inferior de la caja torácica.
- Con pinzas romas y tijeras rectas, haga una pequeña incisión longitudinal cerca de la parte inferior de la caja torácica para exponer la capa muscular subyacente.
- Moviéndose ventralmente, use la disección contundente para separar el tejido epitelial y adiposo de la capa muscular. Cauterizar los vasos sanguíneos expuestos. Una vez mitigado el riesgo de pérdida de sangre, extienda la incisión original ventralmente hasta el proceso xifoide.
- Repita este proceso dorsalmente hasta ~5 mm lateral a la columna vertebral.
- Moviéndose cranealmente, use disección contundente para exponer la caja torácica. Cauterizar cualquier vaso sanguíneo expuesto para preservar la estabilidad hemodinámica.
- Una vez mitigado el riesgo de pérdida de sangre, extienda la incisión desde el proceso xifoide hasta la axila.
- Repita este proceso en el lado dorsal de la incisión hasta ~ 1 cm inferior a la oreja izquierda.
- Usando fórceps hemostáticos, agarre el tejido epitelial y adiposo diseccionado y colóquelo fuera del área quirúrgica (Figura 2B).
- Inyectar una solución de Rhodamine-6G (0,5 mg/mL; 1,5 mL/kg) para la visualización de leucocitos y FITC-albúmina bovina (50 mg/mL; 1 mL/kg) para la visualización de la perfusión capilar a través de la vena de la cola.
- Usando pinzas dentadas, agarre la costilla inmediatamente inferior a la posición de la base del pulmón en la inspiración final y retraiga ligeramente para alejar la costilla del pulmón. Corte la costilla para inducir un neumotórax.
- Extienda la incisión lateralmente a lo largo del músculo intercostal en ambas direcciones, teniendo cuidado de no tocar la superficie pulmonar expuesta.
- Usando fórceps contundentes, agarre la siguiente costilla más alta y retraiga ligeramente para permitir que el pulmón se caiga lejos de la pared torácica. Si el pulmón no se desprende, presione la pared torácica ligeramente contra el pulmón para hacer que el pulmón se adhiera a la pleura subyacente y, por lo tanto, se caiga más fácilmente.
- Continúe la incisión original ventralmente hasta el esternón y cranealmente hasta que el ápice del pulmón esté expuesto. Use aplicadores de algodón y gasas para atenuar cualquier sangrado que surja.
- Levante la caja torácica para exponer los vasos sanguíneos intercostales en el aspecto dorsal de la cavidad torácica. Teniendo cuidado de no dañar el pulmón, cauterice el vaso intercostal más inferior cerca de la columna vertebral y luego corte la costilla. Moviéndose craneal y ventralmente, repita hasta que se extirpe una porción de aproximadamente 1 cm x 1,5 cm de la caja torácica (Figura 2C).
- Elimine cualquier exceso de acumulación de líquido en la cavidad torácica a través de la acción capilar utilizando pequeñas tiras de gasa.
- Mientras se procede a la microscopía, permita ~ 5 minutos para que el líquido intrapleural se disipe para una interfaz más segura entre el pulmón y la ventana de imágenes.
6. Microscopía
- Encienda la bomba de vacío y ajuste la presión a ~50–60 mmHg.
- Transfiera la plataforma IVM a la etapa de microscopio. Coloque el poste de metal y el micromanipulador de modo que la ventana de imágenes esté directamente sobre el pulmón expuesto y el brazo de la ventana se acerque al pulmón desde, aproximadamente, la posición de las 3 en punto.
- Usando el micromanipulador, baje cuidadosamente la ventana de imágenes hasta que se adhiera y estabilice la superficie pulmonar (Figura 3A).
- Utilizando el objetivo 20x y el filtro de excitación de paso de banda de 460-490 nm, identifique una vénula pulmonar basada en el patrón convergente del flujo sanguíneo. Centra el buque en el campo de visión y graba 30 s de vídeo.
- Cambie al filtro de excitación de paso de banda de 530-550 nm y grabe 30 s de video en el mismo campo de visión.
- Repita el paso anterior hasta que se hayan tomado imágenes de cinco vénulas pulmonares.
- Utilizando el filtro de excitación de paso de banda de 460-490 nm, identifique una arteriola pulmonar basada en el patrón divergente del flujo sanguíneo. Centra el buque en el campo de visión y graba 30 s de vídeo.
- Cambie al filtro de excitación de paso de banda de 530-550 nm y grabe 30 s de video en el mismo campo de visión.
- Repita el paso anterior hasta que se hayan tomado imágenes de cinco arteriolas pulmonares.
- Usando el filtro de excitación de paso de banda de 460-490 nm, localice una región de alvéolos y capilares no intersectados por vasos más grandes y grabe 30 s de video.
- Cambie al filtro de excitación de paso de banda de 530-550 nm y grabe 30 s de video en el mismo campo de visión.
- Repita el paso anterior hasta que se hayan tomado imágenes de cinco regiones capilares.
7. Eutanasia y protocolo de limpieza
- Retire la plataforma IVM de la etapa de microscopio y ajuste la administración de isoflurano al 5% durante 5 minutos para sacrificar al ratón.
- Mientras espera, deseche el vidrio de la cubierta y desconecte la ventana de imágenes de la plataforma. Limpie la ventana de imágenes con un cepillo pequeño y use una jeringa de 30 G insertada en el canal para enjuagarla varias veces con agua destilada. Luego, enjuague con etanol al 95% usando la bomba de vacío.
- Después de que hayan transcurrido 5 minutos, detenga el ventilador y asegure la eutanasia completa a través de la dislocación cervical.
Resultados
Para ilustrar los resultados alcanzables a través de este protocolo, la lesión pulmonar aguda (ALI) se indujo 6 h antes de la obtención de imágenes utilizando un modelo de instilación de lipopolisacáridos bacterianos intranasales (LPS). Brevemente, los ratones (n = 3) fueron anestesiados con isoflurano, y pequeñas gotas de LPS de Pseudomonas aeruginosa en solución salina estéril (10 mg/ml) se pipetearon en el naris izquierdo a una dosis de 5 mg/kg. Esto se comparó con ratones ingenuos (n = 3; sin administración intranasal).
Tras la obtención de imágenes, una preparación quirúrgica exitosa es identificable por varios factores. El pulmón debe ser relativamente estable con respiración que cause desplazamientos de marco cíclicos no mayores de 25 μm. Los alvéolos deben ser claramente visibles y pueden exhibir distensión/contracción de marea. La excitación por luz azul (longitud de onda de 450-490 nm) permitirá la visualización de la direccionalidad del flujo sanguíneo, y puede ser posible distinguir los glóbulos rojos individuales (Película suplementaria 1, Película suplementaria 3 y Película suplementaria 5). Los leucocitos serán claramente identificables tras la excitación por luz verde (longitud de onda de 530-560 nm, Película suplementaria 2, Película suplementaria 4 y Película suplementaria 6). Después de completar la imagen y la extracción de la ventana de succión, puede haber moretones leves en la superficie pulmonar, aunque no dentro del área fotografiada, como se muestra en la Figura 3B.
Varios desafíos técnicos pueden interferir con la viabilidad experimental. La acumulación de sangre en la superficie pulmonar comprometerá la estabilización del vacío e incluso puede obstruir el canal. Para evitar esto, se debe tener extrema precaución durante cada paso quirúrgico. La presión de vacío excesivamente alta puede dañar el pulmón y afectar la microcirculación. Esto puede ser identificable por estasis alveolar o hematomas excesivos en la superficie pulmonar (Figura 3C) y se puede remediar reduciendo la presión de la bomba de vacío. Además, los errores en la inyección intravenosa de fluoróforos pueden conducir a una mala visualización del tráfico de leucocitos y el flujo sanguíneo.
Después de completar el protocolo, se realizó un análisis manual ciego utilizando Fiji21 de una manera adaptada de la literatura anterior28. Se analizaron cinco vénulas, arteriolas y regiones capilares de interés (ROI) de cada animal. La adhesión leucocitaria en vénulas y arteriolas se definió como el número de células que permanecen adheridas al endotelio vascular durante 30 s de observación por área de superficie endotelial. Esto se transmite en celdas/mm2. La adhesión leucocitaria en capilares se definió como el número de células dentro del ROI que permanecen adheridas al endotelio vascular durante 30 s de observación por área total analizada. Esto también se transmite en celdas/mm2. El balanceo leucocitario se definió como el doble del número de células que pasan por un punto de referencia en el vaso durante el período de observación de los 30 años. Los leucocitos de flujo libre se excluyeron comparando la velocidad de paso con la del flujo de glóbulos rojos, y esto se transmite en células / min. Para medir la perfusión microcirculatoria, la FCD se definió como la suma de las longitudes de los capilares perfundidos con glóbulos rojos por área de observación. Esto se transmite en cm/cm2. Cada parámetro se informa como un valor medio para cada animal.
Se observó una tendencia común de reclutamiento de leucocitos en vénulas pulmonares, con aumento de la adhesión y el balanceo en ratones tratados con LPS versus ingenuos (Figuras 4C, D). Esta tendencia fue recapitulada por la adhesión leucocitaria arteriolar, aunque tanto los niveles de laminación como los de adhesión fueron muy variables en el grupo ingenuo (Figuras 5C,D). En particular, la administración de LPS resultó en un aumento sustancial en la adhesión de leucocitos en el ROI capilar pulmonar (Figura 6C). Los ratones LPS también demostraron una FCD reducida frente a ratones ingenuos (Figura 7C). Estos efectos dentro de los capilares pulmonares son consistentes con la literatura previa que identifica aumentos en las células inmunes por campo de visión y alteración de la perfusión capilar normal después de diversos estímulos inflamatorios 4,5,16.

Figura 1: Sistema de imágenes pulmonares. El sistema de pedido personalizado incluye (1) una base de metal anodizado, (2) ventana de imágenes, (3) entrada de vacío, (4) micromanipulador. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Preparación quirúrgica. (A) El ratón está asegurado a la plataforma IVM en la posición de decúbito lateral derecho. (B) La caja torácica se expone mediante disección contundente para preservar la hemodinámica. (C) La toracotomía se realiza para exponer el pulmón izquierdo. Haga clic aquí para ver una versión más grande de esta figura.
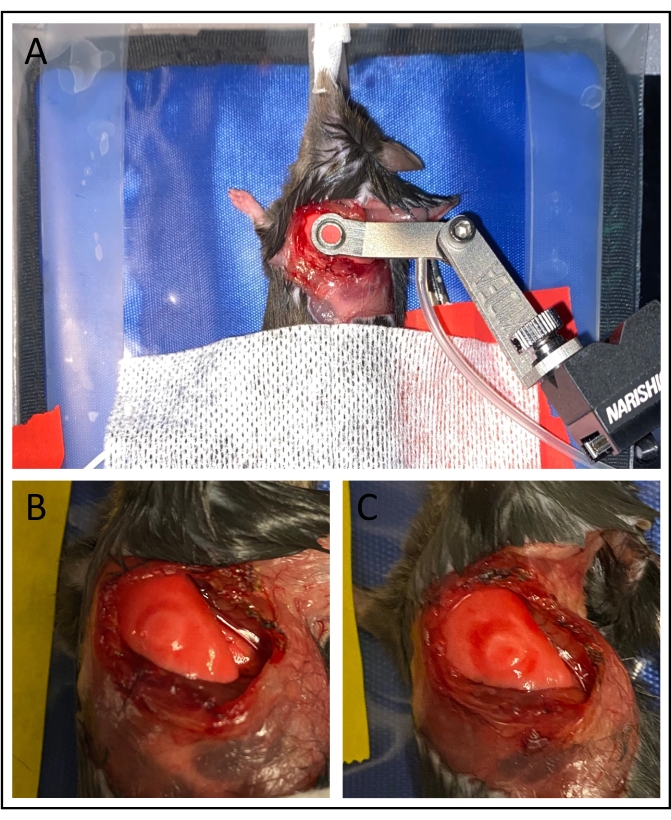
Figura 3: Estabilización al vacío. (A) La aplicación de la ventana de imágenes al vacío estabiliza la superficie pulmonar. (B) La utilización de presiones de vacío por debajo de 75 mmHg minimiza el daño al pulmón, particularmente dentro del área fotografiada. (C) Las presiones de vacío más altas pueden causar hematomas significativos. Haga clic aquí para ver una versión más grande de esta figura.
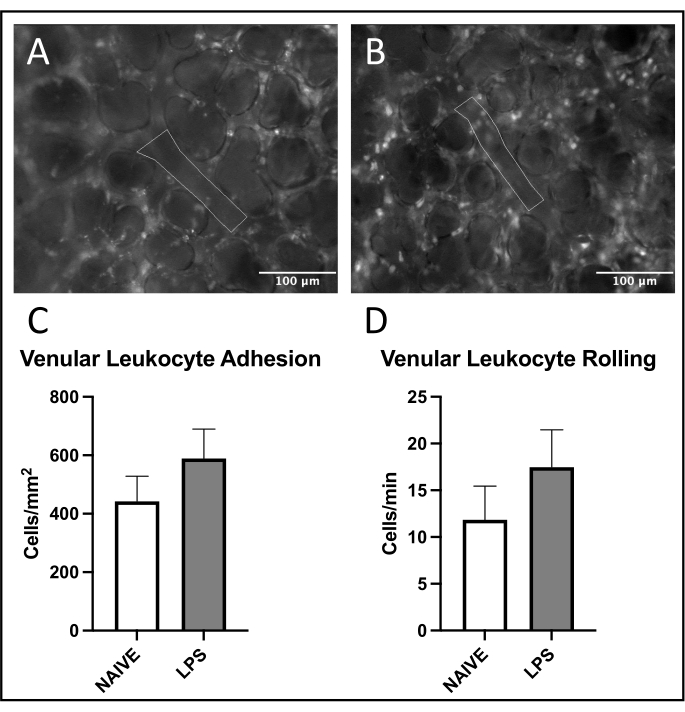
Figura 4: Tráfico de leucocitos en vénulas pulmonares. La excitación de la rodamina 6G permite la visualización de leucocitos adherentes y rodantes. Las áreas delineadas representan porciones analizadas de endotelio vascular confirmadas por la excitación de FITC-albúmina en ratones (A) ingenuos y (B) tratados con LPS. (C,D) La administración intranasal de LPS afecta el balanceo y la adhesión de leucocitos en las vénulas pulmonares. Los valores se indican como media ± SD. Haga clic aquí para ver una versión más grande de esta figura.
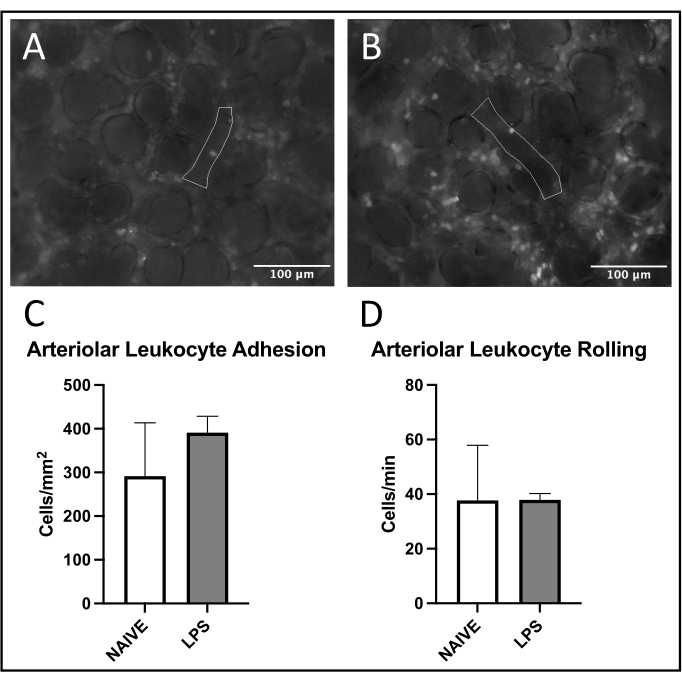
Figura 5: Tráfico de leucocitos en arteriolas pulmonares. La excitación de la rodamina 6G permite la visualización de leucocitos adherentes y rodantes. Las áreas delineadas representan porciones analizadas de endotelio vascular confirmadas por la excitación de FITC-albúmina en ratones (A) ingenuos y (B) tratados con LPS. (C,D) La administración intranasal de LPS afecta el balanceo y la adhesión de los leucocitos en las arteriolas pulmonares. Los valores se indican como media ± SD. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Leucocitos adherentes en capilares pulmonares. La excitación de la rodamina 6G permite la visualización de leucocitos dentro de los ROI en ratones (A) ingenuos y (B) tratados con LPS. (C) La administración intranasal de LPS afecta la adhesión de leucocitos en ratones tratados con LPS. Los valores se indican como media ± SD. Haga clic aquí para ver una versión más grande de esta figura.
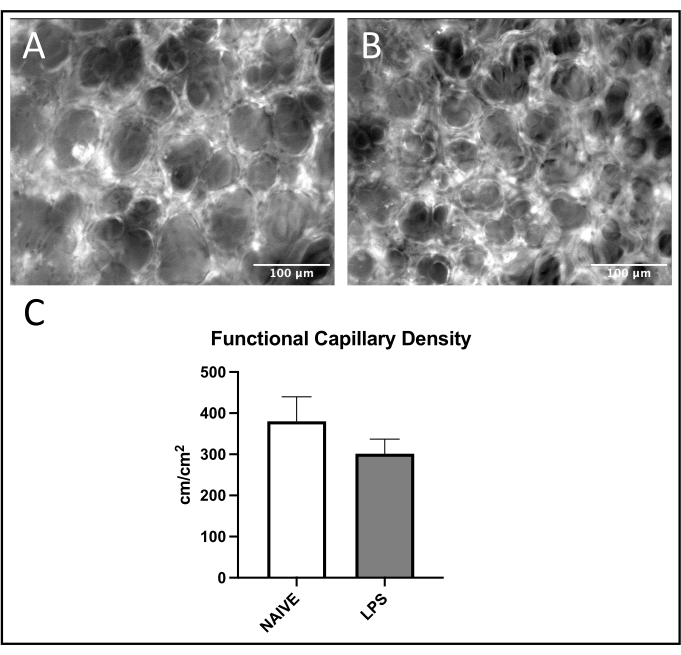
Figura 7: Función capilar pulmonar. La excitación de FITC-albúmina permite la visualización del flujo sanguíneo capilar dentro de los ROI en ratones (A) ingenuos y (B) tratados con LPS. (C) La administración intranasal de LPS afecta la FCD en los capilares pulmonares. Los valores se indican como media ± SD. Haga clic aquí para ver una versión más grande de esta figura.
Archivo suplementario: Archivo para plataforma IVM imprimible en 3D. Haga clic aquí para descargar este archivo.
Figura suplementaria 1: Diagrama del sistema de vacío. Haga clic aquí para descargar este archivo.
Película suplementaria 1: Video de muestra del flujo sanguíneo en la vénula pulmonar. La flecha verde denota la dirección del flujo sanguíneo. Haga clic aquí para descargar esta película.
Película suplementaria 2: Video de muestra del tráfico de leucocitos en la vénula pulmonar. Las flechas rojas denotan leucocitos adherentes dentro del vaso. Haga clic aquí para descargar esta película.
Película suplementaria 3: Video de muestra del flujo sanguíneo en la arteriola pulmonar. La flecha verde denota la dirección del flujo sanguíneo. Haga clic aquí para descargar esta película.
Película suplementaria 4: Video de muestra del tráfico de leucocitos en la arteriola pulmonar. Las flechas rojas denotan leucocitos adherentes dentro de un vaso. Haga clic aquí para descargar esta película.
Película suplementaria 5: Video de muestra del flujo sanguíneo en los capilares pulmonares. Las flechas verdes denotan varias áreas bien visualizadas de capilares perfundidos con glóbulos rojos. Haga clic aquí para descargar esta película.
Película suplementaria 6: Video de muestra del tráfico de leucocitos en capilares pulmonares. Las flechas rojas denotan leucocitos adherentes dentro del campo de visión. Haga clic aquí para descargar esta película.
Discusión
El protocolo presentado aquí requiere práctica y atención a algunos pasos críticos. Primero, es importante preparar la ventana de imágenes antes de iniciar la intubación y la cirugía. Use una cantidad mínima de grasa al vacío para recubrir el anillo exterior de la ventana de imágenes, aplique el vidrio de la cubierta y pruebe la succión con una gota de agua destilada. Preparar esto con anticipación evitará que el pulmón expuesto se seque durante la configuración, de lo contrario. Si bien es posible enjuagar con solución salina tibia, hacerlo puede correr el riesgo de dañar el frágil tejido pulmonar.
Después de la intubación, mientras se transfiere el ratón a la plataforma IVM, la cánula puede desplazarse ocasionalmente. Para evitar esto, considere atar la cánula a los dientes frontales del ratón o suturarla a la piel alrededor de su boca. Si se utiliza ventilación controlada por presión, el volumen corriente debe controlarse cuidadosamente durante todo el procedimiento. Debe permanecer estable a aproximadamente 0,20 ml, ya que valores significativamente más bajos (por ejemplo, ~ 0,10 ml) pueden indicar ventilación pulmonar única. Si esto ocurre, la retracción ligera de la cánula endotraqueal puede resolver el problema. El uso de anestesia inhalante (isoflurano) facilita el control de la profundidad anestésica mientras el ratón está ventilado. Otros medios de anestesia (por ejemplo, ketamina intravenosa/xilazina10,11) han sido empleados por otros laboratorios, y cada uno tiene sus respectivas ventajas e inconvenientes.
Durante la cirugía, se emplea la disección contundente para minimizar el riesgo de cortar los vasos sanguíneos. Esto es de particular importancia cuando se disecciona el tejido adiposo grueso y muy vascularizado cerca del hombro. La resección de la caja torácica requiere velocidad y precisión. El calor del cauterizador es lo suficientemente intenso como para quemar el pulmón si se usa en exceso. Al resecar la caja torácica, debe haber espacio vacío entre el pulmón y la pared torácica. Si el pulmón se adhiere a la pared torácica, presionar ligeramente hacia abajo en el exterior de la caja torácica fomentará la adhesión a la pleura parietal subyacente. Alternativamente, use una aguja roma para inyectar una pequeña cantidad de solución salina tibia entre el pulmón y la caja torácica para facilitar la liberación. Se recomienda colocar el brazo de la ventana en la posición de las 3 en punto para evitar la presión no deseada en las costillas durante la toma de imágenes (Figura 3A). También dejará más espacio libre entre el micromanipulador y el objetivo del microscopio, lo que facilitará el acceso a las manipulaciones. Al bajar la ventana de imágenes, es fundamental apuntar a la región central del pulmón, ya que el contacto con el borde dará como resultado un sello inadecuado y un artefacto de movimiento excesivo durante la toma de imágenes. Además, los múltiples intentos de bajar la ventana pueden dañar el pulmón. Del mismo modo, los ciclos de desprendimiento y reestabilización contribuirán a la lesión pulmonar y pueden comprometer la precisión experimental. Sin embargo, cuando se realiza correctamente, la preparación presentada aquí es lo suficientemente estable como para permitir imágenes intravitales de alta resolución con un objetivo de 20x.
Es necesario un protocolo de limpieza riguroso para evitar la contaminación y el bloqueo del canal de vacío dentro de la ventana de imágenes. El uso de una aguja de 30 G inmediatamente después de los experimentos para enjuagar repetidamente con agua destilada es efectivo para eliminar la mayoría de los contaminantes. Esto es seguido por un lavado con etanol concentrado y un lavado final con agua destilada antes de volver a unirse a la línea de vacío para eliminar la humedad. El uso de acetona o detergentes fuertes puede ser adecuado para resolver bloqueos graves, en caso de que ocurran.
En particular, este protocolo emplea una lectura más alta de la presión de vacío en comparación con algunos otros métodos informados 4,11, y esto puede plantear preocupaciones de daño al tejido pulmonar. Una distinción importante, sin embargo, es que el medidor digital utilizado aquí mide la presión solo en la bomba de vacío. Esta presión se administra a través de tubos estrechos y el canal extremadamente estrecho de la ventana de imágenes antes de la distribución en un área de superficie más grande del pulmón. Como tal, no se observó evidencia de daño a la región fotografiada en estos experimentos después de las sesiones intravitales. Además, los alvéolos fotografiados exhibieron distensión y contracción de marea, lo que indica que este fenómeno fisiológico no se interrumpió significativamente.
A pesar de la creciente popularidad de la IVM pulmonar como una herramienta para estudiar la enfermedad in vivo, existen limitaciones para esta técnica. En primer lugar, la naturaleza invasiva y terminal de la cirugía induce un efecto no despreciable en el estado fisiológico del ratón y limita el procedimiento a una sola sesión de imágenes. Sin embargo, cabe destacar que se han desarrollado varios abordajes longitudinales de la IVM pulmonar30. En segundo lugar, el uso de ventilación mecánica puede inducir un grado de lesión pulmonar asociada al ventilador (VALI)31, aunque esto está limitado por la corta duración del procedimiento. En tercer lugar, el contacto entre la pleura visceral y la cubierta de vidrio y la aplicación de presión de vacío pueden provocar alteraciones en el flujo sanguíneo microvascular. Finalmente, quizás la limitación más significativa de este abordaje es que la imagen se restringe a los alvéolos subpleurales en regiones pulmonares no dependientes, que no son representativas de todo el pulmón32.
En resumen, este protocolo se puede utilizar para estudiar las interacciones leucocitario-endotelial en la microvasculatura pulmonar mediante microscopía de fluorescencia intravital. Si bien estos experimentos emplean lesión pulmonar inducida por endotoxinas, un modelo agudo que se seleccionó en base a investigaciones anteriores, este protocolo también puede adaptarse para estudiar otros procesos patológicos y fisiológicos en el pulmón. Además, el sistema de imágenes pulmonares empleado aquí es aplicable a una variedad de enfoques de microscopía, y la ventana de imágenes es lo suficientemente grande como para acomodar objetivos de inmersión en aceite de alta apertura numérica. Por lo tanto, los procedimientos descritos deberían facilitar una mayor investigación sobre el impacto de varios estados de enfermedad en la microcirculación pulmonar.
Divulgaciones
Kamala D. Patel es la presidenta y cofundadora de Luxidea, la empresa a la que se compró la ventana de imágenes utilizada en este experimento.
Agradecimientos
Los autores desean agradecer al Dr. Pina Colarusso, quien proporcionó una experiencia significativa en la edición y revisión de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL BD Luer Slip Tip Syringe sterile, single use | Becton, Dickinson and Company | 309659 | 1 mL syringe |
| ADSON Dressing Forceps, Tip width 0.6 mm, teeth length 11.5 mm, 12 cm | RWD Life Science Co. | F12002-12 | Blunt forceps |
| Albumin-Fluorescein Isothiocyanate | Sigma-Aldrich | A9771-1G | FITC-albumin |
| Alcohol Swab Isopropyl Alcohol 70% v/v | Canadian Custom Packaging Company | 80002455 | Alcohol wipe |
| AVDC110 Advanced Digital Video Converter | Canopus | 00631069602029 | Digital video converter |
| B/W - CCD - Camera | Horn Imaging | BC-71 | Camera |
| Bovie Deluxe High Temperature Cautery Kit | Fine Science Tools | 18010-00 | Cauterizer |
| C57BL/6 Mice | Charles River Laboratories International | C57BL/6NCrl | C57BL/6 Mice |
| Cotton Tipped Applicators | Puritan | 806-WC | Cotton applicator |
| CS-8R 8mm Round Glass Coverslip | Warner Instruments | 64-0701 | Glass coverslip |
| Digital Pressure Gauge | ITM Instruments Inc. | DG2551L0NAM02L0IM&V | Digital Pressure Gauge |
| Dr Mom Slimline Stainless LED Otoscope | Dr. Mom Otoscopes | 1001 | Otoscope |
| Ethyl Alchohol 95% Vol | Commercial Alcohols | P016EA95 | 95% ethanol |
| Fine Scissors - Martensitic Stainless Steel | Fine Science Tools | 14094-11 | Scissors |
| Fisherbrand Colored Labeling Tape | Fisher Scientific | 1590110 | Labeling tape |
| Gast DOA-P704-AA High-Capacity Vacuum Pump | Cole-Parmer Canada Company | ZA-07061-40 | Vacuum pump |
| Hartman Hemostats | Fine Science Tools | 13003-10 | Hemostatic forceps |
| High Vacuum Grease | Dow Corning | DC976VF | Vacuum grease |
| Isoflurane USP | Fresenius Kabi | CP0406V2 | Isoflurane |
| LIDOcaine HCl Injection 1% 50 mg/5 mL | Teligent Canada | 0121AD01 | Lidocaine HCl 1% |
| Lung SurgiBoard | Luxidea, Inc. | IMCH-0001 | Designed for intravital microscopy of the lung |
| Mineral Oil | Teva Canada | 00485802 | Mineral oil |
| Mouse Endotracheal Intubation Kit | Kent Scientific Corporation | ETI-MSE | Intubation stand, anesthesia mask, 20 G endotracheal cannula, fibre optic cable |
| MST49 Fluorescence Microscope | Leica Microsystems | 10 450 022 | Fluorescence Microscope |
| N Plan L 20x/0.40 Long Working Distance Microscope Objective | Leica Microsystems | 566035 | 20x objective |
| Non-Woven Sponges 2" x 2" | AMD-Ritmed | A2101-CH | Gauze |
| Optixcare Eye Lube Plus | Aventix | 5914322 | Tear gel |
| Original Prusa i3 MK3S+ 3D Printer | Prusa Research | PRI-MK3S-KIT-ORG-PEI | 3D printer |
| Oxygen, Compressed | Linde Canada Inc. | Oxygen | |
| PrecisionGlide Needle 30 G x 1/2 (0.3 mm x 13 mm) | Becton, Dickinson and Company | 305106 | 30 G needle |
| Pyrex 5340-2L 5340 Filtering Flasks, 2000 mL | Cole-Parmer Canada Company | 5340-2L | Vacuum flask |
| Rhodamine 6 G | Sigma-Aldrich | 252433 | Rhodamine 6G |
| Secure Soft Cloth Medical Tape - 3" | Primed | PM5-630709 | Cloth tape |
| Silastic Medical Grade Tubing .040 in. ID x .085 in. OD | Dow Corning | 602-205 | 1.0 mm I.D. polyethylene tubing |
| Somnosuite Low-Flow Anesthesia System | Kent Scientific Corporation | SS-01, SS-04-module | Small rodent ventilator, Low-flow anesthesia system, Heating pad, Rectal temperature probe, Pulse oximeter |
| Tissue Forceps, 12.5cm long, Curved, 1 x 2 Teeth | World Precision Instruments | 501216 | Toothed forceps |
| Transpore Medical Tape, 1527-1, 1 in x 10 yd (2.5 cm x 9.1 m) | 3M | 7000002795 | Medical tape |
| Tubing,Clear,3/8 in Inside Dia. | Grainger Canada | USSZUSA-HT3314 | 1.0 cm I.D. polyethylene tubing |
| Whatman 6720-5002 50 mm In-Line Filters, PTFE, 0.2 µm | Cole-Parmer Canada Company | 6720-5002 | Inline 0.2µm filter |
Referencias
- Alizadeh-Tabrizi, N., Hall, S., Lehmann, C. Intravital imaging of pulmonary immune response in inflammation and infection. Frontiers in Cell and Developmental Biology. 8, 620471(2021).
- Gaertner, M., et al. Toward a comprehensive interpretation of intravital microscopy images in studies of lung tissue dynamics. Journal of Biomedical Optics. 20 (6), 066009(2015).
- Kreisel, D., et al. In vivo two-photon imaging reveals monocyte-dependent neutrophil extravasation during pulmonary inflammation. Proceedings of the National Academy of Sciences of the United States of America. 107 (42), 18073-18078 (2010).
- Looney, M., et al. Stabilized imaging of immune surveillance in the mouse lung. Nature Methods. 8 (2), 91-96 (2011).
- Bennewitz, M. F., Watkins, S. C., Sundda, P. Quantitative intravital two-photon excitation microscopy reveals absence of pulmonary vasoocclusion in unchallenged sickle cell disease mice. IntraVital. 3 (2), 29748(2014).
- Blueschke, G., et al. Automated measurement of microcirculatory blood flow velocity in pulmonary metastases of rats. Journal of Visualized Experiments: JoVE. (93), e51630(2014).
- Tabuchi, A., et al. Precapillary oxygenation contributes relevantly to gas exchange in the intact lung. American Journal of Respiratory and Critical Care Medicine. 188 (4), 474-481 (2013).
- Rodriguez-Tirado, C., et al. Long-term high-resolution intravital microscopy in the lung with a vacuum stabilized imaging window. Journal of Visualized Experiments: JoVE. (116), e54603(2016).
- Fiole, D., et al. Two-photon intravital imaging of lungs during anthrax infection reveals long-lasting macrophage-dendritic cell contacts. Infection and Immunity. 82 (2), 864-872 (2014).
- Thanabalasuriar, A., Neupane, A. S., Wang, J., Krummel, M. F., Kubes, P. iNKT cell emigration out of the lung vasculature requires neutrophils and monocyte-derived dendritic cells in inflammation. Cell Reports. 16 (12), 3260-3272 (2016).
- Neupane, A. S., et al. Patrolling alveolar macrophages conceal bacteria from the immune system to maintain homeostasis. Cell. 183 (1), 110-125 (2020).
- Tschernig, T., et al. Direct visualisation of microparticles in the living lung. Experimental and Toxicologic Pathology. 65 (6), 883-886 (2013).
- Mertens, M., et al. Alveolar dynamics in acute lung injury: Heterogeneous distension rather than cyclic opening and collapse. Critical Care Medicine. 37 (9), 2604-2611 (2009).
- Matuszak, J., Tabuchi, A., Kuebler, W. M. Ventilation and perfusion at the alveolar level: Insights from lung intravital microscopy. Frontiers in Physiology. 11, 291(2020).
- Margraf, A., et al. 6% Hydroxyethyl starch (HES 130/0.4) diminishes glycocalyx degradation and decreases vascular permeability during systemic and pulmonary inflammation in mice. Critical Care. 22 (1), 1-12 (2018).
- Roller, J., et al. Direct in vivo observations of P-selectin glycoprotein ligand-1-mediated leukocyte-endothelial cell interactions in the pulmonary microvasculature in abdominal sepsis in mice. Inflammation Research. 62 (3), 275-282 (2012).
- Marques, P., et al. Cigarette smoke increases endothelial CXCL16-leukocyte CXCR6 adhesion in vitro and in vivo. Potential consequences in chronic obstructive pulmonary disease. Frontiers in Immunology. 8, 1766(2017).
- Condon, M. R., Kim, J. E., Deitch, E. A., Machiedo, G. W., Spolarics, Z. Appearance of an erythrocyte population with decreased deformability and hemoglobin content following sepsis. American Journal of Physiology-Heart and Circulatory Physiology. 284 (6), 2177-2184 (2003).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: Relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Kim, Y. M., Jeong, S., Choe, Y. H., Hyun, Y. M. Two-photon intravital imaging of leukocyte migration during inflammation in the respiratory system. Acute and Critical Care. 34 (2), 101-107 (2019).
- Faust, N., Varas, F., Kelly, L. M., Heck, S., Graf, T. Insertion of enhanced green fluorescent protein into the lysozyme gene creates mice with green fluorescent granulocytes and macrophages. Blood. 96 (2), 719-726 (2000).
- Orthgiess, J., et al. Neurons exhibit Lyz2 promoter activity in vivo: Implications for using LysM-Cre mice in myeloid cell research. European Journal of Immunology. 46 (6), 1529-1532 (2016).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. Journal of Applied Physiology. 104 (2), 338-346 (2008).
- Butt, Y., Kurdowska, A., Allen, T. C. Acute lung injury: A clinical and molecular review. Archives of Pathology and Laboratory Medicine. 140 (4), 345-350 (2016).
- Park, I., et al. Neutrophils disturb pulmonary microcirculation in sepsis-induced acute lung injury. European Respiratory Journal. 53 (3), 1800786(2019).
- Kim, J. K., et al. In vivo imaging of tracheal epithelial cells in mice during airway regeneration. American Journal of Respiratory Cell and Molecular Biology. 47 (6), 864-868 (2012).
- Pieper, M., Schulz-Hildebrandt, H., Mall, M. A., Hüttmann, G., König, P. Intravital microscopic optical coherence tomography imaging to assess mucus-mobilizing interventions for muco-obstructive lung disease in mice. American Journal of Physiology - Lung Cellular and Molecular Physiology. 318 (3), 518-524 (2020).
- Lamm, W. J. E., Bernard, S. L., Wiltz, W., Wagner, J., Glenny, R. W. Intravital microscopic observations of 15-µm microspheres lodging in the pulmonary microcirculation. Journal of Applied Physiology. 98 (6), 2242-2248 (2005).
- Entenberg, D., et al. A permanent window for the murine lung enables high-resolution imaging of cancer metastasis. Nature Methods. 15 (1), 73-80 (2018).
- Amato, M. B. P., et al. Effect of a protective-ventilation strategy on mortality in the acute respiratory distress syndrome. New England Journal of Medicine. 338 (6), 347-354 (2009).
- Looney, M. R., Bhattacharya, J. Live imaging of the lung. Annual Review of Physiology. 76, 431-445 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados