Method Article
Sıçanlarda Omurilik Sıkışmasının Neden Olduğu Bir Nöronal Apoptoz Modeli
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, bir sıçan omurilik kompresyon modeli oluşturmak, davranışsal skorunu değerlendirmek ve sıkıştırılmış omurilik bölgesini gözlemlemek için bir protokol sunuyoruz. Davranışsal değerlendirmeler monitör motor özürlülüğünün azaldığını gösterdi. Hematoksilen ve eozin boyaması ve immün boyama, omuriliğin basılmış bölgesinde önemli nöronal apoptozu ortaya çıkardı.
Özet
Ciddi ilerleyici bir dejeneratif hastalık olan servikal spondilotik miyelopati (CSM) kötü bir prognoza sahiptir ve fiziksel ağrı, sertlik, motor veya duyusal disfonksiyon ve yüksek omurilik yaralanması ve akroparaliz riski ile ilişkilidir. Bu nedenle, bu kronik ve ilerleyici hastalıkta verimli omurilik rejenerasyonunu destekleyen terapötik stratejilere acilen ihtiyaç vardır. CSM'nin altında yatan karmaşık biyolojik mekanizmayı anlamak için etkili ve tekrarlanabilir hayvan omuriliği kompresyon modelleri gereklidir. Çoğu omurilik yaralanması modeli akut ve yapısal yıkıcı durumları yansıtırken, CSM'nin hayvan modelleri omurilikte kronik bir kompresyon gösterir. Bu makale, davranışsal skorun değerlendirilmesi ve sıkıştırılmış omurilik bölgesinin gözlemlenmesiyle daha fazla değerlendirilen bir sıçan omurilik kompresyon modeli oluşturmak için bir protokol sunmaktadır. Davranışsal değerlendirmeler, eklem hareketleri, adım atma yeteneği, koordinasyon, gövde stabilitesi ve uzuv kas gücü dahil olmak üzere monitör motor sakatlığının azaldığını gösterdi. Hematoksilen ve eozin (H&E) boyaması ve immün boyama, omuriliğin sıkışmış bölgesinde önemli nöronal apoptozu ortaya çıkardı.
Giriş
Yaygın bir ilerleyici dejeneratif hastalık olan CSM, tüm servikal spondilozların %5-10'unu oluşturur1. CSM'den muzdarip hastalar semptomlarını görmezden gelir ve bunları zamanında ve etkili bir şekilde tedavi etmezlerse, bu durum omurilik yaralanması ve uzuv felci gibi yaşlanmayla birlikte kötüleşecek ciddi komplikasyonlara yol açarak hastalar ve aileleri için önemli bir ekonomik ve zihinsel yük oluşturabilir 2,3. CSM'nin patogenezi karmaşıktır, statik ve dinamik faktörleri, hipoksi-iskemi teorisini, endotel hücre hasarını, kan omurilik bariyeri yıkım teorisini ve inflamasyon ve apoptoz teorisini içerir 4,5,6,7.
Omuriliğe basının statik ve dinamik mekanizmaları klinik belirtilere neden olur. Çıkıntılı omur diskleri, deforme olmuş omur gövdeleri ve kalsifiye ligamentler, uzun süreli omurilik sıkışmasına neden olabilir, bu da kan-omurilik bariyerini ve omurilikteki lokal mikrovaskülatürü kademeli olarak etkileyecektir 4,8. Buna karşılık, iskemi, iltihaplanma ve apoptoz nöronları, aksonları ve glial hücrelerietkiler 6,9.
Omurilik yaralanmasının deneysel hayvan modelleri arasında kontüzif yaralanma, kompresyon yaralanması, traksiyon yaralanması, fotokimyasal kaynaklı yaralanma ve iskemi-reperfüzyon yaralanması bulunur. Bu modellerin çoğu aynı zamanda bazı akut ve yapısal yıkıcı koşulları (transeksiyon veya kimyasal toksisite) yansıtır. Bununla birlikte, CSM'nin bu hayvan modelleri omurilikte ilerleyici nöronal apoptoz gösteremez.
Bu makale, davranışsal skoru değerlendirerek ve omuriliğin sıkıştırılmış bölgesini gözlemleyerek daha fazla değerlendirilen bir sıçan omurilik kompresyon modeli oluşturmak için ayrıntılı bir protokolü açıklamaktadır. Bu sıçan omurilik kompresyon modeli, CSM'de yer alan mekanizmaların daha fazla araştırılması için güvenilir bir hayvan modelidir.
Protokol
Aşağıdaki prosedür, Şanghay Geleneksel Çin Tıbbı Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi'nin (IACUC) onayı ile gerçekleştirildi. Tüm sağkalım ameliyatları, NIH kılavuzlarında belirtildiği gibi steril koşullar altında gerçekleştirildi. Ağrı ve enfeksiyon riski, başarılı bir sonuç elde etmek için uygun analjezikler ve antibiyotiklerle yönetildi. Bu cerrahi prosedür, 12 haftalık ve 400 g ağırlığındaki Sprague-Dawley (SD) soylu erkek sıçanlar için optimize edilmiştir.
1. PVA-poliakrilamid hidrojel hazırlama
NOT: Şekil 1G, 1H'de gösterildiği gibi, PVA-poliakrilamid hidrojel su emici bir polimer levhadır. Doğal durumda, jelin küçük parçalara ayrılması son derece zordur. Hazırlık aşağıdaki gibi tarif edilmiştir.
- Hidrasyondan sonra kesmeyi kolaylaştırmak için bir PVA-poliakrilamid hidrojeli 24 saat suya koyun.
- Tüm hidrojeli 1 mm x 2 mm x 2 mm boyutlarında parçalara bölmek için kendi kendine yapılan bir kesme aleti (Şekil 2H) kullanın.
- Bu hidrojel parçalarını, implantasyon malzemeleri olarak 1 mm x 1 mm x 1 mm'lik küçük parçalar halinde dehidrasyon için 12 saat boyunca 60 °C'de bir fırına aktarın.
2. Anestezi ve hazırlık
NOT: Steril cerrahi süreç boyunca cerrahi başlık, tek kullanımlık tıbbi maske ve steril cerrahi eldiven taktığınızdan emin olun.
- Fareyi bir ısıtma yastığına yerleştirin ve anestezi sırasında rektal sıcaklığın 37±1 ° C'de tutulduğundan emin olun.
- Fareyi 3 dakika boyunca% 3 izofluran ile doldurulmuş anestezi odasına yerleştirin.
- Geri çekilme tepkisi kaybını test etmek için farenin uzuvlarını ve ayak parmaklarını cımbızla nazikçe sıkıştırın, bu da başarılı bir anestezi olduğunu gösterir.
- Sıçanı ameliyat masasına yüzüstü pozisyonda sabitleyin, sıçanın uzuvlarının ve başının sıkıca sabitlendiğinden emin olun.
- Anestezi maskesini farenin yüzüne sabitleyin. Spinal kompresyon ameliyatı boyunca fareyi uyuşturmak için standart bir sıçan burun maskesi aracılığıyla bir oksijen / hava karışımında% 2 izofluran uygulayın.
- Ameliyat boyunca engelsiz bir hava yolu ve tamamen açıkta kalan cerrahi bölge sağlamak için sıçan ile ameliyat masası arasına silindirik bir gazlı bez (yaklaşık 30 mm x 20 mm x 60 mm boyutunda) yerleştirin (Şekil 1A).
- Sıçanın boynunun cerrahi alanının etrafındaki kılları elektrikli bir tıraş makinesiyle tıraş edin.
- Kalan tüyleri çıkarmak ve cildi açığa çıkarmak için tüy dökücü krem uygulayın.
- Cerrahi bölgeyi iyodofor ile dezenfekte edin.
- Dezenfekte edilmiş alanı, sıçanın boynunun sadece sırt tarafındaki cerrahi alanı açığa çıkaran bir delik bulunan steril bir havluyla örtün.
3. Cerrahi yaklaşım
- İkinci servikal spinöz süreci ve ikinci torasik spinöz süreci perkütan olarak konumlandırdıktan sonra, ikinci servikal spinöz süreçten ikinci torasik spinöz sürece bir neşter ile dorsal orta hatta uzunlamasına bir kesi yapın.
- Deri altı dokusunu ve fasyayı katman katman kestikten sonra C2-T2 laminasını ortaya çıkarmak için her iki tarafın kaslarını hemostatik forseps ile künt olarak ayırın.
- Servikal laminer üzerine bir delik (1 mm x 1 mm) açın (Şekil 1B).
NOT: Omurilikte aşırı yaralanmayı önlemek için, sıçanın boynunun servikal laminalar arasında yeterli boşluk bırakarak dorsal kemer durumunda tutulduğundan emin olun. - 1 mm x 1 mm x 1 mm boyutunda bir PVA-poliakrilamid hidrojel parçasını kavramak için mikrocerrahi forseps kullanın ve önceden delinmiş deliğe yerleştirin (Şekil 1C, 1D).
NOT: Geçici seğirme performansı, omurilik kompresyon modelinin başarıyla kurulduğunu gösterir. - Kas, fasya, deri altı ve cilt dokularını üçgen iğneler ve 5-0 sütür kullanarak katman katman dikin.
- Dezenfeksiyondan sonra hayvanları tekrar kafese aktarın ve sıcak tutun.
- Ameliyattan sonraki 3 gün boyunca her 6 saatte bir ve daha sonra gerektiği gibi deri altına buprenorfin hidroklorür analjezi (0.03 mg / kg) enjekte edin.
4. Ameliyat sonrası yönetim
- Postoperatif enfeksiyonu önlemek ve ağrıyı hafifletmek için sıçanlara günde bir kez intraperitoneal olarak 100.000 ünite penisilin eşdeğeri enjekte edin.
- Ameliyat sonrası yeterli ısı korumasını sağlamak için fareleri kızılötesi lamba ile sürekli ısıtılan yeni kafeslere aktarın.
NOT: Farenin bilinci yerine geldikten sonra ısıtma lambasını çıkarın - Sıçanın besleme kafesinin hijyenini ve havalandırmasını sağlayın.
- Farelere günde iki kez yemek yeme ve içme konusunda yardımcı olun. Gerekirse, idrar fonksiyonu eski haline gelene kadar idrara çıkmaya yardımcı olmak için bir mesane masajı uygulayın.
5. Davranışsal değerlendirme
- Ameliyat sonrası davranışı değerlendirmek için Basso, Beattie ve Bresnahan (BBB) derecelendirme ölçeğini kullanın.
NOT: BBB derecelendirme ölçeği, sıçanlarda omurilik ile ilgili işlevi değerlendirmek için kullanılan altın bir standarttır (Tablo 1). Sıçanların hareketini 0 (arka bacak hareketi gözlenmedi) ile 21 (yürüyüş koordinasyonu, ayak boşluğu tutarlılığı, tüm duruşa paralel ana pençe pozisyonu, tutarlı gövde stabilitesi ve tutarlı kuyruk yüksekliği) arasında değişen skorlara göre değerlendirir.
6. Kavrama gücü testi
- Kavrama gücünü ölçmek için elektronik bir kavrama gücü ölçer kullanın.
- Fareyi askıya almak için farenin alt yarısını tutun ve ön kavrama ölçerin metal çubuğunu tutmasına izin verin.
- Sıçan metal çubuğu kavradığında, onu çekin ve kavrama gücünü kaydedin.
- Her sıçan için kavrama gücünü üç kez ölçün ve en yüksek puanı kaydedin.
7. Eğimli plaka testi
- Fareyi ayarlanabilir bir açıya sahip lastik bir plaka üzerine yerleştirin.
- Sıçan dengede kalmayı ve 5 saniye boyunca sağlam durmayı başarana kadar eğimli plaka açısını her seferinde 5° kademeli olarak yükseltin.
- Sıçanın eğimli plaka üzerinde kendini dengeleyebileceği maksimum açıyı kaydedin.
- Her sıçan için maksimum açıyı üç kez ölçün ve en yüksek puanı kaydedin.
8. Ötenazi, omurilik ayrılması ve donmuş gömme
NOT: Gözleri, yüzü ve solunum yollarını paraformaldehit ve formaldehit gazından korumak için uygun gözlük ve yüz siperi/maskesinin takıldığından emin olun.
- Kalbi açığa çıkarmak için sternumu açmadan önce sıçanları uyuşturmak için intraperitoneal olarak% 10 kloral hidrat eşdeğeri enjekte edin.
- Kalbin tepesine bir perfüzyon iğnesi yerleştirin, hemostatik forseps ile sabitleyin ve yavaşça normal salin ile demleyin.
- Sağ atriyumdan temiz normal salin akana kadar sağ atriyal apendiks üzerinde bir delik açın, bu da başarılı bir infüzyonu gösterir.
- Karaciğer beyaza döndükten sonra normal salin perfüzyonunu durdurun.
- Sıçanın vücudu sertleşene kadar% 10 eşdeğeri paraformaldehit ile demleyin.
- Paraformaldehit perfüzyonundan sonra omurga çevresindeki cildi, kasları ve yumuşak dokuları çıkarın; servikal omurganın C2-C7 segmentini ayırın; ve gece boyunca sabitlemek için% 10 paraformaldehite daldırın.
- Servikal omuriliği omurgadan ayırın ve kademeli dehidrasyon için %10, %20 ve %30 sükroz çözeltileri konsantrasyon gradyanına yerleştirin.
- 2 mm yüksekliğindeki sıkıştırılmış omuriliği bir OCT gömme maddesi ile birlikte -80 ° C'lik bir dondurucuya aktarın.
- 7 μm kalınlığında dilimlere ayrıldıktan ve boyandıktan sonra (H&E boyama ve dUTP çentik ucu etiketleme (TUNEL)/nöronal çekirdekler (NeuN), bkz. bölüm 9), sırasıyla omurilik histopatolojisini ve nöronal apoptozu gözlemleyin.
9. TUNEL/NeuN immün boyama
- Omurilik bölümlerini oda sıcaklığında 10 dakika boyunca fosfat tamponlu salin (PBS) içine daldırın, ardından 1 saat boyunca% 0.3 Triton X-100 ve% 5 sığır serum albümini (BSA) içeren PBS çözeltisi ile bloke edin.
- Omurilik bölümlerini bir tavşan poliklonal anti-NeuN antikoru (1:200 seyreltilmiş) ile gece boyunca 4 °C'de inkübe edin.
- Omurilik bölümlerini PBS'de üç kez durulayın. Daha sonra, oda sıcaklığında 2 saat boyunca Alexa Fluor 594-konjuge ikincil antikorlarla inkübe edin.
- Omurilik bölümlerinin apoptotik çekirdeklerini boyamak için tek adımlı TUNEL apoptoz test kitini (yeşil floresan) gerçekleştirin.
Sonuçlar
Omurilik basınç yaralanması uzuvlarda nöromüsküler sakatlığa yol açabilir
Hidrojel parçası kademeli olarak genişledikçe, omurilik bölgesini uzun süre kalıcı olarak sıkıştırır, bu da servikal omurilik hastalıklarının neden olduğu ön ayak sakatlıklarını simüle eder 8,10. Mevcut modelde, model grubundaki sıçanların çoğunda (9/10) önemli ipsilateral ön pençe kontraktürü gözlenmiştir (Şekil 2A). Ön ayakların uzunluk ve genişliğinin daha fazla ölçümü ve analizi, ızgara çizgili bir kağıt parçası üzerinde gerçekleştirildi (Şekil 2B). Veriler, model grubundaki ipsilateral ön ayakların uzunluk ve genişliğinin ameliyattan bir gün sonra önemli ölçüde azaldığını ortaya koydu (P < 0.01). Bununla birlikte, kontrol ve model grupları arasında kontralateral ön ayaklarda anlamlı bir fark tespit edilmedi (Şekil 2C).
Uzuvlardaki ilerlemeyi ve nöromüsküler özürlülüğü değerlendirmek için, ameliyattan sonraki 1, 3, 7, 14, 21 ve 28. günlerde gözlem için BBB derecelendirme ölçeği, eğik düzlem testi ve ön ayak kavrama testi kullanıldı. Normal dağılım gösteren verileri analiz etmek için Tukey testi ile tek yönlü veya iki yönlü analiz yapılmıştır. Normal dağılım göstermeyen ancak eşit varyanslar içeren veriler için post hoc analizli parametrik olmayan bir Mann-Whitney U-testi yapıldı. Veriler ortalama ± standart sapma (SD) olarak ifade edilir. Farklılıklar P < 0.05'te istatistiksel olarak anlamlı kabul edildi.
Sonuçlar, model grubundaki sıçanların BBB skorlarının ameliyattan sonraki 1. ve 3. günlerde kademeli olarak azaldığını ve erken evrede, özellikle ipsilateral tarafta önemli fonksiyonel sakatlık gösterdiğini göstermiştir (Şekil 2D, 2E, 2G). Hem model hem de kontrol gruplarında omurilik kompresyonu için iyileşme gözlenmesine rağmen, model grubundaki sıçanlar, ameliyattan 4 hafta sonra kontrol grubuna kıyasla anormal ön pençe fonksiyonunda ve dengeleme yeteneğinde geç ve eksik bir iyileşme gösterdi (Şekil 2E, 2G). Model ve kontrol grupları arasında, ameliyat sonrası 28. günde eğik düzlem skoru ve kavrama gücünde önemli farklılıklar korundu. Bu birleşik sonuçlar, bu ameliyatın servikal omurilik üzerinde ilerleyici basıya neden olduğunu ve sıçanlarda motor yeteneğin bozulmasına neden olduğunu göstermektedir.
Omurilikte bası ile indüklenen histolojik değişiklikler ve inflamasyon
Servikal omurilik ayrıldıktan sonra omurilik üzerinde 2 mm derinlikte ve 2 mm x 2 mm'lik alanda belirgin bir girinti izlenebildi (Şekil 3B). Morfometrik değişiklikleri değerlendirmek için omurilik kesitleri boyandı ve ışık mikroskobu altında görüntülendi. H&E boyaması, bağışıklık hücrelerinin infiltrasyonunu ve omuriliğin kompresyon bölgesinde dramatik bir nöron kaybını ortaya çıkardı (Şekil 3C). Ek olarak, immün boyama, model grubundaki omurilik kompresyon bölgesinde nöronal apoptozda dramatik bir artış olduğunu ortaya çıkardı (Şekil 3D, 3E). Bazı hücreler veya dokular yüksek nükleaz ve polimeraz aktivite seviyelerine sahiptir, bu da spesifik olmayan floresan ile sonuçlanabilir. Bu nedenle, bu enzimlerin yanlış pozitiflere neden olmasını önlemek için doku çıkarıldıktan hemen sonra immobilize edildi. TUNEL boyaması spesifik değildir ve hücre veya nöron ölümü durumunda kullanılabilir. NeuN, nöronlar için spesifik bir boyama belirtecidir. Sonuç olarak, nöronal apoptozu göstermek için TUNEL boyaması ve NeuN boyamasından birleştirilmiş görüntüler kullanıldı.
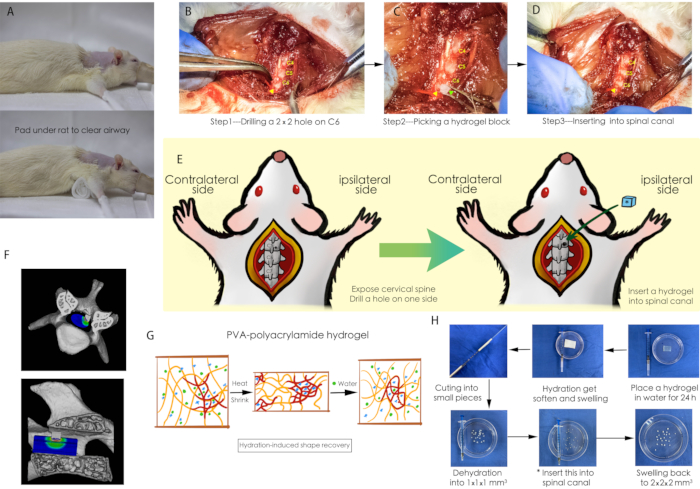
Şekil 1: Cerrahi prosedürün şeması. (A) Ameliyat sırasında sıçanın hava yolunun açık olduğundan emin olmak için sıçanın altına bir gazlı bez yerleştirildi. (B-D) Servikal omurilik kanalına hidrojel implantasyonunun cerrahi bir prosedürü; sarı ok ucu, C6'nın vertebral plakasında açılan küçük bir deliğe işaret eder ve yeşil ok ucu, susuz kalmış hidrojel bloğunu gösterir. (E) Cerrahi prosedürün bir şeması. (F) Omurilik kompresyonunun üç boyutlu bir şeması. (G) PVA-poliakrilamid hidrojelin su emici özelliği. (H) Omurilik sıkışması için hidrojel bloğun hazırlanması. Kısaltmalar: PVA = polivinil alkol. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Ön pençenin morfolojisi ve BBB ölçeği, kavrama kuvveti testi ve eğimli plaka testi ile davranışsal gözlemler. (A) Ameliyattan sonraki üçüncü günde kontrol grubu (solda) ve model grubu (sağda) sıçanların ipsilateral ön ayaklarının tipik bir özelliği. (B) Sıçanların ön ayaklarının genişliği ve uzunluğu ölçüldü. Enine kırmızı ok, birinci parmaktan dördüncü parmağa kadardır ve uzunlamasına kırmızı ok, en uzun parmağın ucundan avuç içi köküne kadardır. (C) Model ve kontrol gruplarındaki ipsilateral ön pençelerin uzunluk ve genişliğinin kantitatif analizi. (D) Ameliyattan 1, 3, 7, 14, 21 ve 28 gün sonra hem ipsilateral hem de kontralateral tarafların BBB skoru. (E) Ameliyattan 1, 3, 7, 14, 21 ve 28 gün sonra hem ipsilateral hem de kontralateral yan ön ayakların kavrama gücü, kavrama gücü testi ile değerlendirilir. (F) Eğimli plaka testinin şeması. (G) Ameliyattan 1, 3, 10, 20 ve 28 gün sonra hem ipsilateral yan hem de karşı yan bacakların gücü ve dengesi, eğimli plaka testi ile değerlendirilir. Veriler ortalama ± SD olarak sunulmuştur. *P < 0.05 ve **P < 0.01 ile kontrol grubu; n = 10/grup. Kısaltma: BBB = Basso, Beattie ve Bresnahan derecelendirme ölçeği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
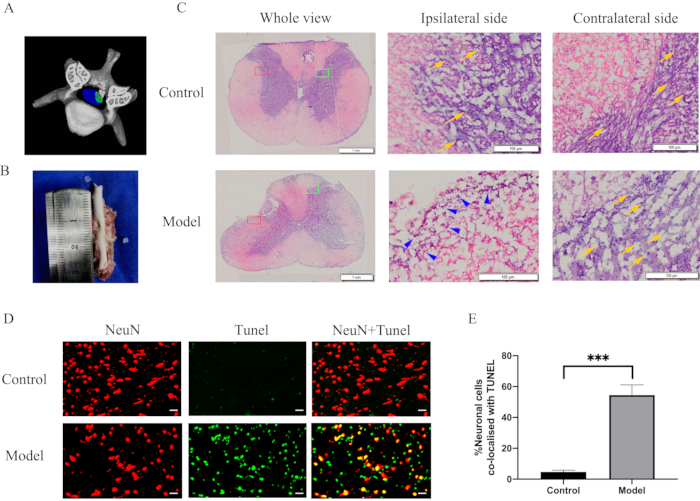
Şekil 3: Uzun süreli servikal omurilik kompresyonundan sonra morfolojik değişiklikler ve inflamatuar yanıtlar. (A) Omurilik kompresyonunun üç boyutlu şeması. (B) Omurilik üzerinde 2 mm derinlik ve 2 mm x 2 mm alan girintisi. (C) Kompresyon ve H & E boyamasından 28 gün sonra omurilik histolojik bölümü. Bağışıklık hücrelerinin infiltrasyonu ve omuriliğin basınç bölgesinde dramatik bir nöron kaybı. Kırmızı dikdörtgen, ipsilateral taraf; yeşil dikdörtgen, kontralateral; mavi ok uçları, bağışıklık hücreleri; sarı oklar, nöronlar. (D) Model ve kontrol gruplarında omurilik kompresyon bölgesinden kesitlerin NeuN (kırmızı) / TUNEL (yeşil) için çift boyama. Ölçek çubukları = 20 μm. (E) NeuN ve TUNEL çift pozitif hücrelerin miktar tayini. P < kontrol grubuna göre 0.001; n = 10/grup. Kısaltmalar: H & E = hematoksilen ve eozin; NeuN = nöronal çekirdekler; TUNEL = dUTP nick sonu etiketleme. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Puan | Kategorilerin ve özniteliklerin operasyonel tanımları | ||
| 0 | Arka ayakların gözlemlenebilir hareketi yok | ||
| 1 | Bir veya iki eklemin, genellikle kalça ve/veya dizin hafif (sınırlı) hareketi | ||
| 2 | Bir eklemin geniş hareketi veya bir eklemin geniş hareketi ve diğerinin hafif hareketi | ||
| 3 | İki eklemin geniş hareketi | ||
| 4 | Arka ayakların üç ekleminin de hafif hareketi | ||
| 5 | İki eklemin hafif hareketi ve üçüncü eklemin geniş hareketi | ||
| 6 | İki eklemin geniş hareketi ve üçüncü eklemin hafif hareketi | ||
| 7 | Arka ayaklardaki üç eklemin kapsamlı hareketi | ||
| 8 | Ağırlık taşımadan süpürme veya ağırlık taşımadan pençenin plantar desteği | ||
| 9 | Pençenin sadece destek aşamasında (yani statik olduğunda) ağırlık taşıma ile plantar desteği veya ağırlık taşıma ile ara sıra, sık veya tutarsız sırt adımı ve plantar adım atma olmadan | ||
| 10 | Ara sıra ağırlık taşıyan ve ön ayak-arka bacak koordinasyonu olmayan plantar adım atma | ||
| 11 | Sık ila tutarlı ağırlık taşıma ve ara sıra ön ayak-arka bacak koordinasyonu ile plantar adım atma | ||
| 12 | Sık ila tutarlı ağırlık taşıma ve ara sıra ön ayak-arka bacak koordinasyonu ile plantar adım atma | ||
| 13 | Sık ila tutarlı ağırlık taşıma ve sık ön ayak-arka bacak koordinasyonu ile plantar adım atma | ||
| 14 | Tutarlı ağırlık desteği, tutarlı ön ayak-arka bacak koordinasyonu ve hareket sırasında ağırlıklı olarak döndürülmüş pençe pozisyonu (dahili veya dış) ile plantar adımlama, hem yüzeyle ilk temas anında hem de destek aşamasının sonunda ayak parmaklarını hareket ettirmeden önce veya sık plantar adımlama, tutarlı ön ayak-arka bacak koordinasyonu ve ara sıra sırt adımlama | ||
| 15 | Tutarlı plantar adımlama, tutarlı ön ayak-arka bacak koordinasyonu ve uzuvun ileri hareketi sırasında ayak parmaklarının hareketi veya ara sıra hareket olmaması; Baskın pençe pozisyonu, ilk temas anında vücuda paraleldir. | ||
| 16 | Ayak parmaklarının yürüyüşü ve hareketi sırasında tutarlı plantar adım atma ve ön ayak-arka bacak koordinasyonu, uzvun ileri hareketi sırasında sıklıkla meydana gelir; Baskın pençe pozisyonu, ilk temas anında vücuda paraleldir ve hareket anında kavislidir. | ||
| 17 | Ayak parmaklarının yürüyüşü ve hareketi sırasında tutarlı plantar adım atma ve ön ayak-arka bacak koordinasyonu, uzuvun ileri hareketi sırasında sıklıkla meydana gelir; Baskın pençe pozisyonu, ilk temas anında ve ayak parmaklarının hareket ettiği anda vücuda paraleldir. | ||
| 18 | Ayak parmaklarının yürüyüşü ve hareketi sırasında tutarlı plantar adım atma ve ön ayak-arka bacak koordinasyonu, uzuvun ileri hareketi sırasında tutarlı bir şekilde gerçekleşir; Baskın pençe pozisyonu, ilk temas anında vücuda paraleldir ve ayak parmaklarının hareketi sırasında kavislidir. | ||
| 19 | Ayak parmaklarının yürüyüşü ve hareketi sırasında tutarlı plantar adım atma ve ön ayak-arka bacak koordinasyonu, uzuvun ileri hareketi sırasında tutarlı bir şekilde gerçekleşir; Baskın pençe pozisyonu, temas anında ve ayak parmaklarının hareketi sırasında vücuda paraleldir ve hayvan, zamanın bir kısmında veya tamamında aşağı doğru bir kuyruk sunar. | ||
| 20 | Ayak parmaklarının yürüyüşü ve hareketi sırasında tutarlı plantar adım atma ve ön ayak-arka bacak koordinasyonu, uzuvun ileri hareketi sırasında tutarlı bir şekilde gerçekleşir; Baskın pençe pozisyonu, temas anında ve ayak parmaklarının hareketi sırasında vücuda paraleldir ve hayvan, kuyruk ve gövde dengesizliğinde tutarlı bir yükselme gösterir. | ||
| 21 | Tutarlı plantar adım ve koordineli yürüyüş, ayak parmaklarının tutarlı hareketi; pençe pozisyonu, tüm destek aşaması boyunca ağırlıklı olarak vücuda paraleldir; tutarlı gövde stabilitesi; Tutarlı kuyruk yüksekliği | ||
Tablo 1: Basso ve ark.'nın 21 puanlık fonksiyonel değerlendirme ölçeği.9,11.
Tartışmalar
Bu cerrahi prosedürün amacı, sıçan omuriliğinde tekrarlanabilir, uzun süreli, nöral apoptoz oluşturmaktı. Bu modelin önemli bir avantajı, genişletilebilir hidrojel implantların omurilik üzerinde uzun süreli bir kompresyon sağlaması ve böylece CSM'nin patolojik süreci ile tutarlı olan ilerleyici bir nöral apoptotik yanıta yol açmasıdır (Şekil 2C). Mevcut çalışmada, omurilik yaralanmasından kaynaklanan mortalite son derece düşüktü (50'de ~ 2), oysa bu modelin tekrarlanabilirliği 50'de > 45 idi. Hidrojel parçalarının yanlış boyutu ve ameliyat sırasında kuvvetli implantasyon, omurilikte akut yaralanmaya neden olabilir12,13.
Yayınlanmamış bir çalışma14 , %350'lik bir genişleme oranına sahip implantasyonun, birkaç hafta boyunca ilerleyici iyileşme ile geçici ve akut CSM ile sonuçlandığını buldu. %200'lük bir genişleme oranı, implantların omurilikten daha sert olması nedeniyle CSM modelinde yavaş ilerleyen bir felce neden oldu. Bununla birlikte, bu modelde, implante edilen materyalin sertliği ile ilgilenmedik, sadece bu implantasyonun son boyutuyla ilgilendik. 4 hafta sonra, omurilik üzerinde bir girinti gözlendi (Şekil 3A, 3B), bu da omurilik üzerindeki sürekli daralmayı, ağırlaştırılmış nöroinflamasyonu ve nöronal apoptozu yansıtıyordu.
Şu anda, implantların boyutu konusunda bir fikir birliği yoktur. Birkaç çalışmada 0.5-1 mm kalınlığında emici tabakalar kullanılmıştır 15,16,17,18 ve spinal kompresyondan fonksiyonel sakatlık bildirilmiştir. Başka bir sıçan omurilik kompresyon çalışması19, sağlam beyaz cevher kaybının ve dramatik kordon düzleşmesinin, iltihaplanma olmadan bir kompresyon suşunu yansıtan şiddetli kord kompresyonunun (2.6 mm kalınlık) indüklendiğini gösterdi. Bu nedenle, yumuşak genişletilebilir bir malzeme ile üretilen büyük bir implant, omurilik üzerinde uzun süreli kompresyon için uygun olabilir.
Mevcut modelde, hidrojel parçalarının ve vertebral plaka üzerindeki matkabın boyutu, akut omurilik yaralanmasını veya aşırı büyük implantlardan kaynaklanan herhangi bir ani kuvvet nedeniyle kaza sonucu ölümü önlemek için kesinlikle 1 mm x 1 mm x 1 mm boyutuyla sınırlıydı. 48 saatlik hidrasyondan sonra, hidrojel bloklar 2 mm x 2 mm x 2 mm boyutuna genişledi. Klinik olarak, CSM hastalarında semptomların şiddetlenmesi, omurilik üzerinde sürekli disk hernisi basısından ve ardından inflamasyon ve ödemin neden olduğu düşük kompanzasyonlu adaptasyondan kaynaklanan omuriliğin ani sıkışması ile ilgilidir 4,7. Bu, tek taraflı hidrojel inflamatuar infiltrasyonun neden bilateral nörolojik fonksiyon eksikliğine yol açtığını açıklayabilir20.
Bu hayvan modelinin bir sınırlaması, sıçanların herhangi bir yaralanmaya21 güçlü adaptasyon göstermesi ve bu da hızlı iyileşmeyi kolaylaştırmasıdır. Birkaç çalışma, kompresyon işleminden sonra zaman içinde nörolojik fonksiyonda sürekli iyileşmeler göstermiştir 15,16,17,18,21,22, oysa sadece birkaç çalışma kötüleşme eğilimi bildirmiştir. Ek olarak, çoğu CSM hastası, omurilik üzerinde tutarlı bir baskı altında nörolojik fonksiyonda kademeli bir iyileşme veya bozulma gösterir23. Mevcut modelde 4 hafta sonra motor fonksiyonda anlamlı bir fark olmadığından, davranışsal değerlendirmeyi durdurduk ve daha ileri histolojik araştırmalar için sıçanlara ötenazi yaptık. Özetle, bu çalışma, CSM ve omurilik rejenerasyonu ile ilişkili hücresel ve moleküler mekanizmaları incelemek için pratik bir hayvan modeli olan sıçanlarda omurilik sıkışmasının neden olduğu bir nöral apoptoz modeli sunmaktadır.
Açıklamalar
Yazarların açıklama konusunda herhangi bir çıkar çatışması yoktur ve bu çalışmada kullanılan tüm materyallere tam erişim konusunda herhangi bir kısıtlama olmadığını belirtirler.
Teşekkürler
Bu çalışma, Çin Ulusal Anahtar Ar-Ge Programı (2018YFC1704300), Çin Ulusal Doğa Bilimleri Vakfı (81930116, 81804115, 81873317 ve 81704096), Şanghay Yelken Programı (18YF1423800), Şanghay Doğa Bilimleri Vakfı (20ZR1473400) tarafından desteklenmiştir. Bu proje aynı zamanda Şanghay Geleneksel Çin Tıbbı Üniversitesi (2019LK057) tarafından da desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Antibiotic ointment | Prevent wound infection | ||
| Buprenorphine-SR | Pain relief | ||
| Isoflurane | Veteasy | Anesthesia | |
| Inhalant anesthesia equipment | Anesthesia | ||
| Micro ophthalmic forceps | Mingren medical equipment | Length: 11 cm, Head diameter: 0.3 mm | Clip the muscle |
| Ophthalmic forceps | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | JD1050 | Clip the skin |
| Ophthalmic scissors (10 cm) | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | Y00030 | Skin incision |
| SD male rats | Shanghai SLAC Laboratory Animal Co., Ltd | SCXK2018-0004 | Animal model |
| Sterile surgical blades (22#) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | 35T0707 | Muscle incision |
| Small animal trimmer | Hair removal | ||
| Veet hair removal cream | RECKITT BENCKISER (India) Ltd | Hair removal | |
| Venus shears | Mingren medical equipment | Length: 12.5 cm | Muscle incision |
Referanslar
- Lebl, D. R., Bono, C. M. Update on the diagnosis and management of cervical spondylotic myelopathy. The Journal of the American Academy of Orthopaedic Surgeons. 23 (11), 648-660 (2015).
- Haddas, R., et al. Spine and lower extremity kinematics during gait in patients with cervical spondylotic myelopathy. The Spine Journal. 18 (9), 1645-1652 (2018).
- Song, D. W., Wu, Y. D., Tian, D. D. Association of Vdr-Foki and Vdbp-Thr420 Lys polymorphisms with cervical spondylotic myelopathy: A case-control study in the population of China. Journal of Clinical Laboratory Analysis. 33 (2), 22669(2019).
- Kurokawa, R., Murata, H., Ogino, M., Ueki, K., Kim, P. Altered blood flow distribution in the rat spinal cord under chronic compression. Spine. 36 (13), 1006-1009 (2011).
- Wen, C. Y., et al. Is Diffusion anisotropy a biomarker for disease severity and surgical prognosis of cervical spondylotic myelopathy. Radiology. 270 (1), 197-204 (2014).
- Long, H. Q., Li, G. S., Hu, Y., Wen, C. Y., Xie, W. H. Hif-1A/Vegf signaling pathway may play a dual role in secondary pathogenesis of cervical myelopathy. Medical Hypotheses. 79 (1), 82-84 (2012).
- Karadimas, S. K., Erwin, W. M., Ely, C. G., Dettori, J. R., Fehlings, M. G. Pathophysiology and natural history of cervical spondylotic myelopathy. Spine. 38, 21-36 (2013).
- Wilson, J. R., et al. State of the art in degenerative cervical myelopathy: an update on current clinical evidence. Neurosurgery. 80, 33-45 (2017).
- Baptiste, D. C., Fehlings, M. G. Pathophysiology of cervical myelopathy. The spine Journal. 6, 190-197 (2006).
- Wilcox, J. T., et al. Generating level-dependent models of cervical and thoracic spinal cord injury: exploring the interplay of neuroanatomy, physiology, and function. Neurobiology of Disease. 105, 194-212 (2017).
- Takano, M., et al. Inflammatory cascades mediate synapse elimination in spinal cord compression. Journal of Neuroinflammation. 11, 40(2014).
- Hu, Y., et al. Somatosensory-evoked potentials as an indicator for the extent of ultrastructural damage of the spinal cord after chronic compressive injuries in a rat model. Clinical Neurophysiology. 122 (7), 1440-1447 (2011).
- Yang, T., et al. Inflammation level after decompression surgery for a rat model of chronic severe spinal cord compression and effects on ischemia-reperfusion injury. Neurologia Medico-Chirurgica. 55 (7), 578-586 (2015).
- Ijima, Y., et al. Experimental rat model for cervical compressive myelopathy. Neuroreport. 28 (18), 1239-1245 (2017).
- Yamamoto, S., Kurokawa, R., Kim, P. Cilostazol, a selective type iii phosphodiesterase inhibitor: prevention of cervical myelopathy in a rat chronic compression model. Journal of Neurosurgery. Spine. 20 (1), 93-101 (2014).
- Holly, L. T., et al. Dietary therapy to promote neuroprotection in chronic spinal cord injury. Journal of Neurosurgery. Spine. 17 (2), 134-140 (2012).
- Zhao, P., et al. In vivo diffusion tensor imaging of chronic spinal cord compression: a rat model with special attention to the conus medullaris. Acta Radiologica. 57 (12), 1531-1539 (2016).
- Kurokawa, R., Nagayama, E., Murata, H., Kim, P. Limaprost alfadex, a prostaglandin E1 derivative, prevents deterioration of forced exercise capability in rats with chronic compression of the spinal cord. Spine. 36 (11), 865-869 (2011).
- Lee, J., Satkunendrarajah, K., Fehlings, M. G. Development and characterization of a novel rat model of cervical spondylotic myelopathy: the impact of chronic cord compression on clinical, neuroanatomical, and neurophysiological outcomes. Journal of Neurotrauma. 29 (5), 1012-1027 (2012).
- Chen, B., et al. Reactivation of dormant relay pathways in injured spinal cord by Kcc2 manipulations. Cell. 174 (3), 521-535 (2018).
- Yu, W. R., Liu, T., Kiehl, T. R., Fehlings, M. G. Human neuropathological and animal model evidence supporting a role for Fas-mediated apoptosis and inflammation in cervical spondylotic myelopathy. Brain. 134, 1277-1292 (2011).
- Yu, W. R., et al. Molecular mechanisms of spinal cord dysfunction and cell death in the spinal hyperostotic mouse: implications for the pathophysiology of human cervical spondylotic myelopathy. Neurobiology of Disease. 33 (2), 149-163 (2009).
- Iyer, A., Azad, T. D., Tharin, S. Cervical spondylotic myelopathy. Clinical Spine Surgery. 29 (10), 408-414 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır