Method Article
Ein neuronales Apoptosemodell, das durch Rückenmarkskompression bei Ratten induziert wird
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um ein Rückenmarkskompressionsmodell für Ratten zu erstellen, seinen Verhaltenswert zu bewerten und die komprimierte Rückenmarksregion zu beobachten. Die Verhaltensbewertungen zeigten eine verminderte motorische Behinderung des Monitors. Hämatoxylin- und Eosin-Färbungen und Immunfärbungen zeigten eine beträchtliche neuronale Apoptose im komprimierten Bereich des Rückenmarks.
Zusammenfassung
Als schwere fortschreitende degenerative Erkrankung hat die zervikale spondylotische Myelopathie (CSM) eine schlechte Prognose und ist mit körperlichen Schmerzen, Steifheit, motorischer oder sensorischer Dysfunktion und einem hohen Risiko für Rückenmarksverletzungen und Akrolähmung verbunden. Daher sind therapeutische Strategien, die eine effiziente Regeneration des Rückenmarks bei dieser chronischen und fortschreitenden Erkrankung fördern, dringend erforderlich. Effektive und reproduzierbare Modelle zur Kompression des Rückenmarks bei Tieren sind erforderlich, um den komplexen biologischen Mechanismus zu verstehen, der der CSM zugrunde liegt. Die meisten Modelle für Rückenmarksverletzungen spiegeln akute und strukturell destruktive Zustände wider, während Tiermodelle der CSM eine chronische Kompression im Rückenmark darstellen. In dieser Arbeit wird ein Protokoll zur Generierung eines Rückenmarkskompressionsmodells von Ratten vorgestellt, das durch die Bewertung des Verhaltensscores und die Beobachtung der komprimierten Rückenmarksregion weiter evaluiert wurde. Die Verhaltensbewertungen zeigten eine verminderte motorische Behinderung des Monitors, einschließlich Gelenkbewegungen, Schrittfähigkeit, Koordination, Rumpfstabilität und Muskelkraft der Gliedmaßen. Die Hämatoxylin- und Eosin (H&E)-Färbung und Immunfärbung zeigte eine beträchtliche neuronale Apoptose im komprimierten Bereich des Rückenmarks.
Einleitung
Als häufige progrediente degenerative Erkrankung macht CSM 5-10% aller zervikalen Spondyloseaus 1. Wenn Patienten, die an CSM leiden, ihre Symptome ignorieren und sie nicht rechtzeitig und wirksam behandeln, kann dies zu schweren Komplikationen wie Rückenmarksverletzungen und Gliedmaßenlähmungen führen, die sich mit zunehmendem Alter verschlimmern und eine erhebliche wirtschaftliche und psychische Belastung für die Patienten und ihre Angehörigen darstellenwürden 2,3. Die Pathogenese der CSM ist komplex und umfasst statische und dynamische Faktoren, die Hypoxie-Ischämie-Theorie, die Endothelzellverletzung, die Theorie der Zerstörung der Rückenmarksbarriere im Blut und die Entzündungs- und Apoptosetheorie 4,5,6,7.
Die statischen und dynamischen Mechanismen der Kompression auf das Rückenmark verursachen klinische Symptome. Vorstehende Bandscheiben, deformierte Wirbelkörper und verkalkte Bänder können zu einer verlängerten Rückenmarkskompression führen, die sich allmählich auf die Blut-Rückenmarks-Schranke und die lokalen Mikrovaskulatur im Rückenmark auswirkt 4,8. Ischämie, Entzündung und Apoptose wirken sich wiederum auf die Neuronen, Axone und Gliazellen aus 6,9.
Zu den experimentellen Tiermodellen für Rückenmarksverletzungen gehören Kontusionsverletzungen, Druckverletzungen, Traktionsverletzungen, photochemisch induzierte Verletzungen und Ischämie-Reperfusionsschäden. Die meisten dieser Modelle spiegeln auch einige akute und strukturell destruktive Zustände (Transsektion oder chemische Toxizität) wider. Diese Tiermodelle der CSM können jedoch keine progressive neuronale Apoptose im Rückenmark aufweisen.
In dieser Arbeit wird ein detailliertes Protokoll zur Generierung eines Rückenmarkskompressionsmodells von Ratten beschrieben, das durch die Bewertung des Verhaltensscores und die Beobachtung der komprimierten Region des Rückenmarks weiter evaluiert wurde. Dieses Modell der Rückenmarkskompression von Ratten ist ein zuverlässiges Tiermodell für die weitere Untersuchung der Mechanismen, die an der CSM beteiligt sind.
Protokoll
Das folgende Verfahren wurde mit Genehmigung des Institutional Animal Care and Use Committee (IACUC) der Shanghai University of Traditional Chinese Medicine durchgeführt. Alle Überlebensoperationen wurden unter sterilen Bedingungen durchgeführt, wie in den NIH-Richtlinien beschrieben. Schmerzen und Infektionsrisiko wurden mit geeigneten Analgetika und Antibiotika behandelt, um ein erfolgreiches Ergebnis zu gewährleisten. Dieses chirurgische Verfahren ist für männliche Ratten mit Sprague-Dawley (SD) im Alter von 12 Wochen und einem Gewicht von 400 g optimiert.
1. PVA-Polyacrylamid-Hydrogel-Zubereitung
HINWEIS: Wie in Abbildung 1G, 1H gezeigt, handelt es sich bei dem PVA-Polyacrylamid-Hydrogel um eine wasserabsorbierende Polymerplatte. Im natürlichen Zustand lässt sich das Gel nur sehr schwer in kleine Stücke schneiden. Die Zubereitung wird wie folgt beschrieben.
- Legen Sie ein PVA-Polyacrylamid-Hydrogel für 24 Stunden in Wasser, um das Schneiden nach der Flüssigkeitszufuhr zu erleichtern.
- Verwenden Sie ein selbstgebautes Schneidwerkzeug (Abbildung 1H), um das gesamte Hydrogel in Stücke mit den Maßen 2 mm x 2 mm x 2 mm zu teilen.
- Diese Hydrogelstücke werden für 12 Stunden bei 60 °C in einen Ofen überführt, um sie in kleine Stücke von 1 mm x 1 mm x 1 mm als Implantationsmaterial zu dehydrieren.
2. Anästhesie und Vorbereitung
HINWEIS: Achten Sie darauf, während des gesamten sterilen chirurgischen Prozesses eine OP-Kappe, medizinische Einwegmasken und sterile OP-Handschuhe zu tragen.
- Legen Sie die Ratte auf ein Heizkissen und stellen Sie sicher, dass die Rektaltemperatur während der Anästhesie bei 37±1 °C gehalten wird.
- Legen Sie die Ratte für 3 Minuten in die mit 3% Isofluran gefüllte Anästhesiekammer.
- Kneifen Sie die Gliedmaßen und Zehen der Ratte vorsichtig mit einer Pinzette, um zu testen, ob die Entzugsreaktion verloren geht, was auf eine erfolgreiche Anästhesie hinweist.
- Fixieren Sie die Ratte in Bauchlage auf dem Operationstisch und stellen Sie sicher, dass die Gliedmaßen und der Kopf der Ratte fest sitzen.
- Fixieren Sie die Anästhesiemaske auf dem Gesicht der Ratte. Verabreichen Sie 2% Isofluran in einem Sauerstoff-Luft-Gemisch über eine Standard-Rattennasenmaske, um die Ratte während der gesamten Wirbelsäulenkompressionsoperation zu betäuben.
- Platzieren Sie ein zylindrisches Mullkissen (Größe ca. 30 mm x 20 mm x 60 mm) zwischen der Ratte und dem Operationstisch (Abbildung 1A), um während der gesamten Operation einen freien Atemweg und eine vollständig freiliegende Operationsstelle zu gewährleisten.
- Rasieren Sie die Haare um den chirurgischen Bereich des Halses der Ratte mit einem Elektrorasierer.
- Tragen Sie Enthaarungscreme auf, um die restlichen Haare zu entfernen und die Haut freizulegen.
- Desinfizieren Sie das Operationsgebiet mit einem Jodophor.
- Decken Sie den desinfizierten Bereich mit einem sterilen Handtuch ab, dessen Loch nur den Operationsbereich auf der Rückenseite des Halses der Ratte freilegt.
3. Chirurgischer Ansatz
- Machen Sie mit einem Skalpell einen Längsschnitt in der dorsalen Mittellinie vom zweiten zervikalen Dornfortsatz zum zweiten thorakalen Dornfortsatz, nachdem Sie den zweiten zervikalen Dornfortsatz und den zweiten thorakalen Dornfortsatz perkutan positioniert haben.
- Trennen Sie die Muskeln beider Seiten mit einer hämostatischen Pinzette, um die C2-T2-Lamina freizulegen, nachdem Sie das Unterhautgewebe und die Faszien Schicht für Schicht durchtrennt haben.
- Bohren Sie ein Loch (1 mm x 1 mm) in die zervikale Lamelle (Abbildung 1B).
HINWEIS: Um übermäßige Verletzungen des Rückenmarks zu vermeiden, stellen Sie sicher, dass der Hals der Ratte in einem dorsalen Bogenzustand gehalten wird, so dass genügend Platz zwischen den Halslaminen bleibt. - Fassen Sie mit einer mikrochirurgischen Pinzette ein Stück PVA-Polyacrylamid-Hydrogel in der Größe von 1 mm x 1 mm x 1 mm und führen Sie es in das zuvor gebohrte Loch ein (Abbildung 1C, 1D).
HINWEIS: Die vorübergehende Zuckungsleistung zeigt an, dass das Rückenmarkskompressionsmodell erfolgreich etabliert wurde. - Vernähen Sie das Muskel-, Faszien-, Unterhaut- und Hautgewebe Schicht für Schicht mit dreieckigen Nadeln und 5-0-Naht.
- Nach der Desinfektion bringen Sie die Tiere zurück in den Käfig und halten Sie sie warm.
- Injizieren Sie die Buprenorphinhydrochlorid-Analgesie (0,03 mg/kg) subkutan alle 6 Stunden für 3 Tage nach der Operation und danach nach Bedarf.
4. Postoperatives Management
- Injizieren Sie den Ratten einmal täglich ein Äquivalent von 100.000 Einheiten Penicillin intraperitoneal, um postoperative Infektionen zu verhindern und Schmerzen zu lindern.
- Bringen Sie die Ratten in neue Käfige, die kontinuierlich mit einer Infrarotlampe beheizt wurden, um einen ausreichenden Wärmeerhalt nach der Operation zu gewährleisten.
HINWEIS: Entfernen Sie die Heizlampe, nachdem das Bewusstsein der Ratte wiederhergestellt ist - Sorgen Sie für Hygiene und Belüftung des Futterkäfigs der Ratte.
- Helfen Sie den Ratten, zweimal täglich zu essen und zu trinken. Verabreichen Sie bei Bedarf eine Blasenmassage, um das Wasserlassen zu unterstützen, bis die Harnfunktion wiederhergestellt ist.
5. Verhaltensbewertung
- Verwenden Sie die Bewertungsskala von Basso, Beattie und Bresnahan (BBB), um das postoperative Verhalten zu beurteilen.
HINWEIS: Die BHS-Bewertungsskala ist ein Goldstandard (Tabelle 1), der zur Bewertung der Rückenmarksfunktion bei Ratten verwendet wird. Es bewertet die Bewegung der Ratten anhand von Werten von 0 (es wurde keine Bewegung der hinteren Gliedmaßen beobachtet) bis 21 (Gangkoordination, Konsistenz des Zehenraums, parallele Position der Hauptkralle in der gesamten Haltung, konsistente Rumpfstabilität und konsistente Schwanzhebung).
6. Prüfung der Griffkraft
- Verwenden Sie ein elektronisches Griffkraftmessgerät, um die Griffkraft zu messen.
- Greifen Sie die untere Hälfte der Ratte, um die Ratte aufzuhängen, und lassen Sie sie die Metallstange des vorderen Griffmessers greifen.
- Wenn die Ratte den Metallstab greift, ziehen Sie ihn weg und notieren Sie die Griffstärke.
- Messen Sie die Griffkraft dreimal für jede Ratte und notieren Sie die höchste Punktzahl.
7. Prüfung der geneigten Platte
- Lege die Ratte auf eine Gummiplatte mit verstellbarem Winkel.
- Den Winkel der geneigten Platte nach und nach jedes Mal um 5° anheben, bis die Ratte es schafft, das Gleichgewicht zu halten und 5 s lang fest zu stehen.
- Notieren Sie den maximalen Winkel, in dem sich die Ratte auf der geneigten Platte balancieren kann.
- Messen Sie den maximalen Winkel dreimal für jede Ratte und notieren Sie die höchste Punktzahl.
8. Euthanasie, Rückenmarkstrennung und eingefrorene Einbettung
HINWEIS: Stellen Sie sicher, dass eine geeignete Augenbrille und ein Gesichtsschutz/eine Gesichtsmaske getragen werden, um Augen, Gesicht und Atemwege vor Paraformaldehyd und Formaldehydgas zu schützen.
- Injizieren Sie ein Äquivalent von 10% Chloralhydrat intraperitoneal, um die Ratten zu betäuben, bevor Sie das Brustbein öffnen und das Herz freilegen.
- Führen Sie eine Perfusionsnadel in die Spitze des Herzens ein, fixieren Sie sie mit einer hämostatischen Pinzette und infundieren Sie sie langsam mit normaler Kochsalzlösung.
- Bohren Sie ein Loch in das rechte Vorhofohr, bis saubere normale Kochsalzlösung aus dem rechten Vorhof fließt, was auf eine erfolgreiche Infusion hinweist.
- Stoppen Sie die normale Kochsalzlösungsperfusion, nachdem die Leber weiß geworden ist.
- Mit einem Äquivalent von 10 % Paraformaldehyd aufgießen, bis der Körper der Ratte steif wird.
- Entfernen Sie nach der Paraformaldehyd-Perfusion die Haut, Muskeln und Weichteile um die Wirbelsäule. trennen Sie das C2-C7-Segment der Halswirbelsäule; und tauchen Sie es in 10% Paraformaldehyd zur Fixierung über Nacht.
- Trennen Sie das zervikale Rückenmark von der Wirbelsäule und legen Sie es in einen Konzentrationsgradienten von 10 %, 20 % und 30 % Saccharoselösungen, um eine allmähliche Dehydrierung zu erzielen.
- Das komprimierte Rückenmark mit einer Höhe von 2 mm wird zusammen mit einem OCT-Einbettungsmittel in einen -80 °C heißen Gefrierschrank gegeben.
- Nach dem Schneiden in 7 μm dicke Schichten und der Färbung (H&E-Färbung und dUTP-Nick-End-Markierung (TUNEL)/neuronale Kerne (NeuN), siehe Abschnitt 9) ist die Histopathologie des Rückenmarks bzw. der neuronalen Apoptose zu beobachten.
9. TUNEL/NeuN-Immunfärbung
- Tauchen Sie die Rückenmarksabschnitte 10 Minuten lang bei Raumtemperatur in phosphatgepufferte Kochsalzlösung (PBS) und blockieren Sie sie dann 1 h lang mit PBS-Lösung, die 0,3 % Triton X-100 und 5 % Rinderserumalbumin (BSA) enthält.
- Die Rückenmarksabschnitte werden über Nacht bei 4 °C mit einem polyklonalen Kaninchen-Anti-NeuN-Antikörper (verdünnt 1:200;) inkubiert.
- Spülen Sie die Rückenmarksabschnitte dreimal in PBS. Anschließend mit Alexa Fluor 594-konjugierten Sekundärantikörpern für 2 h bei Raumtemperatur inkubieren.
- Führen Sie das einstufige TUNEL-Apoptose-Assay-Kit (grüne Fluoreszenz) durch, um die apoptotischen Kerne der Rückenmarksabschnitte zu färben.
Ergebnisse
Eine Kompressionsverletzung des Rückenmarks kann zu neuromuskulären Behinderungen in den Gliedmaßen führen
Da sich das Hydrogelstück allmählich ausdehnt, komprimiert es die Rückenmarksregion über einen längeren Zeitraum anhaltend, was die durch zervikale Rückenmarkserkrankungen induzierten Behinderungen der Vordergliedmaßen simuliert 8,10. Im aktuellen Modell wurde bei den meisten Ratten (9/10) der Modellgruppe eine signifikante ipsilaterale Vorderpfotenkontraktur beobachtet (Abbildung 2A). Weitere Messungen und Analysen der Länge und Breite der Vorderpfoten wurden auf einem Blatt Papier mit einer Gitterlinie durchgeführt (Abbildung 2B). Die Daten zeigten, dass die Länge und Breite der ipsilateralen Vorderpfoten in der Modellgruppe einen Tag nach der Operation bemerkenswert abnahm (P < 0,01). Es wurde jedoch kein signifikanter Unterschied in den kontralateralen Vorderpfoten zwischen der Kontroll- und der Modellgruppe festgestellt (Abbildung 2C).
Um den Fortschritt und die neuromuskuläre Behinderung der Gliedmaßen zu bewerten, wurden die BHS-Bewertungsskala, der Schiefe-Ebenen-Test und der Grifftest der Vordergliedmaßen zur Beobachtung an den Tagen 1, 3, 7, 14, 21 und 28 nach der Operation verwendet. Eine unidirektionale oder bidirektionale Analyse mit dem Tukey-Test wurde durchgeführt, um normalverteilte Daten zu analysieren. Ein nichtparametrischer Mann-Whitney-U-Test mit Post-hoc-Analyse wurde für Daten durchgeführt, die nicht normalverteilt, aber gleiche Varianzen enthielten. Die Daten werden als Mittelwert ± Standardabweichung (SD) ausgedrückt. Die Unterschiede wurden bei P < 0,05 als statistisch signifikant angesehen.
Die Ergebnisse zeigten, dass die BHS-Werte der Ratten in der Modellgruppe an den Tagen 1 und 3 nach der Operation allmählich abnahmen, was in der frühen Phase zu einer signifikanten funktionellen Behinderung führte, insbesondere auf der ipsilateralen Seite (Abbildung 2D, 2E, 2G). Obwohl sowohl in der Modell- als auch in der Kontrollgruppe eine Erholung der Rückenmarkskompression beobachtet wurde, zeigten die Ratten in der Modellgruppe 4 Wochen nach der Operation im Vergleich zur Kontrollgruppe eine verspätete und unvollständige Wiederherstellung der aberranten Vorderpfotenfunktion und des Gleichgewichtsvermögens (Abbildung 2E, 2G). Signifikante Unterschiede zwischen der Modell- und der Kontrollgruppe blieben am Tag 28 nach der Operation im Schieflagen-Score und in der Griffstärke erhalten. Diese kombinierten Ergebnisse deuten darauf hin, dass diese Operation eine fortschreitende Kompression des zervikalen Rückenmarks induziert und bei Ratten eine Verschlechterung der motorischen Fähigkeiten verursacht.
Histologische Veränderungen und Entzündungen, die durch Kompression im Rückenmark induziert werden
Nach der Durchtrennung des zervikalen Rückenmarks konnte eine markante Vertiefung von 2 mm Tiefe und 2 mm x 2 mm Fläche am Rückenmark beobachtet werden (Abbildung 3B). Um die morphometrischen Veränderungen beurteilen zu können, wurden die Rückenmarksschnitte angefärbt und unter einem Lichtmikroskop betrachtet. Die H&E-Färbung zeigte die Infiltration von Immunzellen und einen dramatischen Verlust von Neuronen im Kompressionsbereich des Rückenmarks (Abbildung 3C). Darüber hinaus zeigte die Immunfärbung in der Modellgruppe einen dramatischen Anstieg der neuronalen Apoptose an der Kompressionsstelle des Rückenmarks (Abbildung 3D, 3E). Einige Zellen oder Gewebe weisen eine hohe Nuklease- und Polymerase-Aktivität auf, was zu unspezifischer Fluoreszenz führen kann. Daher wurde das Gewebe unmittelbar nach der Extraktion immobilisiert, um zu verhindern, dass diese Enzyme falsch positive Ergebnisse verursachen. Die TUNEL-Färbung ist unspezifisch und kann im Falle eines Zell- oder Neuronentods eingesetzt werden. NeuN ist ein spezifischer Färbemarker für Neuronen. Als Ergebnis wurden zusammengeführte Bilder von TUNEL-Färbungen und NeuN-Färbungen verwendet, um die neuronale Apoptose zu demonstrieren.
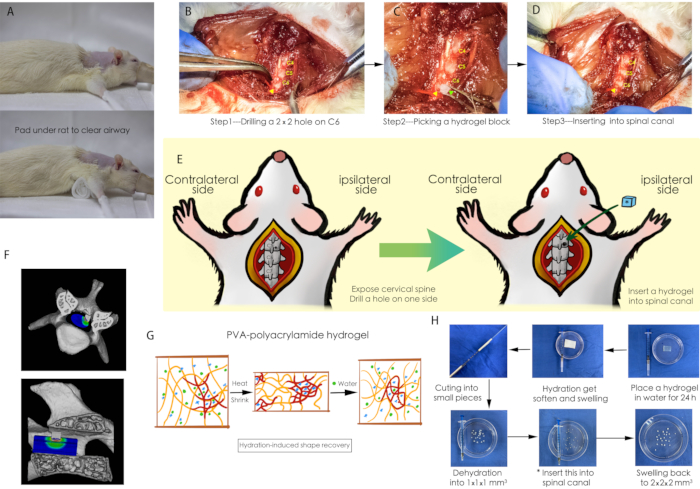
Abbildung 1: Ein Schema des chirurgischen Eingriffs. (A) Ein Mullkissen wurde unter die Ratte gelegt, um sicherzustellen, dass die Atemwege der Ratte während der Operation frei waren. (B-D) Ein chirurgischer Eingriff der Hydrogel-Implantation in den zervikalen Spinalkanal; Die gelbe Pfeilspitze zeigt auf ein winziges Loch, das in die Wirbelplatte von C6 gebohrt wurde, und die grüne Pfeilspitze zeigt den dehydrierten Hydrogelblock. (E) Ein Schema des chirurgischen Eingriffs. (F) Ein dreidimensionales Schema der Rückenmarkskompression. (G) Wasserabsorbierende Eigenschaft des PVA-Polyacrylamid-Hydrogels. (H) Vorbereitung des Hydrogelblocks für die Rückenmarkskompression. Abkürzungen: PVA = Polyvinylalkohol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Morphologie der Vorderpfote und Verhaltensbeobachtungen mit BHS-Skala, Griffkrafttest und Schrägplattentest. (A) Ein typisches Merkmal der ipsilateralen Vorderpfoten der Ratten der Kontrollgruppe (links) und der Modellgruppe (rechts) am dritten Tag nach der Operation. (B) Die Breite und Länge der Vorderpfoten der Ratten wurden gemessen. Der rote Querpfeil verläuft vom ersten bis zum vierten Finger, und der rote Längspfeil verläuft von der Spitze des längsten Fingers bis zur Wurzel der Handfläche. (C) Quantitative Analyse der Länge und Breite der ipsilateralen Vorderpfoten in der Modell- und Kontrollgruppe. (D) BHS-Score sowohl der ipsilateralen als auch der kontralateralen Seite 1, 3, 7, 14, 21 und 28 Tage nach der Operation. (E) Die Griffkraft sowohl der ipsilateralen als auch der kontralateralen Seitenvordergliedmaßen 1, 3, 7, 14, 21 und 28 Tage nach der Operation, beurteilt mit dem Grifffestigkeitstest. (F) Schematische Darstellung der Prüfung der geneigten Platte. (G) Die Stärke und das Gleichgewicht sowohl der ipsilateralen als auch der kontralateralen Seitengliedmaßen 1, 3, 10, 20 und 28 Tage nach der Operation, beurteilt mit dem Schrägplattentest. Die Daten werden als Mittelwert ± SD dargestellt. *P < 0,05 und **P < 0,01 vs. Kontrollgruppe; n = 10/Gruppe. Abkürzung: BBB = Basso, Beattie und Bresnahan Rating Scale. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
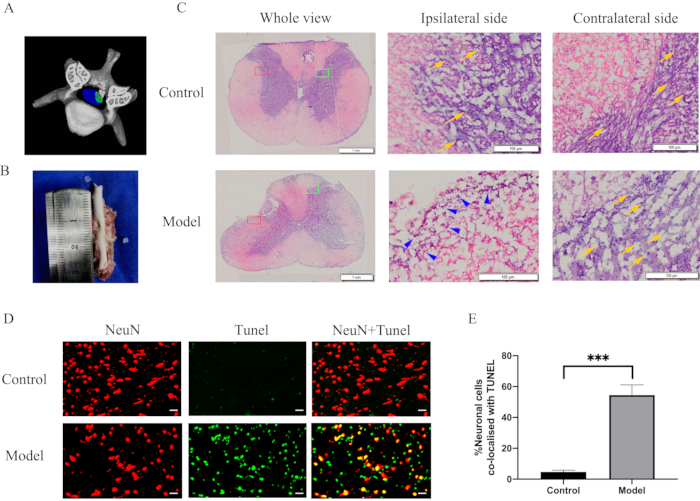
Abbildung 3: Morphologische Veränderungen und Entzündungsreaktionen nach längerer zervikaler Rückenmarkskompression. (A) Ein dreidimensionales Schema der Rückenmarkskompression. (B) Eine Vertiefung von 2 mm Tiefe und einer Fläche von 2 mm x 2 mm auf dem Rückenmark. (C) Ein histologischer Schnitt des Rückenmarks 28 Tage nach der Kompression und H&E-Färbung. Die Infiltration von Immunzellen und ein dramatischer Verlust von Neuronen im Kompressionsbereich des Rückenmarks. Rotes Rechteck, ipsilaterale Seite; grünes Rechteck, kontralateral; blaue Pfeilspitzen, Immunzellen; gelbe Pfeile, Neuronen. (D) Doppelte Färbung für NeuN (rot)/TUNEL (grün) von Schnitten aus der Rückenmarkskompressionsstelle in der Modell- und Kontrollgruppe. Maßstabsbalken = 20 μm. (E) Quantifizierung von doppelt positiven NeuN- und TUNEL-Zellen. P < 0,001 im Vergleich zur Kontrollgruppe; n = 10/Gruppe. Abkürzungen: H & E = Hämatoxylin und Eosin; NeuN = neuronale Kerne; TUNEL = dUTP-Beschriftung des Nick-Ends. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Punktzahl | Operationelle Definitionen von Kategorien und Attributen | ||
| 0 | Keine beobachtbare Bewegung der Hintergliedmaßen | ||
| 1 | Leichte (begrenzte) Bewegung eines oder zweier Gelenke, in der Regel Hüfte und/oder Knie | ||
| 2 | Ausgedehnte Bewegung eines Gelenks oder ausgedehnte Bewegung eines Gelenks und leichte Bewegung des anderen Gelenks | ||
| 3 | Umfangreiche Bewegung von zwei Gelenken | ||
| 4 | Leichte Bewegung aller drei Gelenke der Hintergliedmaßen | ||
| 5 | Leichte Bewegung von zwei Gelenken und ausgedehnte Bewegung des dritten Gelenks | ||
| 6 | Ausgedehnte Bewegung von zwei Gelenken und leichte Bewegung des dritten Gelenks | ||
| 7 | Ausgedehnte Bewegung der drei Gelenke in den Hintergliedmaßen | ||
| 8 | Kehren ohne Belastung oder plantare Abstützung der Pfote ohne Belastung | ||
| 9 | Plantarstütze der Pfote mit Belastung nur in der Stützphase (d.h. wenn statisch) oder gelegentliches, häufiges oder inkonsistentes Rückentreten mit Belastung und ohne Plantartritt | ||
| 10 | Plantarschritt mit gelegentlicher Belastung und ohne Koordination zwischen Vordergliedmaßen und Hintergliedmaßen | ||
| 11 | Plantarschritt mit häufiger bis gleichmäßiger Belastung und gelegentlicher Koordination zwischen Vordergliedmaße und Hintergliedmaße | ||
| 12 | Plantarschritt mit häufiger bis gleichmäßiger Belastung und gelegentlicher Koordination zwischen Vordergliedmaße und Hintergliedmaße | ||
| 13 | Plantarschritt mit häufiger bis gleichmäßiger Belastung und häufiger Koordination zwischen Vordergliedmaßen und Hintergliedmaßen | ||
| 14 | Plantarschritt mit konsequenter Gewichtsstützung, konsequenter Koordination der Vordergliedmaßen-Hintergliedmaßen und überwiegend rotierter Pfotenhaltung (innen oder außen) während der Fortbewegung, sowohl im Moment des ersten Kontakts mit der Oberfläche als auch vor dem Bewegen der Zehen am Ende der Stützphase oder häufiges Plantartreten, konsequente Koordination der Vordergliedmaße-Hintergliedmaßen und gelegentliches Dorsaltreten | ||
| 15 | Konsequenter Plantarschritt, konsequente Koordination zwischen Vordergliedmaßen und Hintergliedmaßen und keine Bewegung der Zehen oder gelegentliche Bewegungen während der Vorwärtsbewegung der Gliedmaßen; Die vorherrschende Pfotenposition ist zum Zeitpunkt des ersten Kontakts parallel zum Körper. | ||
| 16 | Konsistenter Plantarschritt und Koordination zwischen Vordergliedmaßen und Hintergliedmaßen während des Gangs und der Bewegung der Zehen treten häufig während der Vorwärtsbewegung der Extremität auf; Die vorherrschende Pfotenposition ist zum Zeitpunkt des ersten Kontakts parallel zum Körper und im Moment der Bewegung gekrümmt. | ||
| 17 | Konsistenter Plantarschritt und Koordination zwischen Vordergliedmaßen und Hintergliedmaßen während des Gangs und der Bewegung der Zehen treten häufig während der Vorwärtsbewegung der Gliedmaßen auf; Die vorherrschende Pfotenposition ist zum Zeitpunkt des ersten Kontakts und im Moment der Bewegung der Zehen parallel zum Körper. | ||
| 18 | Konsistenter Plantarschritt und Koordination zwischen Vordergliedmaßen und Hintergliedmaßen während des Gangs und der Bewegung der Zehen erfolgt konsistent während der Vorwärtsbewegung der Gliedmaßen; Die vorherrschende Pfotenposition ist zum Zeitpunkt des ersten Kontakts parallel zum Körper und bei Bewegung der Zehen gekrümmt. | ||
| 19 | Konsistenter Plantarschritt und Koordination zwischen Vordergliedmaßen und Hintergliedmaßen während des Gangs und der Bewegung der Zehen erfolgt konsistent während der Vorwärtsbewegung der Gliedmaßen; Die vorherrschende Pfotenposition ist zum Zeitpunkt des Kontakts und zum Zeitpunkt der Bewegung der Zehen parallel zum Körper, und das Tier präsentiert die ganze Zeit oder über einen nach unten gerichteten Schwanz. | ||
| 20 | Konsistenter Plantarschritt und Koordination zwischen Vordergliedmaßen und Hintergliedmaßen während des Gangs und der Bewegung der Zehen erfolgt konsistent während der Vorwärtsbewegung der Gliedmaßen; Die vorherrschende Pfotenposition ist zum Zeitpunkt des Kontakts und zum Zeitpunkt der Bewegung der Zehen parallel zum Körper, und das Tier weist eine gleichmäßige Erhöhung der Schwanz- und Rumpfinstabilität auf. | ||
| 21 | Gleichmäßiger Plantarschritt und koordinierter Gang, gleichmäßige Bewegung der Zehen; Die Pfotenposition ist während der gesamten Stützphase überwiegend parallel zum Körper; gleichbleibende Rumpfstabilität; Gleichmäßige Heckerhöhung | ||
Tabelle 1: 21-Punkte-Funktionsbewertungsskala von Basso et al.9,11.
Diskussion
Ziel dieses chirurgischen Eingriffs war es, eine reproduzierbare, verlängerte, neuronale Apoptose im Rückenmark der Ratte zu erzeugen. Ein wesentlicher Vorteil dieses Modells besteht darin, dass die expandierbaren Hydrogel-Implantate eine verlängerte Kompression des Rückenmarks ermöglichen, was zu einer progressiven neuronalen apoptotischen Reaktion führt (Abbildung 2C), die mit dem pathologischen Prozess der CSM übereinstimmt. In der aktuellen Studie war die Mortalität durch Rückenmarksverletzungen extrem niedrig (~2 von 50), während die Wiederholbarkeit dieses Modells > 45 von 50 lag. Eine falsche Größe der Hydrogelstücke und eine kräftige Implantation während der Operation können zu einer akuten Verletzung des Rückenmarks führen12,13.
Eine unveröffentlichte Studie14 ergab, dass eine Implantation mit einer Expansionsrate von 350 % zu einer vorübergehenden und akuten CSM mit fortschreitender Genesung über mehrere Wochen führte. Eine Expansionsrate von 200% führte im CSM-Modell zu einer langsam fortschreitenden Lähmung, da die Implantate härter waren als das Rückenmark. Bei diesem Modell waren wir jedoch nicht an der Härte des implantierten Materials interessiert, sondern nur an der endgültigen Größe dieser Implantation. Nach 4 Wochen wurde eine Vertiefung am Rückenmark beobachtet (Abbildung 3A, 3B), die die anhaltende Verengung des Rückenmarks, die verschlimmerte Neuroinflammation und die neuronale Apoptose widerspiegelte.
Derzeit gibt es keinen Konsens über die Größe der Implantate. Mehrere Studien verwendeten saugfähige Platten mit einer Dicke von 0,5-1 mm 15,16,17,18 und berichteten über Funktionsbehinderungen durch Wirbelsäulenkompression. Eine weitere Studie zur Kompression des Rückenmarks an Ratten19 zeigte, dass der Verlust der intakten weißen Substanz und die dramatische Abflachung des Rückenmarks durch eine starke Rückenmarkskompression (2,6 mm Dicke) induziert wurden, die eine Kompressionsdehnung ohne Entzündung widerspiegelte. Daher kann ein großes Implantat, das aus einem weichen, expandierbaren Material hergestellt wird, für eine verlängerte Kompression des Rückenmarks geeignet sein.
Im aktuellen Modell war die Größe der Hydrogelstücke und des Bohrers auf der Wirbelplatte streng auf eine Größe von 1 mm x 1 mm x 1 mm begrenzt, um eine akute Rückenmarksverletzung oder einen Unfalltod durch plötzliche Gewalteinwirkung durch übergroße Implantate zu vermeiden. Nach 48 Stunden Hydratation dehnten sich die Hydrogelblöcke auf eine Größe von 2 mm x 2 mm x 2 mm aus. Klinisch hängt die Verschlimmerung der Symptome bei CSM-Patienten mit der plötzlichen Kompression des Rückenmarks zusammen, die auf eine kontinuierliche Bandscheibenvorfallkompression am Rückenmark und eine anschließende geringere kompensierte Anpassung zurückzuführen ist, die durch Entzündungen und Ödeme induziert wird 4,7. Dies könnte erklären, warum die einseitige inflammatorische Hydrogel-Infiltration zu einem bilateralen neurologischen Funktionsdefizit führt20.
Eine Einschränkung dieses Tiermodells besteht darin, dass Ratten eine starke Anpassung an jede Verletzung zeigen21, was eine schnelle Genesung erleichtert. Mehrere Studien haben eine kontinuierliche Verbesserung der neurologischen Funktion im Laufe der Zeit nach der Kompressionsoperation gezeigt 15,16,17,18,21,22, während nur wenige Studien über eine Verschlechterung des Trends berichtet haben. Darüber hinaus zeigen die meisten CSM-Patienten bei konsequenter Kompression des Rückenmarks entweder eine allmähliche Genesung oder eine Verschlechterung der neurologischen Funktion23. Da es im aktuellen Modell nach 4 Wochen keinen signifikanten Unterschied in der Motorik gab, brachen wir die Verhaltensuntersuchung ab und euthanasierten die Ratten für weitere histologische Untersuchungen. Zusammenfassend lässt sich sagen, dass diese Studie ein neuronales Apoptosemodell vorstellt, das durch Rückenmarkskompression bei Ratten induziert wird, ein praktisches Tiermodell zur Untersuchung der zellulären und molekularen Mechanismen, die mit CSM und Rückenmarksregeneration verbunden sind.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen und geben an, dass es keine Einschränkungen für den vollen Zugang zu allen in dieser Studie verwendeten Materialien gibt.
Danksagungen
Diese Studie wurde unterstützt vom National Key R&D Program of China (2018YFC1704300), der National Natural Science Foundation of China (81930116, 81804115, 81873317 und 81704096), dem Shanghai Sailing Program (18YF1423800) und der Natural Science Foundation of Shanghai (20ZR1473400). Dieses Projekt wurde auch von der Shanghai University of Traditional Chinese Medicine (2019LK057) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Antibiotic ointment | Prevent wound infection | ||
| Buprenorphine-SR | Pain relief | ||
| Isoflurane | Veteasy | Anesthesia | |
| Inhalant anesthesia equipment | Anesthesia | ||
| Micro ophthalmic forceps | Mingren medical equipment | Length: 11 cm, Head diameter: 0.3 mm | Clip the muscle |
| Ophthalmic forceps | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | JD1050 | Clip the skin |
| Ophthalmic scissors (10 cm) | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | Y00030 | Skin incision |
| SD male rats | Shanghai SLAC Laboratory Animal Co., Ltd | SCXK2018-0004 | Animal model |
| Sterile surgical blades (22#) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | 35T0707 | Muscle incision |
| Small animal trimmer | Hair removal | ||
| Veet hair removal cream | RECKITT BENCKISER (India) Ltd | Hair removal | |
| Venus shears | Mingren medical equipment | Length: 12.5 cm | Muscle incision |
Referenzen
- Lebl, D. R., Bono, C. M. Update on the diagnosis and management of cervical spondylotic myelopathy. The Journal of the American Academy of Orthopaedic Surgeons. 23 (11), 648-660 (2015).
- Haddas, R., et al. Spine and lower extremity kinematics during gait in patients with cervical spondylotic myelopathy. The Spine Journal. 18 (9), 1645-1652 (2018).
- Song, D. W., Wu, Y. D., Tian, D. D. Association of Vdr-Foki and Vdbp-Thr420 Lys polymorphisms with cervical spondylotic myelopathy: A case-control study in the population of China. Journal of Clinical Laboratory Analysis. 33 (2), 22669(2019).
- Kurokawa, R., Murata, H., Ogino, M., Ueki, K., Kim, P. Altered blood flow distribution in the rat spinal cord under chronic compression. Spine. 36 (13), 1006-1009 (2011).
- Wen, C. Y., et al. Is Diffusion anisotropy a biomarker for disease severity and surgical prognosis of cervical spondylotic myelopathy. Radiology. 270 (1), 197-204 (2014).
- Long, H. Q., Li, G. S., Hu, Y., Wen, C. Y., Xie, W. H. Hif-1A/Vegf signaling pathway may play a dual role in secondary pathogenesis of cervical myelopathy. Medical Hypotheses. 79 (1), 82-84 (2012).
- Karadimas, S. K., Erwin, W. M., Ely, C. G., Dettori, J. R., Fehlings, M. G. Pathophysiology and natural history of cervical spondylotic myelopathy. Spine. 38, 21-36 (2013).
- Wilson, J. R., et al. State of the art in degenerative cervical myelopathy: an update on current clinical evidence. Neurosurgery. 80, 33-45 (2017).
- Baptiste, D. C., Fehlings, M. G. Pathophysiology of cervical myelopathy. The spine Journal. 6, 190-197 (2006).
- Wilcox, J. T., et al. Generating level-dependent models of cervical and thoracic spinal cord injury: exploring the interplay of neuroanatomy, physiology, and function. Neurobiology of Disease. 105, 194-212 (2017).
- Takano, M., et al. Inflammatory cascades mediate synapse elimination in spinal cord compression. Journal of Neuroinflammation. 11, 40(2014).
- Hu, Y., et al. Somatosensory-evoked potentials as an indicator for the extent of ultrastructural damage of the spinal cord after chronic compressive injuries in a rat model. Clinical Neurophysiology. 122 (7), 1440-1447 (2011).
- Yang, T., et al. Inflammation level after decompression surgery for a rat model of chronic severe spinal cord compression and effects on ischemia-reperfusion injury. Neurologia Medico-Chirurgica. 55 (7), 578-586 (2015).
- Ijima, Y., et al. Experimental rat model for cervical compressive myelopathy. Neuroreport. 28 (18), 1239-1245 (2017).
- Yamamoto, S., Kurokawa, R., Kim, P. Cilostazol, a selective type iii phosphodiesterase inhibitor: prevention of cervical myelopathy in a rat chronic compression model. Journal of Neurosurgery. Spine. 20 (1), 93-101 (2014).
- Holly, L. T., et al. Dietary therapy to promote neuroprotection in chronic spinal cord injury. Journal of Neurosurgery. Spine. 17 (2), 134-140 (2012).
- Zhao, P., et al. In vivo diffusion tensor imaging of chronic spinal cord compression: a rat model with special attention to the conus medullaris. Acta Radiologica. 57 (12), 1531-1539 (2016).
- Kurokawa, R., Nagayama, E., Murata, H., Kim, P. Limaprost alfadex, a prostaglandin E1 derivative, prevents deterioration of forced exercise capability in rats with chronic compression of the spinal cord. Spine. 36 (11), 865-869 (2011).
- Lee, J., Satkunendrarajah, K., Fehlings, M. G. Development and characterization of a novel rat model of cervical spondylotic myelopathy: the impact of chronic cord compression on clinical, neuroanatomical, and neurophysiological outcomes. Journal of Neurotrauma. 29 (5), 1012-1027 (2012).
- Chen, B., et al. Reactivation of dormant relay pathways in injured spinal cord by Kcc2 manipulations. Cell. 174 (3), 521-535 (2018).
- Yu, W. R., Liu, T., Kiehl, T. R., Fehlings, M. G. Human neuropathological and animal model evidence supporting a role for Fas-mediated apoptosis and inflammation in cervical spondylotic myelopathy. Brain. 134, 1277-1292 (2011).
- Yu, W. R., et al. Molecular mechanisms of spinal cord dysfunction and cell death in the spinal hyperostotic mouse: implications for the pathophysiology of human cervical spondylotic myelopathy. Neurobiology of Disease. 33 (2), 149-163 (2009).
- Iyer, A., Azad, T. D., Tharin, S. Cervical spondylotic myelopathy. Clinical Spine Surgery. 29 (10), 408-414 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten