Method Article
쥐에서 척수 압박에 의해 유도된 신경 세포 사멸 모델
* 이 저자들은 동등하게 기여했습니다
요약
여기에서는 쥐의 척수 압박 모델을 생성하고, 행동 점수를 평가하고, 압박된 척수 영역을 관찰하는 프로토콜을 제시합니다. 행동 평가는 모니터 운동 장애가 감소한 것으로 나타났습니다. 헤마톡실린(Hematoxylin)과 에오신 염색(eosin staining) 및 면역염색(immunostaining)은 척수의 압박 부위에서 상당한 신경세포 자멸사(neuronal apoptosis)를 밝혀냈습니다.
초록
경추 척추 척수병증(CSM)은 중증의 진행성 퇴행성 질환으로 예후가 좋지 않으며 신체적 통증, 뻣뻣함, 운동 또는 감각 기능 장애, 척수 손상 및 고관절리증의 위험이 높습니다. 따라서 이 만성 및 진행성 질환에서 효율적인 척수 재생을 촉진하는 치료 전략이 시급히 필요합니다. CSM의 기저에 있는 복잡한 생물학적 메커니즘을 이해하기 위해서는 효과적이고 재현 가능한 동물 척수 압박 모델이 필요합니다. 대부분의 척수 손상 모델은 급성 및 구조적 파괴 상태를 반영하는 반면, CSM의 동물 모델은 척수의 만성적인 압박을 나타냅니다. 이 논문은 쥐의 척수 압박 모델을 생성하는 프로토콜을 제시하며, 이는 행동 점수를 평가하고 압박된 척수 영역을 관찰하여 추가로 평가되었습니다. 행동 평가에서는 관절 움직임, 스테핑 능력, 협응력, 몸통 안정성 및 사지 근력을 포함한 모니터 운동 장애가 감소한 것으로 나타났습니다. 헤마톡실린(Hematoxylin)과 에오신(eosin, H&E) 염색 및 면역염색 결과, 척수의 압박 부위에서 상당한 신경세포 사멸(neuronal apoptosis)이 밝혀졌습니다.
서문
흔한 진행성 퇴행성 질환인 CSM은 모든 경추증의 5-10%를 차지합니다1. CSM을 앓고 있는 환자가 증상을 무시하고 적시에 효과적인 방식으로 치료하지 못할 경우, 척수 손상 및 사지 마비와 같은 심각한 합병증이 발생할 수 있으며, 이는 노화에 따라 악화되어 환자와 그 가족에게 상당한 경제적, 정신적 부담을 줄 수 있습니다 2,3. CSM의 발병 기전은 정적 요인과 동적 요인, 저산소증-허혈 이론, 내피 세포 손상, 혈수 장벽 파괴 이론, 염증 및 세포사멸 이론 4,5,6,7 등을 포함하는 복잡합니다.
척수에 가해지는 압박의 정적 및 동적 메커니즘은 임상 증상을 유발합니다. 돌출된 척추 디스크, 기형적인 척추체 및 석회화된 인대는 장기간의 척수 압박을 유발할 수 있으며, 이는 척수의 혈액-척수 장벽과 국소 미세혈관 구조에 점차적으로 영향을 미칠 수 있습니다 4,8. 차례로 허혈, 염증 및 세포사멸은 뉴런, 축삭 및 신경교세포에 영향을 미칩니다 6,9.
척수 손상의 실험 동물 모델에는 타박상 손상, 압박 손상, 견인 손상, 광화학 유발 손상 및 허혈-재관류 손상이 포함됩니다. 이러한 모델의 대부분은 또한 일부 급성 및 구조적 파괴 조건(절제 또는 화학적 독성)을 반영합니다. 그러나 이러한 CSM의 동물 모델은 척수에 진행성 신경 세포 사멸을 나타낼 수 없습니다.
이 논문은 쥐의 척수 압박 모델을 생성하기 위한 자세한 프로토콜을 설명하며, 이는 행동 점수를 평가하고 척수의 압박 영역을 관찰하여 추가로 평가되었습니다. 이 쥐의 척수 압박 모델은 CSM과 관련된 메커니즘에 대한 추가 연구를 위한 신뢰할 수 있는 동물 모델입니다.
프로토콜
다음 절차는 상하이 중국 전통 의학 대학의 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받아 수행되었습니다. 모든 생존 수술은 NIH 지침에 명시된 멸균 상태에서 수행되었습니다. 통증과 감염 위험은 성공적인 결과를 보장하기 위해 적절한 진통제와 항생제로 관리되었습니다. 이 수술 절차는 생후 12주와 체중 400g의 Sprague-Dawley(SD) 근친 수컷 쥐에 최적화되어 있습니다.
1. PVA-폴리아크릴아미드 하이드로겔 제제
참고: 그림 1G, 1H에서 볼 수 있듯이 PVA-폴리아크릴아미드 하이드로겔은 수분을 흡수하는 폴리머 시트입니다. 자연 상태에서 젤은 작은 조각으로 자르는 것이 매우 어렵습니다. 제제는 다음과 같이 설명됩니다.
- PVA-폴리아크릴아미드 하이드로겔을 물에 24시간 동안 넣어 수화 후 쉽게 절단할 수 있습니다.
- 자체 제작 절단 도구(그림 1H)를 사용하여 전체 하이드로겔을 2mm x 2mm x 2mm 크기의 조각으로 나눕니다.
- 이 하이드로겔 조각을 60°C의 오븐에서 12시간 동안 옮겨 탈수시켜 1mm x 1mm x 1mm의 작은 조각으로 주입 재료로 만듭니다.
2. 마취 및 준비
참고: 멸균 수술 과정 내내 수술용 모자, 일회용 의료용 마스크, 멸균 수술용 장갑을 착용하십시오.
- 쥐를 가열 패드에 놓고 마취 중에 직장 온도가 37±1 °C로 유지되는지 확인합니다.
- 쥐를 3% 이소플루란으로 채워진 마취실에 3분 동안 놓습니다.
- 핀셋으로 쥐의 팔다리와 발가락을 부드럽게 꼬집어 금단 반응 상실을 테스트하면 성공적인 마취를 나타냅니다.
- 쥐를 엎드린 자세로 수술대에 고정하고 쥐의 팔다리와 머리가 단단히 고정되었는지 확인하십시오.
- 마취 마스크를 쥐의 얼굴에 고정하십시오. 척추 압박 수술 전반에 걸쳐 쥐를 마취하기 위해 표준 쥐 코 마스크를 통해 산소/공기 혼합물에 2% 이소플루란을 투여합니다.
- 쥐와 수술대(그림 1A) 사이에 원통형 거즈 패드(약 30mm x 20mm x 60mm 크기)를 놓아 수술 내내 기도가 막히지 않고 수술 부위가 완전히 노출되도록 합니다.
- 전기 면도기로 쥐의 목 수술 부위 주위의 털을 면도합니다.
- 제모 크림을 바르면 남은 털을 제거하고 피부가 드러납니다.
- 요오드로 수술 부위를 소독하십시오.
- 소독된 부위를 멸균 수건으로 덮고 구멍이 뚫려 있어 쥐 목의 등쪽 수술 부위만 노출시킵니다.
3. 외과적 접근법
- 두 번째 경추 척추 돌기와 두 번째 흉추 돌기를 경피적으로 배치한 후 두 번째 경추 가시돌기에서 두 번째 흉추돌기로 메스로 등쪽 정중선을 세로로 절개합니다.
- Blunt는 피하 조직과 근막을 층별로 절단한 후 C2-T2 층을 노출시키기 위해 지혈 겸자로 양쪽의 근육을 분리합니다.
- 경추 층류에 구멍(1mm x 1mm)을 뚫습니다(그림 1B).
알림: 척수에 과도한 부상을 입지 않으려면 쥐의 목이 등쪽 아치 상태로 유지되어 경추 얇은 판 사이에 충분한 공간이 있는지 확인하십시오. - 미세수술 겸자를 사용하여 1mm x 1mm x 1mm 크기의 PVA-폴리아크릴아미드 하이드로겔 조각을 잡고 이전에 뚫린 구멍에 삽입합니다(그림 1C, 1D).
참고: 일시적인 경련 성능은 척수 압박 모델이 성공적으로 설정되었음을 나타냅니다. - 근육, 근막, 피하 및 피부 조직을 삼각형 바늘과 5-0 봉합사를 사용하여 층별로 봉합합니다.
- 소독 후 동물을 우리로 다시 옮기고 따뜻하게 유지하십시오.
- 부프레노르핀 염산염 진통제(0.03mg/kg)를 수술 후 3일간 6시간 간격으로 피하주사하고 그 후 필요에 따라 투여합니다.
4. 수술 후 관리
- 하루에 한 번 100,000 단위의 페니실린을 복강내 주사하여 수술 후 감염을 예방하고 통증을 완화합니다.
- 수술 후 적절한 열 보존을 보장하기 위해 적외선 램프로 지속적으로 가열된 새 케이지로 쥐를 옮깁니다.
알림: 쥐의 의식이 회복된 후 난방 램프를 제거하십시오. - 쥐의 먹이 케이지의 위생과 환기를 유지하십시오.
- 쥐가 하루에 두 번 먹고 마시는 것을 도와주세요. 필요한 경우 소변 기능이 회복될 때까지 배뇨를 돕기 위해 방광 마사지를 실시합니다.
5. 행동 평가
- BBB(Basso, Beattie 및 Bresnahan) 평가 척도를 사용하여 수술 후 행동을 평가합니다.
참고: BBB 등급 척도는 쥐의 척수 관련 기능을 평가하는 데 사용되는 황금 표준(표 1)입니다. 0(뒷다리 움직임이 관찰되지 않음)에서 21(보행 협응, 발가락 공간 일관성, 전체 자세에서 평행한 주요 발톱 위치, 일관된 몸통 안정성 및 일관된 꼬리 높이)까지의 점수에 따라 쥐의 움직임을 평가합니다.
6. 악력 시험
- 전자 그립 강도 측정기를 사용하여 그립 강도를 측정하십시오.
- 쥐의 아래쪽 절반을 잡아 쥐를 매달고 전면 그립 미터의 금속 막대를 잡을 수 있도록 합니다.
- 쥐가 금속 막대를 잡으면 당겨서 그립 강도를 기록하십시오.
- 각 쥐의 악력을 세 번 측정하고 가장 높은 점수를 기록합니다.
7. 경사판 시험
- 각도를 조절할 수 있는 고무판에 쥐를 놓습니다.
- 쥐가 균형을 잡고 5초 동안 단단히 서 있을 때까지 매번 경사판 각도를 5°씩 점차적으로 높입니다.
- 쥐가 경사판에서 균형을 잡을 수 있는 최대 각도를 기록하십시오.
- 각 쥐에 대해 최대 각도를 세 번 측정하고 가장 높은 점수를 기록합니다.
8. 안락사, 척수 분리 및 동결 임베딩
알림: 파라포름알데히드 및 포름알데히드 가스로부터 눈, 얼굴 및 호흡기를 보호하기 위해 적절한 눈 고글과 안면 보호대/마스크를 착용하십시오.
- 10% 클로랄 수화물에 해당하는 것을 복강내에 주입하여 쥐를 마취한 후 흉골을 열어 심장을 노출시킵니다.
- 관류 바늘을 심장 정점에 삽입하고 지혈 겸자로 고정한 다음 일반 식염수를 천천히 주입합니다.
- 깨끗한 생리식염수가 우심방에서 흘러나올 때까지 우심방 부속기에 구멍을 뚫어 성공적인 주입을 나타냅니다.
- 간이 하얗게 변한 후 정상적인 식염수 관류를 중단하십시오.
- 쥐의 몸이 뻣뻣해질 때까지 10% 상당의 파라포름알데히드를 주입합니다.
- 파라포름알데히드 관류 후 척추 주변의 피부, 근육 및 연조직을 제거합니다. 경추의 C2-C7 분절을 분리한다. 그리고 하룻밤 동안 고정을 위해 10% 파라포름알데히드에 담그십시오.
- 척추에서 경추를 분리하고 점진적인 탈수를 위해 10%, 20% 및 30% 자당 용액의 농도 구배에 놓습니다.
- 2mm 높이의 압축된 척수를 OCT 임베딩제와 함께 -80°C 냉동고에 옮깁니다.
- 7μm 두께의 절편으로 절편화하고 염색(H&E 염색 및 dUTP 닉 엔드 라벨링(TUNEL)/뉴런 핵(NeuN), 섹션 9 참조)한 후 각각 척수 및 신경 세포 사멸의 조직 병리학을 관찰합니다.
9. TUNEL/NeuN 면역 염색
- 척수 절편을 실온에서 10분 동안 인산염 완충 식염수(PBS)에 담근 다음 0.3% Triton X-100 및 5% 소 혈청 알부민(BSA)이 함유된 PBS 용액으로 1시간 동안 차단합니다.
- 4°C에서 하룻밤 동안 rabbit polyclonal anti-NeuN anti-NeuN antibody(1:200;)로 척수 절편을 배양합니다.
- PBS에서 척수 부분을 세 번 헹굽니다. 그 후 실온에서 2시간 동안 Alexa Fluor 594 복합 2차 항체를 배양합니다.
- 원스텝 TUNEL 세포사멸 분석 키트(녹색 형광)를 수행하여 척수 절편의 자가사멸핵을 염색합니다.
결과
척수 압박 손상은 사지의 신경근 장애로 이어질 수 있습니다.
하이드로겔 조각이 점진적으로 팽창함에 따라 장기간 동안 척수 부위를 지속적으로 압박하여 경추 척수 질환으로 인한 앞다리 장애를 시뮬레이션합니다 8,10. 현재 모델에서는 모델 그룹의 대부분의 쥐(9/10)에서 상당한 동측 앞발 구축이 관찰되었습니다(그림 2A). 앞발의 길이와 너비에 대한 추가 측정 및 분석은 격자선이 있는 종이에서 수행되었습니다(그림 2B). 이 데이터는 모델 그룹에서 동측 앞발의 길이와 너비가 수술 하루 후 현저하게 감소했음을 밝혔습니다(P < 0.01). 그러나 대조군과 모델군 사이의 반대쪽 앞발에서는 유의미한 차이가 감지되지 않았습니다(그림 2C).
사지의 경과와 신경근 장애를 평가하기 위해 BBB 등급 척도, 경사면 테스트 및 앞다리 그립 테스트를 사용하여 수술 후 1일, 3일, 7일, 14일, 21일, 28일에 관찰했습니다. 정규 분포 데이터를 분석하기 위해 Tukey의 검정을 사용한 단방향 또는 양방향 분석을 수행했습니다. 사후 분석을 사용한 비모수 Mann-Whitney U-검정은 정규 분포는 아니지만 등분산을 포함하는 데이터에 대해 수행되었습니다. 데이터는 평균 ± 표준 편차(SD)로 표현됩니다. 차이는 P < 0.05에서 통계적으로 유의한 것으로 간주되었다.
그 결과, 모델 그룹에 속한 쥐의 BBB 점수는 수술 후 1일과 3일에 점차 감소하여 초기 단계, 특히 동측 측에서 심각한 기능 장애를 나타내는 것으로 나타났습니다(그림 2D, 2E, 2G). 척수 압박에 대한 회복은 모델군과 대조군 모두에서 관찰되었지만, 모델군의 쥐는 수술 후 4주에 대조군에 비해 비정상적인 앞발 기능과 균형 능력의 회복이 느리고 불완전한 것으로 나타났습니다(그림 2E, 2G). 모델과 대조군 간의 유의한 차이는 수술 후 28일째에 경사면 점수와 악력에서 유지되었습니다. 이러한 종합적인 결과는 이 수술이 경추 척수에 점진적 압박을 유발하고 쥐의 운동 능력 저하를 유발한다는 것을 나타냅니다.
척수 압박에 의해 유발된 조직학적 변화 및 염증
경추 척수를 분리한 후 척수에서 2mm 깊이와 2mm x 2mm 영역의 눈에 띄는 움푹 들어간 곳이 관찰될 수 있었습니다(그림 3B). 형태학적 변화를 평가하기 위해 척수 부분을 염색하고 광학 현미경으로 관찰했습니다. H&E 염색은 면역 세포의 침투와 척수의 압축 영역에서 뉴런의 급격한 손실을 보여주었습니다(그림 3C). 또한, 면역염색을 통해 모델 그룹의 척수 압박 부위에서 신경 세포 사멸이 급격히 증가한 것으로 나타났습니다(그림 3D, 3E). 일부 세포 또는 조직은 뉴클레아제 및 중합효소 활성 수준이 높아 비특이적 형광을 유발할 수 있습니다. 따라서 이러한 효소가 위양성을 일으키는 것을 방지하기 위해 추출 직후 조직을 고정시켰습니다. TUNEL 염색은 비특이적이며 세포 또는 뉴런이 사멸하는 경우에 사용할 수 있습니다. NeuN은 뉴런에 대한 특정 염색 마커입니다. 그 결과, TUNEL 염색 및 NeuN 염색의 병합된 이미지를 사용하여 신경 세포 사멸을 입증했습니다.
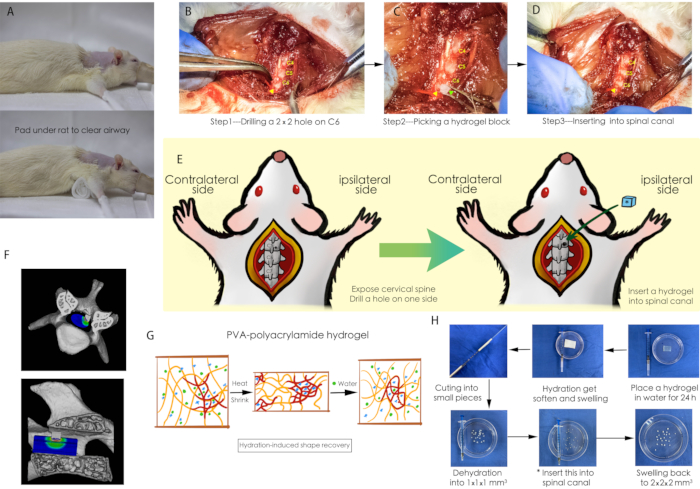
그림 1: 수술 절차의 개략도. (A) 수술 중 쥐의 기도가 깨끗한지 확인하기 위해 거즈 패드를 쥐 아래에 놓았습니다. (B-D) 경추 척추관에 하이드로겔을 이식하는 수술 절차; 노란색 화살촉은 C6의 척추판에 뚫린 작은 구멍을 가리키고 녹색 화살촉은 탈수된 하이드로겔 블록을 나타냅니다. (E) 수술 절차의 개략도. (F) 척수 압박의 3차원 개략도. (G) PVA-폴리아크릴아미드 하이드로겔의 흡수성. (H) 척수 압박을 위한 하이드로겔 블록의 준비. 약어: PVA = 폴리비닐 알코올. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 앞발의 형태 및 BBB 스케일, 악력 테스트 및 경사판 테스트를 통한 행동 관찰. (A) 수술 후 3일째 되는 날 대조군(왼쪽)과 모델 그룹(오른쪽) 쥐의 동측 앞발의 전형적인 특징. (B) 쥐의 앞발의 너비와 길이를 측정했습니다. 가로 방향 빨간색 화살표는 첫 번째 손가락에서 네 번째 손가락까지이고 세로 빨간색 화살표는 가장 긴 손가락 끝에서 손바닥 뿌리까지입니다. (C) 모델 및 대조군에서 동측 앞발의 길이와 너비에 대한 정량적 분석. (D) 수술 후 동측 및 반대측 1, 3, 7, 14, 21, 28일 모두의 BBB 점수. (E) 수술 후 1, 3, 7, 14, 21, 28일 후 동측 및 반대쪽 측면 앞다리의 악력은 악력 테스트로 평가됩니다. (F) 경사판 시험의 개략도. (G) 수술 후 1, 3, 10, 20, 28일 후 동측 및 반대쪽 사지의 강도와 균형을 경사판 테스트로 평가했습니다. 데이터는 평균 ± SD로 표시됩니다. *P < 0.05 및 **P < 0.01 대 대조군; n = 10/그룹. 약어: BBB = Basso, Beattie 및 Bresnahan 평가 척도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
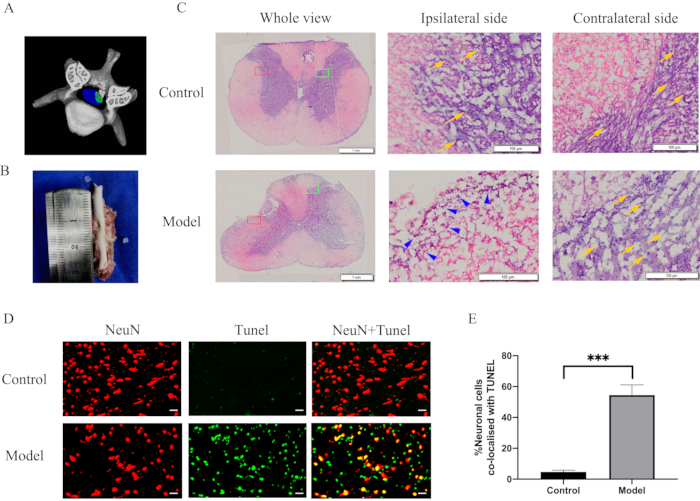
그림 3: 장기간의 경추 척수 압박 후 형태학적 변화 및 염증 반응. (A) 척수 압박의 3차원 도식. (B) 척수에 2mm 깊이와 2mm x 2mm 면적의 움푹 들어간 곳. (C) 압박 및 H&E 염색 후 28일째에 척수 조직학적 절편. 면역 세포의 침투와 척수의 압축 영역에서 뉴런의 급격한 손실. 빨간색 직사각형, 동측 측면; 녹색 직사각형, 반대쪽; 푸른 화살촉, 면역 세포; 노란색 화살표, 뉴런. (D) 모델 및 대조군에서 척수 압박 부위 절편의 NeuN(빨간색)/TUNEL(녹색)에 대한 이중 염색. 스케일 바 = 20μm. (E) NeuN 및 TUNEL 이중 양성 셀의 정량화. P < 0.001 대조군과 비교; n = 10/그룹. 약어: H & E = 헤마톡실린 및 에오신 ; NeuN = 신경핵; TUNEL = dUTP 흠집 끝 라벨링. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 점수 | 범주와 속성의 운영 정의Operational definitions of categories and attributes | ||
| 0 | 뒷다리의 눈에 띄는 움직임 없음 | ||
| 1 | 하나 또는 두 개의 관절, 일반적으로 엉덩이 및/또는 무릎의 경미한(제한된) 움직임 | ||
| 2 | 한 관절의 광범위한 움직임 또는 한 관절의 광범위한 움직임과 다른 관절의 경미한 움직임 | ||
| 3 | 두 관절의 광범위한 움직임 | ||
| 4 | 뒷다리의 세 관절이 모두 약간 움직입니다. | ||
| 5 | 두 관절의 경미한 움직임 및 세 번째 관절의 광범위한 움직임 | ||
| 6 | 두 관절의 광범위한 움직임과 세 번째 관절의 약간의 움직임 | ||
| 7 | 뒷다리에 있는 세 관절의 광범위한 움직임 | ||
| 8 | 체중을 지탱하지 않고 쓸어넘기거나 체중을 지탱하지 않고 발을 발바닥으로 지지합니다. | ||
| 9 | 지지 단계(즉, 정지된 경우)에서만 체중을 지탱하는 발바닥을 지지하거나 체중을 지탱하고 발바닥 스테핑이 없는 가끔, 빈번하거나 일관성 없는 등쪽 스테핑 | ||
| 10 | 가끔 체중을 지탱하고 앞다리와 뒷다리의 협응이 없는 발바닥 밟기 | ||
| 11 | 빈번하고 일관된 체중 부하와 때때로 앞다리-뒷다리 협응을 통한 발바닥 스텝 | ||
| 12 | 빈번하고 일관된 체중 부하와 때때로 앞다리-뒷다리 협응을 통한 발바닥 스텝 | ||
| 13 | 잦은 발바닥 스테핑에서 일관된 체중 부하와 빈번한 앞다리-뒷다리 협응 | ||
| 14 | 일관된 체중 지지, 일관된 앞다리-뒷다리 협응 및 주로 회전된 발 위치(내부 또는 외부)를 통한 발바닥 스테핑, 지반 단계가 끝날 때 발가락을 움직이기 전뿐만 아니라 표면과 처음 접촉하는 순간 또는 빈번한 발바닥 스테핑, 일관된 앞다리-뒷다리 협응 및 가끔 등쪽 스테핑 | ||
| 15 | 일관된 발바닥 밟기, 일관된 앞다리-뒷다리 협응 및 발가락의 움직임이 없거나 사지의 전진 운동 중 가끔 움직임이 없습니다. 우세한 발 위치는 처음 접촉할 때 몸과 평행합니다. | ||
| 16 | 발가락의 보행과 움직임 중 일관된 발바닥 걸음걸이와 앞다리-뒷다리 협응은 사지가 앞으로 움직이는 동안 자주 발생합니다. 우세한 발 위치는 처음 접촉할 때 몸체와 평행하고 움직이는 순간에 구부러져 있습니다. | ||
| 17 | 발가락의 보행 및 움직임 중 일관된 발바닥 걸음걸이와 앞다리-뒷다리 협응은 사지를 앞으로 움직이는 동안 자주 발생합니다. 우세한 발 위치는 처음 접촉할 때와 발가락이 움직이는 순간에 몸과 평행합니다. | ||
| 18 | 발가락의 보행과 움직임 중 일관된 발바닥 밟기와 앞다리-뒷다리 협응은 사지의 전진 운동 중에 일관되게 발생합니다. 우세한 발 위치는 처음 접촉할 때 몸체와 평행하고 발가락이 움직이는 동안 구부러져 있습니다. | ||
| 19 | 발가락의 보행과 움직임 중 일관된 발바닥 밟기와 앞다리-뒷다리 협응은 사지의 전진 운동 중에 일관되게 발생합니다. 우세한 발 위치는 접촉하는 순간과 발가락이 움직일 때 몸과 평행하며, 동물은 일부 또는 항상 아래쪽 꼬리를 나타냅니다. | ||
| 20 | 발가락의 보행과 움직임 중 일관된 발바닥 밟기와 앞다리-뒷다리 협응은 사지의 전진 운동 중에 일관되게 발생합니다. 우세한 발 위치는 접촉 순간과 발가락이 움직일 때 몸과 평행하며, 동물은 꼬리와 몸통의 불안정성을 일관되게 높여줍니다. | ||
| 21 | 일관된 발바닥 걸음걸이와 조정된 걸음걸이, 발가락의 일관된 움직임; 발 위치는 전체 지지 단계에서 주로 몸과 평행합니다. 일관된 트렁크 안정성; 일관된 꼬리 높이 | ||
표 1: Basso 등의 21점 기능 평가 척도.9,11.
토론
이 수술 절차의 목표는 쥐의 척수에 재현 가능하고 장기간의 신경 사멸을 생성하는 것이었습니다. 이 모델의 주요 장점은 팽창성 하이드로겔 임플란트가 척수를 장기간 압박하여 CSM의 병리학적 과정과 일치하는 점진적인 신경 세포사멸 반응을 유도한다는 것입니다(그림 2C). 본 연구에서 척수 손상으로 인한 사망률은 극히 낮았지만(50명 중 ~2명), 이 모델의 반복성은 50명 중 45명으로 >. 하이드로겔 조각의 크기가 잘못되고 수술 중 격렬한 이식이 이루어지면 척수에 급성 손상이 발생할 수 있습니다12,13.
미발표 연구14 에 따르면 팽창률이 350%인 이식은 몇 주 동안 점진적으로 회복되는 일시적이고 급성 CSM을 초래했습니다. 200%의 팽창률은 임플란트가 척수보다 단단하기 때문에 CSM 모델에서 느린 진행성 마비를 일으켰습니다. 그러나 이 모델에서는 이식된 재료의 경도가 아니라 이 이식의 최종 크기에만 관심이 있었습니다. 4주 후, 척수에 움푹 들어간 곳(그림 3A, 3B)이 관찰되었는데, 이는 척수에 대한 지속적인 수축, 악화된 신경 염증 및 신경 세포 사멸을 반영합니다.
현재 임플란트의 크기에 대한 합의는 없습니다. 여러 연구에서 두께가 0.5-1mm인 흡수 시트를 사용했으며, 15,16,17,18 척추 압박으로 인한 기능 장애가 있다고 보고했다. 또 다른 쥐 척수 압박 연구(19)에서는 온전한 백질의 손실과 극적인 척수 평탄화가 염증이 없는 압박 변형을 반영하는 심각한 척수 압박(2.6mm 두께)에 의해 유발된다는 것을 보여주었습니다. 그러므로, 부드럽고 팽창할 수 있는 재료로 제작된 대형 임플란트는 척수를 장기간 압박하는 데 적합할 수 있습니다.
현재 모델에서는 척추판의 하이드로겔 조각과 드릴의 크기를 1mm x 1mm x 1mm로 엄격하게 제한하여 대형 임플란트로 인한 갑작스러운 힘으로 인한 급성 척수 손상 또는 우발적 사망을 방지했습니다. 48시간의 수화 후 하이드로겔 블록은 2mm x 2mm x 2mm 크기로 팽창했습니다. 임상적으로 CSM 환자의 증상 악화는 척수의 갑작스러운 압박과 관련이 있는데, 이는 척수에 대한 지속적인 추간판 탈출증 압박과 염증 및 부종에 의해 유발된 보상 적응 저하로 인한 것입니다 4,7. 이는 편측성 하이드로겔 염증성 침윤이 양측 신경학적 기능 결핍을 초래하는 이유를 설명할 수 있다20.
이 동물 모델의 한 가지 한계는 쥐가 모든 부상에 강한 적응력을 보인다는 것이다21 이는 빠른 회복을 용이하게 한다. 여러 연구에서 압박 수술 후 시간이 지남에 따라 신경 기능이 지속적으로 개선되는 것으로 나타났으며, 15,16,17,18,21,22 악화 추세를 보고한 연구는 소수에 불과했습니다. 또한, 대부분의 CSM 환자는 척수를 지속적으로 압박하는 하에서 신경 기능의 점진적인 회복 또는 저하를 보인다23. 4주 후 현재 모델에서 운동 기능에 큰 차이가 없었기 때문에 행동 평가를 중단하고 추가 조직학적 조사를 위해 쥐를 안락사시켰습니다. 요약하면, 본 연구는 쥐의 척수 압박에 의해 유도되는 신경 세포사멸 모델, CSM 및 척수 재생과 관련된 세포 및 분자 메커니즘을 연구하기 위한 실용적인 동물 모델인 신경 자멸사 모델을 제시합니다.
공개
저자는 공개할 이해 상충이 없으며 이 연구에 사용된 모든 자료에 대한 전체 액세스에 제한이 없음을 진술합니다.
감사의 말
본 연구는 중국 국가핵심연구개발프로그램(2018YFC1704300), 중국국가자연과학재단(81930116, 81804115, 81873317, 81704096), 상하이 항해 프로그램(18YF1423800), 상하이 자연과학재단(20ZR1473400)의 지원을 받았다. 이 프로젝트는 상하이 한의과대학(Shanghai University of Traditional Chinese Medicine)의 지원도 받았습니다(2019LK057).
자료
| Name | Company | Catalog Number | Comments |
| Antibiotic ointment | Prevent wound infection | ||
| Buprenorphine-SR | Pain relief | ||
| Isoflurane | Veteasy | Anesthesia | |
| Inhalant anesthesia equipment | Anesthesia | ||
| Micro ophthalmic forceps | Mingren medical equipment | Length: 11 cm, Head diameter: 0.3 mm | Clip the muscle |
| Ophthalmic forceps | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | JD1050 | Clip the skin |
| Ophthalmic scissors (10 cm) | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | Y00030 | Skin incision |
| SD male rats | Shanghai SLAC Laboratory Animal Co., Ltd | SCXK2018-0004 | Animal model |
| Sterile surgical blades (22#) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | 35T0707 | Muscle incision |
| Small animal trimmer | Hair removal | ||
| Veet hair removal cream | RECKITT BENCKISER (India) Ltd | Hair removal | |
| Venus shears | Mingren medical equipment | Length: 12.5 cm | Muscle incision |
참고문헌
- Lebl, D. R., Bono, C. M. Update on the diagnosis and management of cervical spondylotic myelopathy. The Journal of the American Academy of Orthopaedic Surgeons. 23 (11), 648-660 (2015).
- Haddas, R., et al. Spine and lower extremity kinematics during gait in patients with cervical spondylotic myelopathy. The Spine Journal. 18 (9), 1645-1652 (2018).
- Song, D. W., Wu, Y. D., Tian, D. D. Association of Vdr-Foki and Vdbp-Thr420 Lys polymorphisms with cervical spondylotic myelopathy: A case-control study in the population of China. Journal of Clinical Laboratory Analysis. 33 (2), 22669(2019).
- Kurokawa, R., Murata, H., Ogino, M., Ueki, K., Kim, P. Altered blood flow distribution in the rat spinal cord under chronic compression. Spine. 36 (13), 1006-1009 (2011).
- Wen, C. Y., et al. Is Diffusion anisotropy a biomarker for disease severity and surgical prognosis of cervical spondylotic myelopathy. Radiology. 270 (1), 197-204 (2014).
- Long, H. Q., Li, G. S., Hu, Y., Wen, C. Y., Xie, W. H. Hif-1A/Vegf signaling pathway may play a dual role in secondary pathogenesis of cervical myelopathy. Medical Hypotheses. 79 (1), 82-84 (2012).
- Karadimas, S. K., Erwin, W. M., Ely, C. G., Dettori, J. R., Fehlings, M. G. Pathophysiology and natural history of cervical spondylotic myelopathy. Spine. 38, 21-36 (2013).
- Wilson, J. R., et al. State of the art in degenerative cervical myelopathy: an update on current clinical evidence. Neurosurgery. 80, 33-45 (2017).
- Baptiste, D. C., Fehlings, M. G. Pathophysiology of cervical myelopathy. The spine Journal. 6, 190-197 (2006).
- Wilcox, J. T., et al. Generating level-dependent models of cervical and thoracic spinal cord injury: exploring the interplay of neuroanatomy, physiology, and function. Neurobiology of Disease. 105, 194-212 (2017).
- Takano, M., et al. Inflammatory cascades mediate synapse elimination in spinal cord compression. Journal of Neuroinflammation. 11, 40(2014).
- Hu, Y., et al. Somatosensory-evoked potentials as an indicator for the extent of ultrastructural damage of the spinal cord after chronic compressive injuries in a rat model. Clinical Neurophysiology. 122 (7), 1440-1447 (2011).
- Yang, T., et al. Inflammation level after decompression surgery for a rat model of chronic severe spinal cord compression and effects on ischemia-reperfusion injury. Neurologia Medico-Chirurgica. 55 (7), 578-586 (2015).
- Ijima, Y., et al. Experimental rat model for cervical compressive myelopathy. Neuroreport. 28 (18), 1239-1245 (2017).
- Yamamoto, S., Kurokawa, R., Kim, P. Cilostazol, a selective type iii phosphodiesterase inhibitor: prevention of cervical myelopathy in a rat chronic compression model. Journal of Neurosurgery. Spine. 20 (1), 93-101 (2014).
- Holly, L. T., et al. Dietary therapy to promote neuroprotection in chronic spinal cord injury. Journal of Neurosurgery. Spine. 17 (2), 134-140 (2012).
- Zhao, P., et al. In vivo diffusion tensor imaging of chronic spinal cord compression: a rat model with special attention to the conus medullaris. Acta Radiologica. 57 (12), 1531-1539 (2016).
- Kurokawa, R., Nagayama, E., Murata, H., Kim, P. Limaprost alfadex, a prostaglandin E1 derivative, prevents deterioration of forced exercise capability in rats with chronic compression of the spinal cord. Spine. 36 (11), 865-869 (2011).
- Lee, J., Satkunendrarajah, K., Fehlings, M. G. Development and characterization of a novel rat model of cervical spondylotic myelopathy: the impact of chronic cord compression on clinical, neuroanatomical, and neurophysiological outcomes. Journal of Neurotrauma. 29 (5), 1012-1027 (2012).
- Chen, B., et al. Reactivation of dormant relay pathways in injured spinal cord by Kcc2 manipulations. Cell. 174 (3), 521-535 (2018).
- Yu, W. R., Liu, T., Kiehl, T. R., Fehlings, M. G. Human neuropathological and animal model evidence supporting a role for Fas-mediated apoptosis and inflammation in cervical spondylotic myelopathy. Brain. 134, 1277-1292 (2011).
- Yu, W. R., et al. Molecular mechanisms of spinal cord dysfunction and cell death in the spinal hyperostotic mouse: implications for the pathophysiology of human cervical spondylotic myelopathy. Neurobiology of Disease. 33 (2), 149-163 (2009).
- Iyer, A., Azad, T. D., Tharin, S. Cervical spondylotic myelopathy. Clinical Spine Surgery. 29 (10), 408-414 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유