Method Article
Um Modelo de Apoptose Neuronal Induzida por Compressão da Medula Espinhal em Ratos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para gerar um modelo de compressão da medula espinhal de rato, avaliar sua pontuação comportamental e observar a região comprimida da medula espinhal. As avaliações comportamentais mostraram diminuição da incapacidade motora do monitor. A coloração e imunocoloração de hematoxilina e eosina revelaram considerável apoptose neuronal na região comprimida da medula espinhal.
Resumo
Como uma doença degenerativa progressiva grave, a mielopatia espondilótica cervical (MSC) tem um prognóstico desfavorável e está associada a dor física, rigidez, disfunção motora ou sensorial e alto risco de lesão medular e acroparalisia. Assim, estratégias terapêuticas que promovam a regeneração medular eficiente nessa doença crônica e progressiva são urgentemente necessárias. Modelos de compressão da medula espinhal animal eficazes e reprodutíveis são necessários para entender o complexo mecanismo biológico subjacente ao CSM. A maioria dos modelos de lesão medular reflete condições destrutivas agudas e estruturais, enquanto os modelos animais de MSC apresentam uma compressão crônica na medula espinhal. Este trabalho apresenta um protocolo para gerar um modelo de compressão da medula espinhal de ratos, que foi posteriormente avaliado avaliando o escore comportamental e observando a região da medula espinhal comprimida. As avaliações comportamentais mostraram diminuição da incapacidade motora do monitor, incluindo movimentos articulares, capacidade de pisar, coordenação, estabilidade do tronco e força muscular dos membros. A coloração e imunocoloração de hematoxilina e eosina (H&E) revelou considerável apoptose neuronal na região comprimida da medula espinhal.
Introdução
Como uma doença degenerativa progressiva comum, a MSC é responsável por 5-10% de toda a espondilose cervical1. Se os pacientes que sofrem de MSC ignorarem seus sintomas e não os tratarem de maneira oportuna e eficaz, isso pode levar a complicações graves, como lesão medular e paralisia de membros, que se deteriorariam com o envelhecimento, representando um fardo econômico e mental substancial para os pacientes e suas famílias 2,3. A patogênese da MSC é complexa, envolvendo fatores estáticos e dinâmicos, a teoria da hipóxia-isquemia, a lesão das células endoteliais, a teoria da destruição da barreira medular sanguínea e a teoria da inflamação e apoptose 4,5,6,7.
Os mecanismos estáticos e dinâmicos de compressão na medula espinhal causam sintomas clínicos. Discos vertebrais salientes, corpos vertebrais deformados e ligamentos calcificados podem causar compressão medular prolongada, que afetará gradualmente a barreira sangue-medula espinhal e a microvasculatura local na medula espinhal 4,8. Por sua vez, isquemia, inflamação e apoptose afetam os neurônios, axônios e células gliais 6,9.
Os modelos animais experimentais de lesão medular incluem lesão contusiva, lesão compressiva, lesão por tração, lesão induzida por fotoquímica e lesão de isquemia-reperfusão. A maioria desses modelos também reflete algumas condições destrutivas agudas e estruturais (transecção ou toxicidade química). No entanto, esses modelos animais de MSC não podem apresentar apoptose neuronal progressiva na medula espinhal.
Este artigo descreve um protocolo detalhado para gerar um modelo de compressão da medula espinhal de ratos, que foi avaliado posteriormente avaliando o escore comportamental e observando a região comprimida da medula espinhal. Este modelo de compressão da medula espinhal de rato é um modelo animal confiável para uma investigação mais aprofundada dos mecanismos envolvidos na MSC.
Protocolo
O procedimento a seguir foi realizado com a aprovação do Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade de Medicina Tradicional Chinesa de Xangai. Todas as cirurgias de sobrevivência foram realizadas em condições estéreis, conforme descrito pelas diretrizes do NIH. A dor e o risco de infecções foram tratados com analgésicos e antibióticos apropriados para garantir um resultado bem-sucedido. Este procedimento cirúrgico é otimizado para ratos machos Sprague-Dawley (SD) com 12 semanas de idade e 400 g de peso.
1. Preparação de hidrogel de poliacrilamida PVA
NOTA: Conforme mostrado na Figura 1G, 1H, o hidrogel de poliacrilamida PVA é uma folha de polímero absorvente de água. No estado natural, o gel é extremamente difícil de cortar em pedaços pequenos. A preparação é descrita a seguir.
- Coloque um hidrogel de poliacrilamida PVA em água por 24 h para facilitar o corte após a hidratação.
- Use uma ferramenta de corte de fabricação própria (Figura 1H) para dividir todo o hidrogel em pedaços, de tamanho 2 mm x 2 mm x 2 mm.
- Transfira esses pedaços de hidrogel para um forno a 60 ° C por 12 h para desidratação em pequenos pedaços de 1 mm x 1 mm x 1 mm como materiais de implantação.
2. Anestesia e preparação
NOTA: Certifique-se de usar uma touca cirúrgica, máscaras médicas descartáveis e luvas cirúrgicas estéreis durante todo o processo cirúrgico estéril.
- Coloque o rato em uma almofada de aquecimento e certifique-se de que a temperatura retal seja mantida em 37±1 °C durante a anestesia.
- Coloque o rato na câmara de anestesia cheia de isoflurano a 3% por 3 min.
- Aperte suavemente os membros e dedos dos pés do rato com uma pinça para testar a perda da resposta de abstinência, indicando anestesia bem-sucedida.
- Fixe o rato na mesa de operação em decúbito ventral, garantindo que os membros e a cabeça do rato estejam firmemente fixados.
- Fixe a máscara de anestesia no rosto do rato. Administre isoflurano a 2% em uma mistura de oxigênio/ar por meio de uma máscara de nariz de rato padrão para anestesiar o rato durante a cirurgia de compressão espinhal.
- Coloque uma gaze cilíndrica (tamanho de cerca de 30 mm x 20 mm x 60 mm) entre o rato e a mesa cirúrgica (Figura 1A) para garantir uma via aérea desobstruída e um local cirúrgico totalmente exposto durante toda a cirurgia.
- Raspe o cabelo ao redor da área cirúrgica do pescoço do rato com um barbeador elétrico.
- Aplique o creme depilatório para remover os pelos restantes e expor a pele.
- Desinfete a área cirúrgica com iodóforo.
- Cubra a área desinfetada com uma toalha estéril com um orifício expondo apenas a área cirúrgica no lado dorsal do pescoço do rato.
3. Abordagem cirúrgica
- Faça uma incisão longitudinal na linha média dorsal com bisturi do segundo processo espinhoso cervical para o segundo processo espinhoso torácico, após o posicionamento percutâneo do segundo processo espinhoso cervical e do segundo processo espinhoso torácico.
- O Blunt separa os músculos de ambos os lados com pinças hemostáticas para expor a lâmina C2-T2 após o corte do tecido subcutâneo e da fáscia camada por camada.
- Faça um furo (1 mm x 1 mm) no laminar cervical (Figura 1B).
NOTA: Para evitar lesões excessivas na medula espinhal, certifique-se de que o pescoço do rato seja mantido em um estado de arco dorsal, permitindo espaço suficiente entre as lâminas cervicais. - Use uma pinça microcirúrgica para agarrar um pedaço de hidrogel de poliacrilamida PVA do tamanho de 1 mm x 1 mm x 1 mm e insira-o no orifício previamente perfurado (Figura 1C, 1D).
NOTA: O desempenho de contração transitória indica que o modelo de compressão da medula espinhal foi estabelecido com sucesso. - Suturar os tecidos musculares, fáscias, subcutâneos e cutâneos, camada por camada, usando agulhas triangulares e sutura 5-0.
- Após a desinfecção, transfira os animais de volta para a gaiola e mantenha-os aquecidos.
- Injete analgesia por cloridrato de buprenorfina por via subcutânea (0,03 mg/kg) a cada 6 h por 3 dias após a cirurgia e conforme necessário após isso.
4. Manejo pós-operatório
- Injete o equivalente a 100.000 unidades de penicilina por via intraperitoneal nos ratos uma vez ao dia para prevenir infecções pós-operatórias e aliviar a dor.
- Transfira os ratos para novas gaiolas que foram continuamente aquecidas com uma lâmpada infravermelha para garantir a preservação adequada do calor no pós-operatório.
NOTA: Remova a lâmpada de aquecimento depois que a consciência do rato for restaurada - Mantenha a higiene e ventilação da gaiola de alimentação do rato.
- Ajude os ratos a comer e beber duas vezes ao dia. Se necessário, administre uma massagem na bexiga para ajudar na micção até que a função urinária seja restaurada.
5. Avaliação comportamental
- Use a escala de classificação de Basso, Beattie e Bresnahan (BBB) para avaliar o comportamento pós-operatório.
NOTA: A escala de classificação BBB é um padrão-ouro (Tabela 1) usado para avaliar a função relacionada à medula espinhal em ratos. Ele avalia o movimento dos ratos de acordo com pontuações que variam de 0 (nenhum movimento do membro posterior foi observado) a 21 (coordenação da marcha, consistência do espaço do dedo do pé, posição da garra principal paralela em toda a postura, estabilidade consistente do tronco e elevação consistente da cauda).
6. Teste de força de preensão
- Use um medidor eletrônico de força de preensão para medir a força de preensão.
- Pegue a metade inferior do rato para suspendê-lo e permitir que ele agarre a haste de metal do medidor de aderência frontal.
- Quando o rato agarrar a haste de metal, puxe-a e registre a força de preensão.
- Meça a força de preensão três vezes para cada rato e registre a pontuação mais alta.
7. Teste de placa inclinada
- Coloque o rato em uma placa de borracha com um ângulo ajustável.
- Aumente gradualmente o ângulo da placa inclinada em 5° de cada vez até que o rato consiga se equilibrar e permanecer firme por 5 s.
- Registre o ângulo máximo em que o rato pode se equilibrar na placa inclinada.
- Meça o ângulo máximo três vezes para cada rato e registre a pontuação mais alta.
8. Eutanásia, separação da medula espinhal e incorporação congelada
NOTA: Certifique-se de que óculos de proteção e proteção facial/máscara apropriados sejam usados para proteger os olhos, rosto e trato respiratório do paraformaldeído e do gás formaldeído.
- Injete o equivalente a 10% de hidrato de cloral por via intraperitoneal para anestesiar os ratos antes de abrir o esterno para expor o coração.
- Insira uma agulha de perfusão no ápice do coração, fixe-a com uma pinça hemostática e infunda lentamente com solução salina normal.
- Faça um orifício no apêndice atrial direito até que a solução salina normal limpa saia do átrio direito, indicando uma infusão bem-sucedida.
- Pare a perfusão salina normal depois que o fígado ficar branco.
- Infundir com um equivalente a 10% de paraformaldeído até que o corpo do rato fique rígido.
- Após a perfusão do paraformaldeído, remova a pele, os músculos e os tecidos moles ao redor da coluna; separar o segmento C2-C7 da coluna cervical; e mergulhe-o em paraformaldeído a 10% para fixação durante a noite.
- Separe a medula espinhal cervical da coluna e coloque-a em um gradiente de concentração de soluções de sacarose de 10%, 20% e 30% para desidratação gradual.
- Transferir a medula espinhal comprimida de 2 mm de altura juntamente com um agente de inclusão OCT para um congelador a -80 °C.
- Após o corte em fatias de 7 μm de espessura e coloração (coloração H & E e marcação de extremidade de corte dUTP (TUNEL) / núcleos neuronais (NeuN), consulte a seção 9), observe a histopatologia da medula espinhal e da apoptose neuronal, respectivamente.
9. Imunocoloração TUNEL/NeuN
- Mergulhe as seções da medula espinhal em solução salina tamponada com fosfato (PBS) por 10 min em temperatura ambiente e, em seguida, bloqueie com solução de PBS contendo 0,3% de Triton X-100 e 5% de albumina de soro bovino (BSA) por 1 h.
- Incubar as secções da medula espinal com um anticorpo policlonal anti-NeuN de coelho (diluído a 1:200;) durante a noite a 4 °C.
- Enxágue as seções da medula espinhal três vezes em PBS. Posteriormente, incubar com anticorpos secundários conjugados com Alexa Fluor 594 por 2 h em temperatura ambiente.
- Execute o kit de ensaio de apoptose TUNEL de uma etapa (fluorescência verde) para corar os núcleos apoptóticos das seções da medula espinhal.
Resultados
A lesão compressiva da medula espinhal pode levar à incapacidade neuromuscular nos membros
À medida que o pedaço de hidrogel se expande gradualmente, ele comprime persistentemente a região da medula espinhal por um período prolongado, o que simula as incapacidades do membro anterior induzidas por doenças da medula espinhal cervical 8,10. No modelo atual, foi observada considerável contratura ipsilateral da pata dianteira na maioria dos ratos (9/10) do grupo modelo (Figura 2A). Outras medições e análises do comprimento e largura das patas dianteiras foram realizadas em um pedaço de papel com uma linha de grade (Figura 2B). Os dados revelaram que o comprimento e a largura das patas dianteiras ipsilaterais no grupo modelo diminuíram notavelmente um dia após a cirurgia (P < 0,01). No entanto, não foi detectada diferença significativa nas patas dianteiras contralaterais entre os grupos controle e modelo (Figura 2C).
Para avaliar a evolução e a incapacidade neuromuscular nos membros, a escala de classificação BBB, o teste de plano inclinado e o teste de preensão do membro anterior foram empregados para observação nos dias 1, 3, 7, 14, 21 e 28 após a cirurgia. A análise de uma ou duas vias com o teste de Tukey foi realizada para analisar os dados normalmente distribuídos. Um teste U não paramétrico de Mann-Whitney com análise post hoc foi realizado para dados que não eram normalmente distribuídos, mas continham variâncias iguais. Os dados são expressos como média ± desvio padrão (DP). As diferenças foram consideradas estatisticamente significativas em P < 0,05.
Os resultados mostraram que os escores BBB dos ratos do grupo modelo diminuíram gradualmente nos dias 1 e 3 após a cirurgia, apresentando incapacidade funcional significativa durante a fase inicial, especialmente no lado ipsilateral (Figura 2D, 2E, 2G). Embora a recuperação da compressão da medula espinhal tenha sido observada nos grupos modelo e controle, os ratos do grupo modelo mostraram uma recuperação tardia e incompleta da função aberrante da pata dianteira e da capacidade de equilíbrio em comparação com o grupo controle 4 semanas após a cirurgia (Figura 2E, 2G). Diferenças significativas entre os grupos modelo e controle foram mantidas no escore do plano inclinado e na força de preensão no 28º dia pós-operatório. Esses resultados combinados indicam que essa cirurgia induz compressão progressiva na medula espinhal cervical e causa deterioração da capacidade motora em ratos.
Alterações histológicas e inflamação induzida por compressão na medula espinhal
Após a separação da medula espinhal cervical, observou-se uma reentrância proeminente de 2 mm de profundidade e 2 mm x 2 mm de área na medula espinhal (Figura 3B). Para avaliar as alterações morfométricas, os cortes da medula espinhal foram corados e visualizados ao microscópio óptico. A coloração H & E revelou a infiltração de células imunes e uma perda dramática de neurônios na região compressiva da medula espinhal (Figura 3C). Além disso, a imunocoloração revelou um aumento dramático na apoptose neuronal no local de compressão da medula espinhal no grupo modelo (Figura 3D, 3E). Algumas células ou tecidos têm altos níveis de atividade de nuclease e polimerase, o que pode resultar em fluorescência inespecífica. Assim, o tecido foi imobilizado imediatamente após ser extraído para evitar que essas enzimas causassem falsos positivos. A coloração TUNEL é inespecífica e pode ser empregada em caso de morte celular ou neural. NeuN é um marcador de coloração específico para neurônios. Como resultado, imagens mescladas da coloração TUNEL e da coloração NeuN foram usadas para demonstrar a apoptose neuronal.
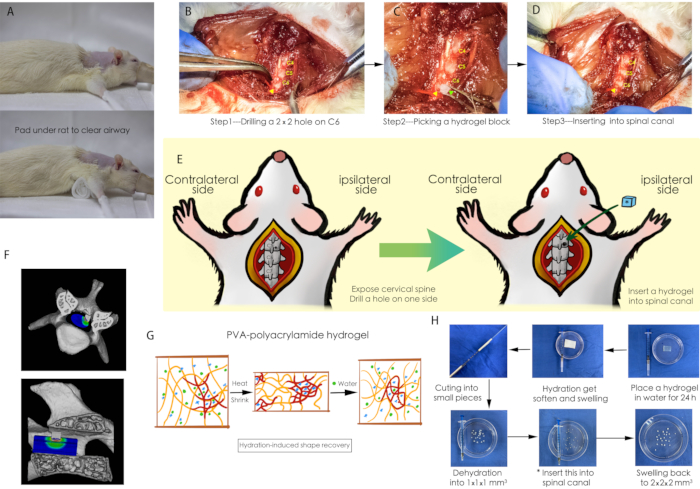
Figura 1: Um esquema do procedimento cirúrgico. (A) Uma gaze foi colocada sob o rato para garantir que as vias aéreas do rato estivessem desobstruídas durante a operação. (BD) Procedimento cirúrgico de implantação de hidrogel no canal espinhal cervical; a ponta da seta amarela aponta para um pequeno orifício perfurado na placa vertebral de C6, e a ponta da seta verde indica o bloco de hidrogel desidratado. (E) Um esquema do procedimento cirúrgico. (F) Um esquema tridimensional da compressão da medula espinhal. (G) Propriedade de absorção de água do hidrogel de poliacrilamida PVA. (H) Preparação do bloco de hidrogel para compressão da medula espinhal. Abreviaturas: PVA = álcool polivinílico. Clique aqui para ver uma versão maior desta figura.

Figura 2: Morfologia da pata dianteira e observações comportamentais com escala BBB, teste de força de preensão e teste de placa inclinada. (A) Uma característica típica das patas dianteiras ipsilaterais dos ratos do grupo controle (esquerda) e do grupo modelo (direita) no terceiro dia após a cirurgia. (B) A largura e o comprimento das patas dianteiras dos ratos foram medidos. A seta vermelha transversal é do primeiro dedo ao quarto dedo, e a seta vermelha longitudinal é da ponta do dedo mais longo até a raiz da palma da mão. (C) Análise quantitativa do comprimento e largura das patas dianteiras ipsilaterais nos grupos modelo e controle. (D) Escore BBB dos lados ipsilateral e contralateral 1, 3, 7, 14, 21 e 28 dias após a cirurgia. (E) A força de preensão dos membros torácicos laterais ipsilaterais e contralaterais 1, 3, 7, 14, 21 e 28 dias após a cirurgia, avaliada com o teste de força de preensão. (F) Esquema do teste de placa inclinada. (G) A força e o equilíbrio dos membros laterais ipsilaterais e contralaterais 1, 3, 10, 20 e 28 dias após a cirurgia, avaliados com o teste da placa inclinada. Os dados são apresentados como média ± DP. *P < 0,05 e **P < 0,01 vs. grupo controle; n = 10/grupo. Abreviatura: BBB = escala de classificação de Basso, Beattie e Bresnahan. Clique aqui para ver uma versão maior desta figura.
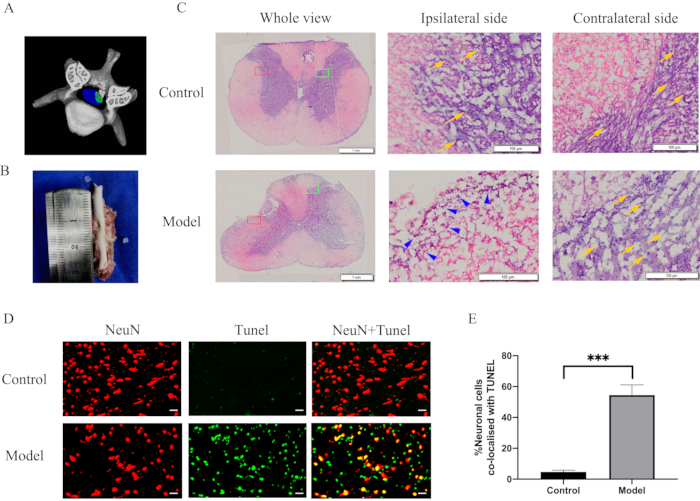
Figura 3: Alterações morfológicas e respostas inflamatórias após compressão prolongada da medula espinhal cervical. (A) Um esquema tridimensional da compressão da medula espinhal. (B) Um recuo de 2 mm de profundidade e 2 mm x 2 mm de área na medula espinhal. (C) Uma secção histológica da medula espinhal 28 dias após a compressão e coloração de H & E. A infiltração de células imunes e uma perda dramática de neurônios na região compressiva da medula espinhal. Retângulo vermelho, lado ipsilateral; retângulo verde, contralateral; pontas de setas azuis, células imunológicas; setas amarelas, neurônios. (D) Coloração dupla para NeuN (vermelho) / TUNEL (verde) de seções do local de compressão da medula espinhal nos grupos modelo e controle. Barras de escala = 20 μm. (E) Quantificação de células duplamente positivas NeuN e TUNEL. P < 0,001 em relação ao grupo controle; n = 10/grupo. Abreviaturas: H & E = hematoxilina e eosina; NeuN = núcleos neuronais; TUNEL = rotulagem de extremidade de nick dUTP. Clique aqui para ver uma versão maior desta figura.
| Pontuação | Definições operacionais de categorias e atributos | ||
| 0 | Nenhum movimento observável dos membros posteriores | ||
| 1 | Movimento leve (limitado) de uma ou duas articulações, geralmente quadril e/ou joelho | ||
| 2 | Movimento extensivo de uma articulação ou movimento extensivo de uma articulação e leve movimento da outra | ||
| 3 | Movimento extensivo de duas articulações | ||
| 4 | Leve movimento de todas as três articulações dos membros posteriores | ||
| 5 | Leve movimento de duas articulações e movimento extenso da terceira articulação | ||
| 6 | Movimento extensivo de duas articulações e leve movimento da terceira articulação | ||
| 7 | Movimento extenso das três articulações nos membros posteriores | ||
| 8 | Varredura sem sustentação de peso ou apoio plantar da pata sem sustentação de peso | ||
| 9 | Apoio plantar da pata com sustentação de peso apenas no estágio de apoio (ou seja, quando estático) ou passo dorsal ocasional, frequente ou inconsistente com sustentação de peso e sem pisada plantar | ||
| 10 | Passos plantares com sustentação de peso ocasional e sem coordenação de membros anteriores e posteriores | ||
| 11 | Passos plantares com sustentação de peso frequente a consistente e coordenação ocasional de membros anteriores e posteriores | ||
| 12 | Passos plantares com sustentação de peso frequente a consistente e coordenação ocasional de membros anteriores e posteriores | ||
| 13 | Passos plantares com sustentação de peso frequente a consistente e coordenação frequente de membros anteriores e posteriores | ||
| 14 | Passos plantares com suporte de peso consistente, coordenação consistente dos membros anteriores-posteriores e posição predominantemente rotacionada da pata (interna ou externamente) durante a locomoção, tanto no instante do contato inicial com a superfície quanto antes de mover os dedos dos pés no final do estágio de apoio ou passo plantar frequente, coordenação consistente dos membros anteriores-posteriores e passo dorsal ocasional | ||
| 15 | Passo plantar consistente, coordenação consistente entre membros anteriores e posteriores e nenhum movimento dos dedos dos pés ou movimento ocasional durante o movimento do membro para frente; A posição predominante da pata é paralela ao corpo no momento do contato inicial. | ||
| 16 | A pisada plantar consistente e a coordenação do membro anterior e posterior durante a marcha e o movimento dos dedos dos pés ocorrem frequentemente durante o movimento para frente do membro; A posição predominante da pata é paralela ao corpo no momento do contato inicial e curvada no instante do movimento. | ||
| 17 | A decada plantar consistente e a coordenação antemembro-membro posterior durante a marcha e o movimento dos dedos dos pés ocorrem frequentemente durante o movimento anterior do membro; A posição predominante da pata é paralela ao corpo no momento do contato inicial e no instante do movimento dos dedos. | ||
| 18 | A pisada plantar consistente e a coordenação dos membros anteriores e posteriores durante a marcha e o movimento dos dedos dos pés ocorrem de forma consistente durante o movimento do membro para frente; A posição predominante da pata é paralela ao corpo no momento do contato inicial e curvada durante o movimento dos dedos. | ||
| 19 | A pisada plantar consistente e a coordenação dos membros anteriores e posteriores durante a marcha e o movimento dos dedos dos pés ocorrem de forma consistente durante o movimento do membro para frente; A posição predominante da pata é paralela ao corpo no instante do contato e no momento do movimento dos dedos, e o animal apresenta cauda descendente algumas ou todas as vezes. | ||
| 20 | A pisada plantar consistente e a coordenação dos membros anteriores e posteriores durante a marcha e o movimento dos dedos dos pés ocorrem de forma consistente durante o movimento do membro para frente; A posição predominante da pata é paralela ao corpo no instante do contato e no momento do movimento dos dedos, e o animal apresenta elevação consistente da instabilidade da cauda e do tronco. | ||
| 21 | Passos plantares consistentes e marcha coordenada, movimento consistente dos dedos dos pés; a posição da pata é predominantemente paralela ao corpo durante todo o estágio de apoio; estabilidade consistente do tronco; elevação consistente da cauda | ||
Tabela 1: Escala de avaliação funcional de 21 pontos de Basso et al.9,11.
Discussão
O objetivo deste procedimento cirúrgico era gerar apoptose neural prolongada e reprodutível na medula espinhal de ratos. Uma das principais vantagens desse modelo é que os implantes de hidrogel expansível fornecem uma compressão prolongada na medula espinhal, levando a uma resposta apoptótica neural progressiva (Figura 2C), que é consistente com o processo patológico da MSC. No presente estudo, a mortalidade por lesão medular foi extremamente baixa (~ 2 em 50), enquanto a repetibilidade desse modelo foi de > de 45 em 50. O tamanho incorreto dos pedaços de hidrogel e o implante vigoroso durante a cirurgia podem causar lesão aguda na medula espinhal12,13.
Um estudo não publicado14 descobriu que o implante com uma taxa de expansão de 350% resultou em MSC temporária e aguda com recuperação progressiva por várias semanas. Uma taxa de expansão de 200% causou uma paralisia progressiva lenta no modelo CSM porque os implantes eram mais duros que a medula espinhal. No entanto, neste modelo, não nos interessava a dureza do material implantado, apenas o tamanho final deste implante. Após 4 semanas, foi observada uma reentrância na medula espinhal (Figura 3A, 3B), que refletiu a constrição sustentada na medula espinhal, neuroinflamação agravada e apoptose neuronal.
Atualmente, não há consenso sobre o tamanho dos implantes. Vários estudos utilizaram lâminas absorventes com espessura de 0,5-1 mm 15,16,17,18 e relataram incapacidade funcional por compressão da coluna vertebral. Outro estudo de compressão da medula espinhalem ratos 19 mostrou que a perda de substância branca intacta e o achatamento dramático do cordão foram induzidos por compressão severa do cordão (2,6 mm de espessura), que refletiu uma tensão de compressão sem inflamação. Portanto, um implante grande fabricado com um material expansível macio pode ser adequado para compressão prolongada na medula espinhal.
No modelo atual, o tamanho dos pedaços de hidrogel e da broca na placa vertebral era estritamente limitado a um tamanho de 1 mm x 1 mm x 1 mm para evitar lesão aguda da medula espinhal ou morte acidental devido a qualquer força repentina devido a implantes superdimensionados. Após 48 h de hidratação, os blocos de hidrogel expandiram-se para um tamanho de 2 mm x 2 mm x 2 mm. Clinicamente, o agravamento dos sintomas em pacientes com MSC está relacionado à compressão súbita da medula espinhal, que é decorrente da compressão contínua da hérnia de disco na medula espinhal e subsequente adaptação menos compensada induzida por inflamação e edema 4,7. Isso poderia explicar por que a infiltração inflamatória unilateral de hidrogel leva a um déficit bilateral de função neurológica20.
Uma limitação desse modelo animal é que os ratos apresentam forte adaptação a qualquer lesão21, o que facilita a recuperação rápida. Vários estudos mostraram melhorias contínuas na função neurológica ao longo do tempo após a operação de compressão 15,16,17,18,21,22, enquanto apenas alguns estudos relataram uma tendência de deterioração. Além disso, a maioria dos pacientes com MSC apresenta recuperação gradual ou deterioração da função neurológica sob compressão consistente na medula espinhal23. Como não houve diferença significativa na função motora no modelo atual após 4 semanas, interrompemos a avaliação comportamental e sacrificamos os ratos para novas investigações histológicas. Em resumo, este estudo apresenta um modelo de apoptose neural induzida por compressão da medula espinhal em ratos, um modelo animal prático para estudar os mecanismos celulares e moleculares associados à MSC e à regeneração da medula espinhal.
Divulgações
Os autores não têm conflitos de interesse a divulgar e afirmam que não há restrições ao acesso total a todos os materiais utilizados neste estudo.
Agradecimentos
Este estudo foi apoiado pelo Programa Nacional de P&D da China (2018YFC1704300), Fundação Nacional de Ciências Naturais da China (81930116, 81804115, 81873317 e 81704096), Programa de Vela de Xangai (18YF1423800), Fundação de Ciências Naturais de Xangai (20ZR1473400). Este projeto também foi apoiado pela Universidade de Medicina Tradicional Chinesa de Xangai (2019LK057).
Materiais
| Name | Company | Catalog Number | Comments |
| Antibiotic ointment | Prevent wound infection | ||
| Buprenorphine-SR | Pain relief | ||
| Isoflurane | Veteasy | Anesthesia | |
| Inhalant anesthesia equipment | Anesthesia | ||
| Micro ophthalmic forceps | Mingren medical equipment | Length: 11 cm, Head diameter: 0.3 mm | Clip the muscle |
| Ophthalmic forceps | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | JD1050 | Clip the skin |
| Ophthalmic scissors (10 cm) | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | Y00030 | Skin incision |
| SD male rats | Shanghai SLAC Laboratory Animal Co., Ltd | SCXK2018-0004 | Animal model |
| Sterile surgical blades (22#) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | 35T0707 | Muscle incision |
| Small animal trimmer | Hair removal | ||
| Veet hair removal cream | RECKITT BENCKISER (India) Ltd | Hair removal | |
| Venus shears | Mingren medical equipment | Length: 12.5 cm | Muscle incision |
Referências
- Lebl, D. R., Bono, C. M. Update on the diagnosis and management of cervical spondylotic myelopathy. The Journal of the American Academy of Orthopaedic Surgeons. 23 (11), 648-660 (2015).
- Haddas, R., et al. Spine and lower extremity kinematics during gait in patients with cervical spondylotic myelopathy. The Spine Journal. 18 (9), 1645-1652 (2018).
- Song, D. W., Wu, Y. D., Tian, D. D. Association of Vdr-Foki and Vdbp-Thr420 Lys polymorphisms with cervical spondylotic myelopathy: A case-control study in the population of China. Journal of Clinical Laboratory Analysis. 33 (2), 22669(2019).
- Kurokawa, R., Murata, H., Ogino, M., Ueki, K., Kim, P. Altered blood flow distribution in the rat spinal cord under chronic compression. Spine. 36 (13), 1006-1009 (2011).
- Wen, C. Y., et al. Is Diffusion anisotropy a biomarker for disease severity and surgical prognosis of cervical spondylotic myelopathy. Radiology. 270 (1), 197-204 (2014).
- Long, H. Q., Li, G. S., Hu, Y., Wen, C. Y., Xie, W. H. Hif-1A/Vegf signaling pathway may play a dual role in secondary pathogenesis of cervical myelopathy. Medical Hypotheses. 79 (1), 82-84 (2012).
- Karadimas, S. K., Erwin, W. M., Ely, C. G., Dettori, J. R., Fehlings, M. G. Pathophysiology and natural history of cervical spondylotic myelopathy. Spine. 38, 21-36 (2013).
- Wilson, J. R., et al. State of the art in degenerative cervical myelopathy: an update on current clinical evidence. Neurosurgery. 80, 33-45 (2017).
- Baptiste, D. C., Fehlings, M. G. Pathophysiology of cervical myelopathy. The spine Journal. 6, 190-197 (2006).
- Wilcox, J. T., et al. Generating level-dependent models of cervical and thoracic spinal cord injury: exploring the interplay of neuroanatomy, physiology, and function. Neurobiology of Disease. 105, 194-212 (2017).
- Takano, M., et al. Inflammatory cascades mediate synapse elimination in spinal cord compression. Journal of Neuroinflammation. 11, 40(2014).
- Hu, Y., et al. Somatosensory-evoked potentials as an indicator for the extent of ultrastructural damage of the spinal cord after chronic compressive injuries in a rat model. Clinical Neurophysiology. 122 (7), 1440-1447 (2011).
- Yang, T., et al. Inflammation level after decompression surgery for a rat model of chronic severe spinal cord compression and effects on ischemia-reperfusion injury. Neurologia Medico-Chirurgica. 55 (7), 578-586 (2015).
- Ijima, Y., et al. Experimental rat model for cervical compressive myelopathy. Neuroreport. 28 (18), 1239-1245 (2017).
- Yamamoto, S., Kurokawa, R., Kim, P. Cilostazol, a selective type iii phosphodiesterase inhibitor: prevention of cervical myelopathy in a rat chronic compression model. Journal of Neurosurgery. Spine. 20 (1), 93-101 (2014).
- Holly, L. T., et al. Dietary therapy to promote neuroprotection in chronic spinal cord injury. Journal of Neurosurgery. Spine. 17 (2), 134-140 (2012).
- Zhao, P., et al. In vivo diffusion tensor imaging of chronic spinal cord compression: a rat model with special attention to the conus medullaris. Acta Radiologica. 57 (12), 1531-1539 (2016).
- Kurokawa, R., Nagayama, E., Murata, H., Kim, P. Limaprost alfadex, a prostaglandin E1 derivative, prevents deterioration of forced exercise capability in rats with chronic compression of the spinal cord. Spine. 36 (11), 865-869 (2011).
- Lee, J., Satkunendrarajah, K., Fehlings, M. G. Development and characterization of a novel rat model of cervical spondylotic myelopathy: the impact of chronic cord compression on clinical, neuroanatomical, and neurophysiological outcomes. Journal of Neurotrauma. 29 (5), 1012-1027 (2012).
- Chen, B., et al. Reactivation of dormant relay pathways in injured spinal cord by Kcc2 manipulations. Cell. 174 (3), 521-535 (2018).
- Yu, W. R., Liu, T., Kiehl, T. R., Fehlings, M. G. Human neuropathological and animal model evidence supporting a role for Fas-mediated apoptosis and inflammation in cervical spondylotic myelopathy. Brain. 134, 1277-1292 (2011).
- Yu, W. R., et al. Molecular mechanisms of spinal cord dysfunction and cell death in the spinal hyperostotic mouse: implications for the pathophysiology of human cervical spondylotic myelopathy. Neurobiology of Disease. 33 (2), 149-163 (2009).
- Iyer, A., Azad, T. D., Tharin, S. Cervical spondylotic myelopathy. Clinical Spine Surgery. 29 (10), 408-414 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados