Method Article
Un modèle d’apoptose neuronale induit par la compression de la moelle épinière chez le rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un protocole pour générer un modèle de compression de la moelle épinière chez le rat, évaluer son score comportemental et observer la région de la moelle épinière comprimée. Les évaluations comportementales ont montré une diminution de l’incapacité motrice du moniteur. La coloration à l’hématoxyline et à l’éosine et l’immunocoloration ont révélé une apoptose neuronale considérable dans la région comprimée de la moelle épinière.
Résumé
En tant que maladie dégénérative progressive sévère, la myélopathie spondylotique cervicale (MCS) a un mauvais pronostic et est associée à des douleurs physiques, à une raideur, à un dysfonctionnement moteur ou sensoriel et à un risque élevé de lésion de la moelle épinière et d’acroparalysie. Ainsi, il est urgent de mettre en place des stratégies thérapeutiques favorisant une régénération efficace de la moelle épinière dans cette maladie chronique et évolutive. Des modèles efficaces et reproductibles de compression de la moelle épinière animale sont nécessaires pour comprendre le mécanisme biologique complexe sous-jacent à la MCS. La plupart des modèles de lésions de la moelle épinière reflètent des conditions destructrices aiguës et structurelles, tandis que les modèles animaux de CSM présentent une compression chronique de la moelle épinière. Cet article présente un protocole pour générer un modèle de compression de la moelle épinière chez le rat, qui a été évalué en évaluant le score comportemental et en observant la région de la moelle épinière comprimée. Les évaluations comportementales ont montré une diminution de l’incapacité motrice du moniteur, y compris les mouvements articulaires, la capacité de marche, la coordination, la stabilité du tronc et la force musculaire des membres. La coloration à l’hématoxyline et à l’éosine (H&E) et l’immunocoloration ont révélé une apoptose neuronale considérable dans la région comprimée de la moelle épinière.
Introduction
En tant que maladie dégénérative progressive courante, la MCS représente 5 à 10 % de toutes les spondylose cervicales1. Si les patients souffrant de MCS ignorent leurs symptômes et ne les traitent pas rapidement et efficacement, cela pourrait entraîner de graves complications, telles que des lésions de la moelle épinière et une paralysie des membres, qui se détérioreraient avec l’âge, ce qui constituerait un fardeau économique et mental substantiel pour les patients et leursfamilles2,3. La pathogenèse de la CSM est complexe, impliquant des facteurs statiques et dynamiques, la théorie de l’hypoxie-ischémie, les lésions des cellules endothéliales, la théorie de la destruction de la barrière vertébrale sanguine et la théorie de l’inflammation et de l’apoptose 4,5,6,7.
Les mécanismes statiques et dynamiques de compression sur la moelle épinière provoquent des symptômes cliniques. Des disques vertébraux saillants, des corps vertébraux déformés et des ligaments calcifiés peuvent provoquer une compression prolongée de la moelle épinière, qui affectera progressivement la barrière hémato-moépinière et la microvascularisation locale de la moelle épinière 4,8. À leur tour, l’ischémie, l’inflammation et l’apoptose affectent les neurones, les axones et les cellules gliales 6,9.
Les modèles animaux expérimentaux de lésions de la moelle épinière comprennent les lésions contusives, les lésions compressives, les lésions de traction, les lésions photochimiques et les lésions d’ischémie-reperfusion. La plupart de ces modèles reflètent également des conditions destructrices aiguës et structurelles (section ou toxicité chimique). Cependant, ces modèles animaux de CSM ne peuvent pas présenter d’apoptose neuronale progressive dans la moelle épinière.
Cet article décrit un protocole détaillé pour générer un modèle de compression de la moelle épinière du rat, qui a été évalué en évaluant le score comportemental et en observant la région compressée de la moelle épinière. Ce modèle de compression de la moelle épinière du rat est un modèle animal fiable pour une étude plus approfondie des mécanismes impliqués dans la MCS.
Protocole
La procédure suivante a été réalisée avec l’approbation du Comité institutionnel de soin et d’utilisation des animaux (IACUC) de l’Université de médecine traditionnelle chinoise de Shanghai. Toutes les chirurgies de survie ont été effectuées dans des conditions stériles telles que décrites par les directives du NIH. La douleur et le risque d’infections ont été gérés à l’aide d’analgésiques et d’antibiotiques appropriés pour assurer un résultat positif. Cette intervention chirurgicale est optimisée pour les rats mâles consanguins Sprague-Dawley (SD) à l’âge de 12 semaines et pesant 400 g.
1. Préparation de l’hydrogel PVA-polyacrylamide
REMARQUE : Comme le montre la figure 1G, 1H, l’hydrogel PVA-polyacrylamide est une feuille de polymère absorbant l’eau. À l’état naturel, le gel est extrêmement difficile à couper en petits morceaux. La préparation est décrite comme suit.
- Placez un hydrogel de PVA-polyacrylamide dans l’eau pendant 24 h pour faciliter la coupe après hydratation.
- À l’aide d’un outil de coupe fabriqué par vos soins (Figure 1H), vous divisez l’ensemble de l’hydrogel en morceaux de 2 mm x 2 mm x 2 mm.
- Transférez ces morceaux d’hydrogel dans un four à 60 °C pendant 12 h pour les déshydrater en petits morceaux de 1 mm x 1 mm x 1 mm comme matériaux d’implantation.
2. Anesthésie et préparation
REMARQUE : Assurez-vous de porter un bonnet chirurgical, des masques médicaux jetables et des gants chirurgicaux stériles tout au long du processus chirurgical stérile.
- Placez le rat sur un coussin chauffant et assurez-vous que la température rectale est maintenue à 37±1 °C pendant l’anesthésie.
- Placez le rat dans la chambre d’anesthésie remplie d’isoflurane à 3 % pendant 3 min.
- Pincez doucement les membres et les orteils du rat avec une pince à épiler pour tester la perte de réponse de retrait, indiquant une anesthésie réussie.
- Fixez le rat sur la table d’opération en position couchée, en vous assurant que les membres et la tête du rat sont fermement fixés.
- Fixez le masque d’anesthésie sur le visage du rat. Administrer de l’isoflurane à 2 % dans un mélange d’oxygène et d’air à l’aide d’un masque nasal standard pour anesthésier le rat tout au long de la chirurgie de compression vertébrale.
- Placez un tampon de gaze cylindrique (d’environ 30 mm x 20 mm x 60 mm) entre le rat et la table d’opération (Figure 1A) pour assurer que les voies respiratoires ne soient pas obstruées et que le site chirurgical soit entièrement exposé tout au long de la chirurgie.
- Rasez les poils autour de la zone chirurgicale du cou du rat avec un rasoir électrique.
- Appliquez une crème dépilante pour enlever les poils restants et exposer la peau.
- Désinfectez la zone chirurgicale avec de l’iodophore.
- Couvrez la zone désinfectée avec une serviette stérile avec un trou n’exposant que la zone chirurgicale sur la face dorsale du cou du rat.
3. Approche chirurgicale
- Faites une incision longitudinale dans la ligne médiane dorsale avec un scalpel de la deuxième apophyse épineuse cervicale à la deuxième apophyse épineuse thoracique, après avoir positionné par voie percutanée la deuxième apophyse épineuse cervicale et la deuxième apophyse épineuse thoracique.
- Blunt sépare les muscles des deux côtés avec une pince hémostatique pour exposer la lame C2-T2 après avoir coupé le tissu sous-cutané et le fascia couche par couche.
- Percez un trou (1 mm x 1 mm) sur la lame cervicale (Figure 1B).
REMARQUE : Pour éviter des blessures excessives sur la moelle épinière, assurez-vous que le cou du rat est maintenu dans un état d’arc dorsal, en laissant suffisamment d’espace entre les lames cervicales. - À l’aide d’une pince microchirurgicale, saisissez un morceau d’hydrogel PVA-polyacrylamide de 1 mm x 1 mm x 1 mm et insérez-le dans le trou précédemment percé (figures 1C, 1D).
REMARQUE : Les performances de contraction transitoire indiquent que le modèle de compression de la moelle épinière a été établi avec succès. - Suturez les tissus musculaires, fasciales et cutanés, couche par couche, à l’aide d’aiguilles triangulaires et de sutures 5-0.
- Après la désinfection, transférez les animaux dans la cage et gardez-les au chaud.
- Injecter par voie sous-cutanée un analgésique au chlorhydrate de buprénorphine (0,03 mg/kg) toutes les 6 heures pendant 3 jours après la chirurgie et au besoin par la suite.
4. Prise en charge postopératoire
- Injecter l’équivalent de 100 000 unités de pénicilline par voie intrapéritonéale chez les rats une fois par jour pour prévenir l’infection postopératoire et soulager la douleur.
- Transférez les rats dans de nouvelles cages qui ont été chauffées en continu avec une lampe infrarouge pour assurer une conservation adéquate de la chaleur postopératoire.
REMARQUE : Retirez la lampe chauffante une fois que le rat a repris conscience - Maintenir l’hygiène et la ventilation de la cage d’alimentation du rat.
- Aidez les rats à manger et à boire deux fois par jour. Si nécessaire, administrez un massage de la vessie pour aider à la miction jusqu’à ce que la fonction urinaire soit rétablie.
5. Évaluation comportementale
- Utilisez l’échelle d’évaluation Basso, Beattie et Bresnahan (BBB) pour évaluer le comportement postopératoire.
REMARQUE : L’échelle d’évaluation de la BHE est un étalon-or (tableau 1) utilisé pour évaluer la fonction liée à la moelle épinière chez les rats. Il évalue le mouvement des rats en fonction de scores allant de 0 (aucun mouvement des membres postérieurs n’a été observé) à 21 (coordination de la marche, cohérence de l’espace des orteils, position des griffes principales parallèle dans toute la posture, stabilité constante du tronc et élévation constante de la queue).
6. Test de force de préhension
- Utilisez un indicateur électronique de la force de préhension pour mesurer la force de préhension.
- Saisissez la moitié inférieure du rat pour suspendre le rat et lui permettre d’attraper la tige métallique du compteur de poignée avant.
- Lorsque le rat saisit la tige métallique, retirez-la et notez la force de préhension.
- Mesurez la force de préhension trois fois pour chaque rat et notez le score le plus élevé.
7. Test de plaque inclinée
- Placez le rat sur une plaque en caoutchouc avec un angle réglable.
- Augmentez progressivement l’angle de la plaque inclinée de 5° à chaque fois jusqu’à ce que le rat parvienne à s’équilibrer et à rester ferme pendant 5 s.
- Notez l’angle maximum auquel le rat peut se tenir en équilibre sur la plaque inclinée.
- Mesurez l’angle maximum trois fois pour chaque rat et notez le score le plus élevé.
8. Euthanasie, séparation de la moelle épinière et intégration congelée
REMARQUE : Assurez-vous de porter des lunettes de protection et un écran facial/masque appropriés pour protéger les yeux, le visage et les voies respiratoires du paraformaldéhyde et du gaz formaldéhyde.
- Injectez l’équivalent de 10 % d’hydrate de chloral par voie intrapéritonéale pour anesthésier les rats avant d’ouvrir le sternum pour exposer le cœur.
- Insérez une aiguille de perfusion dans l’apex du cœur, fixez-la avec une pince hémostatique et perférez lentement avec une solution saline normale.
- Percez un trou sur l’appendice auriculaire droit jusqu’à ce qu’une solution saline normale et propre s’écoule de l’oreillette droite, indiquant une perfusion réussie.
- Arrêtez la perfusion saline normale après que le foie devienne blanc.
- Infuser avec l’équivalent de 10 % de paraformaldéhyde jusqu’à ce que le corps du rat devienne ferme.
- Après la perfusion de paraformaldéhyde, retirez la peau, les muscles et les tissus mous autour de la colonne vertébrale ; séparer le segment C2-C7 de la colonne cervicale ; et immergez-le dans 10 % de paraformaldéhyde pour la fixation pendant la nuit.
- Séparez la moelle épinière cervicale de la colonne vertébrale et placez-la dans un gradient de concentration de 10 %, 20 % et 30 % de solutions de saccharose pour une déshydratation progressive.
- Transférez la moelle épinière comprimée de 2 mm de hauteur avec un agent d’enrobage OCT dans un congélateur à -80 °C.
- Après coupe en tranches de 7 m d’épaisseur et coloration (coloration H&E et marquage dUTP nick end (TUNEL)/noyaux neuronaux (NeuN), voir rubrique 9), observez l’histopathologie de la moelle épinière et l’apoptose neuronale, respectivement.
9. Immunomarquage TUNEL/NeuN
- Immerger les sections de la moelle épinière dans une solution saline tamponnée au phosphate (PBS) pendant 10 min à température ambiante, puis bloquer avec une solution de PBS contenant 0,3 % de Triton X-100 et 5 % d’albumine sérique bovine (BSA) pendant 1 h.
- Incuber les sections de la moelle épinière avec un anticorps polyclonal anti-NeuN de lapin (dilué 1:200 ;) pendant la nuit à 4 °C.
- Rincez les sections de la moelle épinière trois fois dans PBS. Ensuite, incuber avec des anticorps secondaires conjugués à Alexa Fluor 594 pendant 2 h à température ambiante.
- Effectuez le kit de test d’apoptose TUNEL en une étape (fluorescence verte) pour colorer les noyaux apoptotiques des sections de la moelle épinière.
Résultats
Une lésion compressive de la moelle épinière peut entraîner une invalidité neuromusculaire dans les membres
Au fur et à mesure que la pièce d’hydrogel se dilate progressivement, elle comprime de manière persistante la région de la moelle épinière pendant une période prolongée, ce qui simule les handicaps des membres antérieurs induits par les maladies de la moelle épinière cervicale 8,10. Dans le modèle actuel, une contracture ipsilatérale considérable de la patte antérieure a été observée chez la plupart des rats (9/10) du groupe modèle (figure 2A). D’autres mesures et analyses de la longueur et de la largeur des pattes avant ont été effectuées sur une feuille de papier avec une ligne de grille (figure 2B). Les données ont révélé que la longueur et la largeur des pattes antérieures ipsilatérales dans le groupe modèle étaient remarquablement réduites un jour après l’opération (P < 0,01). Cependant, aucune différence significative n’a été détectée dans les pattes antérieures controlatérales entre le groupe témoin et le groupe modèle (figure 2C).
Pour évaluer les progrès et l’incapacité neuromusculaire des membres, l’échelle d’évaluation BBB, le test du plan incliné et le test de préhension des membres antérieurs ont été utilisés pour l’observation les jours 1, 3, 7, 14, 21 et 28 après la chirurgie. Une analyse unidirectionnelle ou bidirectionnelle avec le test de Tukey a été effectuée pour analyser des données normalement distribuées. Un test U de Mann-Whitney non paramétrique avec analyse a posteriori a été effectué pour des données qui n’étaient pas normalement distribuées mais qui contenaient des variances égales. Les données sont exprimées en moyenne ± en écart-type (ET). Les différences ont été considérées comme statistiquement significatives à P < 0,05.
Les résultats ont montré que les scores de BHE des rats du groupe modèle diminuaient progressivement les jours 1 et 3 après l’opération, présentant une incapacité fonctionnelle significative au cours de la phase précoce, en particulier du côté ipsilatéral (Figure 2D, 2E, 2G). Bien que la récupération pour la compression de la moelle épinière ait été observée dans le groupe modèle et dans le groupe témoin, les rats du groupe modèle ont montré une récupération tardive et incomplète de la fonction aberrante de la patte avant et de la capacité d’équilibre par rapport au groupe témoin à 4 semaines après la chirurgie (figures 2E, 2G). Des différences significatives entre le modèle et le groupe témoin ont été maintenues dans le score du plan incliné et la force de préhension au 28e jour après la chirurgie. Ces résultats combinés indiquent que cette chirurgie induit une compression progressive de la moelle épinière cervicale et provoque une détérioration des capacités motrices chez les rats.
Modifications histologiques et inflammation induites par la compression de la moelle épinière
Après avoir séparé la moelle épinière cervicale, une échancrure proéminente de 2 mm de profondeur et de 2 mm x 2 mm a été observée sur la moelle épinière (figure 3B). Pour évaluer les changements morphométriques, les sections de la moelle épinière ont été colorées et observées au microscope optique. La coloration H&E a révélé l’infiltration de cellules immunitaires et une perte spectaculaire de neurones dans la région compressive de la moelle épinière (Figure 3C). De plus, l’immunomarquage a révélé une augmentation spectaculaire de l’apoptose neuronale dans le site de compression de la moelle épinière dans le groupe modèle (Figure 3D, 3E). Certaines cellules ou tissus ont des niveaux élevés d’activité des nucléases et de la polymérase, ce qui pourrait entraîner une fluorescence non spécifique. Par conséquent, le tissu a été immobilisé immédiatement après son extraction pour éviter que ces enzymes ne provoquent de faux positifs. La coloration TUNEL n’est pas spécifique et peut être utilisée en cas de mort cellulaire ou neuronale. NeuN est un marqueur de coloration spécifique pour les neurones. En conséquence, des images fusionnées de la coloration TUNEL et de la coloration NeuN ont été utilisées pour démontrer l’apoptose neuronale.
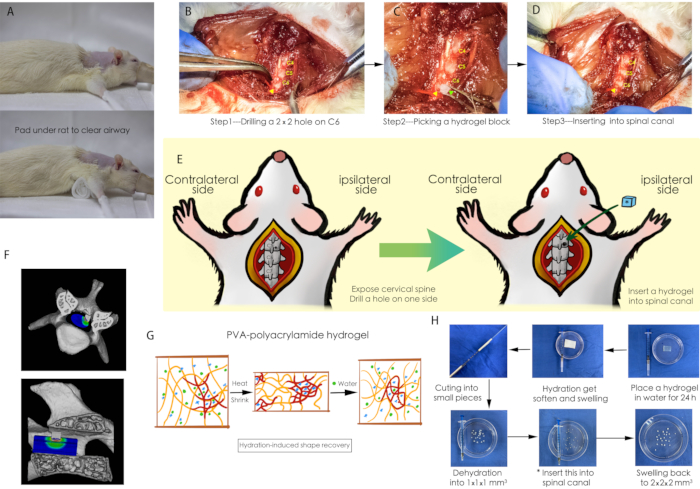
Figure 1 : Schéma de l’intervention chirurgicale. (A) Un tampon de gaze a été placé sous le rat pour s’assurer que les voies respiratoires du rat étaient dégagées pendant l’opération. (B-D) Une intervention chirurgicale d’implantation d’hydrogel dans le canal rachidien cervical ; la pointe de flèche jaune pointe vers un petit trou percé sur la plaque vertébrale de C6, et la pointe de flèche verte indique le bloc d’hydrogel déshydraté. (E) Un schéma de l’intervention chirurgicale. (F) Un schéma tridimensionnel de la compression de la moelle épinière. (G) Propriété d’absorption d’eau de l’hydrogel PVA-polyacrylamide. (H) Préparation du bloc d’hydrogel pour la compression de la moelle épinière. Abréviations : PVA = alcool polyvinylique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Morphologie de la patte antérieure et observations comportementales avec l’échelle BBB, le test de force de préhension et le test de la plaque inclinée. (A) Une caractéristique typique des pattes antérieures ipsilatérales des rats du groupe témoin (à gauche) et du groupe modèle (à droite) le troisième jour après l’opération. (B) La largeur et la longueur des pattes avant des rats ont été mesurées. La flèche rouge transversale va du premier doigt au quatrième doigt, et la flèche rouge longitudinale va du bout du doigt le plus long à la racine de la paume. (C) Analyse quantitative de la longueur et de la largeur des pattes antérieures ipsilatérales dans le groupe modèle et le groupe témoin. (D) Score BBB des côtés ipsilatéral et controlatéral 1, 3, 7, 14, 21 et 28 jours après la chirurgie. (E) La force de préhension des membres antérieurs latéraux ipsilatéraux et controlatéraux 1, 3, 7, 14, 21 et 28 jours après la chirurgie, évaluée à l’aide du test de force de préhension. (F) Schéma de l’essai sur plaque inclinée. (G) La force et l’équilibre des membres latéraux ipsilatéraux et controlatéraux 1, 3, 10, 20 et 28 jours après la chirurgie, évalués à l’aide du test de la plaque inclinée. Les données sont présentées sous forme de moyenne ± écart-type. *P < 0,05 et **P < 0,01 par rapport au groupe témoin ; n = 10/groupe. Abréviation : BBB = Échelle d’évaluation Basso, Beattie et Bresnahan. Veuillez cliquer ici pour voir une version agrandie de cette figure.
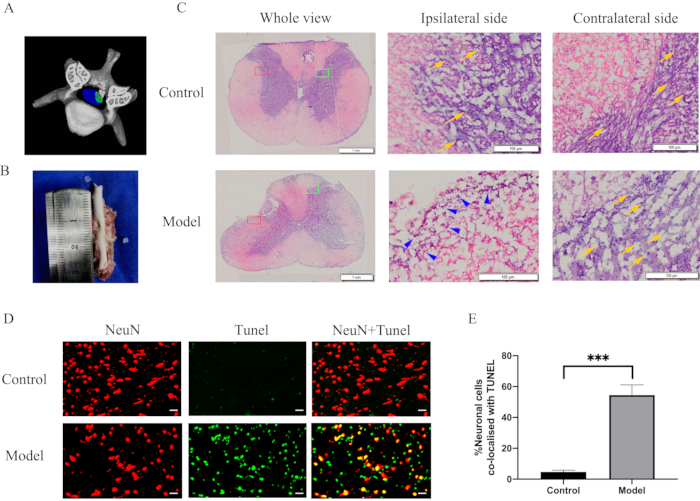
Figure 3 : Changements morphologiques et réponses inflammatoires après une compression prolongée de la moelle épinière cervicale. (A) Un schéma tridimensionnel de la compression de la moelle épinière. (B) Une indentation de 2 mm de profondeur et de 2 mm x 2 mm sur la moelle épinière. (C) Une coupe histologique de la moelle épinière à 28 jours après la compression et la coloration H&E. L’infiltration de cellules immunitaires et une perte dramatique de neurones dans la région compressive de la moelle épinière. Rectangle rouge, côté ipsilatéral ; rectangle vert, controlatéral ; pointes de flèches bleues, cellules immunitaires ; flèches jaunes, neurones. (D) Double coloration pour NeuN (rouge)/TUNEL (vert) de sections du site de compression de la moelle épinière dans le groupe modèle et le groupe témoin. Barres d’échelle = 20 μm. (E) Quantification des cellules doublement positives NeuN et TUNEL. P < 0,001 par rapport au groupe témoin ; n = 10/groupe. Abréviations : H & E = hématoxyline et éosine ; NeuN = noyaux neuronaux ; TUNEL = étiquetage dUTP de l’encoche de l’en-tête. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Score | Définitions opérationnelles des catégories et des attributs | ||
| 0 | Aucun mouvement observable des membres postérieurs | ||
| 1 | Mouvement léger (limité) d’une ou deux articulations, généralement de la hanche et/ou du genou | ||
| 2 | Mouvement important d’une articulation ou mouvement important d’une articulation et léger mouvement de l’autre | ||
| 3 | Mouvement extensif de deux articulations | ||
| 4 | Léger mouvement des trois articulations des membres postérieurs | ||
| 5 | Léger mouvement de deux articulations et mouvement extensif de la troisième articulation | ||
| 6 | Mouvement important de deux articulations et léger mouvement de la troisième articulation | ||
| 7 | Mouvement important des trois articulations des membres postérieurs | ||
| 8 | Balayage sans mise en charge ou appui plantaire de la patte sans mise en charge | ||
| 9 | Soutien plantaire de la patte avec mise en charge uniquement au stade de l’appui (c.-à-d. lorsqu’il est statique) ou pas dorsal occasionnel, fréquent ou incohérent avec mise en charge et pas de marche plantaire | ||
| 10 | Marche plantaire avec mise en charge occasionnelle et absence de coordination entre les membres antérieurs et postérieurs | ||
| 11 | Pas plantaire avec mise en charge fréquente à constante et coordination occasionnelle entre les membres antérieurs et postérieurs | ||
| 12 | Pas plantaire avec mise en charge fréquente à constante et coordination occasionnelle entre les membres antérieurs et postérieurs | ||
| 13 | Pas plantaire avec mise en charge fréquente à constante et coordination fréquente des membres antérieurs et postérieurs | ||
| 14 | Pas plantaire avec un soutien de poids constant, une coordination constante des membres antérieurs et postérieurs et une position de rotation prédominante des pattes (interne ou externe) pendant la locomotion, à la fois au moment du contact initial avec la surface et avant de bouger les orteils à la fin de l’étape de soutien ou des pas plantaires fréquents, une coordination constante des membres antérieurs et postérieurs et des pas dorsaux occasionnels | ||
| 15 | Pas plantaire constant, coordination constante des membres antérieurs et postérieurs et aucun mouvement des orteils ou mouvement occasionnel pendant le mouvement vers l’avant du membre ; La position prédominante de la patte est parallèle au corps au moment du contact initial. | ||
| 16 | Le pas plantaire constant et la coordination avant-postérieur pendant la marche et le mouvement des orteils se produisent fréquemment lors du mouvement vers l’avant du membre ; La position prédominante de la patte est parallèle au corps au moment du contact initial et incurvée au moment du mouvement. | ||
| 17 | Le pas plantaire constant et la coordination des membres antérieurs et postérieurs pendant la marche et le mouvement des orteils se produisent fréquemment lors du mouvement vers l’avant du membre ; La position prédominante de la patte est parallèle au corps au moment du contact initial et à l’instant du mouvement des orteils. | ||
| 18 | Le pas plantaire et la coordination entre les membres antérieurs et postérieurs pendant la marche et le mouvement des orteils se produisent de manière constante pendant le mouvement vers l’avant du membre ; La position prédominante de la patte est parallèle au corps au moment du contact initial et courbée lors du mouvement des orteils. | ||
| 19 | Le pas plantaire et la coordination entre les membres antérieurs et postérieurs pendant la marche et le mouvement des orteils se produisent de manière constante pendant le mouvement vers l’avant du membre ; La position prédominante de la patte est parallèle au corps au moment du contact et au moment du mouvement des orteils, et l’animal présente une queue vers le bas une partie ou la totalité du temps. | ||
| 20 | Le pas plantaire et la coordination entre les membres antérieurs et postérieurs pendant la marche et le mouvement des orteils se produisent de manière constante pendant le mouvement vers l’avant du membre ; La position prédominante de la patte est parallèle au corps au moment du contact et au moment du mouvement des orteils, et l’animal présente une élévation constante de la queue et une instabilité du tronc. | ||
| 21 | Pas plantaire régulier et démarche coordonnée, mouvement constant des orteils ; la position de la patte est principalement parallèle au corps pendant toute la phase d’appui ; stabilité constante du tronc ; élévation constante de la queue | ||
Tableau 1 : Échelle d’évaluation fonctionnelle en 21 points de Basso et al.9,11.
Discussion
Le but de cette intervention chirurgicale était de générer une apoptose neurale reproductible et prolongée dans la moelle épinière du rat. L’un des principaux avantages de ce modèle est que les implants d’hydrogel expansibles assurent une compression prolongée sur la moelle épinière, conduisant ainsi à une réponse apoptotique neurale progressive (Figure 2C), ce qui est cohérent avec le processus pathologique de la MCS. Dans l’étude actuelle, la mortalité par lésion de la moelle épinière était extrêmement faible (~2 sur 50), alors que la répétabilité de ce modèle était de > 45 sur 50. Une taille incorrecte des morceaux d’hydrogel et une implantation vigoureuse pendant la chirurgie peuvent provoquer une lésion aiguë de la moelle épinière12,13.
Une étude non publiée14 a révélé que l’implantation avec un taux d’expansion de 350 % entraînait une MCS temporaire et aiguë avec une récupération progressive pendant plusieurs semaines. Un taux d’expansion de 200 % a provoqué une paralysie progressive lente dans le modèle CSM parce que les implants étaient plus durs que la moelle épinière. Cependant, dans ce modèle, nous ne nous sommes pas intéressés à la dureté du matériau implanté, mais seulement à la taille finale de cette implantation. Après 4 semaines, une indentation sur la moelle épinière (figures 3A, 3B) a été observée, reflétant une constriction soutenue de la moelle épinière, une neuroinflammation aggravée et une apoptose neuronale.
Actuellement, il n’y a pas de consensus sur la taille des implants. Plusieurs études ont utilisé des feuilles absorbantes d’une épaisseur de 0,5 à 1 mm 15,16,17,18 et ont rapporté une incapacité fonctionnelle due à la compression de la colonne vertébrale. Une autre étude sur la compression de la moelle épinière chez le rata montré que la perte de substance blanche intacte et l’aplatissement spectaculaire de la moelle épinière étaient induits par une compression sévère de la moelle épinière (2,6 mm d’épaisseur), qui reflétait une contrainte de compression sans inflammation. Par conséquent, un grand implant fabriqué avec un matériau souple et expansible peut convenir à une compression prolongée sur la moelle épinière.
Dans le modèle actuel, la taille des morceaux d’hydrogel et de la perceuse sur la plaque vertébrale était strictement limitée à une taille de 1 mm x 1 mm x 1 mm pour éviter une lésion aiguë de la moelle épinière ou une mort accidentelle due à une force soudaine due à des implants surdimensionnés. Après 48 h d’hydratation, les blocs d’hydrogel se sont dilatés jusqu’à une taille de 2 mm x 2 mm x 2 mm. Cliniquement, l’aggravation des symptômes chez les patients atteints de CSM est liée à la compression soudaine de la moelle épinière, qui provient d’une hernie discale continue sur la moelle épinière et d’une adaptation compensée inférieure induite par l’inflammation et l’œdème 4,7. Cela pourrait expliquer pourquoi l’infiltration inflammatoire unilatérale d’hydrogel entraîne un déficit bilatéral de la fonction neurologique20.
L’une des limites de ce modèle animal est que les rats montrent une forte adaptation à toute blessure21, ce qui facilite une récupération rapide. Plusieurs études ont montré des améliorations continues de la fonction neurologique au fil du temps après l’opération de compression 15,16,17,18,21,22, alors que seules quelques études ont rapporté une tendance à la détérioration. De plus, la plupart des patients atteints de MCS présentent soit une récupération progressive, soit une détérioration de la fonction neurologique sous une compression constante de la moelle épinière23. Comme il n’y avait pas de différence significative dans la fonction motrice dans le modèle actuel après 4 semaines, nous avons arrêté l’évaluation comportementale et euthanasié les rats pour des investigations histologiques plus approfondies. En résumé, cette étude présente un modèle d’apoptose neuronale induite par la compression de la moelle épinière chez le rat, un modèle animal pratique pour étudier les mécanismes cellulaires et moléculaires associés à la CSM et à la régénération de la moelle épinière.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer et déclarent qu’il n’y a aucune restriction à l’accès complet à tous les documents utilisés dans cette étude.
Remerciements
Cette étude a été soutenue par le Programme national de R&D clé de la Chine (2018YFC1704300), la Fondation nationale des sciences naturelles de Chine (81930116, 81804115, 81873317 et 81704096), le Programme de voile de Shanghai (18YF1423800), la Fondation des sciences naturelles de Shanghai (20ZR1473400). Ce projet a également été soutenu par l’Université de médecine traditionnelle chinoise de Shanghai (2019LK057).
matériels
| Name | Company | Catalog Number | Comments |
| Antibiotic ointment | Prevent wound infection | ||
| Buprenorphine-SR | Pain relief | ||
| Isoflurane | Veteasy | Anesthesia | |
| Inhalant anesthesia equipment | Anesthesia | ||
| Micro ophthalmic forceps | Mingren medical equipment | Length: 11 cm, Head diameter: 0.3 mm | Clip the muscle |
| Ophthalmic forceps | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | JD1050 | Clip the skin |
| Ophthalmic scissors (10 cm) | Shanghai Medical Devices (Group) Co., Ltd. Surgical Instruments Factory | Y00030 | Skin incision |
| SD male rats | Shanghai SLAC Laboratory Animal Co., Ltd | SCXK2018-0004 | Animal model |
| Sterile surgical blades (22#) | Shanghai Pudong Jinhuan Medical Products Co., Ltd. | 35T0707 | Muscle incision |
| Small animal trimmer | Hair removal | ||
| Veet hair removal cream | RECKITT BENCKISER (India) Ltd | Hair removal | |
| Venus shears | Mingren medical equipment | Length: 12.5 cm | Muscle incision |
Références
- Lebl, D. R., Bono, C. M. Update on the diagnosis and management of cervical spondylotic myelopathy. The Journal of the American Academy of Orthopaedic Surgeons. 23 (11), 648-660 (2015).
- Haddas, R., et al. Spine and lower extremity kinematics during gait in patients with cervical spondylotic myelopathy. The Spine Journal. 18 (9), 1645-1652 (2018).
- Song, D. W., Wu, Y. D., Tian, D. D. Association of Vdr-Foki and Vdbp-Thr420 Lys polymorphisms with cervical spondylotic myelopathy: A case-control study in the population of China. Journal of Clinical Laboratory Analysis. 33 (2), 22669 (2019).
- Kurokawa, R., Murata, H., Ogino, M., Ueki, K., Kim, P. Altered blood flow distribution in the rat spinal cord under chronic compression. Spine. 36 (13), 1006-1009 (2011).
- Wen, C. Y., et al. Is Diffusion anisotropy a biomarker for disease severity and surgical prognosis of cervical spondylotic myelopathy. Radiology. 270 (1), 197-204 (2014).
- Long, H. Q., Li, G. S., Hu, Y., Wen, C. Y., Xie, W. H. Hif-1A/Vegf signaling pathway may play a dual role in secondary pathogenesis of cervical myelopathy. Medical Hypotheses. 79 (1), 82-84 (2012).
- Karadimas, S. K., Erwin, W. M., Ely, C. G., Dettori, J. R., Fehlings, M. G. Pathophysiology and natural history of cervical spondylotic myelopathy. Spine. 38, 21-36 (2013).
- Wilson, J. R., et al. State of the art in degenerative cervical myelopathy: an update on current clinical evidence. Neurosurgery. 80, 33-45 (2017).
- Baptiste, D. C., Fehlings, M. G. Pathophysiology of cervical myelopathy. The spine Journal. 6, 190-197 (2006).
- Wilcox, J. T., et al. Generating level-dependent models of cervical and thoracic spinal cord injury: exploring the interplay of neuroanatomy, physiology, and function. Neurobiology of Disease. 105, 194-212 (2017).
- Takano, M., et al. Inflammatory cascades mediate synapse elimination in spinal cord compression. Journal of Neuroinflammation. 11, 40 (2014).
- Hu, Y., et al. Somatosensory-evoked potentials as an indicator for the extent of ultrastructural damage of the spinal cord after chronic compressive injuries in a rat model. Clinical Neurophysiology. 122 (7), 1440-1447 (2011).
- Yang, T., et al. Inflammation level after decompression surgery for a rat model of chronic severe spinal cord compression and effects on ischemia-reperfusion injury. Neurologia Medico-Chirurgica. 55 (7), 578-586 (2015).
- Ijima, Y., et al. Experimental rat model for cervical compressive myelopathy. Neuroreport. 28 (18), 1239-1245 (2017).
- Yamamoto, S., Kurokawa, R., Kim, P. Cilostazol, a selective type iii phosphodiesterase inhibitor: prevention of cervical myelopathy in a rat chronic compression model. Journal of Neurosurgery. Spine. 20 (1), 93-101 (2014).
- Holly, L. T., et al. Dietary therapy to promote neuroprotection in chronic spinal cord injury. Journal of Neurosurgery. Spine. 17 (2), 134-140 (2012).
- Zhao, P., et al. In vivo diffusion tensor imaging of chronic spinal cord compression: a rat model with special attention to the conus medullaris. Acta Radiologica. 57 (12), 1531-1539 (2016).
- Kurokawa, R., Nagayama, E., Murata, H., Kim, P. Limaprost alfadex, a prostaglandin E1 derivative, prevents deterioration of forced exercise capability in rats with chronic compression of the spinal cord. Spine. 36 (11), 865-869 (2011).
- Lee, J., Satkunendrarajah, K., Fehlings, M. G. Development and characterization of a novel rat model of cervical spondylotic myelopathy: the impact of chronic cord compression on clinical, neuroanatomical, and neurophysiological outcomes. Journal of Neurotrauma. 29 (5), 1012-1027 (2012).
- Chen, B., et al. Reactivation of dormant relay pathways in injured spinal cord by Kcc2 manipulations. Cell. 174 (3), 521-535 (2018).
- Yu, W. R., Liu, T., Kiehl, T. R., Fehlings, M. G. Human neuropathological and animal model evidence supporting a role for Fas-mediated apoptosis and inflammation in cervical spondylotic myelopathy. Brain. 134, 1277-1292 (2011).
- Yu, W. R., et al. Molecular mechanisms of spinal cord dysfunction and cell death in the spinal hyperostotic mouse: implications for the pathophysiology of human cervical spondylotic myelopathy. Neurobiology of Disease. 33 (2), 149-163 (2009).
- Iyer, A., Azad, T. D., Tharin, S. Cervical spondylotic myelopathy. Clinical Spine Surgery. 29 (10), 408-414 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.