Method Article
Vitro ve Omurilikte Floresan Etiketli Küçük Hücre Dışı Veziklin Alımı
Bu Makalede
Özet
Makrofajdan türetilmiş küçük hücre dışı vesikleleri PKH boyalarla etiketlemek ve intratekal doğumdan sonra in vitro ve omurilikte alımlarını gözlemlemek için bir protokol açıklıyoruz.
Özet
Küçük hücre dışı veziklinler (sEV' ler) tüm hücreler tarafından salgılanan ve vücut sıvılarında bulunan 50-150 nm veziklinlerdir. SEV'ler RNA, proteinler ve lipitler gibi biyomolekülleri donörden alıcı hücrelere aktararak hücreler arasında anahtar sinyal verici arabulucular haline getirir. Merkezi sinir sisteminde (CNS), sEV'ler nöroimmün etkileşimler de dahil olmak üzere hücreler arası sinyalizasyona aracılık edebilir. sEV fonksiyonları, alıcı hücrelerde hem in vitro hem de in vivoolarak etiketli sEV'lerin alımını izleyerek incelenebilir. Bu makalede, RAW 264.7 makrofaj hücrelerinin koşullandırılmış ortamlarından SEV'lerin PKH membran boyası kullanılarak etiketlenerek etiketlenimi açıklanmaktadır. Nöro-2a hücreleri ve birincil astrosit in vitro tarafından birden fazla zaman noktasında etiketli sEV'lerinfarklı konsantrasyonlarının alımını gösterir. Ayrıca fare omurilik nöronlarında, astrositlerde ve konfokal mikroskopi ile görselleştirilen mikroglialarda intratekal olarak teslim edilen sEV'lerin alımı gösterilmiştir. Temsili sonuçlar, sEV'lerin farklı hücreler tarafından alınmasında zamana bağlı varyasyonu göstermektedir, bu da omuriliğe başarılı sEV'lerin teslimini doğrulamaya yardımcı olabilir.
Giriş
Küçük hücre dışı veziklinler (sEV'ler) 50-150 nm boyut aralığına sahip nanosized, membran türevi veziklinlerdir. Çok araçlı cisimlerden (MVB' ler) kaynaklanırlar ve MVB'lerin plazma zarı ile füzyonu üzerine hücrelerden salınırlar. sEV'ler miRNA'lar, mRNA'lar, proteinler ve biyoaktif lipitler içerir ve bu moleküller hücreler arasında hücreden hücreye iletişim şeklinde aktarılır. sEV'ler alıcı hücreler tarafından çeşitli endosit yollar tarafından içselleştirilebilir ve sEV'lerin alıcı hücreler tarafından bu şekilde yakalanması, hem EV'lerdeki hem de hedef hücrelerdeki yüzey moleküllerinin tanınması ile aracılık eder1.
SEV'ler, kabul eden hücrelerde moleküler ve fenotipik değişiklikleri tetikleme kapasiteleri, terapötik bir ajan olarak yararları ve kargo molekülleri veya farmakolojik ajanlar için taşıyıcı olarak potansiyelleri nedeniyle ilgi kazanmıştır. Küçük boyutları nedeniyle, sEV'lerin görüntülenmesi ve izlenmesi, özellikle in vivo çalışmalar ve klinik ayarlar için zor olabilir. Bu nedenle, biyodistribution ve in vitro ve in vivo 2 izlemelerine yardımcı olmak için sEV'leri etiketlemek ve görüntülemek için birçok yöntem geliştirilmiştir.
SEV biyodistribasyon ve hedef hücre etkileşimlerini incelemek için en yaygın teknik, floresan boya molekülleri 3 , 4,5,6,7ile etiketlemeyi içerir. EV'ler başlangıçta hücreleri görüntülemde yaygın olarak kullanılan hücre zarı boyaları ile etiketlenmiştir. Bu floresan boyalar genellikle lipid bilayer veya sEV'lerde ilgi çekici proteinleri lekeler. Birkaç lipofilik boyalar, DiR (1,1′-dioctadecyl-3,3,3′,3′,-tetrametindotricarbocyanine iyodür), DiL (1, 1′-dioctadecyl-3), dahil olmak üzere sitozol içine dahil edildiğinde güçlü bir floresan sinyal gösterir. 3, 3′, 3′-tetrametrin indokarboksiyanine perklorat), ve DiD (1, 1′-dioctadecyl-3, 3, 3′, 3′-tetrametil indokarboksiyanin 4-klorobenzenesulfonat tuzu)8,9,10,11.
PKH67 ve PKH26 gibi diğer lipofilik boyalar, son derece floresan bir polar kafa grubuna ve herhangi bir lipit yapısına kolayca karışan ve uzun süreli boya tutma ve stabil floresan12'yeyol açan uzun bir alifatik hidrokarbon kuyruğuna sahiptir. PKH boyaları, VIVO13'tekiEV özelliklerinin incelenmesine izin veren EV'leri deetiketleyebilir. Floresan mikroskopi ve akış sitometrisi kullanarak ekzomları gözlemlemek için başka birçok boya kullanılmıştır, lipid etiketleme boyaları14 ve karboksifluorescein diasetat succinimidyl ester (CFDA-SE)15,16 ve calcein asetoksimetil (AM) ester17gibi hücre geçirgen boyalar dahil.
CNS'deki farklı hücreler arasında sEV aracılı çapraz konuşma çalışmaları nöroinflamatuar ve nörodejeneratif hastalıkların patogenezine dair önemli içgörüler sağlamıştır18. Örneğin, nöronlardan gelen SEV'ler beta-amiloid peptitleri ve fosforillenmiş tau proteinlerini yayabilir ve Alzheimer hastalığının patogenezine yardımcı olabilir19. Ek olarak, eritrositlerden elde edilen EV'ler büyük miktarlarda alfa-sinüklein içerir ve kan-beyin bariyerini geçebilir ve Parkinson patolojisine katkıda bulunabilir20. SEV'lerin fizyolojik engelleri21'i geçebilmeleri ve biyomoleküllerini hedef hücrelere aktarabilmeleri, onları CNS22'yeterapötik ilaçlar sunmak için uygun araçlar haline getirir.
SEV alımını omurilikteki sayısız CNS hücresi tarafından görselleştirmek, hem mekanistik çalışmalara hem de çeşitli hücresel kaynaklardan eksojen olarak uygulanan SEV'lerin terapötik faydalarının değerlendirilmesini sağlayacaktır. Bu makalede, makrofajlardan elde edilen sEV'leri etiketlemek ve lomber omurilikteki in vitro ve in vivo alımlarını nöronlar, mikroglia ve astrositler tarafından görselleştirme ile sEV doğumunu niteliksel olarak doğrulamak için etiketlemek için metodoloji açıklanmaktadır.
Protokol
NOT: Tüm prosedürler Laboratuvar Hayvanlarının Bakımı ve Kullanımı için NIH Kılavuzu'na uygun olarak gerçeklatılmış ve Drexel Üniversitesi Tıp Fakültesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır. Zamanlanmış hamile CD-1 fareler astrositik kültür için kullanıldı ve tüm barajlar emprenye edildikten 15 gün sonra alındı. In vivo alım deneyleri için 10-12 haftalık C57BL/6 fareler kullanıldı.
1. SEV'lerin RAW 264.7 makrofaj hücrelerinden yalıttırılır
- Kültür RAW 264.7 hücre 75 cm2 şişelerde DMEM ekzozom-tükenmiş ortamda% 10 ekzozom tükenmiş fetal sığır serumu (FBS) ve% 1 penisilin-streptomisinin (kalem strep) 24-48 saat.
- 4 °C'de 10 dakika boyunca 300 × g'da 300 mL şartlandırılmış orta ve santrifüj toplayın.
- 4 °C'de 20 dakika boyunca 2.000 g'da 2.000 ×'da süpernatant ve santrifüjü toplayın.
- Süpernatantı santrifüj tüplerine, santrifüjü 12.000 × g'da 4 °C'de 35 dakika aktarın.
- Süpernatantı toplayın ve 0,22 μm şırındi filtresinden filtreleyin.
- 4 °C'de 110.000 g'da 80 dakika ultracentrifuge tüplere × ve santrifüje aktarın.
- Süpernatantı (eksozom tükenmiş ortam) saklayın, peleti 2 mL 1x fosfat tamponlu salin (PBS) ve santrifüjü 110.000 × g 4 °C'de 1 saat boyunca yeniden depolayın.
- Nanopartikül izleme analizi (NTA) ve iletim elektron mikroskopisi (TEM) veya batı şişkinliği için radyoimmün önkeklilik tahlil (RIPA) tamponu kullanılarak daha fazla karakterizasyon için peleti 100 μL PBS'de yeniden atın.
2. SEV'lerin karakterizasyonu
- Nanopartikül izleme analizi (NTA)
NOT: RAW 264.7 hücrelerinden arındırılmış sEV'lerin boyut dağılımı ve partikül sayısı/konsantrasyonu NTA ile ölçüldü.- Optimum izleme için görüş alanı başına 20-60 veziklin elde etmek için sEJ'leri filtrelenmiş PBS'de seyreltin.
- Seyreltilmiş numuneyi sabit bir akış hızına sahip bir şırınna pompası kullanarak bir akış hücresine sokun.
- Her biri 30 sn'lik 3-5 video çek. Deklanşör hızını ve kazancını ayarlayın ve kamera ayarlarını görünür ve izlenebilecek ve analiz edilebilecek maksimum sayıda vezikül için manuel olarak odaklayın.
- Çoğaltma ölçümleri gerçekleştirmek için örnekleri her kayıt arasında ilerletin. NTA alım sonrası ayarlarını optimize edin ve ayarları örnekler arasında sabit tutun.
- Veziklinlerin ortalama boyutunu ve konsantrasyonu elde etmek için NTA yazılımını kullanarak her videoyu analiz edin.
- Tutarlılık için tüm NTA ölçümlerini aynı sistem ayarlarıyla gerçekleştirin.
- Batı lekesi
- Üreticinin talimatlarını takip eden bir protein test kiti kullanarak SEV'lerdeki, hücre lizazlarındaki ve ekzozom tükenmiş ortamlardaki toplam protein miktarlarını ölçün.
- Hücre lysate hazırlanması için, RAW 264.7 hücrelerini 75 cm2 şişelerde% 80-90 birleştiği zamana kadar kültür edin. Hücreleri 10-15 dakika boyunca% 0.25 tripsin ile ayırın, tripini kültür ortamıyla nötralize edin ve 5 dakika boyunca 400 × g'da dönerek hücreleri peletin. Hücreleri taze büyüme ortamında yeniden biriktirin.
- Hemositometre kullanarak hücreleri sayın ve 1 × 106 hücreyi başka bir tüpe aktarın. Yukarıdakiyle aynı santrifüjleme koşullarını kullanarak hücreleri PBS ile iki kez yıkayın ve son dönüşten itibaren hücre peletine 50 μL lizis tamponu (proteaz inhibitörü kokteyli ekli RIPA tamponu) ekleyin.
- Hücreleri girdaplayın ve 20 dakika boyunca buzda tutun. Karışımı 4 °C'de 30 dakika boyunca 10.000 × g'da santrifüje maruz koyun, süpernatantı (yani lisatı) taze mikrosantrifüj tüplerinde toplayın ve kullanıma kadar −80 °C'de tutun.
- Protein miktarını ölçmeden önce 3 kDa kesme santrifüj filtreleri kullanarak 2 mL eksozom tükenmiş ortamı 100 μL'ye konsantre edin. SEV'leri lizis tamponu ile 1:1 oranında, girdapta 30 sn karıştırın ve protein miktarını ölçmek için 15 dakika boyunca buz üzerinde kuluçkaya yatırın.
- Numune tamponunun azaltılmasıyla eşit miktarda sEV, RAW 264,7 hücre lizatı ve eksozom tükenmiş ortamı karıştırın.
- Örnekleri 95 °C'de 5 dakika denature, 5 dakika buzda tutun ve 10.000 × g'da 2 dakika döndürün. Numuneleri% 12 Tris glisinin protein jelini yükleyin ve jeli 125 V'ta 45 dakika çalıştırın.
- Proteini 2 saat boyunca 25 V'ta bir polivinylidene difluorid (PVDF) membranına aktarın.
- Aktarımı takiben, PVDF membranlarını oda sıcaklığında 1 saat boyunca engelleme tamponu ile engelleyin (Malzeme Tablosunabakın).
- Blot'u 4 °C'de bir gecede bir çalkalayıcı üzerinde birincil antikorlarla kuluçkaya yatırın.
NOT: Kullanılan primer antikorlar anti-CD81 (1:1.000), anti-alfa-1,3/1,6-mannosyltransfeaz (ALG-2)-etkileşim proteini X (Alix) (1:1:000) 1.000), anti-Calnexin (1:1.000) ve anti-gliseraldehit 3-fosfat dehidrogenaz (GAPDH) (1:1.000). - Lekeleri 1x Tris tamponlu salin, %0,1 Ara 20 (TBST) ile 3 x 15 dk yıkayın ve oda sıcaklığında keçi anti-fare IgG-yaban turpu peroksidaz (HRP) veya eşek anti-tavşan IgG-HRP-konjuge ikincil antikorlar (1:10,000) ile oda sıcaklığında 1 saat boyunca kuluçkaya yatırın.
- Lekeleri 3 x 15 dk 1x TBST ile yıkayın ve proteinleri bir HRP substratı kullanarak tespit edin.
- Batı leke görüntüleyicısı kullanarak gelişmiş chemiluminescence ile lekeleri analiz edin.
- İletim elektron mikroskopisi (TEM)
- SEV'leri 0,1 M fosfat tamponunda (PB) %2 paraformaldehit (PFA) olarak yeniden oluşturarak düzeltin; 2 x 15 sn için girdap.
- Temiz parafilme 10 μL sEV süspansiyonu yerleştirin. Karbon kaplı formvar ızgarasını, kaplamalı tarafı süspansiyona bakacak şekilde damla üzerinde yüzdürülür. Membranların kuru bir ortamda 20 dakika emici olduğuna izin verin.
- Izgaraları (membran tarafı aşağı) 3 x 2 dakika yıkamak için bir damla PB üzerine yerleştirin.
- Izgaraları 5 dakika boyunca% 1 glutaraldehitin 50 μL'sine aktarın.
- Izgaraları 100 μL damıtılmış su ile 8 x 2 dakika yıkayın.
- Izgaraları 2 dakika boyunca% 1 uranil asetat damlasına yerleştirerek numuneyi karşılaştırın.
- Numuneyi 50 μL%0,2 uranil asetat ile %2 metilselüloz çözeltisi ile parafilm kaplı bir buz kabına 10 dakika boyunca gömün.
- Izgaraları tutmak ve fazla sıvıyı filtre kağıdıyla çıkarmak için paslanmaz çelik halkalar kullanın.
- Hala döngüdeyken ızgarayı 10 dakika boyunca havayla kurulayın.
- 80 kV'da bir iletim elektron mikroskobu altında gözlemleyin.
3. SEV'lerin etiketlenerek etiketlenerek
- Boya kontrolü için 1 mL seyreltici tamponda 20 μg SEV veya 1 mL seyreltici tamponda aynı hacimde PBS seyreltin.
- 3 μL PKH67 veya PKH26 boyasını 1 mL seyreltici tamponda seyreltin ve pipetleme ile karıştırın.
- Seyreltilmiş SEV'lere seyreltilmiş PKH boyası ekleyin ve pipetleme ile karıştırın. Oda sıcaklığında karanlıkta 5 dakika kuluçkaya yatırın. Boya kontrolü için, seyreltilmiş boyayı adım 3.1'den seyreltilmiş PBS ile karıştırın.
- PBS'deki %1 sığır serum albüminin (BSA) 2 mL'sini boya ve sEV karışımı ile tüpe ve fazla boyayı emmek için boya kontrol tüpüne ekleyin.
- 110.000'de 1 saat × 4 °C'de g için santrifüj. Süpernatantı atın, peleti 2 mL PBS'de yeniden atın ve 110.000'de 1 saat santrifüj × 4 °C'de g. Yıkamayı PBS ile tekrarlayın ve etiketli sEV'leri veya boya kontrolünü eşit miktarda PBS'de yeniden diriltin.
- Bradford yöntemiyle toplam protein miktarını ölçün.
4. SEV'lerin Nöro-2a hücreleri tarafından alınması
- 18 mm'lik kapakları 12 kuyulu bir plakaya ve plaka 10 ×10 4 Nöro-2a hücresine% 10 FBS ve% 1 kalem strep içeren toplam 1 mL komple DMEM ortamına yerleştirin.
- Hücre konfülüzyonu %80-90 olduğunda ortamı DMEM eksozom tükenmiş ortam olarak değiştirin. Doz ve zamana bağlı alım için her kuyuya 1, 4 ve 24 saat boyunca 1, 5 veya 10 μg etiketli sEV ekleyin veya eşit miktarda boya kontrolü ekleyin.
5. Birincil astrositik kültürler
- Doğumdan 4 gün sonra hipotermi başlatarak 4 postnatal yavruyu uyuşturmak.
- Beyinleri, 10 mM 4-(2-hidroksetil)-1-piperazineethanesulfonic acid (HEPES) ile desteklenmiş buz gibi Hank'in Dengeli Tuz Çözeltisi (HBSS) içeren 60 mm'lik bir Petri kabında toplayın.
- Her iki kortikal lobun da inceksini alın ve menenjileri çıkarın. Dokuları sterilize edilmiş bir bıçakla kıyma.
- Dokuları papain/deoksiribonükleaz I ayrıştırma tamponu içeren 15 mL konik bir tüpe aktarın ve 37 °C'de 20 dakika kuluçkaya yatırın. Her 5 dakikada bir döndürün.
NOT: 4 fare kortiği için, HBSS'deki 9 mL 7,5 U/mL papain, 37 °C'de en az 30 dakika boyunca etkinleştirilir, 0,22 μm şırıng filtresinden süzülür ve deoksiribonükleaz I ile 0,1 mg/mL'lik son konsantrasyona karıştırılır. - Süpernatantı aspire edin ve enzim aktivitesini inaktive etmek için 5 mL tam DMEM ekleyin. Dokuları 5 mL cam serolojik pipet ve alev cilalı Pasteur pipet ile ayrıştırmak için dikkatlice tritüre edin.
- Hücre süspansiyonunu 40 μm hücre süzgecinden geçirin ve hücreleri 4 °C'de 5 dakika boyunca 250 × g'da santrifüj edin. Ortamı epire edin ve hücreleri 75 cm2 şişede 10 mL tam DMEM'de tohumlayın. Kaplamadan sonra süpernatant ortamı 15 mL taze DMEM ortamı 4 saat ile değiştirin.
- 14 gün in vitrosonra, mikroglia ve oligodendrositleri 320 rpm'de 6 saat boyunca ayırmak için şişeyi yörüngesel bir çalkalayıcıya aktarın.
- Kalan astrositleri 37 °C'de 10 dakika boyunca hücre ayrışmaenziminin (Malzeme Tablosu)5 mL'si kullanılarak deneyin. Enzimatik eylemi devre dışı bırakmak için 5 mL tam DMEM ekleyin ve hücreleri 4 °C'de 5 dakika boyunca 250 × g'da peletleyin.
- Hücreleri tam DMEM'de yeniden biriktirin. Tohum 5 ×10 4 hücre üzerinde 12 mm #1.5 kapaklar üzerinde 24 kuyulu bir plaka.
6. SEV'lerin astrositler tarafından alınması
- Astrositler %80-90 izdiah süresine ulaştığında, ortamı DMEM eksozom tükenmiş ortam olarak değiştirin.
- Hücrelere 1 μg etiketsiz, etiketli sEV, eşit miktarda boya kontrolü veya PBS ekleyin. SEV tedavisinden sonra 1 saat ve 24 saat boyamak için hücreleri kullanın.
7. İmmünoresans
- Hücreleri PBS 3x ile durulayın ve oda sıcaklığında 10 dakika boyunca PB'de% 4 PFA ile sabitlayın.
- Sabit hücreleri PB ile 3 x 5 dk yıkayın ve PB'de %0,1 Triton X-100 kullanarak 10-15 dk boyunca dengelerini bozun ve PB 3 x 5 dk ile yıkayın.
- PB'de %5 normal keçi serumu (NGS) bulunan hücreleri oda sıcaklığında 1 saat boyunca tıkayın.
- Hücreleri birincil antikorlarla kuluçkaya yatırın: Nöro-2a hücreleri için mikrotübül ilişkili protein 2 (MAP2A, 1:500) veya 4 °C'de bir gecede taze % 5 NGS/PB'de birincil astrositler için glial fibril asidik protein (GFAP, 1:500) nazik titreme ile.
- PB ile 3 x 10 dakika yıkayın ve floroforla konjuge ikincil antikorlar ekleyin (Keçi Anti-Mouse IgG1, Alexa Fluor 594; veya Keçi Anti-Mouse IgG H&L, Alexa Fluor 488) % 5 NGS'de ve bir rocker'da oda sıcaklığında 2 saat kuluçkaya yatırın.
- PB ile 3 x 10 dk yıkayın ve oda sıcaklığında 10 dakika boyunca 1 μg/mL nükleer leke 4',6-diamidino-2-fenilindole (DAPI) ile kuluçkaya yatırın. Hücreleri PB ile 3x tekrar yıkayın.
- Kapakları bir antifade montaj ortamı kullanarak 1 numaralı slaytlara monte edin. Karanlıkta gece boyunca kurumalarını bekleyin ve hazırlanan cam slaytları konfokal mikroskopta görüntülemeye kadar 4 °C'de saklayın.
8. SEV'lerin in vivo alımı
- C57BL/6 farelere 10 μL PBS'de yeniden 5 μg etiketli veya etiketli sEV'lerin intratekal enjeksiyonu veya eşit hacimli (10 μL) boya kontrolü (bölüm 3'te hazırlandığı gibi) gerçekleştirin.
- SEV'lerin enjeksiyonundan 6 ve 18 saat sonra, 100 mg / kg vücut ağırlığı ketamin ve 10 mg / kg vücut ağırlığı ksilazinin intraperitoneal enjeksiyonu ile fareleri derinden uyuşturun.
- Kanı temizlemek için% 0.9 salin ile farelerin intrakardiyal perfüzyonunu gerçekleştirin, ardından taze yapılmış buz gibi% 4 PFA / PB.
- Omuriliği parçalara ayrıştırın ve 24 saat boyunca 4 °C'de %4 PFA/PB'de sabitlenin. Dokuları PB'de % 30 sakkarozda 24 saat boyunca veya dokular batana kadar 4 °C'de kriyoprotect. Dokuları immünostokimyaya kadar 4 °C'de saklayın.
9. İmmünohistokinoloji
- L4-L5 omuriliğini O.C.T bileşiğine gömün. Tamamen katılanınya kadar kuru buz üzerinde dondurun.
- Dokuları bir kriyostat kullanarak 30 μm'de (omurilik için kesitsel olarak) bölümlere koyun ve bölümleri PB içeren 24 kuyulu bir plakada toplayın. Pb'de %0,3 Triton ile bölümleri 3 x 5 dk yıkayın.
- Oda sıcaklığında 2 saat boyunca %0,3 Triton/PB'de %5 NGS ile spesifik olmayan bağlama bölgelerini engelleyin.
- Birincil antikorları seyreltin: Anti-MAP2A (1:500), GFAP (1:1.000), mikroglia için Iba1 (1:2.000) ve % 5 NGS ile% 0.3 Triton / PB ve bölümleri bir gecede 4 ° C'de bir çalkalayıcıda kuluçkaya bırakın.
- Bölümleri %0,3 Triton/PB ile 3 x 5 dk yıkayın ve oda sıcaklığında 2 saat boyunca %5 NGS/PB'de ikincil antikorlar (Eşek Anti-Tavşan IgG Alexa Fluor 488, 1:500 veya Keçi Fare Önleyici IgG Alexa Fluor 488, 1:500) ekleyin.
- PB ile 3 x 5 dakika yıkayın ve bölümleri oda sıcaklığında 10 dakika boyunca 1 μg / mL DAPI'da kuluçkaya yatırın. 3 x 5 dk bölümleri PB ile yıkayın.
- Bölümleri hafif bir mikroskop altında ince bir boya fırçası ile temiz bir yapışkan kaydırakta(Malzeme Masası)monte edin.
- Kapak kapağını montaj ortamı ile ıslatın. Oda sıcaklığında karanlıkta gece boyunca tedavi edin.
- İlgili lazerlerle konfokal mikroskop altında görüntü.
Sonuçlar
SEV'lerin RAW 264.7 şartlandırılmış ortamdan santrifüjleme yoluyla izole edilmesi sonrasında, saflaştırılmış SEV'lerin konsantrasyonunu ve boyut dağılımını belirlemek için NTA kullanılmıştır. RAW 264.7 türevi sEV'lerin ortalama ortalama büyüklüğü 140 nm ve tepe parçacık boyutu 121.8 nm idi ve ışık saçılma ölçümündeki çoğu tespit edilebilir parçacığın 50-150 nm'de ekzozom veya sEV boyut aralığına düştüğünü doğruladı (Şekil 1A). Hücre dışı veziklin çalışmaları için minimum bilgide önerildiğiniz gibi 2018 (MISEV2018)23, farklı EV popülasyonlarından bulunması veya dışlanmış olması gereken bir dizi proteini analiz ettik. SEV'lerin, hücre lisatının ve eksoz tükenmiş ortamların Batı blottingi, sEV türevi protein örneklerinin sEV belirteç proteinleri Alix, CD81 ve GAPDH içerdiğini göstermiştir. Hücre lisat fraksiyonu, SEV'lerde bulunmayan endoplazmik retikülum yerleşik proteini calnexin ile zenginleştirilmiştir. Böylece, calnexin hücresel kontaminasyon için negatif bir işaretleyici olarak hizmet etti (Şekil 1B).
Daha sonra sEV alımı in vitroiçin doz-yanıt ve zaman kursu deneyleri gerçekleştirdik. Nöro-2a hücreleri 1, 4 ve 24 saat boyunca tek bir 1 μg PKH67 etiketli sEV dozu ile inkübe edildi ve ardından farklı sEV konsantrasyonlarının (1, 5 ve 10 μg) alımı 1 saat olarak incelendi. NTA sonuçları ortalama 1 μg proteinin ~1 x 109 partiküle eşit olduğunu gösterdi. Buna paralel olarak PBS, etiketsiz sEV'ler ve tek başına boya kontrolleri de test edilmiştir. SEV'lerin alımının 1 saat ( Şekil2A) ve 1, 5 ve 10 μg sEV'ler (Şekil 2B)için gerçekleştiğini gözlemledik. Kuluçka sonrası 5 ve 10 μg sEV'ler (Şekil 2C) için 4 saat olarak floresan tespit edilebilir. Daha sonra, PKH26 etiketli sEV'lerin birincil astrositlere göre alınması incelenmiştir (Şekil 3). Primer kortikal astrositlerde sEV alımından kaynaklanan maksimal floresan 24 saat olarak ortaya çıktı. Etiketsiz sEV'ler floresan göstermedi, sEV otofluoresansı yanlış pozitiflere önemli ölçüde katkıda bulunmadığını gösterdi(Ek Şekil S1A).
Daha sonra, etiketli sEV'ler, immünhistokimya ve konfokal mikroskopi kullanılarak omurilikteki farklı hücreler tarafından SEV'lerin teslimini ve alımını değerlendirmek için farelere intratekal olarak enjekte edildi. MAP2 için nöronal belirteç, Astrositik belirteç olarak GFAP ve mikroglial belirteç olarak IBA1 için lekelendik. Nöronlar (Şekil 4), astrositler (Şekil 5) ve mikroglial hücreler (Şekil 6) hepsi PKH26 etiketli sEV'leri aldı ve enjeksiyon sonrası 6 saatte maksimal sEV floresan gözlendi. SEV'ler her zaman hücresel belirteçlerle kolokalize olmasa da, CNS hücreleri tarafından herhangi bir diferansiyel alımı gözlemlemedik. 5 μg etiketsiz RAW 264.7 sEVs veya boya kontrolü ile intratekal enjeksiyon önemli floresan göstermedi(Ek Şekil S1B). SEV enjeksiyonundan sonra hem 6 h hem de 18 h menenjitlerde floresan sinyaller gözlenmiştir(Ek Şekil S1C).

Şekil 1: Saflaştırılmış RAW 264.7 sEV'lerin karakterizasyonu. (A) NanoSight NS300 kullanılarak sEV'lerin boyutu ve konsantrasyonu belirlendi. Parçacıklar Brownian hareketi ve difüzyon katsayısına göre izlendi ve boyutlandı. SEV'lerin boyut dağılımı nm olarak gösterilmiştir. SEV konsantrasyonu parçacık/mL olarak ifade edildi. (B) SEV işaretleyicileri ALIX, GAPDH ve CD81 kullanılarak saflaştırılmış sEV'lerden, hücre lizatından ve ekzozom tükenmiş ortamdan elde edilen batı protein lekesi. Endoplazmik retikülum protein belirteci calnexin, sEV preparatlarında hücresel kontaminasyonu izlemek için bir kontrol görevi görür. (C) İletim elektron mikroskopisi sEV'lerin boyutunu ve morfolojisini göstermiştir. Ölçek çubuğu = 100 nm. Kısaltmalar: sEVs = küçük hücre dışı veziküller; ALIX = Alfa-1,3/1,6-Mannosyltransfeaz (ALG-2)-etkileşim proteini X; GAPDH = gliseraldehit 3-fosfat dehidrogenaz; CD81 = farklılaşma kümesi 81. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
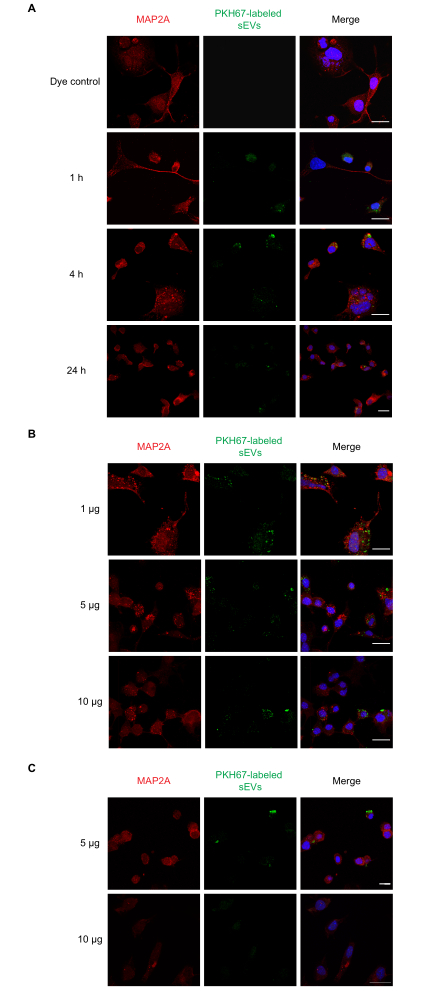
Şekil 2: Neuro-2a hücreleri tarafından etiketli RAW 264.7 sEV'lerin alınması. (A) PKH67 etiketli sEV'ler (1 μg) kültürlü Nöro-2a hücrelerine 1, 4 veya 24 saat boyunca eklendi. (B) Nöro-2a hücrelerine 1 saatboyuncaPKH67 etiketli sEV'ler (1, 5 veya 10 μg) eklendi. PKH boyası ile tedavi edilen negatif kontrol gruplarında tek başına sEV lekesi(Ek Şekil S1) gösterilmemiştir. Nöro-2a hücreleri MAP2A (kırmızı ile gösterilen Alexa Fluor 594 ile araştırıldı) ile immünostain edilirken, hücre çekirdekleri DAPI (mavi ile gösterilmiştir) ve SEV'ler PKH67 (yeşil renkte gösterilmiştir) ile boyanmıştır. Ölçek çubuğu = 50 μm. Kısaltmalar: sEVs = küçük hücre dışı veziküller; MAP2A = mikrotübül ilişkili protein 2A; DAPI = 4′,6-diamidino-2-fenylindole. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: PKH26 etiketli RAW 264.7 sEV'lerin birincil fare kortikal astrositleri tarafından alınması. Bir μg sEV, PKH26 boyası ile etiketlendi ve birincil astrosit kültür ortamına eklendi. Konfokal lazer tarama mikroskobu kullanılarak 1 ve 24 saat sonra sEV alımı gözlendi. Astrositler GFAP ile boyandı (kırmızı ile gösterilen Alexa Fluor 488 ile araştırıldı), hücre çekirdekleri DAPI (mavi ile gösterilmiştir) ile karşı konuldu ve sEV'ler daha önce PKH26 (yeşil renkle gösterilmiştir) ile boyandı. Ölçek çubuğu = 20 μm. PKH26 boya tek başına sEV boyama için negatif bir kontrol görevi görse de. Kısaltmalar: sEVs = küçük hücre dışı veziküller; GFAP = glial fibril asidik protein; DAPI = 4′,6-diamidino-2-fenylindole. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: RAW 264.7 sEVsin nöronlarının alınması. PKH26 etiketli sEV'ler farelere intratekal olarak enjekte edildi; 6 ve 18 saat sonra, farelere% 4 PFA ile perfüzyon yapıldı ve omurilik izole edildi ve 30 μm'de bölümlendi. Omurilik bölümleri bir hücre işaretleyicisi (Alexa Fluor 488 ile araştırılmış, kırmızı ile gösterilmiştir) ve DAPI nükleer kontatatatörü (mavi ile gösterilmiştir) ile bağışıklık sistemine sahipken, SEV'ler daha önce PKH26 (yeşil renkte gösterilmiştir) ile etiketlenmiştir. MAP2A'nın nöronları (kırmızı) görselleştirmesi için omurilik bölümleri immünostain edildi. Konfokal mikroskopi, MAP2A pozitif nöronlardaki SEV'leri farklı zaman noktalarında gösterir. Negatif kontrol, PKH26 tek başına boya grubu, sEV lekesi göstermedi. Ölçek çubuğu = 20 μm. Kısaltmalar: sEVs = küçük hücre dışı veziküller; PFA = paraformaldehit; MAP2A = mikrotübül ilişkili protein 2A; DAPI = 4′,6-diamidino-2-fenylindole. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Astrositlerde RAW 264.7 sEV alımı. PKH26 etiketli sEV'ler farelere intratekal olarak enjekte edildi; 6 ve 18 saat sonra, farelere% 4 PFA ile perfüzyon yapıldı ve omurilik izole edildi ve 30 μm'de bölümlendi. Omurilik bölümleri bir hücre işaretleyicisi (Alexa Fluor 488 ile araştırılmış, kırmızı ile gösterilmiştir) ve DAPI nükleer kontatatatörü (mavi ile gösterilmiştir) ile bağışıklık sistemine sahipken, SEV'ler daha önce PKH26 (yeşil renkte gösterilmiştir) ile etiketlenmiştir. GFAP'ın astrositleri (kırmızı) görselleştirmesi için omurilik bölümleri immünosit edildi. Konfokal mikroskopi, farklı zaman noktalarında GFAP pozitif astrositlerde sEV'leri gösterir. Negatif kontrol, PKH26 tek başına boya grubu, sEV lekesi göstermedi. Ölçek çubuğu = 20 μm. Kısaltmalar: sEVs = küçük hücre dışı veziküller; PFA = paraformaldehit; GFAP = glial fibril asidik protein; DAPI = 4′,6-diamidino-2-fenylindole. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
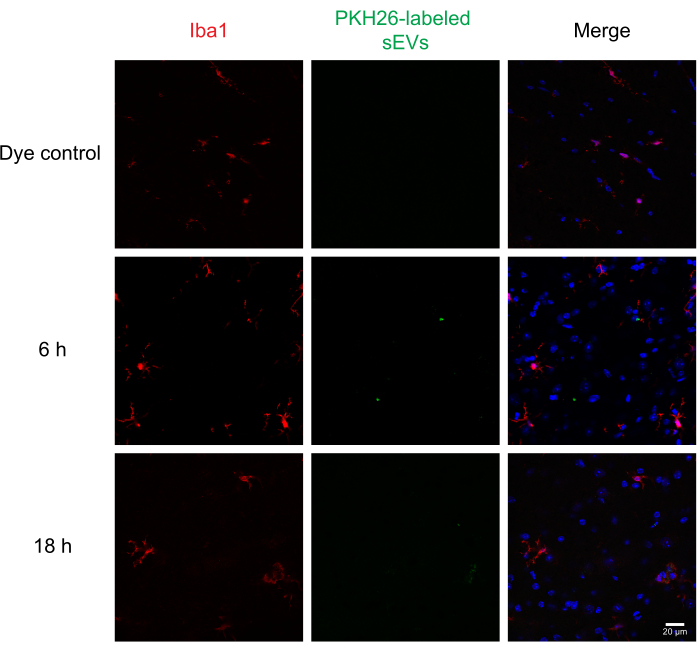
Şekil 6: Mikroglia'da RAW 264.7 sEV alımı. PKH26 etiketli sEV'ler farelere intratekal olarak enjekte edildi; 6 ve 18 saat sonra, farelere% 4 PFA ile perfüzyon yapıldı ve omurilik izole edildi ve 30 μm'de bölümlendi. Omurilik bölümleri bir hücre işaretleyicisi (Alexa Fluor 488 ile araştırılmış, kırmızı ile gösterilmiştir) ve DAPI nükleer kontatatatörü (mavi ile gösterilmiştir) ile bağışıklık sistemine sahipken, SEV'ler daha önce PKH26 (yeşil renkte gösterilmiştir) ile etiketlenmiştir. Omurilik bölümleri IBA1'in mikrogliayı (kırmızı) görselleştirmesi için immünositize edildi. Konfokal mikroskopi, IBA1 pozitif mikrogliadaki SEV'leri farklı zaman noktalarında gösterir. Negatif kontrol, PKH26 tek başına boya grubu, sEV lekesi göstermedi. Ölçek çubuğu = 20 μm. Kısaltmalar: sEVs = küçük hücre dışı veziküller; PFA = paraformaldehit; IBA1 = iyonize kalsiyum bağlayıcı adaptör molekülü 1; DAPI = 4′,6-diamidino-2-fenylindole. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil S1: Etiketli RAW 264.7 sEV'lerin birincil fare kortikal astrositleri ve omurilik tarafından alınması. (A) Birincil fare kortikal astrositleri tarafından PKH26 etiketli RAW 264.7 sEV'lerin alınması için kontroller. Astrositlerin kültür ortamına paralel olarak PBS'de veya eşit miktarda PBS'de yeniden süzülür bir μg etiketsiz sEV eklendi. PBS ve konfokal lazer tarama mikroskobu kullanılarak etiketsiz kontrol için 1 saat boyunca floresan gözlenmedi. Astrositler GFAP ile boyandı (Kırmızı ile gösterilen Alexa Fluor 488 ile yoklandı), çekirdekler DAPI (mavi) ile karşıt olarak çizildi ve etiketlenmemiş sEV'ler PKH26 etiketli SEV'lerle aynı Alexa Fluor 546 kanalı altında görselleştirildi. Ölçek çubuğu = 50 μm. (B) PKH26 etiketli RAW 264.7 sEV'lerin fare omuriliği in vivoile alınması için kontroller. Farelere intratekal olarak beş μg etiketsiz sEV veya boya kontrolü enjekte edildi. Yine, konfokal lazer tarama mikroskobu kullanılarak etiketsiz sEV'ler veya tek başına boya kontrolü için floresan sinyaller gözlenmedi. Astrositler GFAP ile boyandı (Kırmızı ile gösterilen Alexa Fluor 488 ile yoklandı), çekirdekler DAPI (mavi) ile karşı konuldu ve etiketlenmemiş sEV'ler PKH26 etiketli SEV'lerle aynı Alexa Fluor 546 kanalı altında görselleştirildi. Ölçek çubuğu = 50 μm. (C)Temsili görüntüler, intratekal doğumdan sonra fare spinal menenjitlerinde 6 saat ve 18 saat RAW 264.7 sEV'lerin varlığını ortaya koymaktadır. Beş μg sEV PKH26 boyası (yeşil renkle gösterilmiştir) ile etiketlenmiş ve çekirdekler DAPI (mavi ile gösterilmiştir) ile karşılaştırılmıştır. Yıldız işaretleri ön omurilik arterini gösteriyor. Ölçek çubuğu = 50 μm. Kısaltmalar: sEVs = küçük hücre dışı veziküller; PBS = fosfat tamponlu salin; GFAP = glial fibril asidik protein; DAPI = 4′,6-diamidino-2-fenylindole. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu protokolde SEV'lerin PKH boyalarla etiketlenmesi ve omurilikteki alımlarının görselleştirilmesini gösterdik. PKH lipofilik floresan boyalar, akış sitometrisi ve floresan mikroskopi 3 , 5 ,6,12,24,25ile hücreleri etiketlemek için yaygın olarak kullanılmaktadır. Nispeten uzun yarı ömürleri ve düşük sitotoksiklikleri nedeniyle, PKH boyaları çok çeşitli in vivo ve in vitro hücre izleme çalışmaları için kullanılabilir26,27. Mükemmel membran tutma ve biyokimyasal stabilite avantajlı olsa da, sEV'lerle saflaştırılmış lipoprotein kirleticilerle floresan probların interkalasyonu sEV içselleştirme ve fonksiyonel çalışmaların yorumlanmasını tehlikeye atabilir. Bu nedenle, sEV'lerin saflaştırılması ve etiketlenmesi protokolde kritik adımlardır, çünkü boyaların kirleticilerle kalıcılığı in vivo dağılımının yanlış yorumlanmasına neden olabilir28. Kontrollerin dahil edilmesi, parçacıkların spesifik olmayan etiketlemesi ve bu boyaların uzun yarı ömrü nedeniyle yanlış-pozitif floresan sinyallerini önlemek için kritik öneme sahiptir.
Lipofilik boyaların toplanması ve misel oluşumu da yanlış sinyaller verebilir. Tek başına bir boya kontrolü dahil ederek ve ev alımını daha önceki zaman noktalarında görselleştirerek ücretsiz veya ilişkisiz boya sorununu ele aldık. PKH etiketlemesi için bildirilen önemli bir sınırlama, SEV'lerin PKH26 boya etiketlemesi sırasında çok sayıda PKH26 nanopartikülün oluşmasıdır. Bu protokole dahil olmamakla birlikte, PKH26 nanopartiküllerinin sakkaroz gradyani29. Başka bir çalışma, PKH etiketlemesinin NTA tarafından sEV'lerin büyüklüğü üzerindeki etkisini değerlendirdi ve PKH etiketlemesinin ardından boyutunda bir artış bildirdi30. Bununla birlikte, PKH boyaları, SEV'lerin nereden geçiş yaptığına göstermek için pragmatik ve değerli bir izleyici görevi gösterir. Bu çalışmanın bir diğer sınırlaması, bu protokol intratekal doğumdan sonra hücresel alımın onaylanmasına odaklandığı için SEV'leri ölçmememizdir. Yeni siyansin bazlı membran probları son zamanlarda, PKH nanopartiküllerininoluşumu 31gibi, boyutu değiştirmeden veya eserler üretmeden SEV'lerin son derece hassas floresan görüntülemesi için geliştirilmiştir ve şüphesiz gelecekteki etiketleme çalışmalarını geliştirecektir.
Makrofajlar nöroinflamatımda önemli roller oynasa da, yüklerini ekzozom yoluyla teslim ederek nöroprotektif fonksiyonlar da uygularlar32. Çalışmalarımız, etiketli makrofaj türevi SEV'lerin Nöro-2a hücreleri, primer astrositler ve intratekal uygulamadan sonra bel omuriliği tarafından alındığını göstermektedir. Sonuçlar, daha uzun bir kuluçka süresinin daha düşük sEV sinyal yoğunluğuna yol açabileceğini göstermektedir, bu da kültür33,34'tekiNöro-2a hücreleri tarafından SEV'lerin veya hücre bölünmesinin bozulmasına bağlanabilir. Düşük verim olmasına rağmen, omurilikteki etiketli SEV'leri görselleştirmek için bu protokol, intratekal olarak teslim edilen SEV'lerin fonksiyonel etkisini araştırmadan önce sEV alımını onaylayan ilk doğrulama çalışmaları için kullanılabilir. Birkaç CNS hücre tipinde genellikle benzer sEV alımını gözlemlediğimiz gibi, alım işlemi seçici değil gibi görünmektedir. Görüntülemede otofluoresans bir sorunsa, etiketsiz sEV'ler dokuların ve kültürlerin görüntülenmesi sırasında sEV otofluoresansını reddetmek için ek bir kontrol olarak kullanılabilir. SEV'lerin dozu ve uygulama yolu biyodistribution11modelini etkileyebilmesine rağmen, bu protokol sEV alımının nicel analizi için optimize değildir. SEV'leri araştırmak için çeşitli farklı yaklaşımlar ve çeşitli görüntüleme stratejileri bunların yanıp sEV'ler2'nin in vivo takibi için sürekli olarak rafine ve optimize edilmektedir.
Bu protokol, SEV alımını onaylamak için sadece bir yaklaşımdır. Tüm protokollerde olduğu gibi, multimodal yaklaşımlar kullanarak çapraz doğrulama yararlı olabilir. Özellikle, sEV'lerin alımı alıcı hücrelere ve dokulara biyomoleküler kargo transferi araştırılarak doğrulanabilir. Araştırmacı teslim edilen SEV'lerin miRNA bileşimini biliyorsa, sEV transferini onaylamak için alternatif bir yaklaşım, alıcı hücrelerdeki miRNA değişikliklerini kontrol etmek veya aktarılan miRNA'lar için hedef genlerin ifade düzeylerindeki değişiklikleri belirlemek olacaktır. PBS ile işlenmiş numuneler bu yaklaşım için kontrol olarak kullanılabilir. Genel olarak, bu sonuçlar makrofaj türevi SEV'lerin CNS hücreleri tarafından in vitro ve in vivo olarak alındığı kavramını destekler. Bu protokol, sEV'lerin omurga bozuklukları, ağrı ve inflamasyondaki rolünü araştırmak ve SEV'lerin terapötik küçük moleküllerin, RNA'nın ve proteinlerin teslimi için hücresel araçlar olarak geliştirilip geliştirilmeyeceğini belirlemek için kullanılabilir.
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Bu çalışma NIH NINDS R01NS102836 ve Seena K. Ajit'e verilen Pennsylvania Sağlık Bakanlığı Commonwealth Evrensel Araştırma Geliştirme (CURE) hibeleri ile desteklenmiştir. Dr. Bradley Nash'e makaleyi eleştirel okuduğu için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amicon Ultra 0.5 mL centrifugal filters | MilliporeSigma | Z677094 | |
| Anti-Alix Antibody | Abcam | ab186429 | 1:1000 |
| Anti-Calnexin Antibody | Abcam | Ab10286 | 1:1000 |
| Anti-CD81 Antibody | Santa Cruz Biotechnology | sc-166029 | 1:1000 |
| Anti-GAPDH Monoclonal Antibody (14C10) | Cell Signaling Technology | 2118 | 1:1000 |
| Anti-Glial Fibrillary Acidic Protein Antibody | Sigma-Aldrich | MAB360 | 1:500 for IF; 1:1000 for IHC |
| Anti-Iba1 Antibody | Wako | 019-19741 | 1:2000 |
| Anti-MAP2A Antibody | Sigma-Aldrich | MAB378 | 1:500 |
| Bovine Serum Albumin (BSA) | VWR | 0332 | |
| Cell Strainer, 40 μm | VWR | 15-1040-1 | |
| Centrifuge Tubes | Thermo Scientific | 3118-0050 | 12,000 x g |
| Coverslip, 12-mm, #1.5 | Electron Microscopy Sciences | 72230-01 | |
| Coverslip, 18-mm, #1.5 | Electron Microscopy Sciences | 72222-01 | |
| DAPI | Sigma-Aldrich | D9542-1MG | 1 µg/mL |
| DC Protein Assay | Bio-Rad | 500-0116 | |
| Deoxyribonuclease I (DNAse I) | MilliporeSigma | D4513-1VL | |
| Donkey Anti-Rabbit IgG H&L (HRP) | Abcam | ab16284 | 1:10000 |
| Donkey Anti-Rabbit IgG H&L, Alexa Fluor 488 | Invitrogen | A-21206 | 1:500 |
| Double Frosted Microscope Slides, #1 | Thermo Scientific | 12-552-5 | |
| DPBS without Calcium and Magnesium | Corning | 21-031-CV | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10-013-CV | |
| Exosome-Depleted Fetal Bovine Serum | Gibco | A27208-01 | |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| FluorChem M imaging system | ProteinSimple | ||
| FV3000 Confocal Microscope | Olympus | ||
| Goat Anti-Mouse IgG H&L (HRP) | Abcam | ab6789 | 1:10000 |
| Goat Anti-Mouse IgG H&L, Alexa Fluor 488 | Invitrogen | A-11001 | 1:500 |
| Goat Anti-Mouse IgG1, Alexa Fluor 594 | Invitrogen | A-21125 | 1:500 |
| Hank's Balanced Salt Solution (HBSS) | VWR | 02-0121 | |
| HEPES | Gibco | 15630080 | |
| HRP Substrate | Thermo Scientific | 34094 | |
| Intercept blocking buffer, TBS | LI-COR Biosciences | 927-60001 | |
| Laemmli SDS Sample Buffer | Alfa Aesar | AAJ61337AC | |
| Micro Cover Glass, #1 | VWR | 48404-454 | |
| Microm HM550 | Thermo Scientific | ||
| NanoSight NS300 system | Malvern Panalytical | ||
| NanoSight NTA 3.2 software | Malvern Panalytical | ||
| Neuro-2a Cell Line | ATCC | CCL-131 | |
| Normal Goat Serum | Vector Laboratories | S-1000 | |
| O.C.T Compound | Sakura Finetek | 4583 | |
| Papain | Worthington Biochemical Corporation | NC9597281 | |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PKH26 | Sigma-Aldrich | MINI26-1KT | |
| PKH67 | Sigma-Aldrich | MINI67-1KT | |
| Protease Inhibitor Cocktail | Thermo Scientific | 1862209 | |
| PVDF Transfer Membrane | MDI | SVFX8302XXXX101 | |
| RAW 267.4 Cell Line | ATCC | TIB-71 | |
| RIPA Buffer | Sigma-Aldrich | R0278 | |
| Sodium Chloride | AMRESCO | 0241-2.5KG | |
| Superfrost Plus Gold Slides | Thermo Scientific | 15-188-48 | adhesive slides |
| T-75 Flasks | Corning | 431464U | |
| Tecnai 12 Digital Transmission Electron Microscope | FEI Company | ||
| TEM Grids | Electron Microscopy Sciences | FSF300-cu | |
| Tris-Glycine Protein Gel, 12% | Invitrogen | XP00120BOX | |
| Tris-Glycine SDS Running Buffer | Invitrogen | LC26755 | |
| Tris-Glycine Transfer Buffer | Invitrogen | LC3675 | |
| TrypLE Express | Gibco | 12605028 | cell dissociation enzyme |
| Triton X-100 | Acros Organics | 327371000 | |
| Trypsin, 0.25% | Corning | 25-053-CL | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Ultracentrifuge Tubes | Beckman | 344058 | 110,000 x g |
Referanslar
- Mulcahy, L. A., Pink, R. C., Carter, D. R. F. Routes and mechanisms of extracellular vesicle uptake. Journal of Extracellular Vesicles. 3 (1), 24641(2014).
- Betzer, O., et al. Advances in imaging strategies for in vivo tracking of exosomes. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 12 (2), 1594(2020).
- Dehghani, M., Gaborski, T. R. Fluorescent labeling of extracellular vesicles. Methods in Enzymology. 645, 15-42 (2020).
- González, M. I., et al. Covalently labeled fluorescent exosomes for in vitro and in vivo applications. Biomedicines. 9 (1), 81(2021).
- Chuo, S. T. -Y., Chien, J. C. -Y., Lai, C. P. -K. Imaging extracellular vesicles: current and emerging methods. Journal of Biomedical Science. 25 (1), 91(2018).
- vander Vlist, E. J., Nolte-'tHoen, E. N. M., Stoorvogel, W., Arkesteijn, G. J. A., Wauben, M. H. M. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7 (7), 1311-1326 (2012).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Heinrich, L., et al. Confocal laser scanning microscopy using dialkylcarbocyanine dyes for cell tracing in hard and soft biomaterials. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81 (1), 153-161 (2007).
- Haney, M. J., et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release. 207, 18-30 (2015).
- Grange, C., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a model of acute kidney injury monitored by optical imaging. International Journal of Molecular Medicine. 33 (5), 1055-1063 (2014).
- Wiklander, O. P., et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. Journal of Extracellular Vesicles. 4, 26316(2015).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nature Communications. 6 (1), 7029(2015).
- Deddens, J. C., et al. Circulating extracellular vesicles contain miRNAs and are released as early biomarkers for cardiac injury. Journal of Cardiovascular Translational Research. 9 (4), 291-301 (2016).
- Montecalvo, A., et al. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 119 (3), 756-766 (2012).
- Escrevente, C., Keller, S., Altevogt, P., Costa, J. Interaction and uptake of exosomes by ovarian cancer cells. BMC Cancer. 11, 108(2011).
- Cho, E., et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. Journal of Controlled Release. 279, 326-335 (2018).
- Mantel, P. Y., et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host & Microbe. 13 (5), 521-534 (2013).
- Porro, C., Trotta, T., Panaro, M. A. Microvesicles in the brain: Biomarker, messenger or mediator. Journal of Neuroimmunology. 288, 70-78 (2015).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Matsumoto, J., et al. Transmission of alpha-synuclein-containing erythrocyte-derived extracellular vesicles across the blood-brain barrier via adsorptive mediated transcytosis: another mechanism for initiation and progression of Parkinson's disease. Acta Neuropathologica Communications. 5 (1), 71(2017).
- Matsumoto, J., Stewart, T., Banks, W. A., Zhang, J. The transport mechanism of extracellular vesicles at the blood-brain barrier. Current Pharmaceutical Design. 23 (40), 6206-6214 (2017).
- Shaimardanova, A., et al. Extracellular vesicles in the diagnosis and treatment of central nervous system diseases. Neural Regeneration Research. 15 (4), 586-596 (2020).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Hoen, E. N. M. N. -t, et al. Quantitative and qualitative flow cytometric analysis of nanosized cell-derived membrane vesicles. Nanomedicine: Nanotechnology, Biology and Medicine. 8 (5), 712-720 (2012).
- Gangadaran, P., Hong, C. M., Ahn, B. -C. An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Frontiers in Pharmacology. 9, 169(2018).
- Teare, G. F., Horan, P. K., Slezak, S. E., Smith, C., Hay, J. B. Long-term tracking of lymphocytes in vivo: the migration of PKH-labeled lymphocytes. Cellular Immunology. 134 (1), 157-170 (1991).
- Kuffler, D. P. Long-term survival and sprouting in culture by motoneurons isolated from the spinal cord of adult frogs. Journal of Comparative Neurology. 302 (4), 729-738 (1990).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Pužar Dominkuš, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta. Biomembranes. 1860 (6), 1350-1361 (2018).
- Dehghani, M., Gulvin, S. M., Flax, J., Gaborski, T. R. Systematic evaluation of PKH labelling on extracellular vesicle size by nanoparticle tracking analysis. Scientific Reports. 10 (1), 9533(2020).
- Shimomura, T., et al. New lipophilic fluorescent dyes for labeling extracellular vesicles: characterization and monitoring of cellular uptake. Bioconjugate Chemistry. 32 (4), 680-684 (2021).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Polanco, J. C., Li, C., Durisic, N., Sullivan, R., Götz, J. Exosomes taken up by neurons hijack the endosomal pathway to spread to interconnected neurons. Acta Neuropathologica Communications. 6 (1), 10(2018).
- Jurgielewicz, B. J., Yao, Y., Stice, S. L. Kinetics and specificity of HEK293T extracellular vesicle uptake using imaging flow cytometry. Nanoscale Research Letters. 15 (1), 170(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır