Method Article
Absorption de petites vésicules extracellulaires étiquetées par fluorescence in vitro et dans la moelle épinière
Dans cet article
Résumé
Nous décrivons un protocole pour étiqueter les petites vésicules extracellulaires dérivées de macrophages avec des colorants PKH et observons leur absorption in vitro et dans la moelle épinière après l’administration intrathécale.
Résumé
Les petites vésicules extracellulaires (sEV) sont des vésicules de 50 à 150 nm sécrétées par toutes les cellules et présentes dans les fluides corporels. Les sEV transfèrent des biomolécules telles que l’ARN, les protéines et les lipides du donneur aux cellules acceptrices, ce qui en fait des médiateurs de signalisation clés entre les cellules. Dans le système nerveux central (SNC), les sEV peuvent servir de médiateur à la signalisation intercellulaire, y compris les interactions neuro-immunes. Les fonctions sEV peuvent être étudiées en suivant l’absorption des SEV marqués dans les cellules receveuses in vitro et in vivo. Cet article décrit l’étiquetage des sEV à partir du milieu conditionné des cellules macrophages RAW 264.7 à l’aide d’un colorant membranaire PKH. Il montre l’absorption de différentes concentrations de sEV marqués à plusieurs moments par les cellules Neuro-2a et les astrocytes primaires in vitro. On a également montré l’absorption des SEV délivrés par voie intrathécale dans les neurones de la moelle épinière, les astrocytes et les microglies de souris visualisés par microscopie confocale. Les résultats représentatifs démontrent une variation dépendante du temps dans l’absorption des sEV par différentes cellules, ce qui peut aider à confirmer l’administration réussie des sEV dans la moelle épinière.
Introduction
Les petites vésicules extracellulaires (sEV) sont des vésicules nanométriques dérivées de membranes d’une taille comprise entre 50 et 150 nm. Ils proviennent de corps multivésiculaires (M MVB) et sont libérés par les cellules lors de la fusion des M MVB avec la membrane plasmique. Les sEV contiennent des miARN, des ARNm, des protéines et des lipides bioactifs, et ces molécules sont transférées entre les cellules sous forme de communication de cellule à cellule. Les sEV peuvent être internalisés par les cellules réceptrices par une variété de voies endocytaires, et cette capture des sEV par les cellules réceptrices est médiée par la reconnaissance de molécules de surface sur les VE et les cellules cibles1.
Les sEV ont gagné en intérêt en raison de leur capacité à déclencher des changements moléculaires et phénotypiques dans les cellules acceptrices, de leur utilité en tant qu’agent thérapeutique et de leur potentiel en tant que transporteurs de molécules de cargaison ou d’agents pharmacologiques. En raison de leur petite taille, l’imagerie et le suivi des VES peuvent être difficiles, en particulier pour les études in vivo et les contextes cliniques. Par conséquent, de nombreuses méthodes ont été développées pour étiqueter et imager les sEV afin d’aider leur biodistribution et leur suivi in vitro et in vivo2.
La technique la plus courante pour étudier la biodistribution sEV et les interactions cellulaires cibles consiste à les étiqueter avec des molécules de colorant fluorescent3,4,5,6,7. Les VÉHICULES électriques ont d’abord été marqués avec des colorants à membrane cellulaire couramment utilisés pour imager les cellules. Ces colorants fluorescents colorent généralement la bicouche lipidique ou les protéines d’intérêt sur les sEV. Plusieurs colorants lipophiles présentent un fort signal fluorescent lorsqu’ils sont incorporés dans le cytosol, notamment diR (1,1′-dioctadecyl-3,3,3′,3′-iodure de tétraméthyindotricarbocyanine), DiL (1, 1′-dioctadecyl-3, 3, 3′,3′-tétraméthyl indocarbocyanine perchlorate) et DiD (1, 1′-dioctadécyyl-3, 3, 3′-tétraméthyl indocarbocyanine 4-chlorobenzènesulfonate sel)8,9,10,11.
D’autres colorants lipophiles, tels que PKH67 et PKH26, ont un groupe de tête polaire hautement fluorescent et une longue queue d’hydrocarbure aliphatique qui s’intercale facilement dans n’importe quelle structure lipidique et conduit à une rétention de colorant à long terme et à une fluorescence stable12. Les colorants PKH peuvent également étiqueter les véhicules électriques, ce qui permet d’étudier les propriétés des véhicules électriques in vivo13. De nombreux autres colorants ont été utilisés pour observer les exosomes en utilisant la microscopie à fluorescence et la cytométrie en flux, y compris les colorants de marquage des lipides14 et les colorants perméables aux cellules tels que l’ester de diacétate de carboxyfluorescéine succinimidyle (CFDA-SE)15,16 et l’ester d’acétoxyméthyl (AM) de calcéine17.
Des études sur la diaphonie médiée par le SEV entre différentes cellules du SNC ont fourni des informations importantes sur la pathogenèse des maladies neuroinflammatoires et neurodégénératives18. Par exemple, les sEV des neurones peuvent propager des peptides bêta-amyloïdes et des protéines tau phosphorylées et aider à la pathogenèse de la maladie d’Alzheimer19. De plus, les VE dérivés des érythrocytes contiennent de grandes quantités d’alpha-synucléine et peuvent traverser la barrière hémato-encéphalique et contribuer à la pathologie de Parkinson20. La capacité des sEV à franchir les barrières physiologiques21 et à transférer leurs biomolécules aux cellules cibles en fait des outils pratiques pour délivrer des médicaments thérapeutiques auSNC 22.
La visualisation de l’absorption de sEV par une myriade de cellules du SNC dans la moelle épinière permettra à la fois des études mécanistes et l’évaluation des avantages thérapeutiques des sEV administrés de manière exogène à partir de diverses sources cellulaires. Cet article décrit la méthodologie pour étiqueter les sEV dérivés de macrophages et imager leur absorption in vitro et in vivo dans la moelle épinière lombaire par les neurones, les microglies et les astrocytes afin de confirmer qualitativement l’administration de sEV par visualisation.
Protocole
REMARQUE: Toutes les procédures ont été effectuées conformément au Guide des NIH pour le soin et l’utilisation des animaux de laboratoire et approuvées par le comité institutionnel de soins et d’utilisation des animaux du Drexel University College of Medicine. Des souris CD-1 gestantes et chronométrées ont été utilisées pour la culture astrocytaire, et toutes les mères ont été reçues 15 jours après l’imprégnation. Des souris C57BL/6 âgées de dix à douze semaines ont été utilisées pour des expériences d’absorption in vivo.
1. Isolement des sEV des cellules macrophages RAW 264.7
- Culture de cellules RAW 264,7 dans des flacons de 75 cm2 dans un milieu appauvri en exosomes DMEM contenant 10% de sérum fœtal bovin appauvri en exosomes (FBS) et 1% de pénicilline-streptomycine (pen-strep) pendant 24-48 h.
- Recueillir 300 mL de milieu conditionné et centrifuger à 300 × g pendant 10 min à 4 °C.
- Recueillir le surnageant et centrifuger à 2 000 × g pendant 20 min à 4 °C.
- Transférer le surnageant dans des tubes de centrifugeuse, centrifuger pendant 35 min à 12 000 × g à 4 °C.
- Recueillir le surnageant et filtrer à travers un filtre à seringue de 0,22 μm.
- Transférer dans des tubes ultracentrifuges et centrifuger pendant 80 min à 110 000 × g à 4 °C.
- Conserver le surnageant (milieu appauvri en exosomes), resussaisir la pastille dans 2 mL de 1x solution saline tamponnée au phosphate (PBS) et centrifuger pendant 1 h à 110 000 × g à 4 °C.
- Resuspendez la pastille dans 100 μL de PBS pour une caractérisation plus poussée à l’aide de l’analyse de suivi des nanoparticules (NTA) et de la microscopie électronique à transmission (TEM) ou dans un tampon de dosage par radioimmunoprécipitation (RIPA) pour le transfert western.
2. Caractérisation des VES
- Analyse de suivi des nanoparticules (NTA)
REMARQUE: La distribution granulométrique et le nombre / concentration de particules des sEV purifiés à partir de cellules RAW 264.7 ont été mesurés par NTA.- Diluer les sEV dans du PBS filtré pour obtenir 20 à 60 vésicules par champ de vision pour un suivi optimal.
- Introduire l’échantillon dilué dans une cellule de débit à l’aide d’une pompe à seringue à débit constant.
- Prenez 3-5 vidéos de 30 s chacune. Réglez la vitesse d’obturation et le gain, puis concentrez manuellement les paramètres de l’appareil photo pour que le nombre maximal de vésicules soit visible et capable d’être suivi et analysé.
- Avancez les échantillons entre chaque enregistrement pour effectuer des mesures répliquées. Optimisez les paramètres de post-acquisition NTA et maintenez les paramètres constants entre les échantillons.
- Analysez chaque vidéo à l’aide du logiciel NTA pour obtenir la taille et la concentration moyennes des vésicules.
- Effectuez toutes les mesures NTA avec des paramètres système identiques pour plus de cohérence.
- Transfert western
- Quantifier les quantités totales de protéines dans les sEV, les lysates cellulaires et les milieux appauvris en exosomes à l’aide d’un kit de dosage des protéines en suivant les instructions du fabricant.
- Pour la préparation du lysate cellulaire, culturez les cellules RAW 264,7 dans des flacons de 75 cm2 jusqu’à 80-90% de confluent. Détachez les cellules avec 0,25% de trypsine pendant 10-15 min, neutralisez la trypsine avec des milieux de culture et azillez les cellules en les filant à 400 × g pendant 5 min. Ressuspendez les cellules dans un milieu de croissance frais.
- Comptez les cellules à l’aide d’un hémocytomètre et transférez 1 × 106 cellules dans un autre tube. Lavez les cellules avec du PBS deux fois en utilisant les mêmes conditions de centrifugation que ci-dessus et ajoutez 50 μL de tampon de lyse (tampon RIPA avec cocktail d’inhibiteurs de protéase ajouté) à la pastille cellulaire à partir du spin final.
- Vortex les cellules et les garder sur la glace pendant 20 min. Soumettre le mélange à la centrifugation à 10 000 × g pendant 30 min à 4 °C, recueillir le surnageant (c’est-à-dire le lysate) dans des tubes de microcentrifugation frais et conserver à −80 °C jusqu’à utilisation.
- Concentrer 2 mL de milieux appauvris en exosomes à 100 μL à l’aide de filtres centrifuges à coupure de 3 kDa avant de quantifier la quantité de protéines. Mélanger les sEV avec un tampon de lyse dans un rapport de 1:1, vortex pendant 30 s et incuber sur de la glace pendant 15 min pour quantifier la quantité de protéines.
- Mélanger des quantités égales de protéines (2 μg) des sEV, de lysate de cellules RAW 264,7 et de milieux appauvris en exosomes avec un tampon d’échantillon réducteur.
- Dénaturer les échantillons à 95 °C pendant 5 min, les garder sur glace pendant 5 min, et tourner pendant 2 min à 10 000 × g. Chargez les échantillons sur un gel de protéines Tris-glycine à 12% et faites fonctionner le gel à 125 V pendant 45 min.
- Transférer la protéine sur une membrane de difluorure de polyvinylidène (PVDF) à 25 V pendant 2 h.
- Après le transfert, bloquez les membranes PVDF avec un tampon bloquant (voir le tableau des matériaux)pendant 1 h à température ambiante.
- Incuber le blot avec des anticorps primaires sur un shaker pendant la nuit à 4 °C.
REMARQUE : Les principaux anticorps utilisés étaient la protéine X (Alix) (1:1 000), la protéine X (Alix) (1:1 000), l’anti-alpha-1,3/1,6-mannosyltransférase (ALG-2) (1:1 000), l’anti-calnexine (1:1 000) et l’anti-glycéraldéhyde 3-phosphate déshydrogénase (GAPDH) (1:1 000). - Laver les éponges 3 x 15 min avec 1x solution saline tamponnée Tris, 0,1 % Tween 20 (TBST), et incuber à température ambiante avec des anticorps secondaires conjugués IgG-raifort (HRP) anti-chèvre igG-raifort (HRP) ou âne anti-lapin IgG-HRP (1:10 000) pendant 1 h sur le shaker.
- Lavez les taches 3 x 15 min avec 1x TBST, et détectez les protéines à l’aide d’un substrat HRP.
- Analysez les blots par chimiluminescence améliorée à l’aide d’un imageur western blot.
- Microscopie électronique à transmission (TEM)
- Fixer les VES en les réutilisant dans du paraformaldéhyde (PFA) à 2 % dans un tampon phosphate (PB) de 0,1 M; vortex pour 2 x 15 s.
- Placez une goutte de 10 μL de suspension sEV sur un parafilm propre. Faites flotter la grille formvar revêtue de carbone sur la goutte avec leur côté revêtu face à la suspension. Laissez les membranes absorber pendant 20 min dans un environnement sec.
- Placez les grilles (côté membrane vers le bas) sur une goutte de PB pour laver pendant 3 x 2 min.
- Transférer les grilles à 50 μL de 1% de glutaraldéhyde pendant 5 min.
- Lavez les grilles avec 100 μL d’eau distillée pendant 8 x 2 min.
- Comparez l’échantillon en plaçant les grilles sur une goutte d’acétate d’uranyle à 1% pendant 2 min.
- Incorporer l’échantillon avec 50 μL d’acétate d’uranyle à 0,2 % avec une solution de méthylcellulose à 2 % pendant 10 min sur un plat de glace recouvert de parafilm.
- Utilisez des boucles en acier inoxydable pour maintenir les grilles et éliminer l’excès de liquide avec du papier filtre.
- Séchez la grille à l’air libre pendant 10 minutes tout en restant en boucle.
- Observez au microscope électronique à transmission à 80 kV.
3. Étiquetage des sEV
- Diluer 20 μg de sEV dans 1 mL de tampon diluant ou le même volume de PBS dans 1 mL de tampon diluant pour le contrôle des colorants.
- Diluer 3 μL de colorant PKH67 ou PKH26 dans 1 mL de tampon diluant et mélanger par pipetage.
- Ajouter le colorant PKH dilué aux SEV dilués et mélanger par pipetage. Incuber pendant 5 min dans l’obscurité à température ambiante. Pour un contrôle du colorant, mélanger le colorant dilué avec le PBS dilué de l’étape 3.1.
- Ajouter 2 mL d’albumine sérique bovine (BSA) à 1 % dans le PBS au tube avec le colorant et le mélange sEV et au tube témoin du colorant pour absorber l’excès de colorant.
- Centrifuger pendant 1 h à 110 000 × g à 4 °C. Jeter le surnageant, ressuspendre la pastille dans 2 mL de PBS et centrifuger pendant 1 h à 110 000 × g à 4 °C. Répétez le lavage avec PBS et resuspendez les sEV étiquetés ou le contrôle de colorant dans un volume égal de PBS.
- Quantifier la quantité de protéines totales par la méthode de Bradford.
4. Absorption des VES par les cellules Neuro-2a
- Placer des couvercles de 18 mm dans une plaque de 12 puits et plaquer 10 × 104 cellules Neuro-2a dans chaque puits dans un total de 1 mL de milieu DMEM complet contenant 10% de FBS et 1% de streptocoque de stylo.
- Changer le milieu en milieu appauvri en exosomes DMEM lorsque la confluence cellulaire est de 80 à 90%. Ajouter 1, 5 ou 10 μg de SEV marqués dans chaque puits pendant 1, 4 et 24 h pour une absorption dépendante de la dose et du temps, ou ajouter un volume égal de contrôle des colorants.
5. Cultures astrocytaires primaires
- Anesthésier 4 chiots postnatals 4 jours après la naissance en induisant l’hypothermie.
- Recueillir les cerveaux dans une boîte de Petri de 60 mm contenant de la solution saline équilibrée de Hank glacée (HBSS) complétée par 10 mM d’acide 4-(2-hydroxyéthyl)-1-pipérazineéthanesulfonique (HEPES).
- Disséquez les deux lobes corticaux et enlevez les méninges. Hachez les tissus avec une lame stérilisée.
- Transférer les tissus dans un tube conique de 15 mL contenant un tampon de dissociation papaïne/désoxyribonucléase I et incuber pendant 20 min à 37 °C. Tourbillonner toutes les 5 minutes.
REMARQUE: Pour 4 cortex de souris, 9 mL de papaïne de 7,5 U / mL dans HBSS sont activés à 37 ° C pendant au moins 30 min, filtrés à travers un filtre à seringue de 0,22 μm et mélangés à la désoxyribonucléase I à une concentration finale de 0,1 mg / mL. - Aspirer le surnageant et ajouter 5 mL de DMEM complet pour inactiver l’activité enzymatique. Triturez soigneusement pour dissocier les tissus avec une pipette sérologique en verre de 5 mL et une pipette Pasteur polie à la flamme.
- Faire passer la suspension cellulaire à travers une passoire cellulaire de 40 μm et centrifuger les cellules à 250 × g pendant 5 min à 4 °C. Aspirer le milieu et ensemencer les cellules dans 10 mL de DMEM complet dans une fiole de 75 cm2. Remplacer le milieu surnageant par 15 mL de milieu DMEM frais 4 h après le placage.
- Après 14 jours in vitro,transférer la fiole dans un agitateur orbital pour détacher la microglie et les oligodendrocytes à 320 tr/min pendant 6 h.
- Trypsiniser les astrocytes restants en utilisant 5 mL de l’enzyme de dissociation cellulaire (Table des matériaux) pendant 10 min à 37 °C. Ajouter 5 mL de DMEM complet pour inactiver l’action enzymatique et granuler les cellules à 250 × g pendant 5 min à 4 °C.
- Resuspendez les cellules dans un DMEM complet. Graine 5 × 104 cellules sur des couvercles de 12 mm #1.5 dans une plaque de 24 puits.
6. Absorption des sEV par les astrocytes
- Lorsque les astrocytes atteignent 80 à 90% de confluence, changez le milieu en milieu appauvri en exosomes DMEM.
- Ajouter 1 μg de SEV non marqués et étiquetés, un volume égal de contrôle de colorant ou pbS aux cellules. Utilisez les cellules pour la coloration 1 h et 24 h après le traitement sEV.
7. Immunofluorescence
- Rincez les cellules avec DU PBS 3x et fixez-les avec 4% de PFA dans PB pendant 10 min à température ambiante.
- Lavez les cellules fixes 3 x 5 min avec PB et perméabilisez-les à l’aide de 0,1% de Triton X-100 en PB pendant 10-15 min et lavez avec PB 3 x 5 min.
- Bloquer les cellules avec 5% de sérum de chèvre normal (NGS) dans PB pendant 1 h à température ambiante.
- Incuber les cellules avec des anticorps primaires : protéine 2 associée aux microtubules (MAP2A, 1:500) pour les cellules Neuro-2a ou protéine acide fibrillaire gliale (GFAP, 1:500) pour les astrocytes primaires dans des NGS/PB frais à 5 % pendant la nuit à 4 °C avec des secousses douces.
- Laver 3 x 10 min avec du PB et ajouter des anticorps secondaires conjugués au fluorophore (Goat Anti-Mouse IgG1, Alexa Fluor 594; ou Goat Anti-Mouse IgG H&L, Alexa Fluor 488) dans 5% de NGS et incuber pendant 2 h à température ambiante sur une bascule.
- Laver 3 x 10 min avec du PB et incuber avec 1 μg/mL de coloration nucléaire 4',6-diamidino-2-phénylindole (DAPI) pendant 10 min à température ambiante. Lavez à nouveau les cellules 3x avec PB.
- Montez les couvercles sur les glissières #1 à l’aide d’un support de montage antifade. Laissez-les sécher toute la nuit dans l’obscurité et conservez les lames de verre préparées à 4 °C jusqu’à ce qu’elles s’imagent au microscope confocal.
8. Absorption in vivo des VES
- Effectuer une injection intrathécale de 5 μg de SEV non marqués ou étiquetés remis en service dans 10 μL de PBS, ou un volume égal (10 μL) de contrôle des colorants (tel que préparé à la rubrique 3) chez des souris C57BL/6.
- Après 6 et 18 h après l’injection de sEV, anesthésier en profondeur les souris par injection intrapéritonéale de 100 mg/kg de poids corporel de kétamine et de 10 mg/kg de poids corporel de xylazine.
- Effectuer une perfusion intracardique de souris avec une solution saline à 0,9% pour éliminer le sang, suivie d’une pfa / PB glacée fraîchement préparée à 4%.
- Disséquer la moelle épinière et fixer à 4 % de PFA/PB à 4 °C pendant 24 h. Cryoprotéger les tissus dans 30% de saccharose dans PB à 4 °C pendant 24 h ou jusqu’à ce que les tissus coulent. Conserver les tissus à 4 °C jusqu’à l’immunohistochimie.
9. Immunohistochimie
- Incorporer la moelle épinière L4-L5 dans le composé O.C.T. Congeler sur de la glace sèche jusqu’à ce qu’elle soit complètement solidifiée.
- Coupez les tissus à 30 μm (en coupe transversale pour la moelle épinière) à l’aide d’un cryostat et collectez les sections dans une plaque de 24 puits contenant du PB. Lavez les sections 3 x 5 min avec 0,3% de Triton en PB.
- Bloquer les sites de liaison non spécifiques avec 5 % de NGS dans 0,3 % de Triton/PB pendant 2 h à température ambiante.
- Diluer les anticorps primaires : Anti-MAP2A (1:500), GFAP (1:1 000), Iba1 pour la microglie (1:2 000) avec 5 % de NGS dans 0,3 % de Triton/PB, et incuber les sections pendant la nuit à 4 °C sur un agitateur.
- Lavez les sections 3 x 5 min avec 0,3% triton/PB, et ajoutez des anticorps secondaires (Donkey Anti-Rabbit IgG Alexa Fluor 488, 1:500, ou Goat Anti-Mouse IgG Alexa Fluor 488, 1:500) dans 5% NGS/PB pendant 2 h à température ambiante.
- Laver 3 x 5 min avec du PB, et incuber les sections dans 1 μg/mL de DAPI pendant 10 min à température ambiante. Lavez les sections 3 x 5 min avec PB.
- Montez les sections sur une lame adhésive propre (Table des matériaux) avec un pinceau fin sous un microscope optique.
- Mouillez le couvercle avec un support de montage. Durcir toute la nuit dans l’obscurité à température ambiante.
- Image sous un microscope confocal avec les lasers respectifs.
Résultats
Après l’isolement des sEV des milieux conditionnés RAW 264,7 par centrifugation, le NTA a été utilisé pour déterminer la concentration et la distribution granulométrique des sEV purifiés. La taille moyenne moyenne des sEV dérivés de RAW 264,7 était de 140 nm et la taille maximale des particules était de 121,8 nm, ce qui confirme que la plupart des particules détectables dans la mesure de diffusion de la lumière se situent dans la plage de taille des exosomes ou des sEV à 50-150 nm(Figure 1A). Comme suggéré dans l’information minimale pour les études sur les vésicules extracellulaires 2018 (MISEV2018)23, nous avons analysé un ensemble de protéines qui devraient être présentes ou exclues de populations distinctes de VE. Le transfert western des sEV, du lysate cellulaire et des milieux exo-appauvris a démontré que les échantillons de protéines dérivées de sEV contenaient les protéines marqueurs sEV Alix, CD81 et GAPDH. La fraction de lysate cellulaire a été enrichie avec la protéine résidente du réticulum endoplasmique, la calnexine, qui était absente dans les sEV. Ainsi, la calnexine a servi de marqueur négatif de la contamination cellulaire(Figure 1B).
Nous avons ensuite effectué des expériences dose-réponse et temporelle pour l’absorption de sEV in vitro. Les cellules Neuro-2a ont été incubées avec une dose unique de 1 μg de sEV marqués PKH67 pendant 1, 4 et 24 h, après quoi l’absorption de différentes concentrations de sEV (1, 5 et 10 μg) a été examinée à 1 h. Les résultats de la NTA ont indiqué que 1 μg de protéine en moyenne était égal à ~ 1 x 109 particules. En parallèle, des PBS, des sEV non étiquetés et des témoins à colorant seul ont également été testés. Nous avons observé que l’absorption des sEV se produisait à 1 h(figure 2A)et pour les sEV de 1, 5 et 10 μg(figure 2B). La fluorescence a pu être détectée à 4 h pour 5 et 10 μg de VES(Figure 2C)après l’incubation. Ensuite, l’absorption des sEV marqués PKH26 par les astrocytes primaires a été examinée (Figure 3). La fluorescence maximale de l’absorption de sEV dans les astrocytes corticaux primaires s’est produite à 24 h. Les sEV non étiquetés n’ont pas montré de fluorescence, ce qui démontre que l’autofluorescence sEV ne contribue pas de manière significative aux faux positifs(figure supplémentaire S1A).
Ensuite, des sEV marqués ont été injectés par voie intrathécale à des souris pour évaluer l’administration et l’absorption des sEV par différentes cellules de la moelle épinière à l’aide de l’immunohistochimie et de la microscopie confocale. Nous avons taché MAP2 en tant que marqueur neuronal, GFAP en tant que marqueur astrocytaire et IBA1 en tant que marqueur microglial. Les neurones (Figure 4), les astrocytes (Figure 5) et les cellules microgliales (Figure 6) ont tous pris des sEV marqués PKH26, et une fluorescence maximale de sEV a été observée à 6 h après l’injection. Bien que les sEV ne se colocalisent pas toujours avec les marqueurs cellulaires, nous n’avons observé aucune absorption différentielle par les cellules du SNC. L’injection intrathécale avec 5 μg de sEV RAW 264,7 non marqués ou le contrôle du colorant n’a pas montré de fluorescence significative (Figure supplémentaire S1B). Des signaux fluorescents ont été observés dans les méninges, à la fois 6 h et 18 h après l’injection de sEV (Figure supplémentaire S1C).

Figure 1: Caractérisation des sEV RAW 264,7 purifiés. (A) La taille et la concentration des sEV ont été déterminées à l’aide de NanoSight NS300. Les particules ont été suivies et dimensionnées en fonction du mouvement brownien et du coefficient de diffusion. La distribution granulométrique des sEV est indiquée en nm. La concentration de sEV a été exprimée en particules/mL. (B) Transfert occidental de protéines dérivées de sEV purifiés, de lysates cellulaires et de milieux appauvris en exosomes à l’aide de marqueurs sEV ALIX, GAPDH et CD81. Le marqueur de la protéine du réticulum endoplasmique, la calnexine, sert de contrôle pour surveiller la contamination cellulaire dans les préparations sEV. (C) La microscopie électronique à transmission a démontré la taille et la morphologie des sEV. Barre d’échelle = 100 nm. Abréviations: sEV = petites vésicules extracellulaires; ALIX = Alpha-1,3/1,6-Mannosyltransférase (ALG-2)-interagissant avec la protéine X; GAPDH = glycéraldéhyde 3-phosphate déshydrogénase; CD81 = groupe de différenciation 81. Veuillez cliquer ici pour voir une version agrandie de cette figure.
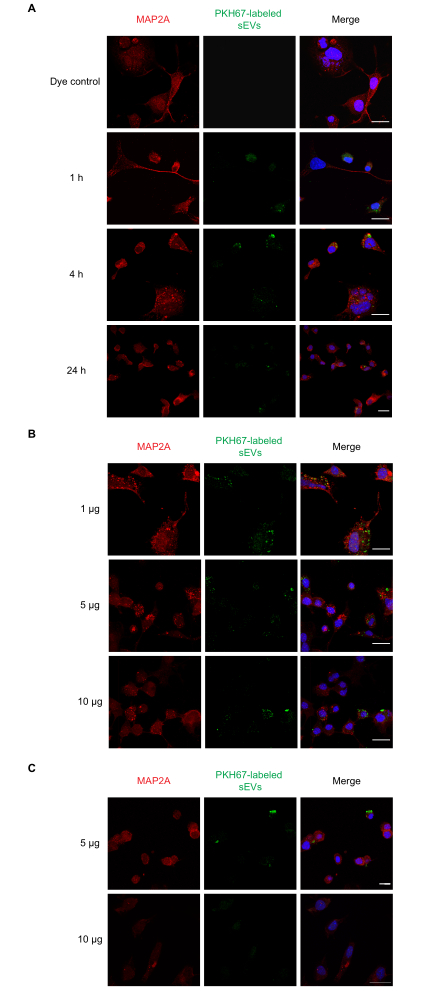
Figure 2: Absorption des sEV RAW 264,7 marqués par les cellules Neuro-2a. ( A )DessEV marqués PKH67 (1 μg) ont été ajoutés aux cellules Neuro-2a cultivées pendant 1, 4 ou 24 h. L’absorption de sEV a été observée à tous les moments avec la microscopie confocale. (B) Des sEV marqués PKH67 (1, 5 ou 10 μg) ont été ajoutés aux cellules Neuro-2a pendant 1 h. (C) Des sEV marqués PKH67 (5 ou 10 μg) ont été ajoutés aux cellules Neuro-2a pendant 4 h. L’absorption de sEV a été observée dans tous les groupes posologiques avec microscopie confocale. Les groupes témoins négatifs traités avec le colorant PKH seul n’ont pas montré de coloration sEV (Figure supplémentaire S1). Les cellules Neuro-2a ont été immunocolorées avec MAP2A (sondées avec Alexa Fluor 594, en rouge), tandis que les noyaux cellulaires ont été colorés avec DAPI (en bleu) et les sEV avec PKH67 (en vert). Barre d’échelle = 50 μm. Abréviations: sEV = petites vésicules extracellulaires; MAP2A = protéine 2A associée aux microtubules; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3: Absorption des sEV RAW 264,7 marqués PKH26 par les astrocytes corticaux primaires de souris. Un μg de sEV a été marqué avec du colorant PKH26 et ajouté au milieu de culture primaire des astrocytes. L’absorption des sEV a été observée 1 et 24 heures après l’addition à l’aide d’un microscope à balayage laser confocal. Les astrocytes ont été colorés avec du GFAP (sondé avec Alexa Fluor 488, en rouge), tandis que les noyaux cellulaires ont été contre-colorés avec du DAPI (en bleu) et les sEV ont été précédemment colorés avec du PKH26 (en vert). Barre d’échelle = 20 μm. Le colorant PKH26 seul a servi de témoin négatif pour la coloration sEV. Abréviations: sEV = petites vésicules extracellulaires; GFAP = protéine acide fibrillaire gliale; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4: Absorption des neurones RAW 264.7 sEVsin. Les SEV marqués PKH26 ont été injectés par voie intrathécale chez la souris; 6 et 18 heures plus tard, les souris ont été perfusées avec 4% de PFA, et la moelle épinière a été isolée et sectionné à 30 μm. Les coupes de la moelle épinière ont été immunocolorées avec un marqueur cellulaire (sondé avec Alexa Fluor 488, en rouge) et une contre-tache nucléaire DAPI (en bleu), tandis que les sEV étaient précédemment étiquetés avec PKH26 (en vert). Les sections de la moelle épinière ont été immunocolorées pour MAP2A afin de visualiser les neurones (rouge). La microscopie confocale montre des sEV dans des neurones MAP2A positifs à différents moments. Le témoin négatif, le groupe PKH26 colorant seul, n’a pas montré de coloration sEV. Barre d’échelle = 20 μm. Abréviations: sEV = petites vésicules extracellulaires; PFA = paraformaldéhyde; MAP2A = protéine 2A associée aux microtubules; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5: Absorption de 264,7 sEV BRUTs dans les astrocytes. Les SEV marqués PKH26 ont été injectés par voie intrathécale chez la souris; 6 et 18 heures plus tard, les souris ont été perfusées avec 4% de PFA, et la moelle épinière a été isolée et sectionné à 30 μm. Les coupes de la moelle épinière ont été immunocolorées avec un marqueur cellulaire (sondé avec Alexa Fluor 488, en rouge) et une contre-tache nucléaire DAPI (en bleu), tandis que les sEV étaient précédemment étiquetés avec PKH26 (en vert). Les coupes de la moelle épinière ont été immunocolorées pour le GFAP afin de visualiser les astrocytes (rouge). La microscopie confocale montre des sEV dans des astrocytes GFAP positifs à différents moments. Le témoin négatif, le groupe PKH26 colorant seul, n’a pas montré de coloration sEV. Barre d’échelle = 20 μm. Abréviations: sEV = petites vésicules extracellulaires; PFA = paraformaldéhyde; GFAP = protéine acide fibrillaire gliale; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
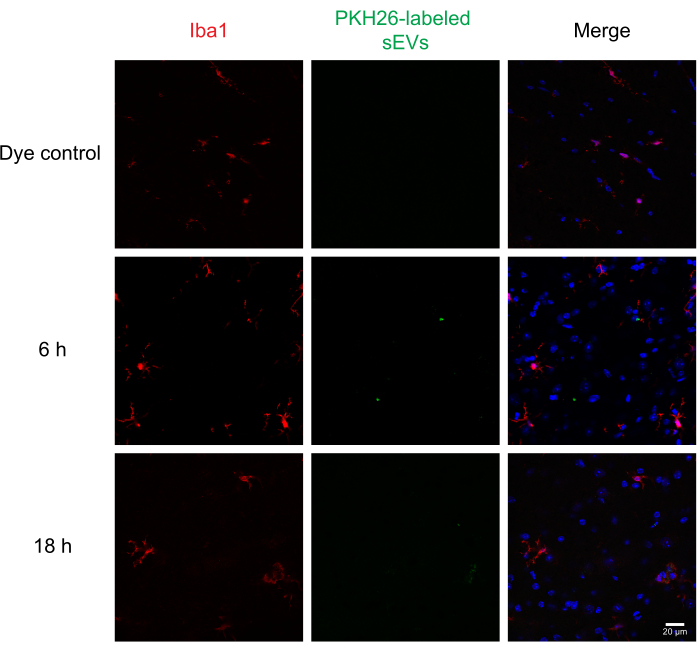
Figure 6: Absorption des sEV RAW 264,7 dans la microglie. Les SEV marqués PKH26 ont été injectés par voie intrathécale chez la souris; 6 et 18 heures plus tard, les souris ont été perfusées avec 4% de PFA, et la moelle épinière a été isolée et sectionné à 30 μm. Les coupes de la moelle épinière ont été immunocolorées avec un marqueur cellulaire (sondé avec Alexa Fluor 488, en rouge) et une contre-tache nucléaire DAPI (en bleu), tandis que les sEV étaient précédemment étiquetés avec PKH26 (en vert). Les coupes de la moelle épinière ont été immunocolorées pour IBA1 afin de visualiser la microglie (rouge). La microscopie confocale montre des sEV dans la microglie IBA1-positive à différents moments. Le témoin négatif, le groupe PKH26 colorant seul, n’a pas montré de coloration sEV. Barre d’échelle = 20 μm. Abréviations: sEV = petites vésicules extracellulaires; PFA = paraformaldéhyde; IBA1 = molécule adaptatrice ionisée de liaison au calcium 1; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure supplémentaire S1 : Absorption des sEV RAW 264,7 marqués par les astrocytes corticaux primaires de souris et dans la moelle épinière. (A) Contrôle de l’absorption des sEV RAW 264,7 marqués PKH26 par les astrocytes corticaux primaires de souris. Un μg de SEV non marqués mis en service dans du PBS ou un volume égal de PBS a été ajouté parallèlement au milieu de culture des astrocytes. Aucune fluorescence n’a été observée à 1 h pour le PBS et le contrôle non marqué à l’aide d’un microscope à balayage laser confocal. Les astrocytes ont été colorés avec du GFAP (sondé avec Alexa Fluor 488, en rouge), tandis que les noyaux ont été contre-colorés avec du DAPI (bleu), et les sEV non marqués ont été visualisés sous le même canal Alexa Fluor 546 que les sEV marqués PKH26. Barre d’échelle = 50 μm. (B) Contrôles de l’absorption des sEV RAW 264,7 marqués PKH26 par la moelle épinière de la souris in vivo. Cinq μg de sEV non marqués ou de colorant témoin ont été injectés par voie intrathécale chez la souris. Encore une fois, les signaux fluorescents n’ont pas été observés pour les sEV non marqués ou le contrôle de colorant seul à l’aide d’un microscope à balayage laser confocal. Les astrocytes ont été colorés avec du GFAP (sondé avec Alexa Fluor 488, en rouge), tandis que les noyaux ont été contre-colorés avec du DAPI (bleu) et que les sEV non marqués ont été visualisés sous le même canal Alexa Fluor 546 que les sEV marqués PKH26. Barre d’échelle = 50 μm. (C)Des images représentatives révèlent la présence de sEV RAW 264,7 dans les méninges spinales de souris 6 h et 18 h après l’administration intrathécale. Cinq μg de sEV ont été marqués avec du colorant PKH26 (en vert), et les noyaux ont été contre-colorés avec du DAPI (en bleu). Les astérisques indiquent l’artère spinale antérieure. Barre d’échelle = 50 μm. Abréviations: sEV = petites vésicules extracellulaires; PBS = solution saline tamponnée au phosphate; GFAP = protéine acide fibrillaire gliale; DAPI = 4′,6-diamidino-2-phénylindole. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans ce protocole, nous avons montré l’étiquetage des sEV avec des colorants PKH et la visualisation de leur absorption dans la moelle épinière. Les colorants fluorescents lipophiles PKH sont largement utilisés pour le marquage des cellules par cytométrie en flux et microscopie fluorescente3,5,6,12,24,25. En raison de leur demi-vie relativement longue et de leur faible cytotoxicité, les colorants PKH peuvent être utilisés pour un large éventail d’études de suivi cellulaire in vivo et in vitro 26,27. Bien qu’une excellente rétention membranaire et une stabilité biochimique soient avantageuses, l’intercalation de sondes fluorescentes avec des contaminants lipoprotéiques purifiés avec des sEV peut compromettre l’interprétation de l’internalisation des sEV et des études fonctionnelles. Ainsi, la purification et l’étiquetage des sEV sont des étapes critiques du protocole car la persistance des colorants avec des contaminants peut conduire à une mauvaise interprétation de la distribution in vivo 28. L’inclusion de témoins est essentielle pour éviter les signaux de fluorescence faussement positifs dus au marquage non spécifique des particules et à la longue demi-vie de ces colorants.
L’agrégation et la formation de micellelles de colorants lipophiles peuvent également produire de faux signaux. Nous avons résolu le problème des colorants libres ou non liés en incluant un contrôle de colorant seul et en visualisant l’absorption des VE à des moments antérieurs. Une limitation importante signalée pour le labelage PKH est que de nombreuses nanoparticules PKH26 se forment lors de l’étiquetage des colorants PKH26 des sEV. Bien qu’elles ne soient pas incluses dans ce protocole, il est rapporté que les nanoparticules de PKH26 peuvent être éliminées par un gradient de saccharose29. Une autre étude a évalué l’effet de l’étiquetage PKH sur la taille des sEV par NTA et a rapporté une augmentation de la taille après l’étiquetage PKH30. Néanmoins, les colorants PKH servent de traceur pragmatique et précieux pour montrer où les sEV ont traversé. Une autre limite de cette étude est que nous n’avons pas quantifié les sEV car ce protocole se concentre sur la confirmation de l’absorption cellulaire après l’administration intrathécale. De nouvelles sondes membranaires à base de cyanine ont été développées récemment pour l’imagerie par fluorescence très sensible des sEV sans altérer la taille ni générer d’artefacts, tels que la formation de nanoparticules de PKH31,et amélioreront sans aucun doute les futures études de marquage.
Bien que les macrophages jouent un rôle important dans la neuroinflammation, ils exercent également des fonctions neuroprotectrices en délivrant leur cargaison via des exosomes32. Nos études montrent que les sEV dérivés de macrophages marqués sont pris par les cellules Neuro-2a, les astrocytes primaires et dans la moelle épinière lombaire après administration intrathécale. Les résultats indiquent qu’un temps d’incubation plus long peut conduire à une intensité de signal sEV plus faible, ce qui pourrait être attribué à la dégradation des sEV ou à la division cellulaire par les cellules Neuro-2a en culture33,34. Bien que à faible débit, ce protocole de visualisation des VES marqués dans la moelle épinière peut être utilisé pour les études de validation initiales qui confirment l’absorption des VES avant d’étudier l’impact fonctionnel des VSE administrés par voie intrathécale. Comme nous avons observé une absorption généralement similaire de sEV dans plusieurs types de cellules du SNC, le processus d’absorption semble être non sélectif. Si l’autofluorescence est un problème en imagerie, les sEV non étiquetés peuvent être utilisés comme contrôle supplémentaire pour annuler l’autofluorescence sEV lors de l’imagerie des tissus et des cultures. Bien que la dose et la voie d’administration des VES puissent influencer le schéma de biodistribution11,ce protocole n’est pas optimisé pour l’analyse quantitative de l’absorption des VES. Plusieurs approches différentes et diverses stratégies d’imagerie sont utilisées pour étudier les sEV, et celles-ci sont continuellement affinées et optimisées pour le suivi in vivo des sEV2.
Ce protocole est censé n’être qu’une approche pour confirmer l’adoption du sEV. Comme pour tous les protocoles, la validation croisée à l’aide d’approches multimodales peut être bénéfique. Plus précisément, l’absorption des VES peut être confirmée en étudiant le transfert de cargaison biomoléculaire vers les cellules et les tissus récepteurs. Si l’investigateur connaît la composition en miARN des SEV délivrés, une autre approche pour confirmer le transfert de sEV serait de vérifier les changements de miARN dans les cellules réceptrices ou de déterminer les changements dans les niveaux d’expression des gènes cibles pour les miARN transférés. Les échantillons traités au PBS peuvent être utilisés comme témoin pour cette approche. Dans l’ensemble, ces résultats soutiennent le concept selon lequel les SEV dérivés de macrophages sont repris par les cellules du SNC in vitro et in vivo. Ce protocole peut être utilisé pour étudier le rôle des sEV dans les troubles de la colonne vertébrale, la douleur et l’inflammation et pour déterminer si les sEV peuvent être développés en tant que véhicules cellulaires pour l’administration de petites molécules thérapeutiques, d’ARN et de protéines.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été soutenue par des subventions du NIH NINDS R01NS102836 et du Pennsylvania Department of Health Commonwealth Universal Research Enhancement (CURE) accordées à Seena K. Ajit. Nous remercions le Dr Bradley Nash pour la lecture critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| Amicon Ultra 0.5 mL centrifugal filters | MilliporeSigma | Z677094 | |
| Anti-Alix Antibody | Abcam | ab186429 | 1:1000 |
| Anti-Calnexin Antibody | Abcam | Ab10286 | 1:1000 |
| Anti-CD81 Antibody | Santa Cruz Biotechnology | sc-166029 | 1:1000 |
| Anti-GAPDH Monoclonal Antibody (14C10) | Cell Signaling Technology | 2118 | 1:1000 |
| Anti-Glial Fibrillary Acidic Protein Antibody | Sigma-Aldrich | MAB360 | 1:500 for IF; 1:1000 for IHC |
| Anti-Iba1 Antibody | Wako | 019-19741 | 1:2000 |
| Anti-MAP2A Antibody | Sigma-Aldrich | MAB378 | 1:500 |
| Bovine Serum Albumin (BSA) | VWR | 0332 | |
| Cell Strainer, 40 μm | VWR | 15-1040-1 | |
| Centrifuge Tubes | Thermo Scientific | 3118-0050 | 12,000 x g |
| Coverslip, 12-mm, #1.5 | Electron Microscopy Sciences | 72230-01 | |
| Coverslip, 18-mm, #1.5 | Electron Microscopy Sciences | 72222-01 | |
| DAPI | Sigma-Aldrich | D9542-1MG | 1 µg/mL |
| DC Protein Assay | Bio-Rad | 500-0116 | |
| Deoxyribonuclease I (DNAse I) | MilliporeSigma | D4513-1VL | |
| Donkey Anti-Rabbit IgG H&L (HRP) | Abcam | ab16284 | 1:10000 |
| Donkey Anti-Rabbit IgG H&L, Alexa Fluor 488 | Invitrogen | A-21206 | 1:500 |
| Double Frosted Microscope Slides, #1 | Thermo Scientific | 12-552-5 | |
| DPBS without Calcium and Magnesium | Corning | 21-031-CV | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10-013-CV | |
| Exosome-Depleted Fetal Bovine Serum | Gibco | A27208-01 | |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| FluorChem M imaging system | ProteinSimple | ||
| FV3000 Confocal Microscope | Olympus | ||
| Goat Anti-Mouse IgG H&L (HRP) | Abcam | ab6789 | 1:10000 |
| Goat Anti-Mouse IgG H&L, Alexa Fluor 488 | Invitrogen | A-11001 | 1:500 |
| Goat Anti-Mouse IgG1, Alexa Fluor 594 | Invitrogen | A-21125 | 1:500 |
| Hank's Balanced Salt Solution (HBSS) | VWR | 02-0121 | |
| HEPES | Gibco | 15630080 | |
| HRP Substrate | Thermo Scientific | 34094 | |
| Intercept blocking buffer, TBS | LI-COR Biosciences | 927-60001 | |
| Laemmli SDS Sample Buffer | Alfa Aesar | AAJ61337AC | |
| Micro Cover Glass, #1 | VWR | 48404-454 | |
| Microm HM550 | Thermo Scientific | ||
| NanoSight NS300 system | Malvern Panalytical | ||
| NanoSight NTA 3.2 software | Malvern Panalytical | ||
| Neuro-2a Cell Line | ATCC | CCL-131 | |
| Normal Goat Serum | Vector Laboratories | S-1000 | |
| O.C.T Compound | Sakura Finetek | 4583 | |
| Papain | Worthington Biochemical Corporation | NC9597281 | |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PKH26 | Sigma-Aldrich | MINI26-1KT | |
| PKH67 | Sigma-Aldrich | MINI67-1KT | |
| Protease Inhibitor Cocktail | Thermo Scientific | 1862209 | |
| PVDF Transfer Membrane | MDI | SVFX8302XXXX101 | |
| RAW 267.4 Cell Line | ATCC | TIB-71 | |
| RIPA Buffer | Sigma-Aldrich | R0278 | |
| Sodium Chloride | AMRESCO | 0241-2.5KG | |
| Superfrost Plus Gold Slides | Thermo Scientific | 15-188-48 | adhesive slides |
| T-75 Flasks | Corning | 431464U | |
| Tecnai 12 Digital Transmission Electron Microscope | FEI Company | ||
| TEM Grids | Electron Microscopy Sciences | FSF300-cu | |
| Tris-Glycine Protein Gel, 12% | Invitrogen | XP00120BOX | |
| Tris-Glycine SDS Running Buffer | Invitrogen | LC26755 | |
| Tris-Glycine Transfer Buffer | Invitrogen | LC3675 | |
| TrypLE Express | Gibco | 12605028 | cell dissociation enzyme |
| Triton X-100 | Acros Organics | 327371000 | |
| Trypsin, 0.25% | Corning | 25-053-CL | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Ultracentrifuge Tubes | Beckman | 344058 | 110,000 x g |
Références
- Mulcahy, L. A., Pink, R. C., Carter, D. R. F. Routes and mechanisms of extracellular vesicle uptake. Journal of Extracellular Vesicles. 3 (1), 24641(2014).
- Betzer, O., et al. Advances in imaging strategies for in vivo tracking of exosomes. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 12 (2), 1594(2020).
- Dehghani, M., Gaborski, T. R. Fluorescent labeling of extracellular vesicles. Methods in Enzymology. 645, 15-42 (2020).
- González, M. I., et al. Covalently labeled fluorescent exosomes for in vitro and in vivo applications. Biomedicines. 9 (1), 81(2021).
- Chuo, S. T. -Y., Chien, J. C. -Y., Lai, C. P. -K. Imaging extracellular vesicles: current and emerging methods. Journal of Biomedical Science. 25 (1), 91(2018).
- vander Vlist, E. J., Nolte-'tHoen, E. N. M., Stoorvogel, W., Arkesteijn, G. J. A., Wauben, M. H. M. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7 (7), 1311-1326 (2012).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Heinrich, L., et al. Confocal laser scanning microscopy using dialkylcarbocyanine dyes for cell tracing in hard and soft biomaterials. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81 (1), 153-161 (2007).
- Haney, M. J., et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release. 207, 18-30 (2015).
- Grange, C., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a model of acute kidney injury monitored by optical imaging. International Journal of Molecular Medicine. 33 (5), 1055-1063 (2014).
- Wiklander, O. P., et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. Journal of Extracellular Vesicles. 4, 26316(2015).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nature Communications. 6 (1), 7029(2015).
- Deddens, J. C., et al. Circulating extracellular vesicles contain miRNAs and are released as early biomarkers for cardiac injury. Journal of Cardiovascular Translational Research. 9 (4), 291-301 (2016).
- Montecalvo, A., et al. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 119 (3), 756-766 (2012).
- Escrevente, C., Keller, S., Altevogt, P., Costa, J. Interaction and uptake of exosomes by ovarian cancer cells. BMC Cancer. 11, 108(2011).
- Cho, E., et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. Journal of Controlled Release. 279, 326-335 (2018).
- Mantel, P. Y., et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host & Microbe. 13 (5), 521-534 (2013).
- Porro, C., Trotta, T., Panaro, M. A. Microvesicles in the brain: Biomarker, messenger or mediator. Journal of Neuroimmunology. 288, 70-78 (2015).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Matsumoto, J., et al. Transmission of alpha-synuclein-containing erythrocyte-derived extracellular vesicles across the blood-brain barrier via adsorptive mediated transcytosis: another mechanism for initiation and progression of Parkinson's disease. Acta Neuropathologica Communications. 5 (1), 71(2017).
- Matsumoto, J., Stewart, T., Banks, W. A., Zhang, J. The transport mechanism of extracellular vesicles at the blood-brain barrier. Current Pharmaceutical Design. 23 (40), 6206-6214 (2017).
- Shaimardanova, A., et al. Extracellular vesicles in the diagnosis and treatment of central nervous system diseases. Neural Regeneration Research. 15 (4), 586-596 (2020).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Hoen, E. N. M. N. -t, et al. Quantitative and qualitative flow cytometric analysis of nanosized cell-derived membrane vesicles. Nanomedicine: Nanotechnology, Biology and Medicine. 8 (5), 712-720 (2012).
- Gangadaran, P., Hong, C. M., Ahn, B. -C. An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Frontiers in Pharmacology. 9, 169(2018).
- Teare, G. F., Horan, P. K., Slezak, S. E., Smith, C., Hay, J. B. Long-term tracking of lymphocytes in vivo: the migration of PKH-labeled lymphocytes. Cellular Immunology. 134 (1), 157-170 (1991).
- Kuffler, D. P. Long-term survival and sprouting in culture by motoneurons isolated from the spinal cord of adult frogs. Journal of Comparative Neurology. 302 (4), 729-738 (1990).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Pužar Dominkuš, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta. Biomembranes. 1860 (6), 1350-1361 (2018).
- Dehghani, M., Gulvin, S. M., Flax, J., Gaborski, T. R. Systematic evaluation of PKH labelling on extracellular vesicle size by nanoparticle tracking analysis. Scientific Reports. 10 (1), 9533(2020).
- Shimomura, T., et al. New lipophilic fluorescent dyes for labeling extracellular vesicles: characterization and monitoring of cellular uptake. Bioconjugate Chemistry. 32 (4), 680-684 (2021).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Polanco, J. C., Li, C., Durisic, N., Sullivan, R., Götz, J. Exosomes taken up by neurons hijack the endosomal pathway to spread to interconnected neurons. Acta Neuropathologica Communications. 6 (1), 10(2018).
- Jurgielewicz, B. J., Yao, Y., Stice, S. L. Kinetics and specificity of HEK293T extracellular vesicle uptake using imaging flow cytometry. Nanoscale Research Letters. 15 (1), 170(2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon