Method Article
Captación de pequeñas vesículas extracelulares con marca fluorescente in vitro y en la médula espinal
En este artículo
Resumen
Describimos un protocolo para etiquetar pequeñas vesículas extracelulares derivadas de macrófagos con colorantes PKH y observar su captación in vitro y en la médula espinal después del parto intratecal.
Resumen
Las vesículas extracelulares pequeñas (sEV) son vesículas de 50-150 nm secretadas por todas las células y presentes en los fluidos corporales. Los sEV transfieren biomoléculas como ARN, proteínas y lípidos del donante a las células aceptoras, lo que las convierte en mediadores clave de señalización entre las células. En el sistema nervioso central (SNC), los sEV pueden mediar la señalización intercelular, incluidas las interacciones neuroinmunes. Las funciones de sEV se pueden estudiar mediante el seguimiento de la absorción de sEV etiquetados en células receptoras tanto in vitro como in vivo. Este artículo describe el etiquetado de los sEV de los medios acondicionados de las células macrófagos RAW 264.7 utilizando un tinte de membrana PKH. Muestra la captación de diferentes concentraciones de sEVs etiquetados en múltiples puntos de tiempo por células Neuro-2a y astrocitos primarios in vitro. También se muestra la captación de sEV administrados intratecalmente en neuronas de la médula espinal de ratón, astrocitos y microglía visualizados por microscopía confocal. Los resultados representativos demuestran una variación dependiente del tiempo en la absorción de sEV por diferentes células, lo que puede ayudar a confirmar la entrega exitosa de sEV en la médula espinal.
Introducción
Las vesículas extracelulares pequeñas (sEV) son vesículas de tamaño nanométrico derivadas de membranas con un rango de tamaño de 50-150 nm. Se originan a partir de cuerpos multi-vesiculares (MVB) y se liberan de las células tras la fusión de los MVB con la membrana plasmática. Los sEV contienen miRNAs, mRNAs, proteínas y lípidos bioactivos, y estas moléculas se transfieren entre las células en forma de comunicación de célula a célula. Los sEV pueden ser internalizados por las células receptoras por una variedad de vías endocíticas, y esta captura de sEV por las células receptoras está mediada por el reconocimiento de moléculas de superficie tanto en los VE como en las células diana1.
Los sEV han ganado interés debido a su capacidad para desencadenar cambios moleculares y fenotípicos en las células aceptoras, su utilidad como agente terapéutico y su potencial como portadores de moléculas de carga o agentes farmacológicos. Debido a su pequeño tamaño, las imágenes y el seguimiento de los sEV pueden ser un desafío, especialmente para estudios in vivo y entornos clínicos. Por lo tanto, se han desarrollado muchos métodos para etiquetar e imagenar los sEV para ayudar a su biodistribución y seguimiento in vitro e in vivo2.
La técnica más común para estudiar la biodistribución de sEV y las interacciones de las células diana consiste en etiquetarlas con moléculas de colorante fluorescente3,4,5,6,7. Los vehículos eléctricos se etiquetaron inicialmente con tintes de membrana celular que se usaban comúnmente para obtener imágenes de las células. Estos colorantes fluorescentes generalmente tiñen la bicapa lipídica o las proteínas de interés en los sEV. Varios colorantes lipofílicos muestran una fuerte señal fluorescente cuando se incorporan al citosol, incluyendo DiR (1,1′-dioctadecil-3,3,3′,3′-yoduro de tetrametilindotricarbocianina), DiL (1, 1′-dioctadecil-3, 3, 3′, 3′-tetrametil indocarbocianina perclorato) y DiD (1, 1′-dioctadecil-3, 3, 3′, 3′-tetrametil indocarbocianina 4-clorobencenosulfonato de sal)8,9,10,11.
Otros colorantes lipofílicos, como PKH67 y PKH26, tienen un grupo de cabeza polar altamente fluorescente y una larga cola de hidrocarburos alifáticos que se intercala fácilmente en cualquier estructura lipídica y conduce a la retención de colorantes a largo plazo y a una fluorescencia estable12. Los colorantes PKH también pueden etiquetar EV, lo que permite el estudio de las propiedades EV in vivo13. Se han utilizado muchos otros colorantes para observar exosomas utilizando microscopía de fluorescencia y citometría de flujo, incluidos los colorantes de marcación lipídica14 y los colorantes permeables a las células, como el éster de acetato de carboxifluoresceína succinimidil (CFDA-SE)15,16 y el éster de calceína acetoximetil (AM)17.
Los estudios de diafonía mediada por sEV entre diferentes células del SNC han proporcionado información importante sobre la patogénesis de las enfermedades neuroinflamatorias y neurodegenerativas18. Por ejemplo, los sEV de las neuronas pueden propagar péptidos beta-amiloides y proteínas tau fosforilados y ayudar en la patogénesis de la enfermedad de Alzheimer19. Además, los vehículos eléctricos derivados de los eritrocitos contienen grandes cantidades de alfa-sinucleína y pueden cruzar la barrera hematoencefálica y contribuir a la patología del Parkinson20. La capacidad de los sEV para cruzar barreras fisiológicas21 y transferir sus biomoléculas a las células diana los convierte en herramientas convenientes para administrar fármacos terapéuticos al SNC22.
La visualización de la absorción de sEV por una miríada de células del SNC en la médula espinal permitirá tanto estudios mecanicistas como la evaluación de los beneficios terapéuticos de los sEV administrados exógenamente de diversas fuentes celulares. Este artículo describe la metodología para etiquetar los sEV derivados de macrófagos e imagen de su absorción in vitro e in vivo en la médula espinal lumbar por neuronas, microglía y astrocitos para confirmar cualitativamente la entrega de sEV mediante visualización.
Protocolo
NOTA: Todos los procedimientos se realizaron de conformidad con la Guía de los NIH para el cuidado y uso de animales de laboratorio y fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Facultad de Medicina de la Universidad de Drexel. Se utilizaron ratones CD-1 preñados en el tiempo para el cultivo astrocítico, y todas las presas se recibieron 15 días después de la impregnación. Se utilizaron ratones C57BL/6 de diez o doce semanas de edad para experimentos de captación in vivo.
1. Aislamiento de sEV de células macrófagos RAW 264.7
- Cultivo de células RAW 264,7 en matraces de 75 cm2 en medio agotado de exosomas DMEM que contiene un 10% de suero fetal bovino (FBS) agotado de exosomas y un 1% de penicilina-estreptomicina (pen-strep) durante 24-48 h.
- Recoger 300 ml de medio acondicionado y centrifugar a 300 × g durante 10 min a 4 °C.
- Recoger el sobrenadante y la centrífuga a 2.000 × g durante 20 min a 4 °C.
- Transfiera el sobrenadante a los tubos de la centrífuga, centrífuga durante 35 min a 12.000 × g a 4 °C.
- Recoger el sobrenadante y filtrar a través de un filtro de jeringa de 0,22 μm.
- Transferir a tubos de ultracentrífuga y centrífuga durante 80 min a 110.000 × g a 4 °C.
- Guarde el sobrenadante (medio agotado con exosomas), resuspante el pellet en 2 ml de solución salina tamponada con fosfato (PBS) y centrífuga durante 1 h a 110.000 × g a 4 °C.
- Resuspend el pellet en 100 μL de PBS para su posterior caracterización utilizando el análisis de seguimiento de nanopartículas (NTA) y la microscopía electrónica de transmisión (TEM) o en el tampón de ensayo de radioinmunoprecipitación (RIPA) para western blotting.
2. Caracterización de los sEVs
- Análisis de seguimiento de nanopartículas (NTA)
NOTA: La distribución del tamaño y el número de partículas/ concentración de los sEV purificados de las células RAW 264.7 se midieron mediante NTA.- Diluya los sEV en PBS filtrados para obtener 20-60 vesículas por campo de visión para un seguimiento óptimo.
- Introduzca la muestra diluida en una celda de flujo utilizando una bomba de jeringa con un caudal constante.
- Toma 3-5 videos de 30 s cada uno. Establezca la velocidad de obturación y la ganancia, y enfoque manualmente la configuración de la cámara para que el número máximo de vesículas sea visible y pueda rastrearse y analizarse.
- Avance las muestras entre cada grabación para realizar mediciones replicadas. Optimice la configuración posterior a la adquisición de NTA y mantenga la configuración constante entre las muestras.
- Analice cada video utilizando el software NTA para obtener el tamaño promedio y la concentración de las vesículas.
- Realice todas las mediciones de NTA con la misma configuración del sistema para mayor consistencia.
- Mancha occidental
- Cuantifique las cantidades totales de proteínas en sEV, lisatos celulares y medios agotados por exosomas utilizando un kit de ensayo de proteínas siguiendo las instrucciones del fabricante.
- Para la preparación de lisato celular, culta las células RAW 264.7 en matraces de 75 cm2 hasta un 80-90% de confluencia. Separe las células con tripsina al 0,25% durante 10-15 min, neutralice la tripsina con medios de cultivo y glet las células girando a 400 × g durante 5 min. Resuspend las células en medio de crecimiento fresco.
- Cuente las células usando un hemocitómetro y transfiera 1 × 106 células a otro tubo. Lave las células con PBS dos veces utilizando las mismas condiciones de centrifugación que las anteriores y agregue 50 μL de tampón de lisis (tampón RIPA con cóctel inhibidor de proteasa agregado) al pellet celular desde el giro final.
- Vórtice las células y manténgalas en hielo durante 20 minutos. Someta la mezcla a centrifugación a 10.000 × g durante 30 min a 4 °C, recoja el sobrenadante (es decir, el lisato) en tubos de microcentrífuga frescos y manténgalo a -80 °C hasta su uso.
- Concentre 2 ml de medios agotados por exosomas a 100 μL utilizando filtros centrífugos de corte de 3 kDa antes de cuantificar la cantidad de proteína. Mezcle los sEV con tampón de lisis en una proporción de 1: 1, vórtice durante 30 s e incube en hielo durante 15 minutos para cuantificar la cantidad de proteína.
- Mezcle cantidades iguales de proteína (2 μg) de los sEV, lisato de células RAW 264.7 y medios agotados por exosomas con tampón de muestra reductor.
- Desnaturaliza las muestras a 95 °C durante 5 min, manténgalas en hielo durante 5 min y gire durante 2 min a 10.000 × g. Cargue las muestras en un gel de proteína Tris-glicina al 12% y ejecute el gel a 125 V durante 45 min.
- Transfiera la proteína a una membrana de difluoruro de polivinilideno (PVDF) a 25 V durante 2 h.
- Después de la transferencia, bloquee las membranas de PVDF con tampón de bloqueo (consulte la Tabla de materiales)durante 1 h a temperatura ambiente.
- Incubar la mancha con anticuerpos primarios en un agitador durante la noche a 4 °C.
NOTA: Los anticuerpos primarios utilizados fueron la proteína X (Alix) anti-CD81 (1:1.000), la proteína X (Alix) anti-alfa-1,3/1,6-manosiltransferasa (ALG-2) (1:1.000), la anti-calexina (1:1.000) y la antigliceraldehído 3-fosfato deshidrogenasa (GAPDH) (1:1.000). - Lave las manchas 3 x 15 min con 1x solución salina tamponada tris, 0,1% Tween 20 (TBST), e incube a temperatura ambiente con anticuerpos secundarios conjugados igG-rábano de cabra IgG-rábano (HRP)- o burro anti-conejo IgG-HRP conjugados (1:10.000) durante 1 h en la coctelera.
- Lave las manchas 3 x 15 min con 1x TBST y detecte las proteínas utilizando un sustrato HRP.
- Analice las manchas mediante quimioluminescencia mejorada utilizando un imager de western blot.
- Microscopía electrónica de transmisión (TEM)
- Corregir los sEV resuspendiéndolos en paraformaldehído al 2% (PFA) en tampón de fosfato (PB) de 0,1 M; vórtice para 2 x 15 s.
- Coloque una gota de 10 μL de suspensión sEV sobre parafilm limpio. Flote la rejilla formvar recubierta de carbono en la gota con su lado recubierto frente a la suspensión. Deje que las membranas se absorban durante 20 min en un ambiente seco.
- Coloque las rejillas (lado de la membrana hacia abajo) sobre una gota de PB para lavar durante 3 x 2 min.
- Transfiera las rejillas a 50 μL de glutaraldehído al 1% durante 5 min.
- Lavar las rejillas con 100 μL de agua destilada durante 8 x 2 min.
- Contraste la muestra colocando las rejillas en una gota de acetato de uranilo al 1% durante 2 min.
- Incrustale la muestra con 50 μL de acetato de uranilo al 0,2% con solución de metilcelulosa al 2% durante 10 min en una placa de hielo cubierta de parapelícula.
- Use bucles de acero inoxidable para sostener las rejillas y eliminar el exceso de líquido con papel de filtro.
- Seque al aire la rejilla durante 10 minutos mientras aún está en el bucle.
- Observar bajo un microscopio electrónico de transmisión a 80 kV.
3. Etiquetado de los sEV
- Diluir 20 μg de sEV en 1 ml de tampón de diluyente o el mismo volumen de PBS en 1 ml de tampón de diluyente para el control de colorantes.
- Diluir 3 μL de colorante PKH67 o PKH26 en 1 ml de tampón diluyente y mezclar mediante pipeteo.
- Agregue el tinte PKH diluido a los sEV diluidos y mezcle mediante pipeteo. Incubar durante 5 min en la oscuridad a temperatura ambiente. Para un control de tinte, mezcle el tinte diluido con PBS diluido del paso 3.1.
- Agregue 2 ml de albúmina sérica bovina al 1% (BSA) en PBS al tubo con el tinte y la mezcla sEV y al tubo de control del tinte para absorber el exceso de tinte.
- Centrifugadora durante 1 h a 110.000 × g a 4 °C. Deseche el sobrenadante, vuelva a colocar el pellet en 2 ml de PBS y centrífuga durante 1 h a 110.000 × g a 4 °C. Repita el lavado con PBS y vuelva a utilizar los sEV etiquetados o el control de tinte en un volumen igual de PBS.
- Cuantificar la cantidad de proteína total por el método de Bradford.
4. Captación de sEV por las células Neuro-2a
- Coloque las cubiertas de 18 mm en una placa de 12 pozos y la placa 10 × 104 células Neuro-2a en cada pozo en un total de 1 ml de medio DMEM completo que contenga 10% de FBS y 1% de estreptococo de pluma.
- Cambie el medio a medio agotado por exosomas DMEM cuando la confluencia celular sea del 80-90%. Agregue 1, 5 o 10 μg de sEV etiquetados en cada pozo durante 1, 4 y 24 h para la absorción dependiente de la dosis y el tiempo, o agregue un volumen igual de control del tinte.
5. Cultivos astrocíticos primarios
- Anestesiar a 4 cachorros postnatales 4 días después del nacimiento induciendo hipotermia.
- Recoja los cerebros en una placa de Petri de 60 mm que contenga solución de sal equilibrada de Hank (HBSS) helada suplementada con ácido 4-(2-hidroxietil)-1-piperazinatenosulfónico (HEPES) de 10 mM.
- Diseccionar ambos lóbulos corticales y retirar las meninges. Picar los pañuelos con una cuchilla esterilizada.
- Transfiera los tejidos a un tubo cónico de 15 ml que contenga tampón de disociación de papaína/desoxirribonucleasa I e incube durante 20 min a 37 °C. Remolino cada 5 min.
NOTA: Para 4 cortezas de ratón, 9 ml de papaína de 7,5 U/ml en HBSS se activan a 37 °C durante al menos 30 min, se filtran a través de un filtro de jeringa de 0,22 μm y se mezclan con desoxirribonucleasa I a una concentración final de 0,1 mg/ml. - Aspire el sobrenadante y agregue 5 ml de DMEM completo para inactivar la actividad enzimática. Triturar cuidadosamente para disociar los tejidos con una pipeta serológica de vidrio de 5 ml y una pipeta Pasteur pulida al fuego.
- Pasar la suspensión celular a través de un colador celular de 40 μm y centrifugar las células a 250 × g durante 5 min a 4 °C. Aspirar el medio y sembrar las células en 10 mL de DMEM completo en un matraz de 75 cm2. Reemplace el medio sobrenadante con 15 ml de medio DMEM fresco 4 h después del emplatado.
- Después de 14 días in vitro,transfiera el matraz a un agitador orbitario para separar la microglía y los oligodendrocitos a 320 rpm durante 6 h.
- Tripsinizar los astrocitos restantes utilizando 5 ml de la enzima de disociación celular(Tabla de materiales)durante 10 min a 37 °C. Añadir 5 ml de DMEM completo para inactivar la acción enzimática y gletizar las células a 250 × g durante 5 min a 4 °C.
- Resuspend las células en DMEM completo. Semilla 5 × 104 celdas en fundas de 12 mm #1.5 en una placa de 24 pozos.
6. Captación de sEV por astrocitos
- Cuando los astrocitos alcancen el 80-90% de confluencia, cambie el medio a medio agotado por exosoma DMEM.
- Agregue 1 μg de sEV etiquetados y etiquetados, un volumen igual de control de colorantes o PBS a las células. Utilice las células para la tinción 1 h y 24 h después del tratamiento con sEV.
7. Inmunofluorescencia
- Enjuague las células con PBS 3x y corríjalas con 4% de PFA en PB durante 10 min a temperatura ambiente.
- Lavar las células fijas 3 x 5 min con PB y permeabilizarlas usando 0.1% Triton X-100 en PB durante 10-15 min y lavar con PB 3 x 5 min.
- Bloquee las células con suero de cabra normal (NGS) al 5% en PB durante 1 h a temperatura ambiente.
- Incubar las células con anticuerpos primarios: proteína 2 asociada a microtúbulos (MAP2A, 1:500) para células Neuro-2a o proteína ácida fibrilar glial (GFAP, 1:500) para astrocitos primarios en NGS/PB fresco al 5% durante la noche a 4 °C con agitación suave.
- Lavar 3 x 10 min con PB y añadir anticuerpos secundarios conjugados con fluoróforos (Goat Anti-Mouse IgG1, Alexa Fluor 594; o Goat Anti-Mouse IgG H&L, Alexa Fluor 488) en NGS al 5% e incubar durante 2 h a temperatura ambiente en un balancín.
- Lavar 3 x 10 min con PB e incubar con 1 μg/mL de tinción nuclear 4',6-diamidino-2-fenilindol (DAPI) durante 10 min a temperatura ambiente. Lave las células de nuevo 3 veces con PB.
- Monte los cubrecubos en las diapositivas #1 utilizando un medio de montaje antifade. Déjelos secar durante la noche en la oscuridad y guarde los portaobjetos de vidrio preparados a 4 ° C hasta obtener imágenes en un microscopio confocal.
8. Absorción in vivo de los sEV
- Realizar una inyección intratecal de 5 μg de sEV no etiquetados o etiquetados resuspendidos en 10 μL de PBS, o en un volumen igual (10 μL) de control de colorantes (como se prepara en la sección 3) en ratones C57BL/6.
- Después de 6 y 18 h después de la inyección de sEV, anestesiar profundamente a los ratones mediante inyección intraperitoneal de 100 mg / kg de peso corporal de ketamina y 10 mg / kg de peso corporal de xilazina.
- Realice perfusión intracárdica de ratones con solución salina al 0,9% para eliminar la sangre, seguida de PFA / PB al 4% recién hecho y helado.
- Diseccionar la médula espinal y fijar en 4% PFA/PB a 4 °C durante 24 h. Crioproteger los tejidos en sacarosa al 30% en PB a 4 °C durante 24 h o hasta que los tejidos se hundan. Conservar los tejidos a 4 °C hasta la inmunohistoquímica.
9. Inmunohistoquímica
- Incrustar la médula espinal L4-L5 en el compuesto O.C.T. Congelar sobre hielo seco hasta que esté completamente solidificado.
- Seccionar los tejidos a 30 μm (transversalmente para la médula espinal) usando un criostato, y recoger las secciones en una placa de 24 pozos que contenga PB. Lavar las secciones 3 x 5 min con Tritón al 0,3% en PB.
- Bloquee los sitios de unión no específicos con 5% NGS en Tritón/PB al 0,3% durante 2 h a temperatura ambiente.
- Anticuerpos primarios diluidos: Anti-MAP2A (1:500), GFAP (1:1.000), Iba1 para microglia (1:2.000) con NGS al 5% en Tritón/PB al 0,3%, e incubar las secciones durante la noche a 4 °C en un agitador.
- Lave las secciones 3 x 5 min con Tritón/PB al 0,3% y añada anticuerpos secundarios (Donkey Anti-Rabbit IgG Alexa Fluor 488, 1:500, o Goat Anti-Mouse IgG Alexa Fluor 488, 1:500) en NGS/PB al 5% durante 2 h a temperatura ambiente.
- Lavar 3 x 5 min con PB, e incubar las secciones en 1 μg/mL de DAPI durante 10 min a temperatura ambiente. Lavar las secciones 3 x 5 min con PB.
- Monte las secciones en una diapositiva adhesiva limpia(Tabla de materiales)con un pincel fino bajo un microscopio de luz.
- Humedezca el cubrecubres con el medio de montaje. Curar durante la noche en la oscuridad a temperatura ambiente.
- Imagen bajo un microscopio confocal con los respectivos láseres.
Resultados
Después del aislamiento de los sEV de los medios acondicionados RAW 264.7 mediante centrifugación, se utilizó NTA para determinar la concentración y la distribución del tamaño de los sEV purificados. El tamaño medio promedio de los sEV derivados de RAW 264.7 fue de 140 nm, y el tamaño máximo de partícula fue de 121.8 nm, lo que confirma que la mayoría de las partículas detectables en la medición de dispersión de luz cayeron dentro del rango de tamaño de los exosomas o sEV a 50-150 nm(Figura 1A). Como se sugiere en la información mínima para estudios de vesículas extracelulares 2018 (MISEV2018)23,analizamos un conjunto de proteínas que deberían estar presentes o excluidas de distintas poblaciones de EV. Western blotting de sEV, lisato celular y medios exo-agotados demostró que las muestras de proteínas derivadas de sEV contenían las proteínas marcadoras de sEV Alix, CD81 y GAPDH. La fracción de lisato celular se enriqueció con la proteína residente del retículo endoplásmico, la calcexina, que estaba ausente en los sEV. Por lo tanto, la calexina sirvió como un marcador negativo para la contaminación celular(Figura 1B).
A continuación, realizamos experimentos de dosis-respuesta y de tiempo-curso para la absorción de sEV in vitro. Las células Neuro-2a se incubaron con una dosis única de 1 μg de sEV etiquetados con PKH67 durante 1, 4 y 24 h, después de lo cual se examinó la absorción de diferentes concentraciones de sEV (1, 5 y 10 μg) a 1 h. Los resultados de la NTA indicaron que 1 μg de proteína en promedio era igual a ~ 1 x 109 partículas. Paralelamente, también se probaron PBS, sEV sin etiquetar y controles de colorante solo. Observamos que la captación de sEV ocurrió a 1 h(Figura 2A)y para los sEV de 1, 5 y 10 μg(Figura 2B). La fluorescencia se pudo detectar a las 4 h para 5 y 10 μg de sEV(Figura 2C)después de la incubación. A continuación, se examinó la absorción de sEV etiquetados con PKH26 por astrocitos primarios(Figura 3). La fluorescencia máxima de la captación de sEV en astrocitos corticales primarios se produjo a las 24 h. Los sEV no etiquetados no mostraron fluorescencia, lo que demuestra que la autofluorescencia de sEV no contribuye significativamente a los falsos positivos(Figura suplementaria S1A).
A continuación, los sEV etiquetados se inyectaron intratecalmente en ratones para evaluar la administración y la absorción de sEV por diferentes células de la médula espinal mediante inmunohistoquímica y microscopía confocal. Teñimos para MAP2 como marcador neuronal, GFAP como marcador astrocítico e IBA1 como marcador microglial. Las neuronas(Figura 4),los astrocitos(Figura 5)y las células microgliales(Figura 6)tomaron sEV etiquetados con PKH26, y se observó fluorescencia máxima de sEV a las 6 h después de la inyección. Si bien los sEV no siempre se colocalizaron con los marcadores celulares, no observamos ninguna absorción diferencial por parte de las células del SNC. La inyección intratecal con 5 μg de sEV RAW 264.7 sin etiquetar o control de colorantes no mostró fluorescencia significativa(Figura suplementaria S1B). Se observaron señales fluorescentes en las meninges, tanto 6 h como 18 h después de la inyección de sEV(Figura suplementaria S1C).

Figura 1: Caracterización de los sEV RAW 264.7 purificados. (A) El tamaño y la concentración de los sEV se determinaron utilizando NanoSight NS300. Las partículas fueron rastreadas y dimensionadas en función del movimiento browniano y el coeficiente de difusión. La distribución de tamaño de los sEV se muestra en nm. La concentración de sEVs se expresó como partículas/mL. (B) Western blot de proteínas derivadas de sEV purificados, lisato celular y medios agotados por exosomas utilizando los marcadores sEV ALIX, GAPDH y CD81. El marcador de proteína del retículo endoplásmico, la calcexina, sirve como control para monitorear la contaminación celular en preparaciones de sEV. (C) La microscopía electrónica de transmisión demostró el tamaño y la morfología de los sEV. Barra de escala = 100 nm. Abreviaturas: sEVs = pequeñas vesículas extracelulares; ALIX = Alfa-1,3/1,6-Manosiltransferasa (ALG-2)-proteína X que interactúa; GAPDH = gliceraldehído 3-fosfato deshidrogenasa; CD81 = grupo de diferenciación 81. Haga clic aquí para ver una versión más grande de esta figura.
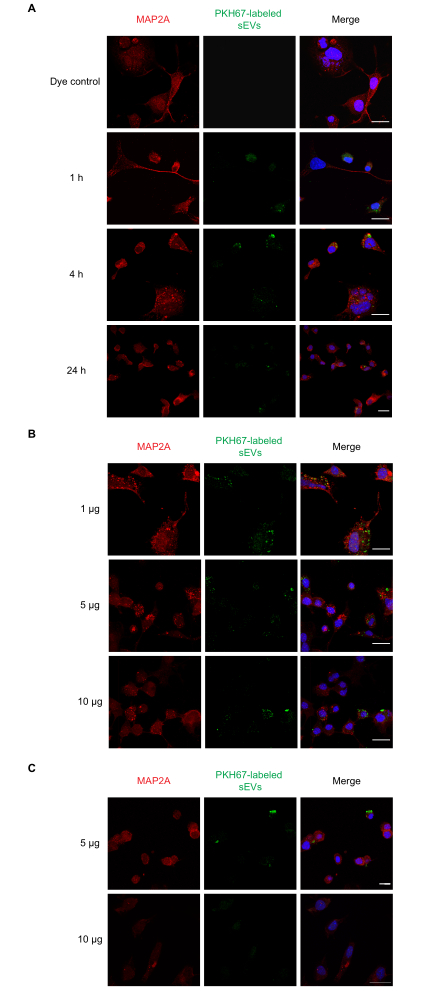
Figura 2: Absorción de sEV RAW 264.7 etiquetados por células Neuro-2a. (A) Se agregaron sEV (1 μg) etiquetados con PKH67 a las células Neuro-2a cultivadas durante 1, 4 o 24 h. La absorción de sEV se observó en todos los puntos temporales con microscopía confocal. (B) Los sEV etiquetados con PKH67 (1, 5 o 10 μg) se agregaron a las células Neuro-2a durante 1 h. (C) Los sEV etiquetados con PKH67 (5 o 10 μg) se agregaron a las células Neuro-2a durante 4 h. Se observó una absorción de sEV en todos los grupos de dosificación con microscopía confocal. Los grupos de control negativos tratados con colorante PKH solo no mostraron tinción de sEV(Figura suplementaria S1). Las células neuro-2a fueron inmunocuidadas con MAP2A (sondeadas con Alexa Fluor 594, mostradas en rojo), mientras que los núcleos celulares fueron teñidos con DAPI (mostrado en azul) y sEV con PKH67 (mostrado en verde). Barra de escala = 50 μm. Abreviaturas: sEVs = pequeñas vesículas extracelulares; MAP2A = proteína 2A asociada a microtúbulos; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Absorción de sEV RAW 264.7 etiquetados con PKH26 por astrocitos corticales primarios de ratón. Se etiquetó un μg de sEV con colorante PKH26 y se agregó al medio de cultivo primario de astrocitos. La captación de sEV se observó a las 1 y 24 h después de la adición utilizando un microscopio de barrido láser confocal. Los astrocitos se tiñeron con GFAP (sondeado con Alexa Fluor 488, que se muestra en rojo), mientras que los núcleos celulares se contratainedron con DAPI (se muestra en azul) y los sEV se tiñeron previamente con PKH26 (se muestra en verde). Barra de escala = 20 μm. El tinte PKH26 solo sirvió como control negativo para la tinción de sEV. Abreviaturas: sEVs = pequeñas vesículas extracelulares; GFAP = proteína ácida fibrilar glial; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Captación de neuronas RAW 264.7 sEVsin. Los sEV etiquetados con PKH26 se inyectaron intratecalmente en ratones; 6 y 18 h más tarde, los ratones fueron perfundidos con 4% de PFA, y la médula espinal fue aislada y seccionada a 30 μm. Las secciones de la médula espinal se inmunosutainedron con un marcador celular (sondeado con Alexa Fluor 488, que se muestra en rojo) y una contratinción nuclear DAPI (que se muestra en azul), mientras que los sEV se etiquetaron previamente con PKH26 (se muestra en verde). Las secciones de la médula espinal fueron inmunoteñidas para MAP2A para visualizar las neuronas (rojo). La microscopía confocal muestra sEV en neuronas MAP2A positivas en diferentes puntos de tiempo. El control negativo, el grupo de colorante PKH26 solo, no mostró tinción de sEV. Barra de escala = 20 μm. Abreviaturas: sEVs = pequeñas vesículas extracelulares; PFA = paraformaldehído; MAP2A = proteína 2A asociada a microtúbulos; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Captación de sEV RAW 264.7 en astrocitos. Los sEV etiquetados con PKH26 se inyectaron intratecalmente en ratones; 6 y 18 h más tarde, los ratones fueron perfundidos con 4% de PFA, y la médula espinal fue aislada y seccionada a 30 μm. Las secciones de la médula espinal se inmunosutainedron con un marcador celular (sondeado con Alexa Fluor 488, que se muestra en rojo) y una contratinción nuclear DAPI (que se muestra en azul), mientras que los sEV se etiquetaron previamente con PKH26 (se muestra en verde). Las secciones de la médula espinal fueron inmunoteñidas para que el GFAP visualizara los astrocitos (rojo). La microscopía confocal muestra sEV en astrocitos GFAP positivos en diferentes puntos temporales. El control negativo, el grupo de colorante PKH26 solo, no mostró tinción de sEV. Barra de escala = 20 μm. Abreviaturas: sEVs = pequeñas vesículas extracelulares; PFA = paraformaldehído; GFAP = proteína ácida fibrilar glial; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
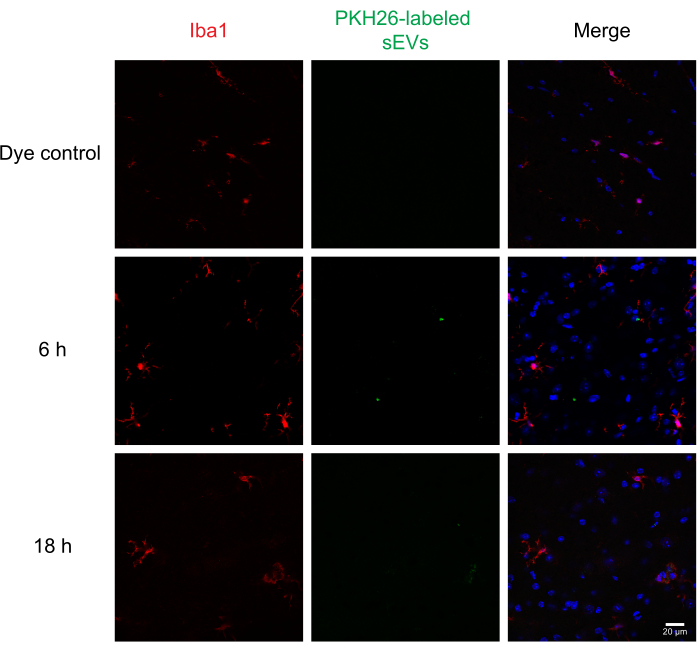
Figura 6: Absorción de sEV RAW 264.7 en microglia. Los sEV etiquetados con PKH26 se inyectaron intratecalmente en ratones; 6 y 18 h más tarde, los ratones fueron perfundidos con 4% de PFA, y la médula espinal fue aislada y seccionada a 30 μm. Las secciones de la médula espinal se inmunosutainedron con un marcador celular (sondeado con Alexa Fluor 488, que se muestra en rojo) y una contratinción nuclear DAPI (que se muestra en azul), mientras que los sEV se etiquetaron previamente con PKH26 (se muestra en verde). Las secciones de la médula espinal fueron inmunoteñidas para IBA1 para visualizar la microglía (rojo). La microscopía confocal muestra sEV en microglía IBA1 positiva en diferentes puntos de tiempo. El control negativo, el grupo de colorante PKH26 solo, no mostró tinción de sEV. Barra de escala = 20 μm. Abreviaturas: sEVs = pequeñas vesículas extracelulares; PFA = paraformaldehído; IBA1 = molécula adaptadora ionizada de unión al calcio 1; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria S1: Absorción de los sEV RAW 264.7 etiquetados por los astrocitos corticales primarios de ratón y en la médula espinal. (A) Controles para la absorción de sEV RAW 264.7 con etiqueta PKH26 por astrocitos corticales primarios de ratón. Se agregó un μg de sEV no etiquetados resuspendidos en PBS o un volumen igual de PBS en paralelo al medio de cultivo de astrocitos. No se observó fluorescencia a 1 h para PBS y el control no marcado utilizando un microscopio de barrido láser confocal. Los astrocitos se tiñeron con GFAP (sondeado con Alexa Fluor 488, que se muestra en rojo), mientras que los núcleos se contralazaron con DAPI (azul), y los sEV no etiquetados se visualizaron bajo el mismo canal Alexa Fluor 546 que los sEV etiquetados con PKH26. Barra de escala = 50 μm. (B) Controles para la absorción de sEV RAW 264.7 etiquetados con PKH26 por la médula espinal del ratón in vivo. Cinco μg de sEV no etiquetados o control de colorantes se inyectaron intratecalmente en ratones. Una vez más, no se observaron señales fluorescentes para los sEV no etiquetados o el control con colorante solo utilizando un microscopio de barrido láser confocal. Los astrocitos se tiñeron con GFAP (sondeado con Alexa Fluor 488, que se muestra en rojo), mientras que los núcleos se contralazaron con DAPI (azul), y los sEV no etiquetados se visualizaron bajo el mismo canal Alexa Fluor 546 que los sEV etiquetados con PKH26. Barra de escala = 50 μm. (C)Las imágenes representativas revelan la presencia de sEV RAW 264.7 en meninges espinales de ratón 6 h y 18 h después del parto intratecal. Cinco μg de sEV fueron etiquetados con colorante PKH26 (mostrado en verde), y los núcleos fueron contramantados con DAPI (mostrado en azul). Los asteriscos indican la arteria espinal anterior. Barra de escala = 50 μm. Abreviaturas: sEVs = pequeñas vesículas extracelulares; PBS = solución salina tamponada con fosfato; GFAP = proteína ácida fibrilar glial; DAPI = 4′,6-diamidino-2-fenilindol. Haga clic aquí para descargar este archivo.
Discusión
En este protocolo, mostramos el etiquetado de los sEV con colorantes PKH y la visualización de su captación en la médula espinal. Los colorantes fluorescentes lipofílicos PKH son ampliamente utilizados para el etiquetado de células por citometría de flujo y microscopía fluorescente3,5,6,12,24,25. Debido a su vida media relativamente larga y baja citotoxicidad, los colorantes PKH se pueden utilizar para una amplia gama de estudios de seguimiento celular in vivo e in vitro 26,27. Aunque la excelente retención de la membrana y la estabilidad bioquímica son ventajosas, la intercalación de sondas fluorescentes con contaminantes de lipoproteínas purificados con sEV puede comprometer la interpretación de la internalización de sEV y los estudios funcionales. Por lo tanto, la purificación y el etiquetado de los sEV son pasos críticos en el protocolo porque la persistencia de los colorantes con contaminantes puede llevar a una mala interpretación de la distribución in vivo 28. La inclusión de controles es fundamental para evitar señales de fluorescencia falsas positivas debido al etiquetado inespecífico de partículas y la larga vida media de estos colorantes.
La agregación y la formación de micelas de colorantes lipofílicos también pueden producir señales falsas. Abordamos el problema del tinte libre o no unido incluyendo un control de tinte solo y visualizando la absorción de EV en puntos de tiempo anteriores. Una limitación importante reportada para el etiquetado PKH es que se forman numerosas nanopartículas PKH26 durante el etiquetado de colorantes PKH26 de los sEV. Aunque no está incluido en este protocolo, se informa que las nanopartículas PKH26 pueden ser eliminadas por un gradiente de sacarosa29. Otro estudio evaluó el efecto del etiquetado PKH sobre el tamaño de los sEV por NTA e informó un aumento en el tamaño después del etiquetado PKH30. Sin embargo, los tintes PKH sirven como un trazador pragmático y valioso para mostrar dónde han atravesado los sEV. Otra limitación de este estudio es que no cuantificamos los sEV ya que este protocolo se centra en la confirmación de la captación celular después del parto intratecal. Recientemente se han desarrollado nuevas sondas de membrana basadas en cianina para imágenes de fluorescencia altamente sensibles de sEV sin alterar el tamaño ni generar artefactos, como la formación de nanopartículas PKH31,y sin duda mejorarán los futuros estudios de etiquetado.
Aunque los macrófagos juegan un papel importante en la neuroinflamación, también ejercen funciones neuroprotectoras al entregar su carga a través de exosomas32. Nuestros estudios muestran que los sEV derivados de macrófagos etiquetados son absorbidos por las células Neuro-2a, losastrocitos primarios y en la médula espinal lumbar después de la administración intratecal. Los resultados indican que un tiempo de incubación más largo puede conducir a una menor intensidad de la señal sEV, lo que podría atribuirse a la degradación de los sEV o a la división celular por las células Neuro-2a en cultivo33,34. Aunque de bajo rendimiento, este protocolo para visualizar los sEV etiquetados en la médula espinal se puede utilizar para estudios de validación iniciales que confirman la absorción de sEV antes de investigar el impacto funcional de los sEV administrados por vía intratecal. Como observamos una absorción de sEV generalmente similar en varios tipos de células del SNC, el proceso de absorción parece no ser selectivo. Si la autofluorescencia es un problema en las imágenes, los sEV no etiquetados se pueden usar como un control adicional para negar la autofluorescencia de sEV durante las imágenes de tejidos y cultivos. Aunque la dosis y la vía de administración de los sEV pueden influir en el patrón de biodistribución11,este protocolo no está optimizado para el análisis cuantitativo de la absorción de sEV. Se están empleando varios enfoques diferentes y diversas estrategias de imagen para investigar los sEV, y estos se están refinando y optimizando continuamente para el seguimiento in vivo de los sEV2.
Este protocolo está destinado a ser solo un enfoque para confirmar la adopción de sEV. Al igual que con todos los protocolos, la validación cruzada mediante enfoques multimodales puede ser beneficiosa. Específicamente, la absorción de sEV se puede confirmar investigando la transferencia de carga biomolecular a las células y tejidos receptores. Si el investigador conoce la composición de miRNA de los sEV entregados, un enfoque alternativo para confirmar la transferencia de sEV sería verificar si hay cambios de miRNA en las células receptoras o determinar los cambios en los niveles de expresión de los genes objetivo para los miRNAs transferidos. Las muestras tratadas con PBS se pueden utilizar como control para este enfoque. En general, estos resultados apoyan el concepto de que los sEV derivados de macrófagos son absorbidos por las células del SNC in vitro e in vivo. Este protocolo se puede utilizar para investigar el papel de los sEV en los trastornos de la columna vertebral, el dolor y la inflamación y para determinar si los sEV se pueden desarrollar como vehículos celulares para la entrega de moléculas pequeñas terapéuticas, ARN y proteínas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este estudio fue apoyado por subvenciones de NIH NINDS R01NS102836 y el Departamento de Salud de Pensilvania Commonwealth Universal Research Enhancement (CURE) otorgado a Seena K. Ajit. Agradecemos al Dr. Bradley Nash por la lectura crítica del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Amicon Ultra 0.5 mL centrifugal filters | MilliporeSigma | Z677094 | |
| Anti-Alix Antibody | Abcam | ab186429 | 1:1000 |
| Anti-Calnexin Antibody | Abcam | Ab10286 | 1:1000 |
| Anti-CD81 Antibody | Santa Cruz Biotechnology | sc-166029 | 1:1000 |
| Anti-GAPDH Monoclonal Antibody (14C10) | Cell Signaling Technology | 2118 | 1:1000 |
| Anti-Glial Fibrillary Acidic Protein Antibody | Sigma-Aldrich | MAB360 | 1:500 for IF; 1:1000 for IHC |
| Anti-Iba1 Antibody | Wako | 019-19741 | 1:2000 |
| Anti-MAP2A Antibody | Sigma-Aldrich | MAB378 | 1:500 |
| Bovine Serum Albumin (BSA) | VWR | 0332 | |
| Cell Strainer, 40 μm | VWR | 15-1040-1 | |
| Centrifuge Tubes | Thermo Scientific | 3118-0050 | 12,000 x g |
| Coverslip, 12-mm, #1.5 | Electron Microscopy Sciences | 72230-01 | |
| Coverslip, 18-mm, #1.5 | Electron Microscopy Sciences | 72222-01 | |
| DAPI | Sigma-Aldrich | D9542-1MG | 1 µg/mL |
| DC Protein Assay | Bio-Rad | 500-0116 | |
| Deoxyribonuclease I (DNAse I) | MilliporeSigma | D4513-1VL | |
| Donkey Anti-Rabbit IgG H&L (HRP) | Abcam | ab16284 | 1:10000 |
| Donkey Anti-Rabbit IgG H&L, Alexa Fluor 488 | Invitrogen | A-21206 | 1:500 |
| Double Frosted Microscope Slides, #1 | Thermo Scientific | 12-552-5 | |
| DPBS without Calcium and Magnesium | Corning | 21-031-CV | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10-013-CV | |
| Exosome-Depleted Fetal Bovine Serum | Gibco | A27208-01 | |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| FluorChem M imaging system | ProteinSimple | ||
| FV3000 Confocal Microscope | Olympus | ||
| Goat Anti-Mouse IgG H&L (HRP) | Abcam | ab6789 | 1:10000 |
| Goat Anti-Mouse IgG H&L, Alexa Fluor 488 | Invitrogen | A-11001 | 1:500 |
| Goat Anti-Mouse IgG1, Alexa Fluor 594 | Invitrogen | A-21125 | 1:500 |
| Hank's Balanced Salt Solution (HBSS) | VWR | 02-0121 | |
| HEPES | Gibco | 15630080 | |
| HRP Substrate | Thermo Scientific | 34094 | |
| Intercept blocking buffer, TBS | LI-COR Biosciences | 927-60001 | |
| Laemmli SDS Sample Buffer | Alfa Aesar | AAJ61337AC | |
| Micro Cover Glass, #1 | VWR | 48404-454 | |
| Microm HM550 | Thermo Scientific | ||
| NanoSight NS300 system | Malvern Panalytical | ||
| NanoSight NTA 3.2 software | Malvern Panalytical | ||
| Neuro-2a Cell Line | ATCC | CCL-131 | |
| Normal Goat Serum | Vector Laboratories | S-1000 | |
| O.C.T Compound | Sakura Finetek | 4583 | |
| Papain | Worthington Biochemical Corporation | NC9597281 | |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PKH26 | Sigma-Aldrich | MINI26-1KT | |
| PKH67 | Sigma-Aldrich | MINI67-1KT | |
| Protease Inhibitor Cocktail | Thermo Scientific | 1862209 | |
| PVDF Transfer Membrane | MDI | SVFX8302XXXX101 | |
| RAW 267.4 Cell Line | ATCC | TIB-71 | |
| RIPA Buffer | Sigma-Aldrich | R0278 | |
| Sodium Chloride | AMRESCO | 0241-2.5KG | |
| Superfrost Plus Gold Slides | Thermo Scientific | 15-188-48 | adhesive slides |
| T-75 Flasks | Corning | 431464U | |
| Tecnai 12 Digital Transmission Electron Microscope | FEI Company | ||
| TEM Grids | Electron Microscopy Sciences | FSF300-cu | |
| Tris-Glycine Protein Gel, 12% | Invitrogen | XP00120BOX | |
| Tris-Glycine SDS Running Buffer | Invitrogen | LC26755 | |
| Tris-Glycine Transfer Buffer | Invitrogen | LC3675 | |
| TrypLE Express | Gibco | 12605028 | cell dissociation enzyme |
| Triton X-100 | Acros Organics | 327371000 | |
| Trypsin, 0.25% | Corning | 25-053-CL | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Ultracentrifuge Tubes | Beckman | 344058 | 110,000 x g |
Referencias
- Mulcahy, L. A., Pink, R. C., Carter, D. R. F. Routes and mechanisms of extracellular vesicle uptake. Journal of Extracellular Vesicles. 3 (1), 24641(2014).
- Betzer, O., et al. Advances in imaging strategies for in vivo tracking of exosomes. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 12 (2), 1594(2020).
- Dehghani, M., Gaborski, T. R. Fluorescent labeling of extracellular vesicles. Methods in Enzymology. 645, 15-42 (2020).
- González, M. I., et al. Covalently labeled fluorescent exosomes for in vitro and in vivo applications. Biomedicines. 9 (1), 81(2021).
- Chuo, S. T. -Y., Chien, J. C. -Y., Lai, C. P. -K. Imaging extracellular vesicles: current and emerging methods. Journal of Biomedical Science. 25 (1), 91(2018).
- vander Vlist, E. J., Nolte-'tHoen, E. N. M., Stoorvogel, W., Arkesteijn, G. J. A., Wauben, M. H. M. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7 (7), 1311-1326 (2012).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Heinrich, L., et al. Confocal laser scanning microscopy using dialkylcarbocyanine dyes for cell tracing in hard and soft biomaterials. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81 (1), 153-161 (2007).
- Haney, M. J., et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release. 207, 18-30 (2015).
- Grange, C., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a model of acute kidney injury monitored by optical imaging. International Journal of Molecular Medicine. 33 (5), 1055-1063 (2014).
- Wiklander, O. P., et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. Journal of Extracellular Vesicles. 4, 26316(2015).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nature Communications. 6 (1), 7029(2015).
- Deddens, J. C., et al. Circulating extracellular vesicles contain miRNAs and are released as early biomarkers for cardiac injury. Journal of Cardiovascular Translational Research. 9 (4), 291-301 (2016).
- Montecalvo, A., et al. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 119 (3), 756-766 (2012).
- Escrevente, C., Keller, S., Altevogt, P., Costa, J. Interaction and uptake of exosomes by ovarian cancer cells. BMC Cancer. 11, 108(2011).
- Cho, E., et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. Journal of Controlled Release. 279, 326-335 (2018).
- Mantel, P. Y., et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host & Microbe. 13 (5), 521-534 (2013).
- Porro, C., Trotta, T., Panaro, M. A. Microvesicles in the brain: Biomarker, messenger or mediator. Journal of Neuroimmunology. 288, 70-78 (2015).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Matsumoto, J., et al. Transmission of alpha-synuclein-containing erythrocyte-derived extracellular vesicles across the blood-brain barrier via adsorptive mediated transcytosis: another mechanism for initiation and progression of Parkinson's disease. Acta Neuropathologica Communications. 5 (1), 71(2017).
- Matsumoto, J., Stewart, T., Banks, W. A., Zhang, J. The transport mechanism of extracellular vesicles at the blood-brain barrier. Current Pharmaceutical Design. 23 (40), 6206-6214 (2017).
- Shaimardanova, A., et al. Extracellular vesicles in the diagnosis and treatment of central nervous system diseases. Neural Regeneration Research. 15 (4), 586-596 (2020).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Hoen, E. N. M. N. -t, et al. Quantitative and qualitative flow cytometric analysis of nanosized cell-derived membrane vesicles. Nanomedicine: Nanotechnology, Biology and Medicine. 8 (5), 712-720 (2012).
- Gangadaran, P., Hong, C. M., Ahn, B. -C. An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Frontiers in Pharmacology. 9, 169(2018).
- Teare, G. F., Horan, P. K., Slezak, S. E., Smith, C., Hay, J. B. Long-term tracking of lymphocytes in vivo: the migration of PKH-labeled lymphocytes. Cellular Immunology. 134 (1), 157-170 (1991).
- Kuffler, D. P. Long-term survival and sprouting in culture by motoneurons isolated from the spinal cord of adult frogs. Journal of Comparative Neurology. 302 (4), 729-738 (1990).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Pužar Dominkuš, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta. Biomembranes. 1860 (6), 1350-1361 (2018).
- Dehghani, M., Gulvin, S. M., Flax, J., Gaborski, T. R. Systematic evaluation of PKH labelling on extracellular vesicle size by nanoparticle tracking analysis. Scientific Reports. 10 (1), 9533(2020).
- Shimomura, T., et al. New lipophilic fluorescent dyes for labeling extracellular vesicles: characterization and monitoring of cellular uptake. Bioconjugate Chemistry. 32 (4), 680-684 (2021).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Polanco, J. C., Li, C., Durisic, N., Sullivan, R., Götz, J. Exosomes taken up by neurons hijack the endosomal pathway to spread to interconnected neurons. Acta Neuropathologica Communications. 6 (1), 10(2018).
- Jurgielewicz, B. J., Yao, Y., Stice, S. L. Kinetics and specificity of HEK293T extracellular vesicle uptake using imaging flow cytometry. Nanoscale Research Letters. 15 (1), 170(2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados