Method Article
Assorbimento di piccole vescicole extracellulari etichettate fluorescenti in vitro e nel midollo spinale
In questo articolo
Riepilogo
Descriviamo un protocollo per etichettare piccole vescicole extracellulari derivate da macrofagi con coloranti PKH e osservarne l'assorbimento in vitro e nel midollo spinale dopo il parto intratecale.
Abstract
Le piccole vescicole extracellulari (sEV) sono vescicole da 50-150 nm secrete da tutte le cellule e presenti nei fluidi corporei. Gli sEV trasferiscono biomolecole come RNA, proteine e lipidi dalle cellule donatrici alle cellule accettori, rendendole mediatori chiave di segnalazione tra le cellule. Nel sistema nervoso centrale (SNC), i sEV possono mediare la segnalazione intercellulare, comprese le interazioni neuroimmune. Le funzioni di sEV possono essere studiate monitorando l'assorbimento di sEV etichettati nelle cellule riceventi sia in vitro che in vivo. Questo documento descrive l'etichettatura dei sEV dai mezzi condizionati delle cellule macrofagiCHE RAW 264.7 utilizzando un colorante a membrana PKH. Mostra l'assorbimento di diverse concentrazioni di sEV etichettati in più punti temporali da parte delle cellule Neuro-2a e degli astrociti primari in vitro. Viene anche mostrato l'assorbimento di sEV somministrati per via intratecale nei neuroni del midollo spinale del topo, negli astrociti e nelle microglia visualizzate mediante microscopia confocale. I risultati rappresentativi dimostrano una variazione dipendente dal tempo nell'assorbimento di sEV da parte di cellule diverse, che può aiutare a confermare il successo della consegna di sEV nel midollo spinale.
Introduzione
Le piccole vescicole extracellulari (sEV) sono vescicole nanodimensionate derivate dalla membrana con un intervallo di dimensioni di 50-150 nm. Hanno origine da corpi multi-vescicolari (MVB) e vengono rilasciati dalle cellule dopo la fusione degli MVB con la membrana plasmatica. Gli sEV contengono miRNA, mRNA, proteine e lipidi bioattivi e queste molecole vengono trasferite tra le cellule sotto forma di comunicazione cellula-cellula. Le sEV possono essere internalizzate dalle cellule riceventi attraverso una varietà di vie endocitiche e questa cattura di sEV da parte delle cellule riceventi è mediata dal riconoscimento delle molecole di superficie sia sugli EV che sulle cellule bersaglio1.
I sEV hanno guadagnato interesse grazie alla loro capacità di innescare cambiamenti molecolari e fenotipici nelle cellule accettori, alla loro utilità come agente terapeutico e al loro potenziale come vettori di molecole di carico o agenti farmacologici. A causa delle loro piccole dimensioni, l'imaging e il tracciamento dei sEV possono essere impegnativi, specialmente per gli studi in vivo e le impostazioni cliniche. Pertanto, sono stati sviluppati molti metodi per etichettare e immaginare i sEV per aiutare la loro biodistribuzione e tracciamento in vitro e in vivo2.
La tecnica più comune per studiare la biodistribuzione sEV e le interazioni delle cellule bersaglio prevede l'etichettatura con molecole di colorante fluorescente3,4,5,6,7. I veicoli elettrici sono stati inizialmente etichettati con coloranti a membrana cellulare che erano comunemente usati per l'immagine delle cellule. Questi coloranti fluorescenti generalmente macchiano il doppio strato lipidico o le proteine di interesse sui sEV. Diversi coloranti lipofili mostrano un forte segnale fluorescente quando incorporati nel citosol, tra cui DiR (1,1′-diottadecile-3,3,3′,3′-tetrametilinditricarbocianina ioduro), DiL (1, 1′-diottadecile-3, 3, 3′, 3′-tetrametil indocarbocianina perclorato) e DiD (1, 1′-diottadecile-3, 3, 3′,3′-tetrametil indocarbocianine 4-clorobenzensolfonato sale)8,9,10,11.
Altri coloranti lipofili, come PKH67 e PKH26, hanno un gruppo di testa polare altamente fluorescente e una lunga coda di idrocarburi alifatici che si intercala facilmente in qualsiasi struttura lipidica e porta alla ritenzione del colorante a lungo termine e alla fluorescenza stabile12. I coloranti PKH possono anche etichettare i veicoli elettrici, il che consente lo studio delle proprietà EV in vivo13. Molti altri coloranti sono stati utilizzati per osservare gli esosomi utilizzando la microscopia a fluorescenza e la citometria a flusso, compresi i coloranti per l'etichettatura lipidica14 e coloranti permeabili alle cellule come l'estere succinimidile carbossifluoresceina diacetato (CFDA-SE)15,16 e l'estere acetoximetile (AM) di calceina17.
Studi di crosstalk mediata da sEV tra diverse cellule del SNC hanno fornito importanti approfondimenti sulla patogenesi delle malattie neuroinfiammatorie e neurodegenerative18. Ad esempio, gli sEV dei neuroni possono diffondere peptidi beta-amiloidi e proteine tau fosforilate e aiutare nella patogenesi della malattia di Alzheimer19. Inoltre, gli EV derivati dagli eritrociti contengono grandi quantità di alfa-sinucleina e possono attraversare la barriera emato-encefalica e contribuire alla patologia del Parkinson20. La capacità dei sEV di attraversare le barriere fisiologiche21 e trasferire le loro biomolecole alle cellule bersaglio li rende strumenti convenienti per fornire farmaci terapeutici al SNC22.
La visualizzazione dell'assorbimento di sEV da parte di una miriade di cellule del SNC nel midollo spinale consentirà sia studi meccanicistici che la valutazione dei benefici terapeutici dei sEV somministrati esogenamente da varie fonti cellulari. Questo documento descrive la metodologia per etichettare i sEV derivati dai macrofagi e immaginare il loro assorbimento in vitro e in vivo nel midollo spinale lombare da parte di neuroni, microglia e astrociti per confermare qualitativamente la consegna di sEV mediante visualizzazione.
Protocollo
NOTA: Tutte le procedure sono state eseguite in conformità con la Guida NIH per la cura e l'uso di animali da laboratorio e approvate dal Comitato istituzionale per la cura e l'uso degli animali del Drexel University College of Medicine. I topi CD-1 gravidi a tempo sono stati utilizzati per la coltura astrocitica e tutte le dighe sono state ricevute 15 giorni dopo l'impregnazione. I topi C57BL/6 di dieci-dodici settimane sono stati utilizzati per esperimenti di assorbimento in vivo.
1. Isolamento di sEV da cellule macrofagiche RAW 264.7
- Coltura RAW 264,7 cellule in palloni da 75 cm2 in mezzo impoverito di esosomi DMEM contenenti il 10% di siero bovino fetale impoverito di esosomi (FBS) e l'1% di penicillina-streptomicina (pen-streptococco) per 24-48 ore.
- Raccogliere 300 ml di mezzo condizionato e centrifugare a 300 × g per 10 minuti a 4 °C.
- Raccogliere il surnatante e la centrifuga a 2.000 × g per 20 minuti a 4 °C.
- Trasferire il surnatante in tubi centrifughi, centrifugare per 35 minuti a 12.000 × g a 4 °C.
- Raccogliere il surnatante e filtrare attraverso un filtro a siringa da 0,22 μm.
- Trasferire in tubi ultracentrifughi e centrifuga per 80 minuti a 110.000 × g a 4 °C.
- Conservare il surnatante (mezzo impoverito di esosomi), riesemere il pellet in 2 mL di 1x soluzione salina tamponata con fosfato (PBS) e centrifugare per 1 ora a 110.000 × g a 4 °C.
- Rinsociemere il pellet in 100 μL di PBS per un'ulteriore caratterizzazione utilizzando l'analisi di tracciamento delle nanoparticelle (NTA) e la microscopia elettronica a trasmissione (TEM) o nel tampone del saggio di radioimmunoprecipitazione (RIPA) per il western blotting.
2. Caratterizzazione dei sEV
- Analisi di tracciamento delle nanoparticelle (NTA)
NOTA: La distribuzione dimensionale e il numero/concentrazione di particelle dei sEV purificati dalle celle RAW 264.7 sono stati misurati da NTA.- Diluire i sEV in PBS filtrati per ottenere 20-60 vescicole per campo visivo per un tracciamento ottimale.
- Introdurre il campione diluito in una cella di flusso utilizzando una pompa a siringa con una portata costante.
- Prendi 3-5 video di 30 s ciascuno. Impostare la velocità e il guadagno dell'otturatore e mettere a fuoco manualmente le impostazioni della fotocamera affinché il numero massimo di vescicole sia visibile e in grado di essere monitorato e analizzato.
- Avanza i campioni tra ogni registrazione per eseguire misurazioni di replica. Ottimizza le impostazioni di post-acquisizione NTA e mantieni costanti le impostazioni tra i campioni.
- Analizza ogni video utilizzando il software NTA per ottenere la dimensione media e la concentrazione delle vescicole.
- Eseguire tutte le misurazioni NTA con impostazioni di sistema identiche per coerenza.
- Macchia occidentale
- Quantificare le quantità totali di proteine in sEV, lisati cellulari e mezzi impoveriti di esosomi utilizzando un kit di analisi proteica seguendo le istruzioni del produttore.
- Per la preparazione del lisato cellulare, colturare le cellule RAW 264,7 in palloni da 75 cm2 fino all'80-90% di confluenti. Staccare le cellule con lo 0,25% di tripsina per 10-15 minuti, neutralizzare la tripsina con mezzi di coltura e pellettizzare le cellule ruotando a 400 × g per 5 minuti. Risuspendare le cellule in un terreno di crescita fresco.
- Contare le cellule usando un emocitometro e trasferire 1 × 106 cellule in un altro tubo. Lavare le cellule con PBS due volte utilizzando le stesse condizioni di centrifugazione di cui sopra e aggiungere 50 μL di tampone di lisi (tampone RIPA con cocktail inibitore della proteasi aggiunto) al pellet cellulare dal giro finale.
- Vortice le cellule e tenerle sul ghiaccio per 20 min. Sottoporre la miscela a centrifugazione a 10.000 × g per 30 minuti a 4 °C, raccogliere il surnatante (cioè il lisato) in tubi microcentrifuga freschi e conservare a -80 °C fino all'uso.
- Concentrare 2 mL di mezzi impoveriti di esosomi a 100 μL utilizzando filtri centrifughi a taglio di 3 kDa prima di quantificare la quantità di proteine. Mescolare i sEV con tampone di lisi in un rapporto 1: 1, vortice per 30 s e incubare sul ghiaccio per 15 minuti per quantificare la quantità di proteine.
- Mescolare quantità uguali di proteine (2 μg) dei sEV, del lisato cellulare RAW 264.7 e dei mezzi impoveriti di esosomi con tampone campione riducente.
- Denaturare i campioni a 95 °C per 5 minuti, tenerli sul ghiaccio per 5 minuti e ruotare per 2 minuti a 10.000 × g. Caricare i campioni su un gel proteico Tris-glicina al 12% ed eseguire il gel a 125 V per 45 minuti.
- Trasferire la proteina su una membrana di polivinilidene difluoruro (PVDF) a 25 V per 2 ore.
- Dopo il trasferimento, bloccare le membrane pvDF con tampone di blocco (vedere la tabella dei materiali)per 1 ora a temperatura ambiente.
- Incubare la macchia con anticorpi primari su uno shaker durante la notte a 4 °C.
NOTA: Gli anticorpi primari utilizzati erano anti-CD81 (1:1.000), anti-alfa-1,3/1,6-mannosiltransferasi (ALG-2)-interazione proteina X (Alix) (1:1.000), anti-Calnexin (1:1.000) e anti-gliceraldeide 3-fosfato deidrogenasi (GAPDH) (1:1.000). - Lavare le macchie 3 x 15 minuti con 1x soluzione salina tamponata tris, 0,1% Tween 20 (TBST) e incubare a temperatura ambiente con anticorpi secondari coniugati IgG-rafano perossidasi (HRP) o anti-asino anti-coniglio IgG-HRP (1:10.000) per 1 ora sullo shaker.
- Lavare le macchie 3 x 15 minuti con 1x TBST e rilevare le proteine utilizzando un substrato HRP.
- Analizza le macchie migliorando la chemiluminescenza utilizzando un imager western blot.
- Microscopia elettronica a trasmissione (TEM)
- Correggere i sEV riconsostandoli in paraformaldeide al 2% (PFA) in tampone fosfato 0,1 M (PB); vortice per 2 x 15 s.
- Posizionare una goccia di 10 μL di sospensione sEV su parafilm pulito. Fai galleggiare la griglia del formvar rivestita in carbonio sulla goccia con il lato rivestito rivolto verso la sospensione. Lasciare assorbire le membrane per 20 minuti in ambiente asciutto.
- Posizionare le griglie (lato membrana verso il basso) su una goccia di PB per lavare per 3 x 2 min.
- Trasferire le griglie a 50 μL di glutaraldeide all'1% per 5 minuti.
- Lavare le griglie con 100 μL di acqua distillata per 8 x 2 min.
- Contrasta il campione posizionando le griglie su una goccia di acetato di uranile all'1% per 2 minuti.
- Incorporare il campione con 50 μL di acetato di uranile allo 0,2% con soluzione di metilcellulosa al 2% per 10 minuti su una palaccia di ghiaccio ricoperta di parafilm.
- Utilizzare anelli in acciaio inossidabile per tenere le griglie e rimuovere il fluido in eccesso con carta da filtro.
- Asciugare all'aria la griglia per 10 minuti mentre si è ancora sul loop.
- Osservare al microscopio elettronico a trasmissione a 80 kV.
3. Etichettatura dei sEV
- Diluire 20 μg di sEV in 1 mL di tampone diluente o lo stesso volume di PBS in 1 mL di tampone diluente per il controllo del colorante.
- Diluire 3 μL di colorante PKH67 o PKH26 in 1 mL di tampone diluente e miscelare mediante pipettaggio.
- Aggiungere il colorante PKH diluito ai sEV diluiti e mescolare mediante pipettaggio. Incubare per 5 minuti al buio a temperatura ambiente. Per un controllo del colorante, mescolare il colorante diluito con PBS diluito dal passaggio 3.1.
- Aggiungere 2 ml di albumina sierica bovina all'1% (BSA) in PBS al tubo con il colorante e la miscela sEV e al tubo di controllo del colorante per assorbire il colorante in eccesso.
- Centrifuga per 1 ora a 110.000 × g a 4 °C. Scartare il surnatante, risuscivare il pellet in 2 ml di PBS e centrifugare per 1 ora a 110.000 × g a 4 °C. Ripetere il lavaggio con PBS e risusediare i sEV etichettati o il controllo del colorante in un volume uguale di PBS.
- Quantificare la quantità di proteine totali con il metodo Bradford.
4. Assorbimento di sEV da parte delle cellule Neuro-2a
- Posizionare le coperture da 18 mm in una piastra a 12 pozzetti e la piastra 10 × 104 cellule Neuro-2a in ciascun pozzetti in un totale di 1 mL di mezzo DMEM completo contenente il 10% di FBS e l'1% di pen-strep.
- Cambiare il mezzo in mezzo impoverito di esosomi DMEM quando la confluenza cellulare è dell'80-90%. Aggiungere 1, 5 o 10 μg di sEV etichettati in ciascun pozzetto per 1, 4 e 24 ore per l'assorbimento dose-dipendente e tempo, oppure aggiungere un volume uguale di controllo del colorante.
5. Culture astrocitiche primarie
- Anestetizzare 4 cuccioli postnatali 4 giorni dopo la nascita inducendo ipotermia.
- Raccogli il cervello in una capsula di Petri da 60 mm contenente hank's Balanced Salt Solution (HBSS) ghiacciata integrata con acido 4-(2-idrossietil)-1-piperazineanesofonico (HEPES) da 10 mM.
- Sezionare entrambi i lobi corticali e rimuovere le meningi. Tritare i tessuti con una lama sterilizzata.
- Trasferire i tessuti in un tubo conico da 15 mL contenente tampone di dissociazione papaina/desossiribonucleasi I e incubare per 20 minuti a 37 °C. Vortice ogni 5 min.
NOTA: Per 4 cortecce di topo, 9 mL di 7,5 U/mL di papaina in HBSS vengono attivati a 37 °C per almeno 30 minuti, filtrati attraverso un filtro a siringa da 0,22 μm e miscelati con desossiribonucleasi I ad una concentrazione finale di 0,1 mg/mL. - Aspirare il surnatante e aggiungere 5 ml di DMEM completo per inattivare l'attività enzimatica. Triturare accuratamente per dissociare i tessuti con una pipetta sierologica di vetro da 5 ml e una pipetta Pasteur lucidata a fiamma.
- Passare la sospensione cellulare attraverso un filtro cellulare da 40 μm e centrifugare le cellule a 250 × g per 5 minuti a 4 °C. Aspirare il mezzo e seminare le cellule in 10 ml di DMEM completo in un pallone da 75 cm2. Sostituire il mezzo surnatante con 15 ml di DMEM medio fresco 4 ore dopo la placcatura.
- Dopo 14 giorni in vitro,trasferire il pallone su uno shaker orbitale per staccare la microglia e gli oligodendrociti a 320 giri/min per 6 ore.
- Tripsinizzare gli astrociti rimanenti utilizzando 5 mL dell'enzima di dissociazione cellulare (Table of Materials) per 10 min a 37 °C. Aggiungere 5 mL di DMEM completo per inattivare l'azione enzimatica e pellettizzare le cellule a 250 × g per 5 min a 4 °C.
- Risuspendare le celle in DMEM completo. Seme 5 × 104 celle su 12 mm #1.5 coverslips in una piastra a 24 pozzetti.
6. Assorbimento di sEV da parte degli astrociti
- Quando gli astrociti raggiungono l'80-90% di confluenza, cambiare il mezzo in mezzo impoverito di esosomi DMEM.
- Aggiungere 1 μg di sEV non etichettati, un volume uguale di controllo del colorante o PBS alle cellule. Utilizzare le cellule per la colorazione 1 ora e 24 ore dopo il trattamento sEV.
7. Immunofluorescenza
- Risciacquare le cellule con PBS 3x e fissarle con il 4% di PFA in PB per 10 minuti a temperatura ambiente.
- Lavare le celle fisse 3 x 5 min con PB e permeabilizzarle utilizzando 0,1% Triton X-100 in PB per 10-15 min e lavare con PB 3 x 5 min.
- Bloccare le cellule con il 5% di siero di capra normale (NGS) in PB per 1 ora a temperatura ambiente.
- Incubare le cellule con anticorpi primari: proteina 2 associata a microtubuli (MAP2A, 1:500) per cellule Neuro-2a o proteina acida fibrillare gliale (GFAP, 1:500) per astrociti primari in NGS/PB fresco al 5% durante la notte a 4 °C con agitazione delicata.
- Lavare 3 x 10 minuti con PB e aggiungere anticorpi secondari coniugati con fluoroforo (Goat Anti-Mouse IgG1, Alexa Fluor 594; o Goat Anti-Mouse IgG H & L, Alexa Fluor 488) in 5% NGS e incubare per 2 ore a temperatura ambiente su un bilanciere.
- Lavare 3 x 10 min con PB e incubare con 1 μg/mL di macchia nucleare 4',6-diamidino-2-fenilindolo (DAPI) per 10 min a temperatura ambiente. Lavare nuovamente le celle 3 volte con PB.
- Montare i coperchi su diapositive #1 utilizzando un mezzo di montaggio antifade. Lasciarli asciugare per una notte al buio e conservare i vetrini preparati a 4 °C fino all'imaging al microscopio confocale.
8. Diffusione in vivo dei sEV
- Eseguire l'iniezione intratecale di 5 μg di sEV non etichettati o marcati sospenati in 10 μL di PBS, o di uguale volume (10 μL) di controllo del colorante (come preparato nel paragrafo 3) in topi C57BL/6.
- Dopo 6 e 18 ore dopo l'iniezione di sEV, anestetizzare profondamente i topi mediante iniezione intraperitoneale di 100 mg/kg di peso corporeo di ketamina e 10 mg/kg di peso corporeo di xilazina.
- Eseguire la perfusione intracardica di topi con soluzione salina allo 0,9% per scovare il sangue, seguita da PFA / PB al 4% ghiacciato appena fatto.
- Sezionare il midollo spinale e fissare in PFA/PB al 4% a 4 °C per 24 ore. Crioproteggere i tessuti in saccarosio al 30% in PB a 4 °C per 24 ore o fino a quando i tessuti affondano. Conservare i tessuti a 4 °C fino all'immunoistochimica.
9. Immunoistochimica
- Incorporare il midollo spinale L4-L5 nel composto O.C.T. Congelare su ghiaccio secco fino a completa solidificazione.
- Sezionare i tessuti a 30 μm (in sezione trasversale per il midollo spinale) usando un criostato e raccogliere le sezioni in una piastra a 24 pozzetti contenente PB. Lavare le sezioni 3 x 5 min con 0,3% Triton in PB.
- Blocca siti di legame non specifici con 5% NGS in 0,3% Triton/PB per 2 ore a temperatura ambiente.
- Anticorpi primari diluiti: Anti-MAP2A (1:500), GFAP (1:1.000), Iba1 per microglia (1:2.000) con 5% NGS in 0,3% Triton/PB, e incubare le sezioni durante la notte a 4 °C su uno shaker.
- Lavare le sezioni 3 x 5 min con lo 0,3% di Triton/PB e aggiungere anticorpi secondari (Donkey Anti-Rabbit IgG Alexa Fluor 488, 1:500, o Goat Anti-Mouse IgG Alexa Fluor 488, 1:500) al 5% NGS/PB per 2 ore a temperatura ambiente.
- Lavare 3 x 5 minuti con PB e incubare le sezioni in 1 μg/mL di DAPI per 10 minuti a temperatura ambiente. Lavare le sezioni 3 x 5 min con PB.
- Montare le sezioni su un vetrino adesivo pulito (Table of Materials) con un pennello fine al microscopio ottico.
- Bagnare il coperchio con il mezzo di montaggio. Curare durante la notte al buio a temperatura ambiente.
- Immagine al microscopio confocale con i rispettivi laser.
Risultati
Dopo l'isolamento dei sEV dai mezzi condizionati RAW 264.7 tramite centrifugazione, nta è stato utilizzato per determinare la concentrazione e la distribuzione dimensionale dei sEV purificati. La dimensione media media delle sEV derivate da RAW 264,7 era di 140 nm e la dimensione delle particelle di picco era di 121,8 nm, confermando che la maggior parte delle particelle rilevabili nella misurazione della diffusione della luce rientrava nell'intervallo di dimensioni degli esosomi o dei sEV a 50-150 nm (Figura 1A). Come suggerito nelle informazioni minime per gli studi sulle vescicole extracellulari 2018 (MISEV2018)23, abbiamo analizzato un insieme di proteine che dovrebbero essere presenti o escluse da popolazioni EV distinte. Il western blotting di sEV, lysate cellulare e mezzi eso-impoveriti ha dimostrato che i campioni proteici derivati da sEV contenevano le proteine marcatori sEV Alix, CD81 e GAPDH. La frazione di lisato cellulare è stata arricchita con la proteina residente nel reticolo endoplasmatico, la calnexina, che era assente nei sEV. Pertanto, la calnexina è servita come marcatore negativo per la contaminazione cellulare (Figura 1B).
Successivamente abbiamo eseguito esperimenti dose-risposta e time-course per l'assorbimento di sEV in vitro. Le cellule Neuro-2a sono state incubate con una singola dose di 1 μg di sEV con PKH67 per 1, 4 e 24 ore, a seguito della quale è stato esaminato l'assorbimento di diverse concentrazioni di sEV (1, 5 e 10 μg) a 1 ora. I risultati dell'NTA hanno indicato che 1 μg di proteine in media era pari a ~ 1 x 109 particelle. In parallelo, sono stati testati anche PBS, sEV senza etichetta e controlli da solo colorante. Abbiamo osservato che l'assorbimento di sEV si è verificato a 1 ora (Figura 2A) e per gli sEV da 1, 5 e 10 μg (Figura 2B). La fluorescenza potrebbe essere rilevata a 4 ore per 5 e 10 μg di sEV (Figura 2C) dopo l'incubazione. Successivamente, è stato esaminato l'assorbimento di sEV con PKH26 da parte di astrociti primari (Figura 3). La fluorescenza massima dall'assorbimento di sEV negli astrociti corticali primari si è verificata a 24 ore. I sEV non etichettati non hanno mostrato fluorescenza, dimostrando che l'autofluorescenza sEV non contribuisce in modo significativo ai falsi positivi (Figura supplementare S1A).
Successivamente, gli sEV etichettati sono stati iniettati per via intratecale nei topi per valutare la consegna e l'assorbimento di sEV da parte di diverse cellule del midollo spinale utilizzando l'immunoistochimica e la microscopia confocale. Abbiamo colorato per MAP2 come marcatore neuronale, GFAP come marcatore astrocitico e IBA1 come marcatore microgliale. I neuroni (Figura 4), gli astrociti (Figura 5) e le cellule microgliali (Figura 6) hanno tutti assunto sEV con PKH26 e la fluorescenza massima di sEV è stata osservata a 6 ore dopo l'iniezione. Mentre i sEV non sempre si sono colocalizzati con i marcatori cellulari, non abbiamo osservato alcun assorbimento differenziale da parte delle cellule del SNC. L'iniezione intratecale con 5 μg di sEV RAW 264.7 non etichettati o il controllo del colorante non hanno mostrato una fluorescenza significativa (Figura supplementare S1B). Segnali fluorescenti sono stati osservati nelle meningi, sia 6 h che 18 h dopo l'iniezione di sEV (Figura supplementare S1C).

Figura 1: Caratterizzazione di sEV RAW 264.7 purificati. (A) Le dimensioni e la concentrazione dei sEV sono state determinate utilizzando NanoSight NS300. Le particelle sono state tracciate e dimensionate in base al moto browniano e al coefficiente di diffusione. La distribuzione dimensionale dei sEV è mostrata in nm. La concentrazione di sEV è stata espressa come particelle/mL. (B) Western blot di proteine derivate da sEV purificati, lisato cellulare e mezzi impoveriti di esosomi utilizzando i marcatori sEV ALIX, GAPDH e CD81. Il marcatore proteico del reticolo endoplasmatico, la calnexina, funge da controllo per monitorare la contaminazione cellulare nei preparati sEV. (C) La microscopia elettronica a trasmissione ha dimostrato le dimensioni e la morfologia dei sEV. Barra della scala = 100 nm. Abbreviazioni: sEV = piccole vescicole extracellulari; ALIX = Proteina X che interagisce con alfa-1,3/1,6-mannosiltransferasi (ALG-2); GAPDH = gliceraldeide 3-fosfato deidrogenasi; CD81 = cluster di differenziazione 81. Fare clic qui per visualizzare una versione più grande di questa figura.
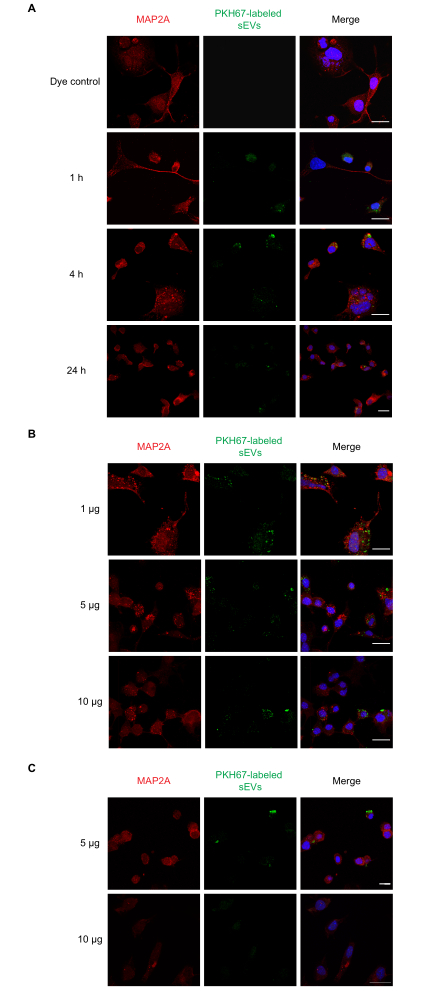
Figura 2: Assorbimento di sEV RAW 264.7 etichettati da parte delle cellule Neuro-2a. (A) I SEV con etichetta PKH67 (1 μg) sono stati aggiunti alle cellule Neuro-2a in coltura per 1, 4 o 24 h. L'assorbimento di sEV è stato osservato in tutti i punti temporali con la microscopia confocale. (B) Gli sEV con etichetta PKH67 (1, 5 o 10 μg) sono stati aggiunti alle cellule Neuro-2a per 1 ora. (C) I SEV etichettati PKH67 (5 o 10 μg) sono stati aggiunti alle cellule Neuro-2a per 4 h. L'assorbimento di sEV è stato osservato in tutti i gruppi di dosaggio con microscopia confocale. I gruppi di controllo negativi trattati con colorante PKH da solo non hanno mostrato colorazione sEV (Figura supplementare S1). Le cellule Neuro-2a sono state immunomacizzate con MAP2A (sonde con Alexa Fluor 594, mostrato in rosso), mentre i nuclei cellulari sono stati colorati con DAPI (mostrato in blu) e sEV con PKH67 (mostrato in verde). Barra della scala = 50 μm. Abbreviazioni: sEV = piccole vescicole extracellulari; MAP2A = proteina 2A associata ai microtubuli; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Assorbimento di sEV RAW 264.7 con marchio PKH26 da parte di astrociti corticali primari di topo. Un μg di sEV è stato etichettato con colorante PKH26 e aggiunto al terreno di coltura primaria degli astrociti. L'assorbimento di sEV è stato osservato a 1 e 24 ore dopo l'aggiunta utilizzando un microscopio a scansione laser confocale. Gli astrociti sono stati colorati con GFAP (sondato con Alexa Fluor 488, mostrato in rosso), mentre i nuclei cellulari sono stati controstainati con DAPI (mostrato in blu) e gli sEV sono stati precedentemente colorati con PKH26 (mostrato in verde). Barra della scala = 20 μm. Il colorante PKH26 da solo fungeva da controllo negativo per la colorazione sEV. Abbreviazioni: sEV = piccole vescicole extracellulari; GFAP = proteina acida fibrillare gliale; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Assorbimento dei neuroni RAW 264.7 sEVsin. I sEV con etichetta PKH26 sono stati iniettati per via intratecale nei topi; 6 e 18 ore dopo, i topi sono stati perfusi con il 4% di PFA e il midollo spinale è stato isolato e sezionato a 30 μm. Le sezioni del midollo spinale sono state immunostampate con un marcatore cellulare (sondato con Alexa Fluor 488, mostrato in rosso) e una controstain nucleare DAPI (mostrato in blu), mentre i sEV erano precedentemente etichettati con PKH26 (mostrato in verde). Le sezioni del midollo spinale sono state immunostainate per MAP2A per visualizzare i neuroni (rosso). La microscopia confocale mostra sEV nei neuroni MAP2A-positivi in diversi punti temporali. Il controllo negativo, il gruppo colorante PKH26 da solo, non ha mostrato colorazione sEV. Barra della scala = 20 μm. Abbreviazioni: sEV = piccole vescicole extracellulari; PFA = paraformaldeide; MAP2A = proteina 2A associata ai microtubuli; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Assorbimento di RAW 264.7 sEV negli astrociti. I sEV con etichetta PKH26 sono stati iniettati per via intratecale nei topi; 6 e 18 ore dopo, i topi sono stati perfusi con il 4% di PFA e il midollo spinale è stato isolato e sezionato a 30 μm. Le sezioni del midollo spinale sono state immunostampate con un marcatore cellulare (sondato con Alexa Fluor 488, mostrato in rosso) e una controstain nucleare DAPI (mostrato in blu), mentre i sEV erano precedentemente etichettati con PKH26 (mostrato in verde). Le sezioni del midollo spinale sono state immunostained per GFAP per visualizzare gli astrociti (rosso). La microscopia confocale mostra sEV negli astrociti GFAP-positivi in diversi punti temporali. Il controllo negativo, il gruppo colorante PKH26 da solo, non ha mostrato colorazione sEV. Barra della scala = 20 μm. Abbreviazioni: sEV = piccole vescicole extracellulari; PFA = paraformaldeide; GFAP = proteina acida fibrillare gliale; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.
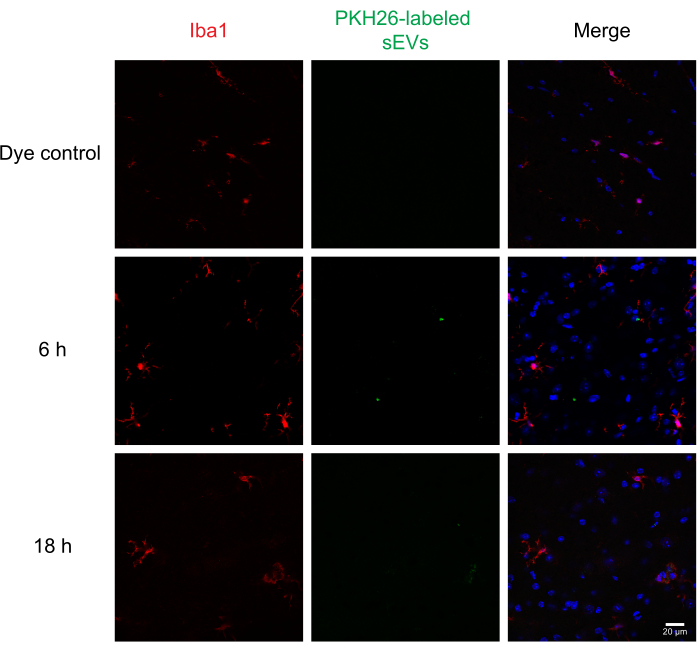
Figura 6: Assorbimento di RAW 264.7 sEV in microglia. I sEV con etichetta PKH26 sono stati iniettati per via intratecale nei topi; 6 e 18 ore dopo, i topi sono stati perfusi con il 4% di PFA e il midollo spinale è stato isolato e sezionato a 30 μm. Le sezioni del midollo spinale sono state immunostampate con un marcatore cellulare (sondato con Alexa Fluor 488, mostrato in rosso) e una controstain nucleare DAPI (mostrato in blu), mentre i sEV erano precedentemente etichettati con PKH26 (mostrato in verde). Le sezioni del midollo spinale sono state immunosostenate per IBA1 per visualizzare la microglia (rossa). La microscopia confocale mostra sEV nella microglia IBA1-positiva in diversi punti temporali. Il controllo negativo, il gruppo colorante PKH26 da solo, non ha mostrato colorazione sEV. Barra della scala = 20 μm. Abbreviazioni: sEV = piccole vescicole extracellulari; PFA = paraformaldeide; IBA1 = molecola adattatrice legante il calcio ionizzato 1; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare S1: Assorbimento di sEV RAW 264.7 etichettati da parte di astrociti corticali primari di topo e nel midollo spinale. (A) Controlli per l'assorbimento di sEV RAW 264.7 con marchio PKH26 da parte di astrociti corticali primari di topo. Un μg di sEV non etichettati risusipenati in PBS o un volume uguale di PBS è stato aggiunto in parallelo al terreno di coltura degli astrociti. Nessuna fluorescenza è stata osservata a 1 ora per PBS e il controllo non etichettato utilizzando un microscopio a scansione laser confocale. Gli astrociti sono stati colorati con GFAP (sondato con Alexa Fluor 488, mostrato in rosso), mentre i nuclei sono stati controbilanciati con DAPI (blu) e i sEV senza etichetta sono stati visualizzati sotto lo stesso canale Alexa Fluor 546 dei SEV etichettati PKH26. Barra della scala = 50 μm. (B) Controlli per l'assorbimento di RAW 264.7 sEV con etichetta PKH26 da parte del midollo spinale del topo in vivo. Cinque μg di sEV non etichettati o controllo del colorante sono stati iniettati per via intratecale nei topi. Ancora una volta, i segnali fluorescenti non sono stati osservati per i sEV non etichettati o il controllo del solo colorante utilizzando un microscopio a scansione laser confocale. Gli astrociti sono stati colorati con GFAP (sondato con Alexa Fluor 488, mostrato in rosso), mentre i nuclei sono stati controbatteti con DAPI (blu) e gli sEV non etichettati sono stati visualizzati sotto lo stesso canale Alexa Fluor 546 dei SEV etichettati PKH26. Barra di scala = 50 μm. (C)Le immagini rappresentative rivelano la presenza di RAW 264.7 sEV nelle meningi spinali di topo 6 ore e 18 ore dopo il parto intratecale. Cinque μg di sEV sono stati etichettati con colorante PKH26 (mostrato in verde) e i nuclei sono stati controbilanciati con DAPI (mostrato in blu). Gli asterischi indicano l'arteria spinale anteriore. Barra della scala = 50 μm. Abbreviazioni: sEV = piccole vescicole extracellulari; PBS = soluzione salina tamponata con fosfato; GFAP = proteina acida fibrillare gliale; DAPI = 4′,6-diamidino-2-fenilindolo. Fare clic qui per scaricare questo file.
Discussione
In questo protocollo, abbiamo mostrato l'etichettatura dei sEV con coloranti PKH e la visualizzazione del loro assorbimento nel midollo spinale. I coloranti fluorescenti lipofili PKH sono ampiamente utilizzati per l'etichettatura delle cellule mediante citometria a flusso e microscopia fluorescente3,5,6,12,24,25. A causa della loro emivita relativamente lunga e della bassa citotossicità, i coloranti PKH possono essere utilizzati per una vasta gamma di studi di tracciamento cellulare in vivo e in vitro 26,27. Sebbene un'eccellente ritenzione della membrana e la stabilità biochimica siano vantaggiose, l'intercalazione di sonde fluorescenti con contaminanti lipoproteici purificati con sEV può compromettere l'interpretazione dell'internalizzazione sEV e degli studi funzionali. Pertanto, la purificazione e l'etichettatura dei sEV sono passaggi critici nel protocollo perché la persistenza dei coloranti con contaminanti può portare a un'interpretazione errata della distribuzione in vivo 28. L'inclusione di controlli è fondamentale per evitare segnali di fluorescenza falsi positivi dovuti all'etichettatura non specifica delle particelle e alla lunga emivita di questi coloranti.
L'aggregazione e la formazione di micelle di coloranti lipofili possono anche produrre falsi segnali. Abbiamo affrontato il problema del colorante libero o non legato includendo un controllo del solo colorante e visualizzando l'assorbimento ev nei momenti precedenti. Un'importante limitazione riportata per l'etichettatura PKH è che numerose nanoparticelle PKH26 si formano durante l'etichettatura del colorante PKH26 dei sEV. Sebbene non incluso in questo protocollo, è stato riferito che le nanoparticelle di PKH26 possono essere rimosse da un gradiente di saccarosio29. Un altro studio ha valutato l'effetto dell'etichettatura PKH sulla dimensione dei sEV da parte di NTA e ha riportato un aumento delle dimensioni dopo l'etichettatura PKH30. Tuttavia, i coloranti PKH fungono da tracciante pragmatico e prezioso per mostrare dove i sEV hanno attraversato. Un'altra limitazione di questo studio è che non abbiamo quantificato i sEV poiché questo protocollo si concentra sulla conferma dell'assorbimento cellulare dopo il parto intratecale. Recentemente sono state sviluppate nuove sonde a membrana a base di cianina per l'imaging a fluorescenza altamente sensibile di sEV senza alterare le dimensioni o generare artefatti, come la formazione di nanoparticelle PKH31,e senza dubbio migliorerà i futuri studi di etichettatura.
Sebbene i macrofagi svolgano un ruolo importante nella neuroinfiammazione, esercitano anche funzioni neuroprotettive consegnando il loro carico tramite esosomi32. I nostri studi dimostrano che i sEV derivati da macrofagi etichettati sonoassorbiti dalle cellule Neuro-2a, dagli astrociti primari e nel midollo spinale lombare dopo somministrazione intratecale. I risultati indicano che un tempo di incubazione più lungo può portare a una minore intensità del segnale sEV, che potrebbe essere attribuita alla degradazione dei sEV o alla divisione cellulare da parte delle cellule Neuro-2a incoltura 33,34. Sebbene a basso rendimento, questo protocollo per la visualizzazione di sEV etichettati nel midollo spinale può essere utilizzato per studi di convalida iniziali che confermano l'assorbimento di sEV prima di indagare l'impatto funzionale dei sEV somministrati per via intratecale. Poiché abbiamo osservato un assorbimento di sEV generalmente simile in diversi tipi di cellule del SNC, il processo di assorbimento sembra non essere selettivo. Se l'autofluorescenza è un problema nell'imaging, i sEV non etichettati possono essere utilizzati come controllo aggiuntivo per negare l'autofluorescenza sEV durante l'imaging di tessuti e colture. Sebbene la dose e la via di somministrazione dei sEV possano influenzare il modello di biodistribuzione11, questo protocollo non è ottimizzato per l'analisi quantitativa dell'assorbimento di sEV. Diversi approcci diversi e varie strategie di imaging vengono impiegati per studiare i sEV, e questi vengono continuamente perfezionati e ottimizzati per il tracciamento in vivo di sEV2.
Questo protocollo è pensato per essere solo un approccio per confermare l'assorbimento di sEV. Come per tutti i protocolli, la convalida incrociata utilizzando approcci multimodali può essere utile. In particolare, l'assorbimento di sEV può essere confermato studiando il trasferimento di carichi biomolecolari alle cellule e ai tessuti riceventi. Se lo sperimentatore conosce la composizione del miRNA dei sEV consegnati, un approccio alternativo per confermare il trasferimento di sEV sarebbe quello di verificare i cambiamenti di miRNA nelle cellule riceventi o determinare i cambiamenti nei livelli di espressione dei geni bersaglio per i miRNA trasferiti. I campioni trattati con PBS possono essere utilizzati come controllo per questo approccio. Nel complesso, questi risultati supportano il concetto che i sEV derivati dai macrofagi sono assorbiti dalle cellule del SNC in vitro e in vivo. Questo protocollo può essere utilizzato per studiare il ruolo dei sEV nei disturbi spinali, nel dolore e nell'infiammazione e per determinare se i sEV possono essere sviluppati come veicoli cellulari per la consegna di piccole molecole terapeutiche, RNA e proteine.
Divulgazioni
Gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo studio è stato supportato da sovvenzioni del NIH NINDS R01NS102836 e del Pennsylvania Department of Health Commonwealth Universal Research Enhancement (CURE) assegnato a Seena K. Ajit. Ringraziamo il Dr. Bradley Nash per la lettura critica del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Amicon Ultra 0.5 mL centrifugal filters | MilliporeSigma | Z677094 | |
| Anti-Alix Antibody | Abcam | ab186429 | 1:1000 |
| Anti-Calnexin Antibody | Abcam | Ab10286 | 1:1000 |
| Anti-CD81 Antibody | Santa Cruz Biotechnology | sc-166029 | 1:1000 |
| Anti-GAPDH Monoclonal Antibody (14C10) | Cell Signaling Technology | 2118 | 1:1000 |
| Anti-Glial Fibrillary Acidic Protein Antibody | Sigma-Aldrich | MAB360 | 1:500 for IF; 1:1000 for IHC |
| Anti-Iba1 Antibody | Wako | 019-19741 | 1:2000 |
| Anti-MAP2A Antibody | Sigma-Aldrich | MAB378 | 1:500 |
| Bovine Serum Albumin (BSA) | VWR | 0332 | |
| Cell Strainer, 40 μm | VWR | 15-1040-1 | |
| Centrifuge Tubes | Thermo Scientific | 3118-0050 | 12,000 x g |
| Coverslip, 12-mm, #1.5 | Electron Microscopy Sciences | 72230-01 | |
| Coverslip, 18-mm, #1.5 | Electron Microscopy Sciences | 72222-01 | |
| DAPI | Sigma-Aldrich | D9542-1MG | 1 µg/mL |
| DC Protein Assay | Bio-Rad | 500-0116 | |
| Deoxyribonuclease I (DNAse I) | MilliporeSigma | D4513-1VL | |
| Donkey Anti-Rabbit IgG H&L (HRP) | Abcam | ab16284 | 1:10000 |
| Donkey Anti-Rabbit IgG H&L, Alexa Fluor 488 | Invitrogen | A-21206 | 1:500 |
| Double Frosted Microscope Slides, #1 | Thermo Scientific | 12-552-5 | |
| DPBS without Calcium and Magnesium | Corning | 21-031-CV | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10-013-CV | |
| Exosome-Depleted Fetal Bovine Serum | Gibco | A27208-01 | |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| FluorChem M imaging system | ProteinSimple | ||
| FV3000 Confocal Microscope | Olympus | ||
| Goat Anti-Mouse IgG H&L (HRP) | Abcam | ab6789 | 1:10000 |
| Goat Anti-Mouse IgG H&L, Alexa Fluor 488 | Invitrogen | A-11001 | 1:500 |
| Goat Anti-Mouse IgG1, Alexa Fluor 594 | Invitrogen | A-21125 | 1:500 |
| Hank's Balanced Salt Solution (HBSS) | VWR | 02-0121 | |
| HEPES | Gibco | 15630080 | |
| HRP Substrate | Thermo Scientific | 34094 | |
| Intercept blocking buffer, TBS | LI-COR Biosciences | 927-60001 | |
| Laemmli SDS Sample Buffer | Alfa Aesar | AAJ61337AC | |
| Micro Cover Glass, #1 | VWR | 48404-454 | |
| Microm HM550 | Thermo Scientific | ||
| NanoSight NS300 system | Malvern Panalytical | ||
| NanoSight NTA 3.2 software | Malvern Panalytical | ||
| Neuro-2a Cell Line | ATCC | CCL-131 | |
| Normal Goat Serum | Vector Laboratories | S-1000 | |
| O.C.T Compound | Sakura Finetek | 4583 | |
| Papain | Worthington Biochemical Corporation | NC9597281 | |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PKH26 | Sigma-Aldrich | MINI26-1KT | |
| PKH67 | Sigma-Aldrich | MINI67-1KT | |
| Protease Inhibitor Cocktail | Thermo Scientific | 1862209 | |
| PVDF Transfer Membrane | MDI | SVFX8302XXXX101 | |
| RAW 267.4 Cell Line | ATCC | TIB-71 | |
| RIPA Buffer | Sigma-Aldrich | R0278 | |
| Sodium Chloride | AMRESCO | 0241-2.5KG | |
| Superfrost Plus Gold Slides | Thermo Scientific | 15-188-48 | adhesive slides |
| T-75 Flasks | Corning | 431464U | |
| Tecnai 12 Digital Transmission Electron Microscope | FEI Company | ||
| TEM Grids | Electron Microscopy Sciences | FSF300-cu | |
| Tris-Glycine Protein Gel, 12% | Invitrogen | XP00120BOX | |
| Tris-Glycine SDS Running Buffer | Invitrogen | LC26755 | |
| Tris-Glycine Transfer Buffer | Invitrogen | LC3675 | |
| TrypLE Express | Gibco | 12605028 | cell dissociation enzyme |
| Triton X-100 | Acros Organics | 327371000 | |
| Trypsin, 0.25% | Corning | 25-053-CL | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Ultracentrifuge Tubes | Beckman | 344058 | 110,000 x g |
Riferimenti
- Mulcahy, L. A., Pink, R. C., Carter, D. R. F. Routes and mechanisms of extracellular vesicle uptake. Journal of Extracellular Vesicles. 3 (1), 24641(2014).
- Betzer, O., et al. Advances in imaging strategies for in vivo tracking of exosomes. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 12 (2), 1594(2020).
- Dehghani, M., Gaborski, T. R. Fluorescent labeling of extracellular vesicles. Methods in Enzymology. 645, 15-42 (2020).
- González, M. I., et al. Covalently labeled fluorescent exosomes for in vitro and in vivo applications. Biomedicines. 9 (1), 81(2021).
- Chuo, S. T. -Y., Chien, J. C. -Y., Lai, C. P. -K. Imaging extracellular vesicles: current and emerging methods. Journal of Biomedical Science. 25 (1), 91(2018).
- vander Vlist, E. J., Nolte-'tHoen, E. N. M., Stoorvogel, W., Arkesteijn, G. J. A., Wauben, M. H. M. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7 (7), 1311-1326 (2012).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Heinrich, L., et al. Confocal laser scanning microscopy using dialkylcarbocyanine dyes for cell tracing in hard and soft biomaterials. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81 (1), 153-161 (2007).
- Haney, M. J., et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release. 207, 18-30 (2015).
- Grange, C., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a model of acute kidney injury monitored by optical imaging. International Journal of Molecular Medicine. 33 (5), 1055-1063 (2014).
- Wiklander, O. P., et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. Journal of Extracellular Vesicles. 4, 26316(2015).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nature Communications. 6 (1), 7029(2015).
- Deddens, J. C., et al. Circulating extracellular vesicles contain miRNAs and are released as early biomarkers for cardiac injury. Journal of Cardiovascular Translational Research. 9 (4), 291-301 (2016).
- Montecalvo, A., et al. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 119 (3), 756-766 (2012).
- Escrevente, C., Keller, S., Altevogt, P., Costa, J. Interaction and uptake of exosomes by ovarian cancer cells. BMC Cancer. 11, 108(2011).
- Cho, E., et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. Journal of Controlled Release. 279, 326-335 (2018).
- Mantel, P. Y., et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host & Microbe. 13 (5), 521-534 (2013).
- Porro, C., Trotta, T., Panaro, M. A. Microvesicles in the brain: Biomarker, messenger or mediator. Journal of Neuroimmunology. 288, 70-78 (2015).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Matsumoto, J., et al. Transmission of alpha-synuclein-containing erythrocyte-derived extracellular vesicles across the blood-brain barrier via adsorptive mediated transcytosis: another mechanism for initiation and progression of Parkinson's disease. Acta Neuropathologica Communications. 5 (1), 71(2017).
- Matsumoto, J., Stewart, T., Banks, W. A., Zhang, J. The transport mechanism of extracellular vesicles at the blood-brain barrier. Current Pharmaceutical Design. 23 (40), 6206-6214 (2017).
- Shaimardanova, A., et al. Extracellular vesicles in the diagnosis and treatment of central nervous system diseases. Neural Regeneration Research. 15 (4), 586-596 (2020).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Hoen, E. N. M. N. -t, et al. Quantitative and qualitative flow cytometric analysis of nanosized cell-derived membrane vesicles. Nanomedicine: Nanotechnology, Biology and Medicine. 8 (5), 712-720 (2012).
- Gangadaran, P., Hong, C. M., Ahn, B. -C. An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Frontiers in Pharmacology. 9, 169(2018).
- Teare, G. F., Horan, P. K., Slezak, S. E., Smith, C., Hay, J. B. Long-term tracking of lymphocytes in vivo: the migration of PKH-labeled lymphocytes. Cellular Immunology. 134 (1), 157-170 (1991).
- Kuffler, D. P. Long-term survival and sprouting in culture by motoneurons isolated from the spinal cord of adult frogs. Journal of Comparative Neurology. 302 (4), 729-738 (1990).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Pužar Dominkuš, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta. Biomembranes. 1860 (6), 1350-1361 (2018).
- Dehghani, M., Gulvin, S. M., Flax, J., Gaborski, T. R. Systematic evaluation of PKH labelling on extracellular vesicle size by nanoparticle tracking analysis. Scientific Reports. 10 (1), 9533(2020).
- Shimomura, T., et al. New lipophilic fluorescent dyes for labeling extracellular vesicles: characterization and monitoring of cellular uptake. Bioconjugate Chemistry. 32 (4), 680-684 (2021).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Polanco, J. C., Li, C., Durisic, N., Sullivan, R., Götz, J. Exosomes taken up by neurons hijack the endosomal pathway to spread to interconnected neurons. Acta Neuropathologica Communications. 6 (1), 10(2018).
- Jurgielewicz, B. J., Yao, Y., Stice, S. L. Kinetics and specificity of HEK293T extracellular vesicle uptake using imaging flow cytometry. Nanoscale Research Letters. 15 (1), 170(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon