Method Article
امتصاص الفلورسنت المسمى Vesicles صغيرة خارج الخلية في المختبر وفي الحبل الشوكي
In This Article
Summary
نحن نصف بروتوكول لتسمية الحويصلات الصغيرة المشتقة من الضامة خارج الخلية مع أصباغ PKH ومراقبة امتصاصها في المختبر وفي الحبل الشوكي بعد الولادة داخل العين.
Abstract
الحويصلات الصغيرة خارج الخلية (sEVs) هي الحويصلات 50-150 نانومتر تفرزها جميع الخلايا ومتواجدة في سوائل الجسم. تقوم المركبات الذاتية بنقل الجزيئات الحيوية مثل الحمض النووي الريبي والبروتينات والدهون من المتبرعين إلى خلايا القبول، مما يجعلها وسطاء إشارات رئيسية بين الخلايا. في الجهاز العصبي المركزي (CNS)، يمكن أن تتوسط أجهزة التلفاز للإشارات بين الخلايا، بما في ذلك التفاعلات العصبية المناعية. يمكن دراسة وظائف sEV عن طريق تتبع امتصاص sEVs المسمى في الخلايا المتلقية في المختبر وفي الجسم الحي. تصف هذه الورقة وضع العلامات على المركبات ذاتية الدفع من الوسائط المكيفة لخلايا الضامة RAW 264.7 باستخدام صبغة غشاء PKH. فإنه يظهر امتصاص تركيزات مختلفة من sEVs المسمى في نقاط زمنية متعددة من قبل خلايا Neuro-2a والخلايا الفلكية الأولية في المختبر. كما يظهر امتصاص sEVs تسليمها intrathecally في الخلايا العصبية الحبل الشوكي الماوس، والخلايا الفلكية، وmicroglia تصورها المجهر confocal. تظهر النتائج التمثيلية تباينا يعتمد على الوقت في امتصاص الخلايا المختلفة للمركبات الكهربائية المستقلة ، مما يمكن أن يساعد في تأكيد الولادة الناجحة للمركبات الكهربائية في الحبل الشوكي.
Introduction
الحويصلات الصغيرة خارج الخلية (sEVs) هي حويصلات نانوية مشتقة من الأغشية مع نطاق حجم يتراوح بين 50-150 نانومتر. أنها تنشأ من أجسام متعددة المركبات (MVBs) ويتم تحريرها من الخلايا عند دمج MVBs مع غشاء البلازما. تحتوي المركبات الذاتية على ميرناس، ورناس، وبروتينات، ودهون نشطة بيولوجيا، ويتم نقل هذه الجزيئات بين الخلايا في شكل اتصال من خلية إلى خلية. يمكن استيعابها بواسطة الخلايا المتلقية بواسطة مجموعة متنوعة من المسارات الانسطية، ويتم التوسط في التقاط هذه المركبات من قبل الخلايا المتلقية من خلال التعرف على جزيئات السطح على كل من المركبات الكهربائية والخلايا المستهدفة1.
اكتسبت sEVs الاهتمام بسبب قدرتها على إحداث تغييرات جزيئية وفينوطيبيك في الخلايا المقبولة ، وفائدتها كعامل علاجي ، وإمكاناتها كناقلين لجزيئات الشحن أو العوامل الدوائية. نظرا لصغر حجمها ، يمكن أن يكون تصوير وتتبع المركبات ذاتية الدفع تحديا ، خاصة بالنسبة للدراسات الحية والإعدادات السريرية. لذلك ، تم تطوير العديد من الطرق لتسمية وصور sEVs للمساعدة في التوزيع الحيوي وتتبع في المختبر وفي الجسم الحي2.
التقنية الأكثر شيوعا لدراسة التوزيع الحيوي SEV والتفاعلات الخلية المستهدفة ينطوي على وضع العلامات عليها مع جزيئات صبغ الفلورسنت3،4،5،6،7. وصفت المركبات الكهربائية في البداية مع الأصباغ غشاء الخلية التي كانت تستخدم عادة لتصوير الخلايا. هذه الأصباغ الفلورية وصمة عار عموما ثنائي الطبقة الدهون أو البروتينات ذات الفائدة على sEVs. العديد من الأصباغ lipophilic عرض إشارة الفلورسنت قوية عندما أدرجت في السيتوسول، بما في ذلك دير (1،1′-ديوكوتاديسيل-3,3′,3′-tetramethylindotricarbocyanine يوديد), ديال (1, 1′-dioctadecyl-3, 3، 3′، 3′-tetramethyl إندوكاربواسيانين بيركلورات)، ودي دي دي (1، 1′-ديوكوتاديسيل-3، 3، 3′-tetramethyl إندوكاربواسيانين 4-chlorobenzenesulfonate الملح)8،9،10،11.
الأصباغ الدهنية الأخرى، مثل PKH67 و PKH26، لديها مجموعة رأس قطبية فلورية للغاية وذيل هيدروكربوني طويل يتداخل بسهولة في أي بنية دهون ويؤدي إلى احتباس صبغ طويل الأجل وفلورسنس مستقر12. يمكن للأصباغ PKH أيضا تسمية المركبات الكهربائية ، والتي تسمح بدراسة خصائص EV في الجسم الحي13. وقد استخدمت العديد من الأصباغ الأخرى لمراقبة exosomes باستخدام المجهر الفلوري وتدفق قياس الخلايا، بما في ذلك الأصباغ تسمية الدهون14 والأصباغ نفاذية الخلية مثل carboxyfluorescein diacetate succinimidyl استر (CFDA-SE)15،16 وكالسين أسيتوكسميثيل (AM) استر17.
وقد وفرت دراسات المحادثات المتقاطعة بوساطة SEV بين خلايا مختلفة في الجهاز العصبي المركزي رؤى هامة حول الإمراض من الأمراض العصبية والعصبية18. على سبيل المثال، يمكن أن SEVs من الخلايا العصبية نشر الببتيدات بيتا اميلويد والبروتينات تاو الفوسفورية والمساعدة في الإمراض من مرض الزهايمر19. بالإضافة إلى ذلك ، تحتوي المركبات الكهربائية المشتقة من الكريات الحمراء على كميات كبيرة من ألفا سينوكلين ويمكن أن تعبر حاجز الدم في الدماغ وتسهم في أمراض باركنسون20. قدرة SEVs لعبور الحواجز الفسيولوجية21 ونقل الجزيئات الحيوية لاستهداف الخلايا يجعلها أدوات مريحة لتقديم الأدوية العلاجية إلى CNS22.
تصور امتصاص SEV من قبل عدد لا يحصى من خلايا الجهاز العصبي المركزي في الحبل الشوكي ستمكن كل من الدراسات الميكانيكية وتقييم الفوائد العلاجية للمركبات ذاتية المنشأ تدار من مصادر خلوية مختلفة. تصف هذه الورقة منهجية تسمية المركبات الكهربائية المشتقة من الضامة وصورة امتصاصها في المختبر وفي الجسم الحي في الحبل الشوكي القطني بواسطة الخلايا العصبية والخلايا الدقيقة والخلايا الفلكية لتأكيد تسليم SEV نوعيا عن طريق التصور.
Protocol
ملاحظة: تم تنفيذ جميع الإجراءات وفقا لدليل المعاهد القومية للصحة لرعاية واستخدام المختبر ووافقت عليها اللجنة المؤسسية للعناية بالحيوانات واستخدامها التابعة لكلية الطب بجامعة دريكسل. واستخدمت فئران CD-1 الحامل في الوقت المناسب في زراعة الاسطوانة الفلكية، وتم استقبال جميع السدود بعد 15 يوما من التلقيح. تم استخدام الفئران C57BL/6 التي يبلغ عمرها عشرة أسابيع في تجارب امتصاص الجسم الحي.
1. عزل sEVs من خلايا الضامة RAW 264.7
- الثقافة RAW 264.7 خلايا في 75 سم2 قوارير في المتوسط DMEM الإكسوسوم المنضب تحتوي على 10٪ مصل البقر الجنيني المنضب exosome (FBS) و 1٪ البنسلين-streptomycin (القلم العقدية) لمدة 24-48 ساعة.
- جمع 300 مل من أجهزة الطرد المركزي والمتوسطة مكيفة في 300 × غرام لمدة 10 دقيقة في 4 درجة مئوية.
- جمع supernatant والطرد المركزي في 2000 × غرام لمدة 20 دقيقة في 4 درجة مئوية.
- نقل الناطور إلى أنابيب الطرد المركزي، أجهزة الطرد المركزي لمدة 35 دقيقة في 12،000 × غرام في 4 درجة مئوية.
- جمع supernatant ومرشح من خلال مرشح حقنة 0.22 ميكرومتر.
- نقل إلى أنابيب الطرد المركزي للغاية والطرد المركزي لمدة 80 دقيقة في 110،000 × غرام في 4 درجة مئوية.
- تخزين supernatant (المتوسطة المنضب exosome) ، وإعادة إنفاق بيليه في 2 مل من المالحة 1x الفوسفات العازلة (PBS) ، والطرد المركزي لمدة 1 ساعة في 110000 × غرام في 4 درجة مئوية.
- Resuspend بيليه في 100 ميكرولتر من برنامج تلفزيوني لمزيد من التوصيف باستخدام تحليل تتبع الجسيمات النانوية (NTA) ومجهر الإلكترون الإرسال (TEM) أو في المقايسة الإشعاعية (RIPA) العازلة للنشاف الغربي.
2. توصيف المركبات الكهربائية
- تحليل تتبع الجسيمات النانوية (NTA)
ملاحظة: تم قياس توزيع الحجم وعدد/تركيز الجسيمات من المركبات ذاتية التنقية من خلايا RAW 264.7 بواسطة NTA.- تمييع sEVs في برنامج تلفزيوني تمت تصفيته للحصول على 20-60 الحويصلات لكل مجال من مجالات الرؤية لتتبع الأمثل.
- أدخل العينة المخففة في خلية تدفق باستخدام مضخة حقنة بمعدل تدفق ثابت.
- خذ 3-5 أشرطة الفيديو من 30 ق لكل منهما. تعيين سرعة مصراع الكاميرا وكسب، والتركيز يدويا إعدادات الكاميرا لأقصى عدد من الحويصلات لتكون مرئية وقادرة على أن يتم تعقب وتحليلها.
- تقدم العينات بين كل تسجيل لإجراء قياسات النسخ المتماثل. تحسين إعدادات NTA بعد الاستحواذ والحفاظ على الإعدادات ثابتة بين العينات.
- تحليل كل فيديو باستخدام برنامج NTA للحصول على متوسط حجم وتركيز الحويصلات.
- إجراء جميع قياسات NTA مع إعدادات النظام متطابقة لتحقيق الاتساق.
- لطخة غربية
- قياس كميات البروتين الإجمالية في sEVs، lysates الخلية، والوسائط المنضب exosome باستخدام مجموعة اختبار البروتين وفقا لتعليمات الشركة المصنعة.
- لإعداد lysate الخلية، والثقافة الخلايا RAW 264.7 في 75 سم2 قوارير حتى التقاء 80-90٪. فصل الخلايا مع 0.25٪ تريبسين لمدة 10-15 دقيقة, تحييد تريبسين مع وسائل الإعلام الثقافة, بيليه الخلايا عن طريق الغزل في 400 × غرام لمدة 5 دقائق. إعادة إنفاق الخلايا في وسط نمو جديد.
- عد الخلايا باستخدام مقياس الدم ونقل 1 × 106 خلايا إلى أنبوب آخر. غسل الخلايا مع برنامج تلفزيوني مرتين باستخدام نفس ظروف الطرد المركزي على النحو الوارد أعلاه وإضافة 50 ميكرولتر من العازلة تحلل (ريبا العازلة مع كوكتيل مثبطات البروتيز المضافة) إلى بيليه الخلية من تدور النهائي.
- دوامة الخلايا والاحتفاظ بها على الجليد لمدة 20 دقيقة. تخضع الخليط إلى الطرد المركزي في 10،000 × غرام لمدة 30 دقيقة في 4 درجة مئوية، وجمع supernatant (أي، lysate) في أنابيب الطرد المركزي الدقيق الطازجة، والحفاظ على -80 درجة مئوية حتى الاستخدام.
- ركز 2 مل من الوسائط المستنفدة للاكسوسوم إلى 100 ميكرولتر باستخدام 3 مرشحات طرد مركزي مقطوفة من الكيدا قبل تحديد كمية البروتين. امزج المركبات الكهربائية الكهربائية مع حاجز التحلل بنسبة 1:1، ودوامة لمدة 30 s، واحتضنها على الجليد لمدة 15 دقيقة لتحديد كمية البروتين.
- مزيج كميات متساوية من البروتين (2 ميكروغرام) من sEVs، RAW 264.7 خلية lysate، والوسائط التي استنفدت exosome مع الحد من المخزن المؤقت عينة.
- إزالة العينات في 95 درجة مئوية لمدة 5 دقائق، والاحتفاظ بها على الجليد لمدة 5 دقائق، وتدور لمدة 2 دقيقة في 10،000 × غرام. تحميل العينات على هلام البروتين تريس الجليسين 12٪ وتشغيل هلام في 125 V لمدة 45 دقيقة.
- نقل البروتين على غشاء ثنائي فلوريد البولي فينيلدين (PVDF) في 25 V لمدة 2 ساعة.
- بعد النقل، قم بحظر أغشية PVDF مع حاجز الحجب (انظر جدول المواد)لمدة ساعة واحدة في درجة حرارة الغرفة.
- احتضان وصمة عار مع الأجسام المضادة الأولية على شاكر بين عشية وضحاها في 4 °C.
ملاحظة: كانت الأجسام المضادة الأولية المستخدمة مضادة للCD81 (1:1,000)، مضادة ألفا-1،3/1،6-mannosyltransferase (ALG-2) التفاعل البروتين X (أليكس) (1 :1,000), المضادة كالنكسين (1:1,000), ومكافحة جليسيرالدهيد 3 فوسفات ديهيدروجيناز (GAPDH) (1:1,000). - غسل البقع 3 × 15 دقيقة مع 1x تريس العازلة المالحة، 0.1٪ توين 20 (TBST)، واحتضان في درجة حرارة الغرفة مع الماعز المضادة للفأرة IgG-الفجل peroxidase (HRP) - أو حمار المضادة للأرنب IgG-HRP-الأجسام المضادة الثانوية المقترنة (1:10،000) لمدة 1 ساعة على شاكر.
- غسل البقع 3 × 15 دقيقة مع TBST 1x، والكشف عن البروتينات باستخدام ركيزة HRP.
- تحليل البقع عن طريق تعزيز chemiluminescence باستخدام صور لطخة الغربية.
- المجهر الإلكتروني الإرسال (TEM)
- إصلاح sEVs عن طريق إعادة تعليقها في 2٪ بارافورمالديهايد (PFA) في 0.1 M الفوسفات العازلة (PB)؛ دوامة لمدة 2 × 15 s.
- ضع قطرة من 10 ميكرولتر من تعليق SEV على البارافيلم نظيفة. تعويم شبكة فورمافار المغلفة بالكربون على قطرة مع جانبهم المغلفة التي تواجه التعليق. دع الأغشية تمتص لمدة 20 دقيقة في بيئة جافة.
- ضع الشبكات (جانب الغشاء لأسفل) على قطرة من PB لغسلها لمدة 3 × 2 دقيقة.
- نقل الشبكات إلى 50 ميكرولتر من 1٪ الغلوتارالدهيد لمدة 5 دقائق.
- غسل الشبكات مع 100 ميكرولتر من الماء المقطر لمدة 8 × 2 دقيقة.
- على النقيض من العينة عن طريق وضع الشبكات على قطرة من 1٪ أورانيل خلات لمدة 2 دقيقة.
- تضمين العينة مع 50 ميكرولتر من خلات أورانيل 0.2٪ مع محلول ميثيلسليلوز 2٪ لمدة 10 دقائق على طبق الثلج المغطى بالبارافيلم.
- استخدام حلقات الفولاذ المقاوم للصدأ لعقد الشبكات وإزالة السوائل الزائدة مع ورقة تصفية.
- الهواء الجاف الشبكة لمدة 10 دقيقة في حين لا يزال على حلقة.
- مراقبة تحت المجهر الإلكتروني انتقال في 80 كيلو فولت.
3. وضع العلامات على المركبات الكهربائية
- تمييع 20 ميكروغرام من sEVs في 1 مل من العازلة المخففة أو نفس حجم برنامج تلفزيوني في 1 مل من العازلة المخفف للسيطرة على الصبغة.
- تمييع 3 ميكرولتر من PKH67 أو PKH26 صبغة في 1 مل من العازلة المخففة ومزيج عن طريق pipetting.
- إضافة صبغة PKH المخفف إلى SEVs المخففة وتخلط عن طريق pipetting. حضانة لمدة 5 دقائق في الظلام في درجة حرارة الغرفة. للتحكم في الصبغة، اخلطي الصبغة المخففة مع برنامج تلفزيوني مخفف من الخطوة 3.1.
- إضافة 2 مل من 1٪ ألبوم مصل البقر (BSA) في برنامج تلفزيوني إلى أنبوب مع مزيج صبغ وSEV و إلى أنبوب التحكم صبغ لامتصاص الصبغة الزائدة.
- جهاز طرد مركزي لمدة ساعة واحدة عند 110,000 × غرام عند 4 درجات مئوية. تجاهل supernatant، resuspend بيليه في 2 مل من برنامج تلفزيوني، والطرد المركزي لمدة 1 ساعة في 110،000 × غرام في 4 درجة مئوية. كرر الغسيل مع برنامج تلفزيوني وإعادة إنفاق المركبات ذاتية الدفع المسماة أو التحكم في الصبغة في حجم متساو من PBS.
- تحديد كمية البروتين الكلي عن طريق طريقة برادفورد.
4. امتصاص sEVs بواسطة خلايا Neuro-2a
- ضع أغطية 18 مم في لوحة من 12 بئرا ولوحة 10 × 104 خلايا Neuro-2a في كل بئر في ما مجموعه 1 مل من متوسط DMEM الكامل الذي يحتوي على 10٪ FBS و 1٪ قلم بكتيريا.
- تغيير المتوسطة إلى المتوسطة DMEM الإكسوسوم المنضب عندما يكون التقاء الخلية 80-90٪. أضف 1 أو 5 أو 10 ميكروغرام من المركبات ذاتية الدفع المسماة في كل بئر لمدة 1 و4 و24 ساعة لامتصاص الجرعة والوقت المعتمدين ، أو أضف حجما متساويا من التحكم في الصبغة.
5. الثقافات الفلكية الأولية
- تخدير 4 جراء بعد الولادة بعد 4 أيام من الولادة عن طريق تحفيز انخفاض حرارة الجسم.
- جمع العقول في طبق بيتري 60 ملم تحتوي على الجليد الباردة هانك متوازنة الملح الحل (HBSS) تكملها مع 10 M 4-(2-hydroxyethyl)-1-بيبيرازينيثانسولفونيك حمض (HEPES).
- تشريح كل من الفصوص القشرية وإزالة السحايا. فرم الأنسجة مع شفرة معقمة.
- نقل الأنسجة إلى أنبوب مخروطي 15 مل تحتوي على papain / deoxyribonuclease I العازلة التفكك واحتضان لمدة 20 دقيقة في 37 درجة مئوية. دوامة كل 5 دقائق.
ملاحظة: بالنسبة ل 4 قشريات فأر، يتم تنشيط 9 مل من 7.5 U/mL papain في HBSS عند 37 درجة مئوية لمدة 30 دقيقة على الأقل، وتصفيتها من خلال فلتر حقنة 0.22 ميكرومتر، وخلطها مع إزالة الأكسجين I إلى تركيز نهائي قدره 0.1 ملغم/مل. - أسبيرات supernatant وإضافة 5 مل من DMEM كاملة لتثبيط نشاط الانزيم. triturate بعناية لتفكك الأنسجة مع ماصة مصلية زجاجية 5 مل وماصة باستور مصقول باللهب.
- تمرير تعليق الخلية من خلال مصفاة الخلية 40 ميكرومتر والطرد المركزي الخلايا في 250 × غرام لمدة 5 دقائق في 4 درجة مئوية. يستنشق المتوسطة والبذور الخلايا في 10 مل من DMEM كاملة في قارورة 75 سم2. استبدال المتوسطة فائقة مع 15 مل من DMEM الطازجة المتوسطة 4 ساعة بعد الطلاء.
- بعد 14 يوما في المختبر، نقل القارورة إلى شاكر المداري لفصل microglia وoligodendrocytes في 320 دورة في الدقيقة لمدة 6 ساعة.
- جرب الخلايا الفلكية المتبقية باستخدام 5 مل من إنزيم فص الخلية(جدول المواد)لمدة 10 دقائق عند 37 درجة مئوية. إضافة 5 مل من DMEM كاملة ل inactivate العمل الأنزيمي والكريهات الخلايا في 250 × غرام لمدة 5 دقائق في 4 درجة مئوية.
- إعادة إنفاق الخلايا في DMEM كاملة. البذور 5 × 104 خلايا على 12 مم # 1.5 coverslips في لوحة 24 جيدا.
6. امتصاص sEVs بواسطة الخلايا الفلكية
- عندما تصل الخلايا الفلكية إلى التقاء 80-90٪، قم بتغيير الوسط إلى المتوسط المنضب DMEM.
- أضف 1 ميكروغرام من المركبات ذاتية الدفع غير المسماة أو الحجم المتساوي للتحكم في الصبغة أو برنامج تلفزيوني إلى الخلايا. استخدام الخلايا لتلطيخ 1 ساعة و 24 ساعة بعد العلاج SEV.
7. الفلورة المناعية
- شطف الخلايا مع برنامج تلفزيوني 3x وإصلاحها مع 4٪ PFA في PB لمدة 10 دقيقة في درجة حرارة الغرفة.
- غسل الخلايا الثابتة 3 × 5 دقيقة مع PB و permeabilize لهم باستخدام 0.1٪ تريتون X-100 في PB لمدة 10-15 دقيقة ويغسل مع PB 3 × 5 دقيقة.
- منع الخلايا مع 5٪ مصل الماعز العادي (NGS) في PB لمدة 1 ساعة في درجة حرارة الغرفة.
- احتضان الخلايا ذات الأجسام المضادة الأولية: البروتين المرتبط بالميكروتبول 2 (MAP2A، 1:500) للخلايا العصبية-2a أو البروتين الحمضي الرجفانى الدبقية (GFAP، 1:500) للخلايا الفلكية الأولية في NGS/PB الطازجة 5٪ بين عشية وضحاها عند 4 درجة مئوية مع اهتزاز لطيف.
- غسل 3 × 10 دقيقة مع PB وإضافة الأجسام المضادة الثانوية المترافقة مع الفلوروفوري (الماعز المضادة للفأرة IgG1، اليكسا فلور 594؛ أو الماعز المضادة للفأرة IgG H&L، اليكسا فلور 488) في 5٪ NGS واحتضان لمدة 2 ساعة في درجة حرارة الغرفة على الروك.
- غسل 3 × 10 دقيقة مع PB واحتضان مع 1 ميكروغرام / مل من وصمة عار النووية 4'،6-diamidino-2-phenylindole (DAPI) لمدة 10 دقيقة في درجة حرارة الغرفة. غسل الخلايا مرة أخرى 3x مع PB.
- قم بتركيب الأغطية على الشرائح رقم 1 باستخدام وسيط تصاعد مضاد للضفميد. دعهم يجفون بين عشية وضحاها في الظلام، وتخزين الشرائح الزجاجية المعدة في 4 درجة مئوية حتى التصوير على المجهر confocal.
8. في استيعاب الجسم الحي من sEVs
- إجراء الحقن داخل الثكال من 5 ميكروغرام من sEVs غير المسمى أو المسمى resuspended في 10 ميكرولتر من برنامج تلفزيوني، أو حجم متساو (10 ميكرولتر) من السيطرة على الصبغة (كما أعدت في القسم 3) في الفئران C57BL/6.
- بعد 6 و 18 ساعة بعد حقن سيفس، تخدير الفئران بعمق عن طريق الحقن داخل الصفاق من 100 ملغ / كجم وزن الجسم من الكيتامين و 10 ملغ / كجم وزن الجسم من xylazine.
- إجراء التغلغل داخل القلب من الفئران مع 0.9٪ المالحة لطرد الدم، تليها الطازجة الجليد الباردة 4٪ PFA / PB.
- تشريح الحبل الشوكي وإصلاح في 4٪ PFA / PB في 4 درجة مئوية لمدة 24 ساعة. Cryoprotect الأنسجة في 30٪ السكروز في PB في 4 °C ل 24 ح أو حتى تغرق الأنسجة. تخزين الأنسجة في 4 درجة مئوية حتى الكيمياء المناعية.
9. الكيمياء المناعية
- تضمين الحبل الشوكي L4-L5 في مركب O.C.T. تجميد على الجليد الجاف حتى توطد تماما.
- قسم الأنسجة في 30 ميكرومتر (مقطع عرضي للنخاع الشوكي) باستخدام cryostat، وجمع المقاطع في لوحة 24 جيدا تحتوي على PB. غسل المقاطع 3 × 5 دقائق مع 0.3٪ تريتون في PB.
- حظر مواقع ملزمة غير محددة مع 5٪ NGS في 0.3٪ تريتون / PB لمدة 2 ساعة في درجة حرارة الغرفة.
- تمييع الأجسام المضادة الأولية: مكافحة MAP2A (1:500)، GFAP (1:1،000)، Iba1 لmicroglia (1:2،000) مع 5٪ NGS في 0.3٪ تريتون / PB، واحتضان الأقسام بين عشية وضحاها في 4 درجة مئوية على شاكر.
- غسل أقسام 3 × 5 دقيقة مع 0.3٪ تريتون / PB، وإضافة الأجسام المضادة الثانوية (حمار المضادة للأرنب IgG اليكسا فلور 488، 1:500، أو الماعز المضادة للفأرة IgG اليكسا فلور 488، 1:500) في 5٪ NGS/PB لمدة 2 ساعة في درجة حرارة الغرفة.
- غسل 3 × 5 دقائق مع PB، واحتضان الأقسام في 1 ميكروغرام / مل من DAPI لمدة 10 دقيقة في درجة حرارة الغرفة. غسل المقاطع 3 × 5 دقائق مع PB.
- جبل المقاطع على شريحة لاصقة نظيفة (جدول المواد) مع فرشاة طلاء غرامة تحت المجهر الخفيفة.
- الرطب غطاء مع تصاعد المتوسطة. علاج بين عشية وضحاها في الظلام في درجة حرارة الغرفة.
- صورة تحت مجهر كونفوجكال مع الليزر المعنية.
النتائج
بعد عزل أجهزة SEVs عن الوسائط المكيفة RAW 264.7 عبر الطرد المركزي ، تم استخدام NTA لتحديد تركيز وحجم أجهزة التلفاز المنقى. وكان متوسط حجم الجسيمات الخام 264.7 المشتقة 140 نانومتر، وكان حجم الجسيمات الذروة 121.8 نانومتر، مما يؤكد أن معظم الجسيمات التي يمكن اكتشافها في قياس تشتت الضوء تقع ضمن نطاق حجم exosomes أو sEVs في 50-150 نانومتر (الشكل 1A). كما هو مقترح في الحد الأدنى من المعلومات لدراسات الحويصلات خارج الخلية 2018 (MISEV2018)23، قمنا بتحليل مجموعة من البروتينات التي يجب أن تكون موجودة أو مستبعدة من مجموعات EV المتميزة. أظهر النشاف الغربي من المركبات الذاتية ، وlysate الخلية ، ووسائل الإعلام المنضبة exo أن عينات البروتين المشتقة من SEV تحتوي على بروتينات علامة SEV Alix و CD81 و GAPDH. تم إثراء كسر lysate الخلية مع البروتين المقيم الشبكية endoplasmic، كالنكسين، الذي كان غائبا في sEVs. وهكذا، كالنكسين بمثابة علامة سلبية للتلوث الخلوي (الشكل 1B).
قمنا بعد ذلك بإجراء تجارب الاستجابة للجرعة والدورة الزمنية لامتصاص SEV في المختبر. تم احتضان خلايا Neuro-2a بجرعة واحدة 1 ميكروغرام من المركبات ذاتية الدفع ذات العلامات PKH67 لمدة 1 و 4 و 24 ساعة ، وبعد ذلك تم فحص امتصاص تركيزات مختلفة من المركبات ذاتية الدفع (1 و 5 و 10 ميكروغرام) على مدار ساعة واحدة. وأشارت نتائج NTA إلى أن 1 ميكروغرام من البروتين في المتوسط يساوي ~ 1 × 109 جزيئات. وبالتوازي مع ذلك، تم اختبار برنامج تلفزيوني، وأجهزة SEVs غير توصف، وضوابط الصبغة وحدها. لاحظنا أن امتصاص المركبات ذاتية الدفع حدث عند 1 ساعة(الشكل 2A)وبالنسبة للمركبات الكهربائية 1 و5 و10 ميكروغرام(الشكل 2B). ويمكن الكشف عن الفلورسينس في 4 ساعة لمدة 5 و 10 ميكروغرام من SEVs (الشكل 2C) بعد الحضانة. بعد ذلك ، تم فحص امتصاص المركبات الذاتية التي تحمل علامة PKH26 بواسطة الخلايا الفلكية الأولية(الشكل 3). حدث الفلورسينس القصوى من امتصاص SEV في الخلايا الفلكية القشرية الأولية في 24 ساعة. لم تظهر SEVs غير المزينة بفلورة ، مما يدل على أن الفلورة الذاتية SEV لا تساهم بشكل كبير في الإيجابياتالزائفة (الشكل التكميلي S1A).
بعد ذلك ، تم حقن المركبات الكهربائية المستقلة المسماة داخل الدماغ في الفئران لتقييم تسليم وامتصاص المركبات الكهربائية من قبل خلايا مختلفة في الحبل الشوكي باستخدام الكيمياء المناعية والمجهر confocal. نحن ملطخة MAP2 كعلامة الخلايا العصبية، GFAP كعلامة الفلكية، وIBA1 كعلامة microglial. الخلايا العصبية (الشكل 4), الخلايا الفلكية (الشكل 5), والخلايا الدقيقة (الشكل 6) تناولوا جميع PKH26 المسمى SEVs, ولوحظ فلورية SEV القصوى في 6 ح بعد الحقن. في حين أن SEVs لم تتراكم دائما مع العلامات الخلوية ، إلا أننا لم نلاحظ أي امتصاص تفاضلي من قبل خلايا CNS. الحقن داخل الثكال مع 5 ميكروغرام من RAW 264.7 غير الغامق أو التحكم في صبغ لم تظهر مضان كبير (الشكل التكميلي S1B). لوحظت إشارات الفلورسنت في السحايا، على حد سواء 6 ساعة و 18 ساعة بعد حقن sEVs (الشكل التكميلي S1C).

الشكل 1: تم تحديدتوصيف RAW 264.7 sEVs المنقى. (A) تم تحديد حجم وتركيز المركبات ذاتية الدفع باستخدام NanoSight NS300. تم تتبع الجسيمات وحجمها على أساس الحركة البراونية ومعامل الانتشار. يظهر توزيع حجم sEVs في نانومتر. تم التعبير عن تركيز المركبات ذاتية الدفع كجسيمات /مل. (ب) لطخة غربية من البروتينات المشتقة من أجهزة الاستخلاص الذاتي النقية، و lysate الخلية، و الوسائط المستنفدة للاكسوسوم باستخدام علامات SEV ALIX و GAPDH و CD81. علامة البروتين الشبكية الإنتوبلازمية، كالنكسين، بمثابة عنصر تحكم لرصد التلوث الخلوي في الاستعدادات SEV. (ج)أظهر المجهر الإلكتروني الإرسال حجم ومورفولوجيا من sEVs. شريط المقياس = 100 نانومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ ALIX = ألفا-1,3/1,6-مانوسيل ترانسفيراسي (ALG-2)-التفاعل البروتين X; GAPDH = غليسيرالدهيد 3-فوسفات ديهيدروجيناز; CD81 = مجموعة من التمايز 81. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
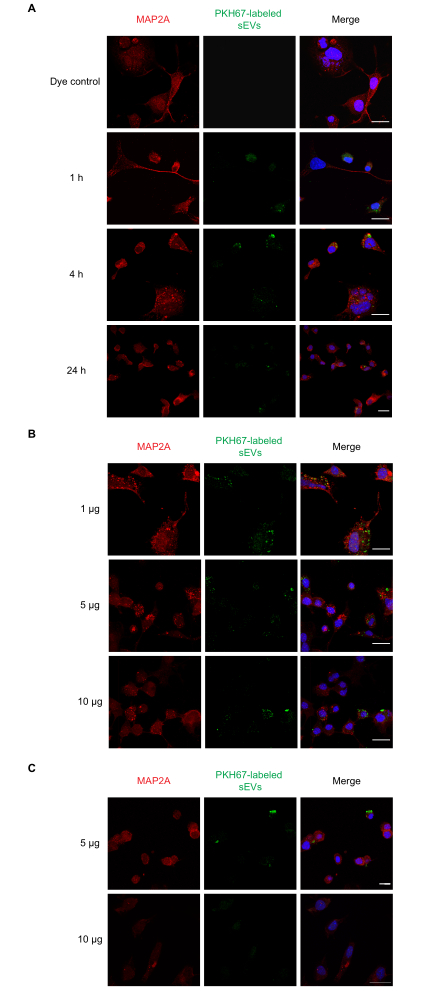
الشكل 2:امتصاص RAW 264.7 sEVs المسمى بواسطة خلايا Neuro-2a. (أ)تمت إضافة مركبات SEVs ذات العلامات PKH67 (1 ميكروغرام) إلى خلايا Neuro-2a المستزرعة لمدة 1 أو 4 أو 24 ساعة. لوحظ امتصاص SEV في جميع النقاط الزمنية باستخدام المجهر البؤري. (ب)أضيفت مركبات SEVs تحمل علامة PKH67 (1 أو 5 أو 10 ميكروغرام) إلى خلايا Neuro-2a لمدة ساعة واحدة (C) PKH67-labeled sEVs (5 أو 10 ميكروغرام) إلى خلايا Neuro-2a لمدة 4 ساعة. لوحظ امتصاص SEV في جميع مجموعات الجرعة باستخدام المجهر confocal. لم مجموعات المراقبة السلبية تعامل مع صبغة PKH وحدها لا تظهر تلطيخ SEV (الشكل التكميلي S1). كانت خلايا Neuro-2a ملطخة بالمناعة MAP2A (تم فحصها مع Alexa Fluor 594 ، الموضحة باللون الأحمر) ، في حين كانت نواة الخلية ملطخة DAPI (موضحة باللون الأزرق) و SEVs مع PKH67 (كما هو موضح باللون الأخضر). شريط المقياس = 50 ميكرومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ MAP2A = البروتين المرتبطة microtubule 2A; DAPI = 4′,6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3:امتصاص PKH26 المسمى RAW 264.7 sEVs بواسطة الخلايا الفلكية القشرية الماوس الأساسي. وصفت واحدة ميكروغرام من SEVs مع صبغ PKH26 وإضافتها إلى المتوسطة ثقافة الخلايا الفلكية الأولية. ولوحظ امتصاص المركبات الكهربائية ذاتية الدفع في 1 و 24 ساعة بعد الإضافة باستخدام مجهر المسح بالليزر confocal. كانت ملطخة Astrocytes مع GFAP (بحث مع اليكسا فلور 488، هو مبين باللون الأحمر)، في حين كانت مضادة نواة الخلية مع DAPI (يظهر باللون الأزرق)، وكانت ملطخة سابقا SEVs مع PKH26 (هو مبين باللون الأخضر). شريط المقياس = 20 ميكرومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ GFAP = بروتين حمضي الرجفان الدبقية; DAPI = 4′,6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: امتصاص RAW 264.7 الخلايا العصبية SEVsin. تم حقن المركبات ذاتية الدفع التي تحمل علامة PKH26 داخل العين في الفئران؛ 6 و 18 ساعة في وقت لاحق، تم perfused الفئران مع 4٪ PFA، وتم عزل الحبل الشوكي ومقسمة في 30 ميكرومتر. كانت أقسام الحبل الشوكي ملطخة بالمناعة بعلامة الخلية (تم فحصها مع Alexa Fluor 488 ، الموضحة باللون الأحمر) والعلامة المضادة النووية DAPI (الموضحة باللون الأزرق) ، في حين تم تسمية المركبات ذاتية الدفع سابقا ب PKH26 (الموضح باللون الأخضر). كانت أقسام الحبل الشوكي ملطخة بالمناعة ل MAP2A لتصور الخلايا العصبية (الحمراء). يظهر المجهر Confocal sEVs في الخلايا العصبية الإيجابية MAP2A في نقاط زمنية مختلفة. لم تظهر السيطرة السلبية ، مجموعة PKH26 الصبغية وحدها ، تلطيخ SEV. شريط المقياس = 20 ميكرومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ PFA = بارافورمالديهايد; MAP2A = البروتين المرتبطة microtubule 2A; DAPI = 4′,6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: امتصاص RAW 264.7 sEVs في الخلايا الفلكية. تم حقن المركبات ذاتية الدفع التي تحمل علامة PKH26 داخل العين في الفئران؛ 6 و 18 ساعة في وقت لاحق، تم perfused الفئران مع 4٪ PFA، وتم عزل الحبل الشوكي ومقسمة في 30 ميكرومتر. كانت أقسام الحبل الشوكي ملطخة بالمناعة بعلامة الخلية (تم فحصها مع Alexa Fluor 488 ، الموضحة باللون الأحمر) والعلامة المضادة النووية DAPI (الموضحة باللون الأزرق) ، في حين تم تسمية المركبات ذاتية الدفع سابقا ب PKH26 (الموضح باللون الأخضر). كانت أقسام الحبل الشوكي ملطخة بالمناعة لGFAP لتصور الخلايا الفلكية (الحمراء). يظهر المجهر Confocal sEVs في الخلايا الفلكية إيجابية GFAP في نقاط زمنية مختلفة. لم تظهر السيطرة السلبية ، مجموعة PKH26 الصبغية وحدها ، تلطيخ SEV. شريط المقياس = 20 ميكرومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ PFA = بارافورمالديهايد; GFAP = بروتين حمضي الرجفان الدبقية; DAPI = 4′,6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
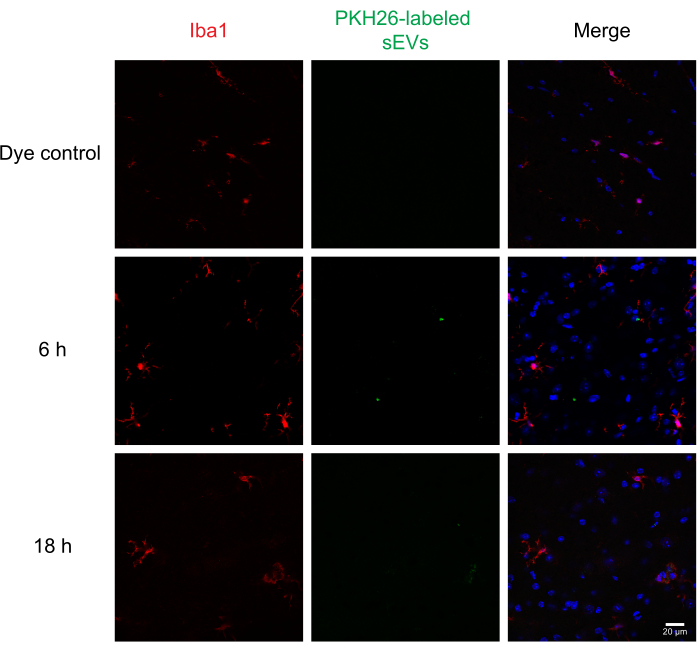
الشكل 6: امتصاص RAW 264.7 sEVs في ميكروجليا. تم حقن المركبات ذاتية الدفع التي تحمل علامة PKH26 داخل العين في الفئران؛ 6 و 18 ساعة في وقت لاحق، تم perfused الفئران مع 4٪ PFA، وتم عزل الحبل الشوكي ومقسمة في 30 ميكرومتر. كانت أقسام الحبل الشوكي ملطخة بالمناعة بعلامة الخلية (تم فحصها مع Alexa Fluor 488 ، الموضحة باللون الأحمر) والعلامة المضادة النووية DAPI (الموضحة باللون الأزرق) ، في حين تم تسمية المركبات ذاتية الدفع سابقا ب PKH26 (الموضح باللون الأخضر). كانت أقسام الحبل الشوكي ملطخة بالمناعة ل IBA1 لتصور الميكروجليا (الحمراء). يظهر المجهر Confocal sEVs في ميكروغليا إيجابية IBA1 في نقاط زمنية مختلفة. لم تظهر السيطرة السلبية ، مجموعة PKH26 الصبغية وحدها ، تلطيخ SEV. شريط المقياس = 20 ميكرومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ PFA = بارافورمالديهايد; IBA1 = جزيء محول ربط الكالسيوم المؤين 1؛ DAPI = 4′,6-دياميدينو-2-فينيليندول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: امتصاص RAW 264.7 sEVs المسمى بواسطة الخلايا الفلكية القشرية للفأر الأساسي وفي الحبل الشوكي. (أ) ضوابط لامتصاص PKH26 المسمى RAW 264.7 sEVs بواسطة الخلايا الفلكية القشرية الماوس الأساسي. تمت إضافة ميكروغرام واحد من sEVs غير المبللة في PBS أو حجم متساو من PBS بالتوازي مع وسيط الثقافة للخلايا الفلكية. لم يلاحظ أي مضان في 1 ساعة لبرنامج تلفزيوني والتحكم غير الهادئة باستخدام المجهر المسح بالليزر confocal. كانت الخلايا الفلكية ملطخة ب GFAP (تم فحصها مع Alexa Fluor 488 ، الموضحة باللون الأحمر) ، في حين كانت النواة ملطخة ب DAPI (الأزرق) ، وتم تصور المركبات ذاتية الدفع غير المسماة تحت نفس قناة Alexa Fluor 546 مثل SEVs المسماة PKH26. شريط المقياس = 50 ميكرومتر (ب) ضوابط لامتصاص PKH26 المسمى RAW 264.7 sEVs بواسطة الحبل الشوكي الماوس في الجسم الحي. تم حقن خمسة ميكروغرام من المركبات ذاتية الدفع غير الممسوغة أو التحكم في الصبغة داخل العين في الفئران. مرة أخرى ، لم يتم ملاحظة إشارات الفلورسنت لأجهزة التلفاز غير الممسوحة أو التحكم في الصبغة وحدها باستخدام مجهر مسح ليزر confocal. كانت ملطخة Astrocytes مع GFAP (بحث مع اليكسا فلور 488، هو مبين باللون الأحمر)، في حين كانت مضادة للنيوية مع DAPI (الأزرق)، وتصورت SEVs غير المسمى تحت نفس قناة اليكسا فلور 546 كما PKH26 المسمى sEVs. شريط المقياس = 50 ميكرومتر (C) الصور التمثيلية تكشف عن وجود RAW 264.7 sEVs في السحاي الشوكي الماوس 6 ساعة و 18 ساعة بعد الولادة داخل الحساب. وصفت خمسة ميكروغرام من SEVs مع صبغ PKH26 (يظهر باللون الأخضر)، وكانت النوى مضادة مع DAPI (يظهر باللون الأزرق). تشير النجمات إلى الشريان الشوكي الأمامي. شريط المقياس = 50 ميكرومتر. الاختصارات: sEVs = الحويصلات الصغيرة خارج الخلية؛ PBS = المالحة العازلة بالفوسفات؛ GFAP = بروتين حمضي الرجفان الدبقية; DAPI = 4′,6-دياميدينو-2-فينيليندول. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
في هذا البروتوكول، أظهرنا وضع العلامات على المركبات ذاتية الدفع بأصباغ PKH وتصور امتصاصها في الحبل الشوكي. تستخدم الأصباغ الفلورية PKH lipophilic على نطاق واسع لتسمية الخلايا عن طريق قياس التدفق الخلوي والمجهر الفلوري3،5،6،12،24،25. نظرا لنصف عمرها الطويل نسبيا وانخفاض السمية الخلوية ، يمكن استخدام أصباغ PKH لمجموعة واسعة من دراسات تتبع الخلايا في الجسم الحي وفي المختبر 26،27. على الرغم من أن الاحتفاظ ممتازة الغشاء والاستقرار البيوكيميائية مفيدة، يمكن أن التداخل من المسابير الفلورية مع ملوثات البروتين الدهني تنقيتها مع SEVs المساس تفسير الاستيعاب SEV والدراسات الوظيفية. وبالتالي ، فإن تنقية ووضع العلامات على المركبات ذاتية الدفع هي خطوات حاسمة في البروتوكول لأن استمرار الأصباغ مع الملوثات يمكن أن يؤدي إلى سوء تفسير التوزيع في الجسم الحي 28. إدراج الضوابط أمر بالغ الأهمية لتجنب إشارات مضان إيجابية كاذبة بسبب وضع علامات غير محددة من الجسيمات ونصف عمر طويل من هذه الأصباغ.
تجميع وتشكيل micelle من الأصباغ lipophilic قد تسفر أيضا إشارات خاطئة. عالجنا مشكلة الصبغة الحرة أو غير المنضمة من خلال تضمين التحكم في الصبغة وحدها وتصور امتصاص EV في النقاط الزمنية السابقة. وهناك قيد مهم أبلغ عن وضع العلامات PKH هو أن تتشكل العديد من PKH26 الجسيمات النانوية خلال PKH26 صبغ وضع العلامات من SEVs. على الرغم من عدم تضمينها في هذا البروتوكول، أفيد أنه يمكن إزالة PKH26 الجسيمات النانوية بواسطة التدرج السكروز29. قيمت دراسة أخرى تأثير وضع العلامات PKH على حجم المركبات الكهربائية من قبل NTA وأفادت عن زيادة في الحجم بعد وضع العلامات PKH30. ومع ذلك ، فإن الأصباغ PKH بمثابة تتبع عملي وقيم لإظهار أين اجتازت سيارات الدفع الرباعي. وثمة قيد آخر لهذه الدراسة هو أننا لم قياس sEVs كما يركز هذا البروتوكول على تأكيد امتصاص الخلوية بعد التسليم داخل الحساب. وقد وضعت تحقيقات غشاء السيانين القائم على الرواية في الآونة الأخيرة للتصوير الفلوري حساسة للغاية من SEVs دون تغيير حجم أو توليد القطع الأثرية، مثل تشكيل الجسيمات النانوية PKH31،ومما لا شك فيه تحسين دراسات وضع العلامات في المستقبل.
على الرغم من أن الضامة تلعب أدوارا هامة في الاشتعال العصبي ، إلا أنها تمارس أيضا وظائف الحماية العصبية من خلال تسليم حمولتها عبر exosomes32. تظهر دراساتنا أن المركبات الكهربائية المشتقة من الماكروفاج المسماة يتم تناولها من قبل خلايا Neuro-2aوالخلايا الفلكية الأولية وفي الحبل الشوكي القطني بعد الإدارة داخل العين. وتشير النتائج إلى أن فترة حضانة أطول يمكن أن تؤدي إلى انخفاض كثافة إشارة SEV، والتي يمكن أن تعزى إلى تدهور المركبات الكهربائية أو انقسام الخلايا من قبل خلايا Neuro-2a في الثقافة33،34. على الرغم من انخفاض الإنتاجية، يمكن استخدام هذا البروتوكول لتصور المركبات الكهربائية المسماة في الحبل الشوكي لدراسات التحقق الأولية التي تؤكد امتصاص SEV قبل التحقيق في التأثير الوظيفي للمركبات ذاتية الدفع التي يتم تسليمها داخل العين. كما لاحظنا عموما امتصاص SEV مماثلة في العديد من أنواع خلايا الجهاز العصبي المركزي، يبدو أن عملية امتصاص غير انتقائية. إذا كان autofluorescence هو قضية في التصوير، يمكن استخدام المركبات الكهربائية غير المبهمة كتحكم إضافي لنفي الفلورة الذاتية SEV أثناء تصوير الأنسجة والثقافات. على الرغم من أن الجرعة وطريق إدارة المركبات الذاتية يمكن أن تؤثر على نمط التوزيع الحيوي11، إلا أن هذا البروتوكول غير محسن للتحليل الكمي لامتصاص SEV. ويجري استخدام العديد من النهج المختلفة واستراتيجيات التصوير المختلفة للتحقيق في SEVs ، ويجري صقلها باستمرار وتحسينها لتتبع في الجسم الحي من sEVs2.
والمقصود من هذا البروتوكول أن يكون مجرد نهج واحد لتأكيد امتصاص SEV. وكما هو الحال مع جميع البروتوكولات، يمكن أن يكون التحقق من صحة المتصالب باستخدام نهج متعددة الوسائط مفيدا. على وجه التحديد، يمكن تأكيد امتصاص المركبات ذاتية الدفع من خلال التحقيق في نقل البضائع الجزيئية الحيوية إلى الخلايا والأنسجة المتلقية. إذا كان المحقق يعرف تكوين ميرنا من sEVs تسليمها، فإن نهجا بديلا لتأكيد نقل SEV يكون للتحقق من وجود تغييرات ميرنا في الخلايا المتلقية أو تحديد التغيرات في مستويات التعبير من الجينات المستهدفة ل ميرناس نقلها. ويمكن استخدام العينات المعالجة من قبل برنامج تلفزيوني كعنصر تحكم لهذا النهج. بشكل عام، تدعم هذه النتائج مفهوم أن يتم تناول المركبات الذاتية المشتقة من الماكروفاج من قبل خلايا CNS في المختبر وفي الجسم الحي. يمكن استخدام هذا البروتوكول للتحقيق في دور المركبات الكهربائية في اضطرابات العمود الفقري والألم والالتهاب وتحديد ما إذا كان يمكن تطوير المركبات الخلوية لتوصيل الجزيئات الصغيرة العلاجية والجيش الملكي النيبالي والبروتينات.
Disclosures
ولا يوجد لدى صاحبي البلاغ تضارب في المصالح يكشفان عنه.
Acknowledgements
تم دعم هذه الدراسة من خلال المنح المقدمة من المعاهد القومية للصحة NINDS R01NS102836 ووزارة الصحة في ولاية بنسلفانيا تعزيز البحوث العالمية الكومنولث (CURE) الممنوحة لسينا ك. أجيت. نشكر الدكتور برادلي ناش على القراءة النقدية للمخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| Amicon Ultra 0.5 mL centrifugal filters | MilliporeSigma | Z677094 | |
| Anti-Alix Antibody | Abcam | ab186429 | 1:1000 |
| Anti-Calnexin Antibody | Abcam | Ab10286 | 1:1000 |
| Anti-CD81 Antibody | Santa Cruz Biotechnology | sc-166029 | 1:1000 |
| Anti-GAPDH Monoclonal Antibody (14C10) | Cell Signaling Technology | 2118 | 1:1000 |
| Anti-Glial Fibrillary Acidic Protein Antibody | Sigma-Aldrich | MAB360 | 1:500 for IF; 1:1000 for IHC |
| Anti-Iba1 Antibody | Wako | 019-19741 | 1:2000 |
| Anti-MAP2A Antibody | Sigma-Aldrich | MAB378 | 1:500 |
| Bovine Serum Albumin (BSA) | VWR | 0332 | |
| Cell Strainer, 40 μm | VWR | 15-1040-1 | |
| Centrifuge Tubes | Thermo Scientific | 3118-0050 | 12,000 x g |
| Coverslip, 12-mm, #1.5 | Electron Microscopy Sciences | 72230-01 | |
| Coverslip, 18-mm, #1.5 | Electron Microscopy Sciences | 72222-01 | |
| DAPI | Sigma-Aldrich | D9542-1MG | 1 µg/mL |
| DC Protein Assay | Bio-Rad | 500-0116 | |
| Deoxyribonuclease I (DNAse I) | MilliporeSigma | D4513-1VL | |
| Donkey Anti-Rabbit IgG H&L (HRP) | Abcam | ab16284 | 1:10000 |
| Donkey Anti-Rabbit IgG H&L, Alexa Fluor 488 | Invitrogen | A-21206 | 1:500 |
| Double Frosted Microscope Slides, #1 | Thermo Scientific | 12-552-5 | |
| DPBS without Calcium and Magnesium | Corning | 21-031-CV | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10-013-CV | |
| Exosome-Depleted Fetal Bovine Serum | Gibco | A27208-01 | |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| FluorChem M imaging system | ProteinSimple | ||
| FV3000 Confocal Microscope | Olympus | ||
| Goat Anti-Mouse IgG H&L (HRP) | Abcam | ab6789 | 1:10000 |
| Goat Anti-Mouse IgG H&L, Alexa Fluor 488 | Invitrogen | A-11001 | 1:500 |
| Goat Anti-Mouse IgG1, Alexa Fluor 594 | Invitrogen | A-21125 | 1:500 |
| Hank's Balanced Salt Solution (HBSS) | VWR | 02-0121 | |
| HEPES | Gibco | 15630080 | |
| HRP Substrate | Thermo Scientific | 34094 | |
| Intercept blocking buffer, TBS | LI-COR Biosciences | 927-60001 | |
| Laemmli SDS Sample Buffer | Alfa Aesar | AAJ61337AC | |
| Micro Cover Glass, #1 | VWR | 48404-454 | |
| Microm HM550 | Thermo Scientific | ||
| NanoSight NS300 system | Malvern Panalytical | ||
| NanoSight NTA 3.2 software | Malvern Panalytical | ||
| Neuro-2a Cell Line | ATCC | CCL-131 | |
| Normal Goat Serum | Vector Laboratories | S-1000 | |
| O.C.T Compound | Sakura Finetek | 4583 | |
| Papain | Worthington Biochemical Corporation | NC9597281 | |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PKH26 | Sigma-Aldrich | MINI26-1KT | |
| PKH67 | Sigma-Aldrich | MINI67-1KT | |
| Protease Inhibitor Cocktail | Thermo Scientific | 1862209 | |
| PVDF Transfer Membrane | MDI | SVFX8302XXXX101 | |
| RAW 267.4 Cell Line | ATCC | TIB-71 | |
| RIPA Buffer | Sigma-Aldrich | R0278 | |
| Sodium Chloride | AMRESCO | 0241-2.5KG | |
| Superfrost Plus Gold Slides | Thermo Scientific | 15-188-48 | adhesive slides |
| T-75 Flasks | Corning | 431464U | |
| Tecnai 12 Digital Transmission Electron Microscope | FEI Company | ||
| TEM Grids | Electron Microscopy Sciences | FSF300-cu | |
| Tris-Glycine Protein Gel, 12% | Invitrogen | XP00120BOX | |
| Tris-Glycine SDS Running Buffer | Invitrogen | LC26755 | |
| Tris-Glycine Transfer Buffer | Invitrogen | LC3675 | |
| TrypLE Express | Gibco | 12605028 | cell dissociation enzyme |
| Triton X-100 | Acros Organics | 327371000 | |
| Trypsin, 0.25% | Corning | 25-053-CL | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Ultracentrifuge Tubes | Beckman | 344058 | 110,000 x g |
References
- Mulcahy, L. A., Pink, R. C., Carter, D. R. F. Routes and mechanisms of extracellular vesicle uptake. Journal of Extracellular Vesicles. 3 (1), 24641(2014).
- Betzer, O., et al. Advances in imaging strategies for in vivo tracking of exosomes. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 12 (2), 1594(2020).
- Dehghani, M., Gaborski, T. R. Fluorescent labeling of extracellular vesicles. Methods in Enzymology. 645, 15-42 (2020).
- González, M. I., et al. Covalently labeled fluorescent exosomes for in vitro and in vivo applications. Biomedicines. 9 (1), 81(2021).
- Chuo, S. T. -Y., Chien, J. C. -Y., Lai, C. P. -K. Imaging extracellular vesicles: current and emerging methods. Journal of Biomedical Science. 25 (1), 91(2018).
- vander Vlist, E. J., Nolte-'tHoen, E. N. M., Stoorvogel, W., Arkesteijn, G. J. A., Wauben, M. H. M. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7 (7), 1311-1326 (2012).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Heinrich, L., et al. Confocal laser scanning microscopy using dialkylcarbocyanine dyes for cell tracing in hard and soft biomaterials. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81 (1), 153-161 (2007).
- Haney, M. J., et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release. 207, 18-30 (2015).
- Grange, C., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a model of acute kidney injury monitored by optical imaging. International Journal of Molecular Medicine. 33 (5), 1055-1063 (2014).
- Wiklander, O. P., et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. Journal of Extracellular Vesicles. 4, 26316(2015).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nature Communications. 6 (1), 7029(2015).
- Deddens, J. C., et al. Circulating extracellular vesicles contain miRNAs and are released as early biomarkers for cardiac injury. Journal of Cardiovascular Translational Research. 9 (4), 291-301 (2016).
- Montecalvo, A., et al. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 119 (3), 756-766 (2012).
- Escrevente, C., Keller, S., Altevogt, P., Costa, J. Interaction and uptake of exosomes by ovarian cancer cells. BMC Cancer. 11, 108(2011).
- Cho, E., et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. Journal of Controlled Release. 279, 326-335 (2018).
- Mantel, P. Y., et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host & Microbe. 13 (5), 521-534 (2013).
- Porro, C., Trotta, T., Panaro, M. A. Microvesicles in the brain: Biomarker, messenger or mediator. Journal of Neuroimmunology. 288, 70-78 (2015).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Matsumoto, J., et al. Transmission of alpha-synuclein-containing erythrocyte-derived extracellular vesicles across the blood-brain barrier via adsorptive mediated transcytosis: another mechanism for initiation and progression of Parkinson's disease. Acta Neuropathologica Communications. 5 (1), 71(2017).
- Matsumoto, J., Stewart, T., Banks, W. A., Zhang, J. The transport mechanism of extracellular vesicles at the blood-brain barrier. Current Pharmaceutical Design. 23 (40), 6206-6214 (2017).
- Shaimardanova, A., et al. Extracellular vesicles in the diagnosis and treatment of central nervous system diseases. Neural Regeneration Research. 15 (4), 586-596 (2020).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Hoen, E. N. M. N. -t, et al. Quantitative and qualitative flow cytometric analysis of nanosized cell-derived membrane vesicles. Nanomedicine: Nanotechnology, Biology and Medicine. 8 (5), 712-720 (2012).
- Gangadaran, P., Hong, C. M., Ahn, B. -C. An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Frontiers in Pharmacology. 9, 169(2018).
- Teare, G. F., Horan, P. K., Slezak, S. E., Smith, C., Hay, J. B. Long-term tracking of lymphocytes in vivo: the migration of PKH-labeled lymphocytes. Cellular Immunology. 134 (1), 157-170 (1991).
- Kuffler, D. P. Long-term survival and sprouting in culture by motoneurons isolated from the spinal cord of adult frogs. Journal of Comparative Neurology. 302 (4), 729-738 (1990).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Pužar Dominkuš, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta. Biomembranes. 1860 (6), 1350-1361 (2018).
- Dehghani, M., Gulvin, S. M., Flax, J., Gaborski, T. R. Systematic evaluation of PKH labelling on extracellular vesicle size by nanoparticle tracking analysis. Scientific Reports. 10 (1), 9533(2020).
- Shimomura, T., et al. New lipophilic fluorescent dyes for labeling extracellular vesicles: characterization and monitoring of cellular uptake. Bioconjugate Chemistry. 32 (4), 680-684 (2021).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Polanco, J. C., Li, C., Durisic, N., Sullivan, R., Götz, J. Exosomes taken up by neurons hijack the endosomal pathway to spread to interconnected neurons. Acta Neuropathologica Communications. 6 (1), 10(2018).
- Jurgielewicz, B. J., Yao, Y., Stice, S. L. Kinetics and specificity of HEK293T extracellular vesicle uptake using imaging flow cytometry. Nanoscale Research Letters. 15 (1), 170(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved