Method Article
Absorção de Vesículos Extracelulares Fluorescentes Em Vitro e na Medula Espinhal
Neste Artigo
Resumo
Descrevemos um protocolo para rotular pequenas vesículas extracelulares derivadas do macrófago com corantes PKH e observar sua absorção in vitro e na medula espinhal após a entrega intratecal.
Resumo
Pequenas vesículas extracelulares (sEVs) são vesículas de 50-150 nm secretadas por todas as células e presentes em fluidos corporais. os sEVs transferem biomoléculas como RNA, proteínas e lipídios de doadores para células aceitadoras, tornando-os os principais mediadores de sinalização entre as células. No sistema nervoso central (SNC), os SEVs podem mediar a sinalização intercelular, incluindo interações neuroimunes. As funções sEV podem ser estudadas rastreando a absorção de sEVs rotulados em células receptoras tanto in vitro quanto in vivo. Este artigo descreve a rotulagem de sEVs da mídia condicionada de células macrófagos RAW 264.7 usando um corante de membrana PKH. Mostra a absorção de diferentes concentrações de SEVs rotulados em vários pontos de tempo por células Neuro-2a e astrócitos primários in vitro. Também é mostrada a absorção de sEVs entregues intrathecally em neurônios da medula espinhal do camundongo, astrócitos e microglia visualizados por microscopia confocal. Os resultados representativos demonstram variação dependente do tempo na absorção de SEVs por diferentes células, o que pode ajudar a confirmar a entrega bem-sucedida de SEVs na medula espinhal.
Introdução
Pequenas vesículas extracelulares (sEVs) são vesículas nanosized, derivadas de membrana com uma faixa de tamanho de 50-150 nm. Eles se originam de corpos multi-vesiculares (MVBs) e são liberados das células após a fusão dos MVBs com a membrana plasmática. os sEVs contêm miRNAs, mRNAs, proteínas e lipídios bioativos, e essas moléculas são transferidas entre células na forma de comunicação célula-celular. os sEVs podem ser internalizados por células receptoras por uma variedade de vias endocíticas, e esta captura de sEVs por células receptoras é mediada pelo reconhecimento de moléculas superficiais em EVs e nas células-alvo1.
os sEVs ganharam interesse devido à sua capacidade de desencadear mudanças moleculares e fenotípicas nas células aceitadoras, sua utilidade como agente terapêutico e seu potencial como portadores de moléculas de carga ou agentes farmacológicos. Devido ao seu pequeno tamanho, a imagem e o rastreamento de SEVs podem ser desafiadores, especialmente para estudos in vivo e configurações clínicas. Portanto, muitos métodos foram desenvolvidos para rotular e imagem sEVs para auxiliar sua biodistribução e rastreamento in vitro e in vivo2.
A técnica mais comum para estudar a biodistribução sEV e as interações celulares-alvo envolve rotulá-las com moléculas de corante fluorescente3,4,5,6,7. Os EVs foram inicialmente rotulados com corantes de membrana celular que eram comumente usados para células de imagem. Esses corantes fluorescentes geralmente mancham a bicamadas lipídica ou proteínas de interesse em sEVs. Vários corantes lipofílicos apresentam um forte sinal fluorescente quando incorporados ao citosol, incluindo DiR (1,1'-dioctadecyl-3,3,3′,3′-tetramethylindotricarbocyanine iodide), DiL (1, 1'-dioctadecyl-3, 3, 3′, 3'-tetramethyl indocarbocyanine perclorato), e DiD (1, 1'-dioctadecyl-3, 3,3′, 3′-tetrametiletotototo 4-clorobenzenesulfonato sal)8,9,10,11.
Outros corantes lipofílicos, como PKH67 e PKH26, têm um grupo de cabeça polar altamente fluorescente e uma longa cauda de hidrocarboneto alifático que facilmente se intercala em qualquer estrutura lipídica e leva à retenção de corantes a longo prazo e fluorescência estável12. Os corantes PKH também podem rotular EVs, o que permite o estudo de propriedades EV in vivo13. Muitos outros corantes têm sido usados para observar exosomos usando microscopia de fluorescência e citometria de fluxo, incluindo corantes de rotulagem lipídica14 e corantes permeáveis de células, como carboxyfluorescein diacetate éster succinimidyl (CFDA-SE)15,16 e acetoximilo de calceina (AM) ester17.
Estudos de crosstalk mediado pelo SEV entre diferentes células do CNS forneceram insights importantes sobre a patogênese das doenças neuroinflamatórias e neurodegenerativas18. Por exemplo, sEVs de neurônios podem espalhar peptídeos beta-amilóides e proteínas tau fosforiladas e ajudar na patogênese da doença de Alzheimer19. Além disso, os EVs derivados de eritrócitos contêm grandes quantidades de alfa-sinucleína e podem atravessar a barreira hemenceroencefálica e contribuir para a patologia de Parkinson20. A capacidade dos SEVs de atravessar barreiras fisiológicas21 e transferir suas biomoléculas para células-alvo torna-as ferramentas convenientes para fornecer medicamentos terapêuticos ao CNS22.
O visualização da absorção do SEV por inúmeras células CNS na medula espinhal permitirá tanto estudos mecanicistas quanto a avaliação dos benefícios terapêuticos de SEVs exogenoumente administrados de várias fontes celulares. Este artigo descreve a metodologia de rotular sEVs derivados de macrófagos e imaginar sua absorção in vitro e in vivo na medula espinhal lombar por neurônios, microglia e astrócitos para confirmar qualitativamente a entrega do SEV por visualização.
Protocolo
NOTA: Todos os procedimentos foram realizados em conformidade com o Guia nih para o cuidado e uso de animais de laboratório e aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Faculdade de Medicina da Universidade Drexel. Os camundongos CD-1 grávidas foram usados para a cultura astróctica, e todas as barragens foram recebidas 15 dias após a impregnação. Os camundongos C57BL/6 de dez e doze semanas foram usados para experimentos de absorção in vivo.
1. Isolamento de sEVs de células macrófagos RAW 264.7
- Cultura RAW 264,7 células em 75 cm2 frascos em MMEM exosome-despojado médio contendo 10% de soro bovino fetal exososome -despojado (FBS) e 1% penicilina-estreptomicina (pen-estreptomicina) por 24-48 h.
- Colete 300 mL de média e centrífuga condicionada a 300 × g por 10 min a 4 °C.
- Colete o supernatante e centrífuga a 2.000 × g por 20 min a 4 °C.
- Transfira o supernatante para tubos de centrífuga, centrífuga por 35 min a 12.000 × g a 4 °C.
- Colete o supernatante e filtre através de um filtro de seringa de 0,22 μm.
- Transfira para tubos ultracentrífugas e centrífuga por 80 min a 110.000 × g a 4 °C.
- Armazene o supernatante (meio exossomo esgotado), resuspense a pelota em 2 mL de salina tamponada com fosfato de 1x (PBS) e centrífuga por 1h a 110.000 × g a 4 °C.
- Resuspenque a pelota em 100 μL de PBS para caracterização adicional usando análise de rastreamento de nanopartículas (NTA) e microscopia eletrônica de transmissão (TEM) ou no tampão de ensaio de radioimunoprecipitação (RIPA) para mancha ocidental.
2. Caracterização de sEVs
- Análise de rastreamento de nanopartículas (NTA)
NOTA: A distribuição de tamanho e o número/concentração de partículas dos sEVs purificados das células RAW 264.7 foram medidos pela NTA.- Diluir os sEVs no PBS filtrado para obter 20-60 vesículas por campo de visão para um rastreamento ideal.
- Introduza a amostra diluída em uma célula de fluxo usando uma bomba de seringa com uma taxa de fluxo constante.
- Faça 3-5 vídeos de 30 s cada. Defina a velocidade e o ganho do obturador e concentre manualmente as configurações da câmera para que o número máximo de vesículas seja visível e capaz de ser rastreado e analisado.
- Avance as amostras entre cada gravação para realizar medições de replicação. Otimize as configurações pós-aquisição da NTA e mantenha as configurações constantes entre as amostras.
- Analise cada vídeo usando o software NTA para obter o tamanho médio e concentração das vesículas.
- Realize todas as medições NTA com configurações de sistema idênticas para consistência.
- Mancha ocidental
- Quantifique as quantidades totais de proteína em SEVs, lises celulares e mídia exosome-despoqueda usando um kit de ensaio de proteínas seguindo as instruções do fabricante.
- Para a preparação do lisecelular, cultura as células RAW 264,7 em frascos de 75 cm2 até 80-90% confluentes. Despeque as células com 0,25% de trippsina por 10-15 min, neutralize a trippsina com mídia cultural e pelota as células girando a 400 × g por 5 min. Resuspend as células em meio de crescimento fresco.
- Conte as células usando um hemócito e transfira 1 × 106 células para outro tubo. Lave as células com PBS duas vezes usando as mesmas condições de centrifugação acima e adicione 50 μL de tampão de lise (tampão RIPA com coquetel inibidor de protease adicionado) à pelota da célula a partir do giro final.
- Vórtice as células e mantê-las no gelo por 20 minutos. Sujeito a mistura à centrifugação a 10.000 × g por 30 min a 4 °C, colete o sobrenascer (ou seja, o lise) em tubos de microcentrifuus frescos e mantenha-se a −80 °C até usar.
- Concentre 2 mL de mídia exossome-esgotado a 100 μL usando filtros centrífugos de corte de 3 kDa antes de quantificar a quantidade de proteína. Misture os sEVs com tampão de lise em uma proporção de 1:1, vórtice para 30 s e incubar no gelo por 15 minutos para quantificar a quantidade de proteína.
- Misture quantidades iguais de proteína (2 μg) dos sEVs, lysato de células RAW 264,7 e mídia exossome-despojada com redução do buffer amostral.
- Desnaturar as amostras a 95 °C por 5 min, mantê-las no gelo por 5 minutos, e girar por 2 min a 10.000 × g. Carregue as amostras em um gel de proteína tris-glicina de 12% e execute o gel a 125 V por 45 min.
- Transfira a proteína para uma membrana de difluoreto de polivinida (PVDF) a 25 V por 2 h.
- Após a transferência, bloqueie as membranas PVDF com tampão de bloqueio (ver a Tabela de Materiais) por 1h à temperatura ambiente.
- Incubar a mancha com anticorpos primários em um agitador durante a noite a 4 °C.
NOTA: Os anticorpos primários utilizados foram anti-CD81 (1:1.000), anti-alfa-1,3/1,6-mannosyltransferase (ALG-2)-interacting protein X (Alix) (1:1.000), anti-Calnexin (1:1.000) e antigliceraldeído 3-fosfato desidrogenase (GAPDH) (1:1.000). - Lave as manchas 3 x 15 min com soro fisiológico 1x Tris-tampão, 0,1% Tween 20 (TBST), e incubar à temperatura ambiente com anti-rato de cabra IgG-rabanete peroxidase (HRP)- ou anti-coelho anti-coelho IgG-HRP-conjugado anticorpos secundários (1:10.000) para 1 h no shaker.
- Lave as manchas 3 x 15 min com 1x TBST e detecte as proteínas usando um substrato HRP.
- Analise as manchas por quimiominascência aprimorada usando um imager de mancha ocidental.
- Microscopia eletrônica de transmissão (TEM)
- Corrigir sEVs resusususá-los em 2% de paraformaldeído (PFA) em tampão fosfato de 0,1 M (PB); vórtice para 2 x 15 s.
- Coloque uma gota de 10 μL de suspensão sEV em parafilm limpo. Flutue a grade formvar revestida de carbono na queda com seu lado revestido de frente para a suspensão. Deixe as membranas absorverem por 20 minutos em um ambiente seco.
- Coloque as grades (lado da membrana para baixo) em uma gota de PB para lavar por 3 x 2 min.
- Transfira as grades para 50 μL de 1% de glutaraldeído por 5 min.
- Lave as grades com 100 μL de água destilada por 8 x 2 min.
- Contraste a amostra colocando as grades em uma queda de 1% de acetato de uranyl por 2 min.
- Incorpore a amostra com 50 μL de acetato de urilo de 0,2% com solução de metilcelulose de 2% por 10 minutos em uma antena de gelo coberta de parafilm.
- Use laços de aço inoxidável para segurar as grades e remover o excesso de fluido com papel filtro.
- Seque a rede por 10 minutos enquanto ainda estiver no loop.
- Observe sob um microscópio eletrônico de transmissão a 80 kV.
3. Rotulagem de sEVs
- Diluir 20 μg de sEVs em 1 mL de tampão diluído ou o mesmo volume de PBS em 1 mL de tampão diluído para controle de corante.
- Diluir 3 μL de corante PKH67 ou PKH26 em 1 mL de tampão diluído e misturar por pipetação.
- Adicione corante PKH diluído aos sEVs diluídos e misture por pipetação. Incubar por 5 minutos no escuro à temperatura ambiente. Para um controle de corante, misture o corante diluído com o PBS diluído da etapa 3.1.
- Adicione 2 mL de 1% de gérso bovino (BSA) no PBS ao tubo com o corante e a mistura sEV e ao tubo de controle de corante para absorver o excesso de corante.
- Centrifugar por 1h a 110.000 × g a 4 °C. Descarte o supernasce, resuspenque a pelota em 2 mL de PBS e centrífuga por 1h a 110.000 × g a 4 °C. Repita a lavagem com PBS e resuspenque os sEVs rotulados ou o controle de corante em um volume igual de PBS.
- Quantifique a quantidade total de proteína pelo método Bradford.
4. Captação de sEVs por células Neuro-2a
- Coloque tampas de 18 mm em uma placa de 12 poços e placa 10 × 104 células Neuro-2a em cada poço em um total de 1 mL de meio DMEM completo contendo 10% de FBS e 1% de estreptococos de caneta.
- Mude o meio para o dMEM exossome-esgotado quando a confluência celular é de 80-90%. Adicione 1, 5 ou 10 μg de SEVs rotulados em cada poço por 1, 4 e 24 h para captação dependente de dose e tempo, ou adicione um volume igual de controle de corante.
5. Culturas astrócticas primárias
- Anestesiar 4 filhotes pós-natais 4 dias após o nascimento induzindo hipotermia.
- Colete os cérebros em uma placa de Petri de 60 mm contendo solução de sal balanceado (HBSS) de gelo da Hank's Balanced com 10 mM 4-(2-hidroxitil)-1-piperazineethanethanesulfônico (HEPES).
- Dissecar os dois lobos cortical e remover as meninges. Pique os tecidos com uma lâmina esterilizada.
- Transfira os tecidos para um tubo cônico de 15 mL contendo papan/desoxyribonuclease I tampão de dissociação e incubar por 20 min a 37 °C. Redemoinho a cada 5 minutos.
NOTA: Para 4 cortices de camundongos, 9 mL de 7,5 U/mL papain no HBSS é ativado a 37 °C por pelo menos 30 min, filtrado através de um filtro de seringa de 0,22 μm e misturado com desoxiribonuclease I a uma concentração final de 0,1 mg/mL. - Aspire o supernasal e adicione 5 mL de DMEM completo para inativar a atividade enzimátil. Treque cuidadosamente para dissociar os tecidos com uma pipeta sorológica de vidro de 5 mL e uma pipeta Pasteur polida em chamas.
- Passe a suspensão celular através de um coador de células de 40 μm e centrifugar as células a 250 × g por 5 min a 4 °C. Aspire as células médias e semeadas em 10 mL de DMEM completo em um frasco de 75 cm2. Substitua o meio supernatante por 15 mL de DMEM médio fresco 4h após o revestimento.
- Após 14 dias in vitro,transfira o frasco para um agitador orbital para desprender a microglia e os oligodendrócitos a 320 rpm por 6h.
- Trypsinize os astrócitos restantes usando 5 mL da enzima de dissociação celular(Tabela de Materiais) por 10 min a 37 °C. Adicione 5 mL de DMEM completo para inativar a ação enzimática e pelotar as células a 250 × g por 5 min a 4 °C.
- Resuspenda as células em DMEM completo. Semente 5 × 104 células em 12 mm #1,5 tampas em uma placa de 24 poços.
6. Captação de sEVs por astrócitos
- Quando os astrócitos atingirem 80-90% de confluência, mude o meio para o dMEM exososome-desporoso.
- Adicione 1 μg de SEVs não rotulados e rotulados, um volume igual de controle de corante ou PBS às células. Use as células para coloração 1h e 24 h após o tratamento sEV.
7. Imunofluorescência
- Enxágüe as células com PBS 3x e fixe-as com 4% de PFA em PB por 10 minutos à temperatura ambiente.
- Lave as células fixas 3 x 5 min com PB e permeabiliza-as usando 0,1% Triton X-100 em PB por 10-15 min e lave com PB 3 x 5 min.
- Bloqueie as células com soro de cabra 5% normal (NGS) na PB por 1h a temperatura ambiente.
- Incubar as células com anticorpos primários: proteína associada a microtúbulos 2 (MAP2A, 1:500) para células Neuro-2a ou proteína ácida fibrilar glial (GFAP, 1:500) para astrócitos primários em 5% NGS/PB fresco durante a noite a 4 °C com agitação suave.
- Lave 3 x 10 min com PB e adicione anticorpos secundários conjugados com fluoróforo (Goat Anti-Mouse IgG1, Alexa Fluor 594; ou Goat Anti-Mouse IgG H&L, Alexa Fluor 488) em 5% NGS e incubar por 2 h à temperatura ambiente em um roqueiro.
- Lave 3 x 10 min com PB e incubar com 1 μg/mL de mancha nuclear 4',6-diamidino-2-fenilômalo (DAPI) por 10 minutos à temperatura ambiente. Lave as células novamente 3x com PB.
- Monte as tampas em slides #1 usando um meio de montagem antifade. Deixe-os secar durante a noite no escuro, e armazene os slides de vidro preparados a 4 °C até a imagem em um microscópio confocal.
8. Captação in vivo de sEVs
- Realizar injeção intrathecal de 5 μg de sEVs não rotulados ou rotulados resuspended em 10 μL de PBS, ou igual volume (10 μL) de controle de corante (como preparado na seção 3) em camundongos C57BL/6.
- Após 6 e 18 h pós-injeção de sEVs, anestinar profundamente os camundongos por injeção intraperitoneal de 100 mg/kg de peso corporal de cetamina e 10 mg/kg de peso corporal de xilazina.
- Realizar perfusão intracárdia de camundongos com soro fisiológico de 0,9% para fora do sangue, seguido por 4% de PFA/PB recém-feito no gelo.
- Dissecar a medula espinhal e fixar em 4% PFA/PB a 4 °C por 24 h. Crioprotetor os tecidos em 30% de sacarose na PB a 4 °C por 24 h ou até que os tecidos afundem. Armazene os tecidos a 4 °C até a imunohistoquímica.
9. Imunohistoquímica
- Incorpore medula espinhal L4-L5 no composto O.C.T. Congele em gelo seco até solidificar completamente.
- Se sectionia os tecidos a 30 μm (transversalmente para a medula espinhal) usando um criostat e colete as seções em uma placa de 24 poços contendo PB. Lave as seções 3 x 5 min com Triton 0,3% em PB.
- Bloqueie locais de ligação não específicos com 5% de NGS em 0,3% Triton/PB por 2 h à temperatura ambiente.
- Anticorpos primários diluídos: Anti-MAP2A (1:500), GFAP (1:1.000), Iba1 para microglia (1:2.000) com 5% de NGS em 0,3% Triton/PB, e incubar as seções durante a noite a 4 °C em um shaker.
- Lave as seções 3 x 5 min com 0,3% Triton/PB, e adicione anticorpos secundários (Donkey Anti-Rabbit IgG Alexa Fluor 488, 1:500, ou Goat Anti-Mouse IgG Alexa Fluor 488, 1:500) em 5% NGS/PB por 2h em temperatura ambiente.
- Lave 3 x 5 min com PB e incuba as seções em 1 μg/mL de DAPI por 10 minutos à temperatura ambiente. Lave as seções 3 x 5 min com PB.
- Monte as seções em um slide adesivo limpo(Tabela de Materiais)com uma escova de tinta fina sob um microscópio leve.
- Molhe a tampa com meio de montagem. Cura durante a noite no escuro à temperatura ambiente.
- Imagem sob um microscópio confocal com os respectivos lasers.
Resultados
Após o isolamento dos SEVs da mídia RAW 264.7 condicionada via centrifugação, a NTA foi utilizada para determinar a concentração e distribuição de tamanho dos sEVs purificados. O tamanho médio médio dos SEVs DERIVADOS RAW 264,7 foi de 140 nm, e o tamanho da partícula máxima foi de 121,8 nm, confirmando que a maioria das partículas detectáveis na medição de dispersão de luz caiu dentro da faixa de tamanho de exossomos ou sEVs a 50-150 nm(Figura 1A). Conforme sugerido nas informações mínimas para estudos de vesículas extracelulares 2018 (MISEV2018)23, analisamos um conjunto de proteínas que devem estar presentes ou excluídas de populações distintas de EV. A mancha ocidental de sEVs, lysate celular e mídia exo-esgotada demonstrou que as amostras de proteínas derivadas do SEV continham as proteínas marcadores sEV Alix, CD81 e GAPDH. A fração de liseto celular foi enriquecida com a proteína residente de calcário endoplasmático, calnexin, que estava ausente nos sEVs. Assim, a calnexina serviu como um marcador negativo para contaminação celular(Figura 1B).
Em seguida, realizamos experimentos de dose-resposta e curso de tempo para captação de SEV in vitro. As células neuro-2a foram incubadas com uma única dose de 1 μg de SEVs rotulados por PKH67 para 1, 4 e 24 h, após a qual a absorção de diferentes concentrações de SEVs (1, 5 e 10 μg) foi examinada em 1 h. Os resultados da NTA indicaram que 1 μg de proteína em média era igual a ~1 x 109 partículas. Em paralelo, PBS, SEVs não rotulados e controles somente de corante também foram testados. Observou-se que a absorção de sEVs ocorreu às 1h(Figura 2A) e para os sEVs de 1, 5 e 10 μg(Figura 2B). A fluorescência pode ser detectada a 4 h para 5 e 10 μg de sEVs(Figura 2C) pós incubação. Em seguida, foi examinada a absorção de SEVs com rótulo PKH26 por astrócitos primários (Figura 3). A fluorescência máxima da absorção de SEV em astrócitos cortical primário ocorreu às 24 h. Os SEVs não rotulados não apresentaram fluorescência, demonstrando que a autofluorescência sEV não contribui significativamente para falsos positivos(Figura Suplementar S1A).
Em seguida, os SEVs rotulados foram injetados intratecalmente em camundongos para avaliar a entrega e absorção de SEVs por diferentes células na medula espinhal usando imunohistoquímica e microscopia confocal. Manchamos o MAP2 como um marcador neuronal, GFAP como um marcador astúcito, e IBA1 como um marcador microglial. Neurônios(Figura 4),astrócitos(Figura 5)e células microgliais(Figura 6) todos tomaram sEVs rotulados por PKH26, e fluorescência sEV máxima foi observada em 6 h pós-injeção. Embora os sEVs nem sempre se colocalizem com os marcadores celulares, não observamos nenhuma captação diferencial por células CNS. A injeção intrathecal com 5 μg de SEVs RAW 264,7 não foram significativas ou controle de corante não apresentaram fluorescência significativa(Figura Suplementar S1B). Sinais fluorescentes foram observados nas meninges, 6h e 18 h após a injeção de sEVs (Figura Suplementar S1C).

Figura 1: Caracterização de sEVs RAW 264.7 purificados. (A) Tamanho e concentração de sEVs foram determinados utilizando NanoSight NS300. As partículas foram rastreadas e dimensionadas com base no movimento browniano e coeficiente de difusão. A distribuição de tamanho dos sEVs é mostrada em nm. A concentração de sEVs foi expressa como partículas/mL. (B) Mancha ocidental de proteínas derivadas de sEVs purificados, lises celulares e mídia exososome-despoqueda usando marcadores sEV ALIX, GAPDH e CD81. O marcador de proteína calcário endoplasmático, calnexin, serve como controle para monitorar a contaminação celular nas preparações do SEV. (C) A microscopia eletrônica de transmissão demonstrou o tamanho e a morfologia dos sEVs. Barra de escala = 100 nm. Abreviaturas: sEVs = pequenas vesículas extracelulares; ALIX = Alpha-1,3/1,6-Mannosyltransferase (ALG-2)-interacting protein X; GAPDH = glicealdeído 3-fosfato desidrogenase; CD81 = cluster de diferenciação 81. Clique aqui para ver uma versão maior desta figura.
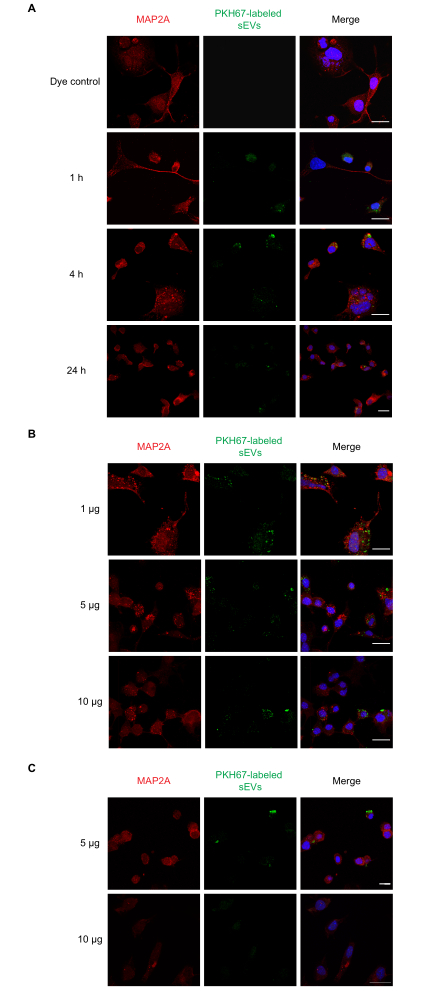
Figura 2: Captação de sEVs RAW 264.7 rotulados por células Neuro-2a. (A) SEVs rotulados por PKH67 (1 μg) foram adicionados às células neuro-2a cultivadas por 1, 4 ou 24 h. a absorção de sEV foi observada em todos os pontos de tempo com microscopia confocal. (B) SEVs rotulados com PKH67 (1, 5 ou 10 μg) foram adicionados às células Neuro-2a por 1 h. (C) SEVs rotulados PKH67 (5 ou 10 μg) foram adicionados às células Neuro-2a por 4 h. a absorção de SEV foi observada em todos os grupos de dosagem com microscopia de confocal. Grupos de controle negativos tratados apenas com corante PKH não apresentaram coloração sEV(Figura Suplementar S1). As células neuro-2a foram imunostidas com MAP2A (sondado com Alexa Fluor 594, mostrado em vermelho), enquanto núcleos celulares foram manchados com DAPI (mostrado em azul) e sEVs com PKH67 (mostrado em verde). Barra de escala = 50 μm. Abreviaturas: sEVs = pequenas vesículas extracelulares; MAP2A = proteína associada a microtúbulos 2A; DAPI = 4′,6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.

Figura 3: Absorção de SVs RAW 264.7 rotulados por Astrócitos cortical do rato primário. Um μg de sEVs foi rotulado com corante PKH26 e adicionado ao meio de cultura de astrócito primário. A absorção de sEVs foi observada em 1 e 24 h após a adição usando um microscópio de varredura a laser confocal. Os astrócitos foram manchados com GFAP (sondado com Alexa Fluor 488, mostrado em vermelho), enquanto núcleos celulares foram contra-manchados com DAPI (mostrado em azul), e os SEVs foram previamente manchados com PKH26 (mostrado em verde). Barra de escala = 20 μm. Corante PKH26 sozinho serviu como um controle negativo para a coloração sEV. Abreviaturas: sEVs = pequenas vesículas extracelulares; GFAP = proteína ácida fibrilar gliana; DAPI = 4′,6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.

Figura 4: Absorção de neurônios sEVsin RAW 264.7. SEVs com rótulo PKH26 foram injetados intrathecally em camundongos; 6 e 18 horas depois, os camundongos foram perfundidos com 4% de PFA, e a medula espinhal foi isolada e seccionada a 30 μm. As seções da medula espinhal foram imunos detidas com um marcador celular (sondado com Alexa Fluor 488, mostrado em vermelho) e contrastain nuclear DAPI (mostrado em azul), enquanto os SEVs foram previamente rotulados com PKH26 (mostrado em verde). As seções da medula espinhal foram imunos detidas para map2A visualizar os neurônios (vermelho). A microscopia confocal mostra sEVs em neurônios MAP2A positivos em diferentes pontos de tempo. O controle negativo, grupo pkh26 sozinho de corante, não mostrou manchas sEV. Barra de escala = 20 μm. Abreviaturas: sEVs = pequenas vesículas extracelulares; PFA = paraformaldeído; MAP2A = proteína associada a microtúbulos 2A; DAPI = 4′,6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.

Figura 5: Captação de SEVs RAW 264.7 em astrócitos. SEVs com rótulo PKH26 foram injetados intrathecally em camundongos; 6 e 18 horas depois, os camundongos foram perfundidos com 4% de PFA, e a medula espinhal foi isolada e seccionada a 30 μm. As seções da medula espinhal foram imunos detidas com um marcador celular (sondado com Alexa Fluor 488, mostrado em vermelho) e contrastain nuclear DAPI (mostrado em azul), enquanto os SEVs foram previamente rotulados com PKH26 (mostrado em verde). As seções da medula espinhal foram imunostidados para gfap para visualizar os astrócitos (vermelho). A microscopia confocal mostra sEVs em astrócitos positivos gfap em diferentes pontos de tempo. O controle negativo, grupo pkh26 sozinho de corante, não mostrou manchas sEV. Barra de escala = 20 μm. Abreviaturas: sEVs = pequenas vesículas extracelulares; PFA = paraformaldeído; GFAP = proteína ácida fibrilar gliana; DAPI = 4′,6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.
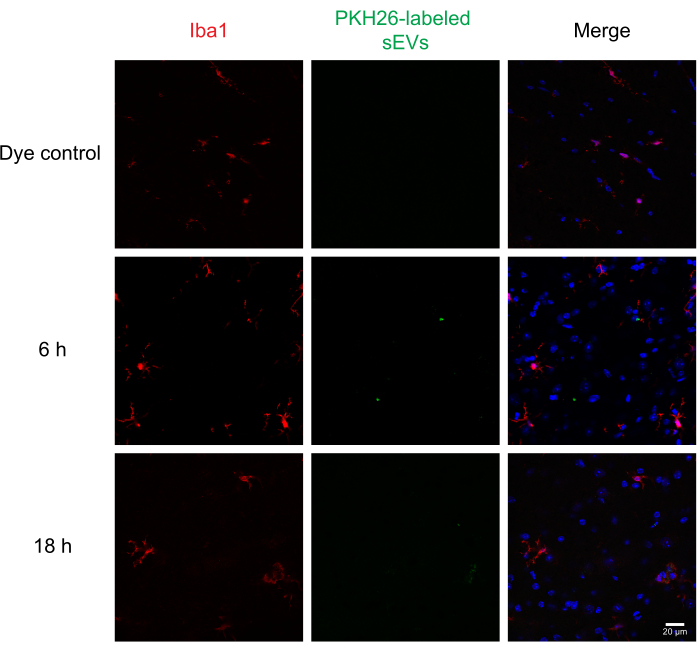
Figura 6: Captação de SEVs RAW 264,7 em microglia. SEVs com rótulo PKH26 foram injetados intrathecally em camundongos; 6 e 18 horas depois, os camundongos foram perfundidos com 4% de PFA, e a medula espinhal foi isolada e seccionada a 30 μm. As seções da medula espinhal foram imunos detidas com um marcador celular (sondado com Alexa Fluor 488, mostrado em vermelho) e contrastain nuclear DAPI (mostrado em azul), enquanto os SEVs foram previamente rotulados com PKH26 (mostrado em verde). As seções da medula espinhal foram imunos detidas para iba1 visualizar a microglia (vermelha). A microscopia confocal mostra sEVs em microglia IBA1 positivo em diferentes pontos de tempo. O controle negativo, grupo pkh26 sozinho de corante, não mostrou manchas sEV. Barra de escala = 20 μm. Abreviaturas: sEVs = pequenas vesículas extracelulares; PFA = paraformaldeído; IBA1 = molécula adaptadora de ligação de cálcio ionizada 1; DAPI = 4′,6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.
Figura Suplementar S1: Absorção de SEVs RAW 264.7 rotulados por astrócitos cortical primários do rato e na medula espinhal. (A) Controles para a absorção de SEVs RAW 264.7 rotulados por PKH26 por astrócitos cortical primários do rato. Um μg de sEVs não rotulados resuspended em PBS ou um volume igual de PBS foi adicionado em paralelo ao meio cultural dos astrócitos. Nenhuma fluorescência foi observada a 1 h para PBS e o controle não rotulado usando um microscópio de varredura a laser confocal. Os astrócitos foram manchados com GFAP (sondado com Alexa Fluor 488, mostrado em vermelho), enquanto os núcleos foram contra-manchados com DAPI (azul), e sEVs não rotulados foram visualizados sob o mesmo canal Alexa Fluor 546 como SEVs com etiqueta PKH26. Barra de escala = 50 μm. (B) Controles para a absorção de SEVs RAW 264,7 rotulados por 3ª medula intra vivo. Cinco μg de sEVs não rotulados ou controle de corante foram injetados intratecally em camundongos. Novamente, não foram observados sinais fluorescentes para SEVs não rotulados ou controle sozinho por corante usando um microscópio de varredura a laser confocal. Os astrócitos foram manchados com GFAP (sondado com Alexa Fluor 488, mostrado em vermelho), enquanto os núcleos foram neutralizados com DAPI (azul), e sEVs não rotulados foram visualizados sob o mesmo canal Alexa Fluor 546 como SEVs com etiqueta PKH26. Barra de escala = 50 μm. (C)Imagens representativas revelam a presença de SEVs RAW 264,7 em meninges espinhais de camundongos 6h e 18 h após a entrega intratecal. Cinco μg de sEVs foram rotulados com corante PKH26 (mostrado em verde), e os núcleos foram contra-manchados com DAPI (mostrado em azul). Asteriscos indicam a artéria espinhal anterior. Barra de escala = 50 μm. Abreviaturas: sEVs = pequenas vesículas extracelulares; PBS = soro fisiológico tamponado por fosfato; GFAP = proteína ácida fibrilar gliana; DAPI = 4′,6-diamidino-2-fenildole. Clique aqui para baixar este Arquivo.
Discussão
Neste protocolo, mostramos a rotulagem de sEVs com corantes PKH e a visualização de sua absorção na medula espinhal. Os corantes fluorescentes lipofílicos PKH são amplamente utilizados para rotulagem de células por citometria de fluxo e microscopia fluorescente3,5,6,12,24,25. Devido à sua meia-vida relativamente longa e baixa citotoxicidade, os corantes PKH podem ser usados para uma ampla gama de estudos in vivo e in vitro de rastreamento celular26,27. Embora a excelente retenção de membrana e a estabilidade bioquímica sejam vantajosas, a intercalação de sondas fluorescentes com contaminantes de lipoproteína purificados com sEVs pode comprometer a interpretação da internalização sEV e estudos funcionais. Assim, a purificação e rotulagem de sEVs são passos críticos no protocolo, pois a persistência dos corantes com contaminantes pode levar à má interpretação da distribuição in vivo 28. A inclusão de controles é fundamental para evitar sinais de fluorescência falso-positivos devido à rotulagem não específica de partículas e à longa meia-vida desses corantes.
A agregação e formação de micelas de corantes lipofílicos também podem produzir sinais falsos. Abordamos o problema do corante livre ou desvinculado, incluindo um controle sozinho por corante e visualizando a absorção de EV em pontos de tempo anteriores. Uma limitação importante relatada para a rotulagem PKH é que numerosas nanopartículas PKH26 são formadas durante a rotulagem de tinta PKH26 de sEVs. Embora não esteja incluído neste protocolo, é relatado que as nanopartículas PKH26 podem ser removidas por um gradiente de sacarose29. Outro estudo avaliou o efeito da rotulagem PKH sobre o tamanho dos SEVs pela NTA e relatou um aumento de tamanho após a rotulagem PKH30. No entanto, os corantes PKH servem como um rastreador pragmático e valioso para mostrar onde os SEVs atravessaram. Outra limitação deste estudo é que não quantificamos os SEVs, pois este protocolo se concentra na confirmação da captação celular após a entrega intratecal. Novas sondas de membrana à base de cianeto foram desenvolvidas recentemente para imagens de fluorescência altamente sensíveis de sEVs sem alterar o tamanho ou gerar artefatos, como a formação de nanopartículas PKH31,e, sem dúvida, melhorarão os estudos futuros de rotulagem.
Embora os macrófagos tenham papéis importantes na neuroinflamação, eles também exercem funções neuroprotetoras, entregando sua carga através de exosóis32. Nossos estudos mostram que os SEVs derivados do macrófago são ocupados por células Neuro-2a, astrócitos primáriose na medula espinhal lombar após administração intratecal. Os resultados indicam que um tempo de incubação mais longo pode levar a uma menor intensidade de sinal sEV, o que pode ser atribuído à degradação de SEVs ou divisão celular por células Neuro-2a na cultura33,34. Embora de baixa produtividade, este protocolo para visualização de SEVs rotulados na medula espinhal pode ser usado para estudos iniciais de validação que confirmam a absorção de SEV antes de investigar o impacto funcional dos SEVs entregues intratecally. Como observamos geralmente a absorção de sEV semelhante em vários tipos de células CNS, o processo de absorção parece não ser seletivo. Se a autofluorescência é um problema na imagem, os SEVs não rotulados podem ser usados como um controle adicional para negar a autofluorescência sEV durante a imagem de tecidos e culturas. Embora a dose e a rota de administração dos SEVs possam influenciar o padrão de biodistribução11,este protocolo não é otimizado para a análise quantitativa da captação de sEV. Várias abordagens diferentes e várias estratégias de imagem estão sendo empregadas para investigar sEVs, e estas estão sendo continuamente refinadas e otimizadas para o rastreamento in vivo de sEVs2.
Este protocolo deve ser apenas uma abordagem para confirmar a absorção do SEV. Como em todos os protocolos, a validação cruzada usando abordagens multimodais pode ser benéfica. Especificamente, a captação de sEVs pode ser confirmada investigando a transferência de carga biomolecular para células e tecidos receptores. Se o pesquisador souber a composição miRNA dos sEVs entregues, uma abordagem alternativa para confirmar a transferência sEV seria verificar as alterações do miRNA nas células receptoras ou determinar as alterações nos níveis de expressão dos genes-alvo para os miRNAs transferidos. As amostras tratadas com PBS podem ser usadas como controle para esta abordagem. No geral, esses resultados suportam o conceito de que os sEVs derivados do macrófago são tomados por células CNS in vitro e in vivo. Este protocolo pode ser usado para investigar o papel dos SEVs em distúrbios da coluna vertebral, dor e inflamação e para determinar se os SEVs podem ser desenvolvidos como veículos celulares para a entrega de pequenas moléculas terapêuticas, RNA e proteínas.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este estudo foi apoiado por subsídios do NIH NINDS R01NS102836 e do Departamento de Saúde da Pensilvânia Universal Research Enhancement (CURE) concedidos a Seena K. Ajit. Agradecemos ao Dr. Bradley Nash pela leitura crítica do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Amicon Ultra 0.5 mL centrifugal filters | MilliporeSigma | Z677094 | |
| Anti-Alix Antibody | Abcam | ab186429 | 1:1000 |
| Anti-Calnexin Antibody | Abcam | Ab10286 | 1:1000 |
| Anti-CD81 Antibody | Santa Cruz Biotechnology | sc-166029 | 1:1000 |
| Anti-GAPDH Monoclonal Antibody (14C10) | Cell Signaling Technology | 2118 | 1:1000 |
| Anti-Glial Fibrillary Acidic Protein Antibody | Sigma-Aldrich | MAB360 | 1:500 for IF; 1:1000 for IHC |
| Anti-Iba1 Antibody | Wako | 019-19741 | 1:2000 |
| Anti-MAP2A Antibody | Sigma-Aldrich | MAB378 | 1:500 |
| Bovine Serum Albumin (BSA) | VWR | 0332 | |
| Cell Strainer, 40 μm | VWR | 15-1040-1 | |
| Centrifuge Tubes | Thermo Scientific | 3118-0050 | 12,000 x g |
| Coverslip, 12-mm, #1.5 | Electron Microscopy Sciences | 72230-01 | |
| Coverslip, 18-mm, #1.5 | Electron Microscopy Sciences | 72222-01 | |
| DAPI | Sigma-Aldrich | D9542-1MG | 1 µg/mL |
| DC Protein Assay | Bio-Rad | 500-0116 | |
| Deoxyribonuclease I (DNAse I) | MilliporeSigma | D4513-1VL | |
| Donkey Anti-Rabbit IgG H&L (HRP) | Abcam | ab16284 | 1:10000 |
| Donkey Anti-Rabbit IgG H&L, Alexa Fluor 488 | Invitrogen | A-21206 | 1:500 |
| Double Frosted Microscope Slides, #1 | Thermo Scientific | 12-552-5 | |
| DPBS without Calcium and Magnesium | Corning | 21-031-CV | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10-013-CV | |
| Exosome-Depleted Fetal Bovine Serum | Gibco | A27208-01 | |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| FluorChem M imaging system | ProteinSimple | ||
| FV3000 Confocal Microscope | Olympus | ||
| Goat Anti-Mouse IgG H&L (HRP) | Abcam | ab6789 | 1:10000 |
| Goat Anti-Mouse IgG H&L, Alexa Fluor 488 | Invitrogen | A-11001 | 1:500 |
| Goat Anti-Mouse IgG1, Alexa Fluor 594 | Invitrogen | A-21125 | 1:500 |
| Hank's Balanced Salt Solution (HBSS) | VWR | 02-0121 | |
| HEPES | Gibco | 15630080 | |
| HRP Substrate | Thermo Scientific | 34094 | |
| Intercept blocking buffer, TBS | LI-COR Biosciences | 927-60001 | |
| Laemmli SDS Sample Buffer | Alfa Aesar | AAJ61337AC | |
| Micro Cover Glass, #1 | VWR | 48404-454 | |
| Microm HM550 | Thermo Scientific | ||
| NanoSight NS300 system | Malvern Panalytical | ||
| NanoSight NTA 3.2 software | Malvern Panalytical | ||
| Neuro-2a Cell Line | ATCC | CCL-131 | |
| Normal Goat Serum | Vector Laboratories | S-1000 | |
| O.C.T Compound | Sakura Finetek | 4583 | |
| Papain | Worthington Biochemical Corporation | NC9597281 | |
| Paraformaldehyde | Electron Microscopy Sciences | 19210 | |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| PKH26 | Sigma-Aldrich | MINI26-1KT | |
| PKH67 | Sigma-Aldrich | MINI67-1KT | |
| Protease Inhibitor Cocktail | Thermo Scientific | 1862209 | |
| PVDF Transfer Membrane | MDI | SVFX8302XXXX101 | |
| RAW 267.4 Cell Line | ATCC | TIB-71 | |
| RIPA Buffer | Sigma-Aldrich | R0278 | |
| Sodium Chloride | AMRESCO | 0241-2.5KG | |
| Superfrost Plus Gold Slides | Thermo Scientific | 15-188-48 | adhesive slides |
| T-75 Flasks | Corning | 431464U | |
| Tecnai 12 Digital Transmission Electron Microscope | FEI Company | ||
| TEM Grids | Electron Microscopy Sciences | FSF300-cu | |
| Tris-Glycine Protein Gel, 12% | Invitrogen | XP00120BOX | |
| Tris-Glycine SDS Running Buffer | Invitrogen | LC26755 | |
| Tris-Glycine Transfer Buffer | Invitrogen | LC3675 | |
| TrypLE Express | Gibco | 12605028 | cell dissociation enzyme |
| Triton X-100 | Acros Organics | 327371000 | |
| Trypsin, 0.25% | Corning | 25-053-CL | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Ultracentrifuge Tubes | Beckman | 344058 | 110,000 x g |
Referências
- Mulcahy, L. A., Pink, R. C., Carter, D. R. F. Routes and mechanisms of extracellular vesicle uptake. Journal of Extracellular Vesicles. 3 (1), 24641(2014).
- Betzer, O., et al. Advances in imaging strategies for in vivo tracking of exosomes. Wiley Interdisciplinary Reviews. Nanomedicine and Nanobiotechnology. 12 (2), 1594(2020).
- Dehghani, M., Gaborski, T. R. Fluorescent labeling of extracellular vesicles. Methods in Enzymology. 645, 15-42 (2020).
- González, M. I., et al. Covalently labeled fluorescent exosomes for in vitro and in vivo applications. Biomedicines. 9 (1), 81(2021).
- Chuo, S. T. -Y., Chien, J. C. -Y., Lai, C. P. -K. Imaging extracellular vesicles: current and emerging methods. Journal of Biomedical Science. 25 (1), 91(2018).
- vander Vlist, E. J., Nolte-'tHoen, E. N. M., Stoorvogel, W., Arkesteijn, G. J. A., Wauben, M. H. M. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nature Protocols. 7 (7), 1311-1326 (2012).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Heinrich, L., et al. Confocal laser scanning microscopy using dialkylcarbocyanine dyes for cell tracing in hard and soft biomaterials. Journal of Biomedical Materials Research. Part B, Applied Biomaterials. 81 (1), 153-161 (2007).
- Haney, M. J., et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy. Journal of Controlled Release. 207, 18-30 (2015).
- Grange, C., et al. Biodistribution of mesenchymal stem cell-derived extracellular vesicles in a model of acute kidney injury monitored by optical imaging. International Journal of Molecular Medicine. 33 (5), 1055-1063 (2014).
- Wiklander, O. P., et al. Extracellular vesicle in vivo biodistribution is determined by cell source, route of administration and targeting. Journal of Extracellular Vesicles. 4, 26316(2015).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nature Communications. 6 (1), 7029(2015).
- Deddens, J. C., et al. Circulating extracellular vesicles contain miRNAs and are released as early biomarkers for cardiac injury. Journal of Cardiovascular Translational Research. 9 (4), 291-301 (2016).
- Montecalvo, A., et al. Mechanism of transfer of functional microRNAs between mouse dendritic cells via exosomes. Blood. 119 (3), 756-766 (2012).
- Escrevente, C., Keller, S., Altevogt, P., Costa, J. Interaction and uptake of exosomes by ovarian cancer cells. BMC Cancer. 11, 108(2011).
- Cho, E., et al. Comparison of exosomes and ferritin protein nanocages for the delivery of membrane protein therapeutics. Journal of Controlled Release. 279, 326-335 (2018).
- Mantel, P. Y., et al. Malaria-infected erythrocyte-derived microvesicles mediate cellular communication within the parasite population and with the host immune system. Cell Host & Microbe. 13 (5), 521-534 (2013).
- Porro, C., Trotta, T., Panaro, M. A. Microvesicles in the brain: Biomarker, messenger or mediator. Journal of Neuroimmunology. 288, 70-78 (2015).
- De Toro, J., Herschlik, L., Waldner, C., Mongini, C. Emerging roles of exosomes in normal and pathological conditions: new insights for diagnosis and therapeutic applications. Frontiers in Immunology. 6, 203(2015).
- Matsumoto, J., et al. Transmission of alpha-synuclein-containing erythrocyte-derived extracellular vesicles across the blood-brain barrier via adsorptive mediated transcytosis: another mechanism for initiation and progression of Parkinson's disease. Acta Neuropathologica Communications. 5 (1), 71(2017).
- Matsumoto, J., Stewart, T., Banks, W. A., Zhang, J. The transport mechanism of extracellular vesicles at the blood-brain barrier. Current Pharmaceutical Design. 23 (40), 6206-6214 (2017).
- Shaimardanova, A., et al. Extracellular vesicles in the diagnosis and treatment of central nervous system diseases. Neural Regeneration Research. 15 (4), 586-596 (2020).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Hoen, E. N. M. N. -t, et al. Quantitative and qualitative flow cytometric analysis of nanosized cell-derived membrane vesicles. Nanomedicine: Nanotechnology, Biology and Medicine. 8 (5), 712-720 (2012).
- Gangadaran, P., Hong, C. M., Ahn, B. -C. An update on in vivo imaging of extracellular vesicles as drug delivery vehicles. Frontiers in Pharmacology. 9, 169(2018).
- Teare, G. F., Horan, P. K., Slezak, S. E., Smith, C., Hay, J. B. Long-term tracking of lymphocytes in vivo: the migration of PKH-labeled lymphocytes. Cellular Immunology. 134 (1), 157-170 (1991).
- Kuffler, D. P. Long-term survival and sprouting in culture by motoneurons isolated from the spinal cord of adult frogs. Journal of Comparative Neurology. 302 (4), 729-738 (1990).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Pužar Dominkuš, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta. Biomembranes. 1860 (6), 1350-1361 (2018).
- Dehghani, M., Gulvin, S. M., Flax, J., Gaborski, T. R. Systematic evaluation of PKH labelling on extracellular vesicle size by nanoparticle tracking analysis. Scientific Reports. 10 (1), 9533(2020).
- Shimomura, T., et al. New lipophilic fluorescent dyes for labeling extracellular vesicles: characterization and monitoring of cellular uptake. Bioconjugate Chemistry. 32 (4), 680-684 (2021).
- Yuan, D., et al. Macrophage exosomes as natural nanocarriers for protein delivery to inflamed brain. Biomaterials. 142, 1-12 (2017).
- Polanco, J. C., Li, C., Durisic, N., Sullivan, R., Götz, J. Exosomes taken up by neurons hijack the endosomal pathway to spread to interconnected neurons. Acta Neuropathologica Communications. 6 (1), 10(2018).
- Jurgielewicz, B. J., Yao, Y., Stice, S. L. Kinetics and specificity of HEK293T extracellular vesicle uptake using imaging flow cytometry. Nanoscale Research Letters. 15 (1), 170(2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados