Method Article
Megakaryosit Farklılaşması ve Trombosit Oluşumunu İncelemek için Hücre Kaynağı Olarak Leukodepletion Filtreleri-Türetilmiş CD34+ Hücreler
Bu Makalede
Özet
Bu protokol, lökofilter türevi CD34+ hematopoetik progenitörlerin elde edilmesi ve bunların kültür ortamında trombositleri serbest bırakabilen proplatelet taşıyan megakaryositlere in vitro farklılaşması ve olgunlaşması ile ilgili tüm adımları ayrıntılı olarak açıklar. Bu prosedür, megakaryopoezleri kontrol eden hücresel ve moleküler mekanizmaların derinlemesine analizi için yararlıdır.
Özet
İnsan hematopoetik progenitörlerin proplatletleri uzatabilen ve trombositleri serbest bırakabilen megakaryositlere in vitro genişlemesi ve farklılaşması, trombosit biyogenezinin altında kalan mekanizmaların derinlemesine incelenmesini sağlar. Mevcut kültür protokolleri çoğunlukla kemik iliği veya kordon kanından elde edilen hematopoetik progenitörlere dayanır ve bir dizi etik, teknik ve ekonomik endişeyi yükseltir. Periferik kandan CD34 hücreleri elde etmek için zaten mevcut protokoller varsa, bu makale kan merkezlerinde kolayca bulunan leukodepletion filtrelerinden CD34+ hücreleri elde etmek için basit ve optimize edilmiş bir protokol önermektedir. Bu hücreler, sekiz kan bağışına karşılık gelen kan transfüzyon ürünlerinin hazırlanmasında kullanılan leukodepletion filtrelerinden izole edilmiştir. Bu filtrelerin atılması gerekir. Cd34+ hücreleri olarak tanımlanan hematopoetik progenitörleri bu filtrelerden toplamak için ayrıntılı bir prosedür açıklanmıştır. Fenotipik evrimlerini tartışırken proplateletleri genişleten olgun megakaryositler elde etme yöntemi de ayrıntılı olarak açıktır. Son olarak, protokol, morfolojik ve işlevsel olarak yerel olanlara benzer trombositleri verimli bir şekilde serbest bırakmak için kalibre edilmiş bir pipetleme yöntemi sunar. Bu protokol, alttaki mekanizmaları parçalamak ve in vivo trombosit verimine yaklaşmak için sürecin çeşitli adımlarında hareket eden farmakolojik bileşiklerin değerlendirilmesi için bir temel görevi görebilirsiniz.
Giriş
Kan trombositleri, megakaryopoez (MKP) olarak bilinen sabit ve ince ayarlı bir üretim sürecinden kaynaklanan özel büyük poliploid hücrelerden, megakaryositlerden (MK) gelir. Bu sürecin en başında, kemik iliği ortamıyla temas halinde (sitokinler, transkripsiyon faktörleri, hematopoetik niş) çoğalabilecek ve hematopoetik progenitörlere (HP) dönüşebilecek ve olgunlaşmamışMK'larayol açan hematopoetik progenitörlere (HP) dönüşebilecek hematopoetik kök hücreler vardır. Çeşitli sitokinlerin ve özellikle MKP'nin ana sitokini olan trombopoietin (TPO) etkisi altında; MK daha sonra olgunlaşmanın iki ana aşamasından geçecektir: endokatoz ve sınır membranlarının (DMS) gelişimi. Bu tamamen olgun MK daha sonra sitoplazmik uzantılar yayabileceği bir sinüzoid damara yakın görünür, kan akışı altında serbest bırakılacak ve daha sonra fonksiyonel trombositler halinde yeniden şekillendirilecek proplateletler2. 19943'te TPO'nun klonlanması, HP farklılaşmasına ve MK olgunlaşmasına izin veren in vitro kültür tekniklerinin geliştirilmesini hızlandırarak MKP'nin çalışmasında bir destek sağladı.
Kan trombositlerini etkileyen birçok patoloji vardır, hem trombosit sayısı (artış veya azalma) hem de fonksiyon4,5. MKP in vitro'yu insan HP'sinden geri alabilmek, bu sürecin altında kalan moleküler ve hücresel mekanizmaların ve nihayetinde hastaların terapötik yönetiminin anlaşılmasını artırabilir.
çeşitli insan HP kaynakları uygundur: kordon kanı, kemik iliği ve periferik kan6,7,8. HP'nin periferik kandan toplanması, kordon kanından veya kemik iliğinden iyileşmelerinden daha az lojistik ve etik sorunları gündeme getirmektedir. HP lökerez veya buffy coat'dan kurtarılabilir, ancak bu kaynaklar pahalıdır ve kan merkezlerinde her zaman mevcut değildir. Daha az pahalı ve daha kolay gerçekleştirilen diğer protokoller, önceden CD34 tahrikli izolasyon4,8'egerek kalmadan insan periferik kan mononükleer hücrelerinin (PBMC' ler) doğrudan iyileşmesine izin verir. Bununla birlikte, megakaryositlerin saflığı bu yöntemle tatmin edici değildir ve MK'ye optimal farklılaşma için PBMC'den CD34+ hücre seçimi önerilir. Bu, beyaz kan hücrelerini çıkarmak ve böylece olumsuz immünolojik reaksiyonlardan kaçınmak için kan bankalarında rutin olarak kullanılan lökoredüksiyon filtrelerinden (LRF) bir HP saflaştırması uygulamamıza neden oldu9. Nitekim, 1998'den beri Trombosit konsantreleri Fransa'da otomatik olarak leukodeplet edilmiştir. Bu işlemin sonunda LRF atılır ve LRF'de tutulan tüm hücreler yok edilir. Bu nedenle, LRF'lerdeki hücreler ek ücret ödemeden kolayca kullanılabilir. LRF'ler, lökerez veya buffy coats tarafından elde edilene yakın bir hücresel içeriğe sahiptir, özellikle CD34 + HP bileşimlerinde onları son derece çekici bir kaynak10. Bir insan HP kaynağı olarak LRF, hücrelere sağlam fonksiyonel kapasiteler sağlamak için zaten gösterilmiştir11. Bu kaynak laboratuvar araştırmaları için bol ve uygun fiyatlı olma avantajına sahiptir. Bu bağlamda, bu makalede art arda açıklanmaktadır: i) CD34+ HP'nin LRF'lerden çıkarılması ve seçilmesi; ii) HP'nin megakaryositik yola olan bağlılığını ve proplatelet yayabilen MK'nın olgunlaşmasını yeniden düzenleyen iki fazlı optimize edilmiş bir kültür; iii) trombositleri bu MK'dan verimli bir şekilde serbest bırakmak için bir yöntem; ve iv) fenotipleme MK ve kültürlü trombositler için bir prosedür.
Protokol
Kontrol insan örnekleri, araştırmanın yapıldığı kan transfüzyon merkezi (Etablissement Français du Sang-Grand Est) tarafından işe alınan yazılı bilgilendirilmiş onay veren volonteer kan bağışçılarından alınmıştır. Tüm prosedürler Fransa Yükseköğretim ve Araştırma Bakanlığı tarafından tescil ve onaylanmış ve AC_2015_2371 numarası altında tescil edilmiştir.Bağışçılar, numunelerin araştırma amacıyla kullanılabilmesi için CODHECO numarası AC- 2008 - 562 onay formunda onay vermiştir. Helsinki bildirgesine göre insan çalışmaları yapıldı.
1. LRF'den CD34+ hücrelerinin (HP) çıkarılması ve seçimi
-
Reaktifin hazırlanması (bir LRF için)
- 25 mL filtrelenmiş elüsyon tamponu hazırlayın: 21,25 mL Fosfat Tamponlu Salin (PBS), 2,5 mL Asit-Sitrat-Dekstroz (ACD) ve 1,25 mL ayrışmış Fetal Sığır Serumu (FBS). 0,22 μm'ye filtreleyin ve 37 °C'ye yerleştirin.
- 2 mM etileniamintetraasetik asit (EDTA) ile 500 mL PBS hazırlayın.
- 25 mL yoğunluk degrade ortamını (DGM) (1.077 g/mL) iki adet 50 mL tüpe atın.
-
LRF geri yıkama yöntemleri (Şekil 1)
NOT: Bu adım, termoplastik borunun steril bağlantısını sağlayan steril bir tüp kaynak makinesi gerektirir.- İlk olarak, LRF'yi boş bir 600 mL transfer çantasına ve LRF'yi bir boru setine bağlayın (Şekil 1A). Biyogüvenlik kabininin altında, ele alınan LRF sayısına (xLRF x 25 mL) karşılık gelen filtrelenmiş ve hazırlanmış elüasyon tamponunun toplam hacmini boş torbaya enjekte edin. Daha sonra, çantanın tüm içeriğini LRF'den hafifçe epire etmek için 30 mL şırıngır kullanarak, hücreleri geri fırlayın ve yeni bir 50 mL tüpe aktarın (Şekil 1B).
- Kırmızı kan hücrelerinin çökeltilmesine, hücre süspansiyonunu Dextran% 2 ile yarı yarıya seyreltin ve kırmızı kan hücrelerini toplamak için iyice karıştırın. Oda sıcaklığında (RT) 30 dakika bekleyin.
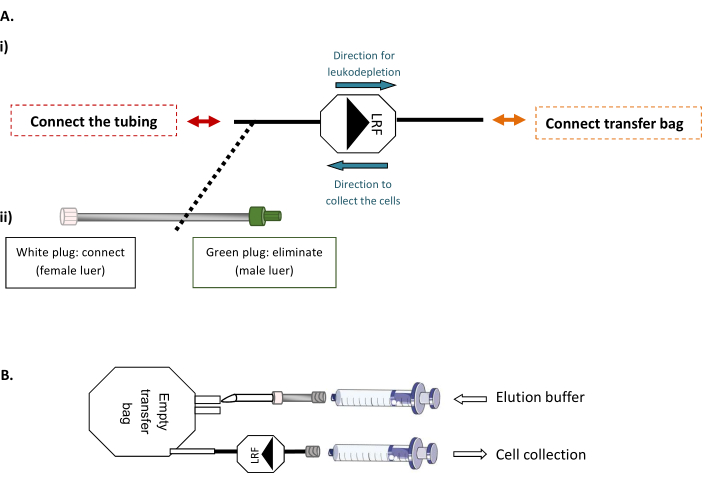
Şekil 1: LRF geri yıkama yöntemleri. (A) (i) transfer çantasının LRF'ye steril bağlantısı ve (ii) boru LRF'ye ayarlanmıştır. (B) Hücre toplama için şırınnaların bağlantısının temsili şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
-
PBMC koleksiyonu
- Kırmızı kan hücrelerinin tortulaşmasını takiben, süpernatantı çıkarın ve 50 mL'lik bir tüpe aktarın ve PBS-EDTA 2 mM ile doldurun. Yukarıda hazırlanmış DGM'ye süpernatantı hafifçe örtün. Yoğunluk gradyanının yüzey düzlemini kırmadan süpernatantın hafifçe akmasını sağlar. Frenleme modunda 30 dakika boyunca RT'de 400 x g'da santrifüj.
- PBMC katmanını tek kullanımlık transfer pipeti ile toplayın. Hücreleri her DGM tüpünden yeni bir steril 50 mL tüpe aktarın. Her tüpü PBS-EDTA 2 mM ile doldurun ve 50 mL PBS-EDTA 2 mM'de iki kez 200 x g'da RT'de 10 dakika boyunca fren modunda yıkayın.
- Pipet kapalı ve 50 mL PBS-EDTA 2 mM ile hücre pelet havuz.
NOT: Toplanan hücreleri gece boyunca 4 °C'de ajitasyon altında tutarak işlemi durdurma imkanı vardır. Ardından, oluşan agregaları çıkarmak için süspansiyonu 40 μm hücre süzgeçle filtreleyin.
-
CD34+ hücre seçimi
- Hücre numarasını ve santrifüjü oda sıcaklığında 400 x g'da 10 dakika boyunca mola ile belirleyin.
- Üstnatantı tamamen epire edin ve CD34 seçim kitinin üreticisi tarafından ayrıntılı olarak açıklanan uygun PBS-EDTA 2 mM hacminde yeniden biriktirin (108 hücre için 300 μL PBS-EDTA). FcR blokaj Reaktifini ve CD34 Mikrobeadlarını uygun konsantrasyonda ekleyin (108 hücre için 50 μL).
- 4 °C'de 30 dakika sonra, hücre süspansiyonu yıkayın ve CD34 seçim kitinin üreticisi tarafından ayrıntılı olarak açıklanan PBS-EDTA 2 mM'nin uygun hacminde yeniden biriktirin (108 hücre başına 500 μL).
NOT: Seçim, sütun başına en fazla 2 x 109 hücre geçişi için sütunları sıralama üzerine yapılır. - Numuneyi mıknatısın ıslak kolonunun üzerinden geçirin. 3 mL PBS-EDTA 2 mM ile iki kez yıkayın ve hücreleri 5 mL PBS-EDTA 2 mM ile elüte edin. Örneğin saflığını artırmak için aynı yordamı izleyen yeni bir sütunda ikinci bir çalışma gereklidir.
NOT: Beklenen sayıda 6.1 x 105 hücre/LRF (Şekil 2A). Daha yüksek LRF sayıları için reaktifleri ve yöntemleri buna göre ölçeklendirin.
-
CD34+ hücre saflığının değerlendirilmesi
- CD34+ seçiminden sonra elde edilen 100 μL süspansiyon, 2 μL insan CD34-PE antikoru veya 2 μL IgG - PE (kontrol) aliquot ekleyin. İyice karıştırın ve 4 °C'de 15 dakika kuluçkaya yatır.
- 5 dakika boyunca 400 x g'da 2 mL PBS ve santrifüj ekleyerek hücreleri yıkayın. Tamamen aspirat süpernatant ve PBS 200 μL resuspend.
- Şekil 2A'da ve Tartışma 'da gösterildiği gibi akış sitometrisine göre saflığı analiz edin.
NOT: CD34+ hücrelerinin %90'ın üzerinde saflığı beklenmektedir (Şekil 2Bii). - CD34+ hücrelerini doğrudan kullanın veya daha fazla kullanım için dondurun.
-
CD34+ hücreleri donuyor
NOT: CD34+ hücre dondurma işlemi mL başına 106 hücre yoğunluğunda yapılır.- CD34+ hücre numarası belirlemesini takiben, aşağıdaki kriyoprezervasyon ortamını hazırlayın: (1) %60 Stemspan + %40 FBS, (2) %40 Stemspan + %40 FBS + %20 Dimetil Sülfit (DMSO) ve 4 °C'de soğumaya izin verin.
- CD34+ hücrelerini oda sıcaklığında 400 x g'da 5 dakika santrifüjleyin ve peletin soğuk çözelti 1'de yeniden depolayın ve ardından hemen soğuk çözelti 2'ye (v/v) ekleyin.
- Kriyotüpleri hemen 24 saat boyunca -80 °C dondurucuya yerleştirin ve ardından kriyotütleri sıvı nitrojen tankına aktarın.
2. Olgun proplatelet taşıyan megakaryositler üretmek için CD34+ hücrelerinin kültürü ve farklılaşması
NOT: Hücre kültürü protokolü (Şekil 3A), hücre kültürü prosedürünün temsili şeması bu bölümde ayrıntılı olarak yer uzamaktadır.
-
CD34+ hücreleri çözülme (gerekirse)
- Çözme çözeltisini hazırlayın: 13 mL PBS-20% FBS ve 15 dakika boyunca 37 °C'ye yerleştirin. Kriyotütleri sadece bir küçük buz kristaline kadar 37 °C'lik bir su banyosuna hızlı bir şekilde aktarın. Biyolojik kültür kabini altında, tüm içeriği pipet ve yavaşça 13 mL önceden ısıtılmamış çözülme çözeltisi aktarın.
- Hücre numarasını ve hücre canlılığını belirleyin.
-
Kültür protokolü, adım 1: 0 günden 7. güne
NOT: Genellikle kültürler, 20.000 uygulanabilir hücre/cm2'yekarşılık gelen 40.000 uygulanabilir hücre/mL yoğunluğunda kuyu başına 1 mL orta ile 24 kuyu plakalarında yapılır. Herhangi bir ölçek büyütme planlanıyorsa bu yoğunluğa saygı duymak çok önemlidir.- Büyüme ortamı hazırlığı : Serumsuz hematopoetik hücre genleşme ortamlarında (daha önce 37 °C'ye ısıtılmış) Penisilin-Streptomisin-Glutamin (PSG) 1x, 20 μg / mL'de insan Düşük Yoğunluklu Lipoprotein (hLDL), megakaryosit genişlemesinin sitokin kokteyli 1x ve Stemregenin 1 (SR1) 1 μM'de ekleyin.
- Hücre tohumlama : Çözülen CD34+ hücrelerini oda sıcaklığında 400 x g'da 5 dakika santrifüjleyin. Üstnatant iyice çıkarın ve hücre peletini 1 mL kültür ortamına yeniden depola ve hücreleri tohumlamak için uygun hacmi belirlemek için hücre sayısını ve canlılığını gerçekleştirin.
- Hücreleri oda sıcaklığında 400 x g 5 dakika santrifüj edin ve peletin ılık büyüme ortamının uygun hacminde yeniden depolayın. Hücreleri 7 gün boyunca% 5 CO2 ile 37 ° C'de kuluçkaya yatırın.
-
Kültür protokolü, adım 2: 7 günden 13. güne kadar(Şekil 3B, 13. günde temsili görüntüler)
NOT: Genellikle kültürler, 25.000 uygulanabilir hücre/cm²'ye karşılık gelen 50.000 uygulanabilir hücre/mL yoğunluğunda kuyu başına 1 mL orta ile 24 kuyu plakalarında yapılır. Herhangi bir ölçek büyütme planlanıyorsa bu yoğunluğa saygı duymak çok önemlidir.- Olgunlaşma ortamı hazırlama: Serumsuz hematopoetik hücre genleşme ortamına (daha önce 37 °C'ye ısıtılmış) PSG 1x, 20 μg/mL'de hLDL, 50 ng/mL'de TPO ve 1 μM'de SR1 ekleyin.
- Mikroskop altındaki hücreleri inceleyin. 7. günde, hücreler çok bir arada olmadan kuyuları veya şişeleri doldurarak yuvarlak ve homojen bir görünüm sergilerler.
- Bir biyogüvenlik kabini altında, hücreleri 15 mL'lik bir tüpe hafifçe aktarın. PBS ile kuyuları yıkayın. Daha sonra, hücre sayısını ve hücreleri tohumlamak için uygun hacmi hesaplamak için canlılıklarını belirleyin.
- Hücreleri oda sıcaklığında 400 x g'da 5 dakika santrifüjlayın. Üst bileşeni çıkarın ve önceki adımda hesaplanan uygun sıcak ortam hacmindeki hücreleri yeniden biriktirin. Hücreleri 6 gün boyunca 37 °C, %5 CO2'de kuluçkaya yatırın.
-
13. günde kültürlü trombosit salınımı
- Kültüre 0,5 μM prostaglandine I2 (PGI2) ve 0,02 U/mL apyrase ekleyin ve 1 mL pipetle beş kez ardışık pipetleme gerçekleştirin.
NOT: Trombositler artık ortama salınır.
- Kültüre 0,5 μM prostaglandine I2 (PGI2) ve 0,02 U/mL apyrase ekleyin ve 1 mL pipetle beş kez ardışık pipetleme gerçekleştirin.
3. Akış sitometri analizi (MK fenotipleme ve kültürlü trombosit sayısı)
NOT: Bu protokol, seçili kültür günlerinde hücrelerin fenotiplemesine uygulanabilir. Ayrıca kültürlü trombosit salınımının sayısının belirlenmesine izin verir (Şekil 4A, B).
-
MK analizine hazırlık
- Dört mikrosantrifüj tüp setini aşağıdaki gibi etiketleyin: Kontrol olarak etiketlenmemiş hücreler, hücreler + 5 μL CD41 - Alexa Fluor 488, Hücreler + 5 μL CD34 - PECy7, Hücreler + 5 μL CD41 - Alexa Fluor 488 + 5 μL CD34 - PECy7. Tüp başına en az 1.105 hücre kullanın, tüp başına 1.106 hücreyi aşmayın. Sitotemetri tüpü başına 100 μL hücre süspansiyonu ve farklı antikorlar ekleyin. 4 °C'de 30 dakika karanlıkta kuluçkaya yaslanın.
- Ardından, tüp başına 2 mL PBS-EDTA 2 mM ekleyin ve oda sıcaklığında 5 dakika boyunca 400 x g'da santrifüj ekleyin. Santrifüjleme sırasında, PBS-EDTA 2 mM + 7-Aminoactinomycin-D (7AAD) (1/100) çözeltisi hazırlayın, tüp başına 300 μL çözeltiye izin verin.
- Üstnatantı çıkarın ve peleti 7AAD ile 300 μL PBS-EDTA 2 mM'de alın. Numuneleri akış sitometresi boyunca 30 dakika içinde çalıştırın.
NOT: Akış sitometrisi için analiz stratejisi Şekil 3C'de ve Tartışma'da gösterilmiştir.
-
Kültürlü trombosit analizi için tüp hazırlığı
- Dört mikrosantrifüj tüp setini aşağıdaki gibi etiketleyin: Kontrol olarak etiketlenmemiş hücreler, Hücreler + 5 μL CD41 - Alexa Fluor 488, Hücreler + 20 μL CD42a - PE, Hücreler + 5 μL CD41 - Alexa Fluor 488 + 20 μL CD42a - PE. Kültür kuyusunda art arda beş pipetlemenin ardından, kalibre edilmiş sayıda floresan boncuk içeren sitotmetri için süspansiyonun 300 μL'sini tüpe aktarın.
- Antikor ekleyin ve RT'de 30 dakika karanlıkta kuluçkaya yatırın.
- Numuneleri 30 dakika içinde akış sitometresi boyunca çalıştırın ve 5.000 boncuk geçişi için kazanımı ayarlayın.
NOT: Akış sitometrisi için analiz stratejisi Şekil 4B'de ve Tartışma'da gösterilmiştir.
Sonuçlar
LRF'lerden CD34+ hücrelerinin çıkarılması ve seçimi
Burada, Peytour ve ark.9'dantüretilen yöntem, lökosit çıkarılmasından sonra kan bankalarında bulunan atılmış LRF'lerden CD34+ hücrelerin çıkarılmasını ve seçilmesini açıklar. Geri tepme prosedürünü takiben, genellikle 1.03 x10 9 ± 2.45 x 108 hücre/ LRF (Ortalama±SEM; n = 155) % 94.88 ± 0.10 canlılık ile kurtarılır (Şekil 2A i). CD34 pozitif seçiminden sonra ortalama 615,54 x 103 ± 12,28 hücre/LRF elde edilir (n = 155) (Şekil 2A ii). Hücre sayısı 300.000'den azsa, prosedürün doğru şekilde gerçekleştirilmediği sonucuna varılmalı ve durdurulmalıdır. CD34 seçiminin başarısını değerlendirmek için, CD34+ hücrelerinin saflığı akış sitometrisi ile değerlendirilir (Şekil 2B). Rutin olarak, % 90'ın üzerinde bir saflık (%91,88 ± %0,79) beklenmektedir (Şekil 2B). %75'in altındaki bir saflık, protokolün yürütülmesinde ve özellikle sütunların elüasyonunda bir sorun olduğu anlamına gelebilir. %75 saflığın altında hücreler kültür deneyleri için korunmuyor.
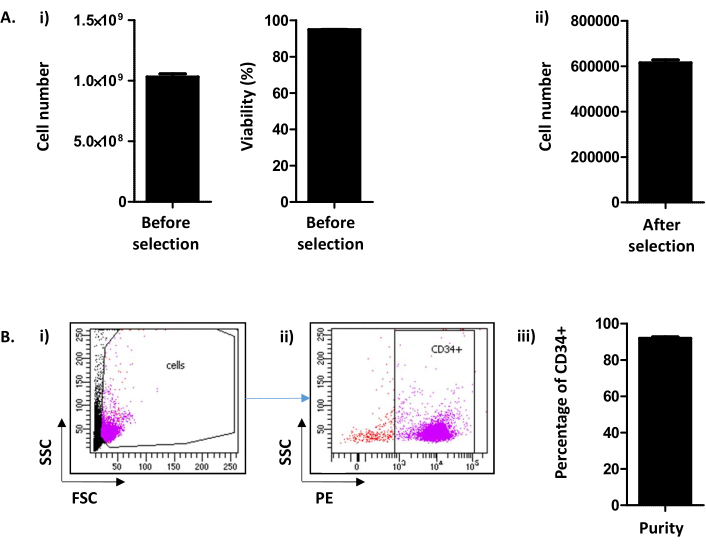
Şekil 2: CD34+ hücre numarası/LRF ve CD34 saflık analizi. (A) (i) Hücre sayacına göre, hem PBMC toplama hem de CD34 seçimi dahil olmak üzere prosedürden sonra elde edilen hücre sayısının ve canlılıklarının analizi yapılır ((1.03.109 ± 2.45.108 hücre/LRF (Ortalama ± SEM; n=155) 94,88 ± %0,10 (n = 155)) canlılığa sahiptir. (ii) CD34 seçiminden sonra hücre sayacına göre bir analiz de yapılır (615.54 x 103 ± 12.28 hücre/LRF (n = 155)). (B) CD34 Saflığı akış sitometrisi ile analiz edilir. (i) Hücreler CD34-PE antikoru ile boyandı ve FSC/SSC parametrelerinde tanımlandı. (ii) Dağılım sinyali ve CD34 ekspresyon analizine dayanarak saflık belirlenir. CD34 işaretleyicisinin negatif kontrolüne dayanarak CD34 pozitifliğinin bir ön kapısı kullanılmıştır. (iii) Çubuk grafikte de görülebileceği gibi CD34+ hücrelerinin %90'ın üzerinde (%91,88 ± %0,79 (n = 17)) saflık beklenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
MK taşıyan proplateletlerin farklılaşması ve olgunlaşması
Açıklanan hücre kültürü yordamı iki adıma ayrılmıştır. İlki, (D) 0'dan D7'ye kadar, sitokinlerin bir kombinasyonuna ve kimyasal bir bileşik SR1 eklenmesine yanıt olarak HP çoğalmasına ve megakaryositik yola bağlılığa adanmıştır. İkincisi, D7'den D13'e, TPO ve SR1'in eklenmesinden sonra MK olgunlaşma ve proplatlet uzantısına odaklanmıştır (Şekil 3A). Kültürün kalite kontrolü, hücre sayımı, hücre canlılığının belirlenmesi ve hücrelerin fenotiplenerek D7 ve D10'da perfomed olarak. Bu aşamalar, sırasıyla HP taahhüdü, D7 ve MK olgunlaşması, D10 (kişisel veriler) için çok önemli olduğu için seçilmiştir. D7 ve 10'da çoğalma rutin olarak x4,16 ± 0,25 (n = 34) ve x2,30 ± 0,16 (n = 5) arasındadır ve hücre canlılığı %86,38 ± ile %0,73 (n = 34) arasında olur; ve 84.80 ± 2.67% (n = 5) (Şekil 3B). Hücre fenotipleme ile ilgili olarak, Şekil 3C'de gösterildiği gibi, D0'da, hücrelerin% 90'ından fazlası CD34 için pozitiftir. Daha sonra, CD34+ hücreleri, MKP'nin belirli ve erken bir işareti olan CD41'in hayaletinin tanık olduğu gibi megakaryositik soyuna doğru bağlanır. Gerçekten de, D7'de, 50.20 ± hücrelerin% 2.90'ı hem CD34 hem de CD41 için pozitiftir (Şekil 3Bii). Daha sonra MK olgunlaşmalarını iyileştirir. D10'da MK'nın çoğunluğu olgundur ve hücrelerin %15,60'ından azı ± %4,70'i CD41, %47,90'ı ± %8,90'ı CD34+CD41+ ve %36,40'ı ± %12,40'ı CD34-CD41+ (Şekil 3Biii)için negatiftir.
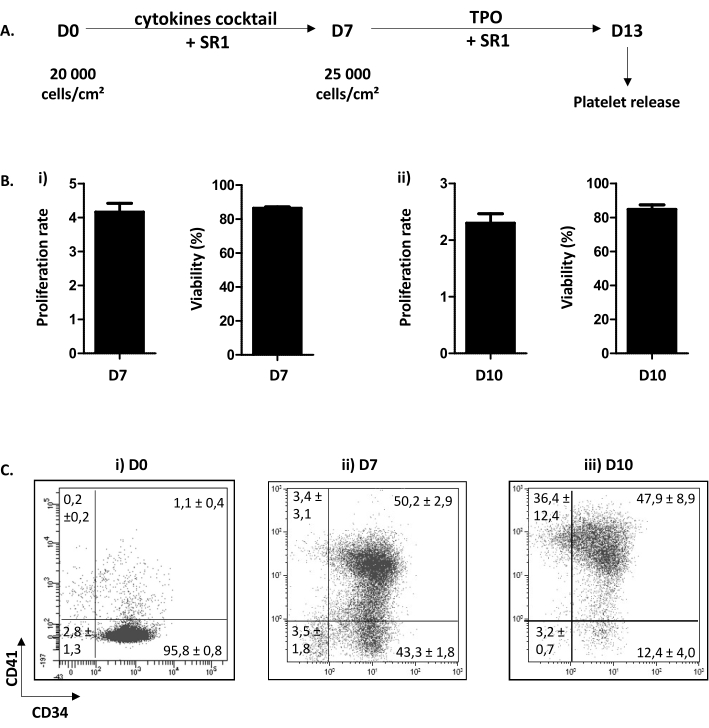
Şekil 3: MK taşıyan proplateletlerin farklılaşması ve olgunlaşması. (A) Hücre kültürü prosedürünün temsili şeması. İki adımlı bir yöntem kullanılır: D0'dan D7'ye bir çoğalma adımı (SR1 ve sitokin kokteyli) ve D7'den D13'e (SR1 ve TPO) olgunlaşma adımı. D13'te, kültürlü trombositler ardışık beş pipetlemenin ardından serbest bırakılabilir. (B) (i) D7'de çoğalma oranı (x4.16 ± 0.25 (n = 34)) ve hücre canlılığı (86.38 ± % 0.73 (n = 34)). (ii) D10'da çoğalma oranı (x2,30 ± 0,16 (n = 5)) ve hücre canlılığı (84,80 ± %2,67 (n = 5)). (C) Kültürde MK'nın fenotipik evriminin akış sitometri analizi durumu. D0'da hücrelerin %95.80'i ± %0.80'i CD34 pozitiftir (n = 3). D7'de 50.20 ± hücrelerin %2.90'ı CD34 ve CD41 pozitiftir. D10'da hücrelerin %4,70'i CD41 için negatif ± 15,60'tan azdır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kültürlü trombosit salınımı, 13.
D13'teki kuyuların incelenmesi yuvarlak MK ve proplatelet taşıyan MK 'yi göstermektedir (Şekil 4A). Kültürlü MK'nın ortalama %35'i proplateletleri12uzatır. Not olarak, D13 proplatlet uzantısı ve trombosit salınımı için en uygun günü temsil eder. Proplatelet yayabilen gerekli MK seviyesine ulaşılmazsa, kültür süreci boyunca bir şeyler ters gitmiş olmalı ve sonuçlar dikkate alınmamalıdır.
Olgun MK'dan trombosit salınımını teşvik eden kesin mekanizmalar hala yeçiz olsa da, hemodinamik kuvvetlerin vazgeçilmez olduğu iyi bilinmektedir. Bu kuvvetleri in vitroolarak taklit etmek için proplatelet taşıyan MK içeren süspansiyon, bir P1000 konisi ile beş kez aspire edilir ve püskürtülür ve daha sonra akış sitometrisi ile analiz edilir. Bu amaçla, kalibre edilmiş sayıda floresan boncuk içeren tüpler kullanılır. İlk olarak, tüpe bulunan boncuklar CD41-Alexa-fluor 488/PErcP-Cy5 penceresinde kapılıdır(Şekil 4Bi, kırmızı). Daha sonra, kültürlü trombositler, yerel trombositlerin ileri saçılım (FSC) ve yan dağılım (SSC) parametrelerinde belirlenen bir ön kapıda (trombosit benzeri elemanlar) görselleştirilir (Şekil 4Bii). Trombositlerin sayısı daha sonra CD41/CD42a pozitifliklerinde belirlenir (Şekil 4Biii). Hücre sayımı bu protokolde 5.000 boncukta durdurulur, ancak tedarikçinin önerisine bağlı olarak başka bir sabit numara kullanılabilir. Elde edilen verilerden, 5.000 boncuk başına sayılan trombosit sayısı rutin olarak ortalama 24,01 ± 92 (n = 15)(Şekil 4C)seviyesindedir. Akış sitometresi tarafından 5.000 boncuk saymak için emişli hacmi (her bir sitometre için hesaplanacak) ve toplam kültür hacmini bilerek, serbest bırakılan toplam kültür trombosit sayısının yaklaşık bir kısmını elde etmek mümkündür.
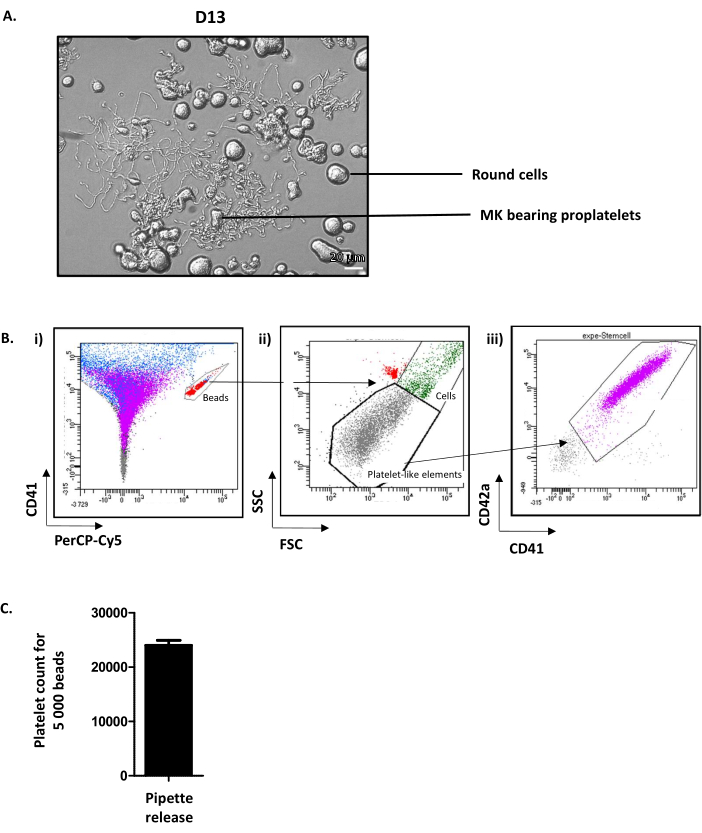
Şekil 4: Kültürlü trombositler 13. günde serbest bırakılsın. (A) D13'te proplatelet yayan MK'nın temsili ışık mikroskopi görüntüsü. (B) Kültürlü trombosit salınımı ölçme stratejisi. (i) Boncuklar CD41-Alexa-fluor 488/PErcP-Cy5 penceresinde (kırmızı) kapılıdır. (ii) Trombosit benzeri elemanlar, yerel trombositlerin (gri noktalar) FSC/SSC parametreleri üzerinde belirlenen bir kapıda görselleştirilir. (iii) Kültürlü trombositler CD41/CD42 pozitifliklerinde (mor) belirlenir. (C) Rutin olarak ortalama 24.011 ± 919 (n = 15) olmak üzere 5.000 boncuk başına sayılan trombosit sayısı elde edilebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bir bakışta prosedür
Yöntemi daha iyi özetlemek ve her adımı anlamak için, şekil 5'te protokolü adım adım özetleyen bir poster sunulmuştur. Bu özet sayfası kültür odasında görüntülenebilir ve not olarak kullanılabilir. Not olarak, denemelerin başarısı yalnızca sağlanan tabloda belirtilen ürün referanslarıyla garanti edilir.

Şekil 5: CD34+İzolasyonu . Protokolü adım adım özetleyen poster. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, kan türevi HP'den proplatelet yayabilen MK üretmek ve trombositleri kültür ortamından serbest bırakmak için bir yöntem açıklanmaktadır. HP, hücresel kan ürünlerindeki kontamine lökositleri gidermek ve advers reaksiyonları önlemek için kullanılan kan bankalarının bir yan ürünü olan LRF'den elde edilir. Bu yöntem nispeten basit olmasına rağmen, birkaç nokta özel ilgiyi hak ediyor.
Hücre süspansiyonunun yoğunluk degrade ortamında (adım 1.3.1) birikmesi, karışımdan (kırmızı içerik) kaçınmak için hafifçe yapılmalıdır. Bu adım dikkatli bir şekilde gerçekleştirilmezse, protokol bu noktada durmalıdır. Benzer şekilde, ayrıca 1.3.1 adımında, kesirlerin karıştırılmasını önlemek için frenin kapalı modda olması gerekir. Değilse, HP seçimi askıya alınmalıdır. Protokolde belirtildiği gibi, bölüm 1.4, prosedür PBMC koleksiyonundan sonra kesilebilir. Bu durumda, hücreler 4 ° C'de bir gecede ajitasyon altında tutulabilir. Ardından, oluşan agregaları çıkarmak için 40 μm hücre süzgeç kullanın, bu da sonraki CD34 seçimini etkileyebilir. Not olarak, prosedürün kesilmesi CD34+ hücrelerinin verimini ve saflığını etkilemez. CD34 seçiminin sonunda, önceki bir çalışmada MK'nın farklılaşması ve olgunlaşması bu saflığın altında zayıf olduğundan, hücrelerin tohumlanması için saflık% 75'ten fazla olmalıdır12 (Şekil 2).
Hücrelerin canlılığını etkilememek için hızlı bir şekilde yapılması gereken CD34+ hücrelerinin çözülmesine özel dikkat edilmelidir. Ek olarak, serum izi bırakmamak için yıkama adımları dikkatlice yapılmalıdır. MKP yoluna ve MK olgunlaşmasına en uygun CD34 taahhüdü için titizlikle seçildiği için hücre tohumlama yoğunluğuna uyulmalıdır (Şekil 3A).
MK'nın farklılaşması ve olgunlaşmasını takip etmek için bir hücre fenotipleme protokolü önerilmiştir. Bu protokol nispeten temeldir, ancak sitometrede güvenilir ayarlar sağlamak için her analiz günü için hem etiketsiz hem de tek etiketleme tüpleri olan tüm kontrol tüplerinin mevcut olması önemlidir. Kültürün sorunsuz çalıştığından emin olmak için, prosedür boyunca çoğalma bilgilerini toplamak önemlidir. D7'de ortalama çoğalma 2 ila 4 kat13 arasındadır. Bu çoğalma deneyler arasında çok az değişir, çünkü her LRF 8 donörden hücre içerir. Varyasyonları daha da yumuşatmak için, 4 ila 8 LRF'ye paralel olarak elde edilen hücreleri birleştirmek mümkündür.
Hücrelerin morfolojisine ışık mikroskopisi ile bakmak mümkündür, ancak hücreler sıcaklık değişimlerine duyarlı oldukları için her gün gözlenmemelidir. Hücreleri inkübatörden çıkarırken, proplatletlerin kırılmasını önlemek için yavaş hareketler yaptığınızdan emin olun.
Trombosit salınımı ile ilgili olarak, beş kez ardışık pipetleme gereklidir. Daha az yapmak, optimum trombosit salınımı sağlamaz ve daha fazlasını yapmak işlevlerine zarar vermez12. Bu adımdaki en önemli husus, trombosit salınımı14 , 15,16için gerekli düzenli bir akış oluşturmak için hassas ve düzenli hareketler kullanmaktır. Beş ardışık pipetleme yöntemi, bu nedenle, literatürde açıklanan verimlere dayanarak tatmin edici performans sonuçlarıyla basit ve kolay gerçekleştirilir. Serbest bırakılan trombositlerin sayısı, Şekil 4B'de gösterilen akış sitometri analizi stratejisi kullanılarak bölüm 3.3'tebelirtildiği gibi belirlenebilir. Serbest bırakılan trombositlerin kalitesi, do Sacramento ve ark. ultrayapı (morfoloji, boyut, granül içeriği) ve fonksiyon (hemostaz) açısından iyi belgelenmiştir ve bu kültürlü trombositlerin yerli olanlara çok benzediğini göstermiştir13.
Burada açıklanan protokol özellikle küçük hacimli kültürler için uygundur, ancak büyük ölçekli kültür için geçerli değildir. Bu nedenle, örneğin küçük moleküller, agonistler veya antagonistler ekleyerek trombosit üretimini yöneten moleküler ve hücresel mekanizmaları daha iyi anlamak için trombosit biyogenezinin incelenmesi için en uygun yöntemdir. Buna ek olarak, MK taahhüdünü, MK olgunlaşmasını ve trombosit üretimini düzenleyen mekanizmaları daha fazla keşfetmek için, CRISPR-Cas9 genom düzenleme yöntemi kullanarak CD34+ HP'yi genetik olarak manipüle etmek artık mümkündür.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma ANR (Agence National de la Recherche) Grant ANR- 17-CE14-0001-1 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
Referanslar
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır