Method Article
巨核球分化と血小板形成を研究する細胞源としての白血病の枯渇フィルター由来CD34+細胞
要約
このプロトコルは、ロイコフィルター由来CD34+造血前駆物質の取得に関与するすべてのステップと、培養培地中の血小板を放出することができる原血小板を持つ巨核球への それらの体外 分化および成熟について詳細に説明する。この手順は、巨核代を制御する細胞および分子機構の詳細な分析に有用である。
要約
ヒト造血前駆細胞を巨核球に分化し、プロ血小板を伸ばし、血小板を放出することができる インビトロ の拡大と分化により、血小板生物形成の根底にあるメカニズムの詳細な研究が可能になる。利用可能な培養プロトコルは、主に骨髄または臍帯血に由来する造血前駆物質に基づいており、倫理的、技術的、経済的な懸念の数を提起する。末梢血からCD34細胞を得るためのプロトコルが既に利用可能な場合、この原稿は、血液中枢で容易に入手可能な白血病減少フィルターからCD34+細胞を得るための簡単で最適化されたプロトコルを提案する。これらの細胞は、輸血製品の調製に使用される白血病枯渇フィルターから単離され、8つの献血に対応する。これらのフィルタは破棄されます。これらのフィルターからCD34+細胞として同定された造血前駆物質を収集する詳細な手順について説明する。プロメトレットを伸ばす成熟した巨核球を得る方法についても詳しく述べています。最後に、このプロトコルは、較正されたピペット法を提示し、形態学的および機能的に天然のものと類似した血小板を効率的に放出する。このプロトコルは、基礎となるメカニズムを解剖し、 インビボ 血小板収量に近づくプロセスの様々なステップで作用する薬理学的化合物を評価するための基礎として役立つことができる。
概要
血小板は、巨核球(MKP)として知られている一定の微調整された生産プロセスに由来する特殊な大きな多倍体細胞、巨核球(MK)から来ます。このプロセスの頂点には、骨髄環境(サイトカイン、転写因子、造血ニッチ)と接触して、巨核球体経路に向かってコミットできる造血前駆体(HP)に増殖し、分化することができる造血幹細胞があります。MKPの主要なサイトカインである様々なサイトカイン、特にトロンボポエチン(TPO)の影響を受ける。MKは成熟の2つの主要な段階を受ける:エンドミドーシスと境界膜(DMS)の開発。この完全に成熟したMKは、血液の流れの下で放出され、その後機能血小板2に改造される細胞質拡張、プロ血小板を放出することができるシヌソード血管の近くに現れる。1994年のTPOのクローニングは、HP の分化とMK成熟を可能にする インビトロ 培養技術の開発を加速させることによって、MKPの研究を後押しした。
血小板に影響を与える多くの病理があり、血小板数(増減)と機能4、5の両方の点で。ヒトHPから生体外でMKPを再現できることは、このプロセスの根底にある分子および細胞メカニズムの理解を深め、最終的には患者の治療管理を改善することができる。
ヒトHPのさまざまな供給源が適している:臍帯血、骨髄、および末梢血6、7、8。末梢血からHPを収穫することは臍帯血または骨髄からの回復より少ない物流および倫理的問題を提起する。HPは、白血病やバフィーコートから回収することができますが、これらの供給源は高価であり、常に血液中枢で利用可能であるとは限りません。他のプロトコルは、より安価で実行しやすく、以前のCD34駆動隔離4、8を必要とせずにヒト末梢血単核細胞(PBMC)を直接回復することを可能にする。しかし、この方法では巨核球の純度は満足のいくものではなく、MKへの最適な分化にはPBMCからCD34+細胞を選択することが推奨されています。これにより、白血球を除去し、免疫反応の悪性を避けるために血液バンクで日常的に使用される、白血病低減フィルター(LRF)からのHP精製を実施するに至った。確かに、1998年以来、フランスでは血小板濃縮物が自動的に白血病になってきた。このプロセスの終了時に、LRF は廃棄され、LRF に保持されているすべてのセルが破棄されます。したがって、LDF 内のセルは、追加コストなしで容易に利用できます。LDFは、白血病またはバフィーコートによって得られたものに近い細胞含有量を有し、特にCD34+HPの組成において、著しく魅力的なソース10を作る。ヒトHP源としてのLRFは、細胞に無傷の機能能力11を提供することが既に実証されている。このソースは、豊富で、実験室の研究のための手頃な価格であることの利点を持っています.この記事では、この資料では、続いて説明します: i) 抽出と LIF から CD34+ HP の選択;ii) 二相最適化培養, 巨核球経路へのHPのコミットメントとプロ血トを放出することができるMKの成熟;iii) これらのMKから血小板を効率よく放出する方法;iv) MKおよび培養血小板のフェノタイピングの手順。
プロトコル
ヒトのサンプルを制御することは、研究が行われた輸血センターによって募集された書面によるインフォームド・コンセントを与えたボロンティアの献血者から得られた(エタブリセメント・フランセ・デュ・サン・グラン・エスト)。すべての手続きはフランスの高等教育研究省によって登録され、承認され、AC_2015_2371数で登録されました。寄付者は、サンプルを研究目的で使用するために、CODHECO番号AC- 2008 - 562同意書で承認を与えました。人間の研究はヘルシンキ宣言に従って行われた。
1. LRFからのCD34+細胞(HP)の抽出と選択
-
試薬の調製 (1つのLRF用)
- 25 mLの濾過溶出バッファーを調製:リン酸緩衝食塩基線21.25 mL(PBS)、酸クエン酸デキストロース(ACD)2.5 mL、および1.25 mLの非補体ウシ胎児血清(FBS)を調製します。0.22 μmでフィルターし、37 °Cに置きます。
- エチレンジアミンテトラ酢酸(EDTA)の2 mMでPBS500mLを調製します。
- 25 mL の密度勾配媒体 (DGM) (1.077 g/mL) を 2 本の 50 mL チューブに入れ、
-
LRF バックフラッシュ モダリティ (図 1)
注:このステップは、熱可塑性チューブの滅菌接続を可能にする滅菌チューブ溶接機を必要とします。- まず、LRFを空の600 mL転送バッグに接続し、LRFをチューブセットに接続します(図1A)。バイオセーフティキャビネットの下で、取り扱ったLFLの数(xLRF x 25 mL)に対応するフィルタ処理および準備溶出バッファの総容量を空の袋に注入します。次いで、30mLシリンジを使用して、LRFを介して袋の内容物全体を穏やかに吸引し、バックフラッシュして細胞を新しい50mLチューブに移す(図1B)。
- 赤血球沈下に, Dextranで半分の細胞懸濁液を希釈 2% 赤血球を凝集するためによく混合.室温(RT)で30分待ちます。
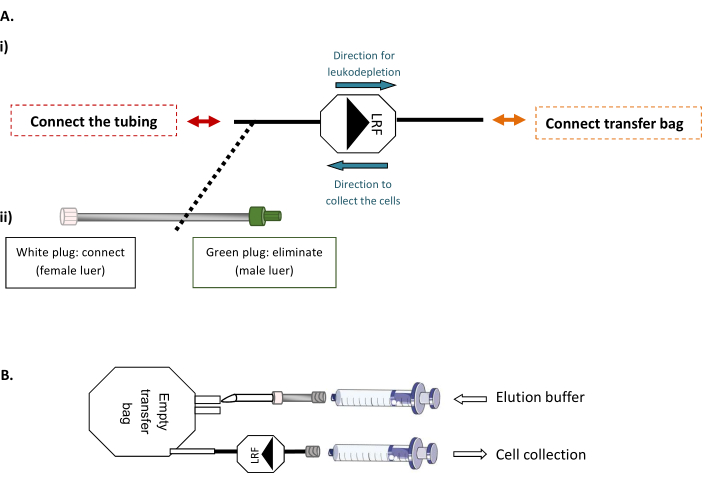
図1:LRFバックフラッシュモダリティ(A)LRFへの転写バッグの無菌接続と(ii)の管セットをLRFに設定した代表的なスキーム。(B) 細胞収集用の注射器の接続の代表的なスキーム。この図の大きなバージョンを表示するには、ここをクリックしてください。
-
PBMCコレクション
- 赤血球沈降に続いて、上清を50mLチューブに取り出して移し、PBS-EDTA 2 mMで満たします。上清を上で準備したDGMにそっと重ねます。密度勾配の表面面を壊さずに、上清が穏やかに流れましょう。ブレーキオフモードで30分間RTで400 x g で遠心分離機。
- 使い捨て可能な転送ピペットでPBMC層を収集します。各DGMチューブから新しい滅菌50 mLチューブに細胞を移します。各チューブにPBS-EDTA 2 mMを充填し、モードのブレーキでRTで10分間200 x g でPBS-EDTA 2 mMの50 mLで2回洗浄します。
- ピペットを外し、50 mL PBS-EDTA 2 mMで細胞ペレットをプールします。
注:夜間に4°Cで攪拌下で収集した細胞を維持することによって、手順を停止する可能性があります。次いで、40μmのセルストレーナーで懸濁液を濾過し、形成された凝集体を除去する。
-
CD34+ セルの選択
- 細胞数と遠心分離機を室温で400xgで10分間、ブレークオンで決定します。
- 上清を完全に吸引し、CD34選択キットのメーカーが詳述したPBS-EDTA 2 mMの適切な容積(108 セル用PBS-EDTAの300 μL)で再懸濁します。適切な濃度(108 細胞に対して50μL)のFcRブロッキング試薬とCD34マイクロビーズを加えます。
- 4°Cで30分後、細胞懸濁液を洗浄し、CD34選択キットのメーカー(108 細胞あたり500 μL)によって詳述されたPBS-EDTA 2 mMの適切な体積で再中断します。
注: 列ごとに最大 2 x 109 個のセルを並べ替える場合に選択します。 - 磁石の濡れたカラムの上にサンプルを渡します。3 mLのPBS-EDTA 2 mMで2回洗浄し、5 mLのPBS-EDTA 2 mMで細胞を溶出させます。サンプルの純度を向上させるためには、同じ手順に従って新しいカラムで2回目の実行が必要です。
注: 期待される数は 6.1 x 105 セル/LRF (図 2A)です。LRF数を増やす場合は、それに応じて試薬と方法をスケールアップします。
-
CD34+ 細胞純度の評価
- CD34+選択後に得られた懸濁液の100μLのアリコートに加えて、ヒトCD34-PE抗体の2μLまたはIgG-PEの2μL(対照)を加える。よく混ぜ、4°Cで15分間インキュベートします。
- 2 mLのPBSと遠心分離機を400xgで5分間加えて細胞を洗浄します。吸気上清は完全に200 μLのPBSで再懸濁します。
- 図 2Aおよび考察に示すように、フローサイトメトリーによる純度を分析します。
メモ: 90%を超える CD34+ セルの純度が期待されます (図 2Bii)。 - CD34+セルを直接使用するか、またはさらに使用するためにフリーズしてください。
-
CD34+ 細胞の凍結
注:CD34+細胞の凍結は、1mLあたり106 細胞の密度で行われます。- CD34+細胞数決定に続いて、(1)60%ステムスパン+40%FBS、(2)40%ステムスパン+40%FBS+20%ジメチルスルホキシド(DMSO)を調製し、4°Cで冷却します。
- CD34+細胞を室温で400xgで5分間遠心し、冷水1でペレットを再懸濁し、すぐに冷水溶液2(v/v)に加えます。
- クライオチューブを-80°Cの冷凍庫に24時間すぐに入れ、液体窒素タンクに凍結チューブを移します。
2. 成熟したプロ血小板を持つ巨核細胞を生産するCD34+細胞の培養と分化
注: 細胞培養プロトコル (図 3A))、細胞培養手順の代表的なスキームについては、このセクションで詳しく説明します。
-
CD34+ セルの解凍 (必要な場合)
- 解凍液を調製:PBS-20%FBSの13 mL、37°Cで15分間置きます。小さな氷の結晶が1つだけになるまで、37°Cの水浴にクライオチューブを素早く移します。生物培養キャビネットの下で、全含量をピペットし、13mLの前温融解液をゆっくりと移す。
- 細胞数と細胞生存率を決定します。
-
文化プロトコル、ステップ1:0日目から7日目まで
注:通常培養物は、20,000個の生存細胞/cm2に対応する40,000個の生存細胞/mLの密度で、ウェルあたり1mLの培地を有する24ウェルプレートで作られる。スケールアップが計画されている場合は、この密度を尊重することが重要です。- 成長培地製剤:無血清造血細胞拡張培地(以前は37°Cに加熱)でペニシリンストレプトマイシングルタミン(PSG)1x、ヒト低密度リポタンパク質(hLDL)を20μg/mLで、巨核球拡張1xおよびステムレゲニン1(SR1)のサイトカインカクテルを1μmμmで添加する。
- 細胞の播種: 解凍したCD34+細胞を室温で400 x g 5分間遠心します。上清を十分に除去し、培養培地の1mLで細胞ペレットを再懸濁し、細胞の分子数と生存率を行い、細胞を播種する適切な体積を決定する。
- 細胞400xgを室温で5分間遠心し、ペレットを適切な量の温成長培地で再懸濁させた。37°Cで細胞を5%CO2で7日間インキュベートします。
-
カルチャープロトコル、ステップ2:7日目から13日目(図3B、13日目の代表的画像)
注:通常、培養は25,000個の生存細胞/cm²に相当する50,000個の生存細胞/mLの密度で、ウェルあたり1mLの培地を有する24ウェルプレートで作られています。スケールアップが計画されている場合は、この密度を尊重することが重要です。- 成熟培地製剤:無血清造血細胞拡張培地(以前は37°Cに加熱)でPSG 1x、20 μg/mLでhLDL、50 ng/mLでTPO、1μMのSR1を加えます。
- 顕微鏡下で細胞を調べなさい。7日目には、細胞は、あまりにもコンフルエントにならずに井戸やフラスコを充填することによって、丸くて均質な外観を表示します。
- バイオセーフティキャビネットの下で、15 mLチューブ内の細胞を静かに移します。PBSで井戸を洗います。次に、細胞の数とそれらの生存率を決定し、細胞を播種する適切な体積を計算する。
- 室温で400xgで細胞を5分間遠心する。上清を取り除き、前のステップで計算したウォームメディアの適切な量のセルを再中断します。細胞を37°C、5%CO2で6日間インキュベートする。
-
13日目に培養血小板放出
- 0.5 μMのプロスタグランジンI2(PGI 2) と0.02 U/mLのアピローゼを培養物に加え、1 mLピペットで5回連続ピペットを行います。
注: 血小板がメディアに放出されるようになりました。
- 0.5 μMのプロスタグランジンI2(PGI 2) と0.02 U/mLのアピローゼを培養物に加え、1 mLピペットで5回連続ピペットを行います。
3. フローサイトメトリー解析(MKフェノタイピングおよび培養血小板数)
注: このプロトコルは、選択したカルチャの日にセルのフェノタイピングに適用できます。また、培養血小板放出の数の決定も可能にする(図4A、B)。
-
MK分析の準備
- マイクロ遠心チューブの4セットをコントロールとしてラベル付けし、細胞+ 5 μL CD41 - アレクサフルオール488、セル + 5 μL CD34 - PECy7、セル + 5 μL CD41 - Alexa Fluor 488 + 5 μL CD34 - PECy7.チューブあたり1.105 細胞以上を使用し、チューブあたり1.106 細胞を超えないようにしてください。細胞懸濁液の100 μLに細胞のチューブおよび異なる抗体を加えます。暗闇の中で4°Cで30分間インキュベートします。
- 次に、PBS-EDTA 2 mM/チューブ、遠心分離機を400 x g で加え、室温で5分間追加します。遠心分離の間に、PBS-EDTA 2 mM + 7-アミノアクチノマイシンD(7AAD)(1/100)の溶液を調製し、チューブあたり300 μL溶液を可能にします。
- 上清を取り出し、7AADでPBS-EDTA 2 mMの300 μLでペレットを取り込みます。30分以内にフローサイトメーターを通してサンプルを実行します。
注: フローサイトメトリーの解析戦略は 、図 3C および 「考察」に示されています。
-
培養血小板分析用チューブ調製
- マイクロ遠心チューブの4セットを次のようにラベル付けします:コントロールとしてラベルなし細胞、セル+ 5 μL CD41 - アレクサフルオール488、セル + 20 μL CD42a - PE、セル + 5 μL CD41 - アレクサフルオール488 + 20 μL CD42a - PE.培養ウェルで5回連続ピペット処理を行った後、キャリブレーションされた数の蛍光ビーズを含む細胞測定用のチューブに懸濁液300μLを移す。
- 抗体を追加し、30分間RTで暗闇の中でインキュベートします。
- 30分以内にフローサイトメーターを通してサンプルを実行し、5,000ビーズの通過のための取得を設定します。
注: フローサイトメトリーの解析方法は、図 4B および 「議論」に示されています。
結果
LIFからのCD34+セルの抽出と選択
ここで、Peytourら9に由来する方法は、白血球除去後に血液バンクで利用可能な廃棄されたLIFからのCD34+細胞の抽出および選択について説明する。バックフラッシュ手順に従って、通常1.03 x 109 ±2.45 x 108セル/LRF(平均±SEM;n = 155)は、94.88±0.10%の生存率で回収される(図2Ai)。 CD34陽性選択後、平均615.54 x 103±12.28細胞/LRFが得られる(n=155) (図2A ii)。セル数が 300,000 未満の場合は、手順が正しく実行されておらず、停止する必要があると結論付ける必要があります。CD34選択の成功を評価するために、CD34+細胞の純度はフローサイトメトリーによって評価される(図2B)。日常的には、90%以上の純度(91.88±0.79%)が期待されます(図2B)。純度が75%を下回ると、プロトコルの実施、特にカラムの溶出に問題があった可能性があります。75%以下の純度の細胞は培養実験のために保存されない。
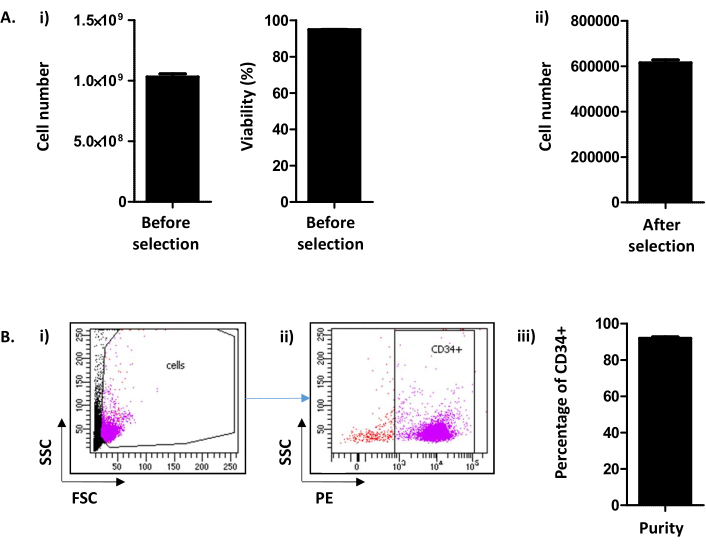
図2:CD34+セル数/LRFおよびCD34純度分析(A) (i) PBMCコレクションと CD34 選択の両方を含む、次の手順で得られる細胞数とその生存率の分析(1.03.109 ± 2.45.108セル/LRF(平均±SEM;n=155)の生存率は94.88±0.10%(n55))(ii)細胞カウンタによる分析は、CD34選択後も行われる(615.54 x 10 3±12.28細胞/LRF(n= 155))。(B)CD34純度はフローサイトメトリーで分析される。(i)細胞をCD34-PE抗体で染色し、FSC/SSCパラメータで同定した。(ii)散乱信号とCD34発現解析に基づいて、純度が決定される。CD34陽性のプレゲートは、CD34マーカーの陰性制御に基づいて使用された。(iii)棒グラフに見られるように、90%を超えるCD34+細胞の純度(91.88±0.79%(n=17))が期待される。この図の大きなバージョンを表示するには、ここをクリックしてください。
MK軸受プロマトレットの分化と成熟
記載した細胞培養手順は、2つのステップで分けられる。最初の1つは、日(D)0からD7まで、サイトカインと化学化合物SR1の添加の組み合わせに応答して、巨核球経路へのHP増殖とコミットメントに専念している。2番目のD7からD13は、TPOとSR1の追加に続くMK成熟およびプロ血小板拡張に焦点を当てています(図3A)。培養の品質管理として、細胞数、細胞生存率の決定、および細胞の表現型は、D7およびD10で浸透する。これらの段階は、それぞれHPコミットメント、D7とMK成熟、D10(個人データ)にとって重要であるために選択されています。D7と10では、増殖はx4.16±0.25(n = 34)とx2.30±0.16(n = 5)で、それぞれ86.38±0.73%(n =34)の間で構成される細胞生存率を有する。84.80 ± 2.67% (n = 5) (図 3B) 。図3Cに示すように、細胞表現型に関しては、D0では、CD34に対して90%以上の細胞が陽性である。そして、CD44+細胞は、MKPの特異的かつ初期のマーカーであるCD41の出現によって目撃されるように、巨核細胞系に向かってコミットされる。実際、D7では、50.20±細胞の2.90%がCD34とCD41の両方に陽性である(図3Bii)。その後、MKは成熟を改善します。D10では、MKの過半数が成熟しており、細胞の4.70%± がCD41の場合は4.70%未満、47.90±8.90%がCD34+ CD41 +36.40%±CD34-CD41+ (図3Biii)
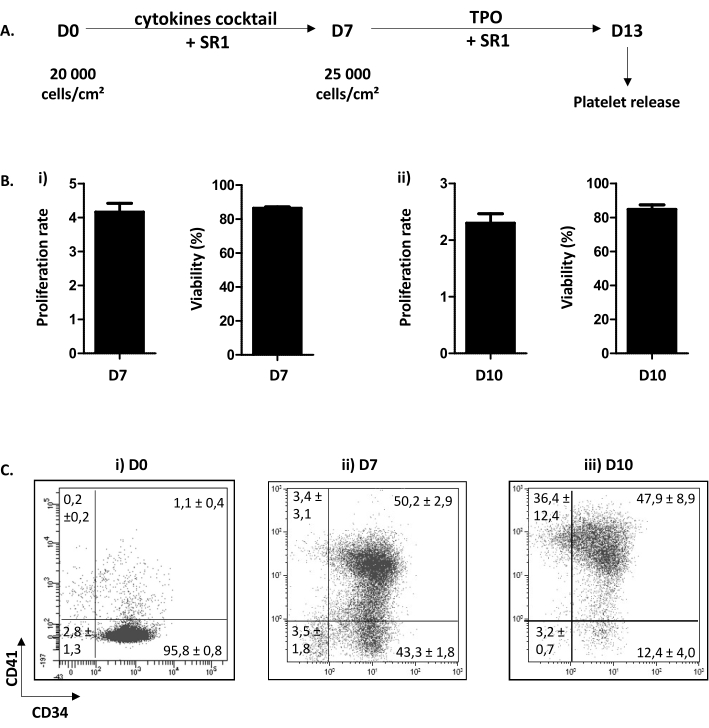
図3:MK軸受プロマトレットの異化と成熟 (A) 細胞培養手順の代表的なスキーム。D0からD7までの増殖ステップ(SR1およびサイトカインのカクテル)とD7からD13(SR1およびTPO)への成熟ステップの2段階の方法が使用される。D13では、培養血小板は、5回連続ピペット処理に続いて放出することができる。(B) (i) D7 (x4.16 ± 0.25 (n = 34)) および細胞生存率 (86.38 ± 0.73% (n = 34)) で増殖率。(ii) D10(x2.30 ± 0.16(n = 5))での増殖率および細胞生存率(84.80±2.67%(n = 5))(C)培養中のMKの形ノティピック進化のフローサイトメトリー分析のステートジー。D0では、95.80±0.80%の細胞がCD34陽性(n= 3)である。D7では、CD34およびCD41の細胞の50.20±2.90%が陽性である。D10では、CD41の細胞の4.70%が負の細胞±15.60未満です。 この図の大きなバージョンを表示するには、ここをクリックしてください。
培養血小板放出 13日目
D13での井戸の検査は、ラウンドMKとプロ血小板を持つMK(図4A)を示しています。培養MKの平均35%がプロ血小板12を拡張する。注目すべきは、D13はプロ血小板延長および血小板放出のための最適な日を表す。プロメトレットを放出できるMKの必要なレベルに達していない場合、培養プロセスに沿って何かが間違っている必要があり、結果を考慮すべきではありません。
成熟したMKからの血小板放出を促進する正確なメカニズムはまだ十分に理解されていないが、血行力が不可欠であることはよく知られている。これらの力を インビトロで模倣するために、プロメトレを含む懸濁液はP1000コーンで5回吸引し、そしてフローサイトメトリーによって分析される。この目的のために、多数の蛍光ビーズを含む管が使用される。まず、チューブに存在するビーズは、CD41-Alexa-fluor 488/PErcP-Cy5ウィンドウ(図4Bi、赤)にゲートされています。次いで、培養血小板をプレゲート(血小板様素子)で可視化し、ネイティブ血小板の前方散乱(FSC)および側散乱(SSC)パラメータで決定する(図4Bii)。その後、血小板の数は、CD41/CD42a陽性度で決定されます(図4Biii)。セルカウントは、5,000ビーズでこのプロトコルで停止されますが、サプライヤーの勧告に応じて別の固定数が使用される場合があります。取得したデータから、5,000個当たりの血小板数は、平均24.01±92(n=15)(図4C)で日常的に行われる。フローサイトメーターで吸引された体積を5,000個のビーズ(各サイトメーター毎に計算する)と培養の総量をカウントすることを知って、放出される培養血小板の総数の近似を得ることができる。
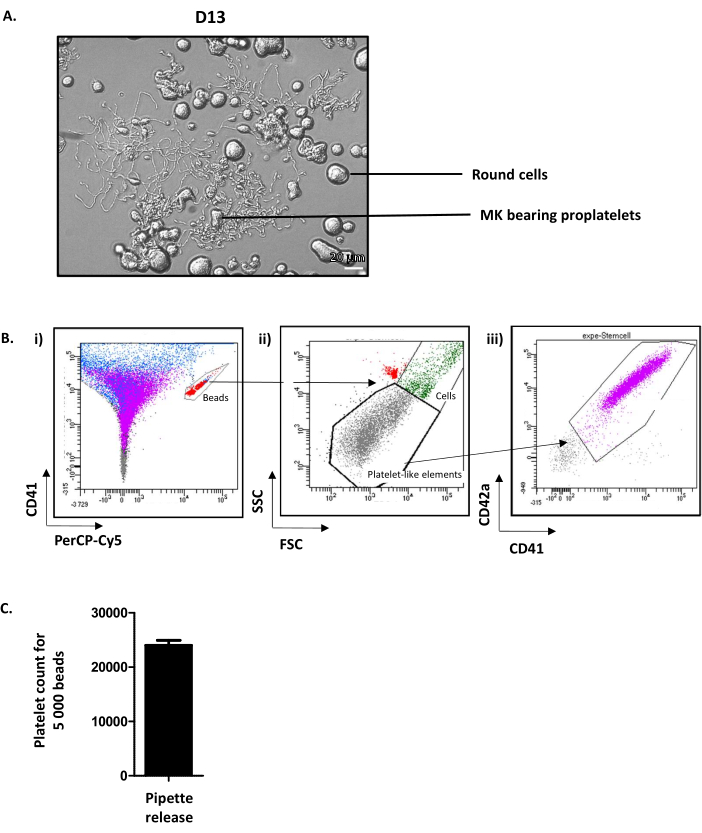
図4:培養血小板が13日目に放出する。(A)D13でのMK発光プロマテレットの代表的な光顕微鏡画像。(B) 培養血小板放出を定量化する戦略(i) ビーズは CD41-Alexa-fluor 488/PErcP-Cy5 ウィンドウ(赤)にゲートされています。(ii) 血小板状の素子は、ネイティブ血小板(灰色の点)のFSC/SSCパラメータで決定されたゲートで可視化される。(iii) 培養血小板は、そのCD41/CD42陽性(紫色)で決定される。(C)5,000個当たりの血小板数は、919±平均24,011個(n=15)で得られる。この図の大きなバージョンを表示するには、ここをクリックしてください。
一目でわかる手順
この方法をより詳しい方法と各ステップについて理解するために、プロトコルをステップごとに要約したポスターを図 5に示します。この集計シートは、文化室に表示し、メモとして使用できます。なお、実験の成功は、提供された表に示されている製品参照でのみ保証されます。

図5: CD34+の分離 プロトコルをステップバイステップで要約したポスター。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、血液由来HPからプロ血小板を放出し、培養培地から血小板を放出することができるMKを産生する方法を説明する。HPは、細胞血液産物から汚染された白血球を除去し、有害反応を避けるために使用される血液バンクの副産物であるLRFから得られる。この方法は比較的簡単ですが、いくつかの点は特別な注意を払うに値します。
密度勾配媒体上の細胞懸濁液の沈着(ステップ1.3.1)は、混合物(赤色含有量)を避けるために穏やかに行われね。この手順を慎重に実行しない場合、プロトコルはこの時点で停止する必要があります。同様に、ステップ1.3.1でも、分数を混ぜないようにブレーキをオフモードにする必要があります。ない場合は、HP の選択を中断する必要があります。プロトコル 1.4 に示されているように、PBMC コレクションの後に手順を中断できます。この場合、細胞は、4°Cで一晩攪拌下で維持することができる。 その後、40 μmのセルストレーナーを使用して形成された凝集体を除去し、その後のCD34選択に影響を与える可能性があります。なお、手順を中断してもCD34+細胞の収率や純度には影響しない。CD34選択の最後に、細胞を播種する純度は75%より大きくなければならない、以前の研究では、MKの分化および成熟がこの純度12を下回って悪かった(図2)。
CD34+細胞の解凍には特別な注意が払われなければならないが、これは細胞の生存率に影響を及ぼさないように迅速に行わなければならない。また、洗浄工程は、血清の痕跡を残さないように注意深く行う必要があります。MKP経路およびMK成熟への最適なCD34コミットメントのために厳密に選択された細胞の播種密度は尊重されなければならない(図3A)。
MKの分化と成熟に従う細胞のフェノタイピングプロトコルが提案されている。このプロトコルは比較的基本的ですが、サイトメーター上の信頼性の高い設定を確保するために、分析の各日に利用可能なすべての制御チューブ、ラベルなしと単一のラベリングチューブを持つことは重要です。培養を円滑に進めるためには、手順に沿って増殖の情報を収集することが重要です。D7では、平均増殖は2〜4倍13の間である。この増殖は、各LRFが8ドナー由来の細胞を含むため、実験間でほとんど異なる。さらにバリエーションを滑らかにするために、4~8個のLFを並列に得た細胞を組み合わせ得る。
光顕微鏡で細胞の形態を見ることは可能ですが、細胞は温度変動に敏感であるため、毎日観察すべきではありません。インキュベーターから細胞を取り除くときは、プロ血小板を壊さないようにゆっくりと動くようにしてください。
血小板放出に関しては、5回連続ピペットが必要である。少なくしても最適な血小板放出が保証されず、より多くのことを行うことは、その機能12に有害である。このステップで最も重要な側面は、正確かつ規則的な動きを使用して、血小板放出14、15、16に必要な規則的な流れを生成することです。5つの連続したピペットの方法は、したがって、文献に記載された収率に基づいて満足のいく性能結果を用いて簡単かつ容易に実行できる。放出された血小板の数は、図4Bに示すフローサイトメトリー解析の戦略を用いて、セクション3.3で述べた通りに決定することができる。放出された血小板の質は、超構造(形態、大きさ、顆粒含有量)および機能(止血)の点でDo Sacramentoらで十分に文書化されており、これらの培養された血小板が天然の血小板13と非常によく似ていることを実証している。
ここで説明するプロトコルは、特に小規模なカルチャに適していますが、大規模なカルチャには適用できません。したがって、例えば小分子、アゴニスト、またはアンタゴニストを加えることによって血小板産生を支配する分子および細胞機構をよりよく理解するために、血小板生物形成の研究に最適な方法である。さらに、MKのコミットメント、MK成熟、および血小板の産生を調節するメカニズムをさらに探求するために、CRISPR-Cas9ゲノム編集法を用いてCD34+HP を遺伝的に操作することが可能になりました。
開示事項
著者らは開示するものは何もない。
謝辞
この作品は、ANR(アジェンス・ナショナル・デ・ラ・レシェルシュ)グラントANR- 17-CE14-0001-1によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
参考文献
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved