Method Article
תאי CD34+ שמקורם במסנני לויקודלציה כמקור לתא לחקר בידול מגהקריוציט והיווצרות טסיות דם
In This Article
Summary
פרוטוקול זה מתאר בפירוט את כל השלבים הכרוכים בהשגת CD34+ hematopoietic שמקורם ב- leukofilter ואת בידול המבחנה וההתבגרות שלהם למגקריוציטים נושאי פרופלטלט המסוגלים לשחרר טסיות דם במדיום התרבותי. הליך זה שימושי לניתוח מעמיק של מנגנונים תאיים ומולקולריים השולטים megakaryopoiesis.
Abstract
הרחבת במבחנה ובידול של אבות hematopoietic אנושי לתוך megakaryocytes מסוגל להאריך את מרחיבים ושחרור טסיות מאפשר מחקר מעמיק של המנגנונים שבבסיס ביוגנזה טסיות דם. פרוטוקולי התרבות הזמינים מבוססים בעיקר על אבות hematopoietic נגזר מח עצם או דם טבורי העלאת מספר חששות אתיים, טכניים וכלכליים. אם יש כבר פרוטוקולים זמינים להשגת תאי CD34 מדם היקפי, כתב יד זה מציע פרוטוקול פשוט וממוטב להשגת תאי CD34+ ממסנני לויקו-פלציה הזמינים במרכזי דם. תאים אלה מבודדים ממסנני לויקודלציה המשמשים להכנת מוצרי עירוי דם, המתאימים לשמונה תרומות דם. מסננים אלה אמורים להימחק. הליך מפורט לאיסוף אבות hematopoietic מזוהה כתאי CD34 + ממסננים אלה מתואר. השיטה להשיג megakaryocytes בוגר הרחבת פרופלטלטים תוך כדי דיון האבולוציה הפנוטיפית שלהם מפורט גם. לבסוף, הפרוטוקול מציג שיטת צנרת מכוילת, כדי לשחרר ביעילות טסיות דם הדומות מבחינה מורפולוגית ופונקציונלית לאלה ילידים. פרוטוקול זה יכול לשמש בסיס להערכת תרכובות פרמקולוגיות הפועלות בשלבים שונים של התהליך כדי לנתח את המנגנונים הבסיסיים ולגשת לתשואות טסיות ה- in vivo.
Introduction
טסיות הדם מגיעות מתאי פוליפלואיד גדולים מיוחדים, המגקריוציטים (MK), שמקורם בתהליך ייצור קבוע ומכוון המכונה megakaryopoiesis (MKP). בשיאו של תהליך זה נמצאים תאי גזע hematopoietic אשר, במגע עם סביבת מח העצם (ציטוקינים, גורמי שעתוק, נישה hematopoietic), יוכלו להתרבות ולהבדיל לתוך אבות hematopoietic (HP) מסוגל להתחייב לכיוון המסלול megakaryocytic, יצירת חברי פרל"ק לא בשלים1. בהשפעת ציטוקינים שונים, ובמיוחד תרומבו-אפיטין (TPO), שהוא הציטוקינים העיקריים של MKP; לאחר מכן יעבור הח"כ שני שלבים עיקריים של התבגרות: אנדומיטוזיס ופיתוח ממברנות תיחום (DMS). ח"כ בוגר לחלוטין זה מופיע אז קרוב לכלי סינויד שבו הוא יכול לפלוט הרחבות ציטופלסמיות, את proplatelets, אשר ישוחררו תחת זרימת הדם ולאחר מכן שופץ לתוך טסיות תפקוד2. השיבוט של TPO בשנת 1994 3 סיפקדחיפה במחקר של MKP על ידי האצת הפיתוח של טכניקות תרבות במבחנה המאפשרות בידול HP והתבגרות MK.
ישנן פתולוגיות רבות המשפיעות על טסיות הדם, הן מבחינת מספר טסיות הדם (עלייה או ירידה) והן מבחינת פונקציה4,5. היכולת לשחזר את MKP במבחנה של HP האנושית יכולה לשפר את ההבנה של המנגנונים המולקולריים והתאים שבבסיס תהליך זה ובסופו של דבר את הניהול הטיפולי של המטופלים.
מקורות שונים של HP האנושית מתאימים: דם טבורי, מח עצם, ודם היקפי6,7,8. קצירת HP מדם היקפי מעלה פחות בעיות לוגיסטיות ואתיות מאשר החלמתן מדם טבורי או ממח העצם. ניתן לשחזר את HP מלוקפרזיס או מעיל באפי, אך מקורות אלה יקרים ולא תמיד זמינים במרכזי דם. פרוטוקולים אחרים, פחות יקר וקל לביצוע, מאפשרים התאוששות ישירה של תאים מונונוקלאריים בדם היקפי אנושי (PBMCs) ללא צורך בבידוד מונע CD34 קודם4,8. עם זאת, טוהר המגקריוציטים אינו משביע רצון בשיטה זו ובחירה של תאי CD34+ מ- PBMC מומלצת לבידול אופטימלי לח"כ. זה הוביל אותנו ליישם טיהור HP ממסנני לויקורדוקציה (LRF), המשמש באופן שגרתי בבנקי דם כדי להסיר תאי דם לבנים ובכך למנוע תגובות חיסוניות שליליות9. ואכן, מאז 1998, תרכיזי טסיות דם כבר אוטומטי לויקודל בצרפת. בסוף תהליך זה, LRF נמחקים וכל התאים שנשמרו ב- LRF נהרסים. תאים במפות ה-LR הם, אם כן, זמינים ללא עלות נוספת. ל-LRFs יש תוכן סלולרי קרוב לזה המתקבל על ידי לויקפרזיס או במעילי באפי, במיוחד בהרכב של CD34+ HP, מה שהופך אותם למקור אטרקטיבי להפליא10. LRF כמקור HP אנושי כבר הוכח לספק לתאים יכולות תפקודיות שלמות11. מקור זה יש את היתרון של להיות בשפע ובמחיר סביר למחקר מעבדה. בהקשר זה, מאמר זה מתאר ברציפות: i) את החילוץ והבחירה של CD34+ HP מ- LRFs; ii) תרבות ממוטבת דו-פאזית, אשר משחזרת את המחויבות של HP למסלול המגקריוציטי והבשלת ח"כים המסוגלים לפלוט מפיץ; iii) שיטה לשחרור יעיל של טסיות דם מח"כים אלה; ו-4) הליך של ח"כ פנוטיפינג וטסיות דם תרבותיות.
Protocol
דגימות אנושיות שליטה התקבלו מתורמי דם וולונטרים שנתנו הסכמה מדעת בכתב שגויסה על ידי מרכז עירוי הדם שבו בוצע המחקר (Etablissement Français du Sang-Grand Est). כל ההליכים נרשמו ואושרו על ידי המשרד הצרפתי להשכלה גבוהה ומחקר ונרשמו תחת המספר AC_2015_2371.התורמים נתנו את אישורם בטופס ההסכמה AC- 2008 - 562, על מנת שהדגימות ישמשו למטרות מחקר. מחקרים בבני אדם בוצעו על פי הצהרת הלסינקי.
1. מיצוי ובחירה של תאי CD34+ (HP) מ- LRF
-
הכנת ריאגנט (עבור LRF אחד)
- הכן 25 מ"ל של חוצץ אלוטיון מסונן: 21.25 מ"ל של תמיסת מלח חוצפת פוספט (PBS), 2.5 מ"ל של חומצה-סיטראט-דקסטרוז (ACD) ו 1.25 מ"ל של סרום בקר עוברי מפורק (FBS). מסננים על 0.22 מיקרומטר ומניחים ב 37 °C (50 °F).
- הכן 500 מ"ל של PBS עם 2 מ"מ של חומצה אתילנדיאמינטטראצטית (EDTA).
- יש להיפטר מ-25 מ"ל של מדיום הדרגתי בצפיפות (DGM) (1.077 גרם/מ"ל) בשני צינורות 50 מ"ל.
-
שיטות שטיפה אחורית של LRF (איור 1)
הערה: שלב זה דורש מכונת ריתוך צינור סטרילי, המאפשר חיבור סטרילי של צינורות תרמופלסטיים.- ראשית, חברו את ה-LRF לתיק העברה ריק של 600 מ"ל ול-LRF לסט צינורות(איור 1A). תחת ארון הבטיחות הביולוגית, הזרק את הנפח הכולל של מאגר אלוטיון מסונן ומוכן המתאים למספר ת.ז',500 שטופלו (xLRF x 25 מ"ל) לתוך השקית הריקה. לאחר מכן, באמצעות מזרק 30 מ"ל כדי לשאוף בעדינות את כל התוכן של התיק דרך LRF, backflush ולהעביר את התאים לתוך צינור חדש 50 mL (איור 1B).
- כדי משקעים תאי הדם האדומים, לדלל את השעיית התא על ידי חצי עם Dextran 2% ומערבבים היטב לצבור תאי דם אדומים. המתן 30 דקות בטמפרטורת החדר (RT).
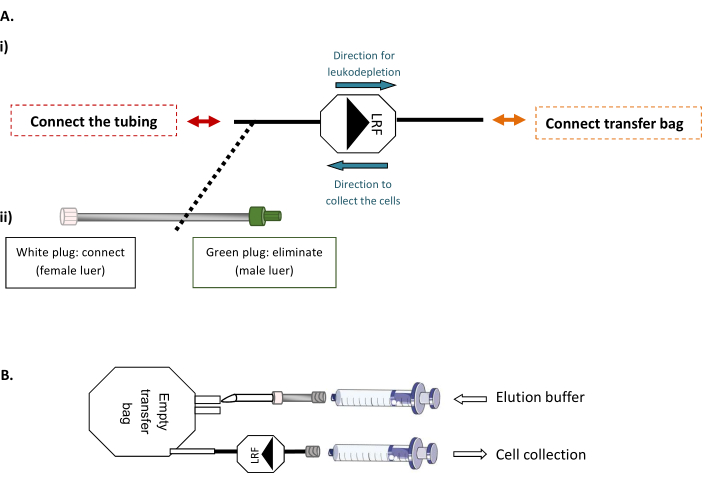
איור 1: שיטות שטיפה אחוריות של LRF. (A)תוכנית מייצגת של (i) החיבור הסטרילי של תיק ההעברה ל- LRF ו -( ii) את צינורות להגדיר LRF. (B)ערכה מייצגת של חיבור המזרקים עבור איסוף תאים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
-
אוסף PBMC
- בעקבות משקעים תאי הדם האדומים, להסיר ולהעביר את supernatant לתוך צינור 50 מ"ל ולמלא אותו עם PBS-EDTA 2 mM. לכסות בעדינות את supernatant על DGM מוכן לעיל. תן לסופר-טבעי לזרום בעדינות מבלי לשבור את מישור פני השטח של שיפוע הצפיפות. צנטריפוגה ב 400 x g ב RT במשך 30 דקות במצב בלימה.
- אסוף את שכבת PBMC עם פיפטה העברה חד פעמית. העבר את התאים מכל צינור DGM לתוך צינור סטרילי חדש 50 מ"ל. מלא כל צינור עם PBS-EDTA 2 mM ולשטוף פעמיים ב 50 מ"ל של PBS-EDTA 2 mM ב 200 x g במשך 10 דקות ב RT במצב בלם על.
- פיפטה את ולאגד את גלולה התא עם 50 מ"ל PBS-EDTA 2 מ"מ.
הערה: יש אפשרות להפסיק את ההליך על ידי שמירה על התאים שנאספו תחת עצבנות ב 4 °C (50 °F) במהלך הלילה. לאחר מכן, לסנן את ההשעיה עם מסננת תא 40 מיקרומטר כדי להסיר את האגרגטים שנוצרו.
-
בחירת תאים של CD34+
- קבע את מספר התא ואת הצנטריפוגה ב 400 x g בטמפרטורת החדר במשך 10 דקות עם ההפסקה על.
- שאף את supernatant לחלוטין resuspend בנפח המתאים של PBS-EDTA 2 mM המפורטים על ידי היצרן של ערכת הבחירה CD34 (300 μL של PBS-EDTA עבור 108 תאים). הוסף את FcR חסימת ריאגנט ואת CD34 Microbeads בריכוז המתאים (50 μL עבור 108 תאים).
- לאחר 30 דקות ב 4 °C (5 °F), לשטוף את השעיית התא resuspend בנפח המתאים של PBS-EDTA 2 mM המפורטים על ידי היצרן של ערכת הבחירה CD34 (500 μL לכל 108 תאים).
הערה: הבחירה נעשית במיון עמודות למעבר של 2 x 109 תאים לכל עמודה. - תעביר את הדגימה מעל העמוד הרטוב של המגנט. לשטוף פעמיים עם 3 מ"ל של PBS-EDTA 2 mM ול elute התאים עם 5 מ"ל של PBS-EDTA 2 mM. ריצה שנייה בעמודה חדשה לאחר אותו הליך נחוצה כדי לשפר את טוהר המדגם.
הערה: מספר צפוי של 6.1 x 105 תאים /LRF (איור 2A). לקבלת מספרי LRF גבוהים יותר, הרחב ריאגנטים ושיטות בהתאם.
-
הערכה של טוהר תאים CD34+
- הוסף aliquot של 100 μL של השעיה שהתקבל לאחר CD34+ בחירה, 2 μL של נוגדן CD34-PE אנושי או 2 μL של IgG - PE (שליטה). מערבבים היטב ודגרה במשך 15 דקות ב 4 °C (7 °F).
- לשטוף תאים על ידי הוספת 2 מ"ל של PBS וצנטריפוגה ב 400 x g במשך 5 דקות. שאף סופרנט לחלוטין ו resuspend ב 200 μL של PBS.
- נתחו את הטוהר לפי ציטומטריית זרימה כפי שמוצג באיור 2A ובדיון.
הערה: צפוי טוהר של תאי CD34+ מעל 90% (איור 2Bii). - השתמש ישירות בתאי CD34+ או קפא לשימוש נוסף.
-
CD34+ תאים קופאים
הערה: CD34+ תאים הקפאה נעשית בצפיפות של 106 תאים לכל mL.- לאחר קביעת מספר התא CD34+ , הכן את מדיית ההקפאה הבאה: (1) 60% Stemspan + 40% FBS, (2) 40% Stemspan + 40% FBS + 20% דימתיל סולפוקסיד (DMSO) ואפשר קירור ב-4 °C (7%).
- צנטריפוגה CD34 + תאים ב 400 x גרם בטמפרטורת החדר במשך 5 דקות ו resuspend הכדור בתמיסה קרה 1 ולאחר מכן מיד להוסיף לפתרון קר 2 (v / v).
- מניחים את cryotubes מיד לתוך -80 °C מקפיא במשך 24 שעות ולאחר מכן להעביר קריוטיוב לתוך מיכל חנקן נוזלי.
2. תרבות ובידול של תאי CD34+ לייצור מגהקריוציטים נושאי פרופלטים בוגרים
הערה: פרוטוקול תרבית תאים (איור 3A), ערכה מייצגת של הליך תרבית התא מפורטת בסעיף זה.
-
CD34+ תאים מפשירים (במידת הצורך)
- הכן את פתרון ההפשרה: 13 מ"ל של PBS-20% FBS ומניחים ב 37 °C (75 °F) במשך 15 דקות. מעבירים במהירות את הקריוטיוב לאמבט מים של 37 מעלות צלזיוס עד לקריסטל קרח אחד קטן בלבד. תחת ארון התרבות הביולוגית, pipette את כל התוכן, ולאט לאט להעביר ב 13 מ"ל של פתרון הפשרה מחמם מראש.
- קבע את מספר התא ואת הכדאיות של התא.
-
פרוטוקול תרבות, שלב 1: מיום 0 ועד היום 7
הערה: בדרך כלל תרביות נעשות לוחות 24-well עם 1 מ"ל של בינוני לבאר בצפיפות של 40,000 תאים קיימא / מ"ל, המקביל 20,000 תאים קיימא / ס"מ2. חשוב לכבד צפיפות זו אם מתוכנן שינוי קנה מידה כלשהו.- הכנה בינונית צמיחה : במדיית הרחבת תאים המטופיאטיים ללא סרום (שחוממה בעבר ל-37 °C) מוסיפים פניצילין-סטרפטומיצין-גלוטמין (PSG) 1x, ליפופרוטאין אנושי בצפיפות נמוכה (hLDL) ב-20 מיקרוגרם/מ"ל, קוקטייל ציטוקינים של הרחבת מגה-קריוציט 1x ו-Stemregenin 1 (SR1) ב-1 מיקרומטר.
- זריעת תאים : צנטריפוגה CD34 + הפשרה תאים ב 400 x גרם בטמפרטורת החדר במשך 5 דקות. הסר ביסודיות את supernatant ו resuspend גלולה התא ב 1 מ"ל של מדיה תרבית ולבצע ספירת תאים ושמיה כדי לקבוע את הנפח המתאים כדי לזרוע את התאים.
- צנטריפוגות התאים 400 x g בטמפרטורת החדר במשך 5 דקות resuspend הכדור בנפח המתאים של מדיום הצמיחה החמה. לדגור על התאים ב 37 °C (5% CO2) במשך 7 ימים.
-
פרוטוקול תרבות, שלב 2: מהיום השביעי ועד היום ה-13(איור 3B, תמונות מייצגות ביום 13)
הערה: בדרך כלל תרביות נעשות לוחות 24-well עם 1 מ"ל בינוני לבאר בצפיפות של 50,000 תאים קיימא / מ"ל, המקביל 25,000 תאים קיימא / cm². חשוב לכבד צפיפות זו אם מתוכנן שינוי קנה מידה כלשהו.- הכנה בינונית להבשלה: במדיית הרחבת תאים המטופויאטיים ללא סרום (שחוממה בעבר ל-37 °C) הוסיפו PSG 1x, hLDL ב-20 מיקרוגרם/מ"ל, TPO ב-50 ננוגרם/מ"ל ו-SR1 ב-1 מיקרומטר.
- בחן את התאים מתחת למיקרוסקופ. ביום 7, תאים מציגים מראה עגול והומוגני על ידי מילוי בארות או הבקבוקונים מבלי להיות יותר מדי.
- תחת ארון בטיחות ביולוגית, בעדינות להעביר את התאים בצינור 15 מ"ל. לשטוף בארות עם PBS. לאחר מכן, לקבוע את מספר התאים ואת הכדאיות שלהם כדי לחשב את אמצעי האחסון המתאים לזרוע את התאים.
- צנטריפוגות התאים ב 400 x גרם בטמפרטורת החדר במשך 5 דקות. הסר את supernatant ו resuspend התאים בנפח המתאים של מדיה חמה מחושב בשלב הקודם. לדגור על התאים ב 37 °C (5 °F), 5% CO2 במשך 6 ימים.
-
שחרור טסיות דם תרבותיות ביום 13
- הוסף 0.5 μM של פרוסטגלנדין I2 (PGI2) ו 0.02 U / mL של apyrase לתרבות ולבצע צנרת רצופה חמש פעמים עם פיפטה 1 מ"ל.
הערה: טסיות דם משתחררות כעת למדיום.
- הוסף 0.5 μM של פרוסטגלנדין I2 (PGI2) ו 0.02 U / mL של apyrase לתרבות ולבצע צנרת רצופה חמש פעמים עם פיפטה 1 מ"ל.
3. ניתוח ציטומטריית זרימה (MK פנוטיפינג וטסיות דם תרבותיות לספור)
הערה: פרוטוקול זה יכול להיות מיושם על phenotyping של התאים בימי התרבות שנבחרו. זה גם מאפשר את קביעת מספר שחרור טסיות הדם התרבותי(איור 4A,B).
-
הכנה לניתוח ח"כים
- תייג ארבעה סטים של צינורות microcentrifuge כדלקמן: תאים ללא תווית כמו שליטה, תאים + 5 μL CD41 - אלכסה פלור 488, תאים + 5 μL CD34 - PECy7, תאים + 5 μL CD41 - אלכסה פלור 488 + 5 μL CD34 - PECy7. השתמש מינימום של 1.105 תאים לכל צינור, לא יעלה על 1.106 תאים לכל צינור. הוסף 100 μL של השעיית התא לכל צינור ציטומטריה ואת הנוגדנים השונים. דגירה בחושך במשך 30 דקות ב 4 °C (50 °F).
- לאחר מכן, להוסיף 2 מ"ל של PBS-EDTA 2 מ"מ לכל צינור וצנטריפוגה ב 400 x גרם במשך 5 דקות בטמפרטורת החדר. במהלך צנטריפוגה, להכין פתרון של PBS-EDTA 2 mM + 7-Aminoactinomycin-D (7AAD) (1/100), לאפשר פתרון 300 μL לכל צינור.
- הסר את supernatant ולקחת את הכדור ב 300 μL של PBS-EDTA 2 mM עם 7AAD. הפעל דגימות דרך cytometer הזרימה בתוך 30 דקות.
הערה: אסטרטגיית ניתוח לציטומטריית זרימה מוצגת באיור 3C ובדיון.
-
הכנת צינור לניתוח טסיות דם תרבותיות
- תווית ארבעה סטים של צינורות microcentrifuge כדלקמן: תאים ללא תווית כמו שליטה, תאים + 5 μL CD41 - אלכסה פלור 488, תאים + 20 μL CD42a - PE, תאים + 5 μL CD41 - אלכסה פלור 488 + 20 μL CD42a - PE. לאחר חמישה צינורות רצופים בתרבות היטב, להעביר 300 μL של ההשעיה בצינור עבור cytometry המכיל מספר מכויל של חרוזים פלואורסצנטיים.
- מוסיפים נוגדנים ודגרה בחושך ב RT במשך 30 דקות.
- הפעל את הדגימות דרך cytometer הזרימה בתוך 30 דקות וקבע את הרכישה למעבר של 5,000 חרוזים.
הערה: אסטרטגיית ניתוח לציטומטריית זרימה מוצגת באיור 4B ובדיון.
תוצאות
מיצוי ובחירה של תאי CD34+ ממפות LRF
כאן, השיטה, נגזרת Peytour ואח'9, מתאר את החילוץ והבחירה של CD34+ תאים מ LRFs זרוק זמין בבנקי דם לאחר הסרת לויקוציטים. בעקבות הליך הזרימה האחורית, בדרך כלל 1.03 x 109 ± 2.45 x 108 תאים / LRF (ממוצע±SEM; n = 155) הם התאוששו עם הכדאיות של 94.88 ± 0.10% (איור 2A i). לאחר הבחירה החיובית CD34, מתקבל בממוצע 615.54 x 103 ± 12.28 תאים/LRF (n = 155) (איור 2A ii). אם מספר התאים קטן מ- 300,000, יש להסיק כי ההליך לא בוצע כראוי ויש לעצור אותו. כדי להעריך את ההצלחה של בחירת CD34, הטוהר של תאי CD34+ מוערך על-ידי ציטומטרייתזרימה (איור 2B). באופן שגרתי, צפוי טוהר מעל 90% (91.88 ± 0.79%)(איור 2B). טוהר מתחת ל-75% יכול להיות שיש בעיה בניהול הפרוטוקול ובמיוחד בקליטת העמודים. מתחת לטוהר של 75% התאים אינם נשמרים לניסויי תרבות.
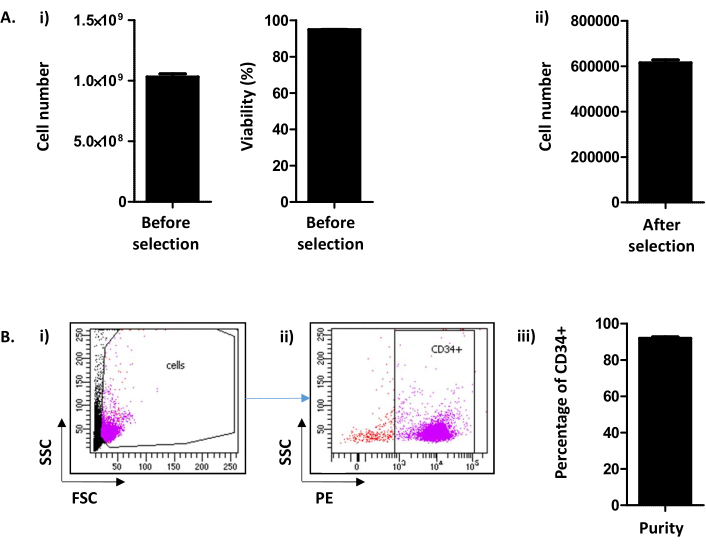
איור 2: CD34+ מספר תא/LRF וניתוח טוהר CD34. (A)(i)מבוצע ניתוח, לפי מונה תאים, של מספר התאים והערך שלהם המתקבלים לאחר ההליך כולל הן אוסף PBMC והן בחירת CD34 מבוצע ((1.03.109 ± 2.45.108 תאים / LRF (ממוצע ± SEM; n = 155) עם כדאיות של 94.88 ± 0.10% (n = 155)). (ii) ניתוח, לפי מונה תאים, מבוצע גם לאחר בחירת CD34 (615.54 x 103 ± 12.28 תאים / LRF (n = 155)). (B)טוהר CD34 מנותח על ידי ציטומטריית זרימה. (i)תאים היו מוכתמים בנוגדן CD34-PE וזוהו על הפרמטרים FSC / SSC שלהם. (ii)בהתבסס על אות הפיזור וניתוח הביטוי CD34, הטוהר נקבע. נעשה שימוש בקדם שער של חיוביות CD34 בהתבסס על הפקד השלילי עבור סמן CD34. (iii)כפי שניתן לראות בגרף העמודות, צפוי טוהר של CD34+ תאים מעל 90% (91.88 ± 0.79% (n = 17)) צפוי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
שונות והבשלה של מפלגות נושאות ח"כים
הליך תרבית התא המתואר מחולק לשני שלבים. הראשון, מיום (D) 0 עד D7, מוקדש להתפשטות ומחויבות של HP למסלול המגקריוציטי בתגובה לשילוב של ציטוקינים ותוספת של תרכובת כימית SR1. השני, מ-D7 עד D13, מתמקד בהבשלת ח"כים ובהרחבת התפשטות בעקבות תוספת של TPO ו- SR1 (איור 3A). כמו בקרת איכות של התרבות, ספירת תאים, קביעת הכדאיות התא, פנוטיפינג של תאים, הם perfomed ב D7 ו- D10. שלבים אלה נבחרו משום שהם חיוניים למחויבות HP, D7 ו- MK התבגרות, D10, בהתאמה (נתונים אישיים). ב- D7 וב- 10, ההתפשטות היא באופן שגרתי של x4.16 ± 0.25 (n = 34) ו- x2.30 ± 0.16 (n = 5), בהתאמה, עם כדאיות תאים המורכבת בין 86.38 ± 0.73% (n = 34); ו- 84.80 ± 2.67% (n = 5) (איור 3B). לגבי פנוטיפינג תאים, כפי שמוצג באיור 3C, ב D0, יותר מ 90% מהתאים חיוביים עבור CD34. לאחר מכן, תאי CD34+ הופכים מחויבים כלפי השושלת המקרוציטית, כפי שניתן לראות על ידי התגלות CD41, סמן ספציפי ומוקדם של MKP. ואכן, ב- D7, 50.20 ± 2.90% מהתאים חיוביים הן ל- CD34 והן ל- CD41 (איור 3Bii). לאחר מכן, ח"כ משפר את התבגרותם. ב- D10, רוב הח"כים בוגרים, כאשר פחות מ-15.60 ± 4.70% מהתאים שליליים ל-CD41, 47.90 ± 8.90% הם CD34+CD41+ ו-36.40 ± 12.40% להיות CD34-CD41+ (איור 3Biii).
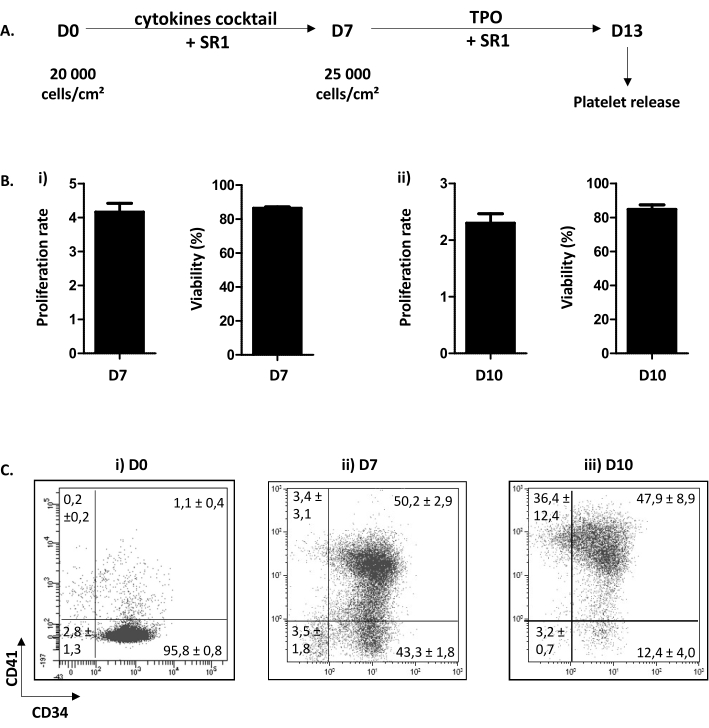
איור 3: שונות והבשלה של מדחפים נושאי ח"כים. (א)ערכה מייצגת של הליך תרבית התא. שיטה דו-שלבית משמשת: שלב התפשטות מ- D0 ל- D7 (SR1 וקוקטייל של ציטוקינים) וצעד התבגרות מ- D7 ל- D13 (SR1 ו- TPO). ב- D13, טסיות דם תרבותיות ניתן לשחרר לאחר חמש צינורות רצופים. (B)(i)קצב התפשטות ב- D7 (x4.16 ± 0.25 (n = 34)) ובירות התא (86.38 ± 0.73% (n = 34)). (ii)קצב התפשטות ב- D10 (x2.30 ± 0.16 (n = 5)) וביכולת ההשמדה של התא (84.80 ± 2.67% (n = 5)). (C)ניתוח ציטומטריה זרימה מצב של האבולוציה הפנוטיפית של MK בתרבות. ב- D0, 95.80 ± 0.80% מהתאים הם CD34 חיוביים (n = 3). ב- D7, 50.20 ± 2.90% מהתאים חיוביים עבור CD34 ו- CD41. ב- D10, פחות מ- 15.60 ± 4.70% מהתאים שליליים עבור CD41. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טסיות דם תרבותיות לשחרר, יום 13
בחינת הבארות ב-D13 מראה ח"כים עגולים וח"כים נושאי פרופלטלטלים(איור 4א). בממוצע 35% מהחו"כים התרבותיים מרחיבים12. שימו לב, D13 מייצג את היום האופטימלי להרחבת התוסף ולשחרור טסיות הדם. אם לא הושגה הרמה הנדרשת של ח"כים המסוגלים לפלוט פרופלטלטים, משהו כנראה השתבש לאורך תהליך התרבות ואין לקחת בחשבון את התוצאות.
למרות שהמנגנונים המדויקים המקדמים שחרור טסיות מח"כים בוגרים עדיין אינם מובנים היטב, ידוע שכוחות המודינמיים חיוניים. כדי לחקות את הכוחות האלה במבחנה, ההשעיה המכילה MK נושאי פרופלט שואפים ונדוחים חמש פעמים עם חרוט P1000 ולאחר מכן מנותח על ידי cytometry זרימה. לשם כך, צינורות המכילים מספר מכויל של חרוזים פלואורסצנטיים משמשים. ראשית, חרוזים הנמצאים בצינור מגודרים בחלון CD41-Alexa-fluor 488/PErcP-Cy5(איור 4Bi,באדום). לאחר מכן, טסיות דם מתורבתות דמיינו לפני השער (אלמנטים דמויי טסיות דם), שנקבעו על הפרמטרים של פיזור קדימה (FSC) ופיזור צד (SSC) של טסיות דם מקוריות(איור 4Bii). מספר טסיות הדם נקבע לאחר מכן בחיוביות CD41/CD42a שלהם(איור 4Biii). ספירת התאים מופסקת בפרוטוקול זה ב- 5,000 חרוזים, אך ניתן להשתמש במספר קבוע אחר בהתאם להמלצת הספק. מהנתונים שנרכשו, מספר טסיות הדם שנספרו לכל 5,000 חרוזים עומד באופן שגרתי על ממוצע של 24.01 ± 92 (n = 15) (איור 4C). בהכירם את הנפח ששאף ציטומטר הזרימה לספור 5,000 חרוזים (לחישוב עבור כל ציטומטר) ואת הנפח הכולל של התרבות, ניתן להשיג קירוב של המספר הכולל של טסיות דם תרבותיות שפורסמו.
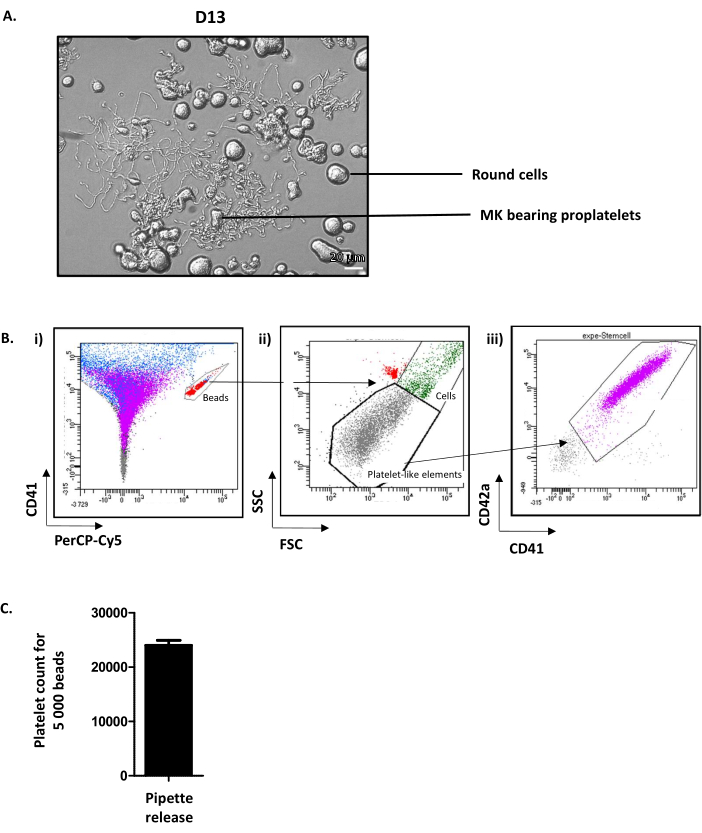
איור 4: טסיות דם מתורבתות מתפרסמות ביום ה-13. (א)תמונת מיקרוסקופיה אור מייצגת של מפיץ פולט ח"כים ב- D13. (ב)אסטרטגיה לכימות שחרור טסיות דם תרבותיות. (i)חרוזים מגודרים בחלון CD41-Alexa-fluor 488 /PErcP-Cy5 (באדום). (ii)אלמנטים דמויי טסיות דם מוצגים בשער שנקבע על הפרמטרים FSC / SSC של טסיות דם מקוריות (נקודות אפורות). (iii)טסיות דם מתורבתות נקבעות על חיוביות CD41 /CD42 שלהם (סגול). (ג)ניתן להשיג את מספר טסיות הדם הנספרות לכל 5,000 חרוזים, באופן שגרתי ממוצע של 24,011 ± 919 (n = 15). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
ההליך במבט חטוף
כדי לסכם טוב יותר את השיטה ולהבין כל שלב, מוצגת באיור 5 כרזההמסכמת את הפרוטוקול צעד אחר צעד . גיליון סיכום זה יכול להיות מוצג בחדר התרבות ולשמש כתזכיר. ראוי לציין שהצלחת הניסויים מובטחת רק עם הפניות המוצר המצוינות בטבלה המסופקת.

איור 5: בידוד CD34+. כרזה המסכמת את הפרוטוקול צעד אחר צעד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר שיטה לייצור MK המסוגלת לפלוט פרופלטלטים מ- HP שמקורה בדם ולשחרר טסיות דם מדיום התרבות. HP מתקבלת מ- LRF, תוצר לוואי של בנקי הדם, המשמשת להסרת לויקוציטים מזהמים ממוצרי דם תאיים ולהימנע מתופעות לוואי. למרות ששיטה זו היא פשוטה יחסית, כמה נקודות ראויות לתשומת לב מיוחדת.
התצהיר של השעיית התא על המדיום המפוצל בצפיפות (שלב 1.3.1) צריך להתבצע בעדינות כדי למנוע תערובת (תוכן אדום). אם שלב זה אינו מתבצע בקפידה, הפרוטוקול צריך להיפסק בשלב זה. באופן דומה, גם בשלב 1.3.1, הבלם צריך להיות במצב כבוי כדי למנוע ערבוב השברים. אם לא, יש להשעות את בחירת HP. כפי שצוין בפרוטוקול, סעיף 1.4, ניתן להפריע להליך לאחר אוסף PBMC. במקרה זה, תאים יכולים להישמר תחת עצבנות לילה ב 4 °C (50 °F). לאחר מכן, השתמש במסננת תאים של 40 מיקרומטר כדי להסיר את האגרגטים שנוצרו, מה שיכול להשפיע על בחירת CD34 הבאה. הערה, הפרעה להליך אינה משפיעה על התפוקה והטוהר של CD34+ תאים. בסוף בחירת CD34, הטוהר חייב להיות גדול מ -75% כדי לזרוע את התאים שכן, במחקר קודם, בידול והתבגרות של ח"כים היו עניים מתחת לטוהר זה12 (איור 2).
יש להקדיש תשומת לב מיוחדת להפשרת CD34+ תאים, אשר חייב להתבצע במהירות כדי למנוע השפעה על הכדאיות של התאים. בנוסף, צעדי כביסה חייבים להתבצע בזהירות כדי לא להשאיר עקבות של סרום. יש לכבד את צפיפות זריעת התאים מכיוון שהיא נבחרה בקפדנות למחויבות אופטימלית ל- CD34 למסלול ה- MKP ולהבשלת ח"כים (איור 3A).
פרוטוקול פנוטיפינג תא מוצע לעקוב אחר ההבחנה וההתבגרות של ח"כ. פרוטוקול זה הוא בסיסי יחסית, אבל חשוב לקבל את כל צינורות הבקרה, הן ללא תווית וצינורות תיוג יחיד, זמין עבור כל יום של ניתוח כדי להבטיח הגדרות אמינות על cytometer. כדי להבטיח שהתרבות פועלת בצורה חלקה, חשוב לאסוף מידע על התפשטות לאורך ההליך. ב D7, ההתפשטות הממוצעת היא בין 2 ל 4 פי13. התפשטות זו משתנה מעט בין ניסויים, שכן כל LRF כולל תאים מ 8 תורמים. כדי להחליק את הווריאציות עוד יותר, ניתן לשלב תאים המתקבלים במקביל בין 4 ל 8 LRFs.
ניתן להסתכל על המורפולוגיה של התאים על ידי מיקרוסקופיה קלה אבל התאים לא צריך להיות נצפה כל יום כי הם רגישים וריאציות טמפרטורה. בעת הסרת התאים מן האינקובטור, להבטיח לבצע תנועות איטיות כדי למנוע שבירת מפלגות.
לגבי שחרור טסיות הדם, נדרשים צינורות חמש פעמים ברציפות. ביצוע פחות אינו מבטיח שחרור טסיות אופטימלי ולעשות יותר מזיק לפונקציונליות שלהם12. ההיבט החשוב ביותר בשלב זה הוא להשתמש בתנועות מדויקות וסדירות, כדי ליצור זרימה סדירה הנדרשת לשחרור טסיות דם14,15,16. השיטה של חמישה צינורות רצופים היא, אם כן, פשוטה וקלה לביצוע עם תוצאות ביצועים משביעות רצון המבוססות על התשואות המתוארות בספרות. ניתן לקבוע את מספר טסיות הדם ששוחררו כאמור בסעיף 3.3 באמצעות האסטרטגיה של ניתוח ציטומטריית זרימה המוצגת באיור 4B. האיכות של טסיות הדם שפורסמו תועדה היטב ב- Do Sacramento et al. במונחים של אולטרה מבנה (מורפולוגיה, גודל, תוכן גרגירים) ותפקוד (המוסטזיס), המוכיח כי טסיות דם מתורבתות אלה דומות מאוד לאלה ילידי13.
הפרוטוקול המתואר כאן מתאים במיוחד לתרבויות בנפח קטן אך אינו חל על תרבות בקנה מידה גדול. לכן זוהי שיטה אופטימלית לחקר ביוגנזה טסיות דם על מנת להבין טוב יותר את המנגנונים המולקולריים והתאים השולטים בייצור טסיות דם על ידי הוספת מולקולות קטנות, אגוניסטים או אנטגוניסטים, למשל. בנוסף, ולחקור עוד יותר את המנגנונים המסדירים את מחויבות הח"כים, הבשלת ח"כים וייצור טסיות דם, ניתן כעת לתפעל גנטית את ה- CD34+ HP בשיטת עריכת הגנום CRISPR-Cas9.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי ANR (אגנס נשיונל דה לה Recherche) גרנט ANR- 17-CE14-0001-1.
Materials
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
References
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved