Method Article
Leukodepletion مرشحات المشتقة CD34 + الخلايا كمصدر الخلية لدراسة التمايز Megakaryocyte وتشكيل الصفائح الدموية
In This Article
Summary
يصف هذا البروتوكول بالتفصيل جميع الخطوات التي ينطوي عليها الحصول على السلف المشتق من اللوكوفلتر CD34+ hematopoietic وتمايزها في المختبر ونضجها في الخلايا الضخمة الحاملة للصفيحات التي تكون قادرة على إطلاق الصفائح الدموية في وسط الثقافة. هذا الإجراء مفيد للتحليل المتعمق للآليات الخلوية والجزيئية التي تتحكم في الخلايا الضخمة.
Abstract
التوسع في المختبر والتمايز من السلف الدموية البشرية في الخلايا الضخمة قادرة على استطالة الصفائح الدموية والإفراج عن الصفائح الدموية يسمح دراسة متعمقة للآليات الكامنة وراء الصفائح الدموية biogenesis. تعتمد بروتوكولات الثقافة المتاحة في الغالب على السلف الدموية المشتقة من نخاع العظم أو دم الحبل السري مما يثير عددا من المخاوف الأخلاقية والتقنية والاقتصادية. إذا كانت هناك بروتوكولات متاحة بالفعل للحصول على خلايا CD34 من الدم المحيطي ، تقترح هذه المخطوطة بروتوكولا مباشرا ومحسنا للحصول على خلايا CD34 + من مرشحات leukodepletion المتاحة بسهولة في مراكز الدم. هذه الخلايا معزولة عن مرشحات leukodepletion المستخدمة في إعداد منتجات نقل الدم، المقابلة لثمانية التبرع بالدم. هذه المرشحات من المفترض أن يتم تجاهلها. ويرد وصف لإجراء مفصل لجمع السلف الدموية التي تم تحديدها على أنها خلايا CD34+ من هذه المرشحات. طريقة الحصول على megakaryocytes ناضجة تمديد proplatelets أثناء مناقشة تطورها phenotypic مفصلة أيضا. وأخيرا، يقدم البروتوكول طريقة معايرة للأنابيب، لإطلاق الصفائح الدموية التي تشبه بشكل شكلي ووظيفي تلك الأصلية بكفاءة. يمكن أن يكون هذا البروتوكول بمثابة أساس لتقييم المركبات الدوائية التي تعمل على خطوات مختلفة من العملية لتشريح الآليات الأساسية والنهج في الصفائح الدموية في الجسم الحي الغلة.
Introduction
تأتي الصفائح الدموية من خلايا متعددة الأضلاع كبيرة متخصصة ، وهي خلايا الكريكريات الضخمة (MK) ، التي تنشأ من عملية إنتاج ثابتة ومضبوطة تعرف باسم megakaryopoiesis (MKP). في ذروة هذه العملية هي الخلايا الجذعية الدموية التي، في اتصال مع بيئة نخاع العظام (السيتوكينات، وعوامل النسخ، المتخصصة الدموية)، وسوف تكون قادرة على الانتشار وتفرق في السلف الدموية (HP) قادرة على الالتزام نحو المسار megakaryocytic، مما أدى إلى MKsغير ناضجة 1. تحت تأثير السيتوكينات المختلفة، وخاصة الجلطات (TPO)، وهو السيتوكين الرئيسي ل MKP؛ سيخضع عضو الكنيست بعد ذلك لمرحلتين رئيسيتين من النضج: بطانة الرحم وتطوير أغشية الترسيم (DMS). هذا MK ناضجة تماما ثم يبدو قريبا من وعاء sinusoid التي يمكن أن تنبعث منها ملحقات السيتوبلازمية، وبروغليتس، والتي سيتم إطلاقها تحت تدفق الدم وإعادة تشكيلها في وقت لاحق إلى الصفائح الدموية وظيفية2. وقد وفر استنساخ TPO في عام 19943 دفعة قوية في دراسة MKP من خلال تسريع تطوير تقنيات الثقافة في المختبر مما يسمح بتمايز HP ونضوج MK.
هناك العديد من الأمراض التي تؤثر على الصفائح الدموية ، سواء من حيث عدد الصفائح الدموية (زيادة أو نقصان) ووظيفة4،5. يمكن أن تكون قادرة على تلخيص MKP في المختبر من HP الإنسان تحسين فهم الآليات الجزيئية والخلوية الكامنة وراء هذه العملية، وفي نهاية المطاف الإدارة العلاجية للمرضى.
مصادر مختلفة من HP الإنسان هي مناسبة: دم الحبل السري, نخاع العظام, والدم المحيطي6,7,8. حصاد HP من الدم المحيطي يثير مشاكل لوجستية وأخلاقية أقل من شفائهم من دم الحبل السري أو نخاع العظام. يمكن استرداد HP من leukapheresis أو معطف برتقالي، ولكن هذه المصادر مكلفة وغير متوفرة دائما في مراكز الدم. بروتوكولات أخرى، أقل تكلفة وأسهل لأداء، تسمح الانتعاش المباشر للخلايا أحادية النوى الدم المحيطي البشري (PBMCs) دون الحاجة إلى العزل CD34 مدفوعة مسبقا4،8. ومع ذلك ، فإن نقاء الخلايا الضخمة غير مرضية مع هذه الطريقة ، ويوصى بمجموعة مختارة من خلايا CD34 + من PBMC للتمايز الأمثل في MK. وهذا ما أدى بنا إلى تنفيذ تنقية HP من مرشحات leukoreduction (LRF)، وتستخدم بشكل روتيني في بنوك الدم لإزالة خلايا الدم البيضاء وبالتالي تجنب ردود الفعل المناعية السلبية9. في الواقع ، منذ عام 1998 ، تم تزويج تركيزات الصفائح الدموية تلقائيا في فرنسا. في نهاية هذه العملية، يتم تجاهل LRF ويتم تدمير جميع الخلايا المحتجزة في LRF. ولذلك، فإن الخلايا الموجودة في أطر العمل الدولية متاحة بسهولة دون أي تكلفة إضافية. LRFs لديها محتوى الخلوية قريبة من تلك التي تم الحصول عليها من قبل leukapheresis أو في المعاطف بافي، لا سيما في تكوينها من CD34 + HP مما يجعلها مصدرا جذابا بشكل ملحوظ10. LRF كمصدر HP الإنسان وقد ثبت بالفعل لتزويد الخلايا مع القدرات الوظيفية سليمة11. هذا المصدر لديه ميزة كونها وفيرة وبأسعار معقولة للبحوث المختبرية. في هذا السياق، توضح هذه المقالة على التوالي: '1' استخراج واختيار CD34 + HP من LRFs؛ '2' الاستخراج والتحديد من CD34 + HP من LRFs؛ '2' الاستخراج والتحديد من ملفات CD34+ HP من LRFs؛ '2' الاستخراج والتحديد من صيغة CD34+ HP من LRFs؛ 2) ثقافة محسنة من مرحلتين ، والتي تلخص التزام HP في المسار الضخمyocytic ونضوج MK قادرة على انبعاث الصفائح الدموية ؛ 3) طريقة لإطلاق الصفائح الدموية بكفاءة من هذه MK؛ و4) إجراء لphenotyping MK والصفائح الدموية المستزرعة.
Protocol
تم الحصول على عينات بشرية مراقبة من المتبرعين بالدم volonteer الذين أعطوا موافقة خطية مستنيرة المعينين من قبل مركز نقل الدم حيث تم إجراء البحث (Etablissement فرانسوا دو سانغ جراند است). وقد سجلت وزارة التعليم العالي والبحوث الفرنسية جميع الإجراءات ووافقت عليها وسجلت تحت الرقم AC_2015_2371.أعطى المانحون موافقتهم في استمارة الموافقة رقم CODHECO AC-2008-562، من أجل استخدام العينات لأغراض البحث. أجريت الدراسات البشرية وفقا لإعلان هلسنكي.
1. استخراج واختيار خلايا CD34 + (HP) من LRF
-
إعداد الكاشف (لLRF واحد)
- إعداد 25 مل من العازلة elution المصفاة: 21.25 مل من الفوسفات المالحة المخزنة (PBS)، 2.5 مل من حمض سيترات-Dextrose (ACD) و 1.25 مل من المصل البقري الجنيني المعتوه (FBS). فلتر على 0.22 ميكرومتر ومكان في 37 درجة مئوية.
- إعداد 500 مل من برنامج تلفزيوني مع 2 مليون من الإيثيلين أمينيت تراسيتراستيك حمض (EDTA).
- التخلص من 25 مل من متوسط التدرج الكثافة (DGM) (1.077 غرام / مل) في اثنين من أنابيب 50 مل.
-
LRF طرائق التنظيف الخلفي (الشكل 1)
ملاحظة: تتطلب هذه الخطوة آلة لحام أنبوب معقمة، مما يسمح بالاتصال العقيم للأنابيب الحرارية.- أولا، قم بتوصيل LRF إلى حقيبة نقل فارغة 600 مل وLRF إلى مجموعة أنابيب(الشكل 1A). تحت خزانة السلامة الحيوية، قم بحقن الحجم الإجمالي لحاجز elution المصفى والمعد المطابق لعدد LRFs المعالج (xLRF x 25 مل) في الكيس الفارغ. ثم، وذلك باستخدام حقنة 30 مل لتنشق بلطف محتويات الحقيبة بأكملها من خلال LRF، backflush ونقل الخلايا إلى أنبوب 50 مل جديدة (الشكل 1B).
- إلى ترسب خلايا الدم الحمراء، تمييع تعليق الخلية إلى النصف مع Dextran 2٪ وتخلط جيدا لتجميع خلايا الدم الحمراء. انتظر لمدة 30 دقيقة في درجة حرارة الغرفة (RT).
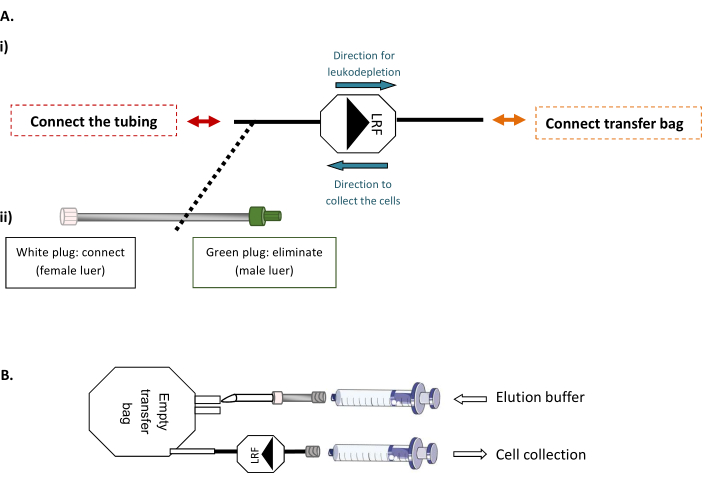
الشكل 1: LRF طرائق التنظيف مرة أخرى. (أ) مخطط تمثيلي من (1) اتصال عقيم من حقيبة نقل إلى LRF و (2) تعيين أنابيب إلى LRF. (ب)مخطط تمثيلي للاتصال المحاقن لجمع الخلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
-
جمع PBMC
- بعد ترسيب خلايا الدم الحمراء، قم بإزالة ونقل النافورة إلى أنبوب 50 مل وملئه ب PBS-EDTA 2 mM. تراكب بلطف supernatant على DGM المعدة أعلاه. السماح للتدفق supernatant بلطف دون كسر مستوى سطح الانحدار الكثافة. جهاز طرد مركزي عند 400 x g في RT لمدة 30 دقيقة في وضع إيقاف تشغيل الفرامل.
- جمع طبقة PBMC مع ماصة نقل المتاح. نقل الخلايا من كل أنبوب DGM إلى أنبوب جديد معقم 50 مل. ملء كل أنبوب مع برنامج تلفزيوني-EDTA 2 mM ويغسل مرتين في 50 مل من PBS-EDTA 2 mM في 200 x g لمدة 10 دقيقة في RT في الفرامل على الوضع.
- ماصة قبالة وتجمع بيليه الخلية مع 50 مل PBS-EDTA 2 mM.
ملاحظة: هناك إمكانية لوقف الإجراء عن طريق الحفاظ على الخلايا التي تم جمعها تحت التحريض عند 4 درجة مئوية أثناء الليل. ثم، تصفية تعليق مع مصفاة الخلية 40 ميكرومتر لإزالة المجاميع التي شكلت.
-
تحديد خلايا CD34+
- تحديد عدد الخلايا والطرد المركزي في 400 × ز في درجة حرارة الغرفة لمدة 10 دقيقة مع كسر على.
- اسبير الناموست تماما وإعادة الإنفاق في الحجم المناسب من برنامج تلفزيوني EDTA 2 mM مفصلة من قبل الشركة المصنعة لمجموعة اختيار CD34 (300 ميكرولتر من PBS-EDTA لمدة 108 خلايا). إضافة كاشف FcR الحجب والميكروبات CD34 في التركيز المناسب (50 ميكرولتر ل108 خلايا).
- بعد 30 دقيقة عند 4 درجة مئوية، اغسل تعليق الخلية وإعادة الإنفاق في الحجم المناسب من PBS-EDTA 2 mM مفصلة من قبل الشركة المصنعة لمجموعة اختيار CD34 (500 ميكرولتر لكل 108 خلايا).
ملاحظة: يتم التحديد على فرز الأعمدة لتمرير الحد الأقصى 2 × 109 خلايا لكل عمود. - تمرير العينة على العمود الرطب من المغناطيس. يغسل مرتين مع 3 مل من برنامج تلفزيوني-EDTA 2 mM وelute الخلايا مع 5 مل من برنامج تلفزيوني-EDTA 2 mM. تشغيل ثاني على عمود جديد يتبع الإجراء نفسه ضروري لتحسين نقاء العينة.
ملاحظة: عدد متوقع من 6.1 × 105 خلايا / LRF (الشكل 2A). بالنسبة لأرقام LRF الأعلى، يمكنك توسيع نطاق الكواشف والأساليب وفقا لذلك.
-
تقييم نقاء الخلايا CD34+
- إضافة إلى aliquot من 100 ميكرولتر من تعليق التي تم الحصول عليها بعد اختيار CD34+ ، 2 ميكرولتر من الأجسام المضادة CD34 - PE الإنسان أو 2 ميكرولتر من IgG -- PE (السيطرة). تخلط جيدا واحتضان لمدة 15 دقيقة في 4 درجة مئوية.
- غسل الخلايا بإضافة 2 مل من برنامج تلفزيوني و الطرد المركزي في 400 x g لمدة 5 دقائق. أسبيرات فائقة تماما وإعادة الإنفاق في 200 ميكرولتر من برنامج تلفزيوني.
- تحليل النقاء حسب قياس التدفق الخلوي كما هو موضح في الشكل 2A وفي المناقشة.
ملاحظة: من المتوقع نقاء خلايا CD34+ فوق 90٪ (الشكل 2Bii). - استخدم خلايا CD34+ مباشرة أو قم بالتجميد لمزيد من الاستخدام.
-
خلايا CD34+ تجميد
ملاحظة: يتم تجميد خلايا CD34+ بكثافة 106 خلايا لكل مل.- بعد تحديد رقم الخلية CD34+ ، قم بإعداد وسائط حفظ التبريد التالية: (1) 60٪ Stemspan + 40٪ FBS ، (2) 40٪ Stemspan + 40٪ FBS + 20٪ ديميثيل سلفكسيد (DMSO) والسماح بالتبريد عند 4 درجة مئوية.
- الطرد المركزي خلايا CD34 + في 400 × ز في درجة حرارة الغرفة لمدة 5 دقائق وإعادة إنفاق بيليه في محلول بارد 1 ومن ثم إضافة فورا إلى الحل البارد 2 (v/v).
- ضع الأنابيب المبردة على الفور في ثلاجة -80 درجة مئوية لمدة 24 ساعة ثم نقل الأنابيب المبردة إلى خزان النيتروجين السائل.
2. ثقافة وتمايز خلايا CD34 + لإنتاج الخلايا الضخمة الحاملة للبروبليتليه الناضجة
ملاحظة: بروتوكول ثقافة الخلية(الشكل 3A)،يتم تفصيل مخطط تمثيلي لإجراء ثقافة الخلية في هذا القسم.
-
ذوبان خلايا CD34+ (إذا لزم الأمر)
- إعداد حل ذوبان الجليد: 13 مل من برنامج تلفزيوني-20٪ FBS ومكان في 37 درجة مئوية لمدة 15 دقيقة. نقل بسرعة cryotubes إلى حمام الماء 37 درجة مئوية حتى بلورة الجليد صغيرة واحدة فقط. تحت خزانة الثقافة البيولوجية، ماصة المحتوى كله، ونقل ببطء في 13 مل من حل ذوبان ما قبل الحرب.
- تحديد رقم الخلية وقابلية البقاء الخلية.
-
بروتوكول الثقافة، الخطوة 1: من اليوم 0 إلى اليوم 7
ملاحظة: عادة ما تصنع الثقافات في لوحات 24 بئرا مع 1 مل من المتوسط لكل بئر في كثافة 40،000 خلية قابلة للحياة / مل، وهو ما يقابل 20،000 خلية قابلة للحياة / سم2. ومن الأهمية بمكان احترام هذه الكثافة إذا كان من المقرر توسيع نطاقها.- إعداد متوسط النمو : في وسائل الإعلام توسيع الخلايا الدموية الخالية من المصل (ساخنة سابقا إلى 37 درجة مئوية) إضافة البنسلين-ستريبتومايسين-الجلوتامين (PSG) 1x، البروتين الدهني منخفض الكثافة البشري (hLDL) في 20 ميكروغرام/مل، كوكتيل السيتوكين من التوسع ميغاكاريوسيتوس 1x و Stemregenin 1 (SR1) في 1 ميكرومتر.
- زرع الخلايا : الطرد المركزي خلايا CD34+ المذابة عند 400 × ز في درجة حرارة الغرفة لمدة 5 دقائق. إزالة تماما supernatant وإعادة إنفاق بيليه الخلية في 1 مل من وسائل الإعلام الثقافة وأداءا الحساب الخلية والقدرة على البقاء لتحديد حجم المناسبة لزرع الخلايا.
- الطرد المركزي الخلايا 400 × ز في درجة حرارة الغرفة لمدة 5 دقائق وإعادة إنفاق بيليه في الحجم المناسب من المتوسط النمو الدافئ. احتضان الخلايا عند 37 درجة مئوية مع 5٪ CO2 لمدة 7 أيام.
-
بروتوكول الثقافة، الخطوة 2: من اليوم 7 إلى اليوم 13 (الشكل 3B، الصور التمثيلية في اليوم 13)
ملاحظة: عادة ما تصنع الثقافات في لوحات 24 بئرا مع 1 مل من المتوسط لكل بئر في كثافة 50،000 خلية قابلة للحياة / مل، وهو ما يقابل 25،000 خلية قابلة للحياة / سم². ومن الأهمية بمكان احترام هذه الكثافة إذا كان من المقرر توسيع نطاقها.- إعداد متوسط النضج: في وسائط توسيع الخلايا الدموية الخالية من المصل (التي كانت ساخنة سابقا إلى 37 درجة مئوية) أضف PSG 1x، hLDL عند 20 ميكروغرام/مل، TPO عند 50 نانوغرام/مل، و SR1 عند 1 ميكرومتر.
- فحص الخلايا تحت المجهر. في اليوم السابع، تظهر الخلايا مظهرا دائريا ومتجانسا عن طريق ملء الآبار أو القوارير دون أن تكون التقاءا كبيرا.
- تحت خزانة السلامة البيولوجية، نقل بلطف الخلايا في أنبوب 15 مل. غسل الآبار مع برنامج تلفزيوني. ثم حدد عدد الخلايا وقدرتها على البقاء لحساب الحجم المناسب لبذور الخلايا.
- الطرد المركزي الخلايا في 400 × ز في درجة حرارة الغرفة لمدة 5 دقائق. إزالة supernatant وإعادة إنفاق الخلايا في الحجم المناسب من وسائل الإعلام الدافئة محسوبة في الخطوة السابقة. احتضان الخلايا في 37 درجة مئوية، 5٪ CO2 لمدة 6 أيام.
-
إطلاق الصفائح الدموية المثقفة في اليوم 13
- إضافة 0.5 ميكرومتر من البروستاجلاندين I2 (PGI2) و 0.02 U/mL من apyrase إلى الثقافة وأداء pipetting المتعاقبة خمس مرات مع ماصة 1 مل.
ملاحظة: يتم الآن تحرير الصفائح الدموية في الوسط.
- إضافة 0.5 ميكرومتر من البروستاجلاندين I2 (PGI2) و 0.02 U/mL من apyrase إلى الثقافة وأداء pipetting المتعاقبة خمس مرات مع ماصة 1 مل.
3. تدفق تحليل قياس الخلايا (MK phenotyping والصفائح الدموية المستزرعة العد)
ملاحظة: يمكن تطبيق هذا البروتوكول على phenotyping الخلايا في الأيام الثقافة المحددة. كما يسمح بتحديد عدد من الافراج عن الصفائح الدموية المستزرعة (الشكل 4A، ب).
-
التحضير لتحليل MK
- تسمية أربع مجموعات من أنابيب الطرد الدقيق على النحو التالي: الخلايا غير المسماة كسيطرة، خلايا + 5 ميكرولتر CD41 - أليكسا فلور 488، خلايا + 5 ميكرولتر CD34 - PECy7، خلايا + 5 ميكرولتر CD41 - أليكسا فلور 488 + 5 ميكرولتر CD34 - PECy7. استخدام الحد الأدنى من 1.105 خلايا لكل أنبوب، لا تتجاوز 1.106 خلايا لكل أنبوب. أضف إلى 100 ميكرولتر من تعليق الخلية لكل أنبوب قياس الخلايا والأجسام المضادة المختلفة. احتضان في الظلام لمدة 30 دقيقة في 4 درجة مئوية.
- ثم أضف 2 مل من برنامج تلفزيوني-EDTA 2 mM لكل أنبوب و الطرد المركزي في 400 x g لمدة 5 دقائق في درجة حرارة الغرفة. أثناء الطرد المركزي، وإعداد حل من برنامج تلفزيوني-EDTA 2 mM + 7-Aminoactinomycin-D (7AAD) (1/100)، تسمح للحل 300 ميكرولتر لكل أنبوب.
- إزالة supernatant وتأخذ بيليه في 300 ميكرولتر من برنامج تلفزيوني-EDTA 2 mM مع 7AAD. قم بتشغيل عينات من خلال مقياس التدفق الخلوي في غضون 30 دقيقة.
ملاحظة: يتم عرض استراتيجية تحليل قياس التدفق الخلوي في الشكل 3C وفي المناقشة.
-
إعداد أنبوب لتحليل الصفائح الدموية المستزرعة
- تسمية أربع مجموعات من أنابيب الطرد الدقيق على النحو التالي: الخلايا غير المسماة كتحكم، خلايا + 5 ميكرولتر CD41 - أليكسا فلور 488، خلايا + 20 ميكرولتر CD42a - PE، خلايا + 5 ميكرولتر CD41 - أليكسا فلور 488 + 20 ميكرولتر CD42a - PE. بعد خمسة pipetting المتعاقبة في الثقافة بشكل جيد، ونقل 300 ميكرولتر من التعليق في أنبوب لقياس الخلايا التي تحتوي على عدد معايرة من الخرز الفلوري.
- إضافة الأجسام المضادة واحتضان في الظلام في RT لمدة 30 دقيقة.
- تشغيل العينات من خلال تدفق الخلايا في غضون 30 دقيقة وتعيين اقتناء لتمرير 5000 حبة.
ملاحظة: يتم عرض استراتيجية تحليل قياس التدفق الخلوي في الشكل 4B وفي المناقشة.
النتائج
استخراج واختيار خلايا CD34+ من LRFs
هنا، الطريقة المستمدة من بيتور وآخرون9،يصف استخراج واختيار CD34+ الخلايا من LRFs المهملة المتاحة في بنوك الدم بعد إزالة الكريات البيض. بعد إجراء النفخة الخلفية، عادة ما يتم استرداد 1.03 × 109 ± 2.45 ×10 8 خلايا/LRF (متوسط±SEM؛ n = 155) مع قابلية البقاء من 94.88 ± 0.10٪(الشكل 2A i). بعد اختيار CD34 الإيجابية، يتم الحصول على متوسط 615.54 × 103 ± 12.28 خلايا / LRF (ن = 155) (الشكل 2A ii). إذا كان عدد الخلايا أقل من 300,000، يجب أن يكون استنتاج أن الإجراء لم يتم تنفيذ بشكل صحيح ويجب إيقاف. لتقييم نجاح اختيار CD34 ، يتم تقييم نقاء خلايا CD34 + عن طريق قياس التدفق الخلوي(الشكل 2B). بشكل روتيني، من المتوقع نقاء فوق 90٪ (91.88 ± 0.79٪)(الشكل 2B). نقاء أقل من 75٪ يمكن أن يعني أن هناك مشكلة في تنفيذ البروتوكول، ولا سيما elution من الأعمدة. تحت نقاء 75٪ لا يتم الحفاظ على الخلايا للتجارب الثقافية.
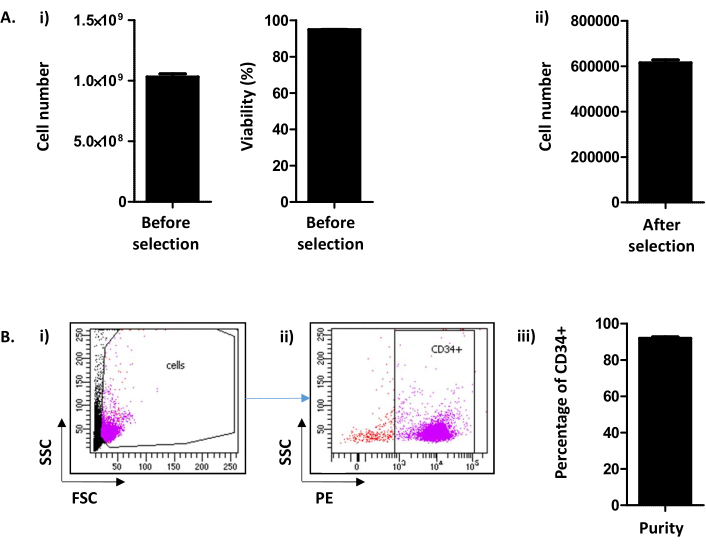
الشكل 2: CD34+ عدد الخلايا / LRF وتحليل نقاء CD34. (أ) (1) يتم إجراء تحليل ، حسب عداد الخلية ، لعدد الخلايا وقابليتها للحياة التي تم الحصول عليها بعد الإجراء بما في ذلك كل من جمع PBMC واختيار CD34 ((1.03.109 ± 2.45.108 خلايا / LRF (متوسط ± SEM ؛ ن = 155) مع قدرة على البقاء من 94.88 ± 0.10 ٪ (ن = 155)). (2)كما يتم إجراء تحليل، حسب عداد الخلية، بعد اختيار CD34 (615.54 × 103 ± 12.28 خلية/ LRF (ن = 155)). (ب)يتم تحليل نقاء CD34 عن طريق قياس التدفق الخلوي. (ط)كانت الخلايا ملطخة بأجسام مضادة CD34-PE وتم تحديدها على معلمات FSC/SSC الخاصة بها. (2)استنادا إلى إشارة مبعثر وتحليل التعبير CD34، يتم تحديد النقاء. تم استخدام ما قبل بوابة الإيجابية CD34 استنادا إلى عنصر التحكم السلبي لعلامة CD34. (iii)كما هو الحال في الرسم البياني الشريطي، من المتوقع أن تكون نقاء خلايا CD34+ أعلى من 90٪ (91.88 ± 0.79٪ (n = 17)). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الاختلاف ونضوج الألواح الحاملة ل MK
يتم تقسيم الإجراء ثقافة الخلية الموصوفة في خطوتين. الأول، من اليوم (D) 0 إلى D7، مكرس لانتشار HP والالتزام في المسار الضخمyocytic استجابة لمزيج من السيتوكينات وإضافة مركب كيميائي SR1. ويركز الثاني، من D7 إلى D13، على نضوج MK وتمديد البروبليت بعد إضافة TPO و SR1(الشكل 3A). كما مراقبة الجودة للثقافة، عد الخلايا، وتحديد صلاحية الخلية، وphenotyping من الخلايا، هي perfomed في D7 و D10. وقد تم اختيار هذه المراحل لأنها حاسمة لالتزام HP، D7 و MK النضج، D10، على التوالي (البيانات الشخصية). وفي D7 و10، يبلغ الانتشار بشكل روتيني x4.16 ± 0.25 (n = 34) وx2.30 ± 0.16 (n = 5)، على التوالي، مع بقاء الخلية بين 86.38 ± 0.73٪ (n = 34)؛ و84.80 ± 2.67٪ (ن = 5) (الشكل 3B). وفيما يتعلق phenotyping الخلية، كما هو مبين في الشكل 3C، في D0، أكثر من 90٪ من الخلايا إيجابية لCD34. ثم، تصبح خلايا CD34+ ملتزمة تجاه النسب الضخم، كما يشهد على ذلك ظهور CD41، وهو علامة محددة ومبكرة من MKP. في الواقع، في D7، 50.20 ± 2.90٪ من الخلايا إيجابية لكل من CD34 و CD41 (الشكل 3Bii). ثم، عضو الكنيست يحسن نضوجها. في D10 ، فإن غالبية MK ناضجة ، مع أقل من 15.60 ± 4.70 ٪ من الخلايا سلبية لCD41 ، 47.90 ± 8.90 ٪ يجري CD34+CD41+ و 36.40 ± 12.40 ٪ يجري CD34--CD41+ (الشكل 3Biii).
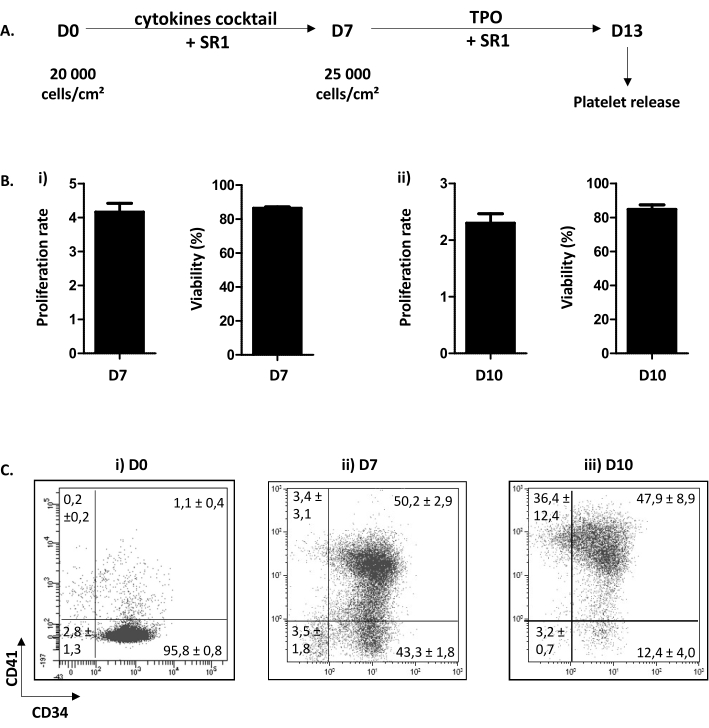
الشكل 3: الاختلاف ونضوج الصفائح الحاملة ل MK. (أ)مخطط تمثيلي لإجراء زراعة الخلية. يتم استخدام طريقة من خطوتين: خطوة انتشار من D0 إلى D7 (SR1 وكوكتيل من السيتوكينات) وخطوة نضوج من D7 إلى D13 (SR1 و TPO). في D13، يمكن إطلاق الصفائح الدموية المستزرعة بعد خمسة أنابيب متتالية. (ب)(1)معدل الانتشار عند D7 (x4.16 ± 0.25 (n = 34)) وقابلية الخلية (86.38 ± 0.73٪ (n = 34)). (2)معدل الانتشار عند D10 (x2.30 ± 0.16 (n = 5)) وقابلية الخلية (84.80 ± 2.67٪ (n = 5)). (ج) تدفق تحليل قياس الخلايا stategy من تطور phenotypic من MK في الثقافة. في D0، 95.80 ± 0.80٪ من الخلايا هي CD34 إيجابية (ن = 3). في D7، 50.20 ± 2.90٪ من الخلايا إيجابية لCD34 و CD41. في D10، أقل من 15.60 ± 4.70٪ من الخلايا سلبية لCD41. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
إطلاق الصفائح الدموية المثقفة، اليوم الثالث عشر
فحص الآبار في D13 يظهر جولة MK وMK proplatelet الحاملة (الشكل 4A). في المتوسط 35٪ من MK مثقف تمديد proplatelets12. من الجدير بالذكر، يمثل D13 اليوم الأمثل لتمديد الصفائح الدموية وإطلاق الصفائح الدموية. إذا لم يتم الوصول إلى المستوى المطلوب من MK قادرة على انبعاث الألواح، يجب أن يكون هناك شيء ما قد حدث خطأ على طول عملية الثقافة والنتائج لا ينبغي أن تؤخذ في الاعتبار.
على الرغم من أن الآليات الدقيقة التي تعزز إطلاق الصفائح الدموية من عضو الكنيست الناضج لا تزال غير مفهومة بشكل جيد ، فمن المعروف جيدا أن القوى الديناميكية الدموية لا غنى عنها. لمحاكاة هذه القوى في المختبر، يتم استنشق التعليق الذي يحتوي على MK الحامل للصفيحات وصده خمس مرات بمخروط P1000 ثم يتم تحليله عن طريق قياس التدفق الخلوي. لهذا الغرض، يتم استخدام أنابيب تحتوي على عدد معايرة من حبات الفلورسنت. أولا، الخرز موجودة في الأنبوب مسور على CD41-اليكسا-فلور 488/PErcP-Cy5 النافذة(الشكل 4Bi، باللون الأحمر). ثم، يتم تصور الصفائح الدموية المستزرعة في مرحلة ما قبل البوابة (عناصر تشبه الصفائح الدموية)، تحدد على مبعثر إلى الأمام (FSC) والجانب مبعثر (SSC) المعلمات من الصفائح الدموية الأصلية(الشكل 4Bii). ثم يتم تحديد عدد الصفائح الدموية على الإيجابية CD41/CD42a(الشكل 4Biii). يتم إيقاف عد الخلايا في هذا البروتوكول عند 5000 حبة ولكن يمكن استخدام رقم ثابت آخر اعتمادا على توصية المورد. من البيانات المكتسبة، وعدد الصفائح الدموية التي تم عدها لكل 5000 حبة بشكل روتيني في المتوسط 24.01 ± 92 (ن = 15) (الشكل 4C). مع العلم حجم يستنشق من قبل مقياس التدفق الخلوي لحساب 5000 حبة (ليتم حسابها لكل مقياس للخلايا) والحجم الإجمالي للثقافة، فمن الممكن الحصول على تقريب من العدد الإجمالي للصفائح الدموية المستزرعة صدر.
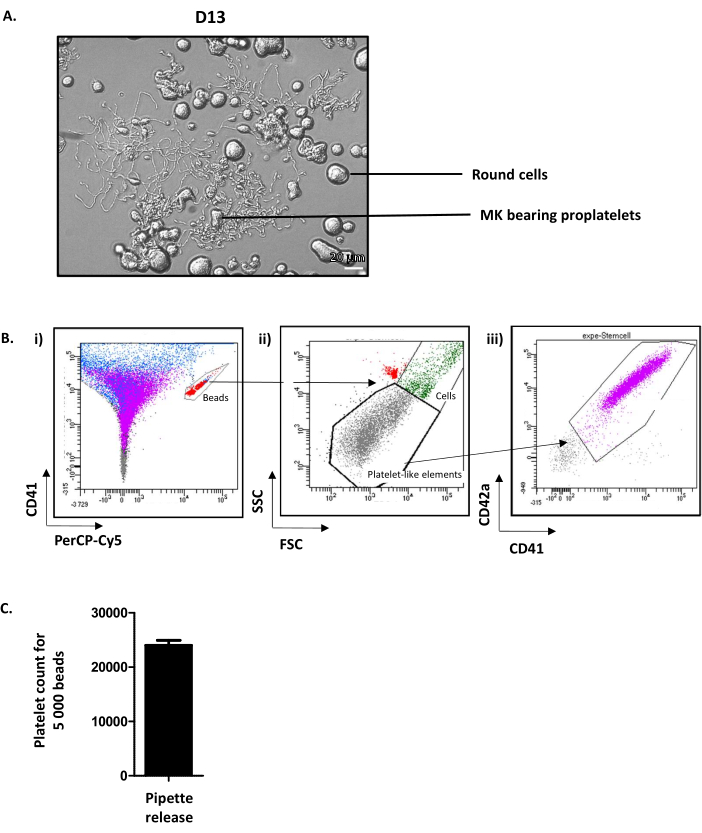
الشكل 4: الصفائح الدموية مثقف الافراج في اليوم 13. (أ) صورة تمثيلية المجهر ضوء MK تنبعث منها الصفائح في D13. (ب) استراتيجية لتحديد كمية الافراج عن الصفائح الدموية المستزرعة. (ط)الخرز مسور على CD41- اليكسا-فلور 488/PErcP-Cy5 النافذة (باللون الأحمر). (ii)يتم تصور العناصر الشبيهة بالصفائح الدموية في بوابة محددة على معلمات FSC / SSC من الصفائح الدموية الأصلية (النقاط الرمادية). (3)يتم تحديد الصفائح الدموية المستزرعة على الإيجابية CD41/CD42 (الأرجواني). (ج)يمكن الحصول على عدد الصفائح الدموية التي يتم عدها لكل 5000 حبة، بمعدل 24011 ± 919 (ن = 15). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الإجراء في لمحة
لتلخيص الأسلوب وفهم كل خطوة بشكل أفضل، يتم عرض ملصق يلخص البروتوكول خطوة بخطوة في الشكل 5. يمكن عرض ورقة الملخص هذه في غرفة الثقافة وتكون بمثابة مذكرة. وتجدر الإشارة إلى أن نجاح التجارب مضمون فقط مع مراجع المنتجات المشار إليها في الجدول المقدم.

الشكل 5: عزل CD34+. ملصق يلخص البروتوكول خطوة بخطوة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول طريقة لإنتاج MK قادرة على انبعاث الصفائح من HP المشتقة من الدم وإطلاق الصفائح الدموية من وسيط الثقافة. يتم الحصول على HP من LRF، وهو منتج ثانوي لبنوك الدم، يستخدم لإزالة الكريات البيض الملوثة من منتجات الدم الخلوية وتجنب ردود الفعل السلبية. على الرغم من أن هذه الطريقة بسيطة نسبيا، إلا أن بعض النقاط تستحق اهتماما خاصا.
يجب إجراء ترسب تعليق الخلية على متوسط تدرج الكثافة (الخطوة 1.3.1) بلطف لتجنب الخليط (المحتوى الأحمر). وإذا لم تنفذ هذه الخطوة بعناية، ينبغي أن يتوقف البروتوكول عند هذه النقطة. وبالمثل، أيضا في الخطوة 1.3.1، يجب أن تكون الفرامل على وضع إيقاف لتجنب خلط الكسور. إذا لم يكن الأمر كذلك، يجب تعليق تحديد HP. كما هو مبين في البروتوكول، القسم 1.4، يمكن مقاطعة الإجراء بعد مجموعة PBMC. في هذه الحالة، يمكن الحفاظ على الخلايا تحت التحريض بين عشية وضحاها في 4 درجة مئوية. ثم استخدم مصفاة خلايا 40 ميكرومتر لإزالة التجميعات التي تم تشكيلها، والتي يمكن أن تؤثر على تحديد CD34 اللاحق. ملاحظة، لا يؤثر مقاطعة الإجراء على العائد ونقاء خلايا CD34+ . في نهاية اختيار CD34 ، يجب أن يكون النقاء أكبر من 75٪ لزرع الخلايا منذ ، في دراسة سابقة ، كان التمايز ونضوج MK ضعيفا تحت هذاالنقاء 12 (الشكل 2).
يجب إيلاء اهتمام خاص لإذابة خلايا CD34+ ، والتي يجب تنفيذها بسرعة لتجنب التأثير على صلاحية الخلايا. بالإضافة إلى ذلك ، يجب تنفيذ خطوات الغسيل بعناية لمغادرة أي أثر المصل. يجب احترام كثافة بذر الخلايا حيث تم اختيارها بدقة للالتزام الأمثل CD34 لمسار MKP ونضوج MK(الشكل 3A).
ويقترح بروتوكول phenotyping الخلية لمتابعة التمايز ونضوج MK. هذا البروتوكول أساسي نسبيا، ولكن من المهم أن يكون جميع أنابيب التحكم، سواء أنابيب وضع العلامات غير المسماة وأنابيب واحدة، متاحة لكل يوم من أيام التحليل لضمان إعدادات موثوقة على مقياس الخلايا. ولضمان سير الثقافة بسلاسة، من المهم جمع معلومات عن الانتشار على طول الإجراء. في D7 ، متوسط الانتشار بين 2 إلى 4 أضعاف13. ويختلف هذا الانتشار قليلا بين التجارب، حيث أن كل إطار من المانحين يتألف من خلايا من 8 جهات مانحة. لتسهيل الاختلافات بشكل أكبر ، من الممكن الجمع بين الخلايا التي تم الحصول عليها بالتوازي من 4 إلى 8 LRFs.
من الممكن النظر إلى مورفولوجيا الخلايا عن طريق المجهر الخفيف ولكن لا ينبغي ملاحظة الخلايا كل يوم لأنها حساسة لتغيرات درجة الحرارة. عند إزالة الخلايا من الحاضنة، تأكد من إجراء حركات بطيئة لتجنب كسر الصفائح.
فيما يتعلق بإطلاق الصفائح الدموية ، هناك حاجة إلى خمس مرات متتالية. القيام بأقل لا يضمن إطلاق الصفائح الدموية الأمثل والقيام بالمزيد يضر بوظائفهم12. الجانب الأكثر أهمية في هذه الخطوة هو استخدام حركات دقيقة ومنتظمة، لتوليد تدفق منتظم المطلوبة لإطلاق الصفائح الدموية14،15،16. ولذلك، فإن طريقة خمسة أنابيب متتالية بسيطة وسهلة الأداء مع نتائج أداء مرضية استنادا إلى الغلة الموصوفة في الأدبيات. يمكن تحديد عدد الصفائح الدموية الصادرة كما هو مذكور في القسم 3.3 باستخدام استراتيجية تحليل قياس التدفق الخلوي الموضحة في الشكل 4B. وقد تم توثيق نوعية الصفائح الدموية الصادرة بشكل جيد في Do Sacramento et al. من حيث البنية الفوقية (مورفولوجيا وحجم ومحتوى الحبيبات) والوظيفة (hemostasis) ، مما يدل على أن هذه الصفائح الدموية المستزرعة تشبه إلى حد كبير تلك الأصلية13.
البروتوكول الموصوف هنا مناسب بشكل خاص للثقافات الصغيرة الحجم ولكنه لا ينطبق على الثقافة واسعة النطاق. ولذلك فهو أسلوب أمثل لدراسة التكوين الحيوي الصفائح الدموية من أجل فهم أفضل للآليات الجزيئية والخلوية التي تحكم إنتاج الصفائح الدموية عن طريق إضافة جزيئات صغيرة، ناهضات، أو الخصوم، على سبيل المثال. بالإضافة إلى ذلك ، ولمزيد من استكشاف الآليات التي تنظم التزام MK ، ونضوج MK ، وإنتاج الصفائح الدموية ، أصبح من الممكن الآن التلاعب وراثيا ب CD34+ HP باستخدام طريقة تحرير الجينوم CRISPR-Cas9.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعم هذا العمل من قبل ANR (وكالة الوطنية للريشة) منح ANR- 17-CE14-0001-1.
Materials
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
References
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved