Method Article
Los filtros de leucodepleción derivan de células CD34+ como fuente celular para estudiar la diferenciación de megacariocitos y la formación de plaquetas
En este artículo
Resumen
Este protocolo describe en detalle todos los pasos implicados en la obtención de progenitores hematopoyéticos CD34+ derivados de leucofiltros y su diferenciación y maduración in vitro en megacariocitos portadores de proplatlet que son capaces de liberar plaquetas en el medio de cultivo. Este procedimiento es útil para el análisis en profundidad de los mecanismos celulares y moleculares que controlan la megacaripoyesis.
Resumen
La expansión y diferenciación in vitro de progenitores hematopoyéticos humanos en megacariocitos capaces de alargar proplatelets y liberar plaquetas permite un estudio en profundidad de los mecanismos subyacentes a la biogénesis plaquetaria. Los protocolos de cultivo disponibles se basan principalmente en progenitores hematopoyéticos derivados de la médula ósea o la sangre del cordón umbilical que plantean una serie de preocupaciones éticas, técnicas y económicas. Si ya existen protocolos disponibles para obtener células CD34 de sangre periférica, este manuscrito propone un protocolo sencillo y optimizado para obtener células CD34+ a partir de filtros de leucodepleción fácilmente disponibles en los centros sanguíneos. Estas células se aíslan de los filtros de leucodepleción utilizados en la preparación de productos de transfusión de sangre, correspondientes a ocho donaciones de sangre. Estos filtros están destinados a ser descartados. Se describe un procedimiento detallado para recolectar progenitores hematopoyéticos identificados como células CD34 + de estos filtros. También se detalla el método para obtener megacariocitos maduros que extienden los proplatlets mientras se discute su evolución fenotípica. Finalmente, el protocolo presenta un método de pipeteo calibrado, para liberar eficientemente plaquetas que son morfológica y funcionalmente similares a las nativas. Este protocolo puede servir como base para evaluar compuestos farmacológicos que actúan en varios pasos del proceso para diseccionar los mecanismos subyacentes y abordar los rendimientos plaquetarios in vivo.
Introducción
Las plaquetas sanguíneas provienen de células poliploides grandes especializadas, los megacariocitos (MK), que se originan en un proceso de producción constante y ajustado conocido como megacaropoyesis (MKP). En el ápice de este proceso se encuentran las células madre hematopoyéticas que, en contacto con el entorno de la médula ósea (citoquinas, factores de transcripción, nicho hematopoyético), serán capaces de proliferar y diferenciarse en progenitores hematopoyéticos (HP) capaces de comprometerse hacia la vía megacariocítica, dando lugar a MKs inmaduros1. Bajo la influencia de varias citoquinas, y en particular la trombopoyetina (TPO), que es la citoquina principal de MKP; el MK se someterá entonces a dos etapas principales de maduración: endomitosis y el desarrollo de membranas de demarcación (DMS). Esta MK completamente madura aparece entonces cerca de un vaso sinusoide en el que puede emitir extensiones citoplasmáticas, los proplatlets, que se liberarán bajo el flujo sanguíneo y posteriormente se remodelarán en plaquetas funcionales2. La clonación de TPO en 19943 proporcionó un impulso en el estudio de MKP al acelerar el desarrollo de técnicas de cultivo in vitro que permiten la diferenciación de HP y la maduración de MK.
Existen muchas patologías que afectan a las plaquetas sanguíneas, tanto en cuanto al número de plaquetas (aumento o disminución) como a la función4,5. Ser capaz de recapitular MKP in vitro a partir de HP humano podría mejorar la comprensión de los mecanismos moleculares y celulares subyacentes a este proceso y, en última instancia, el manejo terapéutico de los pacientes.
Varias fuentes de HP humano son adecuadas: sangre del cordón umbilical, médula ósea y sangre periférica6,7,8. La recolección de HP de la sangre periférica plantea menos problemas logísticos y éticos que su recuperación de la sangre del cordón umbilical o la médula ósea. HP se puede recuperar de la leucoféresis o el pelaje buffy, pero estas fuentes son caras y no siempre están disponibles en los centros sanguíneos. Otros protocolos, menos costosos y más fáciles de realizar, permiten la recuperación directa de células mononucleares de sangre periférica humana (PBMCs) sin necesidad de aislamiento previo impulsado por CD344,8. Sin embargo, la pureza de los megacariocitos no es satisfactoria con este método y se recomienda una selección de células CD34 + de PBMC para una diferenciación óptima en MK. Esto nos llevó a implementar una purificación HP a partir de filtros de leucorreducción (LRF), utilizados rutinariamente en los bancos de sangre para eliminar los glóbulos blancos y así evitar reacciones inmunológicas adversas9. De hecho, desde 1998, los concentrados de plaquetas se han agotado automáticamente en Francia. Al final de este proceso, se descartan los LRF y se destruyen todas las células retenidas en el LRF. Las células en los LRF están, por lo tanto, fácilmente disponibles sin costo adicional. Los LRF tienen un contenido celular cercano al obtenido por leucoféresis o en pelajes buffy, notablemente en su composición de CD34+ HP convirtiéndolos en una fuente notablemente atractiva10. LRF como fuente humana de HP ya se ha demostrado que proporciona a las células capacidades funcionales intactas11. Esta fuente tiene la ventaja de ser abundante y asequible para la investigación de laboratorio. En este contexto, este artículo describe sucesivamente: i) la extracción y selección de CD34+ HP a partir de LRFs; ii) un cultivo optimizado de dos fases, que recapitula el compromiso de HP en la vía megacariocítica y la maduración de MK capaz de emitir proplatelets; iii) un método para liberar eficientemente las plaquetas de estas MK; y iv) un procedimiento para fenotipar MK y plaquetas cultivadas.
Protocolo
Se obtuvieron muestras humanas de control de donantes de sangre voluntarios que dieron su consentimiento informado por escrito reclutados por el centro de transfusión de sangre donde se realizó la investigación (Etablissement Français du Sang-Grand Est). Todos los procedimientos fueron registrados y aprobados por el Ministerio de Educación Superior e Investigación de Francia y registrados con el número AC_2015_2371.Los donantes dieron su aprobación en el formulario de consentimiento CODHECO número AC- 2008 - 562, para que las muestras se utilicen con fines de investigación. Los estudios en humanos se realizaron de acuerdo con la declaración de Helsinki.
1. Extracción y selección de células CD34+ (HP) de LRF
-
Preparación del reactivo (para un LRF)
- Preparar 25 mL de tampón de elución filtrada: 21,25 mL de Solución Salina Tamponada con Fosfato (PBS), 2,5 mL de Ácido-Citrato-Dextrosa (ACD) y 1,25 mL de Suero Fetal Bovino (FBS) descomplementado. Filtrar sobre 0,22 μm y colocar a 37 °C.
- Preparar 500 mL de PBS con 2 mM de ácido etilendiaminatetraacético (EDTA).
- Disponer 25 mL de medio gradiente de densidad (DGM) (1.077 g/mL) en dos tubos de 50 mL.
-
Modalidades de retro-lavado LRF (Figura 1)
NOTA: Este paso requiere una máquina de soldadura de tubos estériles, lo que permite la conexión estéril de tubos termoplásticos.- Primero, conecte el LRF a una bolsa de transferencia vacía de 600 ml y el LRF a un conjunto de tubos(Figura 1A). Debajo del gabinete de bioseguridad, inyecte el volumen total de tampón de elución filtrado y preparado correspondiente al número de LRF manipulados (xLRF x 25 mL) en la bolsa vacía. Luego, usando una jeringa de 30 ml para aspirar suavemente todo el contenido de la bolsa a través del LRF, retroflush y transfiera las células a un nuevo tubo de 50 ml(Figura 1B).
- A la sedimentación de los glóbulos rojos, diluya la suspensión celular a la mitad con Dextran 2% y mezcle bien para agregar glóbulos rojos. Espere 30 minutos a temperatura ambiente (RT).
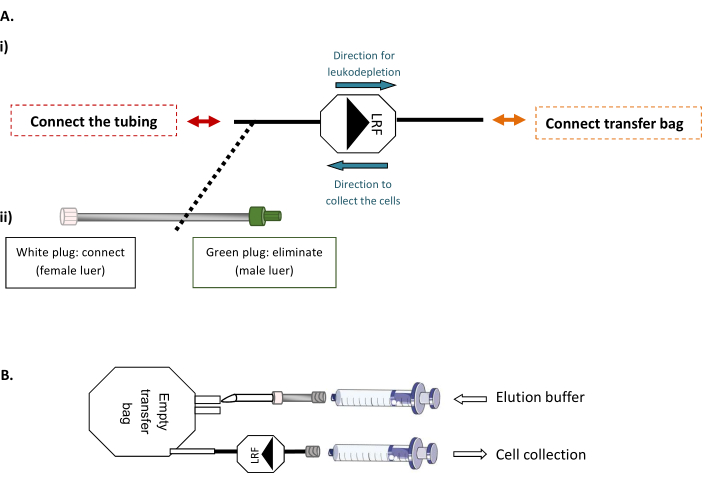
Figura 1: Modalidades de lavado posterior del LRF. (A) Esquema representativo de (i) la conexión estéril de la bolsa de transferencia al LRF y (ii) el conjunto de tubos al LRF. (B) Esquema representativo de la conexión de las jeringas para la recolección de células. Haga clic aquí para ver una versión más grande de esta figura.
-
Colección PBMC
- Después de la sedimentación de los glóbulos rojos, retire y transfiera el sobrenadante a un tubo de 50 ml y llénelo con PBS-EDTA 2 mM. Superponga suavemente el sobrenadante sobre el DGM preparado anteriormente. Deje que el sobrenadante fluya suavemente sin romper el plano superficial del gradiente de densidad. Centrifugar a 400 x g en RT durante 30 min en modo de apagado de freno.
- Recoja la capa de PBMC con una pipeta de transferencia desechable. Transfiera las células de cada tubo DGM a un nuevo tubo estéril de 50 ml. Llene cada tubo con PBS-EDTA 2 mM y lave dos veces en 50 mL de PBS-EDTA 2 mM a 200 x g durante 10 min en RT en modo de freno encendido.
- Pipetee y acumule el pellet celular con 50 mL PBS-EDTA 2 mM.
NOTA: Existe la posibilidad de detener el procedimiento manteniendo las células recolectadas bajo agitación a 4 ° C durante la noche. Luego, filtre la suspensión con un colador de células de 40 μm para eliminar los agregados formados.
-
Selección de células CD34+
- Determine el número de celda y la centrífuga a 400 x g a temperatura ambiente durante 10 minutos con la rotura encendida.
- Aspirar el sobrenadante completamente y resuspend en el volumen apropiado de PBS-EDTA 2 mM detallado por el fabricante del kit de selección CD34 (300 μL de PBS-EDTA para 108 celdas). Añadir el reactivo bloqueador FcR y las microperlas CD34 en la concentración adecuada (50 μL para 108 células).
- Después de 30 min a 4 °C, lavar la suspensión celular y volver a suscripción en el volumen apropiado de PBS-EDTA 2 mM detallado por el fabricante del kit de selección CD34 (500 μL por 108 celdas).
NOTA: La selección se realiza en la ordenación de columnas para el paso de un máximo de 2 x 109 celdas por columna. - Pase la muestra sobre la columna húmeda del imán. Lavar dos veces con 3 mL de PBS-EDTA 2 mM y eluar las células con 5 mL de PBS-EDTA 2 mM. Es necesaria una segunda ejecución en una nueva columna siguiendo el mismo procedimiento para mejorar la pureza de la muestra.
NOTA: Un número esperado de 6.1 x 105 celdas/LRF (Figura 2A). Para números LRF más altos, amplíe los reactivos y métodos en consecuencia.
-
Evaluación de la pureza de las células CD34+
- Añadir a una alícuota de 100 μL de suspensión obtenida tras la seleccióncd34+, 2 μL de anticuerpo CD34-PE humano o 2 μL de IgG-PE (control). Mezclar bien e incubar durante 15 min a 4 °C.
- Lavar las células añadiendo 2 mL de PBS y centrifugar a 400 x g durante 5 min. Aspirar sobrenadante completamente y resuspend en 200 μL de PBS.
- Analizar la pureza por citometría de flujo como se muestra en la Figura 2A y en la Discusión.
NOTA: Se espera una pureza de células CD34+ superior al 90%(Figura 2Bii). - Use las células CD34+ directamente o congele para su uso posterior.
-
Congelación de células CD34+
NOTA: La congelación de células CD34+ se realiza a una densidad de 106 células por ml.- Después de la determinación del número de células CD34+, prepare los siguientes medios de criopreservación: (1) 60% Stemspan + 40% FBS, (2) 40% Stemspan + 40% FBS + 20% Dimetilsulfóxido (DMSO) y permita el enfriamiento a 4 °C.
- Centrifugar las células CD34+ a 400 x g a temperatura ambiente durante 5 min y volver a suspender el pellet en solución fría 1 y luego añadir inmediatamente a la solución fría 2 (v/v).
- Coloque los criotubos inmediatamente en un congelador de -80 °C durante 24 horas y luego transfiera los criotubos al tanque de nitrógeno líquido.
2. Cultivo y diferenciación de células CD34+ para producir megacariocitos maduros portadores de proplatlet
NOTA: El protocolo de cultivo celular (Figura 3A), esquema representativo del procedimiento de cultivo celular se detallan en esta sección.
-
Descongelación de células CD34+ (si es necesario)
- Preparar la solución de descongelación: 13 mL de PBS-20% FBS y colocar a 37 °C durante 15 min. Transfiera rápidamente los criotubos a un baño de agua de 37 ° C hasta que solo un pequeño cristal de hielo. Debajo del gabinete de cultivo biológico, pipetee todo el contenido y transfiera lentamente en 13 ml de solución de descongelación precalentada.
- Determine el número de celda y la viabilidad de la celda.
-
Protocolo de cultivo, paso 1: del día 0 al día 7
NOTA: Generalmente los cultivos se realizan en placas de 24 pozos con 1 mL de medio por pozo a una densidad de 40.000 células viables/ml, lo que corresponde a 20.000 células viables/cm2. Es crucial respetar esta densidad si se planea alguna ampliación.- Preparación del medio de crecimiento: En medios de expansión de células hematopoyéticas libres de suero (previamente calentados a 37 °C) agregue Penicilina-Estreptomicina-Glutamina (PSG) 1x, Lipoproteína de Baja Densidad Humana (hLDL) a 20 μg/mL, cóctel de citoquinas de expansión de megacariocitos 1x y Stemregenina 1 (SR1) a 1 μM.
- Siembra celular: Centrifugar las células CD34+ descongeladas a 400 x g a temperatura ambiente durante 5 min. Retire completamente el sobrenadante y resuspante el pellet celular en 1 ml de medio de cultivo y realice una numeración celular y viabilidad para determinar el volumen apropiado para sembrar las células.
- Centrifugar las células 400 x g a temperatura ambiente durante 5 min y volver a colocar el pellet en el volumen apropiado del medio de crecimiento caliente. Incubar las células a 37 °C con 5% de CO2 durante 7 días.
-
Protocolo de cultivo, paso 2: del día 7 al día 13(Figura 3B,imágenes representativas en el día 13)
NOTA: Generalmente los cultivos se realizan en placas de 24 pozos con 1 mL de medio por pozo a una densidad de 50.000 células viables/ml, lo que corresponde a 25.000 células viables/cm². Es crucial respetar esta densidad si se planea alguna ampliación.- Preparación del medio de maduración: En medios de expansión de células hematopoyéticas libres de suero (previamente calentados a 37 °C), agregue PSG 1x, hLDL a 20 μg/mL, TPO a 50 ng/mL y SR1 a 1 μM.
- Examine las células bajo el microscopio. En el día 7, las células muestran un aspecto redondo y homogéneo al llenar los pozos o los matraces sin ser demasiado confluentes.
- Debajo de un gabinete de bioseguridad, transfiera suavemente las células en un tubo de 15 ml. Lavar los pozos con PBS. Luego, determine el número de células y su viabilidad para calcular el volumen apropiado para sembrar las células.
- Centrifugar las células a 400 x g a temperatura ambiente durante 5 min. Retire el sobrenadante y vuelva a colocar las celdas en el volumen apropiado de medios calientes calculado en el paso anterior. Incubar las células a 37 °C, 5% CO2 durante 6 días.
-
Liberación de plaquetas cultivadas en el día 13
- Añadir 0,5 μM de prostaglandina I2 (IGP2) y 0,02 U/ml de apirasa al cultivo y realizar pipeteos sucesivos cinco veces con una pipeta de 1 ml.
NOTA: Las plaquetas ahora se liberan en el medio.
- Añadir 0,5 μM de prostaglandina I2 (IGP2) y 0,02 U/ml de apirasa al cultivo y realizar pipeteos sucesivos cinco veces con una pipeta de 1 ml.
3. Análisis de citometría de flujo (fenotipado MK y recuento de plaquetas cultivadas)
NOTA: Este protocolo se puede aplicar al fenotipado de las células en los días de cultivo seleccionados. También permite determinar el número de liberación plaquetaria cultivada(Figura 4A,B).
-
Preparación para el análisis MK
- Etiquete cuatro juegos de tubos de microcentrífuga de la siguiente manera: Células sin etiquetar como control, células + 5 μL CD41 - Alexa Fluor 488, Células + 5 μL CD34 - PECy7, Células + 5 μL CD41 - Alexa Fluor 488 + 5 μL CD34 - PECy7. Use un mínimo de 1.105 celdas por tubo, no exceda de 1.106 celdas por tubo. Añadir a 100 μL de suspensión celular por tubo de citometría y los diferentes anticuerpos. Incubar en la oscuridad durante 30 min a 4 °C.
- Luego, agregue 2 ml de PBS-EDTA 2 mM por tubo y centrífuga a 400 x g durante 5 minutos a temperatura ambiente. Durante la centrifugación, prepare una solución de PBS-EDTA 2 mM + 7-Aminoactinomycin-D (7AAD) (1/100), permita una solución de 300 μL por tubo.
- Retire el sobrenadante y tome el pellet en 300 μL de PBS-EDTA 2 mM con 7AAD. Pase las muestras a través del citómetro de flujo dentro de los 30 minutos.
NOTA: La estrategia de análisis para la citometría de flujo se muestra en la Figura 3C y en la Discusión.
-
Preparación de tubos para análisis de plaquetas cultivadas
- Etiquete cuatro juegos de tubos de microcentrífuga de la siguiente manera: Células sin etiquetar como control, Células + 5 μL CD41 - Alexa Fluor 488, Células + 20 μL CD42a - PE, Células + 5 μL CD41 - Alexa Fluor 488 + 20 μL CD42a - PE. Después de cinco pipeteos sucesivos en el pozo de cultivo, transfiera 300 μL de la suspensión en el tubo para citometría que contiene un número calibrado de perlas fluorescentes.
- Agregue anticuerpos e incube en la oscuridad a RT durante 30 min.
- Pase las muestras a través del citómetro de flujo dentro de los 30 minutos y configure la adquisición para el paso de 5,000 cuentas.
NOTA: La estrategia de análisis para la citometría de flujo se muestra en la Figura 4B y en la Discusión.
Resultados
Extracción y selección de células CD34+ de LRFs
Aquí, el método, derivado de Peytour et al.9,describe la extracción y selección de células CD34+ de LRF descartados disponibles en bancos de sangre después de la eliminación de leucocitos. Después del procedimiento de retrolavado, generalmente se recuperan 1,03 x10 9 ± 2,45 x10 8 células/LRF (Media±EM; n = 155) con una viabilidad de 94,88 ± 0,10% (Figura 2A i). Después de la selección positiva de CD34, se obtiene un promedio de 615,54 x10 3 ± 12,28 células/LRF (n = 155) (Figura 2A ii). Si el número de células es inferior a 300.000, debe concluirse que el procedimiento no se ha llevado a cabo correctamente y debe detenerse. Para evaluar el éxito de la selección de CD34, la pureza de las células CD34+ se evalúa mediante citometría de flujo (Figura 2B). Rutinariamente, se espera una pureza superior al 90% (91,88 ± 0,79%)(Figura 2B). Una pureza inferior al 75% podría significar que ha habido un problema en la realización del protocolo y, en particular, en la elución de las columnas. Por debajo de una pureza del 75%, las células no se conservan para experimentos de cultivo.
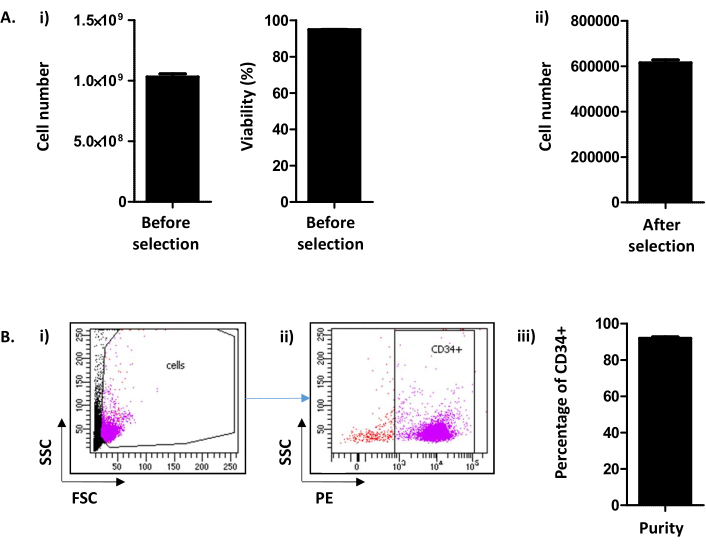
Figura 2: Análisis del número decélulas CD34+/LRF y de pureza de CD34. (A) (i) Se realiza un análisis, por contador celular, del número de células y su viabilidad obtenidas tras el procedimiento, incluyendo tanto la recolección de PBMC como la selección de CD34 ((1.03.109 ± 2.45.108 células/LRF (Media ± SEM; n=155) con una viabilidad de 94,88 ± 0,10% (n = 155)). (ii) También se realiza un análisis, por contador celular, después de la selección de CD34 (615,54 x 103 ± 12,28 células/LRF (n = 155)). (B) La pureza de CD34 se analiza mediante citometría de flujo. (i) Las células se tiñeron con un anticuerpo CD34-PE y se identificaron en sus parámetros FSC/SSC. ii)Sobre la base de la señal de dispersión y el análisis de expresión de CD34, se determina la pureza. Se utilizó una pre-puerta de positividad de CD34 basada en el control negativo para el marcador CD34. (iii) Como se puede ver en el gráfico de barras, se espera una pureza de células CD34+ superior al 90% (91,88 ± 0,79% (n = 17)). Haga clic aquí para ver una versión más grande de esta figura.
Diferenciación y maduración de los proplatlets que contienen MK
El procedimiento de cultivo celular descrito se divide en dos pasos. El primero, del día (D) 0 al D7, está dedicado a la proliferación de HP y el compromiso en la vía megacariocítica en respuesta a una combinación de citoquinas y la adición de un compuesto químico SR1. El segundo, de D7 a D13, se centra en la maduración de MK y la extensión del proplatelet tras la adición de TPO y SR1(Figura 3A). Como control de calidad del cultivo, el conteo celular, la determinación de la viabilidad celular y el fenotipado de las células, se realizan en D7 y D10. Estas etapas se han elegido porque son cruciales para el compromiso de HP, la maduración de D7 y MK, D10, respectivamente (datos personales). En D7 y 10, la proliferación es rutinariamente de x4,16 ± 0,25 (n = 34) y x2,30 ± 0,16 (n = 5), respectivamente, con una viabilidad celular comprendida entre 86,38 ± 0,73% (n = 34); y 84,80 ± 2,67% (n = 5) (Figura 3B). En cuanto al fenotipado celular, como se muestra en la Figura 3C,en D0, más del 90% de las células son positivas para CD34. Luego, las células CD34 + se comprometen con el linaje megacariocítico, como lo atestigua la aparición de CD41, un marcador específico y temprano de MKP. De hecho, en D7, el 50,20 ± el 2,90% de las células son positivas tanto para CD34 como para CD41(Figura 3Bii). Luego, MK mejora su maduración. En D10, la mayoría de las MK son maduras, con menos del 15,60 ± el 4,70% de las células son negativas para CD41, el 47,90 ± el 8,90% es CD34+CD41+ y el 36,40 ± el 12,40% es CD34-CD41+ (Figura 3Biii).
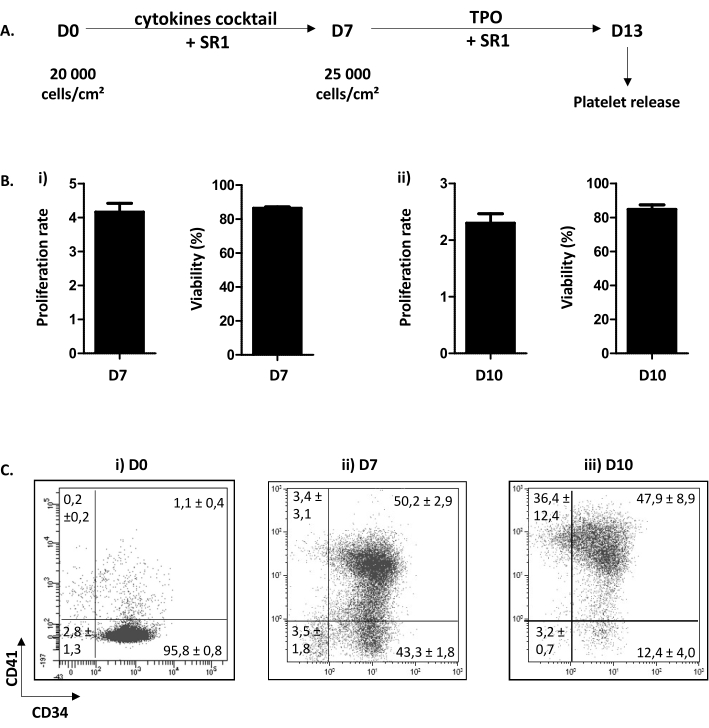
Figura 3: Diferenciación y maduración de los proplatlets que contienen MK. (A) Esquema representativo del procedimiento de cultivo celular. Se utiliza un método de dos pasos: un paso de proliferación de D0 a D7 (SR1 y cóctel de citoquinas) y un paso de maduración de D7 a D13 (SR1 y TPO). En D13, las plaquetas cultivadas se pueden liberar después de cinco pipeteos sucesivos. (B) (i) Tasa de proliferación en D7 (x4,16 ± 0,25 (n = 34)) y viabilidad celular (86,38 ± 0,73% (n = 34)). ii)Tasa de proliferación a D10 (x2,30 ± 0,16 (n = 5)) y viabilidad celular (84,80 ± 2,67% (n = 5)). (C) Análisis de citometría de flujo estado de la evolución fenotípica de MK en cultivo. En D0, 95,80 ± el 0,80% de las células son CD34 positivas (n = 3). En D7, el 50,20 ± el 2,90% de las células son positivas para CD34 y CD41. En D10, menos del 15,60 ± el 4,70% de las células son negativas para CD41. Haga clic aquí para ver una versión más grande de esta figura.
Liberación de plaquetas cultivadas, día 13
El examen de los pozos en D13 muestra MK redondo y MK con proplatelet(Figura 4A). Un promedio del 35% de los proplatelets de extensión MK cultivados12. Cabe destacar que D13 representa el día óptimo para la extensión del proplatelet y la liberación de plaquetas. Si no se alcanza el nivel requerido de MK capaz de emitir proplatelets, algo debe haber salido mal a lo largo del proceso de cultivo y los resultados no deben tenerse en cuenta.
Aunque los mecanismos exactos que promueven la liberación de plaquetas de la MK madura aún no se conocen bien, es bien sabido que las fuerzas hemodinámicas son indispensables. Para imitar estas fuerzas in vitro,la suspensión que contiene proplatelet-bearing MK se aspira y repele cinco veces con un cono P1000 y luego se analiza mediante citometría de flujo. Para este propósito, se utilizan tubos que contienen un número calibrado de cuentas fluorescentes. En primer lugar, las perlas presentes en el tubo están cerradas en la ventana CD41-Alexa-fluor 488/PErcP-Cy5(Figura 4Bi,en rojo). Luego, las plaquetas cultivadas se visualizan en una pre-puerta (elementos similares a las plaquetas), determinada en los parámetros de dispersión hacia adelante (FSC) y dispersión lateral (SSC) de las plaquetas nativas(Figura 4Bii). El número de plaquetas se determina entonces en su positividad CD41/CD42a(Figura 4Biii). El conteo de células se detiene en este protocolo en 5,000 cuentas, pero se puede usar otro número fijo dependiendo de la recomendación del proveedor. A partir de los datos adquiridos, el número de plaquetas contabilizadas por cada 5.000 perlas es rutinariamente de un promedio de 24,01 ± 92 (n = 15) (Figura 4C). Conociendo el volumen aspirado por el citómetro de flujo para contar 5.000 perlas (a calcular para cada citómetro) y el volumen total de cultivo, es posible obtener una aproximación del número total de plaquetas cultivadas liberadas.
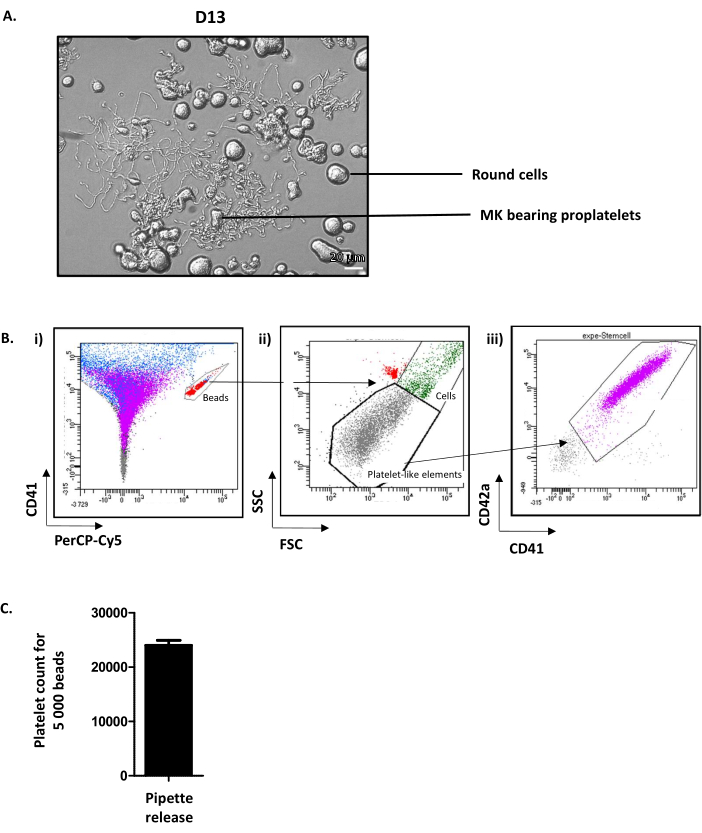
Figura 4: Liberación deplaquetas cultivadas en el día 13. (A) Imagen representativa de microscopía de luz de los proplatlets emisores de MK en D13. (B) Estrategia para cuantificar la liberación de plaquetas cultivadas. (i) Las cuentas están cerradas en la ventana CD41-Alexa-fluor 488/PErcP-Cy5 (en rojo). (ii) Los elementos similares a las plaquetas se visualizan en una puerta determinada sobre los parámetros FSC/SSC de las plaquetas nativas (puntos grises). (iii) Las plaquetas cultivadas se determinan en su positividad CD41/CD42 (púrpura). (C) Se puede obtener el número de plaquetas contabilizadas por cada 5.000 perlas, rutinariamente un promedio de 24.011 ± 919 (n = 15). Haga clic aquí para ver una versión más grande de esta figura.
El procedimiento de un vistazo
Para resumir mejor el método y comprender cada paso, en la Figura 5se presenta un póster que resume el protocolo paso a paso. Esta hoja de resumen se puede mostrar en la sala de cultura y servir como un memorándum. Cabe destacar que el éxito de los experimentos solo está garantizado con las referencias de productos indicadas en la tabla proporcionada.

Figura 5: Aislamiento de CD34+. Póster que resume el protocolo paso a paso. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe un método para producir MK capaz de emitir proplatelets a partir de HP derivados de la sangre y liberar plaquetas del medio de cultivo. Los HP se obtienen de LRF, un subproducto de los bancos de sangre, utilizado para eliminar los leucocitos contaminantes de los productos sanguíneos celulares y evitar reacciones adversas. Aunque este método es relativamente simple, algunos puntos merecen una atención especial.
La deposición de la suspensión celular en el medio de gradiente de densidad (paso 1.3.1) debe realizarse suavemente para evitar la mezcla (contenido rojo). Si este paso no se lleva a cabo con cuidado, el protocolo debe detenerse en este punto. Del mismo modo, también en el paso 1.3.1, el freno tiene que estar en el modo de apagado para evitar mezclar las fracciones. De lo contrario, la selección de HP debe suspenderse. Como se indica en el protocolo, sección 1.4, el procedimiento puede interrumpirse después de la recolección de PBMC. En este caso, las células se pueden mantener bajo agitación durante la noche a 4 °C. Luego, use un colador de células de 40 μm para eliminar los agregados formados, lo que puede afectar la selección posterior de CD34. Cabe destacar que la interrupción del procedimiento no afecta el rendimiento y la pureza de las célulasCD34 +. Al final de la selección de CD34, la pureza debe ser superior al 75% para sembrar las células ya que, en un estudio previo, la diferenciación y maduración de MK eran pobres por debajo de esta pureza12 (Figura 2).
Se debe prestar especial atención a la descongelación de las células CD34+, que debe llevarse a cabo rápidamente para evitar afectar la viabilidad de las células. Además, los pasos de lavado deben llevarse a cabo con cuidado para no dejar rastro de suero. La densidad de siembra celular debe ser respetada, ya que ha sido rigurosamente elegida para un compromiso óptimo de CD34 con la vía MKP y la maduración MK (Figura 3A).
Se propone un protocolo de fenotipado celular para seguir la diferenciación y maduración de MK. Este protocolo es relativamente básico, pero es importante tener todos los tubos de control, tanto tubos sin etiquetar como de etiquetado único, disponibles para cada día de análisis para garantizar una configuración confiable en el citómetro. Para garantizar que la cultura funcione sin problemas, es importante recopilar información sobre la proliferación a lo largo del procedimiento. En D7, la proliferación promedio es de entre 2 a 4 veces13. Esta proliferación varía poco entre experimentos, ya que cada LRF comprende células de 8 donantes. Para suavizar aún más las variaciones, es posible combinar células obtenidas en paralelo de 4 a 8 LRF.
Es posible observar la morfología de las células mediante microscopía de luz, pero las células no deben observarse todos los días porque son sensibles a las variaciones de temperatura. Al retirar las células de la incubadora, asegúrese de hacer movimientos lentos para evitar romper los proplatelets.
En cuanto a la liberación de plaquetas, se requieren cinco veces el pipeteo sucesivo. Hacer menos no asegura una liberación óptima de plaquetas y hacer más es perjudicial para su funcionalidad12. El aspecto más importante en este paso es utilizar movimientos precisos y regulares, para generar un flujo regular requerido para la liberación plaquetaria14,15,16. El método de cinco pipeteos sucesivos es, por lo tanto, simple y fácil de realizar con resultados de rendimiento satisfactorios basados en los rendimientos descritos en la literatura. El número de plaquetas liberadas se puede determinar como se menciona en la sección 3.3 mediante la estrategia de análisis de citometría de flujo que se muestra en la Figura 4B. La calidad de las plaquetas liberadas ha sido bien documentada en Do Sacramento et al. en términos de ultraestructura (morfología, tamaño, contenido de gránulos) y función (hemostasia), demostrando que estas plaquetas cultivadas son muy similares a las nativas13.
El protocolo descrito aquí es particularmente adecuado para cultivos de pequeño volumen, pero no es aplicable a cultivos a gran escala. Por lo tanto, es un método óptimo para el estudio de la biogénesis plaquetaria con el fin de comprender mejor los mecanismos moleculares y celulares que gobiernan la producción de plaquetas mediante la adición de pequeñas moléculas, agonistas o antagonistas, por ejemplo. Además, y para explorar más a fondo los mecanismos que regulan el compromiso MK, la maduración MK y la producción de plaquetas, ahora es posible manipular genéticamente el CD34+ HP utilizando un método de edición del genoma CRISPR-Cas9.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo ha sido apoyado por la ANR (Agence National de la Recherche) Grant ANR- 17-CE14-0001-1.
Materiales
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
Referencias
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados