Method Article
Leukodepletion Filters-Derived CD34+ Cells As a Cell Source to Study Megakaryocyte Diferenciação e Formação de Plaquetas
Neste Artigo
Resumo
Este protocolo descreve em detalhes todas as etapas envolvidas na obtenção de progenitores hematopoiéticos derivados de leucofilter e sua diferenciação in vitro e maturação em megacaiócitos portadores de proplatelet que são capazes de liberar plaquetas no meio da cultura. Este procedimento é útil para uma análise aprofundada dos mecanismos celulares e moleculares que controlam a megacaripoiese.
Resumo
A expansão in vitro e a diferenciação de progenitores hematopoiéticos humanos em megacaiócitos capazes de alongar proplatelets e liberar plaquetas permite um estudo aprofundado dos mecanismos subjacentes à biogênese plaquetária. Os protocolos de cultura disponíveis são baseados principalmente em progenitores hematopoiéticos derivados de medula óssea ou sangue do cordão umbilical levantando uma série de preocupações éticas, técnicas e econômicas. Se já existem protocolos disponíveis para a obtenção de células CD34 a partir de sangue periférico, este manuscrito propõe um protocolo simples e otimizado para a obtenção de células CD34+ a partir de filtros de leucodepleção prontamente disponíveis em hemocentros. Estas células são isoladas de filtros de leucodepleção utilizados na preparação de produtos de transfusão de sangue, correspondendo a oito doações de sangue. Estes filtros devem ser descartados. Um procedimento detalhado para coletar progenitores hematopoiéticos identificados como células CD34+ desses filtros é descrito. O método para obter megacaiócitos maduros estendendo proplatelets enquanto discute sua evolução fenotípica também é detalhado. Finalmente, o protocolo apresenta um método calibrado de pipetação, para liberar eficientemente plaquetas que são morfologicamente e funcionalmente semelhantes às nativas. Este protocolo pode servir de base para avaliar compostos farmacológicos que atuam em várias etapas do processo para dissecar os mecanismos subjacentes e abordar os rendimentos da plaqueta in vivo.
Introdução
As plaquetas de sangue vêm de grandes células poliploides especializadas, os megacaiócitos (MK), que se originam de um processo de produção constante e afinado conhecido como megacariopoiesis (MKP). No ápice desse processo estão células-tronco hematopoiéticas que, em contato com o ambiente de medula óssea (citocinas, fatores de transcrição, nicho hematopoiético), poderão proliferar e diferenciar-se em progenitores hematopoiéticos (HP) capazes de se comprometer em direção à via megacariocítica, dando origem a MKs imaturos1. Sob a influência de várias citocinas, e em particular trombopoietina (TPO), que é a principal citocina de MKP; o MK passará então por dois grandes estágios de maturação: a endomitose e o desenvolvimento de membranas de demarcação (DMS). Este MK totalmente maduro aparece perto de um vaso sinusoide no qual pode emitir extensões citoplasmáticas, as propuladas, que serão liberadas sob o fluxo sanguíneo e posteriormente remodeladas em plaquetas funcionais2. A clonagem de TPO em 19943 proporcionou um impulso no estudo do MKP, acelerando o desenvolvimento de técnicas de cultura in vitro permitindo a diferenciação da HP e o amadurecimento do MK.
Existem muitas patologias que afetam as plaquetas sanguíneas, tanto em termos de número de plaquetas (aumento ou diminuição) quanto função4,5. Ser capaz de recapitular o MKP in vitro da HP humana poderia melhorar a compreensão dos mecanismos moleculares e celulares subjacentes a esse processo e, em última instância, o gerenciamento terapêutico dos pacientes.
Várias fontes de HP humano são adequadas: sangue do cordão umbilical, medula óssea e sangue periférico6,7,8. A colheita de HP do sangue periférico levanta menos problemas logísticos e éticos do que sua recuperação do sangue do cordão umbilical ou da medula óssea. A HP pode ser recuperada de leucemia ou casaco buffy, mas essas fontes são caras e nem sempre estão disponíveis em hemocentros. Outros protocolos, menos caros e mais fáceis de executar, permitem a recuperação direta das células mononucleares de sangue periféricos (PBMCs) sem a necessidade de isolamento prévio orientado por CD344,8. No entanto, a pureza dos megacaitos não é satisfatória com este método e uma seleção de células CD34+ do PBMC é recomendada para a melhor diferenciação em MK. Isso nos levou a implementar uma purificação hp a partir de filtros de leucoredução (LRF), rotineiramente usados em bancos de sangue para remover glóbulos brancos e, assim, evitar reações imunológicas adversas9. De fato, desde 1998, os concentrados de plaquetas foram automaticamente leucodepclados na França. Ao final desse processo, a LRF é descartada e todas as células retidas na LRF são destruídas. As células em LRFs estão, portanto, prontamente disponíveis sem custo adicional. Os LRFs têm um conteúdo celular próximo ao obtido por leucemia ou em casacos buffy, notadamente em sua composição de CD34+ HP tornando-os uma fonte notavelmente atraente10. A LRF como fonte humana de HP já foi demonstrada para fornecer células com capacidades funcionais intactas11. Essa fonte tem a vantagem de ser abundante e acessível para pesquisas laboratoriais. Nesse contexto, este artigo descreve sucessivamente: i) a extração e seleção de CD34+ HP de LRFs; ii) uma cultura otimizada em duas fases, que recapitula o compromisso da HP na via megacariocítica e o amadurecimento do MK capaz de emitir proplatelets; iii) um método para liberar eficientemente plaquetas deste mk; e iv) um procedimento para fenotipagem MK e plaquetas cultivadas.
Protocolo
Foram obtidas amostras humanas de controle de doadores de sangue volonteer que deram consentimento por escrito recrutado pelo centro de transfusão de sangue onde a pesquisa foi realizada (Etablissement Français du Sang-Grand Est). Todos os procedimentos foram registrados e aprovados pelo Ministério da Educação Superior e Pesquisa da França e registrados sob o número AC_2015_2371.Os doadores deram sua aprovação no formulário de consentimento do CODHECO AC- 2008 - 562, para que as amostras fossem utilizadas para fins de pesquisa. Os estudos em humanos foram realizados de acordo com a declaração de Helsinque.
1. Extração e seleção de células CD34+ (HP) da LRF
-
Preparação do reagente (para uma LRF)
- Prepare 25 mL de tampão de eluição filtrada: 21,25 mL de Salina Tamponada fosfato (PBS), 2,5 mL de Ácido-Citrato-Dextrose (ACD) e 1,25 mL de Soro Fetal Bovino descomplementado (FBS). Filtrar em 0,22 μm e colocar a 37 °C.
- Prepare 500 mL de PBS com 2 mM de ácidotraacético e etilenodiaminete (EDTA).
- Descarte 25 mL de gradiente de densidade (DGM) (1,077 g/mL) em dois tubos de 50 mL.
-
LRF back-flushing modalidades (Figura 1)
NOTA: Esta etapa requer uma máquina de solda de tubo estéril, permitindo a conexão estéril de tubos termoplásticos.- Primeiro, conecte o LRF a uma bolsa de transferência vazia de 600 mL e a LRF a um conjunto de tubos(Figura 1A). Sob o gabinete de biossegurança, injete o volume total de tampão de elução filtrado e preparado correspondente ao número de LRFs manuseados (xLRF x 25 mL) no saco vazio. Em seguida, utilizando uma seringa de 30 mL para aspirar suavemente todo o conteúdo do saco através do LRF, retrocede e transferir as células para um novo tubo de 50 mL(Figura 1B).
- Para a sedimentação dos glóbulos vermelhos, diluir a suspensão celular pela metade com o Dextran 2% e misturar bem para agregar glóbulos vermelhos. Aguarde 30 min em temperatura ambiente (RT).
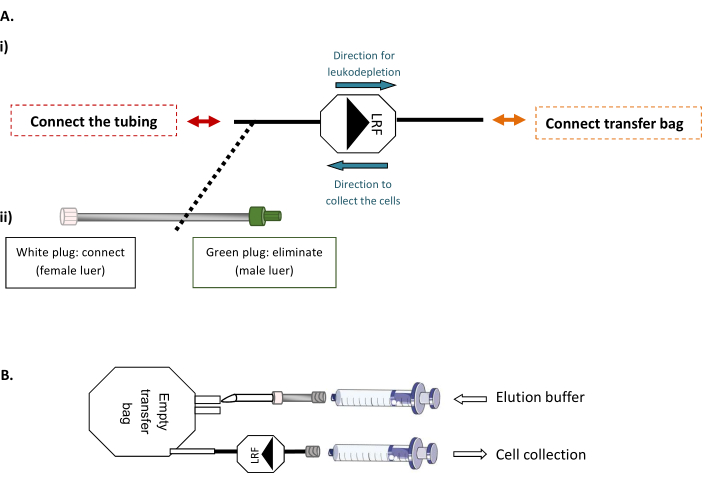
Figura 1: LRF volta às modalidades de descarga. (A) Regime representativo de (i) a conexão estéril da bolsa de transferência para a LRF e (ii)o tubo definido para a LRF. (B) Esquema representativo da conexão das seringas para coleta de células. Clique aqui para ver uma versão maior desta figura.
-
Coleção PBMC
- Seguindo a sedimentação dos glóbulos vermelhos, remova e transfira o supernante em um tubo de 50 mL e preencha-o com PBS-EDTA 2 mM. Sobreponha suavemente o sobrenatante ao DGM acima preparado. Deixe o supernatante fluir suavemente sem quebrar o plano superficial do gradiente de densidade. Centrifugar a 400 x g em RT por 30 min no modo de desligar o freio.
- Colete a camada PBMC com uma pipeta de transferência descartável. Transfira as células de cada tubo DGM para um novo tubo estéril de 50 mL. Encha cada tubo com PBS-EDTA 2 mM e lave duas vezes em 50 mL de PBS-EDTA 2 mM a 200 x g por 10 min no RT no freio no modo.
- Pipeta fora e piscina a pelota celular com 50 mL PBS-EDTA 2 mM.
NOTA: Existe a possibilidade de interromper o procedimento mantendo as células coletadas sob agitação a 4 °C durante a noite. Em seguida, filtre a suspensão com um coador de células de 40 μm para remover os agregados formados.
-
Seleção de células CD34+
- Determine o número do celular e a centrífuga a 400 x g em temperatura ambiente por 10 minutos com o rompimento.
- Aspire completamente o supernascedor e resuspenque no volume apropriado de PBS-EDTA 2 mM detalhado pelo fabricante do kit de seleção CD34 (300 μL de PBS-EDTA para 108 células). Adicione o Reagente bloqueador de FcR e as Microesferas CD34 na concentração apropriada (50 μL para 108 células).
- Após 30 min a 4 °C, lave a suspensão celular e ressuspenda no volume apropriado de PBS-EDTA 2 mM detalhado pelo fabricante do kit de seleção CD34 (500 μL por 108 células).
NOTA: A seleção é feita em colunas de classificação para a passagem de no máximo 2 x 109 células por coluna. - Passe a amostra sobre a coluna molhada do ímã. Lave duas vezes com 3 mL de PBS-EDTA 2 mM e elute as células com 5 mL de PBS-EDTA 2 mM. Uma segunda corrida em uma nova coluna após o mesmo procedimento é necessária para melhorar a pureza da amostra.
NOTA: Um número esperado de 6,1 x 105 células/LRF (Figura 2A). Para maiores números de LRF, aumente os reagentes e métodos em conformidade.
-
Avaliação da pureza celular CD34+
- Adicione a uma alíquota de 100 μL de suspensão obtida após a seleção CD34+, 2 μL de anticorpo cd34-PE humano ou 2 μL de IgG - PE (controle). Misture bem e incubar por 15 min a 4 °C.
- Lave as células adicionando 2 mL de PBS e centrífuga a 400 x g por 5 min. Aspirar supernaente completamente e resuspend em 200 μL de PBS.
- Analise a pureza por citometria de fluxo, como mostrado na Figura 2A e na Discussão.
NOTA: Espera-se uma pureza de células CD34+ acima de 90%(Figura 2Bii). - Use as células CD34+ diretamente ou congele para uso posterior.
-
Cd34+ células congelando
NOTA: O congelamento das células CD34+ é feito a uma densidade de 106 células por mL.- Seguindo a determinação do número de celular CD34+, prepare os seguintes meios de criopreservação: (1) 60% Stemspan + 40% FBS, (2) 40% Hasspan + 40% FBS + 20% Dimethyl Sulfoxide (DMSO) e permita o resfriamento a 4 °C.
- Centrifugar as células CD34+ a 400 x g em temperatura ambiente por 5 minutos e resuspensar a pelota na solução fria 1 e, em seguida, imediatamente adicionar à solução fria 2 (v/v).
- Coloque os criobotos imediatamente em um congelador de -80 °C por 24 h e, em seguida, transfira criobotos para o tanque de nitrogênio líquido.
2. Cultura e diferenciação de células CD34+ para produzir megacaiócitos maduros de proplatelet
NOTA: Protocolo de culturacelular (Figura 3A),esquema representativo do procedimento de cultura celular são detalhados nesta seção.
-
Células CD34+ descongelando (se necessário)
- Prepare a solução de degelo: 13 mL de PBS-20% FBS e coloque a 37 °C por 15 min. Transfira rapidamente os criobotos para um banho de água de 37 °C até que apenas um pequeno cristal de gelo. Sob o gabinete de cultura biológica, pipeta todo o conteúdo, e lentamente transferir em 13 mL de solução de descongelamento pré-armado.
- Determine o número do celular e a viabilidade celular.
-
Protocolo de cultura, passo 1: do dia 0 ao dia 7
NOTA: Geralmente as culturas são feitas em placas de 24 poços com 1 mL de médio por poço a uma densidade de 40.000 células viáveis/mL, correspondendo a 20.000 células viáveis/cm2. É crucial respeitar essa densidade se alguma escala for planejada.- Preparação média de crescimento : Em mídia de expansão de células hematopoiéticas livres de soro (anteriormente aquecida a 37 °C) adicione Penicillin-Streptomicina-Glutamina (PSG) 1x, Lipoproteína de Baixa Densidade humana (hLDL) a 20 μg/mL, coquetel de citocina de expansão de megacaiócito 1x e Stemregenin 1 (SR1) a 1 μM.
- Semeadura celular : Centrifugar as células CD34+ descongeladas a 400 x g em temperatura ambiente por 5 min. Remova completamente o supernasce e resuspenha a pelota celular em 1 mL de mídia cultural e realize uma numeração celular e viabilidade para determinar o volume apropriado para semear as células.
- Centrifugar as células 400 x g à temperatura ambiente por 5 min e resuspensar a pelota no volume apropriado do meio de crescimento quente. Incubar as células a 37 °C com 5% de CO2 durante 7 dias.
-
Protocolo de cultura, passo 2: do dia 7 ao dia 13 (Figura 3B, imagens representativas no dia 13)
NOTA: Geralmente as culturas são feitas em placas de 24 poços com 1 mL de médio por poço a uma densidade de 50.000 células viáveis/mL, correspondendo a 25.000 células viáveis/cm². É crucial respeitar essa densidade se alguma escala for planejada.- Preparação média de maturação: Em mídia de expansão de células hematopoiéticas sem soro (anteriormente aquecida a 37 °C) adicione PSG 1x, hLDL a 20 μg/mL, TPO a 50 ng/mL e SR1 a 1 μM.
- Examine as células sob o microscópio. No dia 7, as células exibem uma aparência redonda e homogênea preenchendo os poços ou os frascos sem serem muito confluentes.
- Sob um armário de biossegurança, transfira suavemente as células em um tubo de 15 mL. Lave poços com PBS. Em seguida, determine o número de células e sua viabilidade para calcular o volume apropriado para semear as células.
- Centrifugar as células a 400 x g em temperatura ambiente por 5 min. Remova o supernatante e resuspenque as células no volume apropriado de mídia quente calculada na etapa anterior. Incubar as células a 37 °C, 5% de CO2 por 6 dias.
-
Lançamento de plaquetas cultivadas no dia 13
- Adicione 0,5 μM de prostaglandina I2 (PGI2) e 0,02 U/mL de apyrase à cultura e realize five vezes sucessivas pipetting com uma pipeta de 1 mL.
NOTA: As plaquetas estão agora liberadas no meio.
- Adicione 0,5 μM de prostaglandina I2 (PGI2) e 0,02 U/mL de apyrase à cultura e realize five vezes sucessivas pipetting com uma pipeta de 1 mL.
3. Análise da citometria de fluxo (fenotipagem mk e contagem de plaquetas cultivadas)
NOTA: Este protocolo pode ser aplicado ao fenotipagem das células nos dias de cultura selecionados. Também permite a determinação do número da liberação de plaquetas cultivadas (Figura 4A,B).
-
Preparação para análise de MK
- Rotular quatro conjuntos de tubos de microcentrifuge da seguinte forma: Células sem rótulo como controle, células + 5 μL CD41 - Alexa Fluor 488, Células + 5 μL CD34 - PECy7, Células + 5 μL CD41 - Alexa Fluor 488 + 5 μL CD34 - PECy7. Use um mínimo de 1,105 células por tubo, não exceda 1,106 células por tubo. Adicione a 100 μL de suspensão celular por tubo de citometria e os diferentes anticorpos. Incubar no escuro por 30 min a 4 °C.
- Em seguida, adicione 2 mL de PBS-EDTA 2 mM por tubo e centrífuga a 400 x g por 5 min a temperatura ambiente. Durante a centrifugação, prepare uma solução de PBS-EDTA 2 mM + 7-Aminoactinomicin-D (7AAD) (1/100), permita uma solução de 300 μL por tubo.
- Remova o supernatante e pegue a pelota em 300 μL de PBS-EDTA 2 mM com 7AAD. Passe amostras através do citômetro de fluxo dentro de 30 minutos.
NOTA: A estratégia de análise da citometria de fluxo é mostrada na Figura 3C e na Discussão.
-
Preparação do tubo para análise de plaquetas cultivadas
- Rotular quatro conjuntos de tubos de microcentrifuuge da seguinte forma: Células sem rótulo como controle, Células + 5 μL CD41 - Alexa Fluor 488, Células + 20 μL CD42a - PE, Células + 5 μL CD41 - Alexa Fluor 488 + 20 μL CD42a - PE. Após cinco pipetting sucessivas em bem cultura, transfira 300 μL da suspensão no tubo para citometria contendo um número calibrado de contas fluorescentes.
- Adicione anticorpos e incubar no escuro em RT por 30 minutos.
- Passe as amostras através do citômetro de fluxo dentro de 30 minutos e defina a aquisição para a passagem de 5.000 contas.
NOTA: A estratégia de análise da citometria de fluxo é mostrada na Figura 4B e na Discussão.
Resultados
Extração e seleção de células CD34+ de LRFs
Aqui, o método, derivado de Peytour et al.9,descreve a extração e seleção de células CD34+ de LRFs descartados disponíveis em bancos de sangue após a remoção de leucócitos. Seguindo o procedimento de retroafismo, geralmente 1,03 x 109 ± 2,45 x 108 células/LRF (Média±SEM; n = 155) são recuperados com uma viabilidade de 94,88 ± 0,10%(Figura 2A i). Após a seleção positiva do CD34, é obtida uma média de 615,54 x 103 ± 12,28 células/LRF (n = 155) (Figura 2A ii). Se o número de células for inferior a 300.000, deve-se concluir que o procedimento não foi realizado corretamente e deve ser interrompido. Para avaliar o sucesso da seleção CD34, a pureza das células CD34+ é avaliada pela citometria de fluxo(Figura 2B). Rotineiramente, espera-se uma pureza acima de 90% (91,88 ± 0,79%)(Figura 2B). Uma pureza abaixo de 75% pode significar que houve um problema na condução do protocolo e, em particular, na eluição das colunas. Abaixo de 75% de pureza, as células não são conservadas para experimentos culturais.
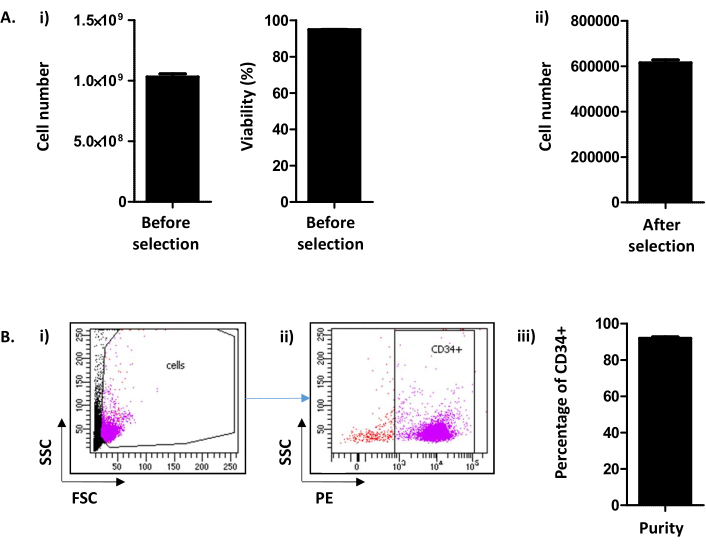
Figura 2: Número de célula CD34+/LRF e análise de pureza CD34. (A) (i) Uma análise, por contador celular, do número de células e sua viabilidade obtida após o procedimento, incluindo tanto a coleta pbmc quanto a seleção cd34 ((1.03.109 ± 2.45.108 células/LRF (Média ± SEM; SEM; n=155) com viabilidade de 94,88 ± 0,10% (n = 155)). (ii) Uma análise, por contador celular, também é realizada após a seleção do CD34 (615,54 x 103 ± 12,28 células/LRF (n = 155)). (B) A pureza cd34 é analisada por citometria de fluxo. (i) As células foram manchadas com um anticorpo CD34-PE e identificadas em seus parâmetros FSC/SSC. (ii)Com base no sinal de dispersão e na análise da expressão CD34, a pureza é determinada. Um pré-portão de positividade CD34 foi usado com base no controle negativo para o marcador CD34. (iii) Como se pode ver no gráfico da barra, espera-se uma pureza de células CD34+ acima de 90% (91,88 ± 0,79% (n = 17)). Clique aqui para ver uma versão maior desta figura.
Diferenciação e maturação de proplatelets portadores de MK
O procedimento de cultura celular descrito é dividido em duas etapas. O primeiro, do dia (D) 0 ao D7, é dedicado à proliferação e compromisso da HP na via megacariocítica em resposta a uma combinação de citocinas e à adição de um composto químico SR1. O segundo, de D7 a D13, é focado na maturação de MK e extensão de proplatelet após a adição de TPO e SR1 (Figura 3A). Como controle de qualidade da cultura, contagem celular, determinação da viabilidade celular e fenotipagem das células, são perfomed em D7 e D10. Essas etapas foram escolhidas porque são cruciais para o comprometimento da HP, a maturação de D7 e MK, D10, respectivamente (dados pessoais). Em D7 e 10, a proliferação é rotineiramente de x4,16 ± 0,25 (n = 34) e x2,30 ± 0,16 (n = 5), respectivamente, com viabilidade celular composta entre 86,38 ± 0,73% (n = 34); e 84,80 ± 2,67% (n = 5) (Figura 3B). Em relação ao fenotipamento celular, como mostra a Figura 3C, em D0, mais de 90% das células são positivas para CD34. Em seguida, as células CD34+ tornam-se comprometidas com a linhagem megacariocítica, como testemunhado pela aparição do CD41, um marcador específico e precoce do MKP. De fato, na D7, 50,20 ± 2,90% das células são positivas tanto para CD34 quanto para CD41(Figura 3Bii). Então, MK melhora sua maturação. Na D10, a maioria dos MK são maduros, sendo menos de 15,60 ± 4,70% das células sendo negativas para CD41, sendo 47,90 ± 8,90% sendo CD34+CD41+ e 36,40 ± 12,40% sendo CD34-CD41+ (Figura 3Biii).
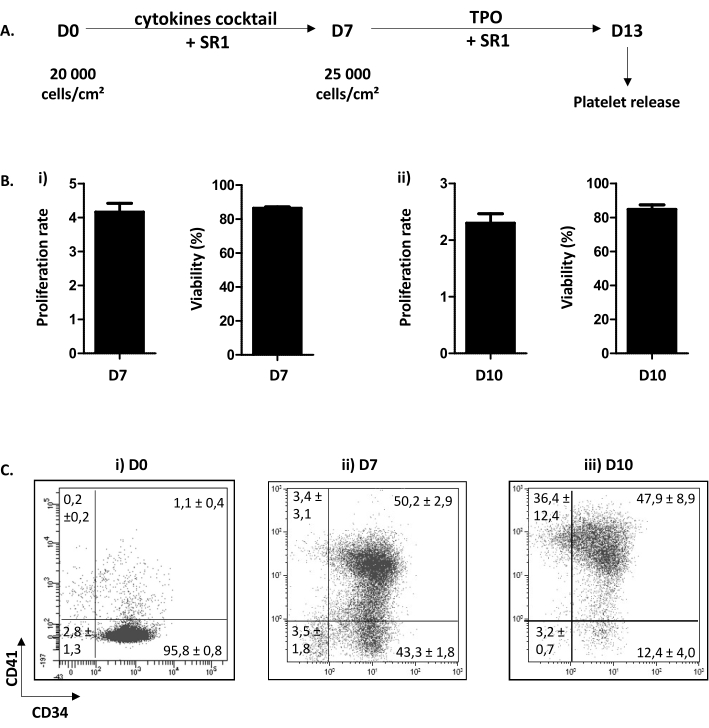
Figura 3: Diferenciação e maturação de proplatelets portadores de MK. (A) Esquema representativo do procedimento de cultura celular. É utilizado um método de duas etapas: um passo de proliferação de D0 para D7 (SR1 e coquetel de citocinas) e um passo de maturação de D7 para D13 (SR1 e TPO). Na D13, plaquetas cultivadas podem ser liberadas após cinco pipetas sucessivas. (B) (i) Taxa de proliferação em D7 (x4,16 ± 0,25 (n = 34)) e viabilidade celular (86,38 ± 0,73% (n = 34)). (ii) Taxa de proliferação em D10 (x2,30 ± 0,16 (n = 5)) e viabilidade celular (84,80 ± 2,67% (n = 5)). (C) Análise da citometria de fluxo da evolução fenotípica da MK na cultura. Em D0, 95,80 ± 0,80% das células são CD34 positivo (n = 3). Na D7, 50,20 ± 2,90% das células são positivas para CD34 e CD41. Na D10, menos de 15,60 ± 4,70% das células são negativas para CD41. Clique aqui para ver uma versão maior desta figura.
Lançamento de plaquetas cultivadas, dia 13
O exame dos poços em D13 mostra MK redondo e MK portador de proplato(Figura 4A). Uma média de 35% do MK cultivado estende as proplatelets12. Note-se que o D13 representa o dia ideal para extensão de proplatelet e liberação de plaquetas. Se o nível necessário de MK capaz de emitir proplatelets não for atingido, algo deve ter dado errado ao longo do processo de cultura e os resultados não devem ser levados em conta.
Embora os mecanismos exatos que promovem a liberação de plaquetas de MK maduros ainda sejam mal compreendidos, é sabido que as forças hemodinâmicas são indispensáveis. Para imitar essas forças in vitro,a suspensão contendo MK portador de proplatelet é aspirada e repelida cinco vezes com um cone P1000 e, em seguida, analisada por citometria de fluxo. Para isso, são utilizados tubos contendo um número calibrado de contas fluorescentes. Primeiro, as contas presentes no tubo são fechadas na janela CD41-Alexa-fluor 488/PErcP-Cy5(Figura 4Bi, em vermelho). Em seguida, plaquetas cultivadas são visualizadas em um pré-portão (elementos semelhantes a plaquetas), determinados nos parâmetros de dispersão dianteira (FSC) e dispersão lateral (SSC) de plaquetas nativas(Figura 4Bii). O número de plaquetas é então determinado em sua positividade CD41/CD42a (Figura 4Biii). A contagem de células é interrompida neste protocolo em 5.000 contas, mas outro número fixo pode ser usado dependendo da recomendação do fornecedor. A partir dos dados adquiridos, o número de plaquetas contadas por 5.000 contas é rotineiramente de 24,01 ± 92 (n = 15) (Figura 4C). Conhecendo o volume aspirado pelo citômetro de fluxo para contar 5.000 contas (a serem calculadas para cada cítmetro) e o volume total de cultura, é possível obter uma aproximação do número total de plaquetas cultivadas liberadas.
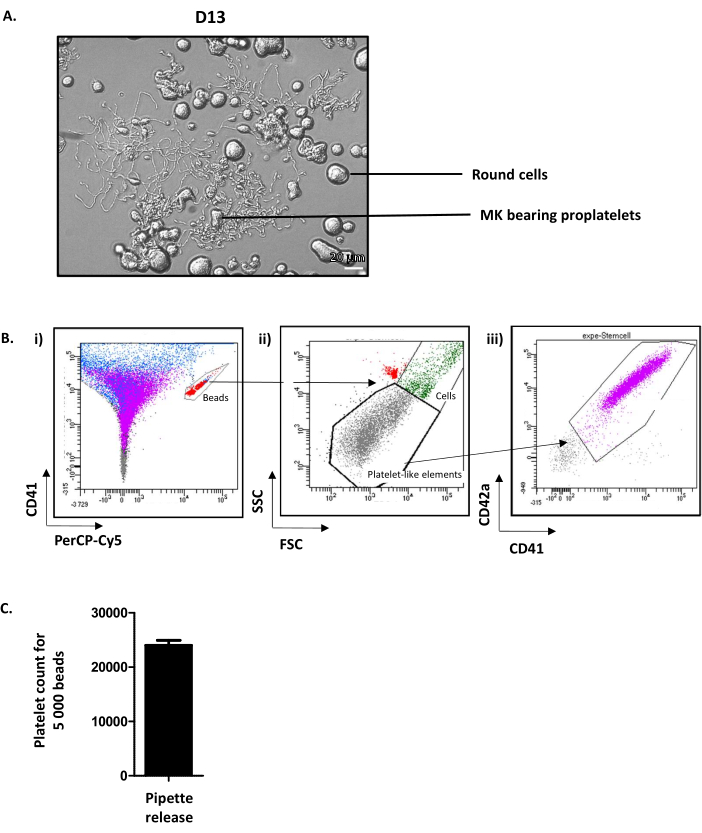
Figura 4: Plaquetas cultivadas liberadas no dia 13. (A) Imagem de microscopia de luz representativa de MK emitindo proplatelets em D13. (B) Estratégia para quantificar a liberação de plaquetas cultivadas. (i) As contas são fechadas na janela CD41-Alexa-fluor 488/PErcP-Cy5 (em vermelho). (ii) Elementos semelhantes a plaquetas são visualizados em um portão determinado nos parâmetros FSC/SSC de plaquetas nativas (pontos cinzentos). (iii) As plaquetas cultivadas são determinadas em sua positividade CD41/CD42 (roxo). (C) Pode-se obter um número de plaquetas contadas por 5.000 contas, rotineiramente uma média de 24.011 ± 919 (n = 15). Clique aqui para ver uma versão maior desta figura.
O procedimento em um relance
Para resumir melhor o método e entender cada etapa, um pôster resumindo o protocolo passo a passo é apresentado na Figura 5. Esta folha de resumo pode ser exibida na sala de cultura e servir como um memorando. Note-se que o sucesso dos experimentos só é garantido com as referências do produto indicadas na tabela fornecida.

Figura 5: Isolamento do CD34+. Pôster resumindo o protocolo passo a passo. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve um método para produzir MK capaz de emitir proplatelets da HP derivada do sangue e para liberar plaquetas do meio de cultura. A HP é obtida da LRF, um subproduto dos bancos de sangue, usado para remover leucócitos contaminantes de produtos sanguíneos celulares e evitar reações adversas. Embora este método seja relativamente simples, alguns pontos merecem atenção especial.
A deposição da suspensão celular no meio gradiente de densidade (etapa 1.3.1) deve ser realizada suavemente para evitar a mistura (teor vermelho). Se esta etapa não for realizada com cuidado, o protocolo deve parar neste momento. Da mesma forma, também na etapa 1.3.1, o freio tem que estar no modo desligado para evitar misturar as frações. Caso não, a seleção hp deve ser suspensa. Conforme indicado no protocolo, seção 1.4, o procedimento pode ser interrompido após a coleta do PBMC. Neste caso, as células podem ser mantidas sob agitação durante a noite a 4 °C. Em seguida, use um coador de célula de 40 μm para remover os agregados formados, o que pode impactar na seleção t CD34 subsequente. Note-se que interromper o procedimento não afeta o rendimento e a pureza das células CD34+ Ao final da seleção cd34, a pureza deve ser superior a 75% para semear as células, uma vez que, em estudo anterior, a diferenciação e a maturação da MK foram pobres abaixo dessa pureza12 (Figura 2).
Atenção especial deve ser dada ao descongelamento das células CD34+ que devem ser realizadas rapidamente para evitar afetar a viabilidade das células. Além disso, as etapas de lavagem devem ser realizadas cuidadosamente para não deixar vestígios de soro. A densidade de semeadura celular deve ser respeitada, pois foi rigorosamente escolhida para o compromisso ótimo de CD34 com a via MKP e a maturação de MK(Figura 3A).
Um protocolo de fenotipagem celular é proposto para seguir a diferenciação e maturação do MK. Este protocolo é relativamente básico, mas é importante ter todos os tubos de controle, tanto tubos de rotulagem não rotulados quanto únicos, disponíveis para cada dia de análise para garantir configurações confiáveis no cítmetro. Para garantir que a cultura funcione sem problemas, é importante coletar informações de proliferação ao longo do procedimento. Na D7, a proliferação média é entre 2 a 4vezes 13. Essa proliferação varia pouco entre os experimentos, uma vez que cada LRF compreende células de 8 doadores. Para suavizar ainda mais as variações, é possível combinar células obtidas em paralelo de 4 a 8 LRFs.
É possível olhar para a morfologia das células por microscopia leve, mas as células não devem ser observadas todos os dias porque são sensíveis às variações de temperatura. Ao remover as células da incubadora, certifique-se de fazer movimentos lentos para evitar quebrar as propulas.
Quanto à liberação de plaquetas, são necessárias cinco vezes mais pipetting. Fazer menos não garante a liberação ideal de plaquetas e fazer mais é prejudicial à sua funcionalidade12. O aspecto mais importante nesta etapa é utilizar movimentos precisos e regulares, para gerar um fluxo regular necessário para a liberação de plaquetas14,15,16. O método de cinco pipetting sucessivas é, portanto, simples e fácil de executar com resultados satisfatórios de desempenho baseados nos rendimentos descritos na literatura. O número de plaquetas liberadas pode ser determinado conforme mencionado na seção 3.3 utilizando-se a estratégia de análise de citometria de fluxo mostrada na Figura 4B. A qualidade das plaquetas liberadas foi bem documentada em Do Sacramento et al. em termos de ultraestrutura (morfologia, tamanho, conteúdo de grânulo) e função (hemostasia), demonstrando que essas plaquetas cultivadas são muito semelhantes às nativas13.
O protocolo aqui descrito é particularmente adequado para culturas de pequeno volume, mas não é aplicável à cultura em larga escala. É, portanto, um método ideal para o estudo da biogênese plaqueta, a fim de entender melhor os mecanismos moleculares e celulares que regem a produção de plaquetas adicionando pequenas moléculas, agonistas ou antagonistas, por exemplo. Além disso, e para explorar ainda mais os mecanismos que regulam o compromisso MK, a maturação de MK e a produção de plaquetas, agora é possível manipular geneticamente o CD34+ HP usando um método de edição de genoma CRISPR-Cas9.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pela ANR (Agence National de la Recherche) Grant ANR- 17-CE14-0001-1.
Materiais
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
Referências
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados