Method Article
Leukodepletion Filter-abgeleitete CD34+ Zellen als Zellquelle zur Untersuchung der Megakaryozytendifferenzierung und Thrombozytenbildung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt detailliert alle Schritte zur Gewinnung von Leukofilter-abgeleiteten CD34+ hämatopoetischen Vorläufern und deren In-vitro-Differenzierung und Reifung zu proplatlettragenden Megakaryozyten, die in der Lage sind, Blutplättchen im Kulturmedium freizusetzen. Dieses Verfahren ist nützlich für die eingehende Analyse zellulärer und molekularer Mechanismen, die die Megakaryopoese kontrollieren.
Zusammenfassung
Die In-vitro-Expansion und Differenzierung menschlicher hämatopoetischer Vorläufer in Megakaryozyten, die in der Lage sind, Proplatelette zu verlängern und Blutplättchen freizusetzen, ermöglicht eine eingehende Untersuchung der Mechanismen, die der Thrombozytenbiogenese zugrunde liegen. Verfügbare Kulturprotokolle basieren meist auf hämatopoetischen Vorläufern, die aus Knochenmark oder Nabelschnurblut gewonnen werden, was eine Reihe ethischer, technischer und wirtschaftlicher Bedenken aufwirft. Wenn es bereits verfügbare Protokolle zur Gewinnung von CD34-Zellen aus peripherem Blut gibt, schlägt dieses Manuskript ein einfaches und optimiertes Protokoll zur Gewinnung von CD34+-Zellen aus Leukodepletionsfiltern vor, die in Blutzentren leicht verfügbar sind. Diese Zellen werden aus Leukodepletionsfiltern isoliert, die bei der Herstellung von Bluttransfusionsprodukten verwendet werden, was acht Blutspenden entspricht. Diese Filter sollen verworfen werden. Ein detailliertes Verfahren zur Entnahme hämatopoetischer Vorläufer, die als CD34+-Zellen identifiziert wurden, aus diesen Filtern wird beschrieben. Die Methode, um reife Megakaryozyten zu erhalten, die Proplatele verlängern, während ihre phänotypische Evolution diskutiert wird, wird ebenfalls detailliert beschrieben. Schließlich stellt das Protokoll eine kalibrierte Pipettiermethode vor, um Thrombozyten, die morphologisch und funktionell nativen ähnlich sind, effizient freizusetzen. Dieses Protokoll kann als Grundlage für die Bewertung pharmakologischer Verbindungen dienen, die in verschiedenen Schritten des Prozesses wirken, um die zugrunde liegenden Mechanismen zu sezieren und sich den In-vivo-Thrombozytenausbeuten zu nähern.
Einleitung
Blutplättchen stammen aus spezialisierten großen polyploiden Zellen, den Megakaryozyten (MK), die aus einem konstanten und fein abgestimmten Produktionsprozess stammen, der als Megakaryopoese (MKP) bekannt ist. An der Spitze dieses Prozesses stehen hämatopoetische Stammzellen, die in Kontakt mit der Knochenmarkumgebung (Zytokine, Transkriptionsfaktoren, hämatopoetische Nische) in der Lage sein werden, sich zu vermehren und sich zu hämatopoetischen Vorläufern (HP) zu differenzieren, die in der Lage sind, sich auf den megakaryozytären Weg zu begeben, was zu unreifen MKsführt 1. Unter dem Einfluss verschiedener Zytokine, insbesondere Thrombopoietin (TPO), das das Hauptzytokin von MKP ist; Das MK wird dann zwei Hauptreifungsstadien durchlaufen: Endomitose und die Entwicklung von Demarkationsmembranen (DMS). Dieses voll ausgereifte MK erscheint dann in der Nähe eines sinusförmigen Gefäßes, in dem es zytoplasmatische Erweiterungen, die Proplatele, emittieren kann, die unter dem Blutfluss freigesetzt und anschließend in funktionelle Blutplättchen umgewandelt werden2. Das Klonen von TPO im Jahr 19943 gab der MKP-Untersuchung einen Schub, indem es die Entwicklung von In-vitro-Kulturtechniken beschleunigte, die eine HP-Differenzierung und MK-Reifung ermöglichen.
Es gibt viele Pathologien, die Blutplättchen betreffen, sowohl in Bezug auf die Thrombozytenzahl (Zunahme oder Abnahme) als auch auf die Funktion4,5. Die Möglichkeit, MKP in vitro aus humanem HP zu rekapitulieren, könnte das Verständnis der molekularen und zellulären Mechanismen, die diesem Prozess zugrunde liegen, und letztendlich das therapeutische Management von Patienten verbessern.
Verschiedene Quellen menschlicher HP sind geeignet: Nabelschnurblut, Knochenmark und peripheres Blut6,7,8. Die Gewinnung von HP aus peripherem Blut wirft weniger logistische und ethische Probleme auf als ihre Wiederherstellung aus Nabelschnurblut oder dem Knochenmark. HP kann aus Leukapherese oder Buffy Coat gewonnen werden, aber diese Quellen sind teuer und nicht immer in Blutzentren verfügbar. Andere Protokolle, die kostengünstiger und einfacher durchzuführen sind, ermöglichen die direkte Wiederherstellung von humanen peripheren mononukleären Blutzellen (PBMCs), ohne dass eine vorherige CD34-gesteuerte Isolierungerforderlich ist 4,8. Die Reinheit der Megakaryozyten ist mit dieser Methode jedoch nicht zufriedenstellend und eine Auswahl von CD34+ Zellen aus PBMC wird für eine optimale Differenzierung in MK empfohlen. Dies führte uns dazu, eine HP-Reinigung aus Leukoreduktionsfiltern (LRF) zu implementieren, die routinemäßig in Blutbanken verwendet wird, um weiße Blutkörperchen zu entfernen und somit unerwünschte immunologische Reaktionen zu vermeiden9. Seit 1998 werden Thrombozytenkonzentrate in Frankreich automatisch leukodepleiert. Am Ende dieses Prozesses werden LRF verworfen und alle in der LRF zurückgehaltenen Zellen werden zerstört. Zellen in LRFs sind daher ohne zusätzliche Kosten leicht verfügbar. LRFs haben einen zellulären Gehalt, der dem durch Leukapherese oder in Buffy Coats erhaltenen Gehalt nahe kommt, insbesondere in ihrer Zusammensetzung von CD34 + HP, was sie zu einer bemerkenswert attraktiven Quellemacht 10. Es wurde bereits nachgewiesen, dass LRF als humane HP-Quelle Zellen mit intakten funktionellen Kapazitäten versorgt11. Diese Quelle hat den Vorteil, dass sie reichlich vorhanden und für die Laborforschung erschwinglich ist. In diesem Zusammenhang beschreibt dieser Artikel sukzessive: i) die Extraktion und Auswahl von CD34+ HP aus LRFs; ii) eine zweiphasig optimierte Kultur, die das Engagement von HP in den megakaryozytären Signalweg und die Reifung von MK, das Proplatele emittieren kann, rekapituliert; iii) ein Verfahren zur effizienten Freisetzung von Blutplättchen aus diesen MK; und iv) ein Verfahren zur Phänotypisierung von MK und kultivierten Blutplättchen.
Protokoll
Kontrollproben von menschlichen Kontrollproben wurden von Freiwilligenblutspendern erhalten, die eine schriftliche Einverständniserklärung gaben, die von dem Bluttransfusionszentrum rekrutiert wurde, in dem die Forschung durchgeführt wurde (Etablissement Français du Sang-Grand Est). Alle Verfahren wurden vom französischen Ministerium für Hochschulbildung und Forschung registriert und genehmigt und unter der Nummer AC_2015_2371 registriert.Die Spender gaben ihre Zustimmung in der CODHECO-Nummer AC- 2008 - 562 Einverständniserklärung, damit die Proben für Forschungszwecke verwendet werden können. Studien am Menschen wurden gemäß der Erklärung von Helsinki durchgeführt.
1. Extraktion und Selektion von CD34+ Zellen (HP) aus LRF
-
Vorbereitung des Reagenzes (für eine LRF)
- Bereiten Sie 25 ml filtrierten Elutionspuffer vor: 21,25 ml phosphatgepufferte Kochsalzlösung (PBS), 2,5 ml Acid-Citrate-Dextrose (ACD) und 1,25 ml dekomplementiertes fetales Rinderserum (FBS). Auf 0,22 μm filtrieren und bei 37 °C stellen.
- 500 ml PBS mit 2 mM Ethylendiamintetraessigsäure (EDTA) zubereiten.
- 25 mL Dichtegradientenmedium (DGM) (1,077 g/ml) werden in zwei 50-ml-Röhrchen entsorgt.
-
LRF-Rückspülmodalitäten (Abbildung 1)
HINWEIS: Dieser Schritt erfordert eine sterile Rohrschweißmaschine, die eine sterile Verbindung von thermoplastischen Schläuchen ermöglicht.- Verbinden Sie zunächst die LRF mit einem leeren 600 ml Transferbeutel und die LRF mit einem Schlauchset (Abbildung 1A). Injizieren Sie unter der Biosicherheitswerkbank das Gesamtvolumen des gefilterten und vorbereiteten Elutionspuffers entsprechend der Anzahl der gehandhabten LRFs (x LLF x 25 ml) in den leeren Beutel. Dann wird mit einer 30 ml Spritze der gesamte Inhalt des Beutels vorsichtig durch die LRF abgesaugt, die Zellen rückspült und in ein neues 50-ml-Röhrchen übertragen (Abbildung 1B).
- Zur Sedimentation der roten Blutkörperchen verdünnen Sie die Zellsuspension um die Hälfte mit Dextran 2% und mischen Sie gut, um rote Blutkörperchen zu aggregieren. Warten Sie 30 minuten bei Raumtemperatur (RT).
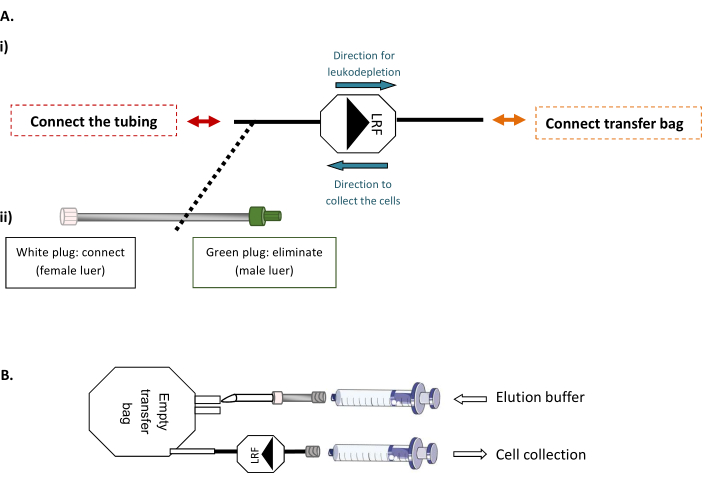
Abbildung 1: LRF-Rückspülmodalitäten. (A) Repräsentatives Schema von (i) der sterilen Verbindung des Transferbeutels mit der LRF und (ii) des Schlauchsatzes mit der LRF. (B) Repräsentatives Schema des Anschlusses der Spritzen zur Zellentnahme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
-
PBMC-Sammlung
- Nach der Sedimentation der roten Blutkörperchen wird der Überstand entfernt, in ein 50 ml großes Röhrchen übertragen und mit PBS-EDTA 2 mM gefüllt. Überlagern Sie den Überstand vorsichtig auf dem oben vorbereiteten DGM. Lassen Sie den Überstand sanft fließen, ohne die Oberflächenebene des Dichtegradienten zu durchbrechen. Zentrifuge bei 400 x g bei RT für 30 min im Bremsmodus.
- Sammeln Sie die PBMC-Schicht mit einer Einweg-Transferpipette. Übertragen Sie die Zellen aus jedem DGM-Röhrchen in ein neues steriles 50-ml-Röhrchen. Füllen Sie jedes Röhrchen mit PBS-EDTA 2 mM und waschen Sie es zweimal in 50 mL PBS-EDTA 2 mM bei 200 x g für 10 min bei RT im Bremsmodus.
- Pipettieren Sie das Zellpellet ab und bündeln Sie es mit 50 ml PBS-EDTA 2 mM.
HINWEIS: Es besteht die Möglichkeit, das Verfahren zu stoppen, indem die gesammelten Zellen während der Nacht bei 4 ° C unter Bewegung gehalten werden. Filtern Sie dann die Suspension mit einem 40 μm Zellsieb, um die gebildeten Aggregate zu entfernen.
-
CD34+ Zellenauswahl
- Bestimmen Sie die Zellzahl und die Zentrifuge bei 400 x g bei Raumtemperatur für 10 min mit eingeschalteter Pause.
- Aspirieren Sie den Überstand vollständig und resuspenieren Sie in dem entsprechenden Volumen von PBS-EDTA 2 mM, das vom Hersteller des CD34-Auswahlkits (300 μL PBS-EDTA für 108 Zellen) detailliert beschrieben wird. Fügen Sie das FcR-blockierende Reagenz und die CD34-Mikrokügelchen in der entsprechenden Konzentration (50 μL für 108 Zellen) hinzu.
- Nach 30 min bei 4 °C die Zellsuspension waschen und in dem entsprechenden Volumen pbS-EDTA 2 mM resuspendieren, das vom Hersteller des CD34-Auswahlkits (500 μL pro 108 Zellen) beschrieben wurde.
HINWEIS: Die Auswahl erfolgt bei der Sortierung von Spalten für den Durchgang von maximal 2 x 109 Zellen pro Spalte. - Führen Sie die Probe über die nasse Säule des Magneten. Zweimal mit 3 ml PBS-EDTA 2 mM waschen und die Zellen mit 5 ml PBS-EDTA 2 mM eluieren. Ein zweiter Durchlauf auf einer neuen Säule nach dem gleichen Verfahren ist notwendig, um die Reinheit der Probe zu verbessern.
HINWEIS: Eine erwartete Anzahl von 6,1 x 105 Zellen/LRF (Abbildung 2A). Für höhere LRF-Zahlen skalieren Sie Reagenzien und Methoden entsprechend.
-
Bewertung der CD34+ Zellreinheit
- Zu einem Aliquot von 100 μL Suspension, das nach der CD34+ -Selektion erhalten wurde, 2 μL des menschlichen CD34-PE-Antikörpers oder 2 μL IgG - PE (Kontrolle) gegeben. Gut mischen und 15 min bei 4 °C inkubieren.
- Waschen Sie die Zellen durch Zugabe von 2 ml PBS und zentrifugieren Sie bei 400 x g für 5 min. Überstand vollständig ansaugen und in 200 μL PBS resuspendieren.
- Analysieren Sie die Reinheit durch Durchflusszytometrie, wie in Abbildung 2A und in der Diskussiongezeigt.
HINWEIS: Eine Reinheit von CD34+ Zellen über 90% wird erwartet (Abbildung 2Bii). - Verwenden Sie die CD34+ Zellen direkt oder frieren Sie sie für die weitere Verwendung ein.
-
EINFRIEREN VON CD34+-Zellen
HINWEIS: Das Einfrieren von CD34+ Zellen erfolgt bei einer Dichte von 106 Zellen pro ml.- Bereiten Sie nach der CD34+-Zellzahlbestimmung die folgenden Kryokonservierungsmedien vor: (1) 60% Stemspan + 40% FBS, (2) 40% Stemspan + 40% FBS + 20% Dimethylsulfoxid (DMSO) und lassen Sie die Kühlung bei 4 °C zu.
- Die CD34+-Zellen bei 400 x g bei Raumtemperatur für 5 min zentrifugieren und das Pellet in kalter Lösung 1 resuspenieren und dann sofort zur kalten Lösung 2 (v/v) geben.
- Legen Sie die Kryotuben sofort für 24 h in einen -80 °C Gefrierschrank und geben Sie dann die Kryotuben in den Flüssigstickstofftank.
2. Kultur und Differenzierung von CD34+-Zellen zur Herstellung reifer Proplatlet-tragender Megakaryozyten
HINWEIS: Zellkulturprotokoll (Abbildung 3A), repräsentatives Schema des Zellkulturverfahrens werden in diesem Abschnitt beschrieben.
-
CD34+ Zellen beim Auftauen (falls erforderlich)
- Die Auftaulösung vorbereiten: 13 ml PBS-20% FBS und 15 min bei 37 °C stellen. Die Kryotuben schnell in ein 37 °C warmes Wasserbad geben, bis nur noch ein kleiner Eiskristall entsteht. Unter dem biologischen Kulturschrank den gesamten Inhalt pipettieren und langsam in 13 ml vorgewärmter Auftaulösung übertragen.
- Bestimmen Sie die Zellzahl und die Zelllebensfähigkeit.
-
Kulturprotokoll, Schritt 1: von Tag 0 bis Tag 7
HINWEIS: Normalerweise werden Kulturen in 24-Well-Platten mit 1 ml Medium pro Vertiefung bei einer Dichte von 40.000 lebensfähigen Zellen / ml hergestellt, was 20.000 lebensfähigen Zellen / cm2entspricht. Es ist wichtig, diese Dichte zu respektieren, wenn eine Skalierung geplant ist.- Vorbereitung des Wachstumsmediums : In serumfreien hämatopoetischen Zellexpansionsmedien (zuvor auf 37 °C erhitzt) Penicillin-Streptomycin-Glutamin (PSG) 1x, humanes Low-Density-Lipoprotein (hLDL) bei 20 μg/ml, Zytokincocktail aus Megakaryozytenexpansion 1x und Stemregenin 1 (SR1) bei 1 μM hinzufügen.
- Cell Seeding : Zentrifugieren Sie die aufgetauten CD34+ Zellen bei 400 x g bei Raumtemperatur für 5 min. Entfernen Sie den Überstand gründlich und resuspenieren Sie das Zellpellet in 1 ml Kulturmedien und führen Sie eine Zellnummerierung und Lebensfähigkeit durch, um das geeignete Volumen für die Aussaat der Zellen zu bestimmen.
- Zentrifugieren Sie die Zellen 400 x g bei Raumtemperatur für 5 min und resuspenieren Sie das Pellet im entsprechenden Volumen des warmen Wachstumsmediums. Inkubieren Sie die Zellen bei 37 °C mit 5% CO2 für 7 Tage.
-
Kulturprotokoll, Schritt 2: von Tag 7 bis Tag 13 (Abbildung 3B, repräsentative Bilder an Tag 13)
HINWEIS: Normalerweise werden Kulturen in 24-Well-Platten mit 1 ml Medium pro Vertiefung bei einer Dichte von 50.000 lebensfähigen Zellen / ml hergestellt, was 25.000 lebensfähigen Zellen / cm² entspricht. Es ist wichtig, diese Dichte zu respektieren, wenn eine Skalierung geplant ist.- Vorbereitung des Reifemediums: In serumfreien hämatopoetischen Zellexpansionsmedien (zuvor auf 37 °C erhitzt) PSG 1x, hLDL bei 20 μg/ml, TPO bei 50 ng/ml und SR1 bei 1 μM hinzufügen.
- Untersuchen Sie die Zellen unter dem Mikroskop. Am Tag 7 zeigen die Zellen ein rundes und homogenes Aussehen, indem sie die Vertiefungen oder die Kolben füllen, ohne zu konfluent zu sein.
- Unter einer Biosicherheitswerkbank die Zellen vorsichtig in ein 15-ml-Röhrchen übertragen. Brunnen mit PBS waschen. Bestimmen Sie dann die Anzahl der Zellen und ihre Lebensfähigkeit, um das geeignete Volumen für die Aussaat der Zellen zu berechnen.
- Zentrifugieren Sie die Zellen bei 400 x g bei Raumtemperatur für 5 min. Entfernen Sie den Überstand und resuspendieren Sie die Zellen in dem entsprechenden Volumen warmer Medien, das im vorherigen Schritt berechnet wurde. Inkubieren Sie die Zellen bei 37 °C, 5%CO2 für 6 Tage.
-
Freisetzung von kultivierten Thrombozyten an Tag 13
- Der Kultur werden 0,5 μM ProstaglandinI2 (g.g.A.) und 0,02 U/ml Apyrase zugegeben und fünfmal mit einer 1 mL Pipette nacheinander pipettiert.
HINWEIS: Blutplättchen werden nun in das Medium freigesetzt.
- Der Kultur werden 0,5 μM ProstaglandinI2 (g.g.A.) und 0,02 U/ml Apyrase zugegeben und fünfmal mit einer 1 mL Pipette nacheinander pipettiert.
3. Durchflusszytometrie-Analyse (MK-Phänotypisierung und kultivierte Thrombozytenzahl)
HINWEIS: Dieses Protokoll kann auf die Phänotypisierung der Zellen an den ausgewählten Kulturtagen angewendet werden. Es erlaubt auch die Bestimmung der Anzahl der kultivierten Thrombozytenfreisetzung (Abbildung 4A, B).
-
Vorbereitung auf die MK-Analyse
- Beschriften Sie vier Sätze von Mikrozentrifugenröhrchen wie folgt: Unmarkierte Zellen als Kontrolle, Zellen + 5 μL CD41 - Alexa Fluor 488, Zellen + 5 μL CD34 - PECy7, Zellen + 5 μL CD41 - Alexa Fluor 488 + 5 μL CD34 - PECy7. Verwenden Sie ein Minimum von 1,105 Zellen pro Röhrchen, überschreiten Sie nicht 1,106 Zellen pro Röhrchen. Zu 100 μL Zellsuspension pro Zytometrieröhrchen und den verschiedenen Antikörpern hinzufügen. Im Dunkeln 30 min bei 4 °C inkubieren.
- Dann 2 ml PBS-EDTA 2 mM pro Röhrchen zugeben und bei 400 x g für 5 min bei Raumtemperatur zentrifugieren. Während der Zentrifugation eine Lösung von PBS-EDTA 2 mM + 7-Aminoactinomycin-D (7AAD) (1/100) herstellen, 300 μL Lösung pro Röhrchen zulassen.
- Entfernen Sie den Überstand und nehmen Sie das Pellet in 300 μL PBS-EDTA 2 mM mit 7AAD auf. Führen Sie die Proben innerhalb von 30 Minuten durch das Durchflusszytometer.
HINWEIS: Die Analysestrategie für die Durchflusszytometrie ist in Abbildung 3C und in der Diskussion dargestellt.
-
Röhrchenpräparation für die kultivierte Thrombozytenanalyse
- Beschriften Sie vier Sätze von Mikrozentrifugenröhrchen wie folgt: Unmarkierte Zellen als Kontrolle, Zellen + 5 μL CD41 - Alexa Fluor 488, Zellen + 20 μL CD42a - PE, Zellen + 5 μL CD41 - Alexa Fluor 488 + 20 μL CD42a - PE. Nach fünf aufeinanderfolgenden Pipettieren in der Kulturbohrung werden 300 μL der Suspension zur Zytometrie mit einer kalibrierten Anzahl von Fluoreszenzperlen in das Röhrchen transferiert.
- Fügen Sie Antikörper hinzu und inkubieren Sie im Dunkeln bei RT für 30 min.
- Führen Sie die Proben innerhalb von 30 minuten durch das Durchflusszytometer und stellen Sie die Erfassung für den Durchgang von 5.000 Kügelchen ein.
HINWEIS: Die Analysestrategie für die Durchflusszytometrie ist in Abbildung 4B und in der Diskussion dargestellt.
Ergebnisse
Extraktion und Selektion von CD34+ Zellen aus LRFs
Hier beschreibt die methode, abgeleitet von Peytour et al.9, die Extraktion und Selektion von CD34+ Zellen aus verworfenen LRFs, die in Blutbanken nach Leukozytenentfernung verfügbar sind. Nach dem Rückspülverfahren werden in der Regel 1,03 x 109 ± 2,45 x10 8 Zellen/LRF (Mittelwert±SEM; n = 155) mit einer Lebensfähigkeit von 94,88 ± 0,10% gewonnen (Abbildung 2A i). Nach der CD34-positiven Selektion erhält man durchschnittlich 615,54 x 103 ± 12,28 Zellen/LRF (n = 155) (Abbildung 2A ii). Wenn die Anzahl der Zellen weniger als 300.000 beträgt, muss der Schluss gezogen werden, dass das Verfahren nicht korrekt durchgeführt wurde und gestoppt werden muss. Um den Erfolg der CD34-Selektion zu bewerten, wird die Reinheit der CD34+-Zellen mittels Durchflusszytometrie beurteilt (Abbildung 2B). Routinemäßig wird eine Reinheit über 90% (91,88 ± 0,79%) erwartet (Abbildung 2B). Eine Reinheit unter 75% könnte bedeuten, dass es ein Problem bei der Durchführung des Protokolls und insbesondere bei der Elution der Säulen gegeben hat. Unterhalb einer Reinheit von 75% werden die Zellen nicht für Kulturexperimente konserviert.
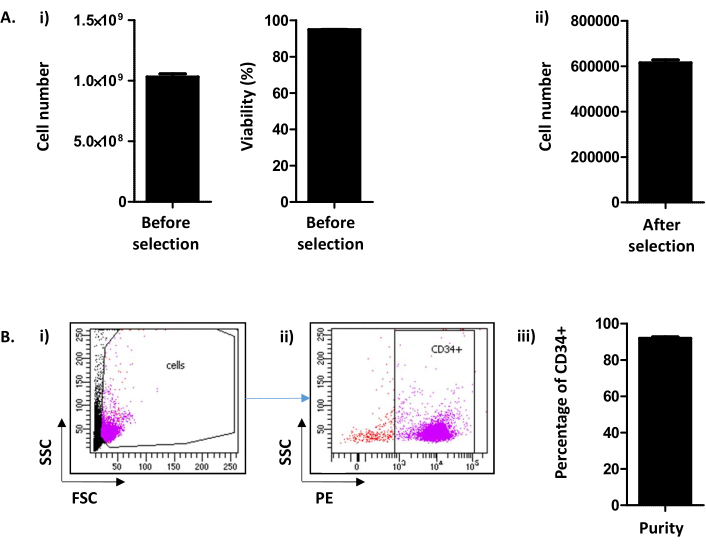
Abbildung 2: CD34+-Zellzahl-/LRF- und CD34-Reinheitsanalyse. (A) (i) Es wird eine Analyse der Anzahl der Zellen und ihrer Lebensfähigkeit, die nach dem Verfahren erhalten wurde, einschließlich PBMC-Sammlung und CD34-Selektion, durchgeführt ((1.03.109 ± 2.45.108 Zellen/LRF (Mittlere ± REM; n=155) mit einer Lebensfähigkeit von 94,88 ± 0,10% (n = 155)). (ii) Eine Analyse mittels Zellzähler wird auch nach CD34-Selektion durchgeführt (615,54 x 103 ± 12,28 Zellen/LRF (n = 155)). (B) Cd34 Reinheit wird durch Durchflusszytometrie analysiert. (i) Die Zellen wurden mit einem CD34-PE-Antikörper gefärbt und anhand ihrer FSC/SSC-Parameter identifiziert. (ii) Auf der Grundlage des Streusignals und der CD34-Expressionsanalyse wird die Reinheit bestimmt. Ein Pre-Gate der CD34-Positivität wurde basierend auf der Negativkontrolle für den CD34-Marker verwendet. (iii) Wie auf dem Balkendiagramm zu sehen ist, wird eine Reinheit der CD34+-Zellen über 90% (91,88 ± 0,79% (n = 17)) erwartet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Differenzierung und Reifung von MK-haltigen Proplaten
Das beschriebene Zellkulturverfahren gliedert sich in zwei Schritte. Die erste, von Tag (D) 0 bis D7, widmet sich der HP-Proliferation und dem Engagement in den megakaryozytären Signalweg als Reaktion auf eine Kombination von Zytokinen und der Zugabe einer chemischen Verbindung SR1. Die zweite, von D7 bis D13, konzentriert sich auf die MK-Reifung und Proplatleterweiterung nach der Hinzufügung von TPO und SR1 (Abbildung 3A). Als Qualitätskontrolle der Kultur werden die Zellzählung, die Bestimmung der Zelllebensfähigkeit und die Phänotypisierung der Zellen an D7 und D10 durchgeführt. Diese Stufen wurden gewählt, weil sie für das HP Engagement, D7 bzw. MK Reifung, D10, entscheidend sind (personenbezogene Daten). Bei D7 und 10 beträgt die Proliferation routinemäßig x4,16 ± 0,25 (n = 34) bzw. x2,30 ± 0,16 (n = 5) mit einer Zelllebensfähigkeit zwischen 86,38 ± 0,73% (n = 34); und 84,80 ± 2,67% (n = 5) (Abbildung 3B). In Bezug auf die Zellphänotypisierung, wie in Abbildung 3C, bei D0 gezeigt, sind mehr als 90% der Zellen positiv auf CD34. Dann werden CD34 + -Zellen der megakaryozytären Linie verschrieben, wie die Erscheinung von CD41, einem spezifischen und frühen Marker von MKP, bezeugt. Tatsächlich sind bei D7 50,20 ± 2,90% der Zellen sowohl für CD34 als auch für CD41 positiv (Abbildung 3Bii). Dann verbessert MK ihre Reifung. Bei D10 ist eine Mehrheit der MK reif, wobei weniger als 15,60 ± 4,70% der Zellen negativ für CD41 sind, 47,90 ± 8,90% für CD34+CD41+ und 36,40 ± 12,40% für CD34-CD41+ (Abbildung 3Biii).
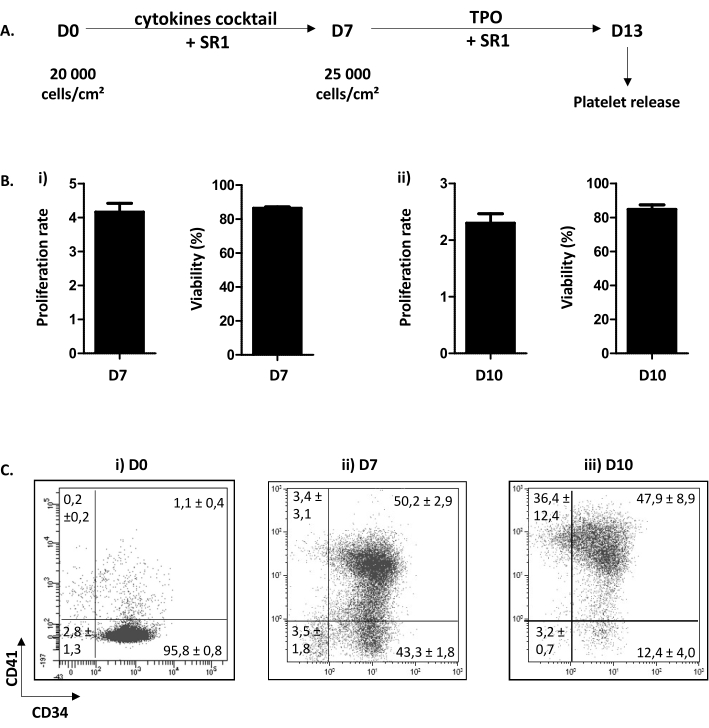
Abbildung 3: Differenzierung und Reifung von MK-haltigen Proplaten. (A) Repräsentatives Schema des Zellkulturverfahrens. Es wird eine zweistufige Methode verwendet: ein Proliferationsschritt von D0 bis D7 (SR1 und Cocktail von Zytokinen) und ein Reifungsschritt von D7 bis D13 (SR1 und TPO). Bei D13 können kultivierte Blutplättchen nach fünf aufeinanderfolgenden Pipettieren freigesetzt werden. (B) (i) Proliferationsrate bei D7 (x4,16 ± 0,25 (n = 34)) und Zelllebensfähigkeit (86,38 ± 0,73% (n = 34)). (ii) Proliferationsrate bei D10 (x2,30 ± 0,16 (n = 5)) und Zelllebensfähigkeit (84,80 ± 2,67% (n = 5)). (C) Durchflusszytometrische Analyse Stategy der phänotypischen Evolution von MK in Kultur. Bei D0 sind 95,80 ± 0,80% der Zellen CD34-positiv (n = 3). Bei D7 sind 50,20 ± 2,90% der Zellen positiv auf CD34 und CD41. Bei D10 sind weniger als 15,60 ± 4,70% der Zellen negativ auf CD41. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Freisetzung kultivierter Blutplättchen, Tag 13
Die Untersuchung der Vertiefungen bei D13 zeigt runde MK und proplatlethaltige MK (Abbildung 4A). Durchschnittlich 35% der kultivierten MK verlängern Proplatele12. Bemerkenswert ist, dass D13 den optimalen Tag für die Proplatletverlängerung und die Thrombozytenfreisetzung darstellt. Wenn das erforderliche MK-Niveau, das Proplatele emittieren kann, nicht erreicht wird, muss während des Kulturprozesses etwas schief gelaufen sein und die Ergebnisse sollten nicht berücksichtigt werden.
Obwohl die genauen Mechanismen, die die Thrombozytenfreisetzung von reifem MK fördern, noch wenig verstanden sind, ist bekannt, dass hämodynamische Kräfte unverzichtbar sind. Um diese Kräfte in vitronachzuahmen, wird die Suspension, die proplatlethaltiges MK enthält, abgesaugt und fünfmal mit einem P1000-Kegel abgestoßen und anschließend mittels Durchflusszytometrie analysiert. Zu diesem Zweck werden Röhrchen verwendet, die eine kalibrierte Anzahl von Fluoreszenzperlen enthalten. Zuerst werden perlen, die in der Röhre vorhanden sind, auf dem CD41-Alexa-fluor 488/PErcP-Cy5-Fenster eingeschlossen(Abbildung 4Bi, in rot). Dann werden kultivierte Thrombozyten in einem Pre-Gate (plättchenartige Elemente) visualisiert, bestimmt auf den Parametern Vorwärtsstreuung (FSC) und Seitenstreuung (SSC) von nativen Thrombozyten (Abbildung 4Bii). Die Anzahl der Blutplättchen wird dann anhand ihrer CD41/CD42a-Positivität bestimmt (Abbildung 4Biii). Die Zellzählung wird in diesem Protokoll bei 5.000 Kügelchen gestoppt, aber je nach Empfehlung des Lieferanten kann eine andere feste Anzahl verwendet werden. Aus den erfassten Daten geht hervor, dass die Anzahl der gezählten Blutplättchen pro 5.000 Perlen routinemäßig bei durchschnittlich 24,01 ± 92 (n = 15) liegt (Abbildung 4C). Wenn man das volumenerfasst, das vom Durchflusszytometer auf 5.000 Kügelchen (für jedes Zytometer zu berechnen) und das Gesamtvolumen der Kultur aspiriert, ist es möglich, eine Annäherung an die Gesamtzahl der freigesetzten kultivierten Blutplättchen zu erhalten.
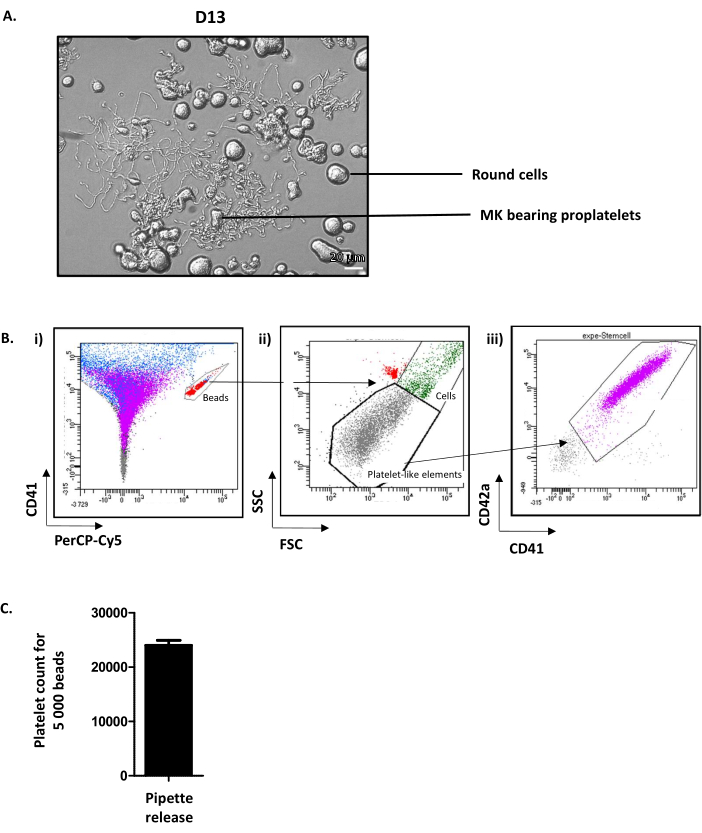
Abbildung 4: Freisetzung kultivierter Blutplättchen am Tag 13. (A) Repräsentative Lichtmikroskopieaufnahme von MK emittierenden Proplaten an D13. (B) Strategie zur Quantifizierung der Freisetzung von kultivierten Thrombozyten. (i) Perlen befinden sich im CD41-Alexa-fluor 488/PErcP-Cy5 Fenster (in rot). (ii) Plättchenartige Elemente werden in einem Gate visualisiert, das auf den FSC/SSC-Parametern nativer Plättchen (graue Punkte) bestimmt wird. (iii) Kultivierte Blutplättchen werden anhand ihrer CD41/CD42-Positivität (violett) bestimmt. (C) Die Anzahl der gezählten Blutplättchen pro 5.000 Perlen kann erhalten werden, routinemäßig ein Durchschnitt von 24.011 ± 919 (n = 15). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Das Vorgehen auf einen Blick
Um die Methode besser zusammenzufassen und jeden Schritt besser zu verstehen, ist in Abbildung 5ein Poster dargestellt, das das Protokoll Schritt für Schritt zusammenfasst. Dieses Übersichtsblatt kann im Kulturraum angezeigt werden und als Memo dienen. Bemerkenswert ist, dass der Erfolg der Experimente nur mit den in der bereitgestellten Tabelle angegebenen Produktreferenzen garantiert werden kann.

Abbildung 5: Isolierung von CD34+. Poster, das das Protokoll Schritt für Schritt zusammenfasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt ein Verfahren zur Herstellung von MK, das in der Lage ist, Proplatelets aus blutabgeleitetem HP zu emittieren und Blutplättchen aus dem Kulturmedium freizusetzen. HP werden aus LRF gewonnen, einem Nebenprodukt der Blutbanken, das verwendet wird, um kontaminierende Leukozyten aus zellulären Blutprodukten zu entfernen und Nebenwirkungen zu vermeiden. Obwohl diese Methode relativ einfach ist, verdienen einige Punkte besondere Aufmerksamkeit.
Die Abscheidung der Zellsuspension auf dem Dichtegradientenmedium (Schritt 1.3.1) ist schonend durchzuführen, um eine Vermischung (Rotgehalt) zu vermeiden. Wenn dieser Schritt nicht sorgfältig ausgeführt wird, sollte das Protokoll an dieser Stelle gestoppt werden. Ebenso muss sich die Bremse auch in Schritt 1.3.1 im Aus-Zustand befinden, um eine Vermischung der Fraktionen zu vermeiden. Ist dies nicht der Fall, muss die HP-Auswahl angehalten werden. Wie im Protokoll, Abschnitt 1.4 angegeben, kann der Vorgang nach der PBMC-Sammlung unterbrochen werden. In diesem Fall können Zellen über Nacht bei 4 °C unter Bewegung gehalten werden. Verwenden Sie dann ein 40-μm-Zellsieb, um die gebildeten Aggregate zu entfernen, was sich auf die nachfolgende CD34-Auswahl auswirken kann. Bemerkenswert ist, dass die Unterbrechung des Verfahrens die Ausbeute und Reinheit von CD34+ -Zellen nicht beeinträchtigt. Am Ende der CD34-Selektion muss die Reinheit größer als 75% sein, um die Zellen zu säen, da in einer früheren Studie die Differenzierung und Reifung von MK unterhalb dieser Reinheit schlecht waren12 (Abbildung 2).
Besonderes Augenmerk muss auf das Auftauen der CD34+ -Zellen gelegt werden, das schnell durchgeführt werden muss, um die Lebensfähigkeit der Zellen nicht zu beeinträchtigen. Darüber hinaus müssen Waschschritte sorgfältig durchgeführt werden, um keine Spuren von Serum zu hinterlassen. Die Zellaussaatdichte muss respektiert werden, da sie rigoros für ein optimales CD34-Engagement für den MKP-Signalweg und die MK-Reifung ausgewählt wurde (Abbildung 3A).
Ein Zellphänotypisierungsprotokoll wird vorgeschlagen, um die Differenzierung und Reifung von MK zu verfolgen. Dieses Protokoll ist relativ einfach, aber es ist wichtig, dass alle Kontrollröhrchen, sowohl unmarkierte als auch einzelne Markierungsröhrchen, für jeden Tag der Analyse zur Verfügung stehen, um zuverlässige Einstellungen auf dem Zytometer zu gewährleisten. Um sicherzustellen, dass die Kultur reibungslos verläuft, ist es wichtig, Informationen über die Proliferation entlang des Verfahrens zu sammeln. Bei D7 liegt die durchschnittliche Proliferation zwischen 2 und 4 mal13. Diese Proliferation variiert wenig zwischen den Experimenten, da jede LRF Zellen von 8 Spendern umfasst. Um die Variationen weiter zu glätten, ist es möglich, parallel erhaltene Zellen von 4 bis 8 LRFs zu kombinieren.
Es ist möglich, die Morphologie der Zellen durch Lichtmikroskopie zu betrachten, aber die Zellen sollten nicht jeden Tag beobachtet werden, da sie empfindlich auf Temperaturschwankungen reagieren. Wenn Sie die Zellen aus dem Inkubator entfernen, stellen Sie sicher, dass Sie langsame Bewegungen ausführen, um das Brechen der Proplatelets zu vermeiden.
Für die Thrombozytenfreisetzung ist ein fünffaches aufeinanderfolgendes Pipettieren erforderlich. Weniger zu tun, gewährleistet keine optimale Thrombozytenfreisetzung und mehr zu tun ist schädlich für ihre Funktionalität12. Der wichtigste Aspekt in diesem Schritt ist die Verwendung präziser und regelmäßiger Bewegungen, um einen regelmäßigen Fluss zu erzeugen, der für die Thrombozytenfreisetzung14,15,16erforderlich ist. Die Methode der fünf aufeinanderfolgenden Pipettieren ist daher einfach und leicht durchzuführen mit zufriedenstellenden Leistungsergebnissen, die auf den in der Literatur beschriebenen Ausbeuten basieren. Die Anzahl der freigesetzten Blutplättchen kann wie in Abschnitt 3.3 erwähnt unter Verwendung der in Abbildung 4Bdargestellten Strategie der Durchflusszytometrieanalyse bestimmt werden. Die Qualität der freigesetzten Blutplättchen wurde in Do Sacramento et al. in Bezug auf Ultrastruktur (Morphologie, Größe, Granulatgehalt) und Funktion (Hämostase) gut dokumentiert, was zeigt, dass diese kultivierten Blutplättchen den einheimischen sehr ähnlich sind13.
Das hier beschriebene Protokoll eignet sich besonders für kleinvolumige Kulturen, ist aber nicht für großräumige Kulturen anwendbar. Es ist daher eine optimale Methode zur Untersuchung der Thrombozytenbiogenese, um die molekularen und zellulären Mechanismen, die die Thrombozytenproduktion steuern, besser zu verstehen, indem beispielsweise kleine Moleküle, Agonisten oder Antagonisten hinzugefügt werden. Darüber hinaus und um die Mechanismen weiter zu erforschen, die das MK-Engagement, die MK-Reifung und die Thrombozytenproduktion regulieren, ist es jetzt möglich, das CD34+ HP mit einer CRISPR-Cas9-Genom-Editing-Methode genetisch zu manipulieren.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit wurde von ANR (Agence National de la Recherche) Grant ANR- 17-CE14-0001-1 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 7-AAD | Biolegend | 558819 | |
| ACD | EFS-Alsace | NA | |
| Anti-CD34-PE | Miltenyi biotec | 130-081-002 | |
| Anti-CD34-PECy7 | eBioscience | 25-0349-42 | |
| Anti-CD41-Alexa Fluor 488 | Biolegend | 303724 | |
| Anti-CD42a-PE | BD Bioscience | 559919 | |
| Apyrase | EFS-Alsace | NA | |
| BD Trucount Tubes | BD Bioscience | 340334 | |
| CD34 MicroBead Kit UltraPure, human | Miltenyi biotec | 130-100-453 | |
| Centrifuge | Heraeus | Megafuge 1.OR | Or equivalent material |
| Compteur ADAM | DiagitalBio | NA | Or equivalent material |
| Cryotubes | Dutscher | 55002 | Or equivalent material |
| Dextran from leuconostoc spp | Sigma | 31392-50g | Or equivalent material |
| DMSO Hybri-max | Sigma | D2650 | |
| EDTA 0.5 M | Gibco | 15575-039 | |
| Eppendorf 1,5 mL | Dutscher | 616201 | Or equivalent material |
| Filtration unit Steriflip PVDF | Merck Millipore Ltd | SE1M179M6 | |
| Flow Cytometer | BD Bioscience | Fortessa | |
| Human LDL | Stemcell technologies | #02698 | |
| ILOMEDINE 0,1 mg/1 mL | Bayer | MA038EX | |
| Inserts | Fenwal | R4R1401 | Or equivalent material |
| Laminar flow hood | Holten | NA | Archived product |
| LS Columms | Miltenyi Biotec | 130-042-401 | |
| Lymphoprep | Stemcell | 7861 | |
| Pen Strep Glutamine (100x) | Gibco | 10378-016 | |
| PBS (-) | Life Technologies | 14190-169 | Or equivalent material |
| PGi2 | Sigma | P6188 | |
| Poches de transferts 600ml | Macopharma | VSE4001XA | |
| Pre-Separation Filters (30µm) | Miltenyi Biotec | 130-041-407 | |
| StemRegenin 1 (SR1) | Stemcell technologies | #72344 | |
| StemSpan Expansion Supplement (100x) | Stemcell technologies | #02696 | |
| StemSpan-SFEM | Stemcell technologies | #09650 | |
| Stericup Durapore 0,22µm PVDF | Merck Millipore Ltd | SCGVU05RE | |
| SVF Hyclone | Thermos scientific | SH3007103 | |
| Syringues 30 mL | Terumo | SS*30ESE1 | Or equivalent material |
| Syringe filters Millex 0,22µM PVDF | Merck Millipore Ltd | SLGV033RB | |
| TPO | Stemcell technologies | #02822 | |
| Tubes 50 mL | Sarstedt | 62.548.004 PP | Or equivalent material |
| Tubes 15 mL | Sarstedt | 62.554.001 PP | Or equivalent material |
| Tubulures | B Braun | 4055137 | Or equivalent material |
Referenzen
- Deutsch, V. R., Tomer, A. Megakaryocyte development and platelet production. British Journal of Haematology. 134 (5), 453-466 (2006).
- Lefrancais, E., et al. The lung is a site of platelet biogenesis and a reservoir for haematopoietic progenitors. Nature. 544 (7648), 105-109 (2017).
- de Sauvage, F. J., et al. Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature. 369 (6481), 533-538 (1994).
- Almomani, M. H., Mangla, A. StatPearls. , (2020).
- Strassel, C., Hechler, B., Bull, A., Gachet, C., Lanza, F. Studies of mice lacking the GPIb-V-IX complex question the role of this receptor in atherosclerosis. Journal of Thrombosis and Haemostasis. 7 (11), 1935-1938 (2009).
- Delalat, B., et al. Isolation and ex vivo expansion of human umbilical cord blood-derived CD34+ stem cells and their cotransplantation with or without mesenchymal stem cells. Hematology. 14 (3), 125-132 (2009).
- Yin, T., Li, L. The stem cell niches in bone. The Journal of Clinical Investigation. 116 (5), 1195-1201 (2006).
- Salunkhe, V., Papadopoulos, P., Gutiérrez, L. Culture of megakaryocytes from human peripheral blood mononuclear cells. Bio-protocol. 5 (21), 1639(2015).
- Peytour, Y., Villacreces, A., Chevaleyre, J., Ivanovic, Z., Praloran, V. Discarded leukoreduction filters: a new source of stem cells for research, cell engineering and therapy. Stem Cell Research. 11 (2), 736-742 (2013).
- Lapostolle, V., et al. Repopulating hematopoietic stem cells from steady-state blood before and after ex vivo culture are enriched in the CD34(+)CD133(+)CXCR4(low) fraction. Haematologica. 103 (10), 1604-1615 (2018).
- Ivanovic, Z., et al. Whole-blood leuko-depletion filters as a source of CD 34+ progenitors potentially usable in cell therapy. Transfusion. 46 (1), 118-125 (2006).
- Strassel, C., et al. Aryl hydrocarbon receptor-dependent enrichment of a megakaryocytic precursor with a high potential to produce proplatelets. Blood. 127 (18), 2231-2240 (2016).
- Do Sacramento, V., et al. Functional properties of human platelets derived in vitro from CD34(+) cells. Scientific Reports. 10 (1), 914(2020).
- Blin, A., et al. Microfluidic model of the platelet-generating organ: beyond bone marrow biomimetics. Scientific Reports. 6, 21700(2016).
- Ito, Y., et al. Turbulence activates platelet biogenesis to enable clinical scale ex vivo production. Cell. 174 (3), 636-648 (2018).
- Pallotta, I., Lovett, M., Kaplan, D. L., Balduini, A. Three-dimensional system for the in vitro study of megakaryocytes and functional platelet production using silk-based vascular tubes. Tissue Engineering. Part C, Methods. 17 (12), 1223-1232 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten