Method Article
İnsan Pluripotent Kök Hücrelerinden Böbrek Organoidleri Üretmek için Basitleştirilmiş Bir Yöntem
Bu Makalede
Özet
Burada, insan pluripotent kök hücrelerinden (hPSC'ler) böbrek organoidleri üretmek için bir protokol tarif ediyoruz. Bu protokol iki hafta içinde böbrek organoidleri üretir. Elde edilen böbrek organoidleri, paralel ilaç testi yaklaşımları için büyük ölçekli iplikçi şişelerinde veya çok kuyulu manyetik karıştırma plakalarında kültürlenebilir.
Özet
hPSC'lerden üretilen böbrek organoidleri, sınırsız bir böbrek dokusu kaynağı sağlamıştır. İnsan böbrek organoidleri, böbrek hastalığı ve hasarını incelemek, hücre bazlı tedaviler geliştirmek ve yeni terapötikleri test etmek için paha biçilmez bir araçtır. Bu tür uygulamalar için, çok sayıda üniform organoid ve yüksek oranda tekrarlanabilir tahlillere ihtiyaç vardır. Organoidlerin genel sağlığını iyileştirmek için daha önce yayınlanmış böbrek organoid protokolümüzün üzerine inşa ettik. Bu basit, sağlam 3D protokolü, 3 gün boyunca lipitler, insülin-transferrin-selenyum-etanolamin takviyesi ve GSK3 inhibitörü (CHIR99021) ile polivinil alkol içeren minimum bileşen ortamında üniform embriyoid cisimlerin oluşumunu ve ardından nakavt serum replasmanı (KOSR) içeren ortamda kültürü içerir. Ek olarak, ajitasyon tahlilleri, embriyoid cisimlerin kümelenmesinde azalmaya ve organoidler arasındaki değişkenliği azaltmak için önemli olan düzgün bir boyutun korunmasına izin verir. Genel olarak, protokol büyük miktarlarda böbrek organoidi üretmek için hızlı, verimli ve uygun maliyetli bir yöntem sağlar.
Giriş
Son yıllarda, insan pluripotent kök hücrelerini böbrek organoidlerine ayırmak için bir dizi protokol geliştirilmiştir 1,2,3,4,5. Böbrek organoidleri, yeni rejeneratif tıp yaklaşımlarına yönelik araştırmalara yardımcı olmak, böbrekle ilgili hastalıkları modellemek, toksisite çalışmaları yapmak ve terapötik ilaç geliştirmek için önemli bir araç sağlamıştır. Geniş uygulanabilirliklerine rağmen, böbrek organoidlerinin olgunlaşma eksikliği, in vitro sınırlı uzun süreli kültür kapasitesi ve insan böbreğinde bulunan çeşitli hücre tiplerinin azlığı gibi sınırlamaları vardır 6,7,8. Son çalışmalar, organoid olgunlaşma seviyesini iyileştirmeye, kültür sürelerini uzatmaya ve mevcut protokollerideğiştirerek böbrek hücresi popülasyonlarının karmaşıklığını genişletmeye odaklanmıştır 9,10,11,12. Yerleşik protokolümüzün 5,13'ünün bu mevcut yinelemesinde, protokolün ilk aşamasındaki ortam bileşenlerini, insülin-transferrin-selenyum-etanolamin (ITSE), lipitler, polivinil alkol (E5-ILP) ve CHIR99021 ile desteklenmiş serumsuz bir baz ortama değiştirdik (Şekil 1). Bu değişiklikler, önceki orta bileşimimiz 5,13'ten daha az bileşene sahip ve ek büyüme faktörleri olmadan, tam olarak tanımlanmış, serum içermeyen, düşük proteinli bir ortam sağlar. Sonuç olarak, ilk aşama ortamının hazırlanması daha önce yayınlanmış sürümümüze göre daha az emek yoğundur ve partiden partiye değişkenliğiazaltabilir 5. Önceki çalışmalar, serumsuz kültür14,15'te hem insülin hem de transferrinin önemli olduğunu göstermiştir, ancak yüksek insülin seviyeleri mezoderm farklılaşmasına inhibide olabilir16. Orijinal protokolde belirtildiği gibi düşük insülin seviyelerini koruduk ve tahlilin ikinci aşamasında KOSR seviyelerini (insülin içeren) daha da azalttık. Böbrek organoid oluşumu için diğer protokollere uygun olarak, daha düşük KOSR seviyeleri, böbrek dokusunun çoğalması ve farklılaşması arasındaki dengeyi korumak için faydalıdır17. Ek olarak, Aşama II ortam13'ümüzdeki glikoz konsantrasyonunu düşürdük.
Yöntemimiz, orijinal yayın 5,13'te açıklandığı gibi, başlangıçtaki ~% 60 birleşik hPSC 100 mm kültür plakasından ~ 1.000 organoid veren böbrek organoidlerinin süspansiyon testi için bir kurulum tanımlamaktadır. Bu protokol, organoid sayılarını daha da artırmak için birden fazla 100 mm veya 150 mm plaka ile başlayarak kolayca ölçeklendirilebilir.
Protokol
hPSC'leri kullanan tüm deneyler kurumsal yönergelere uygun olarak gerçekleştirildi ve uygun kişisel koruyucu ekipmana sahip bir Sınıf II biyogüvenlik başlığında gerçekleştirildi. Tüm reaktifler, aksi belirtilmedikçe hücre kültürü sınıfındadır. Tüm kültürler 37 °C, %5 CO2 hava atmosferinde inkübe edilir. Tahlilin tüm aşamalarında, embriyoid cisimler veya böbrek organoidleri toplanabilir ve analiz için sabitlenebilir veya hazırlanabilir. Bu verileri oluşturmak için kullanılan hPSC hatları tamamen karakterize edilmiş ve yayınlanmıştır18.
1. Kültür plakalarının hazırlanması
NOT: hPSC'lerin bölünmesinden yaklaşık 1 saat önce, 2 x 100 mm doku kültürü plakalarını kök hücre nitelikli bazal membran matris ekstresi (BME) ile kaplayın. Plakalar önceden kaplanabilir, bir parafin filmle kapatılabilir ve üreticilerin talimatlarına göre 4 ° C'de saklanabilir.
- 2 x 100 mm doku kültürü ile muamele edilmiş plakalar (böbrek organoid testi için 1, hücre hattını korumak için 1) ve Sınıf II biyogüvenlik başlığında 15 mL konik tüp hazırlayın.
- Aliquot 8 mL soğuk, serumsuz Dulbecco'nun Modifiye Kartal Ortamı (DMEM) 15 mL konik tüpe ve ~ 4 mL 100 mm plakaların her birine, her plakanın tabanını orta ile örtmeye yetecek kadar.
- Dondurucudan 100 μL BME aliquot alın (-20 ° C). 2 mL'lik bir serolojik pipet kullanarak, 15 mL'lik konik tüpten ~1 mL soğuk DMEM alın. BME aliquot'u soğuk DMEM ile hafifçe yukarı ve aşağı pipetleyerek, kabarcık yapmaktan kaçınarak yavaşça çözün.
NOT: BME aliquot'un oda sıcaklığında oturmasına izin vermeyin. Hemen kullanın. - Çözülmüş DMEM/BME'yi kalan DMEM ile birlikte 15 mL konik tüpe geri aktarın. 10 mL'lik serolojik pipetle, BME'yi eşit şekilde dağıtmak için seyreltilmiş BME'yi en az 8 kez yukarı ve aşağı pipetleyerek, kabarcıklar yapmaktan kaçınarak nazikçe karıştırın.
- Seyreltilmiş BME'nin 4 mL'sini DMEM ile her plakaya aktarın ve BME'nin eşit olarak dağıtılması için plakayı yavaşça döndürün. Kaplanmış plakayı oda sıcaklığında 1 saat veya 37 °C'de 30 dakika boyunca inkübe edin.
NOT: 100 mm plaka başına 50 μL BME kullanın. Diğer hPSC kültür ortamlarının ve hücre hatlarının kullanımı farklı konsantrasyonlarda BME gerektirebilir.
2. Pasaj hPSC'leri
NOT: Rutin hPSC kültürü için, %70-80 oranında geçiş hücresi çizgileri.
- Kültür ortamını geçilecek hPSC plakasından aspire edin. hPSC plakasına ~ 8 mL Dulbecco'nun fosfat tamponlu salini (DPBS) ekleyin ve hücreleri yıkamak için hafifçe döndürün.
- DBPS'yi aspire edin ve 100 mm plakaya 2 mL yumuşak hücre ayrışma reaktifi (GCDR) ekleyin, hücreleri örtmek için üstüne damla damla damla ekleyin.
NOT: Diğer ayrışma reaktifleri de kullanılabilir. Buna göre ayarlayın. - Koloniler parçalanana ve hücreler faz kontrastı altında kırılana kadar oda sıcaklığında ~ 6-8 dakika boyunca inkübe edin (Şekil 2A).
NOT: Zamanlama hücre hatları arasında değişebilir. Buna göre ayarlayın. - Kuluçka yaparken, 50 mL'lik bir konik tüp hazırlayın. 16 mL hPSC ortamı (100 mm plaka başına 8 mL) ekleyin ve Rho ile ilişkili kinaz inhibitörü (ROCKi) 5 μM'lik son konsantrasyona ekleyin.
- DMEM'i BME kaplı plakalardan aspire edin ve her plakaya 8 mL hPSC ortamı artı ROCKi ekleyin.
- Hücreler hazır olduğunda (madde 2.3, Şekil 2A'da açıklandığı gibi), GCDR'yi aspire edin ve plakayı deneyciye doğru ~ 45 ° eğin ve hücreleri bir hücre kaldırıcı ile kazıyın.
NOT: Hücreler parçalanıyorsa, aspire edici GCDR'yi atlayın ve devam edin. - Plakayı ~ 90 ° çevirin ve kalan hücreleri kaldırmak için tekrar kazıyın. Plakayı ~ 45 ° tutun ve hücreleri 10 mL'lik bir serolojik pipet kullanarak 3 mL hPSC ortamı ile yıkayın.
- Büyük kümeleri (en fazla 2-3 kez) parçalamak için yavaşça yukarı ve aşağı pipet yapın ve hücreleri hazırlanan plakalara ilgilenilen hücre hattı için uygun oranda tohumlayın. Plakayı inkübatördeki hücrelerle birlikte yerleştirin ve hücreleri eşit olarak dağıtmak için plakayı şekil sekiz hareketle yavaşça hareket ettirin.
NOT: Bu deneyde hPSC çizgileri 1:5 oranında bölünmüştür, bu diğer hücre hatları ve koşulları için değişebilir. Tabağı gece boyunca rahatsız edilmeden bırakın. - ~ 24 saat sonra, hücreleri bağlantı için inceleyin. Bağlı küçük bireysel kolonileri arayın. Harcanan ortamı aspire edin ve 8 mL taze hPSC ortamı ile doldurun (ROCKi eklenmedi).
- Böbrek organoid tahlilini başlatmak için hücreler ~% 60 akıcılığa ulaşana kadar günlük olarak gözlemlemeye ve beslemeye devam edin (genellikle pasajdan sonra 48 ila 72 saate ulaştı). Koloniler ideal olarak ayrık olacak ve birleşmeyecek (Şekil 2B).
NOT: Pluripotens durumlarını korumak için hücreleri% 80'den fazla akıcılıkla sınırlamamak çok önemlidir. Akıcı kültürler, kaba kullanım veya daha yüksek pasajlar, istenmeyen spontan farklılaşmaya veya böbrek organoid oluşumunun düşük verimliliğine neden olabilir.
3. Gün 0 - Böbrek organoid testinin kurulması
- Başlamadan önce, hem E5-ILP hem de Aşama II ortamını formülasyonlara göre hazırlayın (Tablo 1 ve Tablo 2).
NOT: Ortam, 4 °C'de 14 güne kadar saklanabilir. - Bir böbrek organoid testi için (bir 6 delikli plaka için bir 100 mm kültür plakası gereklidir), 50 mL'lik bir konik tüpte tam E5-ILP ortamı hazırlayın: 8 μM CHIR99021 (14.4 μL), 3.3 μM ROCKi (6 μL), 0.1 mM beta-merkaptoetanol (32.7 μL) ile desteklenmiş 18 mL E5-ILP.
- 6 kuyucuklu ultra düşük bağlantı plakasının her bir kuyucuğuna 2 mL komple E5-ILP ortamı yerleştirin.
- hPSC'leri ~ 8 mL DPBS ile ~% 60 yoğunlukta (Şekil 2B) iki kez yıkayın. Aspirat DPBS daha sonra 100 mm plaka başına 2 mL dispase ekleyin, hücreleri örtmek için damla damla damla ve 37 ° C'de 6 dakika boyunca inkübe edin.
NOT: 6 dakika sonra, kolonilerin kenarları kıvrılmaya başlayacak (Şekil 2C, kırmızı oklar) ve koloninin geri kalanı bağlı kalacaktır. Bu 6 dakika sonra elde edilmezse, hücreleri 30 saniye daha inkübatöre geri yerleştirin. Diğer hPSC ortamları ve matrisleri bu zamanlamayla uyumlu olmayabilir. Laminin esaslı BME kaplama, dispase ile uyumlu değildir. Laminin bazlı BME standart hPSC matrisi ise, bölüm 1'deki plakalardan birini, böbrek organoid testi için kullanılacak bu yöntemde açıklanan BME ile kaplayın. - Hücreleri ~ 10 mL DPBS ile 3 kat yıkayın. DPBS'yi aspire edin, ardından plakayı ~ 45 ° eğin ve bir hücre kaldırıcı ile kazıyın.
NOT: Dispase devre dışı bırakılmaz, bu nedenle iyice yıkanması gerekir. Yıkama sayısını azaltmayın. - 10 mL'lik bir serolojik pipet kullanarak kolonileri üstten aşağıya doğru 6 mL tam E5-ILP ortamı ile yıkayın. Büyük kolonileri parçalamak için hafifçe yukarı ve aşağı pipet yapın (genellikle 2 veya 3 kez yeterlidir).
- 6 delikli plakaya kuyu başına 1 mL ekleyerek koloni kümelerini eşit olarak dağıtın. Plakayı 37 °C inkübatöre yerleştirilen bir yörüngesel çalkalayıcıya (ayarlar: orbital = 30, karşılıklı = 330°, titreşim = 5° - 2 s) yerleştirin (Şekil 2D).
NOT: Titreşim özelliği, organoidlerin yeterli dağılımı ve kümelenmenin önlenmesi için önemlidir.
4. Gün 2 - Yarı-orta değişimle besleme
NOT: 48 saat içinde, koloni kümeleri embriyoid cisimler oluşturacaktır.
- Tüm ortamı hazırlayın: 6 delikli bir plaka için 15 mL'lik bir konik tüp içinde 12 mL E5-ILP ortamı + 8 μM CHIR99021 hazırlayın.
NOT: Beta-merkaptoetanol ve ROCKi gerekli değildir. - Embriyoid cisimlerin plakanın dibine yerleşmesine izin verin, plakayı ~ 45 ° eğin, ardından ortamı yavaşça üstten aspire edin, kuyucuk başına ~ 1 mL bırakın.
NOT: Bu aşamada embriyoid cisimler hızla kümelenir. Onları > 5 dakika yetinmeye bırakmayın. - Kuyu başına 2 mL hazırlanmış tam ortam (bölüm 4.1) ekleyin. Plakayı çalkalayıcıya geri koyun.
5. Gün 3 - Embriyoid cisimlerin Aşama II ortamına transferi
- 50 mL'lik bir konik tüp ve DMEM (düşük glikoz) hazırlayın. Embriyoid cisimlerin plakanın dibine yerleşmesine izin verin. Plakayı ~ 45 ° eğin ve ortamı üstten yavaşça aspire edin, kuyucuk başına ~ 1 mL bırakın.
- 10 mL'lik bir serolojik pipet kullanarak tüm embriyoid cisimciklerini her bir kuyucuktan dikkatlice toplayın ve 50 mL konik tüpe aktarın.
- Kalan embriyoid cisimleri ~ 1 mL DMEM (düşük glikoz) ile toplamak için her bir kuyucuğu yıkayın ve bunları aynı 50 mL konik tüpe ekleyin.
- Embriyoid cisimleri tüpün dibine yerleşmek için bırakın, ~ 5 dakika. Beklerken, 6 delikli plakanın her bir kuyucuğuna 2 mL Aşama II ortamı ekleyin. 200 μm hücre süzgeci kullanarak büyük embriyoid cisimleri (>300 μm) yok edin (Şekil 2E).
- Yeni bir 50 mL konik tüp kullanın ve 200 μm hücre süzgecini üstüne yerleştirin. Hücre süzgeci üzerinde 10 mL'lik serolojik pipet kullanarak embriyoid cisimlerin tümünü dikkatlice pipetleyin.
- Hücre süzgecine sıkışmış embriyoid cisimleri toplamak için hücre süzgecini ek ~ 5 mL DMEM (düşük glikoz) ile durulayın. Embriyoid cisimlerin konik tüpün dibine yerleşmesine izin verin.
- Embriyoid cisimler yerleştiğinde, süpernatantı aspire edin ve ~ 10 mL DMEM (düşük glikoz) ile yıkayın.
- DMEM'i aspire edin ve embriyoid cisimleri 6 mL'lik Evre II ortamında yeniden askıya alın.
- Embriyoid cisimleri 6 kuyu ultra düşük bağlantı plakasına geri aktarın ve 6 kuyu arasında eşit olarak dağıtın.
- Adım 4.2 ve 4.3'te açıklandığı gibi her gün yarım orta ölçekli değişiklikler gerçekleştirin.
NOT: 3. günden itibaren, embriyoid cisimler 'altın' ve pürüzsüz, küresel bir görünüme sahip olacaktır (Şekil 2F). ~ 6. günden itibaren, bireysel embriyoid cisimlerde tübül oluşumu belirginleşecek, takip eden günlerde artan sayılar optimum sayılara ulaşacak ve 14. güne kadar büyüyecektir (Şekil 2G, H). Ara sıra kümelenmeyi ortadan kaldırmak için, böbrek organoidlerini veya tübülsüz çok küçük embriyoid cisimleri görsel olarak gözlemledikten sonra, <200 ve büyük >500 μm organoidleri, 5.4.1 ve 5.4.2 numaralı adımlarda açıklandığı gibi 500 ve 200 μm hücre süzgeçleri ile eleyin.
6. İplikçi şişeye ve beslemeye aktarma
NOT: Bir iplikçi şişesi, çok sayıda organoid gerektiren deneyler için 3. günden itibaren herhangi bir zamanda kullanılabilir. Organoidlerin rutin transferi laboratuvarımızda 6-8. günler arasında gerçekleşir. Ekipman mevcut değilse alternatifler için lütfen Tartışma bölümüne bakın.
- Embriyoid cisimleri, 45 mL Aşama II ortam ile 125 mL'lik bir iplikçi şişeye aktarın. Manyetik karıştırıcı hızını 120 rpm'ye ayarlayın ve inkübatöre yerleştirin (Şekil 2I).
- Embriyoid cisimleri veya böbrek organoidlerini beslemek için, böbrek organoidlerinin iplikçi şişenin dibine kısa bir süre yerleşmesine izin verin. Kapağı şişenin bir yan kolundan kaldırın ve aspire edici pipeti, ucu karşı iç duvara değecek şekilde içine yerleştirin.
- Aspire edici pipeti yavaşça aşağı doğru açın ve ortamın yaklaşık yarısını aspire edin. Aynı açıklıktan pipetleyerek 20 mL taze Stage II ortamı ile doldurun.
7. 6 delikli manyetik karıştırma plakasının (6MSP) ayarlanması
NOT: Birden fazla koşulun test edilmesi gerekiyorsa, eğirici şişelerin yerine 6MSP formatı kullanılabilir. Bileşik veya nefrotoksin tedavileri için 6MSP'yi kullanın. Bu, difüzyon yoluyla besin mevcudiyetini korurken ikinci aşamada kullanılan ortam miktarını korur.
- Oval manyetik karıştırma çubuklarını 50 mL'lik konik bir tüp içinde doku kültürüne uygun bir deterjanda (hiç kullanılmamışsa) yıkayarak temizleyin veya daha önce kullanılmışsa 1 saat > bekletin.
- Steril DPBS'de 3x'i kısaca yıkayın.
- 1x'i %70 etanolde 5 dakika, steril DPBS'de 1x yıkayın.
- Yapışma önleyici çözelti ile durulayın ve steril DPBS'de 1x yıkayın ve aspire edin.
- Dikkatlice, uzun steril forseps kullanarak, embriyoid cisimler veya böbrek organoidleri ile 6 delikli plakanın her bir kuyucuğuna bir manyetik karıştırma çubuğu yerleştirin.
- Plakayı 6MSP'ye yerleştirin ve hızı 120 rpm'ye ayarlayın (Şekil 2J). Böbrek organoidlerini bölüm 4.2 ve 4.3'e göre yarı orta değişiklikle koruyun.
NOT: Manyetik karıştırma çubuklarının yerine oturması ve dönmeye başlaması için, önce güç seviyesini kısaca 100'e ayarlamanız, ardından hepsi döndükten sonra güç seviyesini 25'e indirmeniz gerekebilir.
Sonuçlar
Protokolümüzün bu en son versiyonunda, böbrek organoid farklılaşması tanımlanmış, düşük proteinli bir ortamda başlatılır. Tahliller tamamen süspansiyon halinde gerçekleştirilir ve hPSC'lerin tübülogenezin başlatılması için farklılaşma ve organizasyonun doğuştan gelen yeteneğine dayanır. 100 mm ~% 60 oranında bir akıcılık hPSC kültür plakasından kaynaklanan tek bir tahlil, önceki yayınımızda gösterildiği gibi rutin olarak 500-1.000 böbrek organoidi verir5. Üretilen bu kadar çok sayıda organoid nedeniyle, bu protokol bileşik testi için çok uygundur. Bileşik testi için rutin olarak 6 delikli bir format kullanıyoruz, ancak bu protokol ikinci aşamada (3. günden itibaren) daha yüksek verimli bileşik testi için diğer çok kuyulu formatlara kolayca ölçeklendirilebilir. Parafin kesitlerinin immünofloresansı, organoidlerde nefron segmentlerinin, yani Hepatosit Nükleer Faktör-1 beta (HNF1B) ve Lotus Tetragonolobus Lektin'i (LTL) eksprese eden renal tübüllerin (Şekil 3A - HNF1B, LTL) ve V-maf Musküloaponevrotik Fibrosarkom onkogen homolog B (MAFB) ve nefrin (NPHS1) eksprese eden podosit kümelerinin varlığını göstermektedir (Şekil 3A - MAFB, Şekil 3B - NPHS1). Ayrıca, bu protokoldeki modifikasyonlar, kültürün 26. gününde Trombosit ve Endotel Hücre Adezyon Molekülü 1 (PECAM1) ile boyanmayı gösteren Şekil 3B'de görüldüğü gibi endotel hücrelerinin genişlemesini destekleyebilir.
| Reaktif | Stok conc. | Çalışma conc. | 250 mL başına tutar |
| TeSR-E5 | Yok | Yok | 238,48 milyon L |
| PVA | 10% | 0.25% | 6,25 mL |
| Kalem-Strep | 100x | 1 adet | 2,5 mL |
| ITSE | 100x | 0,1 kat | 250 μL |
| Kimyasal olarak tanımlanmış lipitler | 100x | 1 adet | 2,5 mL |
| Plazmosin | 25 mg/mL | 2,5 μg/mL | 25 μL |
Tablo 1: E5-ILP orta bileşim. Kimyasal olarak tanımlanmış lipitler ve anti-mikoplazma reaktifi dışındaki tüm reaktifleri doğrudan 0.22 μm Stericup filtrasyon ünitesinin üst odasına pipetleyin. Filtrasyondan sonra, lipitleri ve anti-mikoplazma reaktifini ekleyin. İki haftaya kadar 4 °C'de saklayın.
| Reaktif | Stok conc. | Çalışma conc. | 500 mL başına tutar |
| DMEM (Düşük Glikoz) | Yok | Yok | 417,5 mL |
| KOSR | Yok | 10% | 50 mL |
| PVA | 10% | 0.25% | 12,5 mL |
| Kalem-Strep | 100x | 1 adet | 5 mL |
| MEM-NEAA | 100x | 1 adet | 5 mL |
| GlutaMAX | 100x | 1 adet | 5 mL |
| HEPES | 100x | 1 adet | 5 mL |
| Plazmosin | 25 mg/mL | 2,5 μg/mL | 50 μL |
Tablo 2: Aşama II orta kompozisyon. Anti-mikoplazma reaktifi dışındaki tüm reaktifleri doğrudan 0,22 μm Stericup filtrasyon ünitesinin üst odasına pipetleyin. Filtrelendikten sonra, anti-mikoplazma reaktifi ekleyin. İki haftaya kadar 4 °C'de saklayın.
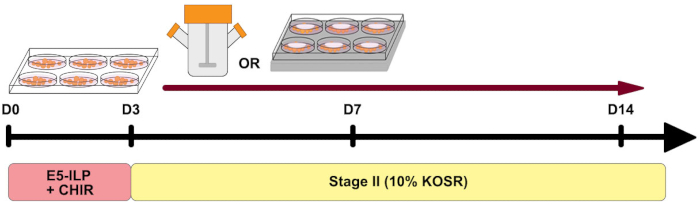
Şekil 1: Protokole genel bakış. İki aşamanın zamanlamasını ve iplikçi şişelerinin ve 6MSP'nin kullanımını gösteren protokole şematik genel bakış. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
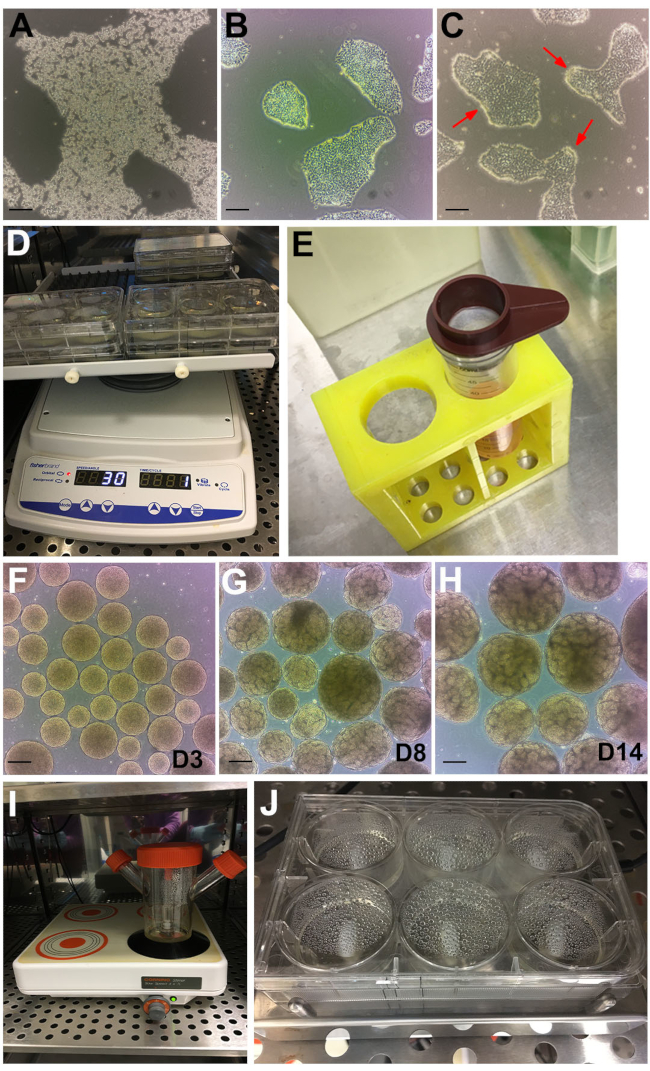
Şekil 2: Protokolün aşamaları . (A) GCDR ile tedavi edilen hPSC kolonisinin parlak alan görüntüsü. (B) Böbrek organoid testine başlamak için optimal akıcılık ve koloni büyüklüğü. (C) 6 dakika boyunca dispase ile muamele edilen hPSC'ler. Kırmızı oklar, kıvrılan kolonilerin kenarlarına işaret eder. (D) Yörüngesel çalkalayıcı üzerinde organoid tahliller. (E) Büyük embriyoid cisimleri elemek için 200 μm hücre süzgecinin kullanılması. (F) Evre II ortama geçmeden önce 3. günde (D3) embriyoid cisimler. (G) Tübül oluşumunun ortaya çıkışı, 8. günde (D8) ve (H) organoid hasat ve tedavi için en uygun zaman noktasında 14. günde (D14) gözlemlenebilir. (I) Çok konumlu manyetik plaka üzerinde dökme kültür için kullanılan iplikçi şişesi. (J) Çok kuyulu manyetik karıştırma plakası üzerinde tahlil. Ölçek çubukları, 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Beklenen sonuçlar . (A) Tübül epitelisi (HNF1B ve LTL) ve podosit kümeleri (MAFB) için pozitif boyama gösteren 14. günün immünofloresan olarak etiketlenmiş parafin kesitlerinin temsili konfokal görüntüleri. (B) Podosit kümeleri (NPHS1) ve endotel hücreleri (PECAM1) için etiketlenmiş 26. Gün böbrek organoid bölümleri. Ölçek çubukları, 100 μm (A); 200 μm (B). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Önceki çalışmalar, ilk protokol adımlarının ara mezoderm farklılaşması 5,19,20 için kritik olduğunu ve bu nedenle bu aşamada sıkı bir orta bileşimin uygulanmasının gerekli olduğunu göstermiştir. Serum, albümin, proteinsiz hibridoma medium II gibi tanımlanmamış bileşenlerin protokolün ilk aşamasından çıkarılması, tahliller21 arasındaki tutarlı farklılaşma verimliliğinin artırılmasına yardımcı olabilir.
Böbrek hücrelerinin metabolik durumu, işlevleri için kritik öneme sahiptir ve glikoz değişiklikleri değişmiş metabolik duruma yol açabilir22. Önceki çalışmalar, yüksek glikoz seviyelerinin (25 mM'ye kadar) endotel hücre disfonksiyonunu indükleyebileceğini ve böbrek hücrelerinin büyümesini ve oksidan kapasitesini değiştirebileceğini tanımlamıştır22,23,24. Yüksek glikoz seviyelerinin, mitokondriyal fonksiyon24'ü değiştirdiği de tanımlanmıştır; bu, böbrek hastalığı ve nefrotoksisiteyi araştırırken veya böbrek organoidlerini kullanarak ilaç keşfi yaparken olumsuz olabilir. Bu nedenle, organoid böbrek hücrelerinin daha in vivo benzeri bir metabolik durumunu teşvik etmek için protokolümüzdeki glikoz seviyesini azalttık. Sonuç olarak, böbrek organoid testindeki değişiklikler, basitliğini korurken tutarlı ve sağlam bir protokol sağlar.
Böbrek organoidleri olgunlaşmamıştır ve uzatılmış kültür (>20 gün), daha önce tarif edildiği gibi pro-fibrotik ve renal olmayan hücre tiplerinin insidansına yol açabilir 5,25, organoidleri sağlıklı insan böbrek dokusunu daha az temsil eder. Deneyimlerimize dayanarak, böbrek organoidlerinin en sağlıklı olduğu optimal tedavi penceresi 14-18. günler arasındadır. Yukarıda açıklandığı gibi iplikçi şişelerinin ve çok kuyulu manyetik karıştırıcıların kullanılması, statik kültür 21,26'nın aksine tek tip besin kullanılabilirliğini artıracaktır. Çalkalayıcı veya manyetik karıştırıcılar gibi süspansiyon kültürü için ekipman mevcut değilse, bu protokol statik kültürdeki ultra düşük bağlantı plakalarında tamamen gerçekleştirilebilir. Bununla birlikte, embriyoid cisimlerin / organoid birleşmesinin insidansında artış olabilir, bu da hipoksiye bağlı nekrotik çekirdekli büyük örneklere yol açabilir. 500 μm'den büyük herhangi bir organoid, tarif edilen hücre süzgeçleri kullanılarak çıkarılabilir. Bu durumlarda organoidlerin birleşme şansını azaltmak için, 6 kuyucuk başına 100'den fazla organoid tohumlamamanızı öneririz. Ek olarak, beslenmeyi takiben, organoidler plaka ile şekil sekiz hareketi gerçekleştirilerek eşit olarak dağıtılmalıdır.
Düşük verimlilikte (<%50) organoid oluşumu gözlenebilir. Bu genellikle hPSC kültürleri standart geçiş sırasında yüksek akıcılığa (>% 80) ulaştığında ortaya çıkar. hPSC bakımının tutarlı olması ve hücrelerin aşırı akışkan hale gelmemesi çok önemlidir. Yüksek akıcılık ve tutarsız pasaj tekniği de spontan farklılaşmaya ve artmış hücre ölümüne yol açabilir. hPSC kültüründe farklılaşma varsa, analize başlamadan önce, hücre popülasyonunun% 5'ini geçmiyorsa, ince bir pipet ucu ile aspire ederek farklılaşmış alanların çıkarılmasını öneririz. Farklılaşma alanları %5'i aşarsa, yeni bir tahlil işlemine başlamadan önce yeni bir hPSC grubunun çözülmesini ve en az bir kez bölünmesini öneririz.
Bazı hPSC hatlarının kalp veya sinir dokusu gibi böbrek dışı hücre tiplerini oluşturmaya daha yatkın olduğunu gözlemledik. Bu meydana gelirse, hücre süzgeçlerini kullanarak boyut filtrasyonu, böbrek dışı çıkıntılar içeren organoidlerin çıkarılmasına yardımcı olabilir. Alternatif olarak, hPSC ortamını ve / veya matrisini değiştirmek, böbrek dışı büyümeleri azaltmaya yardımcı olabilir. Deneyimlerimize göre, minimum bileşenler içeren alternatif hPSC ortamı ve vitronektin gibi BME, daha sıkı bir pluripotent niş sağlar ve böylece daha homojen hPSC kültürleri üretmeye yardımcı olur.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu araştırma Ulusal Sağlık Enstitüleri R01 DK069403, UC2 DK126122 ve P30-DK079307 ve ASN Böbrek Araştırmaları Vakfı Ben J. Lipps Araştırma Burs Programı tarafından AP'ye finanse edilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Thermo Fisher | 21-985-023 | |
| Anti-adherence rinsing solution | STEMCELL Technologies | 7010 | |
| CHIR99021 | STEMCELL Technologies | 72054 | 10 mM stock in DMSO |
| Corning disposable spinner flasks | Fisher Scientific | 07-201-152 | |
| Corning Ultra-Low Attachment 6-well plates | Fisher Scientific | 07-200-601 | |
| Corning Slow-Speed Stirrers | Fisher Scientific | 11-495-03 | Multi plate magnetic stirrer for spinner flask culture |
| Dispase | STEMCELL Technologies | 7923 | Aliquot and freeze |
| DMEM, low glucose, pyruvate, no glutamine, no phenol red | Thermo Fisher | 11054020 | |
| DPBS 1x, no calcium, no magnesium | Thermo Fisher | 14-190-250 | |
| Egg / Oval Stirring Bars | 2mag | PI20106 | |
| Excelta General-Purpose Tweezers | Fisher Scientific | 17-456-103 | Keep sterile in the cell culture hood |
| EZBio Single Use Media Bottle, 250mL | Foxx Life Sciences | 138-3211-FLS | Used to make PVA 10% |
| Falcon Standard Tissue Culture Dishes (100 mm) | Thermo Fisher | 08-772E | |
| Fisherbrand Sterile Aspirating Pipet 2mL | Fisher Scientific | 14-955-135 | |
| Fisherbrand Cell Lifters - Cell lifter | Fisher Scientific | 08-100-240 | |
| Fisherbrand Multi Function 3D Rotators | Fisher Scientific | 88-861-047 | Orbital shaker |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413302 | BME. Aliquot on ice and freeze. Another suitable matrix alternative is Matrigel or Cultrex. |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 7174 | GCDR |
| GlutaMAX Supplement | Thermo Fisher | 35-050-061 | L-glutamine supplement. |
| HEPES (1M) | Thermo Fisher | 15-630-080 | |
| Insulin-Transferrin-Selenium-Ethanolamine | Thermo Fisher | 51-500-056 | ITSE |
| KnockOut Serum Replacement - Multi-Species | Thermo Fisher | A3181502 | KOSR. Aliquot and freeze |
| Lipid Mixture 1, Chemically Defined | Millipore-Sigma | L0288-100ML | |
| MEM Non-Essential Amino Acids Solution | Thermo Fisher | 11140-050 | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 500mL | Fisher Scientific | S2GPU05RE | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 250mL | Fisher Scientific | S2GPU02RE | |
| MIXcontrol MTP / Variomag TELEcontrol MTP Control Unit | 2mag | VMF 90250 U | |
| MIXdrive 6 MTP / Variomag TELEdrive 6 MTP Microplate Stirring Drive | 2mag | VMF 40600 | 6MSP |
| MP Biomedicals 7X Cleaning Solution | Fisher Scientific | MP0976670A4 | Tissue culture suitable detergent. Make a 5% solution in water |
| mTeSR1 | STEMCELL Technologies | 85850 | hPSC medium.TeSR-E8, NutriStem XF, and mTeSR Plus medium have also been tested and are suitable alternatives. |
| Nunc 50 mL Conical, Sterile Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| Nunc 15mL Conical Sterile Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| Penicillin-Streptomycin | Thermo Fisher | 15-140-122 | Aliquot and freeze |
| Plasmocin | Invivogen | ant-mpt | Anti-mycoplasma reagent. Aliquot and freeze |
| pluriStrainer® 200 µm | Fisher Scientific | NC0776417 | Cell strainer |
| pluriStrainer® 500 µm | Fisher Scientific | NC0822591 | Cell strainer |
| Poly(vinyl alcohol) 87-90% hydrolyzed (PVA) | Millipore-Sigma | P8136-250G | 10% in DPBS stirring at 98 degrees C until disolves, make in 138-3211-FLS |
| ROCK inhibitor Y-27632 (ROCKi) | STEMCELL Technologies | 72304 | 10 mM stock in DPBS |
| Sterile Disposable Serological Pipets - 10mL | Fisher Scientific | 13-678-11E | |
| Sterile Disposable Serological Pipets - 25mL | Fisher Scientific | 13-678-11 | |
| Sterile Disposable Serological pipette - 5 mL | Fisher Scientific | 13-678-12D | |
| TeSR-E5 | STEMCELL Technologies | 5916 | Serum-free, low protein base medium for E5-ILP |
| Variomag distriBOX 2 Distributor | 2mag | VMF 90512 | If you use more than one MIXdrive |
Referanslar
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communications. 6, 8715(2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Taguchi, A., et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell. 14 (1), 53-67 (2013).
- Przepiorski, A., et al. A simple bioreactor-based method to generate kidney organoids from pluripotent stem cells. Stem Cell Reports. 11 (2), 470-484 (2018).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communication. 6, 8715(2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Taguchi, A., Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell. 21 (6), 730-746 (2017).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514(2020).
- Howden, S. E., Little, M. H. Generating kidney organoids from human pluripotent stem cells using defined conditions. Methods in Molecular Biology. 2155, 183-192 (2020).
- Tanigawa, S., et al. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. 13 (2), 322-337 (2019).
- Sander, V., et al. Protocol for large-scale production of kidney organoids from human pluripotent stem cells. STAR Protocols. 1 (3), 100150(2020).
- Ekblom, P., Thesleff, I., Miettinen, A., Saxen, L. Organogenesis in a defined medium supplemented with transferrin. Cell Differentiation. 10 (5), 281-288 (1981).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. Journal of Embryology and Experimental Morphology. 82, 147-161 (1984).
- Freund, C., et al. Insulin redirects differentiation from cardiogenic mesoderm and endoderm to neuroectoderm in differentiating human embryonic stem cells. Stem Cells. 26 (3), 724-733 (2008).
- Nishikawa, M., et al. An optimal serum-free defined condition for in vitro culture of kidney organoids. Biochemistry and Biophysics Research Communication. 501 (4), 996-1002 (2018).
- Oh, J. K., et al. Derivation of induced pluripotent stem cell lines from New Zealand donors. Journal of the Royal Society of New Zealand. , 1-14 (2020).
- Takasato, M., et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nature Cell Biology. 16 (1), 118-126 (2013).
- Lam, A. Q., et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. Journal of American Society of Nephrology. 25 (6), 1211-1225 (2014).
- Bratt-Leal, A. M., Carpenedo, R. L., McDevitt, T. C. Engineering the embryoid body microenvironment to direct embryonic stem cell differentiation. Biotechnology Progress. 25 (1), 43-51 (2009).
- Imasawa, T., et al. High glucose repatterns human podocyte energy metabolism during differentiation and diabetic nephropathy. FASEB Journal. 31 (1), 294-307 (2017).
- Kim, K. A., et al. High glucose condition induces autophagy in endothelial progenitor cells contributing to angiogenic impairment. Biological and Pharmaceutical Bulletin. 37 (7), 1248-1252 (2014).
- Piwkowska, A., Rogacka, D., Audzeyenka, I., Jankowski, M., Angielski, S. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes. Journal of Cellular Biochemistry. 112 (6), 1661-1672 (2011).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Lei, X., Deng, Z., Duan, E. Uniform embryoid body production and enhanced mesendoderm differentiation with murine embryonic stem cells in a rotary suspension bioreactor. Methods in Molecular Biology. , Clifton, N.J. (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır