Method Article
인간 다능성 줄기 세포로부터 신장 오가노이드를 생성하는 단순화된 방법
요약
여기서 우리는 인간 다능성 줄기 세포 (hPSCs)로부터 신장 오가노이드를 생성하는 프로토콜을 설명합니다. 이 프로토콜은 두 주 이내에 신장 오가노이드를 생성합니다. 생성된 신장 오가노이드는 병렬 약물 테스트 접근법을 위해 대규모 스피너 플라스크 또는 다중 웰 자기 교반 플레이트에서 배양될 수 있다.
초록
hPSCs에서 생성 된 신장 오가노이드는 신장 조직의 무한한 공급원을 제공했습니다. 인간 신장 오가노이드는 신장 질환 및 부상을 연구하고, 세포 기반 치료법을 개발하고, 새로운 치료법을 테스트하는 데 매우 유용한 도구입니다. 이러한 적용을 위해서는 많은 수의 균일 한 오가노이드와 재현성이 높은 분석이 필요합니다. 우리는 오가노이드의 전반적인 건강을 개선하기 위해 이전에 발표 된 신장 오가노이드 프로토콜을 기반으로합니다. 이 간단하고 견고한 3D 프로토콜은 지질, 인슐린-트랜스페린-셀레늄-에탄올아민 보충제 및 GSK3 억제제(CHIR99021)를 함유한 폴리비닐알코올을 함유하는 최소 성분 배지에서 3일 동안 균일한 배아체를 형성한 다음, 녹아웃 혈청 대체(KOSR) 함유 배지에서 배양하는 것을 포함한다. 또한, 교반 분석은 배아체의 응집을 줄이고 균일 한 크기를 유지할 수있게하며, 이는 오가노이드 간의 변동성을 줄이는 데 중요합니다. 전반적으로이 프로토콜은 다량의 신장 오가노이드를 생성하기위한 빠르고 효율적이며 비용 효율적인 방법을 제공합니다.
서문
최근 몇 년 동안, 인간 다능성 줄기 세포를 신장 오가노이드로 분화시키기 위한 다수의 프로토콜이 개발되었다 1,2,3,4,5. 신장 오가노이드는 새로운 재생 의학 접근법에 대한 연구를 돕고, 신장 관련 질병을 모델링하고, 독성 연구 및 치료 약물 개발을 수행하는 데 중요한 도구를 제공했습니다. 그들의 광범위한 적용성에도 불구하고, 신장 오가노이드는 성숙의 부족, 시험관 내에서의 제한된 장기 배양 능력, 및 인간 신장6,7,8에서 발견되는 여러 세포 유형의 소박함과 같은 한계를 갖는다. 최근의 연구는 오가노이드 성숙 수준을 향상시키고, 배양 기간을 연장하며, 기존 프로토콜 9,10,11,12를 수정하여 신장 세포 집단의 복잡성을 확대하는 데 중점을 두었습니다. 확립된 프로토콜 5,13의 이번 반복에서, 우리는 프로토콜의 첫 번째 단계에서 배지 성분을 인슐린-트랜스페린-셀레늄-에탄올아민(ITSE), 지질, 폴리비닐 알코올(E5-ILP) 및 CHIR99021로 보충된 무혈청 염기 배지로 변형시켰다(도 1). 이러한 변화는 완전히 정의 된 혈청이없고 저단백질 배지를 제공하며, 이전 배지 조성 5,13보다 성분이 적고 추가 성장 인자가 없습니다. 결과적으로, 첫 번째 단계 매체는 이전에 게시된 버전보다 준비에 노동력이 덜 많으며, 배치-배치 간 변동성을 감소시킬 수 있다5. 이전의 연구들은 인슐린과 트랜스페린 둘 다 무혈청 배양14,15에서 중요하다는 것을 보여주었지만, 높은 수준의 인슐린은 중배엽 분화를 억제할 수 있다16. 우리는 원래의 프로토콜에 제공된 바와 같이 낮은 인슐린 수준을 유지하고 분석의 두 번째 단계에서 KOSR (인슐린 함유)의 수준을 더욱 감소시켰다. 신장 오가노이드 형성을 위한 다른 프로토콜과 일치하여, KOSR의 낮은 수준은 신장 조직의 증식과 분화 사이의 균형을 유지하는데 유익하다(17). 또한, 우리는 우리의 Stage II 배지13에서 글루코스 농도를 낮췄다.
우리의 방법은 신장 오가노이드의 현탁 분석을 위한 셋업을 기술하며, 원래의 간행물 5,13에 기술된 바와 같이 초기 ∼60% 합류 hPSC 100 mm 배양 플레이트로부터 최대 ∼1,000개의 오가노이드를 산출한다. 이 프로토콜은 여러 개의 100mm 또는 150mm 플레이트로 시작하여 오가노이드 수를 더욱 늘릴 수 있습니다.
프로토콜
hPSCs를 사용한 모든 실험은 제도적 지침에 따라 수행되었고, 적절한 개인 보호 장비를 갖는 클래스 II 생물안전 후드에서 수행되었다. 모든 시약은 달리 언급되지 않는 한 세포 배양 등급이다. 모든 배양물은 37°C, 5%CO2 공기 분위기에서 배양된다. 분석의 모든 단계에서, 배아체 또는 신장 오가노이드를 수집하고, 고정시키거나 분석을 위해 준비할 수 있다. 이 데이터를 생성하는 데 사용되는 hPSC 라인은 완전히 특성화되고 공개되었다(18).
1. 배양접시 준비
참고: hPSC를 분할하기 약 1시간 전에, 2 x 100 mm 조직 배양 플레이트를 줄기 세포 적격 기저막 매트릭스 추출물(BME)로 코팅하십시오. 플레이트를 미리 코팅하고 파라핀 필름으로 밀봉한 다음 제조업체의 지침에 따라 4°C에서 보관할 수 있습니다.
- 클래스 II 생물안전 후드에서 2 x 100 mm 조직 배양 처리된 플레이트 (신장 오가노이드 분석을 위해 1개, 세포주를 유지하기 위해 1개) 및 15 mL 원뿔형 튜브를 준비한다.
- 8 mL의 차가운 혈청이 없는 둘베코 변형 이글 배지(DMEM)를 15 mL 원뿔형 튜브에 넣고 각 플레이트의 바닥을 매질로 덮기에 충분할 정도로 100 mm 플레이트 각각에 ~4 mL를 넣습니다.
- BME의 100 μL 분취량을 냉동고(-20°C)에서 꺼낸다. 2 mL 혈청 학적 피펫을 사용하여 15 mL 원뿔형 튜브에서 ~ 1 mL의 차가운 DMEM을 섭취하십시오. 차가운 DMEM으로 부드럽게 위아래로 피펫팅하여 BME 분취량을 천천히 해동시켜 거품을 피하십시오.
참고: BME 분취량을 실온에서 놓지 마십시오. 즉시 사용하십시오. - 해동된 DMEM/BME를 나머지 DMEM이 있는 15mL 원뿔형 튜브로 다시 옮깁니다. 10 mL 혈청 학적 피펫으로 희석 된 BME를 적어도 8 번 위아래로 피펫팅하여 부드럽게 혼합하여 BME를 고르게 분산시켜 거품을 피하십시오.
- 희석된 BME의 4 mL를 DMEM으로 각 플레이트에 옮기고 BME가 고르게 분포되도록 플레이트를 부드럽게 소용돌이친다. 코팅된 플레이트를 실온에서 1시간 또는 37°C에서 30분 동안 인큐베이션한다.
참고: 100mm 플레이트당 50μL의 BME를 사용하십시오. 다른 hPSC 배양 배지 및 세포주의 사용은 상이한 농도의 BME를 필요로 할 수 있다.
2. 패시징 hPSC
참고: 일상적인 hPSC 배양을 위해, 70-80% 컨플루언시에서 계대 세포주.
- 배양 배지를 계대될 hPSC 플레이트로부터 흡인한다. Dulbecco의 인산염 완충 식염수 (DPBS)를 hPSC 플레이트에 ~ 8 mL 첨가하고 부드럽게 소용돌이 치며 세포를 세척하십시오.
- 흡인물 DBPS와 2 mL의 온화한 세포 해리 시약 (GCDR)을 100 mm 플레이트에 첨가하고, 세포를 덮기 위해 위에 적방울씩 떨어뜨린다.
참고: 다른 해리 시약도 또한 사용될 수 있다. 그에 따라 조정하십시오. - 콜로니가 해체되고 세포가 위상차 하에서 굴절될 때까지 실온에서 ~6-8분 동안 배양한다(그림 2A).
참고: 타이밍은 세포주마다 다를 수 있습니다. 그에 따라 조정하십시오. - 인큐베이팅하는 동안, 50 mL 코니컬 튜브를 준비한다. hPSC 배지 16 mL(플레이트 100 mm 당 8 mL)를 첨가하고, 로-연관 키나제 억제제(ROCKi)를 최종 농도 5 μM에 첨가한다.
- BME 코팅된 플레이트로부터의 DMEM을 흡인하고, 8 mL의 hPSC 배지 플러스 ROCKi를 각각의 플레이트에 첨가한다.
- 세포가 준비되면 (점 2.3, 도 2A에 설명 된 바와 같이), GCDR을 흡인하고 플레이트를 실험자 쪽으로 ~ 45 ° 기울여 세포 리프터로 세포를 긁어냅니다.
참고 : 세포가 분리되는 경우 흡인 GCDR을 생략하고 진행하십시오. - 플레이트를 ~ 90 ° 돌리고 다시 긁어 나머지 세포를 들어 올립니다. 플레이트를 ~45°로 유지하고 10 mL 혈청학적 피펫을 사용하여 3 mL의 hPSC 배지로 세포를 세척한다.
- 큰 덩어리 (2-3 회 이하)를 분해하고 관심있는 세포주에 대해 적절한 비율로 세포를 준비된 플레이트 상에 시드하기 위해 부드럽게 위아래로 피펫하십시오. 세포와 함께 플레이트를 인큐베이터에 놓고 플레이트를 그림 여덟 동작으로 부드럽게 움직여 세포를 고르게 분포시킨다.
참고: 본 실험에서 hPSC 라인은 1:5의 비율로 분할되었고, 이것은 다른 세포주 및 조건에 따라 달라질 수 있다. 밤에는 접시를 방해받지 않고 두십시오. - ~ 24 시간 후, 부착을 위해 세포를 검사하십시오. 부착 된 작은 개별 식민지를 찾으십시오. 소비 된 배지를 흡인하고 8 mL의 신선한 hPSC 배지로 보충하십시오 (ROCKi 첨가 없음).
- 세포가 신장 오가노이드 분석을 시작하기 위해 ~ 60 % 컨플루언시에 도달 할 때까지 매일 관찰하고 먹이십시오 (일반적으로 통과 후 48 ~ 72 h에 도달). 콜로니는 이상적으로 분리되고 병합되지 않습니다 (그림 2B).
참고 : 다능성 상태를 유지하기 위해 세포를 80 % 이하의 합류율로 제한하는 것이 매우 중요합니다. 합류 배양, 거친 취급 또는 더 높은 계대는 원치 않는 자발적 분화 또는 신장 오가노이드 형성의 낮은 효율로 이어질 수 있다.
3. 0일째 - 신장 오가노이드 분석 설정
- 개시 전에, 제형에 따라 E5-ILP 및 Stage II 배지를 모두 제조하였다(표 1 및 표 2).
참고: 매체는 4°C에서 최대 14일 동안 보관할 수 있습니다. - 하나의 신장 오가노이드 분석(하나의 6-웰 플레이트에 100mm 배양 플레이트가 필요함)을 위해, 50 mL 원뿔형 튜브에서 완전한 E5-ILP 배지를 준비한다: 8 μM CHIR99021 (14.4 μL), 3.3 μM ROCKi (6 μL), 0.1 mM 베타-메르캅토에탄올 (32.7 μL)로 보충된 E5-ILP 배지 18 mL.
- 2 mL의 완전한 E5-ILP 배지를 6 웰 초저 부착 플레이트의 각 웰에 넣는다.
- ~60% 플루언시(그림 2B)에서 hPSC를 ~8mL의 DPBS로 두 번 세척한다. 흡인물 DPBS는 100 mm 플레이트 당 2 mL의 디스파아제를 첨가한 후, 세포를 덮기 위해 적하하여 적하하고, 37°C에서 6분 동안 인큐베이션한다.
참고: 6분 후, 콜로니의 가장자리가 말리기 시작하고(그림 2C, 빨간색 화살표) 나머지 콜로니는 부착되어 있습니다. 6 분 후에 이것이 얻어지지 않으면, 세포를 추가 30 초 동안 인큐베이터에 다시 넣으십시오. 다른 hPSC 배지 및 매트릭스는 이 타이밍과 호환되지 않을 수 있다. 라미닌계 BME 코팅은 디스파제와 호환되지 않습니다. 라미닌계 BME가 표준 hPSC 매트릭스인 경우, 섹션 1의 플레이트 중 하나를 신장 오가노이드 분석에 사용되는 이 방법에 기재된 BME로 코팅한다. - ~10mL의 DPBS로 세포를 3배 세척한다. 흡인물 DPBS는 플레이트를 ~45° 기울여 셀 리프터로 긁어냅니다.
참고 : Dispase는 비활성화되지 않으므로 철저히 씻어 내야합니다. 세척 횟수를 줄이지 마십시오. - 콜로니를 10 mL 혈청학적 피펫을 사용하여 6 mL의 완전한 E5-ILP 배지로 상부로부터 세척한다. 큰 식민지를 부수기 위해 부드럽게 위아래로 피펫을 만듭니다 (일반적으로 2 ~ 3 번이면 충분합니다).
- 웰당 1mL를 6-웰 플레이트에 첨가하여 콜로니 클러스터를 고르게 분배한다. 플레이트를 37°C 인큐베이터에 배치된 궤도 진탕기(설정: 궤도 = 30, 역수 = 330°, 진동 = 5° - 2초) 위에 놓습니다(그림 2D).
참고: 진동 기능은 오가노이드의 적절한 분포와 뭉침을 방지하기 위해 중요합니다.
4. 2 일째 - 반 중간 변화에 의한 먹이기
참고 : 48 시간 이내에 식민지 클러스터는 배아체를 형성합니다.
- 완전한 배지 준비: 하나의 6-웰 플레이트에 대해 15 mL 원뿔형 튜브에서 12 mL의 E5-ILP 배지 + 8 μM CHIR99021을 준비한다.
참고: 베타-메르캅토에탄올과 ROCKi는 필요하지 않습니다. - 배아체가 플레이트의 바닥에 정착하게하고, 플레이트를 ~ 45 ° 기울인 다음 배지를 위에서 천천히 흡인하고 웰 당 ~ 1 mL를 남겨 둡니다.
참고 :이 단계의 배아체는 빠르게 덩어리집니다. 5 분 동안 정착하기 위해 그들을 두> 마십시오. - 웰 당 2 mL의 준비된 완전 배지 (섹션 4.1)를 첨가하십시오. 플레이트를 셰이커에 다시 놓습니다.
5. 3 일째 - 배아체를 단계 II 배지로 옮깁니다.
- 50 mL 원뿔형 튜브 및 DMEM (저글루코스)을 준비한다. 배아체가 판의 바닥에 정착하게하십시오. 플레이트를 ~ 45 ° 기울이고 위에서 배지를 천천히 흡인하고 웰 당 ~ 1 mL를 남겨 둡니다.
- 10 mL 혈청학적 피펫을 사용하여 각 웰로부터 모든 배아체를 조심스럽게 수집하고, 이를 50 mL 원뿔형 튜브로 옮긴다.
- 각 웰을 세척하여 남아있는 배아체를 ~1 mL의 DMEM(저포도당)으로 수집하고, 이를 동일한 50 mL 원뿔형 튜브에 첨가한다.
- 배아체를 튜브 바닥에 정착시키기 위해 ~ 5 분 동안 방치하십시오. 기다리는 동안 2mL의 스테이지 II 배지를 6-웰 플레이트의 각 웰에 첨가한다. 200 μm 세포 스트레이너를 사용하여 큰 배아체 (>300 μm)를 분리하십시오 (그림 2E).
- 새로운 50mL 원뿔형 튜브를 사용하고 200μm 세포 스트레이너를 위에 놓습니다. 모든 배아체를 10 mL 혈청학적 피펫을 사용하여 세포 스트레이너 위에 조심스럽게 피펫한다.
- 세포 스트레이너를 추가로 ~5 mL의 DMEM (저포도당)으로 헹구어 세포 스트레이너에 붙어있는 배아체를 수집하십시오. 배아체가 원뿔형 튜브의 바닥에 정착하도록 허용하십시오.
- 배아체가 침전되면 상층액을 흡인하고 ~10mL의 DMEM(저포도당)으로 세척한다.
- 흡인물 DMEM은 배아체를 6 mL의 단계 II 배지에 재현탁시킨다.
- 배아체를 다시 6웰 초저 부착판으로 옮겨 6개의 웰 사이에 고르게 분배한다.
- 격일로 단계 4.2 및 4.3에 설명된 대로 중간 정도의 변화를 수행합니다.
참고: 3일째부터 배아체는 '황금색'이고 매끄럽고 구형으로 보입니다(그림 2F). ~ 6 일째부터, 개별 배아체에서의 세뇨관 형성이 분명해질 것이며, 다음 날에 걸쳐 증가하는 숫자가 14 일째까지 최적의 숫자와 성장에 도달합니다 (그림 2G, H). 때때로 뭉침 형성을 제거하기 위해, 신장 오가노이드 또는 세뇨관이 없는 매우 작은 배아체를 육안으로 관찰할 때, 단계 5.4.1 및 5.4.2에 기술된 바와 같이 500 및 200 μm 세포 스트레이너를 갖는 <200 및 500 μm 큰 >500 μm 오가노이드를 체질한다.
6. 스피너 플라스크로 옮기고 먹이기
참고 : 스피너 플라스크는 많은 수의 오가노이드가 필요한 실험을 위해 3 일째부터 언제든지 사용할 수 있습니다. 오가노이드의 일상적인 이동은 6-8 일 사이에 우리 실험실에서 발생합니다. 장비를 사용할 수 없는 경우 토론 섹션을 참조하여 대안을 확인하십시오.
- 배아체를 45mL의 Stage II 배지가 있는 125 mL 스피너 플라스크에 옮깁니다. 자기 교반기 속도를 120rpm으로 설정하고 인큐베이터에 넣습니다(그림 2I).
- 배아체 또는 신장 오가노이드를 먹이려면 신장 오가노이드가 스피너 플라스크의 바닥에 잠깐 정착하도록하십시오. 플라스크의 한쪽 팔에서 뚜껑을 들어올리고 흡기 피펫을 안쪽에 넣고 팁이 반대쪽 안쪽 벽에 닿습니다.
- 흡기 피펫을 천천히 아래로 각도를 맞추고 배지의 약 절반을 흡인합니다. 20mL의 신선한 Stage II 배지를 동일한 개구부를 통해 피펫팅하여 보충하십시오.
7. 6웰 마그네틱 교반판(6MSP) 설정
참고: 6MSP 형식은 여러 조건을 테스트해야 하는 경우 스피너 플라스크 대신 사용할 수 있습니다. 화합물 또는 네프로톡신 치료를 위해 6MSP를 사용하십시오. 이것은 확산을 통해 영양소 가용성을 유지하면서 두 번째 단계에서 사용되는 배지의 양을 절약합니다.
- 타원형 자기 교반 막대를 50 mL 원뿔형 튜브에서 청소하고, 조직 배양 적합한 세제를 간단히 (사용하지 않는 경우) 세척하거나 이전에 사용된 경우 > 1 h 동안 담그십시오.
- 멸균 DPBS에서 3x를 간단히 씻으십시오.
- 70% 에탄올로 5분 동안 1x를, 멸균 DPBS에서 1x를 세척하십시오.
- 부착 방지 용액으로 헹구고 멸균 DPBS와 흡인물로 1x를 씻으십시오.
- 조심스럽게 긴 멸균 포셉을 사용하여 배아체 또는 신장 오가노이드가있는 6-웰 플레이트의 각 웰에 하나의 자기 교반 막대를 놓습니다.
- 플레이트를 6MSP 위에 놓고 속도를 120rpm으로 설정합니다(그림 2J). 섹션 4.2 및 4.3에 따라 절반 중간 변화로 신장 오가노이드를 유지하십시오.
참고 : 마그네틱 교반 막대가 제자리에 끼워져 회전을 시작하려면 먼저 전력 레벨을 100으로 간단히 넣은 다음 모두 회전하면 전력 레벨을 25로 낮추어야합니다.
결과
이 프로토콜의 가장 최신 버전에서, 신장 오가노이드 분화는 정의 된 저단백질 배지에서 시작됩니다. 상기 분석은 전적으로 현탁액에서 수행되며, 세뇨관 형성의 개시를 위한 hPSCs 분화 및 조직의 선천적 능력에 의존한다. 100 mm ∼60% 합류성 hPSC 배양 플레이트로부터 기원한 단일 검정은 우리의 이전 간행물 5에 나타난 바와 같이 일상적으로 500-1,000개의 신장 오가노이드를 산출한다. 이렇게 많은 수의 오가노이드가 생성되기 때문에, 이 프로토콜은 화합물 테스트에 매우 적합하다. 우리는 일상적으로 복합 테스트를 위해 6-well 형식을 사용하지만,이 프로토콜은 두 번째 단계 (3 일 이후)에서 더 높은 처리량의 복합 테스트를 위해 다른 멀티 웰 형식으로 쉽게 확장 될 수 있습니다. 파라핀 절편의 면역형광은 오가노이드, 즉 간세포 핵 인자-1 베타 (HNF1B) 및 연꽃 테트라고놀로버스 렉틴 (LTL) (도 3A - HNF1B, LTL)을 발현하는 신장 세뇨관에서 네프론 세그먼트의 존재를 나타내고, V-maf 근아포신경성 섬유육종 종양유전자 상동체 B (MAFB) 및 네프린 (NPHS1)을 발현하는 podocyte 클러스터 (도 3A - MAFB, 도 3B - NPHS1). 더욱이, 이 프로토콜의 변형은 배양 26일째에 혈소판 및 내피 세포 부착 분자 1(PECAM1)로 염색하는 것을 보여주는 도 3B에서 보이는 바와 같이 내피 세포의 확장을 지원할 수 있다.
| 시약 | 주식 conc. | 작업 conc. | 250 mL 당 양 |
| 테SR-E5 | n/a | n/a | 238.48 mL |
| PVA | 10% | 0.25% | 6.25 mL |
| 펜 스트렙 | 100배 | 1배 | 2.5 mL |
| 증권 시세 표시기 | 100배 | 0.1배 | 250 μL |
| 화학적으로 정의된 지질 | 100배 | 1배 | 2.5 mL |
| 플라스모신 | 25 밀리그램/mL | 2.5 μg/mL | 25 μL |
표 1: E5-ILP 배지 조성물. 화학적으로 정의된 지질 및 항마이코플라스마 시약을 제외한 모든 시약을 0.22 μm Stericup 여과 유닛의 상부 챔버 내로 직접 피펫팅한다. 여과 후, 지질 및 항마이코플라스마 시약을 첨가한다. 4°C에서 최대 2주 동안 보관하십시오.
| 시약 | 주식 conc. | 작업 conc. | 500 mL 당 양 |
| DMEM (저포도당) | n/a | n/a | 417.5 mL |
| KOSR | n/a | 10% | 50 mL |
| PVA | 10% | 0.25% | 12.5 mL |
| 펜 스트렙 | 100배 | 1배 | 5 mL |
| MEM-NEAA | 100배 | 1배 | 5 mL |
| 글루타맥스 | 100배 | 1배 | 5 mL |
| 헤페스 | 100배 | 1배 | 5 mL |
| 플라스모신 | 25 밀리그램/mL | 2.5 μg/mL | 50 μL |
표 2: 단계 II 배지 조성. 항마이코플라즈마 시약 및 항마이코플라즈마 시약을 제외한 모든 시약을 0.22 μm Stericup 여과 유닛의 상부 챔버 내로 직접 피펫팅한다. 일단 여과되면, 항 마이코 플라스마 시약을 추가하십시오. 4°C에서 최대 2주 동안 보관하십시오.
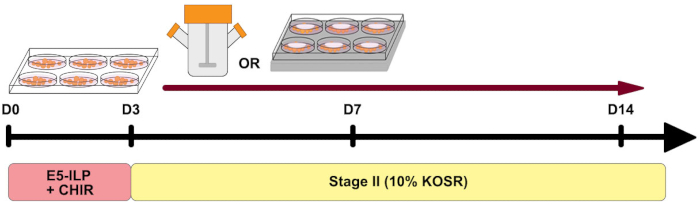
그림 1: 프로토콜 개요. 두 단계의 타이밍과 스피너 플라스크 및 6MSP의 사용을 보여주는 프로토콜의 개략적인 개요. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
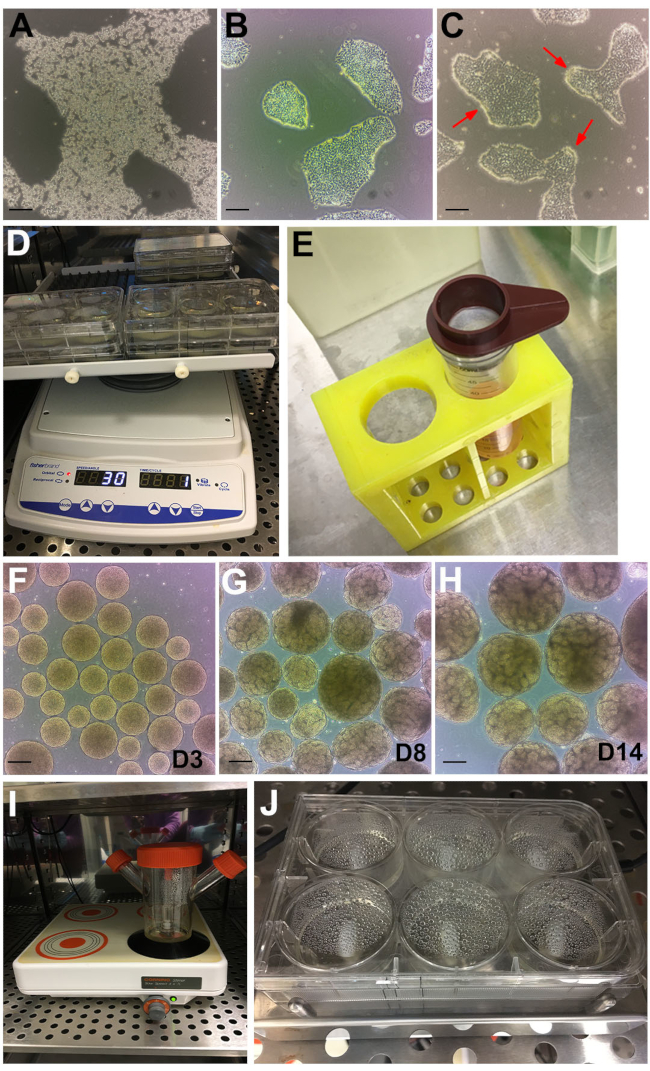
도 2: 프로토콜의 단계. (A) GCDR로 처리된 hPSC 콜로니의 밝은 필드 이미지. (b) 신장 오가노이드 분석을 시작하기 위한 최적의 합류율 및 콜로니 크기. (c) 6분 동안 디스파아제로 처리된 hPSCs. 빨간색 화살표는 말리는 식민지의 가장자리를 가리 킵니다. (d) 궤도 쉐이커에 대한 오가노이드 분석. (e) 200 μm 세포 스트레이너를 사용하여 큰 배아체를 체질한다. (f) 단계 II 배지로 옮기기 전에 3일째(D3)에 배아체. (g) 세뇨관 형성의 출현은 제8일째(D8) 및 (H) 제14일째(D14)에서 오가노이드 수확 및 치료를 위한 최적 시점에 관찰될 수 있다. (i) 다중 위치 자성 플레이트 상에서 벌크 배양을 위해 사용되는 스피너 플라스크. (J) 다중 웰 자기 교반 플레이트 상의 분석. 배율 막대, 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 3: 예상 결과 . (A) 세뇨관 상피(HNF1B 및 LTL) 및 podocyte clusters(MAFB)에 대한 양성 염색을 나타내는 14일째 신장 오가노이드의 면역형광 표지된 파라핀 절편의 대표적인 공초점 이미지. (b) 제26일째 신장 오가노이드 절편은 podocyte clusters (NPHS1) 및 내피 세포 (PECAM1)에 대해 표지되었다. 스케일 바, 100 μm (A); 200 μm (B). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이전의 연구들은 초기 프로토콜 단계들이 중간 중배 엽 분화 5,19,20에 매우 중요하며, 따라서, 이 단계에서 엄격한 배지 조성물을 구현하는 것이 필수적이라는 것을 보여주었다. 프로토콜의 첫 번째 단계로부터 혈청, 알부민, 단백질 프리 하이브리도마 배지 II와 같은 정의되지 않은 성분을 제거하는 것은 분석(21) 사이의 일관된 분화 효율을 향상시키는 데 도움이 될 수 있다.
신장 세포의 대사 상태는 그 기능에 매우 중요하며, 포도당 변화는 변화된 대사 상태(22)로 이어질 수 있다. 이전의 연구들은 높은 수준의 포도당 (최대 25mM)이 내피 세포 기능 장애를 유도하고 신장 세포의 성장 및 산화 능력을 변화시킬 수 있다고 기술했습니다22,23,24. 높은 수준의 포도당은 또한 미토콘드리아 기능(24)을 변화시키는 것으로 기술되었는데, 이는 신장 질환 및 신독성을 조사하거나 신장 오가노이드를 사용하여 약물 발견을 수행할 때 바람직하지 않을 수 있다. 따라서 우리는 오가노이드 신장 세포의 생체 유사 대사 상태에서보다 촉진하기 위해 프로토콜에서 포도당 수준을 감소 시켰습니다. 결과적으로, 신장 오가노이드 분석에 대한 변형은 단순성을 유지하면서 일관되고 강력한 프로토콜을 제공합니다.
신장 오가노이드는 미성숙하고, 연장된 배양(>20일)은 앞서 기술한 바와 같이 프로섬유성 및 비신장 세포 유형의 발생률을 5,25로 유도할 수 있고, 건강한 인간 신장 조직을 덜 대표하는 오가노이드를 남긴다. 우리의 경험에 비추어 볼 때, 신장 오가노이드가 가장 건강했던 최적의 치료 기간은 14-18 일 사이입니다. 상기와 같은 스피너 플라스크 및 다중 웰 마그네틱 교반기의 사용은 정적 배양21,26과는 반대로 균일한 영양소 이용가능성을 향상시킬 것이다. 쉐이커 또는 자기 교반기와 같은 현탁 배양을 위한 장비를 사용할 수 없는 경우, 이 프로토콜은 정적 배양에서 초저 부착 플레이트에서 완전히 수행될 수 있다. 그러나 배아체 / 오가노이드 병합의 발생률이 증가하여 저산소증으로 인해 괴사 성 코어가있는 대형 표본으로 이어질 수 있습니다. 500 μm보다 큰 임의의 오가노이드는 기술된 세포 스트레이너를 사용하여 제거될 수 있다. 이러한 경우 오가노이드가 병합 될 가능성을 줄이려면 6 웰 당 100 개 이상의 오가노이드를 시드하지 않는 것이 좋습니다. 또한, 먹이를 먹은 후, 오가노이드는 플레이트와 함께 그림 여덟 가지 동작을 수행하여 고르게 분포되어야합니다.
유기체 형성의 낮은 효율 (<50 %)이 관찰 될 수있다. 이는 일반적으로 hPSC 배양물이 표준 통과 중에 높은 컨플루언시(>80%)에 도달했을 때 발생합니다. hPSC 유지가 일관되고 세포가 과도하게 합류하지 않도록하는 것이 중요합니다. 높은 합류성 및 일관성 없는 패시징 기술은 또한 자발적인 분화 및 증가된 세포 사멸로 이어질 수 있다. hPSC 배양물에 분화가 존재하는 경우, 분석을 시작하기 전에 세포 집단의 5%를 초과하지 않는 경우 미세 피펫 팁으로 흡입하여 분화된 영역을 제거하는 것이 좋습니다. 분화 영역이 5%를 초과하면 새로운 분석을 시작하기 전에 hPSC의 새 배치를 해동하고 적어도 한 번 분할하는 것이 좋습니다.
우리는 일부 hPSC 라인이 심장 또는 신경 조직과 같은 비 신장 세포 유형을 형성하는 경향이 더 쉽다는 것을 관찰했습니다. 이런 일이 발생하면 세포 스트레이너를 사용한 크기 여과는 비 신장 파생물을 포함하는 오가노이드를 제거하는 데 도움이 될 수 있습니다. 대안적으로, hPSC 배지 및/또는 매트릭스를 변경시키는 것은 비신장 증식을 감소시키는데 도움이 될 수 있다. 우리의 경험에 비추어 볼 때, 최소 성분을 포함하는 대체 hPSC 배지 및 vitronectin과 같은 BME는보다 엄격한 다능성 틈새 시장을 제공하여보다 균질 한 hPSC 문화를 생성하는 데 도움이됩니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 국립 보건원 R01 DK069403, UC2 DK126122 및 P30-DK079307 및 ASN 신장 연구 재단 Ben J. Lipps Research Fellowship Program에서 AP에 자금을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Thermo Fisher | 21-985-023 | |
| Anti-adherence rinsing solution | STEMCELL Technologies | 7010 | |
| CHIR99021 | STEMCELL Technologies | 72054 | 10 mM stock in DMSO |
| Corning disposable spinner flasks | Fisher Scientific | 07-201-152 | |
| Corning Ultra-Low Attachment 6-well plates | Fisher Scientific | 07-200-601 | |
| Corning Slow-Speed Stirrers | Fisher Scientific | 11-495-03 | Multi plate magnetic stirrer for spinner flask culture |
| Dispase | STEMCELL Technologies | 7923 | Aliquot and freeze |
| DMEM, low glucose, pyruvate, no glutamine, no phenol red | Thermo Fisher | 11054020 | |
| DPBS 1x, no calcium, no magnesium | Thermo Fisher | 14-190-250 | |
| Egg / Oval Stirring Bars | 2mag | PI20106 | |
| Excelta General-Purpose Tweezers | Fisher Scientific | 17-456-103 | Keep sterile in the cell culture hood |
| EZBio Single Use Media Bottle, 250mL | Foxx Life Sciences | 138-3211-FLS | Used to make PVA 10% |
| Falcon Standard Tissue Culture Dishes (100 mm) | Thermo Fisher | 08-772E | |
| Fisherbrand Sterile Aspirating Pipet 2mL | Fisher Scientific | 14-955-135 | |
| Fisherbrand Cell Lifters - Cell lifter | Fisher Scientific | 08-100-240 | |
| Fisherbrand Multi Function 3D Rotators | Fisher Scientific | 88-861-047 | Orbital shaker |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413302 | BME. Aliquot on ice and freeze. Another suitable matrix alternative is Matrigel or Cultrex. |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 7174 | GCDR |
| GlutaMAX Supplement | Thermo Fisher | 35-050-061 | L-glutamine supplement. |
| HEPES (1M) | Thermo Fisher | 15-630-080 | |
| Insulin-Transferrin-Selenium-Ethanolamine | Thermo Fisher | 51-500-056 | ITSE |
| KnockOut Serum Replacement - Multi-Species | Thermo Fisher | A3181502 | KOSR. Aliquot and freeze |
| Lipid Mixture 1, Chemically Defined | Millipore-Sigma | L0288-100ML | |
| MEM Non-Essential Amino Acids Solution | Thermo Fisher | 11140-050 | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 500mL | Fisher Scientific | S2GPU05RE | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 250mL | Fisher Scientific | S2GPU02RE | |
| MIXcontrol MTP / Variomag TELEcontrol MTP Control Unit | 2mag | VMF 90250 U | |
| MIXdrive 6 MTP / Variomag TELEdrive 6 MTP Microplate Stirring Drive | 2mag | VMF 40600 | 6MSP |
| MP Biomedicals 7X Cleaning Solution | Fisher Scientific | MP0976670A4 | Tissue culture suitable detergent. Make a 5% solution in water |
| mTeSR1 | STEMCELL Technologies | 85850 | hPSC medium.TeSR-E8, NutriStem XF, and mTeSR Plus medium have also been tested and are suitable alternatives. |
| Nunc 50 mL Conical, Sterile Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| Nunc 15mL Conical Sterile Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| Penicillin-Streptomycin | Thermo Fisher | 15-140-122 | Aliquot and freeze |
| Plasmocin | Invivogen | ant-mpt | Anti-mycoplasma reagent. Aliquot and freeze |
| pluriStrainer® 200 µm | Fisher Scientific | NC0776417 | Cell strainer |
| pluriStrainer® 500 µm | Fisher Scientific | NC0822591 | Cell strainer |
| Poly(vinyl alcohol) 87-90% hydrolyzed (PVA) | Millipore-Sigma | P8136-250G | 10% in DPBS stirring at 98 degrees C until disolves, make in 138-3211-FLS |
| ROCK inhibitor Y-27632 (ROCKi) | STEMCELL Technologies | 72304 | 10 mM stock in DPBS |
| Sterile Disposable Serological Pipets - 10mL | Fisher Scientific | 13-678-11E | |
| Sterile Disposable Serological Pipets - 25mL | Fisher Scientific | 13-678-11 | |
| Sterile Disposable Serological pipette - 5 mL | Fisher Scientific | 13-678-12D | |
| TeSR-E5 | STEMCELL Technologies | 5916 | Serum-free, low protein base medium for E5-ILP |
| Variomag distriBOX 2 Distributor | 2mag | VMF 90512 | If you use more than one MIXdrive |
참고문헌
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communications. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Taguchi, A., et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell. 14 (1), 53-67 (2013).
- Przepiorski, A., et al. A simple bioreactor-based method to generate kidney organoids from pluripotent stem cells. Stem Cell Reports. 11 (2), 470-484 (2018).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communication. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Taguchi, A., Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell. 21 (6), 730-746 (2017).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Howden, S. E., Little, M. H. Generating kidney organoids from human pluripotent stem cells using defined conditions. Methods in Molecular Biology. 2155, 183-192 (2020).
- Tanigawa, S., et al. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. 13 (2), 322-337 (2019).
- Sander, V., et al. Protocol for large-scale production of kidney organoids from human pluripotent stem cells. STAR Protocols. 1 (3), 100150 (2020).
- Ekblom, P., Thesleff, I., Miettinen, A., Saxen, L. Organogenesis in a defined medium supplemented with transferrin. Cell Differentiation. 10 (5), 281-288 (1981).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. Journal of Embryology and Experimental Morphology. 82, 147-161 (1984).
- Freund, C., et al. Insulin redirects differentiation from cardiogenic mesoderm and endoderm to neuroectoderm in differentiating human embryonic stem cells. Stem Cells. 26 (3), 724-733 (2008).
- Nishikawa, M., et al. An optimal serum-free defined condition for in vitro culture of kidney organoids. Biochemistry and Biophysics Research Communication. 501 (4), 996-1002 (2018).
- Oh, J. K., et al. Derivation of induced pluripotent stem cell lines from New Zealand donors. Journal of the Royal Society of New Zealand. , 1-14 (2020).
- Takasato, M., et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nature Cell Biology. 16 (1), 118-126 (2013).
- Lam, A. Q., et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. Journal of American Society of Nephrology. 25 (6), 1211-1225 (2014).
- Bratt-Leal, A. M., Carpenedo, R. L., McDevitt, T. C. Engineering the embryoid body microenvironment to direct embryonic stem cell differentiation. Biotechnology Progress. 25 (1), 43-51 (2009).
- Imasawa, T., et al. High glucose repatterns human podocyte energy metabolism during differentiation and diabetic nephropathy. FASEB Journal. 31 (1), 294-307 (2017).
- Kim, K. A., et al. High glucose condition induces autophagy in endothelial progenitor cells contributing to angiogenic impairment. Biological and Pharmaceutical Bulletin. 37 (7), 1248-1252 (2014).
- Piwkowska, A., Rogacka, D., Audzeyenka, I., Jankowski, M., Angielski, S. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes. Journal of Cellular Biochemistry. 112 (6), 1661-1672 (2011).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Lei, X., Deng, Z., Duan, E. Uniform embryoid body production and enhanced mesendoderm differentiation with murine embryonic stem cells in a rotary suspension bioreactor. Methods in Molecular Biology. , (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유