Method Article
طريقة مبسطة لتوليد عضويات الكلى من الخلايا الجذعية البشرية متعددة القدرات
In This Article
Summary
هنا نصف بروتوكولا لتوليد عضويات الكلى من الخلايا الجذعية البشرية متعددة القدرات (hPSCs). يولد هذا البروتوكول عضويات الكلى في غضون أسبوعين. يمكن استزراع عضويات الكلى الناتجة في قوارير دوارة واسعة النطاق أو لوحات تحريك مغناطيسية متعددة الآبار لنهج اختبار الأدوية المتوازية.
Abstract
وقد وفرت المواد العضوية الكلى المتولدة من hPSCs مصدرا غير محدود للأنسجة الكلوية. تعد عضويات الكلى البشرية أداة لا تقدر بثمن لدراسة أمراض الكلى والإصابات ، وتطوير العلاجات القائمة على الخلايا ، واختبار علاجات جديدة. لمثل هذه التطبيقات ، هناك حاجة إلى أعداد كبيرة من المواد العضوية الموحدة والفحوصات القابلة للتكرار للغاية. لقد بنينا على بروتوكول الكلى العضوي المنشور سابقا لتحسين الصحة العامة للعضويات. يتضمن هذا البروتوكول ثلاثي الأبعاد البسيط والقوي تكوين أجسام جنينية موحدة في الحد الأدنى من وسط المكونات الذي يحتوي على الدهون ، وملحق الأنسولين - ترانسفيرين - السيلينيوم - الإيثانولامين وكحول البولي فينيل مع مثبط GSK3 (CHIR99021) لمدة 3 أيام ، تليها الثقافة في وسط يحتوي على استبدال المصل بالضربة القاضية (KOSR). بالإضافة إلى ذلك ، تسمح الفحوصات التحريضية بتقليل تكتل الأجسام الجنينية والحفاظ على حجم موحد ، وهو أمر مهم لتقليل التباين بين المواد العضوية. بشكل عام ، يوفر البروتوكول طريقة سريعة وفعالة وفعالة من حيث التكلفة لتوليد كميات كبيرة من المواد العضوية في الكلى.
Introduction
في السنوات الأخيرة ، تم تطوير عدد من البروتوكولات للتمييز بين الخلايا الجذعية البشرية متعددة القدرات في الكلى العضوية1،2،3،4،5. وقد وفرت عضويات الكلى أداة هامة للمساعدة في البحث في نهج الطب التجديدي الجديدة، والأمراض المرتبطة بالكلى النموذجية، وإجراء دراسات السمية وتطوير الأدوية العلاجية. على الرغم من قابليتها للتطبيق على نطاق واسع ، فإن المواد العضوية الكلوية لها قيود مثل نقص النضج ، وقدرة الثقافة المحدودة على المدى الطويل في المختبر ، وندرة العديد من أنواع الخلايا الموجودة في الكلى البشرية6،7،8. وقد ركزت الأعمال الأخيرة على تحسين مستوى النضج العضوي ، وتمديد فترات الثقافة وتوسيع تعقيد مجموعات خلايا الكلى من خلال تعديل البروتوكولات الحالية9،10،11،12. في هذا التكرار الحالي لبروتوكولنا المعمول به 5,13 ، قمنا بتعديل المكونات المتوسطة في المرحلة الأولى من البروتوكول إلى وسط أساسي خال من المصل مكمل بالأنسولين - ترانسفيرين - السيلينيوم - الإيثانولامين (ITSE) ، والدهون ، وكحول البولي فينيل (E5-ILP) و CHIR99021 (الشكل 1). توفر هذه التغييرات وسيطا محددا بالكامل وخاليا من المصل ومنخفض البروتين ، مع مكونات أقل من تركيبتنا المتوسطة السابقة 5,13 وبدون عوامل نمو إضافية. ونتيجة لذلك، فإن وسيط المرحلة الأولى أقل كثافة في العمالة للتحضير من نسختنا المنشورة سابقا، وقد يقلل من التباين من دفعة إلى أخرى5. وقد أظهرت الدراسات السابقة أن كلا من الأنسولين والترانسفيرين مهمان في الثقافة الخالية من المصل 14,15 ، ومع ذلك ، يمكن أن تكون المستويات العالية من الأنسولين مثبطة لتمايز الأديم المتوسط16. لقد حافظنا على مستويات الأنسولين المنخفضة كما هو منصوص عليه في البروتوكول الأصلي ، وخفضنا مستويات KOSR (التي تحتوي على الأنسولين) في المرحلة الثانية من الفحص. تمشيا مع البروتوكولات الأخرى لتشكيل الكلى العضوية، وانخفاض مستويات KOSR مفيدة للحفاظ على التوازن بين انتشار والتمايز من أنسجة الكلى17. بالإضافة إلى ذلك ، قمنا بخفض تركيز الجلوكوز في المرحلة الثانية المتوسطة13.
تصف طريقتنا إعدادا لفحص تعليق المواد العضوية في الكلى ، مما ينتج عنه ما يصل إلى ~ 1000 مادة عضوية من لوحة زراعة hPSC 100 مم الأولية المتقاربة بنسبة 60٪ كما هو موضح في المنشور الأصلي 5,13. يمكن توسيع نطاق هذا البروتوكول بسهولة حتى يبدأ بألواح متعددة مقاس 100 مم أو 150 مم لزيادة أعداد المواد العضوية.
Protocol
وأجريت جميع التجارب باستخدام مركبات الوقاية البشرية البشرية امتثالا للمبادئ التوجيهية المؤسسية، وأجريت في غطاء للسلامة الأحيائية من الفئة الثانية مع معدات الحماية الشخصية المناسبة. جميع الكواشف هي من الدرجة المستزرعة الخلوية ما لم ينص على خلاف ذلك. يتم احتضان جميع الثقافات عند 37 درجة مئوية ، 5٪ CO2 الغلاف الجوي الجوي. في جميع مراحل الفحص ، يمكن جمع الأجسام الجنينية أو عضويات الكلى ، وتثبيتها أو إعدادها للتحليل. تم تمييز خطوط hPSC المستخدمة لتوليد هذه البيانات بالكامل ونشرها18.
1. إعداد لوحات الثقافة
ملاحظة: قبل 1 ساعة تقريبا من تقسيم hPSCs ، قم بتغطية ألواح زراعة الأنسجة مقاس 2 × 100 مم بمستخلص مصفوفة غشاء سفلي مؤهل للخلايا الجذعية (BME). يمكن للمرء أن يغلف الألواح مسبقا ، ويغلقها بفيلم بارافين ويخزنها عند 4 درجات مئوية وفقا لتعليمات الشركات المصنعة.
- قم بإعداد ألواح معالجة بزراعة الأنسجة مقاس 2 × 100 مم (1 لفحص الكلى العضوي ، 1 للحفاظ على خط الخلية) وأنبوب مخروطي بسعة 15 مل في غطاء السلامة الأحيائية من الفئة الثانية.
- Aliquot 8 مل من وسط النسر المعدل البارد الخالي من المصل من Dulbecco (DMEM) في أنبوب مخروطي 15 مل و ~ 4 مل في كل لوحة من لوحات 100 مم ، وهو ما يكفي لتغطية الجزء السفلي من كل لوحة بمتوسط.
- خذ 100 ميكرولتر من BME من الفريزر (-20 درجة مئوية). باستخدام ماصة مصلية 2 مل ، خذ ~ 1 مل من DMEM البارد من الأنبوب المخروطي 15 مل. قم بإذابة أليكوت BME ببطء عن طريق السحب بلطف لأعلى ولأسفل باستخدام DMEM البارد ، وتجنب صنع الفقاعات.
ملاحظة: لا تدع BME aliquot يجلس في درجة حرارة الغرفة. يستخدم على الفور. - انقل DMEM/BME المذاب مرة أخرى إلى الأنبوب المخروطي سعة 15 مل مع DMEM المتبقي. باستخدام ماصة مصلية سعة 10 مل ، امزج BME المخفف بلطف عن طريق السحب لأعلى ولأسفل 8 مرات على الأقل لتفريق BME بالتساوي ، وتجنب صنع الفقاعات.
- انقل 4 مل من BME المخفف إلى كل لوحة باستخدام DMEM وقم بتدوير اللوحة بلطف بحيث يتم توزيع BME بالتساوي. احتضن اللوحة المطلية لمدة 1 ساعة في درجة حرارة الغرفة أو 30 دقيقة عند 37 درجة مئوية.
ملاحظة: استخدم 50 ميكرولتر من BME لكل لوحة 100 مم. قد يتطلب استخدام وسائط زراعة hPSC الأخرى وخطوط الخلايا تركيزات مختلفة من BME.
2. تمرير hPSCs
ملاحظة: بالنسبة لزراعة hPSC الروتينية، تمر خطوط الخلايا عند التقاء 70-80٪.
- استنشاق وسط الثقافة من لوحة hPSC المراد تمريرها. أضف ~ 8 مل من محلول دولبيكو الملحي المخزن بالفوسفات (DPBS) إلى لوحة hPSC وقم بالدوران بلطف لغسل الخلايا.
- قم بشفط DBPS وأضف 2 مل من كاشف تفكك الخلايا اللطيف (GCDR) إلى لوحة 100 مم ، قطرة بقطرة في الأعلى لتغطية الخلايا.
ملاحظة: يمكن أيضا استخدام كواشف تفكك أخرى. اضبط وفقا لذلك. - احتضن في درجة حرارة الغرفة لمدة 6-8 دقائق تقريبا حتى تتفكك المستعمرات وتنكسر الخلايا تحت تباين الطور (الشكل 2A).
ملاحظة: قد يختلف التوقيت بين خطوط الخلايا. اضبط وفقا لذلك. - أثناء الحضانة ، قم بإعداد أنبوب مخروطي 50 مل. أضف 16 مل من وسط hPSC (8 مل لكل لوحة 100 مم) وأضف مثبط كيناز المرتبط ب Rho (ROCKi) إلى تركيز نهائي قدره 5 ميكرومتر.
- قم بشفط DMEM من الألواح المطلية ب BME ، وأضف 8 مل من وسط hPSC بالإضافة إلى ROCKi إلى كل لوحة.
- عندما تكون الخلايا جاهزة (كما هو موضح في النقطة 2.3 ، الشكل 2A) ، قم بشفط GCDR وإمالة اللوحة ~ 45 درجة نحو المجرب وكشط الخلايا باستخدام رافع الخلايا.
ملاحظة: إذا كانت الخلايا تقوم بفك الارتباط، فاحذف GCDR الطموح وتابع. - أدر اللوحة ~ 90 درجة وكشط مرة أخرى لرفع الخلايا المتبقية. حافظ على اللوحة ~ 45 درجة واغسل الخلايا ب 3 مل من وسط hPSC باستخدام ماصة مصلية 10 مل.
- ماصة بلطف لأعلى ولأسفل لتفتيت كتل كبيرة (لا تزيد عن 2-3 مرات) وزرع الخلايا في النسبة المناسبة لخط الخلية من الاهتمام على الألواح المعدة. ضع الصفيحة مع الخلايا في الحاضنة وحرك الصفيحة بلطف في الشكل ثماني حركات لتوزيع الخلايا بالتساوي.
ملاحظة: في هذه التجربة، تم تقسيم خطوط hPSC بنسبة 1:5، وقد يختلف ذلك باختلاف خطوط الخلايا وظروفها الأخرى. اترك الطبق دون إزعاج طوال الليل. - بعد ~ 24 ساعة ، افحص الخلايا بحثا عن المرفق. ابحث عن مستعمرات فردية صغيرة مرفقة. استنشق الوسط المستهلك وقم بتجديده باستخدام 8 مل من وسط hPSC الطازج (بدون إضافة ROCKi).
- استمر في المراقبة والتغذية يوميا حتى تصل الخلايا إلى التقاء ~ 60٪ لبدء فحص الكلى العضوي (عادة ما يصل إلى 48 إلى 72 ساعة بعد المرور). من الناحية المثالية ، ستكون المستعمرات منفصلة ولا تندمج (الشكل 2 ب).
ملاحظة: من المهم جدا الحد من الخلايا إلى ما لا يزيد عن 80٪ من الالتقاء من أجل الحفاظ على حالة تعدد القدرات. قد تؤدي الثقافات المتقاربة أو التعامل الخشن أو الممرات الأعلى إلى تمايز تلقائي غير مرغوب فيه أو انخفاض كفاءة تكوين الكلى العضوية.
3. اليوم 0 - إعداد فحص الكلى العضوي
- قبل البدء ، قم بإعداد كل من وسائط E5-ILP والمرحلة الثانية وفقا للصيغ (الجدول 1 والجدول 2).
ملاحظة: يمكن تخزين الوسائط لمدة تصل إلى 14 يوما عند 4 درجات مئوية. - لفحص عضوي واحد للكلى (هناك حاجة إلى لوحة زراعة واحدة 100 مم للوحة واحدة من 6 آبار) ، قم بإعداد وسط E5-ILP كامل في أنبوب مخروطي 50 مل: 18 مل من E5-ILP مكملة ب 8 ميكرومتر CHIR99021 (14.4 ميكرولتر) ، 3.3 ميكرومتر ROCKi (6 ميكرولتر) ، 0.1 مللي متر بيتا ميركابتوإيثانول (32.7 ميكرولتر).
- ضع 2 مل من وسط E5-ILP الكامل في كل بئر من لوحة مرفق 6 عالية الانخفاض.
- اغسل hPSCs عند التقاء ~ 60٪ (الشكل 2B) مرتين مع ~ 8 مل من DPBS. ثم يضيف الشفط DPBS 2 مل من dispase لكل لوحة 100 مم ، قطرة قطرة لتغطية الخلايا واحتضان لمدة 6 دقائق عند 37 درجة مئوية.
ملاحظة: بعد 6 دقائق ، ستبدأ حواف المستعمرات في الالتفاف (الشكل 2C ، الأسهم الحمراء) بينما تظل بقية المستعمرة متصلة. إذا لم يتم الحصول على هذا بعد 6 دقائق ، ضع الخلايا مرة أخرى في الحاضنة لمدة 30 ثانية إضافية. قد لا تكون وسائط ومصفوفة hPSC الأخرى متوافقة مع هذا التوقيت. طلاء BME القائم على Laminin غير متوافق مع dispase. إذا كان BME القائم على اللامينين هو مصفوفة hPSC القياسية ، فقم بتغطية إحدى اللوحات في القسم 1 باستخدام BME الموصوف في هذه الطريقة لاستخدامها في فحص الكلى العضوي. - غسل الخلايا 3x مع ~ 10 مل من DPBS. ثم يقوم Aspirate DPBS بإمالة اللوحة ~ 45 درجة وكشطها باستخدام رافع خلوي.
ملاحظة: لا يتم إلغاء تنشيط Dispase ، وبالتالي يجب غسله جيدا. لا تقلل من عدد الغسيل. - اغسل المستعمرات من الأعلى ب 6 مل من وسط E5-ILP الكامل باستخدام ماصة مصلية سعة 10 مل. ماصة لأعلى ولأسفل بلطف لتفتيت أي مستعمرات كبيرة (2 أو 3 مرات عادة ما تكون كافية).
- قم بتوزيع مجموعات المستعمرة بالتساوي عن طريق إضافة 1 مل لكل بئر في لوحة 6 آبار. ضع الصفيحة على شاكر مداري (الإعدادات: مدارية = 30 ، متبادلة = 330 درجة ، اهتزاز = 5 درجات - 2 ثانية) يتم وضعها في الحاضنة 37 درجة مئوية (الشكل 2D).
ملاحظة: ميزة الاهتزاز مهمة للتوزيع الكافي للمواد العضوية ومنع التكتل.
4. اليوم 2 - التغذية عن طريق تغيير نصف متوسط
ملاحظة: خلال 48 ساعة ، ستشكل مجموعات المستعمرات أجساما جنينية.
- تحضير الوسط الكامل: للحصول على لوحة واحدة من 6 آبار ، قم بإعداد 12 مل من وسط E5-ILP + 8 ميكرومتر CHIR99021 في أنبوب مخروطي 15 مل.
ملاحظة: بيتا ميركابتوإيثانول وروكي غير مطلوبين. - دع الأجسام الجنينية تستقر في الجزء السفلي من اللوحة ، وقم بإمالة اللوحة ~ 45 درجة ثم استطلع الوسط ببطء من الأعلى ، واترك ~ 1 مل لكل بئر.
ملاحظة: تتجمع الأجسام الجنينية في هذه المرحلة بسرعة. لا تتركهم ليستقروا لمدة > 5 دقائق. - أضف 2 مل من الوسط الكامل المحضر (القسم 4.1) لكل بئر. أعد الطبق مرة أخرى إلى الخلاط.
5. اليوم الثالث - نقل الأجسام الجنينية إلى المرحلة الثانية المتوسطة
- تحضير أنبوب مخروطي 50 مل و DMEM (انخفاض الجلوكوز). دع الأجسام الجنينية تستقر في الجزء السفلي من اللوحة. إمالة اللوحة ~ 45 درجة وشفط الوسط من الأعلى ببطء ، وترك ~ 1 مل لكل بئر.
- جمع جميع الأجسام الجنينية بعناية من كل بئر باستخدام ماصة مصلية 10 مل ونقلها إلى أنبوب مخروطي 50 مل.
- اغسل كل بئر لجمع أي أجسام جنينية متبقية مع ~ 1 مل من DMEM (نسبة منخفضة من الجلوكوز) وأضفها إلى نفس الأنبوب المخروطي 50 مل.
- اترك الأجسام الجنينية لتستقر في قاع الأنبوب ، ~ 5 دقائق. أثناء الانتظار ، أضف 2 مل من المرحلة الثانية المتوسطة إلى كل بئر من لوحة 6 آبار. انزع الأجسام الجنينية الكبيرة (>300 ميكرومتر) باستخدام مصفاة خلية 200 ميكرومتر (الشكل 2E).
- استخدم أنبوبا مخروطيا جديدا سعة 50 مل وضع مصفاة الخلايا سعة 200 ميكرومتر في الأعلى. ماصة جميع الأجسام الجنينية باستخدام ماصة مصلية 10 مل بعناية فوق مصفاة الخلية.
- شطف مصفاة الخلية مع ~ 5 مل إضافية من DMEM (انخفاض الجلوكوز) لجمع أي أجسام جنينية عالقة في مصفاة الخلية. اسمح للأجسام الجنينية بالاستقرار في قاع الأنبوب المخروطي.
- عندما يتم تسوية الأجسام الجنينية ، قم بشفط supernatant واغسله ب ~ 10 مل من DMEM (انخفاض الجلوكوز).
- شفط DMEM وإعادة تعليق الأجسام الجنينية في 6 مل من المرحلة الثانية المتوسطة.
- انقل الأجسام الجنينية مرة أخرى إلى لوحة التعلق 6 عالية الانخفاض للغاية ، وقم بتوزيعها بالتساوي بين الآبار ال 6.
- قم بإجراء تغييرات نصف متوسطة كما هو موضح في الخطوتين 4.2 و 4.3 كل يومين.
ملاحظة: من اليوم 3 فصاعدا، سيكون للأجسام الجنينية مظهر كروي "ذهبي" وسلس (الشكل 2F). من اليوم 6 ~ ، سيصبح تكوين النبيب في الأجسام الجنينية الفردية واضحا ، مع زيادة الأعداد خلال الأيام التالية التي تصل إلى الأعداد المثلى والنمو بحلول اليوم 14 (الشكل 2G ، H). للقضاء على تشكل التكتل العرضي ، عند مراقبة بصريا للعضويات الكلوية ، أو الأجسام الجنينية الصغيرة جدا بدون أنابيب ، قم بغربلة <200 و >500 ميكرومتر العضوية الكبيرة مع مصافي خلايا 500 و 200 ميكرومتر كما هو موضح في الخطوتين 5.4.1 و 5.4.2.
6. نقل إلى قارورة الدوار والتغذية
ملاحظة: يمكن استخدام قارورة دوارة في أي وقت من اليوم 3 فصاعدا للتجارب التي تتطلب أعدادا كبيرة من المواد العضوية. يحدث النقل الروتيني للعضويات في مختبرنا بين الأيام 6-8. يرجى الاطلاع على قسم المناقشة للاطلاع على البدائل في حالة عدم توفر المعدات.
- انقل الأجسام الجنينية إلى قارورة دوارة سعة 125 مل مع 45 مل من وسط المرحلة الثانية. اضبط سرعة التحريك المغناطيسي على 120 دورة في الدقيقة وضعها في الحاضنة (الشكل 2I).
- لإطعام الأجسام الجنينية أو عضويات الكلى ، دع عضويات الكلى تستقر لفترة وجيزة في الجزء السفلي من قارورة الغزل. ارفع الغطاء من ذراع جانب واحد من القارورة وضع ماصة الشفط في الداخل ، مع لمس الطرف للجدار الداخلي المعاكس.
- قم بزاوية ماصة الشفط ببطء لأسفل وقم بشفط ما يقرب من نصف الوسط. قم بتجديده ب 20 مل من وسط المرحلة الثانية الطازج عن طريق سحبه من خلال نفس الفتحة.
7. إعداد لوحة تحريك مغناطيسية 6 آبار (6MSP)
ملاحظة: يمكن استخدام تنسيق 6MSP بدلا من قوارير الدوار إذا كانت هناك حاجة إلى اختبار شروط متعددة. استخدم 6MSP للعلاجات المركبة أو الكلوية. هذا يوفر كمية الوسط المستخدمة في المرحلة الثانية مع الحفاظ على توافر المغذيات من خلال الانتشار.
- نظف قضبان التحريك المغناطيسية البيضاوية في أنبوب مخروطي سعة 50 مل عن طريق الغسيل في منظف مناسب لزراعة الأنسجة لفترة وجيزة (إذا لم يتم استخدامه أبدا) أو انقعه لمدة > 1 ساعة إذا تم استخدامه مسبقا.
- اغسل لفترة وجيزة 3x في DPBS معقمة.
- اغسل 1x لمدة 5 دقائق في 70٪ من الإيثانول ، 1x في DPBS المعقمة.
- شطف بمحلول مضاد للالتصاق وغسل 1x في DPBS معقمة والشفط.
- بعناية ، باستخدام ملقط معقم طويل ، ضع قضيب تحريك مغناطيسي واحد في كل بئر من صفيحة 6 آبار مع أجسام جنينية أو عضويات كلوية.
- ضع اللوحة على 6MSP واضبط السرعة على 120 دورة في الدقيقة (الشكل 2J). الحفاظ على عضويات الكلى مع نصف تغيير متوسط وفقا للقسم 4.2 و 4.3.
ملاحظة: لكي تستقر قضبان التحريك المغناطيسي في موضعها وتبدأ في الدوران ، قد تحتاج أولا إلى وضع مستوى الطاقة إلى 100 لفترة وجيزة ، ثم بمجرد أن تدور جميعها ، قم بخفض مستوى الطاقة إلى 25.
النتائج
في هذا الإصدار الأحدث من بروتوكولنا ، يبدأ التمايز العضوي للكلية في وسط محدد منخفض البروتين. يتم إجراء الفحوصات بالكامل في تعليق وتعتمد على القدرة الفطرية لتمايز hPSCs وتنظيمها لبدء تكوين الأنبوب. فحص واحد ينشأ من 100 مم ~ 60٪ لوحة ثقافة hPSC متقاربة تنتج بشكل روتيني 500-1000 من عضويات الكلى ، كما هو موضح في منشورنا السابق5. بسبب هذه الأعداد الكبيرة من المواد العضوية المتولدة ، فإن هذا البروتوكول مناسب تماما للاختبار المركب. نحن نستخدم بشكل روتيني تنسيق 6 آبار للاختبار المركب ومع ذلك ، يمكن بسهولة توسيع نطاق هذا البروتوكول في المرحلة الثانية (اليوم 3 فصاعدا) إلى تنسيقات أخرى متعددة الآبار لاختبار مركب عالي الإنتاجية. يظهر التألق المناعي لأقسام البارافين وجود شرائح النيفرون في المواد العضوية ، أي الأنابيب الكلوية التي تعبر عن العامل النووي لخلايا الكبد -1 بيتا (HNF1B) و Lotus Tetragonolobus Lectin (LTL) (الشكل 3A - HNF1B ، LTL) ، ومجموعات الخلايا البودوسية التي تعبر عن الساركوما الليفية العضلية العصبية V-maf المتجانسة الجينية B (MAFB) والنيفرين (NPHS1) (الشكل 3A - MAFB ، الشكل 3B - NPHS1). علاوة على ذلك ، يمكن أن تدعم التعديلات في هذا البروتوكول توسع الخلايا البطانية كما هو موضح في الشكل 3B الذي يظهر تلطيخا بالصفائح الدموية وجزيء التصاق الخلايا البطانية 1 (PECAM1) في اليوم 26 من الثقافة.
| الكاشف | الأسهم conc. | العمل كونك. | المبلغ لكل 250 مل |
| تي إس آر-إي ٥ | ن / أ | ن / أ | 238.48 مل |
| بي في إيه | 10% | 0.25% | 6.25 مل |
| القلم العقدي | 100x | 1x | 2.5 مل |
| ITSE | 100x | 0.1x | 250 ميكرولتر |
| الدهون المعرفة كيميائيا | 100x | 1x | 2.5 مل |
| البلازموسين | 25 ملغم/مل | 2.5 ميكروغرام/مل | 25 ميكرولتر |
الجدول 1: تكوين E5-ILP المتوسط. ماصة جميع الكواشف باستثناء الدهون المحددة كيميائيا والكاشف المضاد للميكوبلازما مباشرة في الغرفة العليا من وحدة ترشيح Stericup 0.22 ميكرومتر. بعد الترشيح ، أضف الدهون والكاشف المضاد للميكوبلازما. يخزن في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوعين.
| الكاشف | الأسهم conc. | العمل كونك. | المبلغ لكل 500 مل |
| DMEM (منخفض الجلوكوز) | ن / أ | ن / أ | 417.5 مل |
| كوسر | ن / أ | 10% | 50 مل |
| بي في إيه | 10% | 0.25% | 12.5 مل |
| القلم العقدي | 100x | 1x | 5 مل |
| ميم-نيا | 100x | 1x | 5 مل |
| جلوتا ماكس | 100x | 1x | 5 مل |
| هيبس | 100x | 1x | 5 مل |
| البلازموسين | 25 ملغم/مل | 2.5 ميكروغرام/مل | 50 ميكرولتر |
الجدول 2: المرحلة الثانية من التكوين المتوسط. ماصة جميع الكواشف باستثناء والكاشف المضاد للميكوبلازما مباشرة في الغرفة العليا من وحدة ترشيح Stericup 0.22 ميكرومتر. بمجرد تصفيته ، أضف كاشفا مضادا للميكوبلازما. يخزن في درجة حرارة 4 درجات مئوية لمدة تصل إلى أسبوعين.
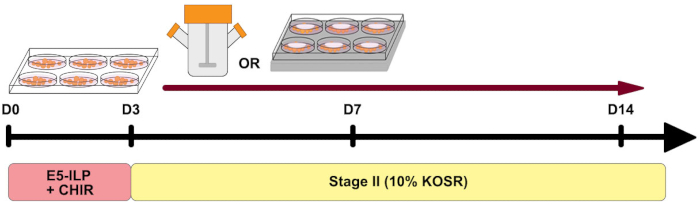
الشكل 1: نظرة عامة على البروتوكول. نظرة عامة تخطيطية على البروتوكول توضح توقيت المرحلتين واستخدام القوارير الدوارة و 6MSP. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
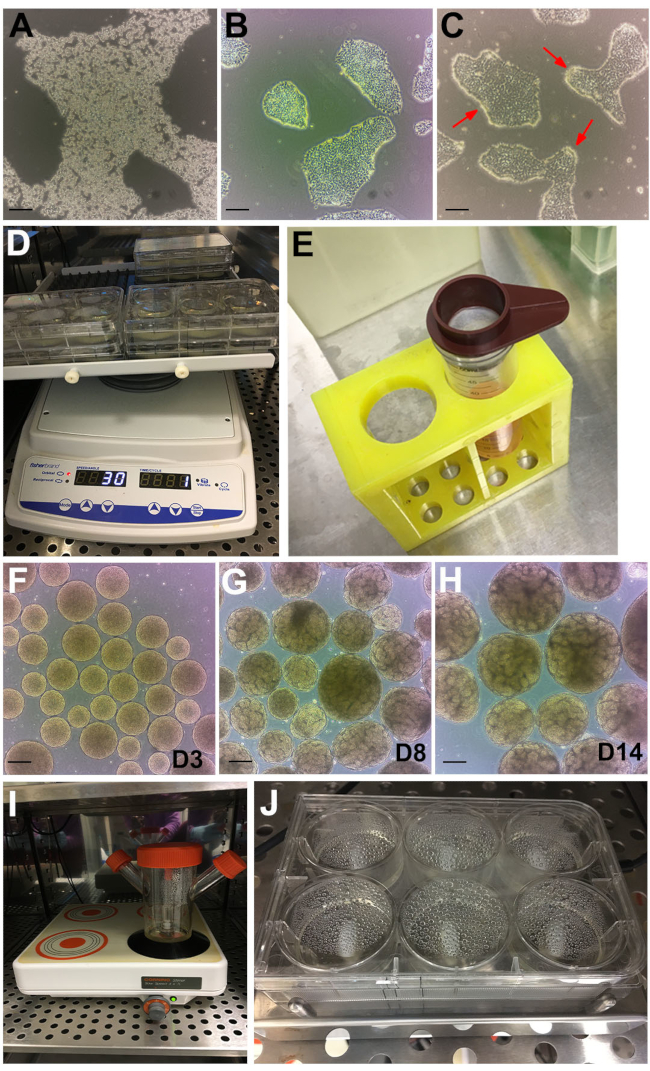
الشكل 2: مراحل البروتوكول . (أ) صورة المجال الساطع لمستعمرة hPSC المعالجة ب GCDR. (ب) الالتقاء الأمثل ، وحجم المستعمرة لبدء فحص الكلى العضوية. (ج) hPSCs تعامل مع dispase لمدة 6 دقائق. تشير الأسهم الحمراء إلى حواف المستعمرات المتجعدة. (د) المقايسات العضوية على شاكر مداري. (ه) استخدام مصفاة خلايا 200 ميكرومتر لغربلة الأجسام الجنينية الكبيرة. (و) الأجسام الجنينية في اليوم 3 (D3) قبل الانتقال إلى المرحلة الثانية المتوسطة. (ز) يمكن ملاحظة ظهور تكوين النبيب في اليوم 8 (D8) و (H) النقطة الزمنية المثلى لحصاد وعلاج المواد العضوية في اليوم 14 (D14). (I) قارورة دوارة تستخدم للاستزراع السائب على لوحة مغناطيسية متعددة المواقع. (ي) الفحص على صفيحة تحريك مغناطيسية متعددة الآبار. أشرطة المقياس ، 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: النتائج المتوقعة. (أ) صور تمثيلية متحدة البؤرة لأقسام البارافين المسماة بالفلورسنت المناعي من اليوم 14 من عضويات الكلى التي تظهر تلطيخا إيجابيا لظهارة النبيب (HNF1B و LTL) ومجموعات الخلايا البودوسية (MAFB). (ب) اليوم 26 أقسام الكلى العضوية الموسومة لمجموعات podocyte (NPHS1) والخلايا البطانية (PECAM1). قضبان المقياس ، 100 ميكرومتر (A) ؛ 200 ميكرومتر (B). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
وقد أظهرت الدراسات السابقة أن خطوات البروتوكول الأولية حاسمة لتمايز الأديم المتوسطالوسيط 5،19،20 ، وبالتالي ، من الضروري تنفيذ تركيبة متوسطة صارمة في هذه المرحلة. قد تساعد إزالة المكونات غير المحددة مثل المصل والألبومين ووسط التهجين الخالي من البروتين II من المرحلة الأولى من البروتوكول على تحسين كفاءة التمايز المتسقة بين المقايسات21.
الحالة الأيضية لخلايا الكلى أمر بالغ الأهمية لوظيفتها ، ويمكن أن تؤدي تغيرات الجلوكوز إلى تغيير الحالة الأيضية22. وقد وصفت الدراسات السابقة أن المستويات العالية من الجلوكوز (حتى 25 ملليمتر) يمكن أن تحفز خلل الخلايا البطانية وتغير النمو والقدرة المؤكسدة لخلايا الكلى22،23،24. كما تم وصف مستويات عالية من الجلوكوز لتغيير وظيفة الميتوكوندريا24 ، والتي قد تكون غير مواتية عند التحقيق في أمراض الكلى والسمية الكلوية أو إجراء اكتشاف الأدوية باستخدام عضويات الكلى. لذلك ، قمنا بتخفيض مستوى الجلوكوز في بروتوكولنا لتعزيز حالة التمثيل الغذائي الأكثر شبها بالجسم الحي لخلايا الكلى العضوية. ونتيجة لذلك ، توفر التعديلات على فحص الكلى العضوي بروتوكولا متسقا وقويا ، مع الحفاظ على بساطته.
عضويات الكلى غير ناضجة ، وقد تؤدي الثقافة الموسعة (>20 يوما) إلى حدوث أنواع الخلايا المؤيدة للتليف وغير الكلوي كما هو موضح سابقا 5,25 ، مما يترك المواد العضوية أقل تمثيلا لأنسجة الكلى البشرية السليمة. بناء على تجربتنا ، فإن نافذة العلاج المثلى ، حيث تكون المواد العضوية في الكلى في أفضل حالاتها الصحية هي بين الأيام 14-18. إن استخدام القوارير الدوارة وآلات التقليب المغناطيسية متعددة الآبار كما هو موضح أعلاه سيعزز توافر المغذيات الموحدة بدلا من الثقافة الثابتة21,26. إذا لم تكن معدات ثقافة التعليق مثل الخلاط أو التقليب المغناطيسي متوفرة ، فلا يزال من الممكن تنفيذ هذا البروتوكول بالكامل في لوحات المرفقات المنخفضة للغاية في الثقافة الثابتة. ومع ذلك ، قد يكون هناك زيادة في حدوث الأجسام الجنينية / الاندماج العضوي ، مما يؤدي إلى عينات كبيرة ذات نوى نخرية بسبب نقص الأكسجة. يمكن إزالة أي عضويات أكبر من 500 ميكرومتر باستخدام مصافي الخلايا الموصوفة. لتقليل فرصة دمج المواد العضوية في تلك الحالات ، نقترح عدم بذر أكثر من 100 مادة عضوية لكل 6 آبار. بالإضافة إلى ذلك ، بعد التغذية ، يجب توزيع المواد العضوية بالتساوي عن طريق أداء حركات الشكل الثامن مع اللوحة.
يمكن ملاحظة كفاءة منخفضة (<50٪) من تكوين العضوية. يحدث هذا عادة عندما تصل ثقافات hPSC إلى التقاء عال (>80٪) أثناء المرور القياسي. من الأهمية بمكان أن تكون صيانة hPSC متسقة ولا تترك الخلايا لتصبح أكثر من اللازم. قد يؤدي الالتقاء العالي وتقنية المرور غير المتناسقة أيضا إلى التمايز التلقائي وزيادة موت الخلايا. إذا كان التمايز موجودا في ثقافة hPSC ، فإننا نوصي بإزالة المناطق المتباينة عن طريق الشفط باستخدام طرف ماصة ناعم إذا لم يتجاوز 5٪ من عدد الخلايا ، قبل بدء الفحص. إذا تجاوزت مناطق التمايز 5٪ ، فإننا نوصي بإذابة دفعة جديدة من hPSCs وتقسيمها مرة واحدة على الأقل قبل البدء في فحص جديد.
لقد لاحظنا أن بعض خطوط hPSC أكثر عرضة لتشكيل أنواع الخلايا غير الكلوية ، مثل الأنسجة القلبية أو العصبية. إذا حدث هذا ، فقد يساعد ترشيح الحجم باستخدام مصافي الخلايا على إزالة تلك المواد العضوية التي تحتوي على نتوءات غير كلوية. بدلا من ذلك ، قد يساعد تغيير وسيط و / أو مصفوفة hPSC على تقليل النمو غير الكلوي. من تجربتنا ، توفر وسائط hPSC البديلة التي تحتوي على الحد الأدنى من المكونات ، و BME مثل vitronectin ، مكانة متعددة القدرات أكثر صرامة وبالتالي تساعد على توليد ثقافات hPSC أكثر تجانسا.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم تمويل هذا البحث من قبل المعاهد الوطنية للصحة R01 DK069403 و UC2 DK126122 و P30-DK079307 ومؤسسة ASN لأبحاث الكلى برنامج زمالة بن ج. ليبس البحثي إلى AP.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Thermo Fisher | 21-985-023 | |
| Anti-adherence rinsing solution | STEMCELL Technologies | 7010 | |
| CHIR99021 | STEMCELL Technologies | 72054 | 10 mM stock in DMSO |
| Corning disposable spinner flasks | Fisher Scientific | 07-201-152 | |
| Corning Ultra-Low Attachment 6-well plates | Fisher Scientific | 07-200-601 | |
| Corning Slow-Speed Stirrers | Fisher Scientific | 11-495-03 | Multi plate magnetic stirrer for spinner flask culture |
| Dispase | STEMCELL Technologies | 7923 | Aliquot and freeze |
| DMEM, low glucose, pyruvate, no glutamine, no phenol red | Thermo Fisher | 11054020 | |
| DPBS 1x, no calcium, no magnesium | Thermo Fisher | 14-190-250 | |
| Egg / Oval Stirring Bars | 2mag | PI20106 | |
| Excelta General-Purpose Tweezers | Fisher Scientific | 17-456-103 | Keep sterile in the cell culture hood |
| EZBio Single Use Media Bottle, 250mL | Foxx Life Sciences | 138-3211-FLS | Used to make PVA 10% |
| Falcon Standard Tissue Culture Dishes (100 mm) | Thermo Fisher | 08-772E | |
| Fisherbrand Sterile Aspirating Pipet 2mL | Fisher Scientific | 14-955-135 | |
| Fisherbrand Cell Lifters - Cell lifter | Fisher Scientific | 08-100-240 | |
| Fisherbrand Multi Function 3D Rotators | Fisher Scientific | 88-861-047 | Orbital shaker |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413302 | BME. Aliquot on ice and freeze. Another suitable matrix alternative is Matrigel or Cultrex. |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 7174 | GCDR |
| GlutaMAX Supplement | Thermo Fisher | 35-050-061 | L-glutamine supplement. |
| HEPES (1M) | Thermo Fisher | 15-630-080 | |
| Insulin-Transferrin-Selenium-Ethanolamine | Thermo Fisher | 51-500-056 | ITSE |
| KnockOut Serum Replacement - Multi-Species | Thermo Fisher | A3181502 | KOSR. Aliquot and freeze |
| Lipid Mixture 1, Chemically Defined | Millipore-Sigma | L0288-100ML | |
| MEM Non-Essential Amino Acids Solution | Thermo Fisher | 11140-050 | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 500mL | Fisher Scientific | S2GPU05RE | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 250mL | Fisher Scientific | S2GPU02RE | |
| MIXcontrol MTP / Variomag TELEcontrol MTP Control Unit | 2mag | VMF 90250 U | |
| MIXdrive 6 MTP / Variomag TELEdrive 6 MTP Microplate Stirring Drive | 2mag | VMF 40600 | 6MSP |
| MP Biomedicals 7X Cleaning Solution | Fisher Scientific | MP0976670A4 | Tissue culture suitable detergent. Make a 5% solution in water |
| mTeSR1 | STEMCELL Technologies | 85850 | hPSC medium.TeSR-E8, NutriStem XF, and mTeSR Plus medium have also been tested and are suitable alternatives. |
| Nunc 50 mL Conical, Sterile Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| Nunc 15mL Conical Sterile Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| Penicillin-Streptomycin | Thermo Fisher | 15-140-122 | Aliquot and freeze |
| Plasmocin | Invivogen | ant-mpt | Anti-mycoplasma reagent. Aliquot and freeze |
| pluriStrainer® 200 µm | Fisher Scientific | NC0776417 | Cell strainer |
| pluriStrainer® 500 µm | Fisher Scientific | NC0822591 | Cell strainer |
| Poly(vinyl alcohol) 87-90% hydrolyzed (PVA) | Millipore-Sigma | P8136-250G | 10% in DPBS stirring at 98 degrees C until disolves, make in 138-3211-FLS |
| ROCK inhibitor Y-27632 (ROCKi) | STEMCELL Technologies | 72304 | 10 mM stock in DPBS |
| Sterile Disposable Serological Pipets - 10mL | Fisher Scientific | 13-678-11E | |
| Sterile Disposable Serological Pipets - 25mL | Fisher Scientific | 13-678-11 | |
| Sterile Disposable Serological pipette - 5 mL | Fisher Scientific | 13-678-12D | |
| TeSR-E5 | STEMCELL Technologies | 5916 | Serum-free, low protein base medium for E5-ILP |
| Variomag distriBOX 2 Distributor | 2mag | VMF 90512 | If you use more than one MIXdrive |
References
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communications. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Taguchi, A., et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell. 14 (1), 53-67 (2013).
- Przepiorski, A., et al. A simple bioreactor-based method to generate kidney organoids from pluripotent stem cells. Stem Cell Reports. 11 (2), 470-484 (2018).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communication. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Taguchi, A., Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell. 21 (6), 730-746 (2017).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Howden, S. E., Little, M. H. Generating kidney organoids from human pluripotent stem cells using defined conditions. Methods in Molecular Biology. 2155, 183-192 (2020).
- Tanigawa, S., et al. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. 13 (2), 322-337 (2019).
- Sander, V., et al. Protocol for large-scale production of kidney organoids from human pluripotent stem cells. STAR Protocols. 1 (3), 100150 (2020).
- Ekblom, P., Thesleff, I., Miettinen, A., Saxen, L. Organogenesis in a defined medium supplemented with transferrin. Cell Differentiation. 10 (5), 281-288 (1981).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. Journal of Embryology and Experimental Morphology. 82, 147-161 (1984).
- Freund, C., et al. Insulin redirects differentiation from cardiogenic mesoderm and endoderm to neuroectoderm in differentiating human embryonic stem cells. Stem Cells. 26 (3), 724-733 (2008).
- Nishikawa, M., et al. An optimal serum-free defined condition for in vitro culture of kidney organoids. Biochemistry and Biophysics Research Communication. 501 (4), 996-1002 (2018).
- Oh, J. K., et al. Derivation of induced pluripotent stem cell lines from New Zealand donors. Journal of the Royal Society of New Zealand. , 1-14 (2020).
- Takasato, M., et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nature Cell Biology. 16 (1), 118-126 (2013).
- Lam, A. Q., et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. Journal of American Society of Nephrology. 25 (6), 1211-1225 (2014).
- Bratt-Leal, A. M., Carpenedo, R. L., McDevitt, T. C. Engineering the embryoid body microenvironment to direct embryonic stem cell differentiation. Biotechnology Progress. 25 (1), 43-51 (2009).
- Imasawa, T., et al. High glucose repatterns human podocyte energy metabolism during differentiation and diabetic nephropathy. FASEB Journal. 31 (1), 294-307 (2017).
- Kim, K. A., et al. High glucose condition induces autophagy in endothelial progenitor cells contributing to angiogenic impairment. Biological and Pharmaceutical Bulletin. 37 (7), 1248-1252 (2014).
- Piwkowska, A., Rogacka, D., Audzeyenka, I., Jankowski, M., Angielski, S. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes. Journal of Cellular Biochemistry. 112 (6), 1661-1672 (2011).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Lei, X., Deng, Z., Duan, E. Uniform embryoid body production and enhanced mesendoderm differentiation with murine embryonic stem cells in a rotary suspension bioreactor. Methods in Molecular Biology. , (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved