Method Article
Упрощенный метод получения органоидов почек из плюрипотентных стволовых клеток человека
В этой статье
Резюме
Здесь мы описываем протокол генерации почечных органоидов из плюрипотентных стволовых клеток человека (hPSCs). Этот протокол генерирует почечные органоиды в течение двух недель. Полученные органоиды почек могут быть культивированы в крупномасштабных колбах спиннера или многолуночных магнитных пластинах перемешивания для параллельных подходов к тестированию лекарств.
Аннотация
Почечные органоиды, полученные из hPSCs, обеспечили неограниченный источник почечной ткани. Органоиды почек человека являются бесценным инструментом для изучения заболеваний и повреждений почек, разработки клеточной терапии и тестирования новых терапевтических средств. Для таких применений необходимо большое количество однородных органоидов и высоковоспроизводимых анализов. Мы опираемся на наш ранее опубликованный протокол органоидов почек для улучшения общего состояния здоровья органоидов. Этот простой, надежный 3D-протокол включает в себя формирование однородных эмбриоидных тел в минимальной компонентной среде, содержащей липиды, добавку инсулин-трансферрин-селен-этаноламин и поливиниловый спирт с ингибитором GSK3 (CHIR99021) в течение 3 дней с последующей культивированием в нокаутирующей сывороточной замещающей среде (KOSR). Кроме того, агитационные анализы позволяют уменьшить слипание эмбриоидных тел и сохранить однородный размер, что важно для снижения изменчивости между органоидами. В целом, протокол обеспечивает быстрый, эффективный и экономически эффективный метод генерации большого количества почечных органоидов.
Введение
В последние годы разработан ряд протоколов дифференциации плюрипотентных стволовых клеток человека в органоиды почек 1,2,3,4,5. Почечные органоиды предоставили важный инструмент для содействия исследованиям новых подходов к регенеративной медицине, моделированию заболеваний, связанных с почками, проведению исследований токсичности и разработке терапевтических препаратов. Несмотря на их широкую применимость, почечные органоиды имеют такие ограничения, как отсутствие созревания, ограниченная долгосрочная культуральная способность in vitro и нехватка нескольких типов клеток, обнаруженных в почках человека 6,7,8. Недавняя работа была сосредоточена на улучшении уровня созревания органоидов, продлении периодов культивирования и расширении сложности популяций клеток почек путем изменения существующих протоколов 9,10,11,12. В данной итерации нашего установленного протокола 5,13 мы модифицировали компоненты среды на первом этапе протокола в безсывороточную базовую среду, дополненную инсулин-трансферрин-селен-этаноламин (ITSE), липидами, поливиниловым спиртом (E5-ILP) и CHIR99021 (рисунок 1). Эти изменения обеспечивают полностью определенную, не содержащую сыворотки, низкобелковую среду, с меньшим количеством компонентов, чем наша предыдущая средняя композиция 5,13 и без дополнительных факторов роста. В результате, среда первой ступени является менее трудоемкой в приготовлении, чем наша ранее опубликованная версия, и может снизить изменчивость от партии к партии5. Предыдущие исследования показали, что как инсулин, так и трансферрин важны в безсыворочной культуре14,15, однако высокие уровни инсулина могут быть ингибирующими дифференцировку мезодермы16. Мы сохранили низкий уровень инсулина, как это предусмотрено в первоначальном протоколе, и еще больше снизили уровни KOSR (содержащего инсулин) на втором этапе анализа. В соответствии с другими протоколами образования органоидов почек, более низкие уровни KOSR полезны для поддержания баланса между пролиферацией и дифференцировкойпочечной ткани 17. Кроме того, мы снизили концентрацию глюкозы в нашей среде стадии II13.
Наш метод описывает установку для суспензионного анализа почечных органоидов, получая до ~1000 органоидов из исходной ~60% сливающейся hPSC 100 мм культуральной пластины, как описано в оригинальной публикации 5,13. Этот протокол может быть легко масштабирован до начала с нескольких пластин 100 мм или 150 мм для дальнейшего увеличения числа органоидов.
протокол
Все эксперименты с использованием гПСК проводились в соответствии с институциональными руководящими принципами и проводились в капюшоне биобезопасности класса II с соответствующими средствами индивидуальной защиты. Все реагенты относятся к клеточной культуре, если не указано иное. Все культуры инкубируются при 37 °C, 5% CO2 в атмосфере воздуха. На всех этапах анализа могут быть собраны эмбриоидные тела или почечные органоиды, зафиксированы или подготовлены к анализу. Линии hPSC, используемые для генерации этих данных, были полностью охарактеризованы и опубликованы18.
1. Подготовка культуральных пластин
ПРИМЕЧАНИЕ: Приблизительно за 1 ч до расщепления гПСК покройте 2 х 100 мм пластины культуры тканей экстрактом матрицы базальной мембраны (BME), сертифицированным стволовыми клетками. Можно предварительно покрыть пластины, запечатать их парафиновой пленкой и хранить при 4 °C в соответствии с инструкциями производителя.
- Подготовьте 2 пластины, обработанные культурой тканей 100 мм (1 для анализа органоидов почек, 1 для поддержания клеточной линии) и коническую трубку объемом 15 мл в капюшоне биобезопасности класса II.
- Aliquot 8 мл холодной, без сыворотки Dulbecco's Modified Eagle Medium (DMEM) в коническую трубку объемом 15 мл и ~ 4 мл в каждую из 100 мм пластин, достаточно, чтобы покрыть дно каждой пластины средой.
- Возьмите из морозильной камеры 100 мкл аликвоту BME (-20 °C). Используя серологическую пипетку объемом 2 мл, возьмите ~1 мл холодного ДМЭМ из конической трубки объемом 15 мл. Медленно размораживайте аликвоту BME, осторожно пипетируя вверх и вниз холодным DMEM, избегая образования пузырьков.
ПРИМЕЧАНИЕ: Не позволяйте Аликвоте BME сидеть при комнатной температуре. Используйте немедленно. - Переместите размороженный DMEM/BME обратно в коническую трубку объемом 15 мл с оставшимся DMEM. С серологической пипеткой объемом 10 мл осторожно перемешайте разбавленный BME, пипеткой вверх и вниз по крайней мере 8 раз, чтобы равномерно рассеять BME, избегая образования пузырьков.
- Переложите 4 мл разбавленного BME в каждую пластину с DMEM и аккуратно закрутите пластину так, чтобы BME равномерно распределился. Инкубировать покрытую пластину в течение 1 ч при комнатной температуре или 30 мин при 37 °C.
ПРИМЕЧАНИЕ: Используйте 50 мкл BME на пластину толщиной 100 мм. Использование других культуральных сред и клеточных линий hPSC может потребовать различных концентраций BME.
2. Пропускающие GPS-серверы
ПРИМЕЧАНИЕ: Для рутинной культуры hPSC проходит клеточные линии с 70-80% слиянием.
- Аспирируйте культуральную среду из пластины hPSC, подлежащей прохождению. Добавьте ~ 8 мл фосфатно-буферного физиологического раствора Dulbecco (DPBS) в пластину hPSC и осторожно закрутите, чтобы промыть клетки.
- Аспирируйте DBPS и добавьте 2 мл мягкого реагента диссоциации клеток (GCDR) на пластину 100 мм, каплю за каплей сверху, чтобы покрыть клетки.
ПРИМЕЧАНИЕ: Могут также использоваться другие диссоциационные реагенты. Отрегулируйте соответствующим образом. - Инкубировать при комнатной температуре в течение ~6-8 мин до тех пор, пока колонии не распадутся и клетки не станут рефракционными при фазовом контрасте (рисунок 2А).
ПРИМЕЧАНИЕ: Время может варьироваться между линиями клеток. Отрегулируйте соответствующим образом. - Во время инкубации подготовьте коническую трубку объемом 50 мл. Добавьте 16 мл среды hPSC (8 мл на пластину 100 мм) и добавьте ингибитор Rho-ассоциированной киназы (ROCKi) до конечной концентрации 5 мкМ.
- Аспирируйте DMEM из пластин, покрытых BME, и добавьте 8 мл среды hPSC плюс ROCKi к каждой пластине.
- Когда ячейки будут готовы (как описано в пункте 2.3, рисунок 2A), аспирируйте GCDR и наклоните пластину ~ 45 ° в сторону экспериментатора и соскоблите клетки с помощью подъемника клеток.
ПРИМЕЧАНИЕ: Если ячейки отсоединяются, опустите аспирирующий GCDR и продолжайте. - Поверните пластину ~90° и снова соскоблите, чтобы поднять оставшиеся ячейки. Держите пластину ~45° и промывайте клетки 3 мл среды hPSC с помощью серологической пипетки объемом 10 мл.
- Аккуратно пипетку вверх и вниз разбить большие комочки (не более 2-3 раз) и высеять клетки в соответствующем соотношении для интересующей клеточной линии на подготовленные пластины. Поместите пластину с клетками в инкубатор и осторожно переместите пластину в восьмерки, чтобы равномерно распределить клетки.
ПРИМЕЧАНИЕ: В этом эксперименте линии hPSC были разделены в соотношении 1:5, это может варьироваться для других клеточных линий и условий. Оставьте тарелку нетронутой на ночь. - Через ~ 24 ч осмотрите клетки на предмет прикрепления. Ищите небольшие отдельные колонии, прикрепленные к ним. Аспирировать отработанную среду и пополнить 8 мл свежей среды hPSC (без добавления ROCKi).
- Продолжайте наблюдение и кормление ежедневно, пока клетки не достигнут ~ 60% слияния, чтобы начать анализ органоидов почек (обычно достигается от 48 до 72 ч после прохождения). Колонии в идеале должны быть дискретными и не сливающимися (рисунок 2B).
ПРИМЕЧАНИЕ: Очень важно ограничить клетки не более чем 80% сливанием, чтобы сохранить их плюрипотентное состояние. Сливающиеся культуры, грубое обращение или более высокие проходы могут привести к нежелательной спонтанной дифференцировке или низкой эффективности образования органоидов почек.
3. День 0 - Настройка анализа органоидов почек
- Перед началом подготовки сред E5-ILP и stage II в соответствии с составами (таблица 1 и таблица 2).
ПРИМЕЧАНИЕ: Носитель может храниться до 14 дней при температуре 4 °C. - Для одного анализа органоидов почек (для одной 6-луночной пластины необходима одна 100-миллиметровая культуральная пластина) приготовьте полную среду E5-ILP в конической трубке объемом 50 мл: 18 мл E5-ILP с добавлением 8 мкМ CHIR99021 (14,4 мкл), 3,3 мкМ ROCKi (6 мкл), 0,1 мМ бета-меркаптоэтанола (32,7 мкл).
- Поместите 2 мл полной среды E5-ILP в каждую скважину из 6 скважин сверхнизкой крепежной пластины.
- Промывайте HPSC при слиянии ~60 % (рисунок 2B) дважды с ~ 8 мл DPBS. Затем аспират DPBS добавляют 2 мл диспазы на пластину 100 мм, каплю за каплей покрывают клетки и инкубируют в течение 6 мин при 37 °C.
ПРИМЕЧАНИЕ: Через 6 минут края колоний начнут сворачиваться (рисунок 2C, красные стрелки), в то время как остальная часть колонии останется прикрепленной. Если это не получено через 6 мин, поместите клетки обратно в инкубатор еще на 30 с. Другие носители и матрицы hPSC могут быть несовместимы с этим таймингом. Покрытие BME на основе ламинина не совместимо с диспазой. Если BME на основе ламинина являются стандартной матрицей hPSC, покройте одну из пластин в разделе 1 BME, описанным в этом способе, которое будет использоваться для анализа органоидов почек. - Промывочные ячейки 3x с ~10 мл DPBS. Затем аспирируйте DPBS наклоните пластину ~ 45 ° и соскоблите вниз с помощью подъемника ячейки.
ПРИМЕЧАНИЕ: Диспаза не деактивируется, поэтому ее необходимо тщательно вымыть. Не уменьшайте количество стирок. - Промыть колонии сверху 6 мл полной среды E5-ILP с помощью серологической пипетки объемом 10 мл. Пипетки вверх и вниз осторожно, чтобы разбить любые большие колонии (обычно достаточно 2 или 3 раз).
- Распределите кластеры колоний равномерно, добавив 1 мл на лунку в 6-луночную плиту. Поместите пластину на орбитальный шейкер (настройки: орбитальный = 30, обратный = 330°, вибрация = 5° - 2 с), который помещается в инкубатор при температуре 37 °C (рисунок 2D).
ПРИМЕЧАНИЕ: Вибрационная особенность важна для адекватного распределения органоидов и предотвращения слипания.
4. День 2 - Кормление полусредним изменением
ПРИМЕЧАНИЕ: В течение 48 часов кластеры колоний образуют эмбриональные тела.
- Подготовьте полную среду: Для одной 6-луночной плиты подготовьте 12 мл среды E5-ILP + 8 мкм CHIR99021 в конической трубке объемом 15 мл.
ПРИМЕЧАНИЕ: Бета-меркаптоэтанол и ROCKi не требуются. - Пусть эмбриоидные тела осядут в нижней части пластины, наклоните пластину ~45°, затем медленно аспирируйте среду сверху, оставьте ~1 мл на лунку.
ПРИМЕЧАНИЕ: Эмбриоидные тела на этой стадии быстро сгущаются. Не оставляйте их на > 5 мин. - Добавить 2 мл подготовленной полной среды (раздел 4.1) на лунку. Верните тарелку обратно на шейкер.
5. День 3 - Перенос эмбриональных тел в среду II стадии
- Приготовьте коническую трубку объемом 50 мл и ДМЭМ (низкий уровень глюкозы). Пусть эмбриоидные тела осядут в нижней части пластины. Наклоните пластину ~45° и медленно аспирируйте среду сверху, оставьте ~1 мл на лунку.
- Тщательно соберите все эмбриоидные тела из каждой лунки с помощью серологической пипетки объемом 10 мл и перенесите их в коническую трубку объемом 50 мл.
- Вымойте каждую лунку, чтобы собрать оставшиеся эмбриональные тела с ~ 1 мл DMEM (низкий уровень глюкозы) и добавьте их в ту же коническую трубку объемом 50 мл.
- Оставьте эмбриональные тела оседать на дно трубки, ~5 мин. Во время ожидания добавьте 2 мл среды стадии II к каждой скважине плиты из 6 скважин. Выводите крупные эмбриоидные тела (>300 мкм) с помощью клеточного сетчатого фильтра 200 мкм (рисунок 2E).
- Используйте новую коническую трубку объемом 50 мл и поместите сверху клеточный сетчатый фильтр 200 мкм. Пипетка всех эмбриональных тел с помощью серологической пипетки объемом 10 мл осторожно над клеточным ситечком.
- Промыть клеточный ситечко дополнительным ~ 5 мл DMEM (низкий уровень глюкозы), чтобы собрать любые эмбриональные тела, застрявшие в клеточном ситечке. Позвольте эмбриоидным телам осесть на дно конической трубки.
- Когда эмбриоидные тела осядут, аспирируйте супернатант и промывайте ~ 10 мл DMEM (низкий уровень глюкозы).
- Аспирировать ДМЭМ и повторно подвешивать эмбриоидные тела в 6 мл среды II стадии.
- Перенесите эмбриоидные тела обратно в 6 лунок сверхнизкой пластины крепления, равномерно распределив их между 6 лунками.
- Выполняйте половинные изменения среды, как описано в шагах 4.2 и 4.3, через день.
ПРИМЕЧАНИЕ: Начиная с 3-го дня, эмбриоидные тела будут иметь «золотистый» и гладкий, сферический вид (рисунок 2F). С ~ дня 6 станет очевидным образование канальцев в отдельных эмбриональных телах, причем увеличение числа в течение следующих дней достигнет оптимальных чисел и роста к 14-му дню (рисунок 2G, H). Чтобы устранить случайное образование слипания, при визуальном наблюдении за почечными органоидами или очень маленькими эмбриональными телами без канальцев, отсейте органоиды <200 и крупных >500 мкм с клеточными сетчатыми фильтрами 500 и 200 мкм, как описано в шагах 5.4.1 и 5.4.2.
6. Перенос в колбу спиннера и подача
ПРИМЕЧАНИЕ: Колба спиннера может использоваться в любое время, начиная с 3-го дня, для экспериментов, требующих большого количества органоидов. Рутинная передача органоидов происходит в нашей лаборатории между днями 6-8. Пожалуйста, ознакомьтесь с разделом Обсуждение альтернатив, если оборудование недоступно.
- Перенос эмбриоидных тел в колбу спиннера объемом 125 мл с 45 мл среды II стадии. Установите скорость магнитной мешалки на 120 об/мин и поместите в инкубатор (рисунок 2I).
- Чтобы питать эмбриональные тела или почечные органоиды, дайте почечным органоидам ненадолго осесть на дно колбы спиннера. Поднимите крышку с одного бокового рычага колбы и поместите аспирационную пипетку внутрь, при этом наконечник коснется противоположной внутренней стенки.
- Медленно наклоните аспирационную пипетку вниз и аспирируйте примерно половину среды. Восполняйте 20 мл свежей среды Stage II, пипеткой ее через то же отверстие.
7. Установка 6-луночной магнитной пластины перемешивания (6MSP)
ПРИМЕЧАНИЕ: Формат 6MSP может использоваться вместо колб спиннера, если необходимо протестировать несколько условий. Используйте 6MSP для лечения соединениями или нефротоксинами. Это экономит количество среды, используемой на втором этапе, сохраняя при этом доступность питательных веществ за счет диффузии.
- Очистите овальные магнитные перемешивания в конической трубке объемом 50 мл, промыв в культуре ткани подходящее моющее средство ненадолго (если оно никогда не использовалось) или замочите > 1 ч, если предварительно использовалось.
- Кратковременно промыть 3x в стерильном DPBS.
- Промыть 1 раз в течение 5 мин в 70% этаноле, 1 раз в стерильном DPBS.
- Промыть антиадгезионным раствором и промыть 1 раз стерильным DPBS и аспиратом.
- Осторожно, используя длинные стерильные щипцы, поместите один магнитный перемешивание в каждую лунку 6-луночной пластины с эмбриональными телами или почечными органоидами.
- Поместите пластину на 6MSP и установите скорость на 120 об/мин (рисунок 2J). Поддерживать почечные органоиды с половинным средним изменением в соответствии с разделами 4.2 и 4.3.
ПРИМЕЧАНИЕ: Для того, чтобы магнитные перемешивания защелкнулись и начали вращаться, вам может потребоваться сначала кратковременно поставить уровень мощности до 100, а затем, как только они все вращатся, снизить уровень мощности до 25.
Результаты
В этой последней версии нашего протокола дифференциация органоидов почек инициируется в определенной среде с низким содержанием белка. Анализы выполняются полностью в суспензии и основаны на врожденной способности дифференцировки и организации hPSCs для инициирования тубулогенеза. Один анализ, полученный из 100 мм ~ 60% сливающейся культуральной пластины hPSC, обычно дает 500-1000 органоидов почек, как показано в нашей предыдущей публикации5. Из-за такого большого количества генерируемых органоидов этот протокол хорошо подходит для тестирования соединений. Мы обычно используем формат 6 скважин для тестирования соединений, однако этот протокол может быть легко масштабирован на втором этапе (день 3 и далее) до других форматов с несколькими скважинами для тестирования соединений с более высокой пропускной способностью. Иммунофлуоресценция парафиновых срезов показывает наличие сегментов нефрона в органоидах, т.е. почечных канальцах, экспрессирующих бета-фактор гепатоцитов-1 (HNF1B) и Lotus Tetragonolobus Lectin (LTL) (Рисунок 3A - HNF1B, LTL), и кластерах подоцитов, экспрессирующих V-maf Мускулоапоневротический фибросаркома онкогенный гомолог B (MAFB) и нефрин (NPHS1) (Рисунок 3A - MAFB, Рисунок 3B - НПХС1). Кроме того, модификации в этом протоколе могут поддерживать расширение эндотелиальных клеток, как показано на рисунке 3B, показывающем окрашивание молекулой адгезии тромбоцитов и эндотелиальных клеток 1 (PECAM1) на 26-й день культивирования.
| Реагент | Стоковый конс. | Рабочий конк. | Количество на 250 мл |
| ТэСР-Э5 | н/д | н/д | 238.48 мл |
| ПВА | 10% | 0.25% | 6.25 мл |
| Ручка-стрептококк | в 100 раз | в 1 раз | 2,5 мл |
| ИТСЕ | в 100 раз | в 0,1 раза | 250 мкл |
| Химически определенные липиды | в 100 раз | в 1 раз | 2,5 мл |
| Плазмоцин | 25 мг/мл | 2,5 мкг/мл | 25 мкл |
Таблица 1: Средний состав Е5-ИЛП. Пипетка всех реагентов, за исключением химически определенных липидов и антимикоплазменного реагента, непосредственно в верхнюю камеру фильтрационной установки Stericup 0,22 мкм. После фильтрации добавляют липиды и антимикоплазменный реагент. Хранить при температуре 4 °C до двух недель.
| Реагент | Стоковый конс. | Рабочий конк. | Количество на 500 мл |
| DMEM (низкий уровень глюкозы) | н/д | н/д | 417.5 мл |
| КОСР | н/д | 10% | 50 мл |
| ПВА | 10% | 0.25% | 12.5 мл |
| Ручка-стрептококк | в 100 раз | в 1 раз | 5 мл |
| МЕМ-НЕАА | в 100 раз | в 1 раз | 5 мл |
| ГлутаМАКС | в 100 раз | в 1 раз | 5 мл |
| ХЕПЕС | в 100 раз | в 1 раз | 5 мл |
| Плазмоцин | 25 мг/мл | 2,5 мкг/мл | 50 мкл |
Таблица 2: Средняя композиция II этапа. Пипетка всех реагентов, кроме антимикоплазменного реагента, непосредственно в верхнюю камеру фильтрующего блока Stericup 0,22 мкм. После фильтрации добавляют антимикоплазменный реагент. Хранить при температуре 4 °C до двух недель.
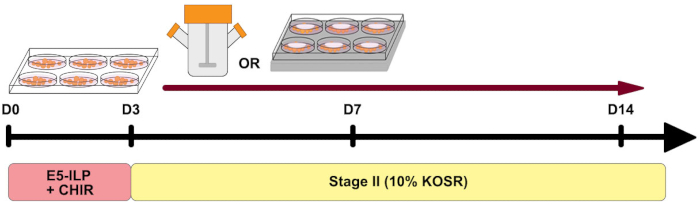
Рисунок 1: Обзор протокола. Схематический обзор протокола, показывающий сроки двух этапов и использование колб спиннера и 6MSP. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
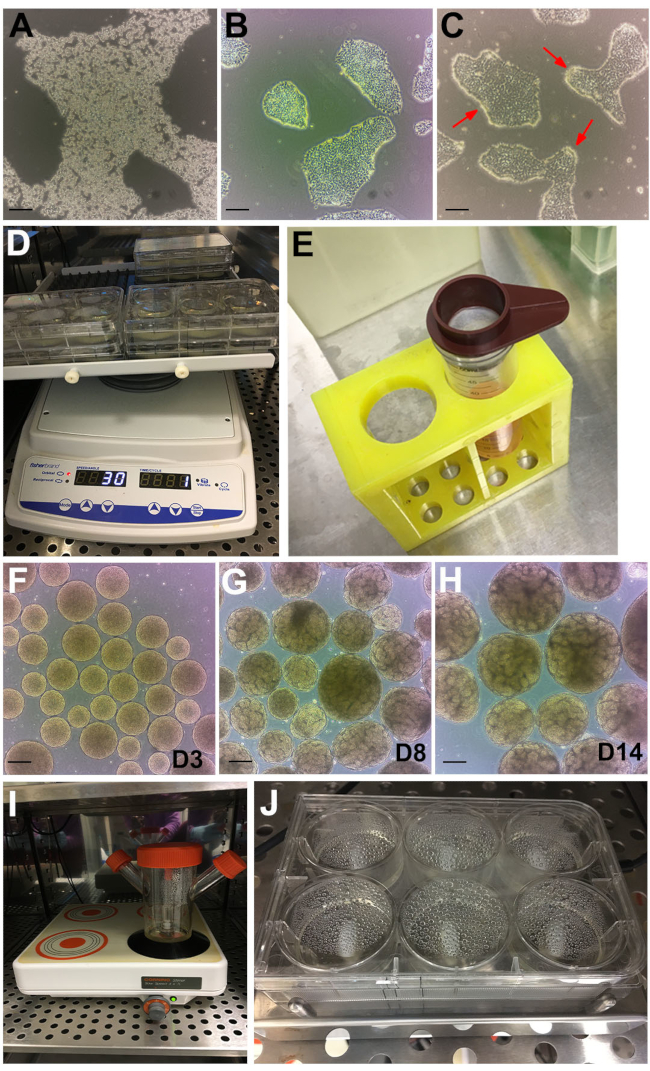
Рисунок 2: Этапы протокола. (A) Изображение яркого поля колонии hPSC, обработанной GCDR. (B) Оптимальное слияние и размер колонии, чтобы начать анализ органоидов почек. (C) хПСК обрабатывают диспазой в течение 6 минут. Красные стрелки указывают на края колоний, сворачивающихся вверх. (D) Органоидные анализы на орбитальном шейкере. (E) Использование клеточного ситечка 200 мкм для отслаивания крупных эмбриоидных тел. (F) Эмбриоидные тела на 3-й день (D3) перед переносом в среду стадии II. (G) Появление канальцевого образования может наблюдаться на 8-й день (D8) и (H) оптимальную временную точку для извлечения органоидов и лечения на 14-й день (D14). (I) Колба спиннера, используемая для объемного культивирования на многопозиционной магнитной пластине. (J) Анализ на многолуночной магнитной перемешивающей пластине. Шкала, 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Ожидаемые результаты. (A) Репрезентативные конфокальные изображения иммунофлуоресцентно меченых парафиновых участков органоидов почек 14-го дня, показывающие положительное окрашивание для эпителия канальцев (HNF1B и LTL) и кластеров подоцитов (MAFB). (B) День 26 секций органоидов почек, помеченных для кластеров подоцитов (NPHS1) и эндотелиальных клеток (PECAM1). Шкала стержней, 100 мкм (А); 200 мкм (B). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Предыдущие исследования показали, что начальные этапы протокола имеют решающее значение для промежуточной дифференциации мезодермы 5,19,20 и, следовательно, на этом этапе необходимо реализовать строгий состав среды. Удаление неопределенных компонентов, таких как сыворотка, альбумин, безбелковая гибридомная среда II с первой стадии протокола, может помочь улучшить последовательную эффективность дифференциации между анализами21.
Метаболическое состояние клеток почек имеет решающее значение для их функции, и изменения глюкозы могут привести к измененному метаболическому состоянию22. Предыдущие исследования описывали, что высокий уровень глюкозы (до 25 мМ) может вызывать дисфункцию эндотелиальных клеток и изменять рост и окислительную способность клеток почек 22,23,24. Также было описано, что высокие уровни глюкозы изменяют функцию митохондрий24, что может быть неблагоприятным при исследовании заболеваний почек и нефротоксичности или при открытии лекарств с использованием почечных органоидов. Таким образом, мы снизили уровень глюкозы в нашем протоколе, чтобы способствовать более in vivo-подобному метаболическому состоянию органоидных клеток почек. В результате модификации анализа органоидов почек обеспечивают последовательный, надежный протокол, сохраняя при этом его простоту.
Почечные органоиды являются незрелыми, и расширенная культура (>20 дней) может привести к заболеваемости профиброзными и непенальными типами клеток, как описано ранее 5,25, оставляя органоиды менее репрезентативными для здоровой почечной ткани человека. Основываясь на нашем опыте, оптимальное окно лечения, где почечные органоиды находятся в наиболее здоровом состоянии, находится между днями 14-18. Использование колб для спиннера и многолуночных магнитных мешалок, как описано выше, повысит равномерную доступность питательных веществ в отличие от статической культуры21,26. Если оборудование для культуры суспензии, такое как шейкер или магнитные мешалки, недоступно, этот протокол все еще может быть выполнен полностью в сверхнизких крепежных пластинах в статической культуре. Однако может быть повышенная частота слияния эмбриоидных тел / органоидов, что приводит к крупным образцам с некротическими ядрами из-за гипоксии. Любые органоиды размером более 500 мкм могут быть удалены с помощью описанных клеточных сетчатых фильтров. Чтобы уменьшить вероятность слияния органоидов в этих случаях, мы предлагаем не сеять более 100 органоидов на 6-лунку. Кроме того, после кормления органоиды следует равномерно распределить, выполнив восьмерки движений пластиной.
Может наблюдаться низкая эффективность (<50%) органообразования. Обычно это происходит, когда культуры hPSC достигают высокой сливаемости (>80%) во время стандартного прохода. Крайне важно, чтобы поддержание hPSC было последовательным, и ячейки не оставались слизыми. Высокая конфлюентность и непоследовательный метод пассирования также могут привести к спонтанной дифференцировке и увеличению гибели клеток. Если дифференцировка присутствует в культуре hPSC, мы рекомендуем удалять дифференцированные участки путем аспирации тонким наконечником пипетки, если она не превышает 5% клеточной популяции, до начала анализа. Если площади дифференциации превышают 5%, мы рекомендуем разморозить и разделить новую партию ГПСК хотя бы один раз перед началом нового анализа.
Мы заметили, что некоторые линии hPSC более склонны к образованию нечеточных типов клеток, таких как сердечная или нервная ткань. Если это происходит, фильтрация размеров с использованием клеточных сетчатых фильтров может помочь удалить те органоиды, которые содержат непорочинные выросты. Альтернативно, изменение среды hPSC и/или матрицы может помочь уменьшить непорочинные выросты. По нашему опыту, альтернативные среды hPSC, содержащие минимальные компоненты, и BME, такие как витронектин, обеспечивают более строгую плюрипотентную нишу и, таким образом, помогают генерировать более однородные культуры hPSC.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование финансировалось Национальными институтами здравоохранения R01 DK069403, UC2 DK126122 и P30-DK079307 и ASN Foundation for Kidney Research Fellowship Program to AP.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Thermo Fisher | 21-985-023 | |
| Anti-adherence rinsing solution | STEMCELL Technologies | 7010 | |
| CHIR99021 | STEMCELL Technologies | 72054 | 10 mM stock in DMSO |
| Corning disposable spinner flasks | Fisher Scientific | 07-201-152 | |
| Corning Ultra-Low Attachment 6-well plates | Fisher Scientific | 07-200-601 | |
| Corning Slow-Speed Stirrers | Fisher Scientific | 11-495-03 | Multi plate magnetic stirrer for spinner flask culture |
| Dispase | STEMCELL Technologies | 7923 | Aliquot and freeze |
| DMEM, low glucose, pyruvate, no glutamine, no phenol red | Thermo Fisher | 11054020 | |
| DPBS 1x, no calcium, no magnesium | Thermo Fisher | 14-190-250 | |
| Egg / Oval Stirring Bars | 2mag | PI20106 | |
| Excelta General-Purpose Tweezers | Fisher Scientific | 17-456-103 | Keep sterile in the cell culture hood |
| EZBio Single Use Media Bottle, 250mL | Foxx Life Sciences | 138-3211-FLS | Used to make PVA 10% |
| Falcon Standard Tissue Culture Dishes (100 mm) | Thermo Fisher | 08-772E | |
| Fisherbrand Sterile Aspirating Pipet 2mL | Fisher Scientific | 14-955-135 | |
| Fisherbrand Cell Lifters - Cell lifter | Fisher Scientific | 08-100-240 | |
| Fisherbrand Multi Function 3D Rotators | Fisher Scientific | 88-861-047 | Orbital shaker |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413302 | BME. Aliquot on ice and freeze. Another suitable matrix alternative is Matrigel or Cultrex. |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 7174 | GCDR |
| GlutaMAX Supplement | Thermo Fisher | 35-050-061 | L-glutamine supplement. |
| HEPES (1M) | Thermo Fisher | 15-630-080 | |
| Insulin-Transferrin-Selenium-Ethanolamine | Thermo Fisher | 51-500-056 | ITSE |
| KnockOut Serum Replacement - Multi-Species | Thermo Fisher | A3181502 | KOSR. Aliquot and freeze |
| Lipid Mixture 1, Chemically Defined | Millipore-Sigma | L0288-100ML | |
| MEM Non-Essential Amino Acids Solution | Thermo Fisher | 11140-050 | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 500mL | Fisher Scientific | S2GPU05RE | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 250mL | Fisher Scientific | S2GPU02RE | |
| MIXcontrol MTP / Variomag TELEcontrol MTP Control Unit | 2mag | VMF 90250 U | |
| MIXdrive 6 MTP / Variomag TELEdrive 6 MTP Microplate Stirring Drive | 2mag | VMF 40600 | 6MSP |
| MP Biomedicals 7X Cleaning Solution | Fisher Scientific | MP0976670A4 | Tissue culture suitable detergent. Make a 5% solution in water |
| mTeSR1 | STEMCELL Technologies | 85850 | hPSC medium.TeSR-E8, NutriStem XF, and mTeSR Plus medium have also been tested and are suitable alternatives. |
| Nunc 50 mL Conical, Sterile Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| Nunc 15mL Conical Sterile Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| Penicillin-Streptomycin | Thermo Fisher | 15-140-122 | Aliquot and freeze |
| Plasmocin | Invivogen | ant-mpt | Anti-mycoplasma reagent. Aliquot and freeze |
| pluriStrainer® 200 µm | Fisher Scientific | NC0776417 | Cell strainer |
| pluriStrainer® 500 µm | Fisher Scientific | NC0822591 | Cell strainer |
| Poly(vinyl alcohol) 87-90% hydrolyzed (PVA) | Millipore-Sigma | P8136-250G | 10% in DPBS stirring at 98 degrees C until disolves, make in 138-3211-FLS |
| ROCK inhibitor Y-27632 (ROCKi) | STEMCELL Technologies | 72304 | 10 mM stock in DPBS |
| Sterile Disposable Serological Pipets - 10mL | Fisher Scientific | 13-678-11E | |
| Sterile Disposable Serological Pipets - 25mL | Fisher Scientific | 13-678-11 | |
| Sterile Disposable Serological pipette - 5 mL | Fisher Scientific | 13-678-12D | |
| TeSR-E5 | STEMCELL Technologies | 5916 | Serum-free, low protein base medium for E5-ILP |
| Variomag distriBOX 2 Distributor | 2mag | VMF 90512 | If you use more than one MIXdrive |
Ссылки
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communications. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Taguchi, A., et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell. 14 (1), 53-67 (2013).
- Przepiorski, A., et al. A simple bioreactor-based method to generate kidney organoids from pluripotent stem cells. Stem Cell Reports. 11 (2), 470-484 (2018).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communication. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Taguchi, A., Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell. 21 (6), 730-746 (2017).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Howden, S. E., Little, M. H. Generating kidney organoids from human pluripotent stem cells using defined conditions. Methods in Molecular Biology. 2155, 183-192 (2020).
- Tanigawa, S., et al. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. 13 (2), 322-337 (2019).
- Sander, V., et al. Protocol for large-scale production of kidney organoids from human pluripotent stem cells. STAR Protocols. 1 (3), 100150 (2020).
- Ekblom, P., Thesleff, I., Miettinen, A., Saxen, L. Organogenesis in a defined medium supplemented with transferrin. Cell Differentiation. 10 (5), 281-288 (1981).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. Journal of Embryology and Experimental Morphology. 82, 147-161 (1984).
- Freund, C., et al. Insulin redirects differentiation from cardiogenic mesoderm and endoderm to neuroectoderm in differentiating human embryonic stem cells. Stem Cells. 26 (3), 724-733 (2008).
- Nishikawa, M., et al. An optimal serum-free defined condition for in vitro culture of kidney organoids. Biochemistry and Biophysics Research Communication. 501 (4), 996-1002 (2018).
- Oh, J. K., et al. Derivation of induced pluripotent stem cell lines from New Zealand donors. Journal of the Royal Society of New Zealand. , 1-14 (2020).
- Takasato, M., et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nature Cell Biology. 16 (1), 118-126 (2013).
- Lam, A. Q., et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. Journal of American Society of Nephrology. 25 (6), 1211-1225 (2014).
- Bratt-Leal, A. M., Carpenedo, R. L., McDevitt, T. C. Engineering the embryoid body microenvironment to direct embryonic stem cell differentiation. Biotechnology Progress. 25 (1), 43-51 (2009).
- Imasawa, T., et al. High glucose repatterns human podocyte energy metabolism during differentiation and diabetic nephropathy. FASEB Journal. 31 (1), 294-307 (2017).
- Kim, K. A., et al. High glucose condition induces autophagy in endothelial progenitor cells contributing to angiogenic impairment. Biological and Pharmaceutical Bulletin. 37 (7), 1248-1252 (2014).
- Piwkowska, A., Rogacka, D., Audzeyenka, I., Jankowski, M., Angielski, S. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes. Journal of Cellular Biochemistry. 112 (6), 1661-1672 (2011).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Lei, X., Deng, Z., Duan, E. Uniform embryoid body production and enhanced mesendoderm differentiation with murine embryonic stem cells in a rotary suspension bioreactor. Methods in Molecular Biology. , (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены