Method Article
Um método simplificado para gerar organoides renais a partir de células-tronco pluripotentes humanas
Neste Artigo
Resumo
Aqui descrevemos um protocolo para gerar organoides renais a partir de células-tronco pluripotentes humanas (hPSCs). Este protocolo gera organoides renais dentro de duas semanas. Os organoides renais resultantes podem ser cultivados em frascos rotadores em larga escala ou placas de agitação magnética multi-bem para abordagens paralelas de teste de drogas.
Resumo
Organoides renais gerados a partir de hPSCs forneceram uma fonte ilimitada de tecido renal. Os organoides renais humanos são uma ferramenta inestimável para estudar doenças e lesões renais, desenvolver terapias baseadas em células e testar novas terapêuticas. Para tais aplicações, um grande número de organoides uniformes e ensaios altamente reprodutíveis são necessários. Nós construímos nosso protocolo organoide renal publicado anteriormente para melhorar a saúde geral dos organoides. Este protocolo 3D simples e robusto envolve a formação de corpos embrióides uniformes em meio de componente mínimo contendo lipídios, suplemento de insulina-transferrina-selênio-etanolamina e álcool polivinyl com inibidor GSK3 (CHIR99021) por 3 dias, seguido pela cultura em meio contendo soro de reposição de soro de knock-out (KOSR). Além disso, ensaios agitados permitem a redução da aglomeração dos corpos embrionários e a manutenção de um tamanho uniforme, importante para reduzir a variabilidade entre organoides. No geral, o protocolo fornece um método rápido, eficiente e econômico para gerar grandes quantidades de organoides renais.
Introdução
Nos últimos anos, uma série de protocolos para diferenciar células-tronco pluripotentes humanas em organoides renais foram desenvolvidos 1,2,3,4,5. Os organoides renais forneceram uma importante ferramenta para auxiliar a pesquisa em novas abordagens de medicina regenerativa, doenças relacionadas ao rim, realizar estudos de toxicidade e desenvolvimento de medicamentos terapêuticos. Apesar de sua ampla aplicabilidade, os organoides renais têm limitações como falta de maturação, capacidade de cultura limitada a longo prazo in vitro e uma escassez de vários tipos de células encontrados no rim humano 6,7,8. Trabalhos recentes têm focado na melhoria do nível de maturação organoide, ampliando os períodos culturais e ampliando a complexidade das populações de células renais, modificando os protocolos existentes 9,10,11,12. Nesta atual iteração do nosso protocolo estabelecido 5,13, modificamos os componentes médios na primeira etapa do protocolo para uma base sem soro complementada com insulina-transferrina-selênio-etanolamina (ITSE), lipídios, álcool polivinyl (E5-ILP) e CHIR99021 (Figura 1). Essas mudanças fornecem um meio de baixa proteína totalmente definido, sem soro, com menos componentes do que a nossa composição média anterior 5,13 e sem fatores adicionais de crescimento. Como resultado, o meio da primeira etapa é menos trabalhoso para preparar do que a nossa versão anteriormente publicada, e pode reduzir a variabilidade em lote paralote 5. Estudos anteriores mostraram que tanto a insulina quanto a transferrina são importantes na cultura livre de soro14,15, no entanto, altos níveis de insulina podem ser inibidores para a diferenciação de mesoderm16. Mantivemos os baixos níveis de insulina conforme previsto no protocolo original, e reduzimos ainda mais os níveis de KOSR (contendo insulina) no segundo estágio do ensaio. De acordo com outros protocolos para formação organoide renal, níveis mais baixos de KOSR são benéficos para manter um equilíbrio entre a proliferação e a diferenciação do tecido renal17. Além disso, reduzimos a concentração de glicose em nosso estágio II médio13.
Nosso método descreve uma configuração para ensaio de suspensão de organoides renais, produzindo até ~1.000 organoides de uma placa de cultura hPSC 100 mm confluente inicial de ~60% conforme descrito na publicação original 5,13. Este protocolo pode ser facilmente dimensionado até começar com várias placas de 100 mm ou 150 mm para aumentar ainda mais o número de organoides.
Protocolo
Todos os experimentos utilizando hPSCs foram realizados em conformidade com as diretrizes institucionais, e foram realizados em uma capa de biossegurança classe II com equipamentos de proteção individual adequados. Todos os reagentes são de grau de cultura celular, a menos que seja dito o contrário. Todas as culturas são incubadas a 37 °C, 5% de atmosfera de ar CO2 . Em todas as etapas do ensaio, corpos embrionários ou organoides renais podem ser coletados e fixados ou preparados para análise. As linhas hPSC utilizadas para gerar esses dados foram totalmente caracterizadas e publicadas18.
1. Preparando placas de cultura
NOTA: Aproximadamente 1 h antes de dividir hPSCs, casaco 2 x 100 mm placas de cultura tecidual com um extrato de matriz de membrana de porão qualificado por célula-tronco (BME). Pode-se pré-revestir as placas, selá-las com um filme de parafina e armazenar a 4 °C de acordo com as instruções dos fabricantes.
- Prepare placas tratadas com cultura de tecido de 2 x 100 mm (1 para ensaio organoide renal, 1 para manter a linha celular) e um tubo cônico de 15 mL na capa de biossegurança classe II.
- Aliquot 8 mL de frio, sem soro Dulbecco's Modified Eagle Medium (DMEM) em um tubo cônico de 15 mL e ~4 mL em cada uma das placas de 100 mm, o suficiente para cobrir o fundo de cada placa com meio.
- Tire uma alíquota de 100 μL de BME do congelador (-20 °C). Usando uma pipeta sorológica de 2 mL, pegue ~1 mL de DMEM frio do tubo cônico de 15 mL. Descongele lentamente a alíquota do BME, encanar suavemente para cima e para baixo com o DMEM frio, evitando fazer bolhas.
NOTA: Não deixe que a alíquota BME fique em temperatura ambiente. Use imediatamente. - Transfira o DMEM/BME descongelado de volta para o tubo cônico de 15 mL com o DMEM restante. Com uma pipeta sorológica de 10 mL, misture suavemente o BME diluído por pipetar para cima e para baixo pelo menos 8 vezes para dispersar uniformemente o BME, evitando fazer bolhas.
- Transfira 4 mL do BME diluído em cada placa com DMEM e gire suavemente a placa para que o BME seja distribuído uniformemente. Incubar a placa revestida por 1h em temperatura ambiente ou 30 min a 37 °C.
NOTA: Use 50 μL de BME por placa de 100 mm. O uso de outras mídias de cultura hPSC e linhas de células pode exigir diferentes concentrações de BME.
2. Passaging hPSCs
NOTA: Para a cultura de rotina do HPSC, as linhas de células de passagem a 70-80% de confluência.
- Aspire o meio de cultura da placa hPSC a ser passagem. Adicione ~ 8 mL da solução salina tamponada de fosfato (DPBS) de Dulbecco à placa hPSC e gire suavemente para lavar as células.
- Aspire DBPS e adicione 2 mL de reagente de dissociação de células suaves (GCDR) à placa de 100 mm, gota por gota em cima para cobrir as células.
NOTA: Outros reagentes de dissociação também podem ser usados. Ajuste de acordo. - Incubar à temperatura ambiente por ~6-8 min até que as colônias estejam se rompendo e as células estejam refrativas sob contraste de fase (Figura 2A).
NOTA: O tempo pode variar entre as linhas de celular. Ajuste de acordo. - Durante a incubação, prepare um tubo cônico de 50 mL. Adicione 16 mL de meio hPSC (8 mL por placa de 100 mm) e adicione o inibidor de quinase associado a Rho (ROCKi) a uma concentração final de 5 μM.
- Aspire DMEM das placas revestidas de BME e adicione 8 mL de hPSC médio mais ROCKi a cada placa.
- Quando as células estiverem prontas (como descrito no ponto 2.3, Figura 2A), aspire o GCDR e incline a placa ~45° em direção ao experimentador e raspe as células com um levantador de células.
NOTA: Se as células estiverem se desartching, omitir gcdr aspirando e proceder. - Gire a placa ~90° e raspe novamente para levantar as células restantes. Mantenha a placa ~45° e lave as células para baixo com 3 mL de meio hPSC usando uma pipeta sorológica de 10 mL.
- Pipeta suavemente para cima e para baixo para quebrar grandes aglomerados (não mais do que 2-3 vezes) e semear as células na razão apropriada para a linha de interesse celular nas placas preparadas. Coloque a placa com as células da incubadora e mova a placa suavemente em 8 movimentos para distribuir as células uniformemente.
NOTA: Neste experimento as linhas hPSC foram divididas a uma proporção de 1:5, isso pode variar para outras linhas e condições celulares. Deixe o prato imperturbável durante a noite. - Depois de ~ 24 h, examine as células para fixação. Procure por pequenas colônias individuais anexadas. Aspire o médio gasto e reponha com 8 mL de meio hPSC fresco (sem adicionado ROCKi).
- Continue observando e se alimentando diariamente até que as células atinjam ~60% de confluência para iniciar o ensaio organoide renal (geralmente chega de 48 a 72h após a passagem). As colônias serão, idealmente, discretas e não se fundindo (Figura 2B).
NOTA: É muito importante limitar as células a não mais do que 80% de confluência para manter seu estado de pluripotência. Culturas confluentes, manuseio áspero ou passagens mais altas podem levar a diferenciação espontânea indesejada ou baixa eficiência da formação organoide renal.
3. Dia 0 - Configuração do ensaio organoide renal
- Antes de começar, prepare tanto a mídia E5-ILP quanto a Fase II conforme formulações (Tabela 1 e Tabela 2).
NOTA: A mídia pode ser armazenada por até 14 dias a 4 °C. - Para um ensaio organoide renal (uma placa de cultura de 100 mm é necessária para uma placa de 6 poços), prepare o meio E5-ILP completo em um tubo cônico de 50 mL: 18 mL de E5-ILP suplementado com 8 μ CHIR99021 (14,4 μL), 3,3 μM ROCKi (6 μL), 0,1 mM beta-mercaptoetanol (32,7 μL).
- Coloque 2 mL de meio E5-ILP completo em cada poço de uma placa de fixação ultra-baixa de 6 poços.
- Lave os hPSCs a ~60 % de confluência (Figura 2B) duas vezes com ~ 8 mL de DPBS. Em seguida, adicione 2 mL de dispase por placa de 100 mm, solte a gota para cobrir as células e incubar por 6 min a 37 °C.
NOTA: Depois de 6 minutos, as bordas das colônias começarão a se enrolar (Figura 2C, setas vermelhas) enquanto o resto da colônia permanece presa. Se isso não for obtido após 6 minutos, coloque as células de volta na incubadora para mais 30 s. Outras mídias e matriz hPSC podem não ser compatíveis com este tempo. O revestimento BME à base de laminina não é compatível com a despase. Se a BME baseada em laminina for a matriz hPSC padrão, cubra uma das placas da seção 1 com a BME descrita neste método a ser utilizado para o ensaio organoide renal. - Lave células 3x com ~10 mL de DPBS. Aspirar DPBS, em seguida, inclinar a placa ~45° e raspar para baixo com um levantador de células.
NOTA: A desapase não está desativada, portanto, precisa ser lavada completamente. Não reduza o número de lavagens. - Lave as colônias do topo com 6 mL de meio E5-ILP completo usando uma pipeta sorológica de 10 mL. Pipeta para cima e para baixo suavemente para quebrar quaisquer colônias grandes (2 ou 3 vezes geralmente é suficiente).
- Distribua os aglomerados da colônia uniformemente adicionando 1 mL por poço na placa de 6 poços. Coloque a placa em um agitador orbital (configurações: orbital = 30, recíproca = 330°, vibração = 5° - 2 s) que é colocada na incubadora de 37 °C (Figura 2D).
NOTA: O recurso de vibração é importante para a distribuição adequada dos organoides e para evitar o agrupamento.
4. Dia 2 - Alimentação por meio-médio
NOTA: Dentro das 48 horas, aglomerados de colônias formarão corpos embrionários.
- Prepare o meio completo: Para uma placa de 6 poços prepare 12 mL de meio E5-ILP + 8 μM CHIR99021 em um tubo cônico de 15 mL.
NOTA: Beta-mercaptoethanol e ROCKi não são necessários. - Deixe os corpos embrionários se acomodarem na parte inferior da placa, incline a placa ~45° e depois aspire o meio lentamente a partir da parte superior, deixe ~1 mL por poço.
NOTA: Corpos embrióides nesta fase se aglomeram rapidamente. Não deixe que eles se contentem com > 5 min. - Adicione 2 mL de meio completo preparado (seção 4.1) por poço. Devolva a placa de volta ao agitador.
5. Dia 3 - Transferência de corpos embrionários para o estágio II médio
- Prepare um tubo cônico de 50 mL e DMEM (baixa glicose). Deixe os corpos embrionários se estabelecerem no fundo da placa. Incline a placa ~45° e aspire o meio de cima lentamente, deixe ~1 mL por poço.
- Colete todos os corpos embrióides cuidadosamente de cada poço usando uma pipeta sorológica de 10 mL e transfira-os para o tubo cônico de 50 mL.
- Lave cada poço para coletar quaisquer corpos embrióides restantes com ~ 1 mL de DMEM (baixa glicose) e adicione-os ao mesmo tubo cônico de 50 mL.
- Deixe os corpos embrionários se acomodarem no fundo do tubo, ~5 min. Enquanto estiver esperando, adicione 2 mL de meio estágio II a cada poço da placa de 6 poços. Seive grandes corpos embrióides (>300 μm) usando um coador de células de 200 μm (Figura 2E).
- Use um novo tubo cônico de 50 mL e coloque o coador de células de 200 μm em cima. Pipeta todos os corpos embrionários usando uma pipeta sorológica de 10 mL cuidadosamente sobre o coador celular.
- Enxágüe o coador celular com um adicional de ~5 mL de DMEM (baixa glicose) para coletar quaisquer corpos embrionários presos no coador celular. Permita que os corpos embrionários se acomodem no fundo do tubo cônico.
- Quando os corpos embrionários estiverem assentados, aspire o supernasciente e lave com ~10 mL de DMEM (baixa glicose).
- Aspirar DMEM e suspender de re suspendida os corpos embrionários em 6 mL do meio estágio II.
- Transfira os corpos embrionários de volta para a placa de fixação 6 bem ultra-baixa, distribuindo-os uniformemente entre os 6 poços.
- Realizar meia alteração média, conforme descrito nas etapas 4.2 e 4.3 a cada dois dias.
NOTA: A partir do dia 3, os corpos embrionários terão uma aparência 'dourada' e lisa e esférica (Figura 2F). A partir do 6º dia, a formação de túbulos em corpos embrióides individuais se tornará aparente, com números crescentes nos dias seguintes atingindo números ideais e crescimento até o dia 14 (Figura 2G,H). Para eliminar a formação de aglomerados ocasionais, ao observar visualmente os organoides renais, ou corpos embrionários muito pequenos sem túbulos, peneirar os <200 e grandes organoides de > 500 μm com uma célula de 500 e 200 μm de coador, conforme descrito nas etapas 5.4.1 e 5.4.2.
6. Transferir para frasco de rotador e alimentação
NOTA: Um frasco rotador pode ser usado a qualquer momento a partir do dia 3 para experimentos que requerem um grande número de organoides. A transferência de rotina de organoides acontece em nosso laboratório entre os dias 6 e 8. Consulte a seção Discussão para obter alternativas se o equipamento não estiver disponível.
- Transfira corpos embrionários em um frasco rotador de 125 mL com 45 mL de meio estágio II. Defina a velocidade do agitador magnético a 120 rpm e coloque na incubadora (Figura 2I).
- Para alimentar corpos embrionários ou organoides renais, deixe os organoides renais se estabelecerem brevemente no fundo do frasco rotador. Levante a tampa de um braço lateral do frasco e coloque a pipeta aspirante dentro, com a ponta tocando o oposto dentro da parede.
- Angule lentamente a pipeta aspirada para baixo e aspire aproximadamente metade do meio. Reabasteca com 20 mL de meio fresco estágio II, tubulando-o através da mesma abertura.
7. Configuração de placa de agitação magnética de 6 poços (6MSP)
NOTA: O formato 6MSP pode ser usado no lugar de frascos rotadores se várias condições precisarem ser testadas. Use o 6MSP para tratamentos compostos ou nefrotoxinas. Isso economiza a quantidade de meio utilizado no segundo estágio, mantendo a disponibilidade de nutrientes através da difusão.
- Limpe as barras de agitação magnética oval em um tubo cônico de 50 mL lavando em uma cultura de tecido detergente adequado brevemente (se nunca usado) ou de molho por > 1 h, se usado anteriormente.
- Lave brevemente 3x em DPBS estéreis.
- Lave 1x por 5 min em 70% de etanol, 1x em DPBS estéreis.
- Enxágüe com solução anti-adesão e lave 1x em DPBS estérei e aspire.
- Com cuidado, usando fórceps longos estéreis coloque uma barra de agitação magnética em cada poço da placa de 6 poços com corpos embrionários ou organoides renais.
- Coloque a placa sobre o 6MSP e defina a velocidade para 120 rpm (Figura 2J). Manter organoides renais com meio meio de alteração conforme seção 4.2 e 4.3.
NOTA: Para que as barras de agitação magnética se posicionem e comecem a girar, talvez seja necessário primeiro colocar o nível de potência para 100 brevemente, então uma vez que todos estejam girando, abaixem o nível de energia para 25.
Resultados
Nesta versão mais recente do nosso protocolo, a diferenciação organoide renal é iniciada em um meio de proteína definido e baixo. Os ensaios são realizados inteiramente em suspensão e contam com a capacidade inata de diferenciação e organização dos HPSCs para o início da tubulogênese. Um único ensaio originário de uma placa de cultura hPSC de 100 mm ~60% confluente produz rotineiramente 500-1.000 organoides renais, como mostrado em nossa publicação anterior5. Devido a um número tão alto de organoides gerados, este protocolo é adequado para testes compostos. Nós usamos rotineiramente um formato de 6 poços para testes compostos, no entanto, este protocolo pode ser facilmente dimensionado no segundo estágio (dia 3 em diante) para outros formatos multi-poço para testes compostos de maior rendimento. A imunofluorescência das seções de parafina mostra presença de segmentos de nefrão nos organoides, ou seja, túbulos renais expressando Hepatocitos Nuclear Factor-1 beta (HNF1B) e Lotus Tetragonolobus Lectin (LTL) (Figura 3A - HNF1B, LTL), e aglomerados podocyte expressando V-maf Musculoaponeurotic Fibrosarcoma oncogene homólogo B (MAFB) e nephrin (NPHS1) (Figura 3A - MAFB, Figura 3B - NPHS1). Além disso, as modificações neste protocolo podem apoiar a expansão das células endoteliais, como visto na Figura 3B mostrando coloração com plaqueta e molécula de adesão celular endotelial 1 (PECAM1) no dia 26 da cultura.
| Reagente | Conc estoque. | Trabalhando conc. | Quantidade por 250 mL |
| TeSR-E5 | n/a | n/a | 238,48 mL |
| PVA | 10% | 0.25% | 6,25 mL |
| Pen-Strep | 100x | 1x | 2,5 mL |
| ITSE | 100x | 0,1x | 250 μL |
| Lipídios quimicamente definidos | 100x | 1x | 2,5 mL |
| Plasmocina | 25 mg/mL | 2,5 μg/mL | 25 μL |
Tabela 1: Composição média E5-ILP. Pipeta todos os reagentes, exceto os lipídios quimicamente definidos e reagente anti-mycoplasma diretamente na câmara superior de uma unidade de filtragem Stericup de 0,22 μm. Após a filtragem, adicione os lipídios e o reagente anti-mycoplasma. Armazene a 4 °C por até duas semanas.
| Reagente | Conc estoque. | Trabalhando conc. | Quantidade por 500 mL |
| DMEM (Baixa Glicose) | n/a | n/a | 417,5 mL |
| RIO KOSR | n/a | 10% | 50 mL |
| PVA | 10% | 0.25% | 12,5 mL |
| Pen-Strep | 100x | 1x | 5 mL |
| MEM-NEAA | 100x | 1x | 5 mL |
| GlutaMAX | 100x | 1x | 5 mL |
| HEPES | 100x | 1x | 5 mL |
| Plasmocina | 25 mg/mL | 2,5 μg/mL | 50 μL |
Tabela 2: Composição média do estágio II. Pipeta todos os reagentes exceto e reagente anti-mycoplasma diretamente na câmara superior de uma unidade de filtragem stericup de 0,22 μm. Uma vez filtrado, adicione reagente anti-mycoplasma. Armazene a 4 °C por até duas semanas.
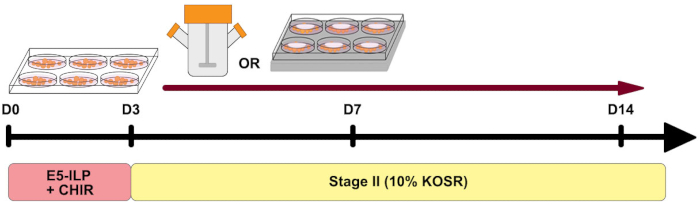
Figura 1: Visão geral do protocolo. Visão geral esquemática do protocolo mostrando o tempo dos dois estágios e o uso de frascos rotadores e 6MSP. Clique aqui para ver uma versão maior desta figura.
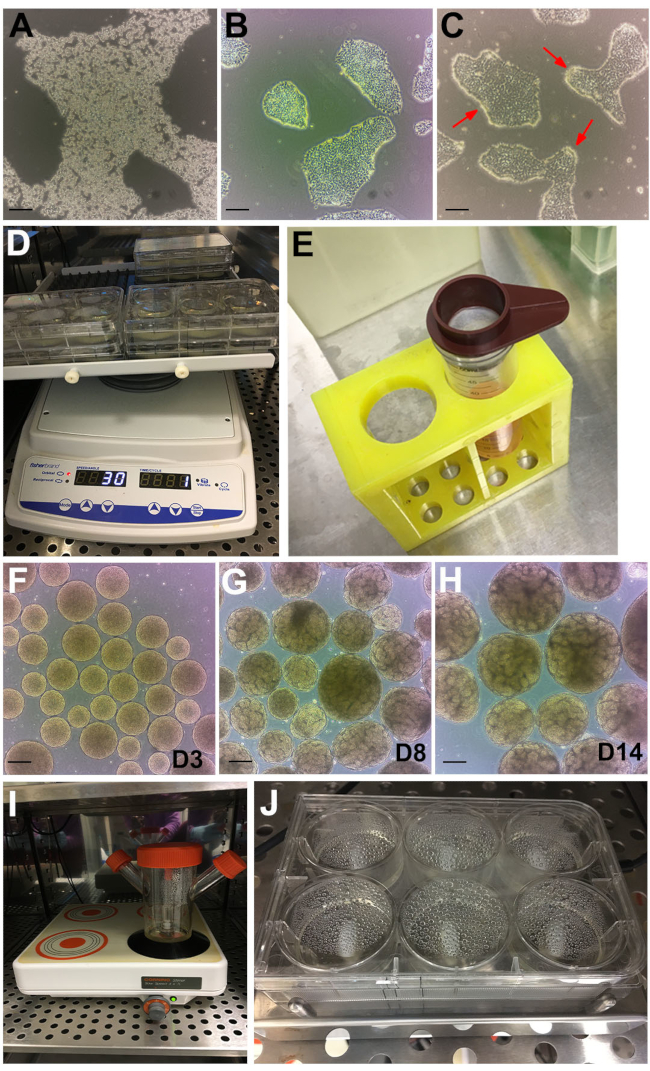
Figura 2: Etapas do protocolo. (A) Imagem de campo brilhante da colônia hPSC tratada com GCDR. (B) Confluência ideal e tamanho da colônia para iniciar um ensaio organoide renal. (C) hPSCs tratados com despase por 6 minutos. Flechas vermelhas apontam para bordas das colônias enroladas. (D) Ensaios organoides em um agitador orbital. (E) Uso de coador de células de 200 μm para peneirar grandes corpos embrionários. (F) Corpos embrionários no dia 3 (D3) antes de transferir para o estágio II médio. (G) O surgimento da formação de túbulos pode ser observado no dia 8 (D8) e (H) ponto de tempo ideal para colheita e tratamento organoide no dia 14 (D14). (I) Frasco rotador usado para cultura a granel em uma placa magnética de várias posições. (J) Ensaio em uma placa de mexida magnética multi-bem. Barras de escala, 200 μm. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Resultados esperados. (A) Imagens confocal representativas de seções de parafina do dia 14 organoides renais mostrando coloração positiva para epitélia de túbulo (HNF1B e LTL) e aglomerados de podocyte (MAFB). (B) Dia 26 seções organoides renais rotuladas para aglomerados de podocito (NPHS1) e células endoteliais (PECAM1). Barras de escala, 100 μm (A); 200 μm (B). Clique aqui para ver uma versão maior desta figura.
Discussão
Estudos anteriores mostraram que as etapas iniciais do protocolo são fundamentais para a diferenciação intermediária do mesoderm 5,19,20 e, portanto, é essencial implementar uma rigorosa composição média nesta fase. Remover componentes indefinidos como soro, albumina, híbridomoico livre de proteínas II do primeiro estágio do protocolo pode ajudar a melhorar a eficiência de diferenciação consistente entre os ensaios21.
O estado metabólico das células renais é fundamental para sua função, e alterações de glicose podem levar ao estado metabólico alterado22. Estudos anteriores descreveram que altos níveis de glicose (até 25 mM) podem induzir disfunção celular endotelial e alterar o crescimento e a capacidade oxidante das células renais 22,23,24. Altos níveis de glicose também foram descritos para alterar a função mitocondrial24, que pode ser desfavorável ao investigar doenças renais e nefrotoxicidade ou realizar a descoberta de medicamentos usando organoides renais. Reduzimos, portanto, o nível de glicose em nosso protocolo para promover um estado metabólico mais in vivo das células renais organoides. Como resultado, as modificações no ensaio organoide renal fornecem um protocolo consistente e robusto, mantendo sua simplicidade.
Os organoides renais são imaturos, e a cultura estendida (>20 dias) pode levar à incidência de tipos de células pró-fibrosas e não renais como descrito anteriormente 5,25, deixando os organoides menos representativos do tecido renal humano saudável. Com base em nossa experiência, a janela de tratamento ideal, onde os organoides renais estão mais saudáveis é entre os dias 14 e 18. O uso de frascos rotadores e agitadores magnéticos multi-poços como descrito acima aumentará a disponibilidade uniforme de nutrientes em oposição à cultura estática21,26. Se o equipamento para cultura de suspensão, como o agitador ou os agitadores magnéticos, este protocolo ainda pode ser realizado completamente nas placas de fixação ultra-baixas na cultura estática. Pode, no entanto, aumentar a incidência de corpos embrióides/fusão organoide, levando a grandes espécimes com núcleos necrosados devido à hipóxia. Quaisquer organoides maiores que 500 μm podem ser removidos usando os filtros celulares descritos. Para reduzir a chance de fusão dos organoides nesses casos, sugerimos não semear mais de 100 organoides por 6-well. Além disso, após a alimentação, os organoides devem ser distribuídos uniformemente realizando a figura oito movimentos com a placa.
Pode-se observar baixa eficiência (<50%) da formação organoide. Isso geralmente ocorre quando as culturas hPSC atingiram alta confluência (>80%) durante a passagem padrão. É fundamental que a manutenção do HPSC seja consistente e as células não sejam deixadas para se tornarem super-confluentes. A alta confluência e a técnica de passagem inconsistente também podem levar à diferenciação espontânea e ao aumento da morte celular. Se a diferenciação estiver presente na cultura hPSC, recomendamos a remoção das áreas diferenciadas aspirando com uma ponta de pipeta fina se não exceder 5% da população celular, antes de iniciar o ensaio. Se as áreas de diferenciação excederem 5%, recomendamos que um novo lote de hPSCs seja descongelado e dividido pelo menos uma vez antes de iniciar um novo ensaio.
Observamos que algumas linhas de hPSC são mais propensas a formar tipos de células não renais, como tecido cardíaco ou neural. Se isso ocorrer, a filtragem de tamanho usando os filtros celulares pode ajudar a remover os organoides que contêm crescimentos não-renais. Alternativamente, a alteração do meio e/ou matriz do HPSC pode ajudar a reduzir os crescimentos não renais. A partir de nossa experiência, as mídias alternativas hPSC contendo componentes mínimos, e BME, como a vitronectina, fornecem um nicho pluripotente mais rigoroso e, assim, ajudam a gerar culturas hPSC mais homogêneas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi financiada pelos Institutos Nacionais de Saúde R01 DK069403, UC2 DK126122 e P30-DK079307 e asan Foundation for Kidney Research Ben J. Lipps Research Fellowship Program to AP.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Thermo Fisher | 21-985-023 | |
| Anti-adherence rinsing solution | STEMCELL Technologies | 7010 | |
| CHIR99021 | STEMCELL Technologies | 72054 | 10 mM stock in DMSO |
| Corning disposable spinner flasks | Fisher Scientific | 07-201-152 | |
| Corning Ultra-Low Attachment 6-well plates | Fisher Scientific | 07-200-601 | |
| Corning Slow-Speed Stirrers | Fisher Scientific | 11-495-03 | Multi plate magnetic stirrer for spinner flask culture |
| Dispase | STEMCELL Technologies | 7923 | Aliquot and freeze |
| DMEM, low glucose, pyruvate, no glutamine, no phenol red | Thermo Fisher | 11054020 | |
| DPBS 1x, no calcium, no magnesium | Thermo Fisher | 14-190-250 | |
| Egg / Oval Stirring Bars | 2mag | PI20106 | |
| Excelta General-Purpose Tweezers | Fisher Scientific | 17-456-103 | Keep sterile in the cell culture hood |
| EZBio Single Use Media Bottle, 250mL | Foxx Life Sciences | 138-3211-FLS | Used to make PVA 10% |
| Falcon Standard Tissue Culture Dishes (100 mm) | Thermo Fisher | 08-772E | |
| Fisherbrand Sterile Aspirating Pipet 2mL | Fisher Scientific | 14-955-135 | |
| Fisherbrand Cell Lifters - Cell lifter | Fisher Scientific | 08-100-240 | |
| Fisherbrand Multi Function 3D Rotators | Fisher Scientific | 88-861-047 | Orbital shaker |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413302 | BME. Aliquot on ice and freeze. Another suitable matrix alternative is Matrigel or Cultrex. |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 7174 | GCDR |
| GlutaMAX Supplement | Thermo Fisher | 35-050-061 | L-glutamine supplement. |
| HEPES (1M) | Thermo Fisher | 15-630-080 | |
| Insulin-Transferrin-Selenium-Ethanolamine | Thermo Fisher | 51-500-056 | ITSE |
| KnockOut Serum Replacement - Multi-Species | Thermo Fisher | A3181502 | KOSR. Aliquot and freeze |
| Lipid Mixture 1, Chemically Defined | Millipore-Sigma | L0288-100ML | |
| MEM Non-Essential Amino Acids Solution | Thermo Fisher | 11140-050 | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 500mL | Fisher Scientific | S2GPU05RE | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 250mL | Fisher Scientific | S2GPU02RE | |
| MIXcontrol MTP / Variomag TELEcontrol MTP Control Unit | 2mag | VMF 90250 U | |
| MIXdrive 6 MTP / Variomag TELEdrive 6 MTP Microplate Stirring Drive | 2mag | VMF 40600 | 6MSP |
| MP Biomedicals 7X Cleaning Solution | Fisher Scientific | MP0976670A4 | Tissue culture suitable detergent. Make a 5% solution in water |
| mTeSR1 | STEMCELL Technologies | 85850 | hPSC medium.TeSR-E8, NutriStem XF, and mTeSR Plus medium have also been tested and are suitable alternatives. |
| Nunc 50 mL Conical, Sterile Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| Nunc 15mL Conical Sterile Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| Penicillin-Streptomycin | Thermo Fisher | 15-140-122 | Aliquot and freeze |
| Plasmocin | Invivogen | ant-mpt | Anti-mycoplasma reagent. Aliquot and freeze |
| pluriStrainer® 200 µm | Fisher Scientific | NC0776417 | Cell strainer |
| pluriStrainer® 500 µm | Fisher Scientific | NC0822591 | Cell strainer |
| Poly(vinyl alcohol) 87-90% hydrolyzed (PVA) | Millipore-Sigma | P8136-250G | 10% in DPBS stirring at 98 degrees C until disolves, make in 138-3211-FLS |
| ROCK inhibitor Y-27632 (ROCKi) | STEMCELL Technologies | 72304 | 10 mM stock in DPBS |
| Sterile Disposable Serological Pipets - 10mL | Fisher Scientific | 13-678-11E | |
| Sterile Disposable Serological Pipets - 25mL | Fisher Scientific | 13-678-11 | |
| Sterile Disposable Serological pipette - 5 mL | Fisher Scientific | 13-678-12D | |
| TeSR-E5 | STEMCELL Technologies | 5916 | Serum-free, low protein base medium for E5-ILP |
| Variomag distriBOX 2 Distributor | 2mag | VMF 90512 | If you use more than one MIXdrive |
Referências
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communications. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Taguchi, A., et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell. 14 (1), 53-67 (2013).
- Przepiorski, A., et al. A simple bioreactor-based method to generate kidney organoids from pluripotent stem cells. Stem Cell Reports. 11 (2), 470-484 (2018).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communication. 6, 8715 (2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Taguchi, A., Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell. 21 (6), 730-746 (2017).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514 (2020).
- Howden, S. E., Little, M. H. Generating kidney organoids from human pluripotent stem cells using defined conditions. Methods in Molecular Biology. 2155, 183-192 (2020).
- Tanigawa, S., et al. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. 13 (2), 322-337 (2019).
- Sander, V., et al. Protocol for large-scale production of kidney organoids from human pluripotent stem cells. STAR Protocols. 1 (3), 100150 (2020).
- Ekblom, P., Thesleff, I., Miettinen, A., Saxen, L. Organogenesis in a defined medium supplemented with transferrin. Cell Differentiation. 10 (5), 281-288 (1981).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. Journal of Embryology and Experimental Morphology. 82, 147-161 (1984).
- Freund, C., et al. Insulin redirects differentiation from cardiogenic mesoderm and endoderm to neuroectoderm in differentiating human embryonic stem cells. Stem Cells. 26 (3), 724-733 (2008).
- Nishikawa, M., et al. An optimal serum-free defined condition for in vitro culture of kidney organoids. Biochemistry and Biophysics Research Communication. 501 (4), 996-1002 (2018).
- Oh, J. K., et al. Derivation of induced pluripotent stem cell lines from New Zealand donors. Journal of the Royal Society of New Zealand. , 1-14 (2020).
- Takasato, M., et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nature Cell Biology. 16 (1), 118-126 (2013).
- Lam, A. Q., et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. Journal of American Society of Nephrology. 25 (6), 1211-1225 (2014).
- Bratt-Leal, A. M., Carpenedo, R. L., McDevitt, T. C. Engineering the embryoid body microenvironment to direct embryonic stem cell differentiation. Biotechnology Progress. 25 (1), 43-51 (2009).
- Imasawa, T., et al. High glucose repatterns human podocyte energy metabolism during differentiation and diabetic nephropathy. FASEB Journal. 31 (1), 294-307 (2017).
- Kim, K. A., et al. High glucose condition induces autophagy in endothelial progenitor cells contributing to angiogenic impairment. Biological and Pharmaceutical Bulletin. 37 (7), 1248-1252 (2014).
- Piwkowska, A., Rogacka, D., Audzeyenka, I., Jankowski, M., Angielski, S. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes. Journal of Cellular Biochemistry. 112 (6), 1661-1672 (2011).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Lei, X., Deng, Z., Duan, E. Uniform embryoid body production and enhanced mesendoderm differentiation with murine embryonic stem cells in a rotary suspension bioreactor. Methods in Molecular Biology. , (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados