Method Article
Un metodo semplificato per la generazione di organoidi renali da cellule staminali pluripotenti umane
In questo articolo
Riepilogo
Qui descriviamo un protocollo per generare organoidi renali da cellule staminali pluripotenti umane (hPSC). Questo protocollo genera organoidi renali entro due settimane. Gli organoidi renali risultanti possono essere coltivati in fiaschi spinner su larga scala o piastre magnetiche multi-pozzo per approcci paralleli di test antidroga.
Abstract
Gli organoidi renali generati dalle hPSC hanno fornito una fonte illimitata di tessuto renale. Gli organoidi renali umani sono uno strumento inestimabile per studiare malattie e lesioni renali, sviluppare terapie cellulari e testare nuove terapie. Per tali applicazioni è necessario un gran numero di organoidi uniformi e saggi altamente riproducibili. Abbiamo costruito sul nostro protocollo organoide renale precedentemente pubblicato per migliorare la salute generale degli organoidi. Questo semplice e robusto protocollo 3D prevede la formazione di corpi embrioidi uniformi in un mezzo componente minimo contenente lipidi, integratore di insulina-transferrina-selenio-etanolammina e alcool polivinilico con inibitore GSK3 (CHIR99021) per 3 giorni, seguito da coltura in mezzo contenente siero sostitutivo knock-out (KOSR). Inoltre, i saggi di agitazione consentono di ridurre l'aggregazione dei corpi embrioidi e di mantenere una dimensione uniforme, che è importante per ridurre la variabilità tra gli organoidi. Nel complesso, il protocollo fornisce un metodo veloce, efficiente ed economico per generare grandi quantità di organoidi renali.
Introduzione
Negli ultimi anni, sono stati sviluppati una serie di protocolli per differenziare le cellule staminali pluripotenti umane in organoidi renali 1,2,3,4,5. Gli organoidi renali hanno fornito uno strumento importante per aiutare la ricerca su nuovi approcci di medicina rigenerativa, modellare malattie renali, eseguire studi di tossicità e sviluppo di farmaci terapeutici. Nonostante la loro ampia applicabilità, gli organoidi renali hanno limitazioni come la mancanza di maturazione, la limitata capacità di coltura a lungo termine in vitro e una scarsità di diversi tipi di cellule presenti nel rene umano 6,7,8. Recenti lavori si sono concentrati sul miglioramento del livello di maturazione organoide, estendendo i periodi di coltura ed espandendo la complessità delle popolazioni di cellule renali modificando i protocolli esistenti 9,10,11,12. In questa attuale iterazione del nostro protocollo stabilito 5,13, abbiamo modificato i componenti medi nella prima fase del protocollo in un mezzo base privo di siero integrato con insulina-transferrina-selenio-etanolammina (ITSE), lipidi, alcool polivinilico (E5-ILP) e CHIR99021 (Figura 1). Questi cambiamenti forniscono un mezzo completamente definito, privo di siero, a basso contenuto proteico, con meno componenti rispetto alla nostra precedente composizione media 5,13 e senza ulteriori fattori di crescita. Di conseguenza, il mezzo di prima fase è meno laborioso da preparare rispetto alla nostra versione pubblicata in precedenza e può ridurre la variabilità da lotto a lotto5. Studi precedenti hanno dimostrato che sia l'insulina che la transferrina sono importanti nella coltura priva di siero14,15, tuttavia, alti livelli di insulina possono essere inibitori della differenziazione del mesoderma16. Abbiamo mantenuto i bassi livelli di insulina come previsto nel protocollo originale e ulteriormente ridotto i livelli di KOSR (contenente insulina) nella seconda fase del test. In linea con altri protocolli per la formazione di organoidi renali, livelli più bassi di KOSR sono utili per mantenere un equilibrio tra proliferazione e differenziazione del tessuto renale17. Inoltre, abbiamo abbassato la concentrazione di glucosio nel nostro mezzo di stadio II13.
Il nostro metodo descrive una configurazione per il dosaggio in sospensione di organoidi renali, producendo fino a ~ 1.000 organoidi da una piastra di coltura iniziale di hPSC 100 mm confluente al ~ 60% come descritto nella pubblicazione originale 5,13. Questo protocollo può essere facilmente scalato fino a partire da più piastre da 100 mm o 150 mm per aumentare ulteriormente i numeri organoidi.
Protocollo
Tutti gli esperimenti che utilizzano hPSC sono stati eseguiti in conformità con le linee guida istituzionali e sono stati condotti in una cappa di biosicurezza di Classe II con adeguati dispositivi di protezione individuale. Tutti i reagenti sono di grado di coltura cellulare, salvo diversa indicazione. Tutte le colture vengono incubate a 37 °C, 5% CO2 atmosfera atmosferica. In tutte le fasi del test, i corpi embrioidi o gli organoidi renali possono essere raccolti e fissati o preparati per l'analisi. Le linee hPSC utilizzate per generare questi dati sono state completamente caratterizzate e pubblicate18.
1. Preparazione delle tavole di coltura
NOTA: Circa 1 ora prima della scissione delle hPSC, rivestire 2 piastre di coltura tissutale da 100 mm con un estratto di matrice di membrana basale qualificato (BME) di cellule staminali. Si possono pre-rivestire le piastre, sigillarle con un film di paraffina e conservare a 4 °C secondo le istruzioni del produttore.
- Preparare 2 piastre tissutali da 100 mm trattate in coltura (1 per il saggio organoide renale, 1 per mantenere la linea cellulare) e un tubo conico da 15 ml nella cappa di biosicurezza di Classe II.
- Aliquota 8 mL di Modified Eagle Medium (DMEM) di Dulbecco freddo e privo di siero in un tubo conico da 15 mL e ~ 4 mL in ciascuna delle piastre da 100 mm, sufficienti a coprire il fondo di ciascuna piastra con il mezzo.
- Estrarre dal congelatore un'aliquota di BME di 100 μL (-20 °C). Utilizzando una pipetta sierologica da 2 ml, prelevare ~ 1 mL di DMEM freddo dal tubo conico da 15 mL. Scongelare lentamente l'aliquota BME pipettando delicatamente su e giù con il DMEM freddo, evitando di produrre bolle.
NOTA: Non lasciare che l'aliquota BME rimanga a temperatura ambiente. Utilizzare immediatamente. - Trasferire il DMEM/BME scongelato nel tubo conico da 15 ml con il DMEM rimanente. Con una pipetta sierologica da 10 ml, mescolare delicatamente il BME diluito pipettando su e giù almeno 8 volte per disperdere uniformemente il BME, evitando di creare bolle.
- Trasferire 4 mL del BME diluito in ogni piastra con DMEM e ruotare delicatamente la piastra in modo che il BME sia distribuito uniformemente. Incubare la piastra rivestita per 1 ora a temperatura ambiente o 30 minuti a 37 °C.
NOTA: utilizzare 50 μL di BME per piastra da 100 mm. L'uso di altri terreni di coltura hPSC e linee cellulari può richiedere diverse concentrazioni di BME.
2. Passaging hPSC
NOTA: per la coltura hPSC di routine, linee cellulari di passaggio con confluenza del 70-80%.
- Aspirare il terreno di coltura dalla piastra hPSC da far passare. Aggiungere ~ 8 ml di soluzione salina tamponata con fosfato di Dulbecco (DPBS) alla piastra hPSC e ruotare delicatamente per lavare le cellule.
- Aspirare DBPS e aggiungere 2 ml di reagente di dissociazione a cellule gentili (GCDR) alla piastra da 100 mm, goccia a goccia sulla parte superiore per coprire le cellule.
NOTA: possono essere utilizzati anche altri reagenti di dissociazione. Regolare di conseguenza. - Incubare a temperatura ambiente per ~ 6-8 minuti fino a quando le colonie si stanno rompendo e le cellule sono rifrattive sotto contrasto di fase (Figura 2A).
NOTA: la temporizzazione può variare tra le linee cellulari. Regolare di conseguenza. - Durante l'incubazione, preparare un tubo conico da 50 ml. Aggiungere 16 mL di mezzo hPSC (8 mL per piastra da 100 mm) e aggiungere l'inibitore della chinasi rho-associata (ROCKi) a una concentrazione finale di 5 μM.
- Aspirare DMEM dalle piastre rivestite BME e aggiungere 8 ml di mezzo hPSC più ROCKi a ciascuna piastra.
- Quando le cellule sono pronte (come descritto al punto 2.3, Figura 2A), aspirare il GCDR e inclinare la piastra di ~45° verso lo sperimentatore e raschiare le cellule con un sollevatore di cellule.
NOTA: se le celle si stanno sta staccando, omettere l'aspirazione di GCDR e procedere. - Ruotare la piastra di ~ 90 ° e raschiare di nuovo per sollevare le celle rimanenti. Tenere la piastra ~ 45 ° e lavare le celle con 3 mL di mezzo hPSC utilizzando una pipetta sierologica da 10 mL.
- Pipettare delicatamente su e giù per rompere grandi ciuffi (non più di 2-3 volte) e seminare le cellule al rapporto appropriato per la linea cellulare di interesse sulle piastre preparate. Posizionare la piastra con le cellule nell'incubatrice e spostare delicatamente la piastra in movimento figura otto per distribuire le cellule in modo uniforme.
NOTA: In questo esperimento le linee hPSC sono state divise in un rapporto di 1:5, questo può variare per altre linee cellulari e condizioni. Lascia il piatto indisturbato durante la notte. - Dopo ~ 24 ore, esaminare le celle per l'attacco. Cerca piccole colonie individuali attaccate. Aspirare il mezzo esaurito e reintegrare con 8 ml di mezzo hPSC fresco (senza ROCKi aggiunto).
- Continuare a osservare e nutrire quotidianamente fino a quando le cellule raggiungono ~ 60% di confluenza per iniziare il test organoide renale (di solito raggiunto da 48 a 72 ore dopo il passaggio). Le colonie saranno idealmente discrete e non si fonderanno (Figura 2B).
NOTA: È molto importante limitare le cellule a non più dell'80% di confluenza per mantenere il loro stato di pluripotenza. Colture confluenti, manipolazione ruvida o passaggi più alti possono portare a differenziazione spontanea indesiderata o bassa efficienza della formazione di organoidi renali.
3. Giorno 0 - Impostazione del test organoide renale
- Prima di iniziare, preparare sia il mezzo E5-ILP che il supporto Stage II secondo le formulazioni (Tabella 1 e Tabella 2).
NOTA: il supporto può essere conservato per un massimo di 14 giorni a 4 °C. - Per un saggio organoide renale (è necessaria una piastra di coltura da 100 mm per una piastra a 6 pozzetti), preparare un mezzo E5-ILP completo in un tubo conico da 50 mL: 18 mL di E5-ILP integrati con 8 μM CHIR99021 (14,4 μL), 3,3 μM ROCKi (6 μL), 0,1 mM beta-mercaptoetanolo (32,7 μL).
- Posizionare 2 mL di mezzo E5-ILP completo in ciascun pozzetto di una piastra di attacco ultra-bassa a 6 pozzetti.
- Lavare le hPSC a ~60 % di confluenza (Figura 2B) due volte con ~ 8 ml di DPBS. Aspirare DPBS quindi aggiungere 2 mL di dispase per piastra da 100 mm, goccia a goccia per coprire le celle e incubare per 6 min a 37 °C.
NOTA: Dopo 6 minuti, i bordi delle colonie inizieranno ad arricciarsi (Figura 2C, frecce rosse) mentre il resto della colonia rimane attaccato. Se questo non si ottiene dopo 6 minuti, riposizionare le cellule nell'incubatore per ulteriori 30 s. Altri supporti e matrici hPSC potrebbero non essere compatibili con questa temporizzazione. Il rivestimento BME a base di laminina non è compatibile con la dispase. Se i BME a base di laminina sono la matrice hPSC standard, rivestire una delle piastre nella sezione 1 con il BME descritto in questo metodo da utilizzare per il saggio organoide renale. - Celle di lavaggio 3x con ~10 mL di DPBS. Aspirare DPBS quindi inclinare la piastra ~ 45 ° e raschiare verso il basso con un sollevatore di celle.
NOTA: Dispase non è disattivato, quindi deve essere lavato accuratamente. Non ridurre il numero di lavaggi. - Lavare le colonie dall'alto con 6 mL di mezzo E5-ILP completo utilizzando una pipetta sierologica da 10 mL. Pipettare su e giù delicatamente per rompere eventuali colonie di grandi dimensioni (2 o 3 volte è di solito sufficiente).
- Distribuire uniformemente i grappoli di colonie aggiungendo 1 mL per pozzetto nella piastra a 6 pozzetti. Posizionare la piastra su uno shaker orbitale (impostazioni: orbitale = 30, reciproco = 330°, vibrazione = 5° - 2 s) che viene posizionato nell'incubatore a 37 °C (Figura 2D).
NOTA: La caratteristica di vibrazione è importante per un'adeguata distribuzione degli organoidi e per evitare l'aggregazione.
4. Giorno 2 - Alimentazione con cambio mezzo-medio
NOTA: Entro le 48 ore, i cluster di colonie formeranno corpi embrioidi.
- Preparare il mezzo completo: per una piastra a 6 pozzetti preparare 12 mL di mezzo E5-ILP + 8 μM CHIR99021 in un tubo conico da 15 ml.
NOTA: Beta-mercaptoetanolo e ROCKi non sono necessari. - Lasciare che i corpi embrioidi si depositino nella parte inferiore della piastra, inclinare la piastra ~ 45 ° quindi aspirare lentamente il mezzo dall'alto, lasciare ~ 1 mL per pozzetto.
NOTA: I corpi embrioidi in questa fase si aggregano rapidamente. Non lasciarli accontentarsi di > 5 min. - Aggiungere 2 ml di mezzo completo preparato (sezione 4.1) per pozzetto. Riportare la piastra sullo shaker.
5. Giorno 3 - Trasferimento di corpi embrioidi al mezzo di stadio II
- Preparare un tubo conico da 50 ml e DMEM (basso contenuto di glucosio). Lascia che i corpi embrioidi si depositino sul fondo del piatto. Inclinare la piastra ~ 45 ° e aspirare lentamente il mezzo dall'alto, lasciare ~ 1 mL per pozzetto.
- Raccogliere con cura tutti i corpi embrioidi da ciascun pozzo utilizzando una pipetta sierologica da 10 ml e trasferirli nel tubo conico da 50 ml.
- Lavare ogni pozzetto per raccogliere eventuali corpi embrioidi rimanenti con ~ 1 mL di DMEM (basso glucosio) e aggiungerli allo stesso tubo conico da 50 ml.
- Lasciare che i corpi embrioidi si depositino sul fondo del tubo, ~ 5 min. Durante l'attesa, aggiungere 2 ml di mezzo Stage II a ciascun pozzetto della piastra a 6 pozzetti. Elimina grandi corpi embrioidi (>300 μm) utilizzando un filtro cellulare da 200 μm (Figura 2E).
- Utilizzare un nuovo tubo conico da 50 ml e posizionare il filtro cellulare da 200 μm sopra. Pipettare tutti i corpi embrioidi usando una pipetta sierologica da 10 ml con attenzione sopra il filtro cellulare.
- Risciacquare il colino cellulare con un ulteriore ~ 5 mL di DMEM (basso glucosio) per raccogliere eventuali corpi embrioidi bloccati nel filtro cellulare. Lasciare che i corpi embrioidi si depositino sul fondo del tubo conico.
- Quando i corpi embrioidi sono sistemati, aspirare il surnatante e lavare con ~ 10 ml di DMEM (basso contenuto di glucosio).
- Aspirare DMEM e risospendere i corpi embrioidi in 6 mL di terreno di stadio II.
- Trasferire i corpi embrioidi nella piastra di attacco ultra-bassa a 6 pozzetti, distribuendoli uniformemente tra i 6 pozzetti.
- Effettuare mezze modifiche medie come descritto nei passaggi 4.2 e 4.3 a giorni alterni.
NOTA: Dal giorno 3 in poi, i corpi embrioidi avranno un aspetto sferico "dorato" e liscio (Figura 2F). Dal ~ giorno 6, la formazione dei tubuli nei singoli corpi embrioidi diventerà evidente, con un numero crescente nei giorni successivi che raggiungerà numeri ottimali e una crescita entro il giorno 14 (Figura 2G, H) . Per eliminare la formazione occasionale di aggregazioni, osservando visivamente gli organoidi renali o corpi embrioidi molto piccoli senza tubuli, setacciare gli organoidi <200 e grandi >500 μm con filtri cellulari da 500 e 200 μm come descritto nei passaggi 5.4.1 e 5.4.2.
6. Trasferire al pallone spinner e l'alimentazione
NOTA: un pallone spinner può essere utilizzato in qualsiasi momento dal giorno 3 in poi per esperimenti che richiedono un gran numero di organoidi. Il trasferimento di routine degli organoidi avviene nel nostro laboratorio tra i giorni 6-8. Si prega di consultare la sezione Discussione per le alternative se l'attrezzatura non è disponibile.
- Trasferire i corpi embrioidi in un pallone da 125 mL con 45 mL di mezzo allo stadio II. Impostare la velocità dell'agitatore magnetico a 120 giri/min e inserirla nell'incubatore (Figura 2I).
- Per nutrire corpi embrioidi o organoidi renali, lasciare che gli organoidi renali si depositino brevemente sul fondo del pallone spinner. Sollevare il coperchio da un braccio laterale del pallone e posizionare la pipetta aspirante all'interno, con la punta che tocca la parete interna opposta.
- Inclinare lentamente la pipetta aspirante verso il basso e aspirare circa la metà del mezzo. Reintegrare con 20 ml di mezzo fresco Stage II pipettandolo attraverso la stessa apertura.
7. Impostazione della piastra magnetica a 6 pozzetti (6MSP)
NOTA: il formato 6MSP può essere utilizzato al posto dei palloni spinner se è necessario testare più condizioni. Utilizzare il 6MSP per trattamenti composti o nefrotossina. Ciò consente di risparmiare la quantità di mezzo utilizzato nella seconda fase, pur mantenendo la disponibilità di nutrienti attraverso la diffusione.
- Pulire brevemente le barre magnetiche ovali in un tubo conico da 50 ml lavando brevemente in una coltura tissutale un detergente adatto (se mai utilizzato) o immergere per > 1 ora se precedentemente utilizzato.
- Lavare brevemente 3 volte in DPBS sterile.
- Lavare 1x per 5 min in etanolo al 70%, 1x in DPBS sterile.
- Risciacquare con soluzione anti aderenza e lavare 1x in DPBS sterile e aspirare.
- Con attenzione, usando lunghe pinze sterili posizionare una barra magnetica in ciascun pozzetto della piastra a 6 pozzetti con corpi embrioidi o organoidi renali.
- Posizionare la piastra sul 6MSP e impostare la velocità su 120 rpm (Figura 2J). Mantenere gli organoidi renali con mezzo cambiamento medio come da paragrafi 4.2 e 4.3.
NOTA: affinché le barre magnetiche si inseriscano in posizione e inizino a girare, potrebbe essere necessario prima mettere brevemente il livello di potenza a 100, quindi una volta che sono tutte rotanti, portare il livello di potenza a 25.
Risultati
In questa versione più recente del nostro protocollo, la differenziazione degli organoidi renali viene avviata in un mezzo definito a basso contenuto proteico. I saggi vengono eseguiti interamente in sospensione e si basano sulla capacità innata di differenziazione e organizzazione delle hPSC per l'inizio della tubulogenesi. Un singolo test proveniente da una piastra di coltura hPSC confluente da 100 mm ~ 60% produce abitualmente 500-1.000 organoidi renali, come mostrato nella nostra precedente pubblicazione5. A causa di un numero così elevato di organoidi generati, questo protocollo è adatto per i test dei composti. Utilizziamo abitualmente un formato a 6 pozzetti per i test dei composti, tuttavia, questo protocollo può essere facilmente scalato nella seconda fase (dal giorno 3 in poi) ad altri formati multi-pozzo per test composti a throughput più elevato. L'immunofluorescenza delle sezioni di paraffina mostra la presenza di segmenti di nefrone negli organoidi, cioè tubuli renali che esprimono Hepatocyte Nuclear Factor-1 beta (HNF1B) e Lotus Tetragonolobus Lectin (LTL) (Figura 3A - HNF1B, LTL), e cluster di podociti che esprimono V-maf Muscoloaponeurotic Fibrosarcoma oncogene omologo B (MAFB) e nefrina (NPHS1) (Figura 3A - MAFB, Figura 3B - NPHS1). Inoltre, le modifiche in questo protocollo possono supportare l'espansione delle cellule endoteliali come si vede nella Figura 3B che mostra la colorazione con piastrine e molecola di adesione delle cellule endoteliali 1 (PECAM1) al giorno 26 della coltura.
| Reagente | Stock conc. | Lavoro conc. | Quantità per 250 ml |
| TeSR-E5 · | n/d | n/d | 238,48 ml |
| PVA | 10% | 0.25% | 6,25 ml |
| Penna-Streptococco | 100x | 1x | 2,5 ml |
| ITSE | 100x | 0,1x | 250 μL |
| Lipidi chimicamente definiti | 100x | 1x | 2,5 ml |
| Plasmocina | 25 mg/mL | 2,5 μg/mL | 25 μL |
Tabella 1: Composizione media E5-ILP. Pipettare tutti i reagenti ad eccezione dei lipidi chimicamente definiti e del reagente anti-micoplasma direttamente nella camera superiore di un'unità di filtrazione Stericup da 0,22 μm. Dopo la filtrazione, aggiungere i lipidi e il reagente anti-micoplasma. Conservare a 4 °C per un massimo di due settimane.
| Reagente | Stock conc. | Lavoro conc. | Quantità per 500 ml |
| DMEM (Basso glucosio) | n/d | n/d | 417,5 ml |
| KOSR · | n/d | 10% | 50 ml |
| PVA | 10% | 0.25% | 12,5 ml |
| Penna-Streptococco | 100x | 1x | 5 ml |
| MEM-NEAA | 100x | 1x | 5 ml |
| GlutaMAX | 100x | 1x | 5 ml |
| HEPES · | 100x | 1x | 5 ml |
| Plasmocina | 25 mg/mL | 2,5 μg/mL | 50 μL |
Tabella 2: Fase II composizione media. Pipettare tutti i reagenti tranne il reagente anti-micoplasma direttamente nella camera superiore di un'unità di filtrazione Stericup da 0,22 μm. Una volta filtrato, aggiungere il reagente anti-micoplasma. Conservare a 4 °C per un massimo di due settimane.
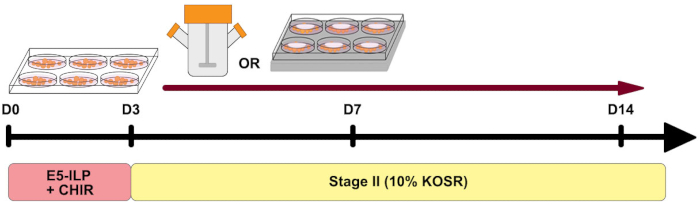
Figura 1: Panoramica del protocollo. Panoramica schematica del protocollo che mostra la tempistica delle due fasi e l'uso di fiaschi spinner e 6MSP. Fare clic qui per visualizzare una versione più grande di questa figura.
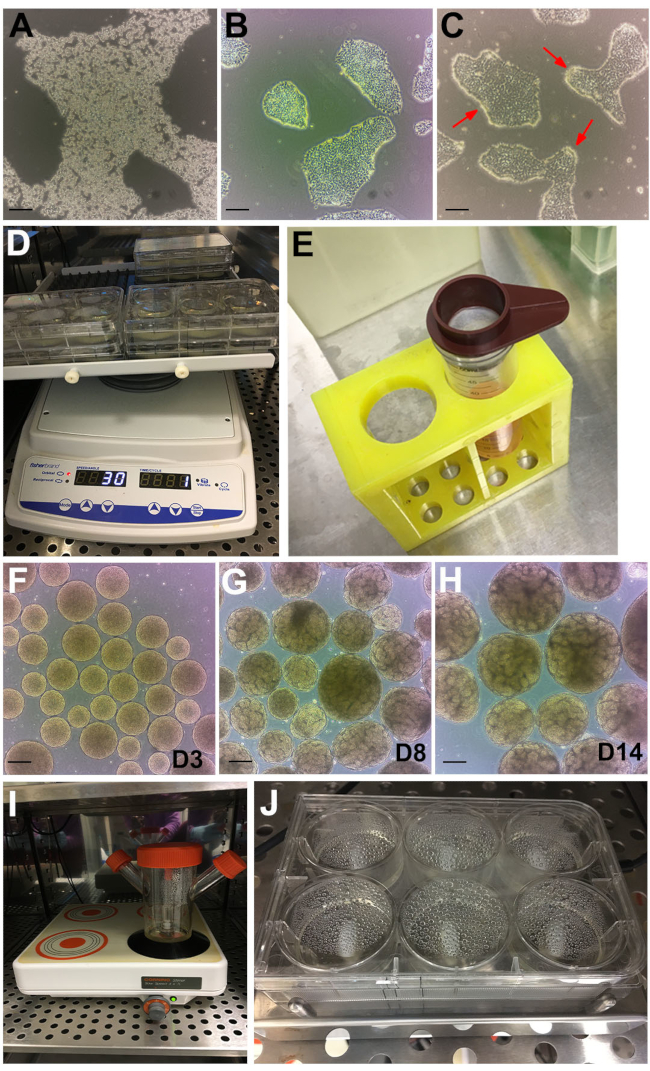
Figura 2: Fasi del protocollo. (A) Immagine in campo luminoso della colonia di hPSC trattata con GCDR. (B) Confluenza ottimale e dimensioni della colonia per iniziare un test organoide renale. C) hPSC trattate con dispase per 6 minuti. Le frecce rosse indicano i bordi delle colonie che si raggomitolano. (D) Saggi organoidi su uno shaker orbitale. (E) Uso di un colino cellulare da 200 μm per setacciare grandi corpi embrioidi. (F) Corpi embrioidi al giorno 3 (D3) prima del trasferimento al mezzo di stadio II. (G) L'emergere della formazione di tubuli può essere osservato al giorno 8 (D8) e (H) punto temporale ottimale per la raccolta e il trattamento degli organoidi al giorno 14 (D14). I) Pallone spinner utilizzato per la coltura alla rinfusa su una piastra magnetica multiposizione. (J) Saggio su una piastra magnetica multi-pozzo. Barre di scala, 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Risultati attesi. (A) Immagini confocali rappresentative di sezioni di paraffina marcate immunofluorescente degli organoidi renali del giorno 14 che mostrano colorazione positiva per epiteli tubulari (HNF1B e LTL) e cluster di podociti (MAFB). (B) Giorno 26 sezioni organoidi renali etichettate per cluster di podociti (NPHS1) e cellule endoteliali (PECAM1). Barre di scala, 100 μm (A); 200 μm (B). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Studi precedenti hanno dimostrato che le fasi iniziali del protocollo sono fondamentali per la differenziazione del mesoderma intermedio 5,19,20 e, pertanto, è essenziale implementare una composizione media rigorosa in questa fase. La rimozione di componenti indefiniti come siero, albumina, ibridoma medio II privo di proteine dal primo stadio del protocollo può aiutare a migliorare l'efficienza di differenziazione coerente tra i saggi21.
Lo stato metabolico delle cellule renali è fondamentale per la loro funzione e i cambiamenti del glucosio possono portare allo stato metabolico alterato22. Studi precedenti hanno descritto che alti livelli di glucosio (fino a 25 mM) possono indurre disfunzione delle cellule endoteliali e alterare la crescita e la capacità ossidante delle cellule renali 22,23,24. Sono stati anche descritti alti livelli di glucosio per alterare la funzione mitocondriale24, che può essere sfavorevole quando si indaga sulla malattia renale e la nefrotossicità o si esegue la scoperta di farmaci utilizzando organoidi renali. Abbiamo, quindi, ridotto il livello di glucosio nel nostro protocollo per promuovere uno stato metabolico più in vivo delle cellule renali organoidi. Di conseguenza, le modifiche al test organoide renale forniscono un protocollo coerente e robusto, pur mantenendo la sua semplicità.
Gli organoidi renali sono immaturi e la coltura prolungata (>20 giorni) può portare all'incidenza di tipi di cellule pro-fibrotiche e non renali come precedentemente descritto 5,25, lasciando gli organoidi meno rappresentativi del tessuto renale umano sano. Sulla base della nostra esperienza, la finestra di trattamento ottimale, in cui gli organoidi renali sono più sani è tra i giorni 14-18. L'uso di fiaschi spinner e agitatori magnetici multi-pozzo come descritto sopra migliorerà la disponibilità uniforme di nutrienti rispetto alla coltura statica21,26. Se le apparecchiature per la coltura delle sospensioni come lo shaker o gli agitatori magnetici non sono disponibili, questo protocollo può comunque essere eseguito completamente nelle piastre di attacco ultra-basse in coltura statica. Ci può tuttavia essere una maggiore incidenza di corpi embrioidi / fusione organoide, portando a grandi campioni con nuclei necrotici a causa dell'ipossia. Qualsiasi organoide di dimensioni superiori a 500 μm può essere rimosso utilizzando i filtri cellulari descritti. Per ridurre la possibilità di fusione degli organoidi in questi casi, suggeriamo di non seminare più di 100 organoidi per 6-pozzetti. Inoltre, dopo l'alimentazione, gli organoidi devono essere distribuiti uniformemente eseguendo la figura otto movimenti con la piastra.
Si può osservare una bassa efficienza (<50%) della formazione di organoidi. Questo di solito si verifica quando le colture hPSC hanno raggiunto un'elevata confluenza (>80%) durante il passaging standard. È fondamentale che la manutenzione dell'hPSC sia coerente e che le cellule non vengano lasciate diventare troppo confluenti. L'alta confluenza e la tecnica di passaggio incoerente possono anche portare a differenziazione spontanea e aumento della morte cellulare. Se la differenziazione è presente nella coltura hPSC, si consiglia di rimuovere le aree differenziate aspirando con una punta di pipetta fine se non supera il 5% della popolazione cellulare, prima di iniziare il test. Se le aree di differenziazione superano il 5%, si consiglia di scongelare e dividere un nuovo lotto di hPSC almeno una volta prima di iniziare un nuovo test.
Abbiamo osservato che alcune linee hPSC sono più inclini a formare tipi di cellule non renali, come il tessuto cardiaco o neurale. Se ciò si verifica, la filtrazione dimensionale utilizzando i filtri cellulari può aiutare a rimuovere quegli organoidi che contengono escrescenze non renali. In alternativa, la modifica del mezzo e/o della matrice hPSC può aiutare a ridurre le escrescenze non renali. Dalla nostra esperienza, i mezzi hPSC alternativi contenenti componenti minimi e BME come vitronectin, forniscono una nicchia pluripotente più rigorosa e quindi aiutano a generare colture hPSC più omogenee.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dal National Institutes of Health R01 DK069403, UC2 DK126122 e P30-DK079307 e ASN Foundation for Kidney Research Ben J. Lipps Research Fellowship Program to AP.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Thermo Fisher | 21-985-023 | |
| Anti-adherence rinsing solution | STEMCELL Technologies | 7010 | |
| CHIR99021 | STEMCELL Technologies | 72054 | 10 mM stock in DMSO |
| Corning disposable spinner flasks | Fisher Scientific | 07-201-152 | |
| Corning Ultra-Low Attachment 6-well plates | Fisher Scientific | 07-200-601 | |
| Corning Slow-Speed Stirrers | Fisher Scientific | 11-495-03 | Multi plate magnetic stirrer for spinner flask culture |
| Dispase | STEMCELL Technologies | 7923 | Aliquot and freeze |
| DMEM, low glucose, pyruvate, no glutamine, no phenol red | Thermo Fisher | 11054020 | |
| DPBS 1x, no calcium, no magnesium | Thermo Fisher | 14-190-250 | |
| Egg / Oval Stirring Bars | 2mag | PI20106 | |
| Excelta General-Purpose Tweezers | Fisher Scientific | 17-456-103 | Keep sterile in the cell culture hood |
| EZBio Single Use Media Bottle, 250mL | Foxx Life Sciences | 138-3211-FLS | Used to make PVA 10% |
| Falcon Standard Tissue Culture Dishes (100 mm) | Thermo Fisher | 08-772E | |
| Fisherbrand Sterile Aspirating Pipet 2mL | Fisher Scientific | 14-955-135 | |
| Fisherbrand Cell Lifters - Cell lifter | Fisher Scientific | 08-100-240 | |
| Fisherbrand Multi Function 3D Rotators | Fisher Scientific | 88-861-047 | Orbital shaker |
| Geltrex LDEV-Free Reduced Growth Factor Basement Membrane Matrix | Thermo Fisher | A1413302 | BME. Aliquot on ice and freeze. Another suitable matrix alternative is Matrigel or Cultrex. |
| Gentle Cell Dissociation Reagent | STEMCELL Technologies | 7174 | GCDR |
| GlutaMAX Supplement | Thermo Fisher | 35-050-061 | L-glutamine supplement. |
| HEPES (1M) | Thermo Fisher | 15-630-080 | |
| Insulin-Transferrin-Selenium-Ethanolamine | Thermo Fisher | 51-500-056 | ITSE |
| KnockOut Serum Replacement - Multi-Species | Thermo Fisher | A3181502 | KOSR. Aliquot and freeze |
| Lipid Mixture 1, Chemically Defined | Millipore-Sigma | L0288-100ML | |
| MEM Non-Essential Amino Acids Solution | Thermo Fisher | 11140-050 | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 500mL | Fisher Scientific | S2GPU05RE | |
| MilliporeSigma Stericup Quick Release-GP Sterile Vacuum Filtration System 250mL | Fisher Scientific | S2GPU02RE | |
| MIXcontrol MTP / Variomag TELEcontrol MTP Control Unit | 2mag | VMF 90250 U | |
| MIXdrive 6 MTP / Variomag TELEdrive 6 MTP Microplate Stirring Drive | 2mag | VMF 40600 | 6MSP |
| MP Biomedicals 7X Cleaning Solution | Fisher Scientific | MP0976670A4 | Tissue culture suitable detergent. Make a 5% solution in water |
| mTeSR1 | STEMCELL Technologies | 85850 | hPSC medium.TeSR-E8, NutriStem XF, and mTeSR Plus medium have also been tested and are suitable alternatives. |
| Nunc 50 mL Conical, Sterile Centrifuge Tubes | Fisher Scientific | 12-565-270 | |
| Nunc 15mL Conical Sterile Centrifuge Tubes | Fisher Scientific | 12-565-268 | |
| Penicillin-Streptomycin | Thermo Fisher | 15-140-122 | Aliquot and freeze |
| Plasmocin | Invivogen | ant-mpt | Anti-mycoplasma reagent. Aliquot and freeze |
| pluriStrainer® 200 µm | Fisher Scientific | NC0776417 | Cell strainer |
| pluriStrainer® 500 µm | Fisher Scientific | NC0822591 | Cell strainer |
| Poly(vinyl alcohol) 87-90% hydrolyzed (PVA) | Millipore-Sigma | P8136-250G | 10% in DPBS stirring at 98 degrees C until disolves, make in 138-3211-FLS |
| ROCK inhibitor Y-27632 (ROCKi) | STEMCELL Technologies | 72304 | 10 mM stock in DPBS |
| Sterile Disposable Serological Pipets - 10mL | Fisher Scientific | 13-678-11E | |
| Sterile Disposable Serological Pipets - 25mL | Fisher Scientific | 13-678-11 | |
| Sterile Disposable Serological pipette - 5 mL | Fisher Scientific | 13-678-12D | |
| TeSR-E5 | STEMCELL Technologies | 5916 | Serum-free, low protein base medium for E5-ILP |
| Variomag distriBOX 2 Distributor | 2mag | VMF 90512 | If you use more than one MIXdrive |
Riferimenti
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communications. 6, 8715(2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Taguchi, A., et al. Redefining the in vivo origin of metanephric nephron progenitors enables generation of complex kidney structures from pluripotent stem cells. Cell Stem Cell. 14 (1), 53-67 (2013).
- Przepiorski, A., et al. A simple bioreactor-based method to generate kidney organoids from pluripotent stem cells. Stem Cell Reports. 11 (2), 470-484 (2018).
- Freedman, B. S., et al. Modelling kidney disease with CRISPR-mutant kidney organoids derived from human pluripotent epiblast spheroids. Nature Communication. 6, 8715(2015).
- Morizane, R., et al. Nephron organoids derived from human pluripotent stem cells model kidney development and injury. Nature Biotechnology. 33 (11), 1193-1200 (2015).
- Takasato, M., et al. Kidney organoids from human iPS cells contain multiple lineages and model human nephrogenesis. Nature. 526 (7574), 564-568 (2015).
- Taguchi, A., Nishinakamura, R. Higher-order kidney organogenesis from pluripotent stem cells. Cell Stem Cell. 21 (6), 730-746 (2017).
- Uchimura, K., Wu, H., Yoshimura, Y., Humphreys, B. D. Human pluripotent stem cell-derived kidney organoids with improved collecting duct maturation and injury modeling. Cell Reports. 33 (11), 108514(2020).
- Howden, S. E., Little, M. H. Generating kidney organoids from human pluripotent stem cells using defined conditions. Methods in Molecular Biology. 2155, 183-192 (2020).
- Tanigawa, S., et al. Activin is superior to BMP7 for efficient maintenance of human iPSC-derived nephron progenitors. Stem Cell Reports. 13 (2), 322-337 (2019).
- Sander, V., et al. Protocol for large-scale production of kidney organoids from human pluripotent stem cells. STAR Protocols. 1 (3), 100150(2020).
- Ekblom, P., Thesleff, I., Miettinen, A., Saxen, L. Organogenesis in a defined medium supplemented with transferrin. Cell Differentiation. 10 (5), 281-288 (1981).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. Journal of Embryology and Experimental Morphology. 82, 147-161 (1984).
- Freund, C., et al. Insulin redirects differentiation from cardiogenic mesoderm and endoderm to neuroectoderm in differentiating human embryonic stem cells. Stem Cells. 26 (3), 724-733 (2008).
- Nishikawa, M., et al. An optimal serum-free defined condition for in vitro culture of kidney organoids. Biochemistry and Biophysics Research Communication. 501 (4), 996-1002 (2018).
- Oh, J. K., et al. Derivation of induced pluripotent stem cell lines from New Zealand donors. Journal of the Royal Society of New Zealand. , 1-14 (2020).
- Takasato, M., et al. Directing human embryonic stem cell differentiation towards a renal lineage generates a self-organizing kidney. Nature Cell Biology. 16 (1), 118-126 (2013).
- Lam, A. Q., et al. Rapid and efficient differentiation of human pluripotent stem cells into intermediate mesoderm that forms tubules expressing kidney proximal tubular markers. Journal of American Society of Nephrology. 25 (6), 1211-1225 (2014).
- Bratt-Leal, A. M., Carpenedo, R. L., McDevitt, T. C. Engineering the embryoid body microenvironment to direct embryonic stem cell differentiation. Biotechnology Progress. 25 (1), 43-51 (2009).
- Imasawa, T., et al. High glucose repatterns human podocyte energy metabolism during differentiation and diabetic nephropathy. FASEB Journal. 31 (1), 294-307 (2017).
- Kim, K. A., et al. High glucose condition induces autophagy in endothelial progenitor cells contributing to angiogenic impairment. Biological and Pharmaceutical Bulletin. 37 (7), 1248-1252 (2014).
- Piwkowska, A., Rogacka, D., Audzeyenka, I., Jankowski, M., Angielski, S. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes. Journal of Cellular Biochemistry. 112 (6), 1661-1672 (2011).
- Wu, H., et al. Comparative analysis and refinement of human PSC-derived kidney organoid differentiation with single-cell transcriptomics. Cell Stem Cell. 23 (6), 869-881 (2018).
- Lei, X., Deng, Z., Duan, E. Uniform embryoid body production and enhanced mesendoderm differentiation with murine embryonic stem cells in a rotary suspension bioreactor. Methods in Molecular Biology. , Clifton, N.J. (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon